Первый слайд презентации
ФармФ Органическая химия ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ Лекция 17
Слайд 2
ФармФ Органическая химия Большинство природных соединений являются гетерофункциональными, т.е. содержат различные функциональные группы. Наиболее часто встречающиеся группы: СООН, ОН, С=О, NH 2
Слайд 3
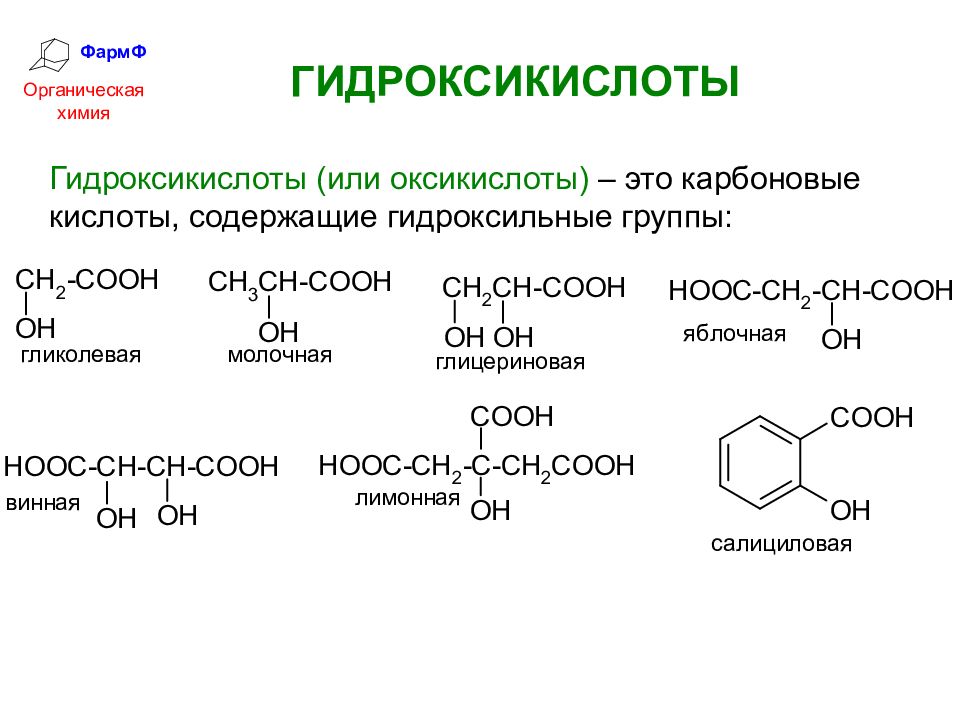
ФармФ Органическая химия ГИДРОКСИКИСЛОТЫ Гидроксикислоты (или оксикислоты) – это карбоновые кислоты, содержащие гидроксильные группы:
Слайд 4
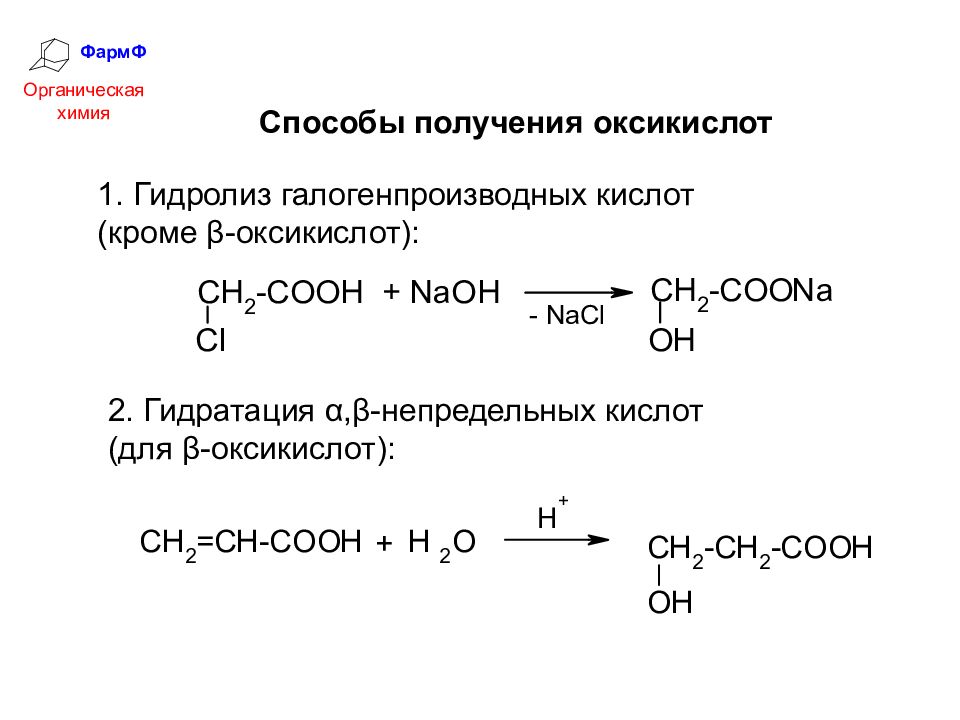
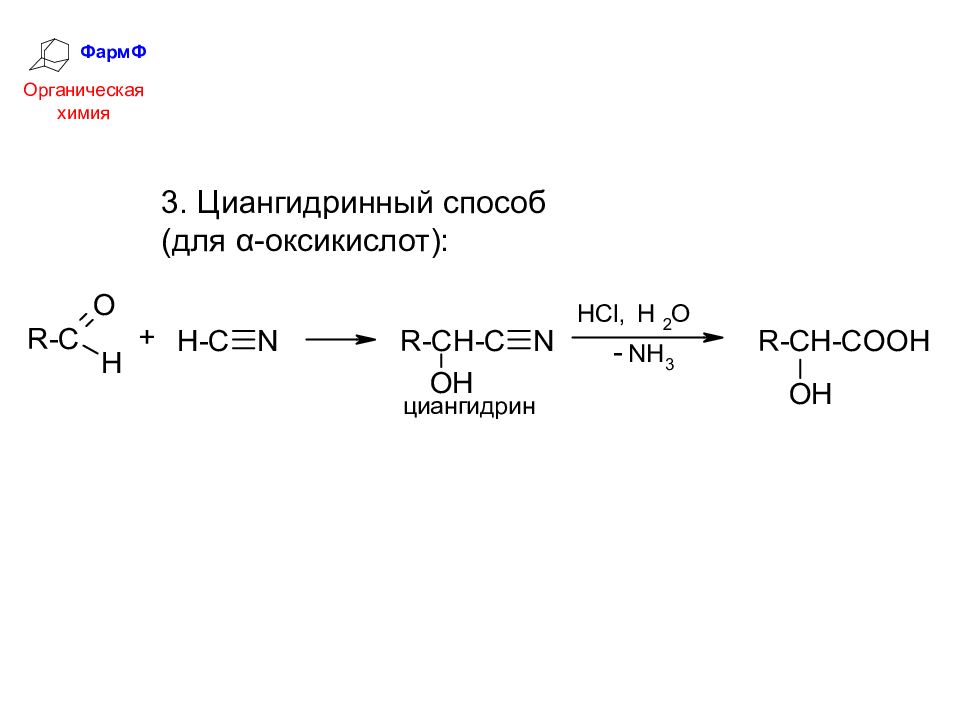
ФармФ Органическая химия Гидролиз галогенпроизводных кислот (кроме β-оксикислот): Способы получения оксикислот 2. Гидратация α,β-непредельных кислот (для β-оксикислот):
Слайд 6
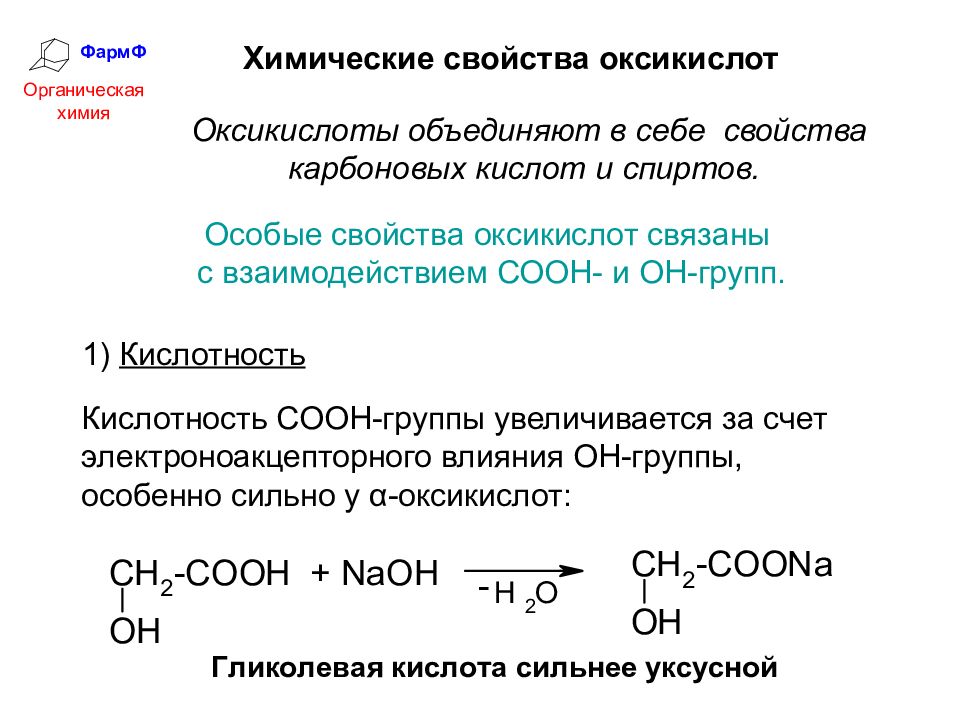
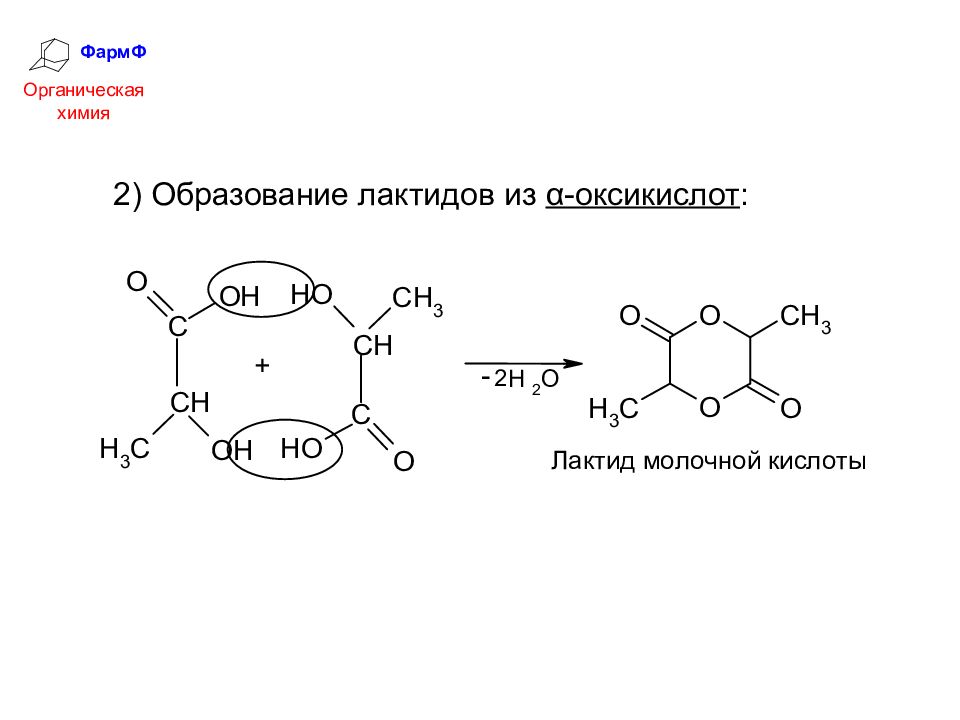
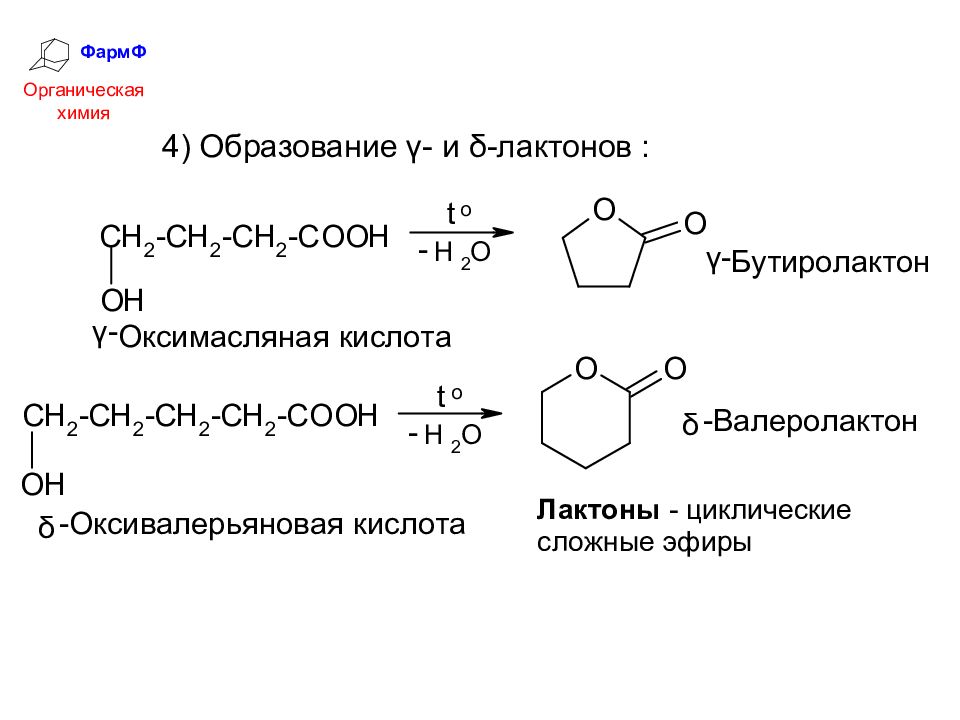
ФармФ Органическая химия Химические свойства оксикислот Оксикислоты объединяют в себе свойства карбоновых кислот и спиртов. 1) Кислотность Кислотность СООН-группы увеличивается за счет электроноакцепторного влияния ОН-группы, особенно сильно у α-оксикислот: Особые свойства оксикислот связаны с взаимодействием СООН- и ОН-групп.
Слайд 8
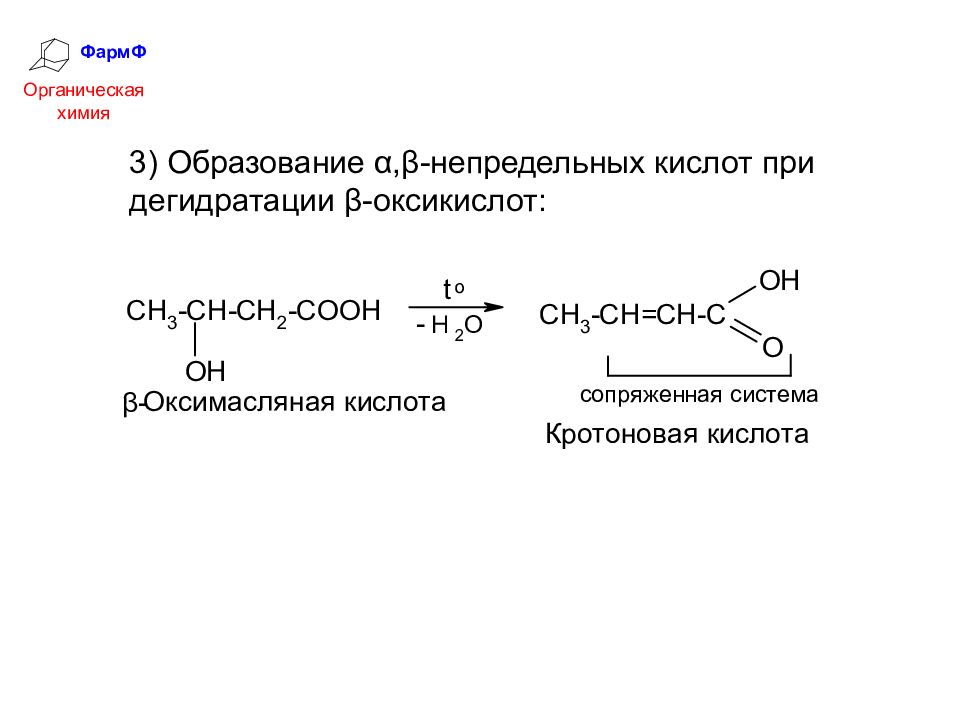
ФармФ Органическая химия 3) Образование α,β-непредельных кислот при дегидратации β-оксикислот:
Слайд 10
ФармФ Органическая химия Отдельные представители оксикислот Молочная кислота. Впервые выделена К Шееле из кислого молока (1780 г.). Широко распространена как продукт биохимического брожения (гликолиз), является одним из ключевых метаболитов в обмене углеводов. Лимонная кислота. Содержится в лимонах (6-8% сухой массы), в листьях махорки, откуда раньше получалась промышленным способом. Сейчас основной способ её получения – биохимическое лимоннокислое брожение под действием определенного штамма грибов. В организме лимонная кислота является одним из ключевых метаболитов энергетического обмена в цикле трикарбоновых кислот (цикл Кребса).
Слайд 11
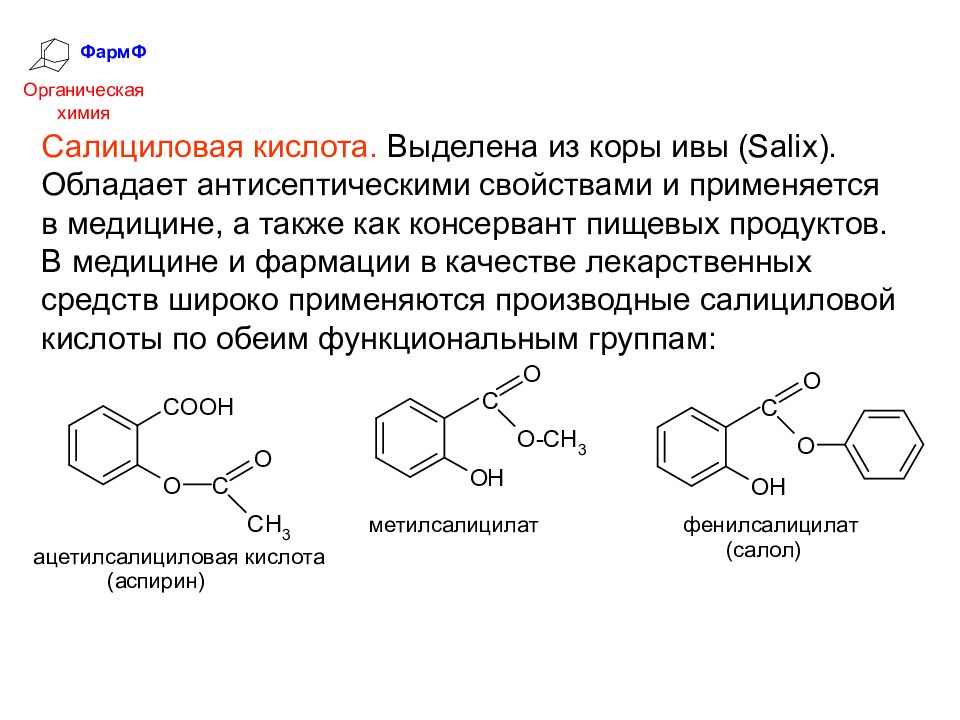
ФармФ Органическая химия Салициловая кислота. Выделена из коры ивы ( Salix ). Обладает антисептическими свойствами и применяется в медицине, а также как консервант пищевых продуктов. В медицине и фармации в качестве лекарственных средств широко применяются производные салициловой кислоты по обеим функциональным группам:
Слайд 12
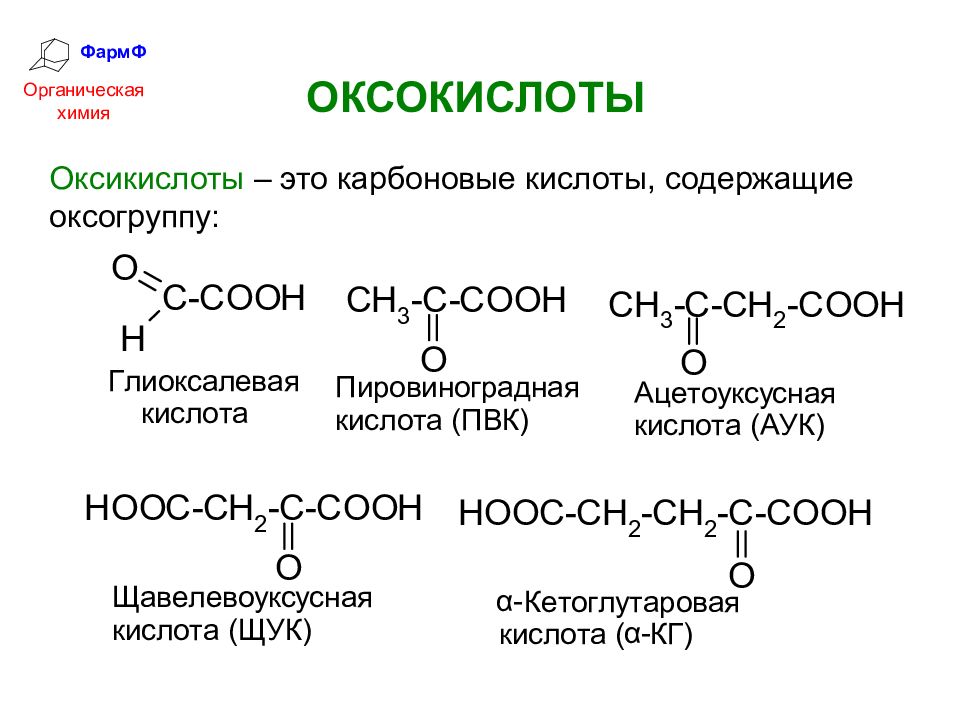
ФармФ Органическая химия ОКСОКИСЛОТЫ Оксикислоты – это карбоновые кислоты, содержащие оксогруппу:
Слайд 13
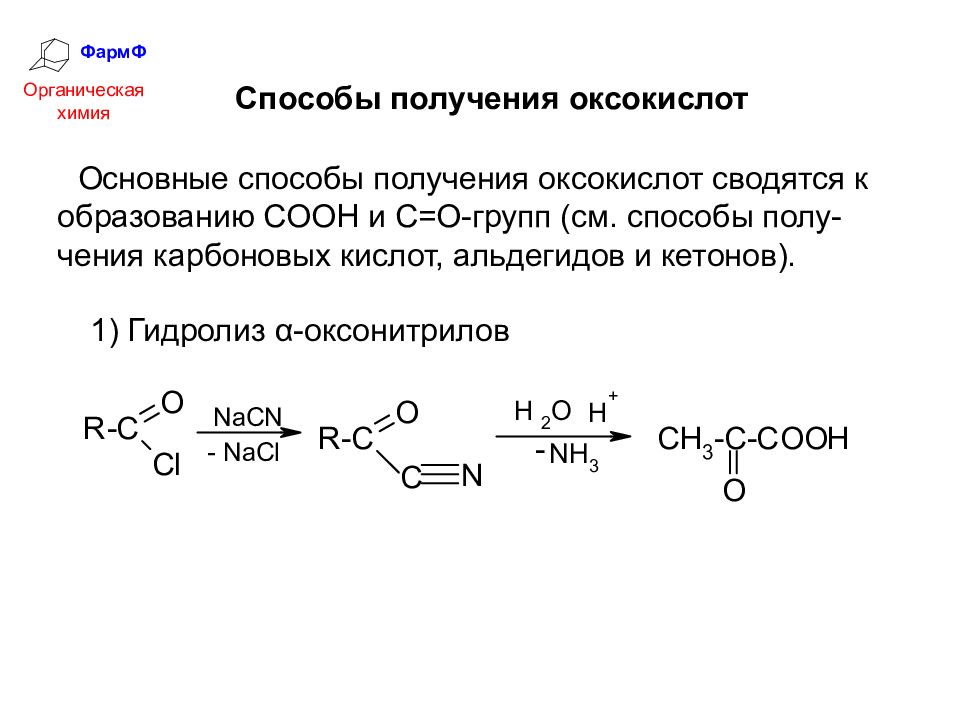
ФармФ Органическая химия Способы получения оксокислот Основные способы получения оксокислот сводятся к образованию СООН и С=О-групп (см. способы полу-чения карбоновых кислот, альдегидов и кетонов). 1) Гидролиз α-оксонитрилов
Слайд 14
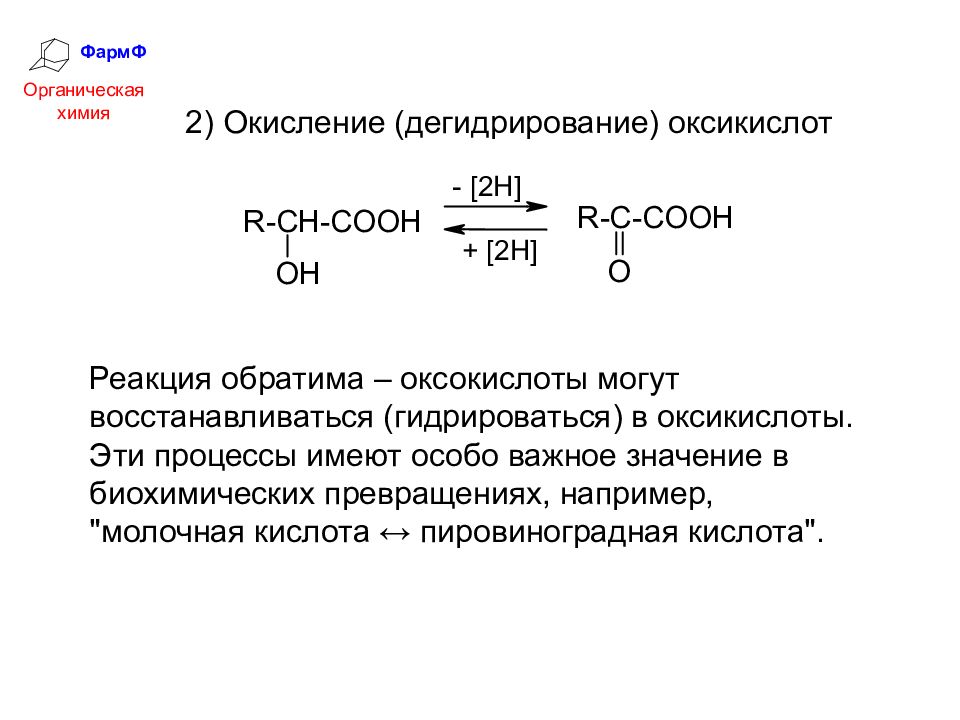
ФармФ Органическая химия 2) Окисление (дегидрирование) оксикислот Реакция обратима – оксокислоты могут восстанавливаться (гидрироваться) в оксикислоты. Эти процессы имеют особо важное значение в биохимических превращениях, например, "молочная кислота ↔ пировиноградная кислота".
Слайд 15
ФармФ Органическая химия Химические свойства оксокислот 1) Кислотность Особые свойства оксокислот связаны с взаимодействием СООН- и С=О-групп. Оксокислоты образуют производные по карбо-ксильной и по карбонильной группам (см. химические свойства карбоновых кислот, альдегидов и кетонов).
Слайд 16
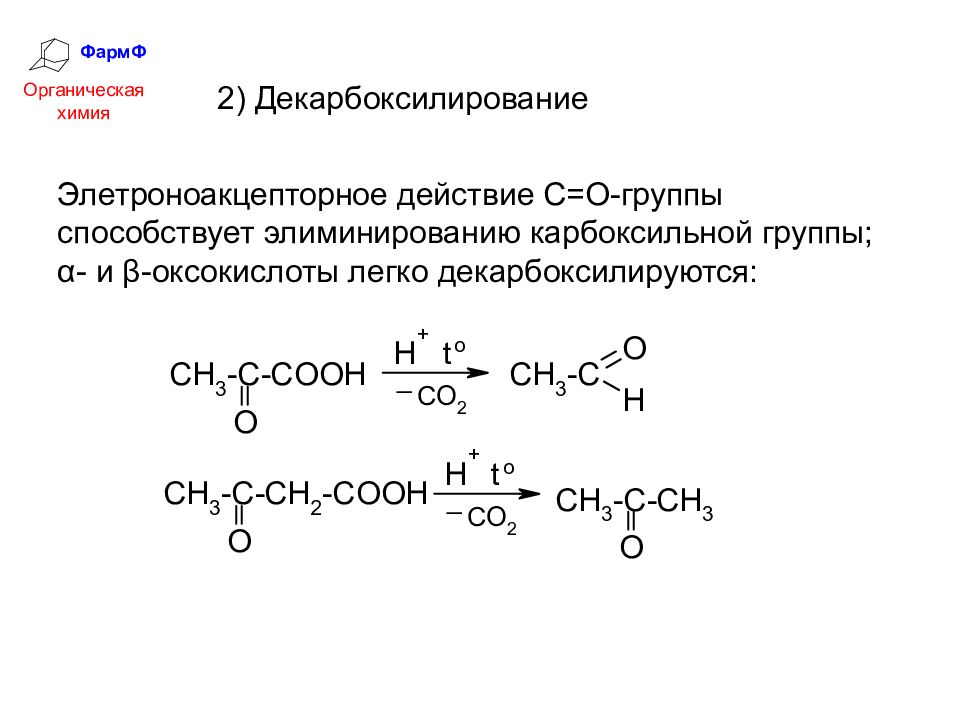
ФармФ Органическая химия 2) Декарбоксилирование Элетроноакцепторное действие С=О-группы способствует элиминированию карбоксильной группы; α- и β-оксокислоты легко декарбоксилируются:
Слайд 17
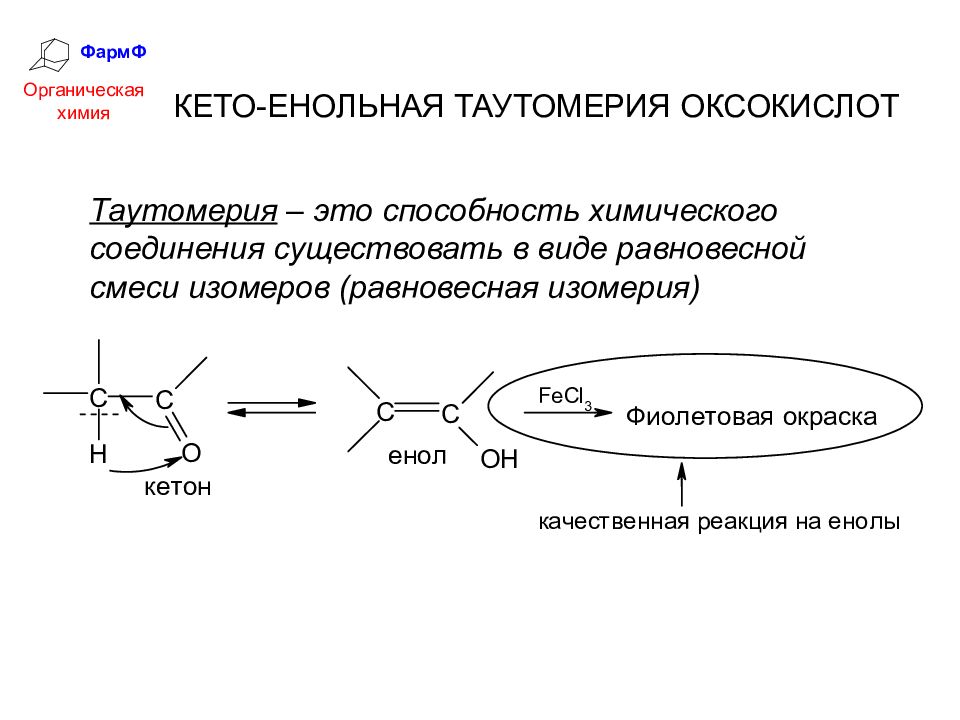
ФармФ Органическая химия КЕТО-ЕНОЛЬНАЯ ТАУТОМЕРИЯ ОКСОКИСЛОТ Таутомерия – это способность химического соединения существовать в виде равновесной смеси изомеров (равновесная изомерия)
Слайд 18
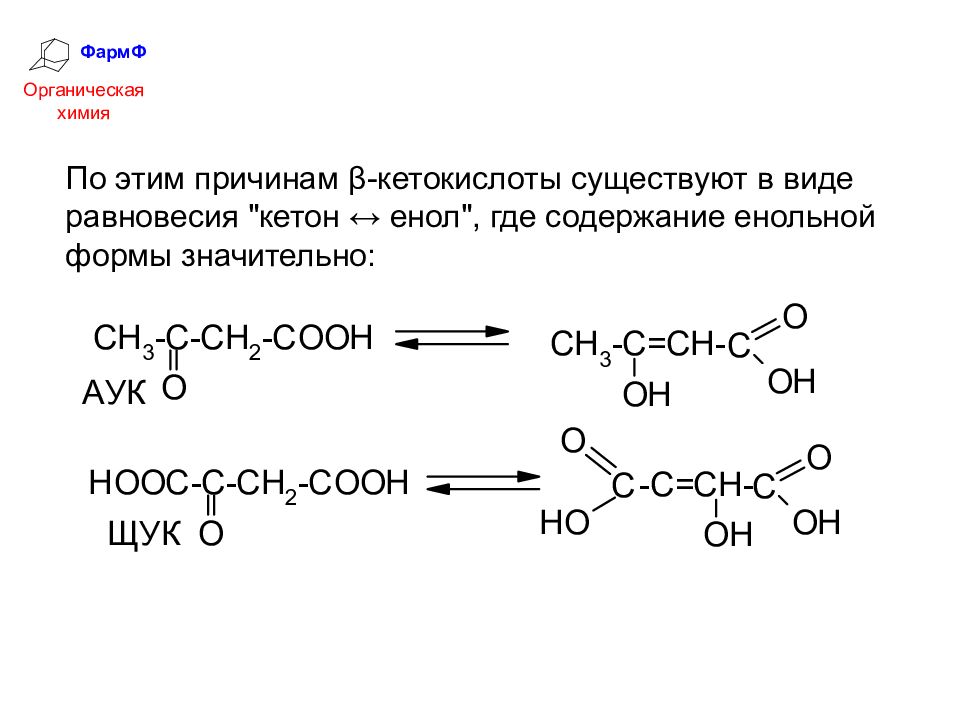
ФармФ Органическая химия Кето-енольное таутомерное равновесие возможно и в простых альдегидах и кетонах, но там содержание енольной формы ничтожно мало. Совместное электроноакцепторное влияние СООН- и С=О-групп в β-кетокислотах: значительно увеличивает подвижность протонов у α-углеродного атома и 2) образующаяся енольная форма содержит сопряженную систему, что значительно увеличивает её термодинамическую устойчивость.
Слайд 19
ФармФ Органическая химия По этим причинам β-кетокислоты существуют в виде равновесия "кетон ↔ енол", где содержание енольной формы значительно:
Слайд 20
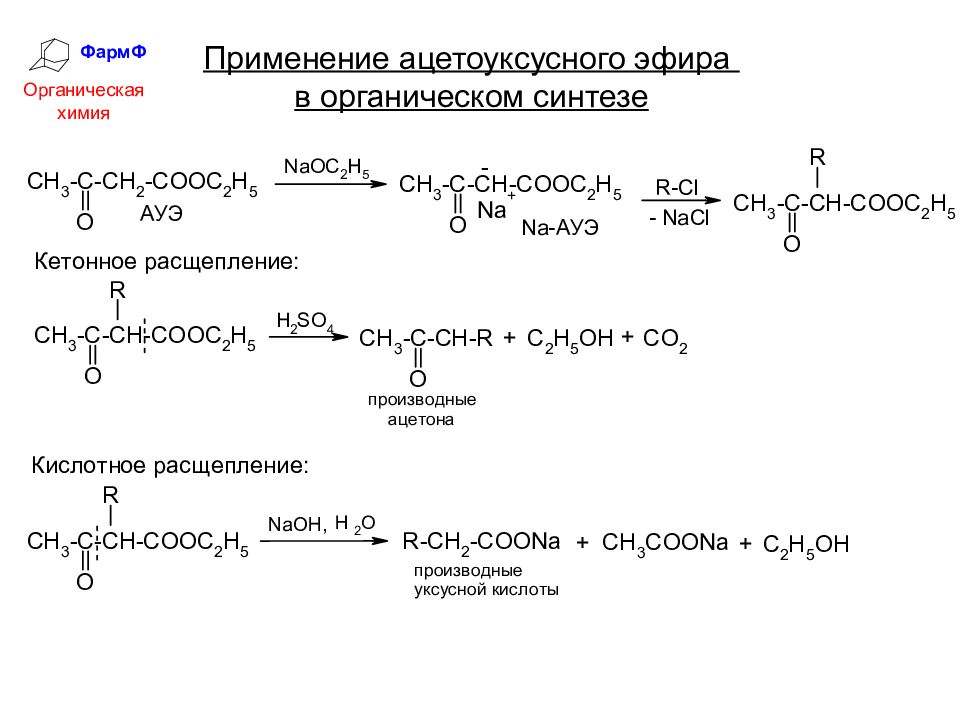
ФармФ Органическая химия АЦЕТОУКСУСНЫЙ ЭФИР Равновесие содержит около 8% енольной формы и её можно обнаружить с помощью цветной реакции с FeCl 3.
Слайд 21
ФармФ Органическая химия Применение ацетоуксусного эфира в органическом синтезе
Слайд 22
ФармФ Органическая химия АМИНОКИСЛОТЫ Наибольшее значение имеют α-аминокислоты, т.к. они являются метаболитами в обмене веществ и "строительным материалом" для важнейших биополимеров – полипептидов и белков
Слайд 24
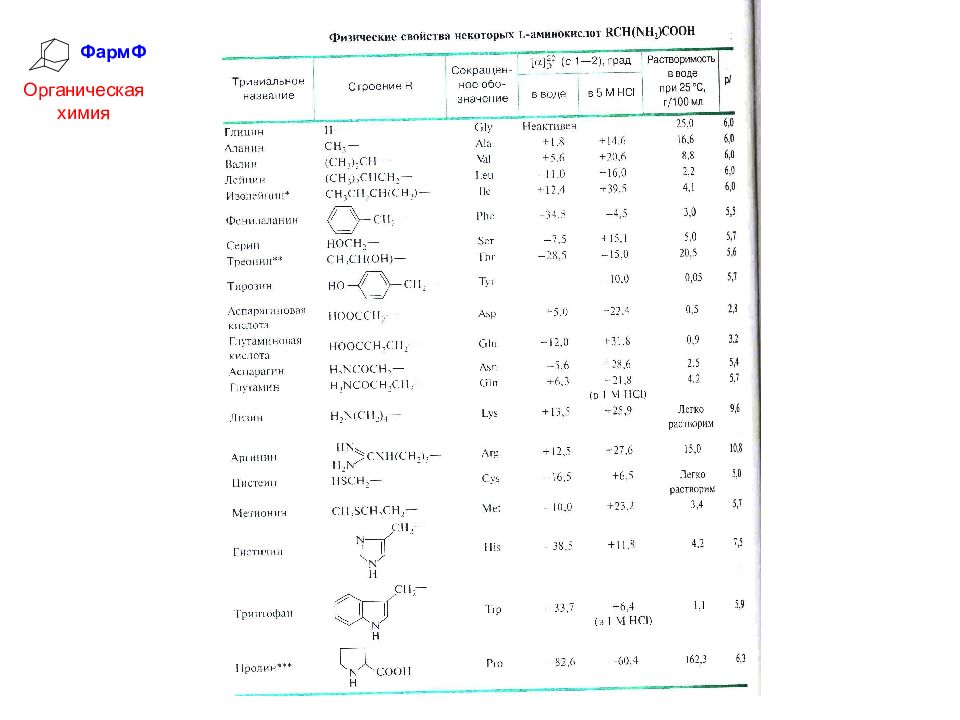
ФармФ Органическая химия ВЫУЧИТЬ! таблицу «Природные α-аминокислоты» Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – Дрофа, М., 2003 г., с. 584. Тюкавкина Н.А., Бауков Ю.И.– Биоорганическая химия – ДРОФА, М., 2007 г., с. 317.
Слайд 25
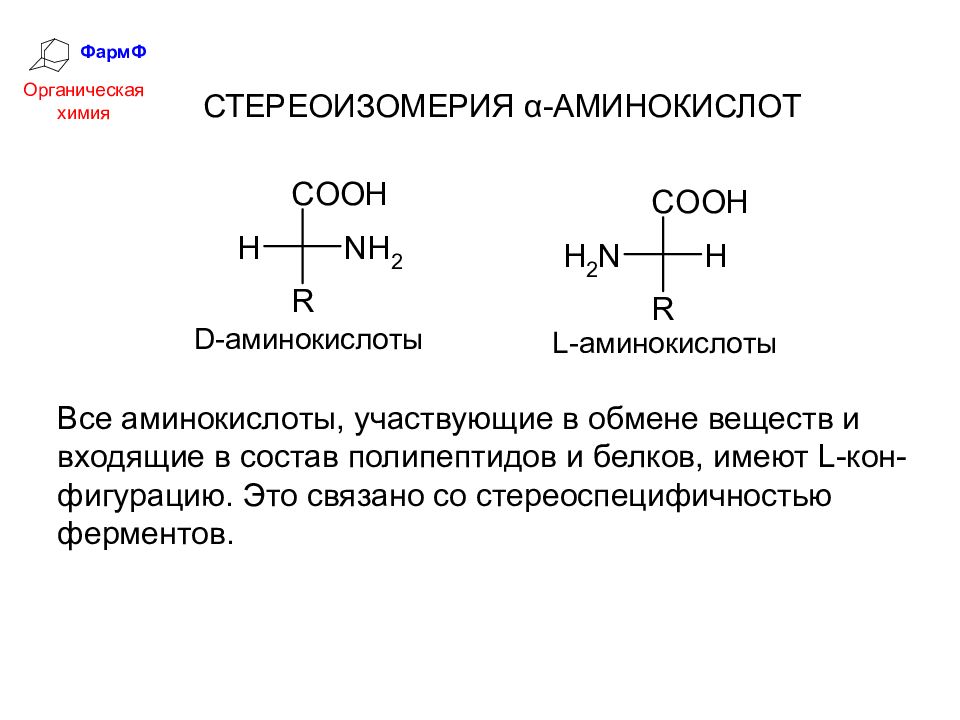
ФармФ Органическая химия СТЕРЕОИЗОМЕРИЯ α-АМИНОКИСЛОТ Все аминокислоты, участвующие в обмене веществ и входящие в состав полипептидов и белков, имеют L -кон-фигурацию. Это связано со стереоспецифичностью ферментов.
Слайд 26
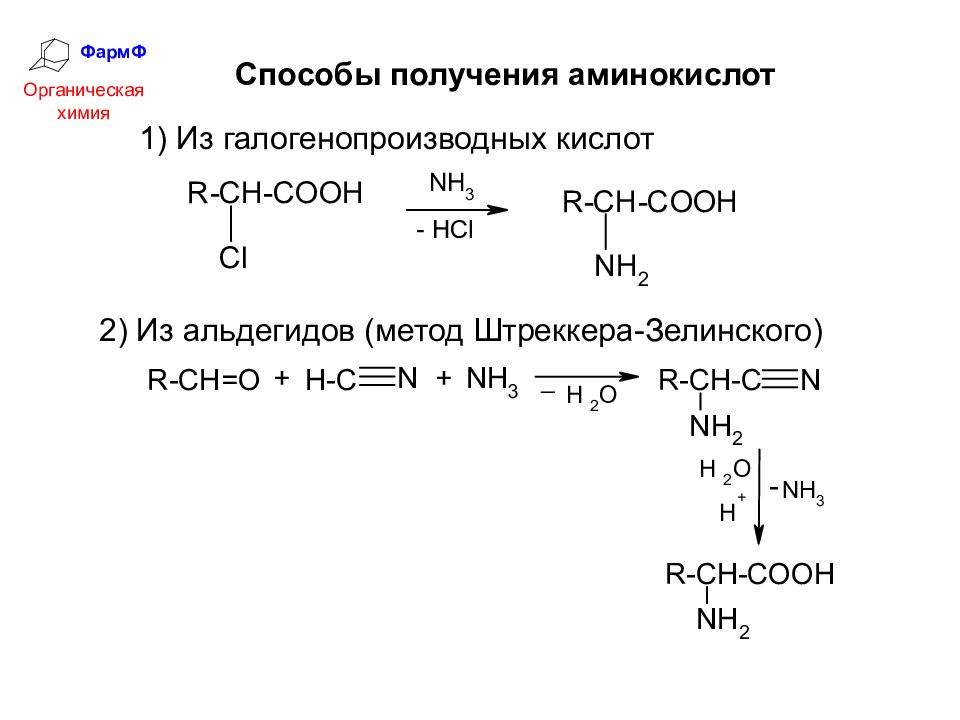
ФармФ Органическая химия Способы получения аминокислот 1) Из галогенопроизводных кислот 2) Из альдегидов (метод Штреккера-Зелинского)
Слайд 27
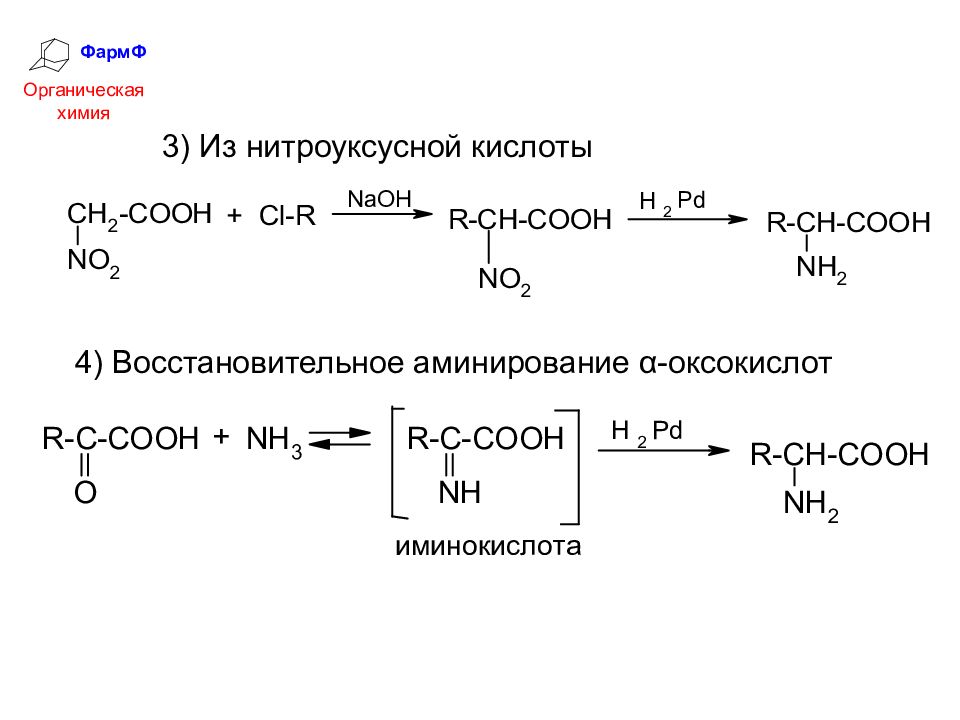
ФармФ Органическая химия 3) Из нитроуксусной кислоты 4) Восстановительное аминирование α-оксокислот
Слайд 28
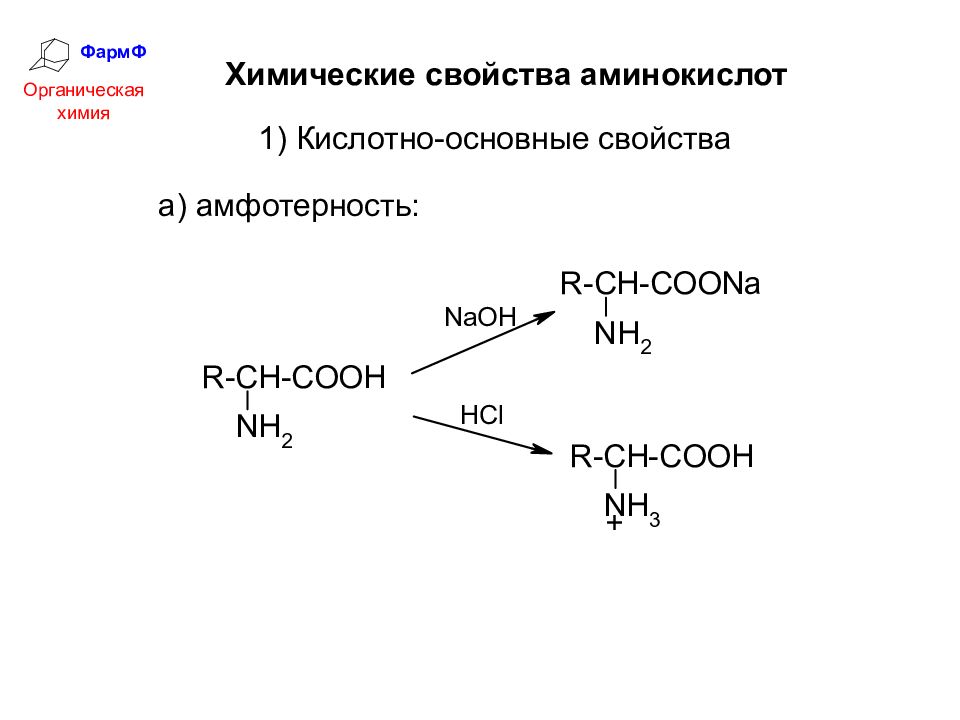
ФармФ Органическая химия Химические свойства аминокислот 1) Кислотно-основные свойства а) амфотерность:
Слайд 29
ФармФ Органическая химия б) образование биполярных ионов (цвиттер-ионов):
Слайд 30
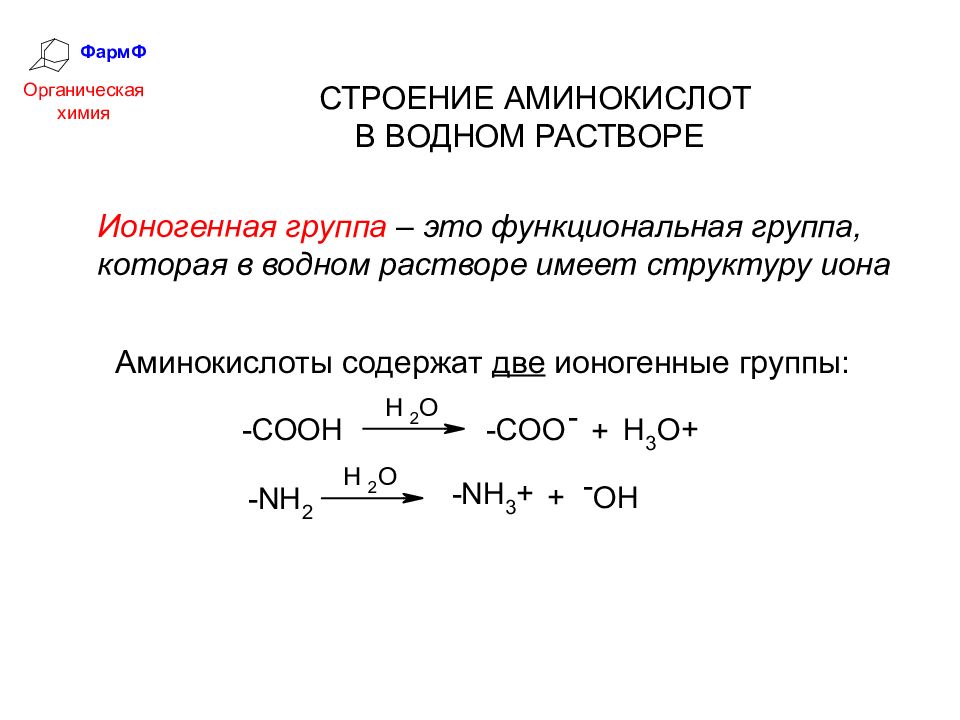
ФармФ Органическая химия СТРОЕНИЕ АМИНОКИСЛОТ В ВОДНОМ РАСТВОРЕ Ионогенная группа – это функциональная группа, которая в водном растворе имеет структуру иона Аминокислоты содержат две ионогенные группы:
Слайд 31
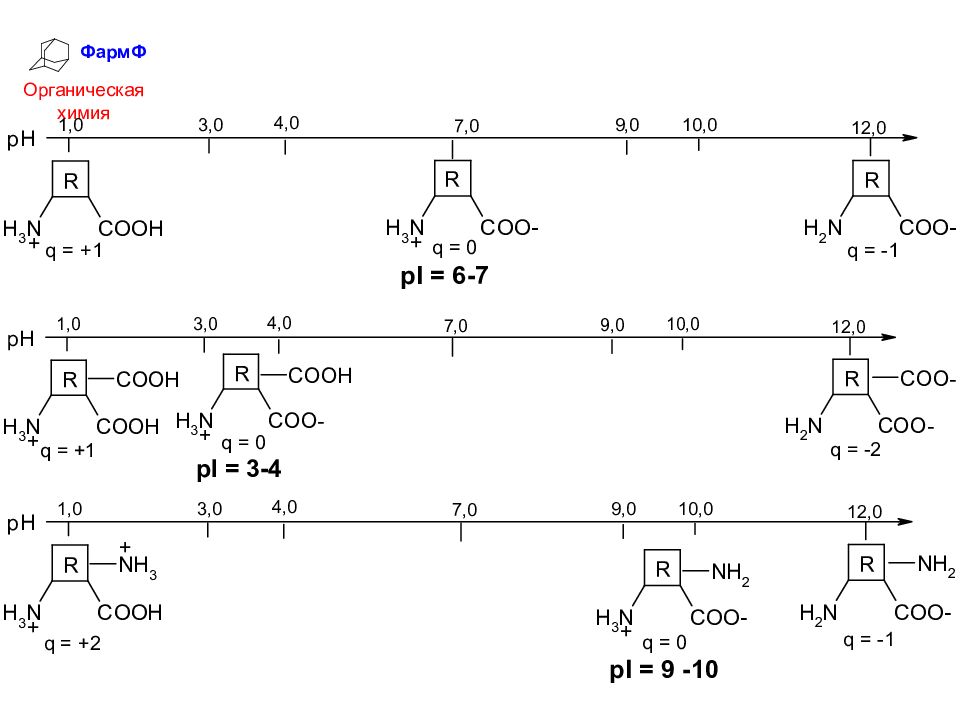
ФармФ Органическая химия В водном растворе молекулы аминокислот всегда имеют электрический заряд, изменяющийся при изменении рН раствора. Изоэлектрическая точка (р I ) – это то значение рН, при котором суммарный заряд молекулы равен О.
Слайд 33
ФармФ Органическая химия Выводы: Если количества ионогенных групп ( COOH и NH 2 ) в молекуле одинаковы, то изолектрическая точка вещества находится в области нейтрального рН ( pI = 7) - нейтральные аминокислоты. 2) Если в молекуле преобладают карбоксильные группы, то изолектрическая точка находится в кислотной области рН ( pI < 7) - кислые аминокислоты ). 3) Если в молекуле преобладают аминогруппы, то изолектрическая точка находится в основной области рН ( pI > 7) - основные аминокислоты ).
Слайд 34
ФармФ Органическая химия 4) Если рН раствора ниже ИЭТ, то молекулы имеют положительный заряд, если рН раствора выше ИЭТ, то молекулы имеют отрицательный заряд. Эти закономерности справедливы не только для индивидуальных аминокислот, но и для их полимеров – полипептидов и белков.
Слайд 35
ФармФ Органическая химия 1) Реакции карбоксильных групп Карбоксильные группы аминокислот вступают во все общие реакции образования солей и функциональных производных и др. Декарбоксилирование:
Слайд 36
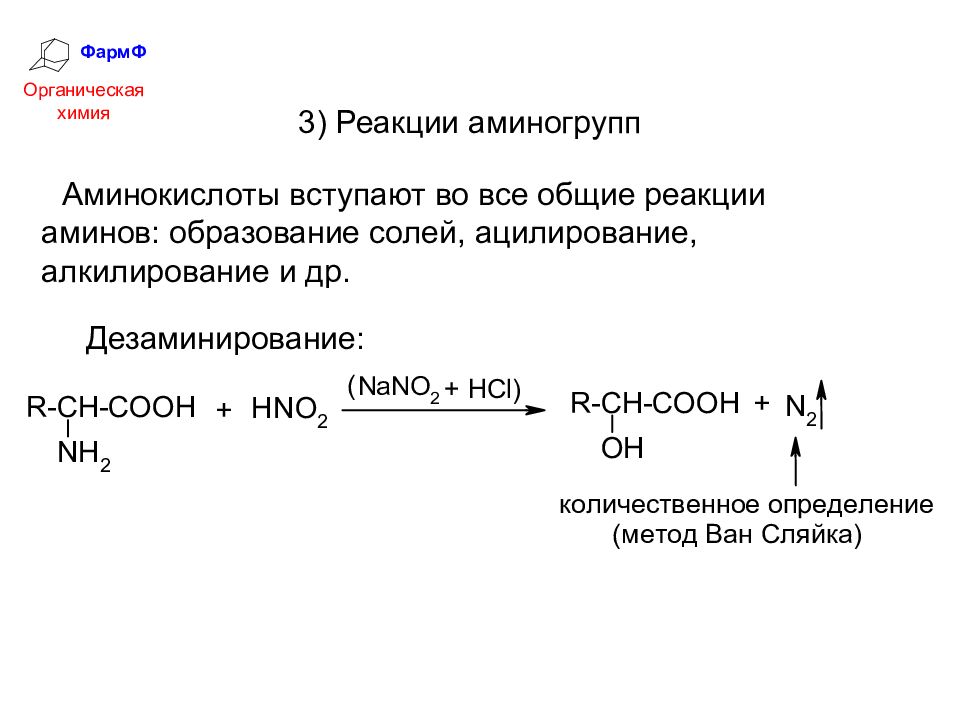
ФармФ Органическая химия 3) Реакции аминогрупп Аминокислоты вступают во все общие реакции аминов: образование солей, ацилирование, алкилирование и др. Дезаминирование:
Слайд 37
ФармФ Органическая химия Биологическое значение и практическое применение аминокислот Наибольшее биологическое значение имеют α-аминокислоты. Они являются структурными компонентами полипептидов и белков, многие из них служат биологическими предшественниками биогенных аминов – гормонов и биорегуляторов.
Слайд 38
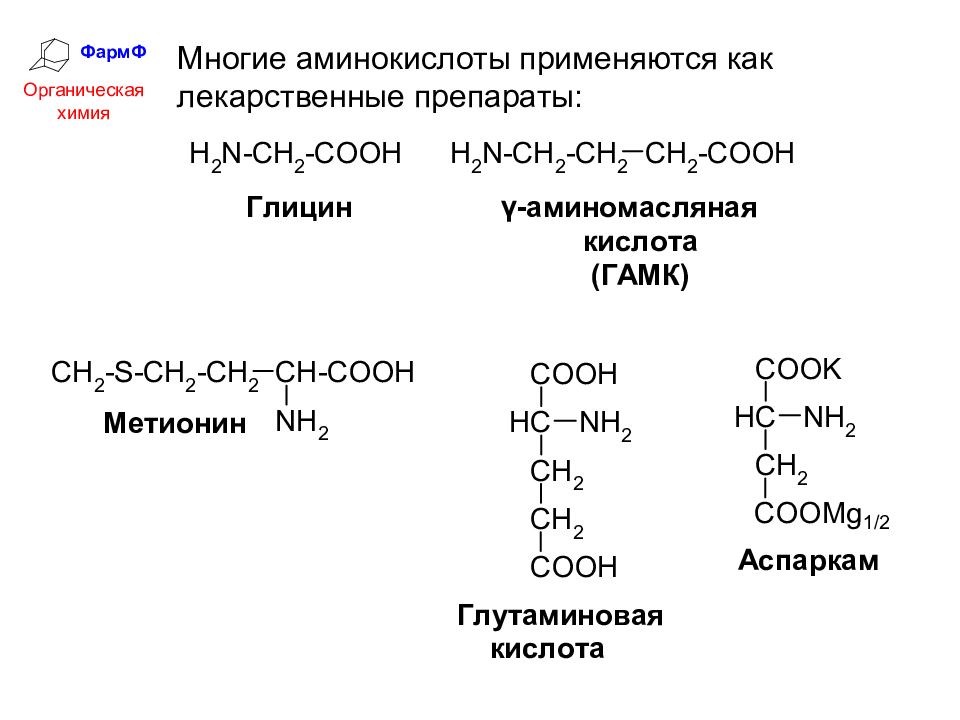
ФармФ Органическая химия Многие аминокислоты применяются как лекарственные препараты:
Последний слайд презентации: ФармФ Органическая химия ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ Лекция 17
ФармФ Органическая химия 05.09.09 ЛИТЕРАТУРА : Основная 1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс), кн. 1 – Дрофа, М., 2003 г., с. 558-604. 1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с. 178-207. Дополнительная 2. Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – Дрофа, М., 2007 г., с. 316-345.