Слайд 2: Углеводный обмен
Слайд 3: Функции углеводов
Обеспечивают около 57% суточного калоригенеза Являются составными частями более сложных соединений (НК, ГП, ГЛ и др.)
Слайд 4: Функции углеводов
Служат предшественниками соединений других классов (липиды, заменимые аминокислоты) Выполняют структурообразовательную функцию Выполняют специфические функции
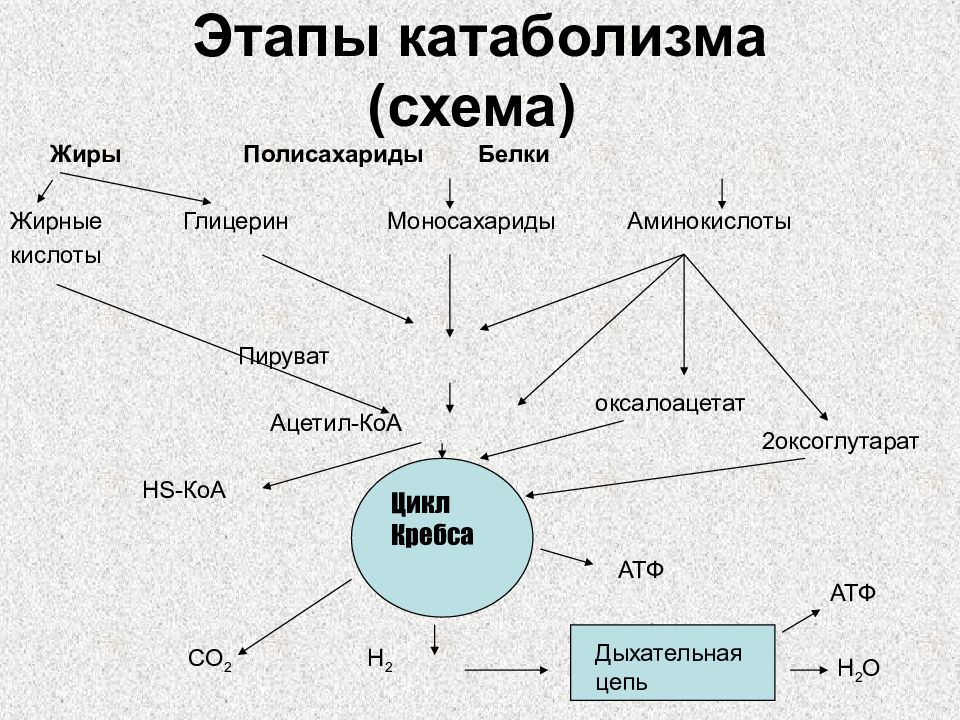
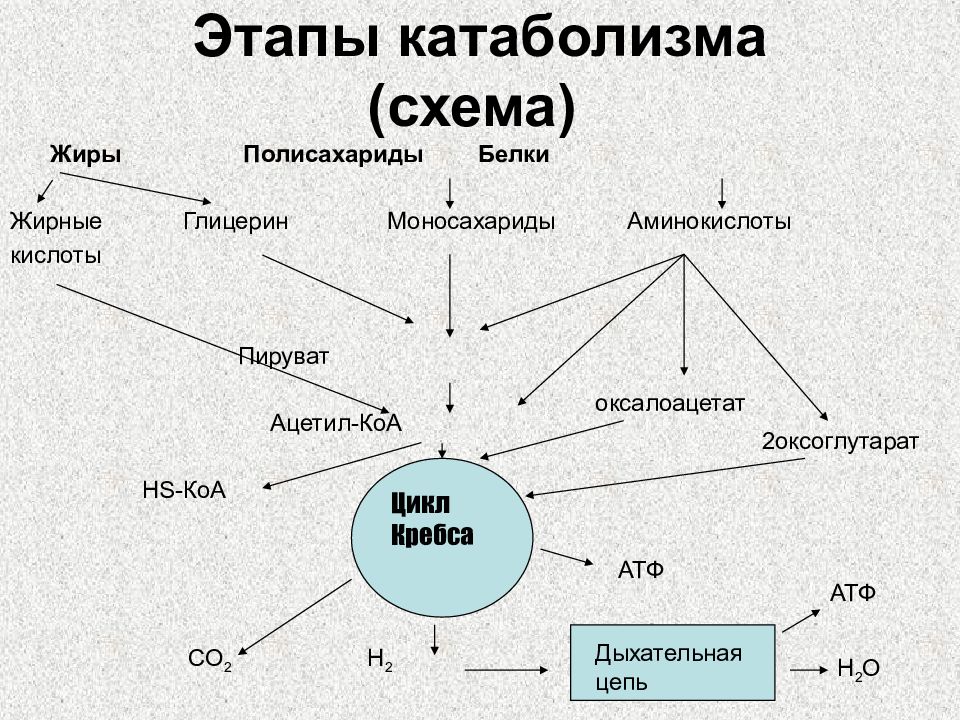
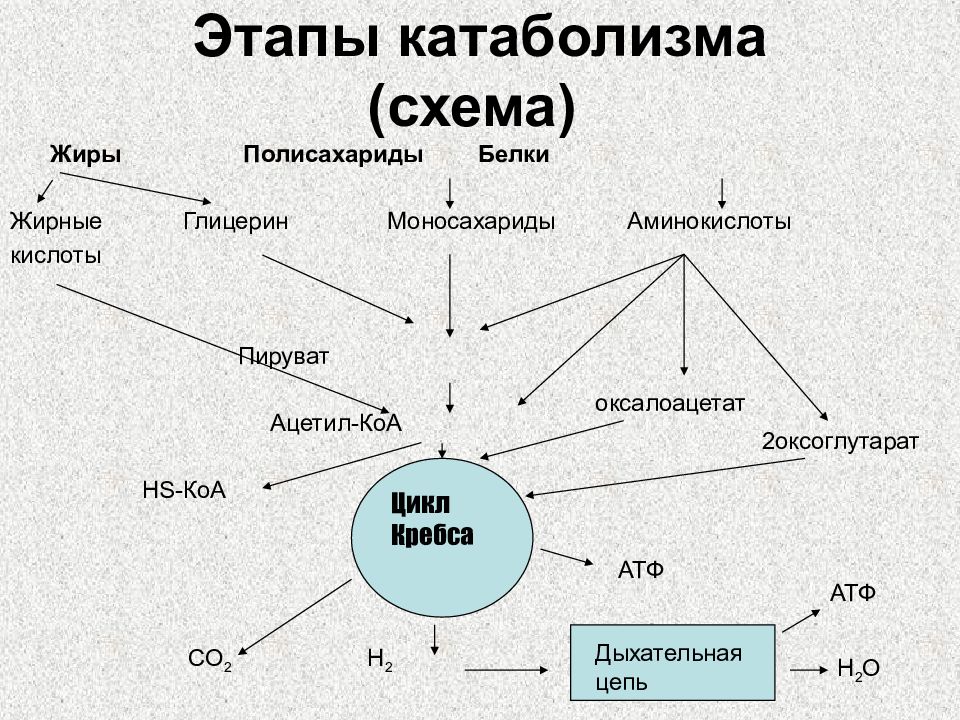
Слайд 5: Этапы катаболизма (схема)
Жиры Полисахариды Белки Жирные Глицерин Моносахариды Аминокислоты кислоты Пируват Ацетил-КоА HS- КоА CO 2 H 2 Цикл Кребса Дыхательная цепь H 2 O АТФ АТФ оксалоацетат 2оксоглутарат
Слайд 9: Роль печени в обмене углеводов
Унификация моносахаридов Гликогенная функция Синтез углеводов из неуглеводных предшественников (глюконеогенез) 4. Синтез гликопротеинов крови 5. Образование глюкуроновой кислоты
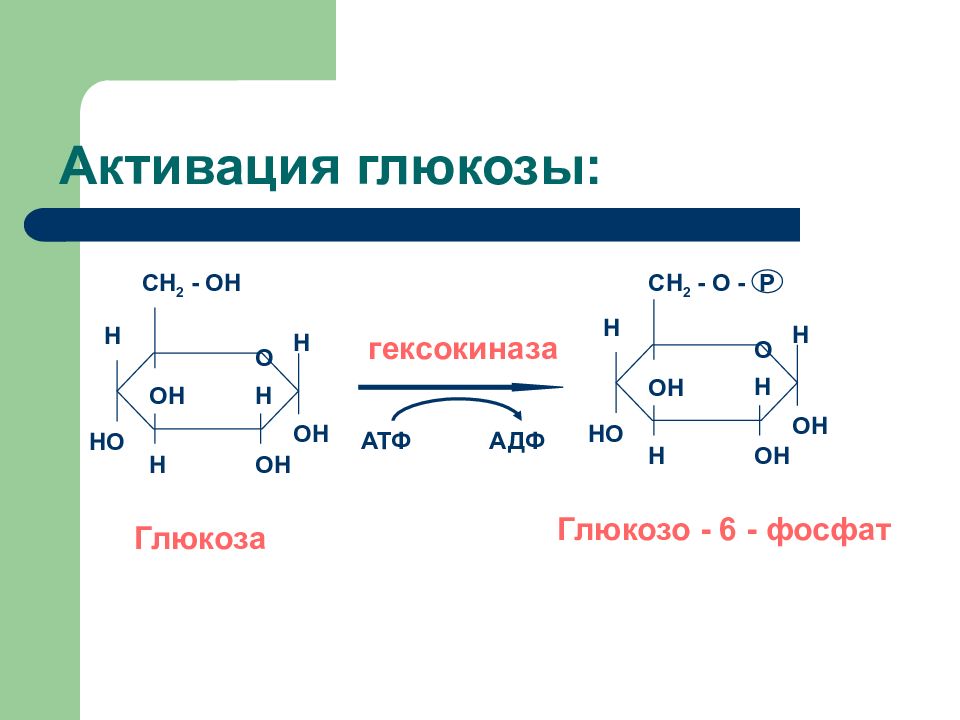
Слайд 10: Активация глюкозы:
O H OH H OH ОН H H HO CH 2 - OH Глюкоз a O H OH H OH О H H H HO CH 2 - O - P Глюкозо - 6 - фосфат гексокиназа АДФ АТФ
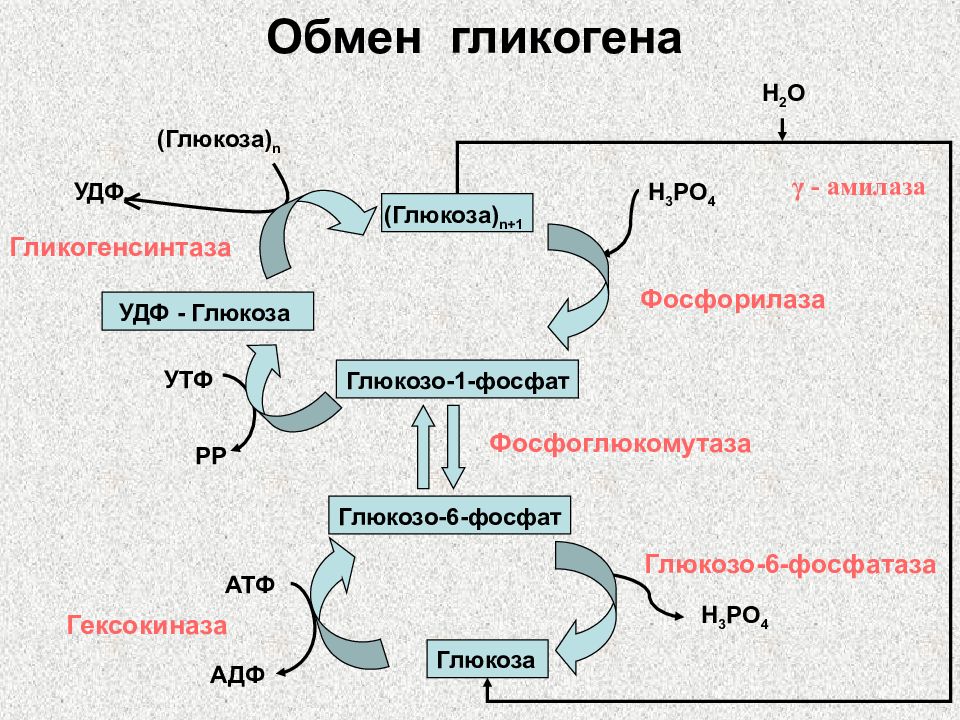
Слайд 11: Обмен гликогена
Глюкоза Глюкозо-6-фосфат Глюкозо-1-фосфат (Глюкоза) n+1 Фосфоглюкомутаза АТФ АДФ Гексокиназа Глюкозо-6-фосфатаза H 3 PO 4 Фосфорилаза H 3 PO 4 УДФ - Глюкоза УТФ РР Гликогенсинтаза (Глюкоза) n УДФ H 2 O γ - амилаза
Слайд 12: Значение гликолиза
Гликолиз имеет энергетическое значение Преимущества гликолиза: анаэробный процесс быстрый универсальный
Слайд 13: Значение гликолиза
Недостатки гликолиза: малоэффективный процесс продуктом гликолиза является лактат, накопление которого вызывает метаболиче-ский ацидоз.
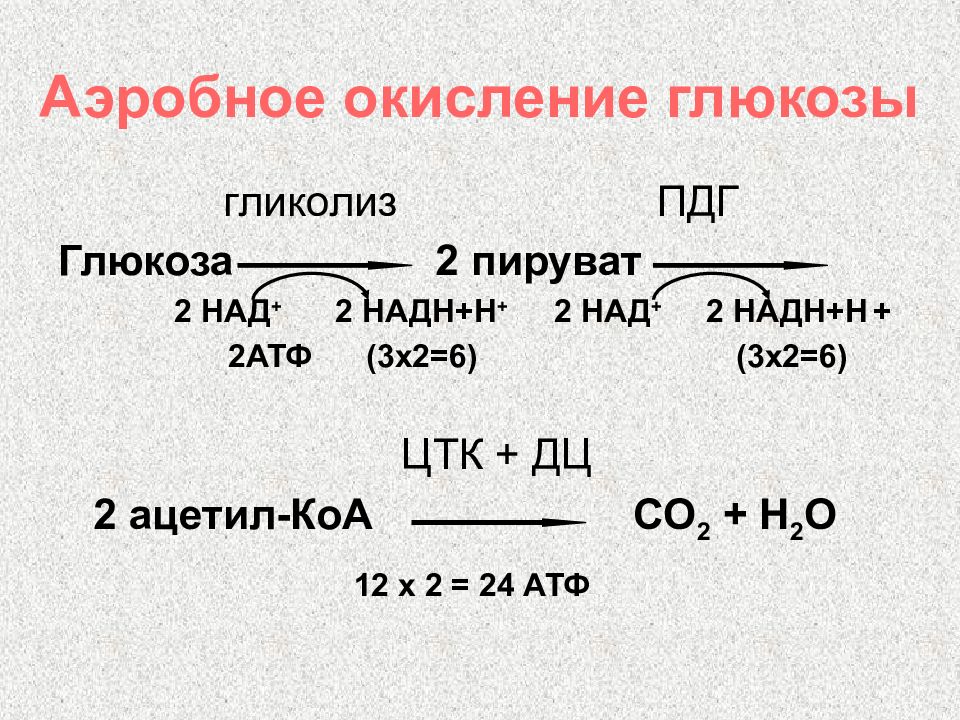
Слайд 14: Аэробное окисление глюкозы
гликолиз ПДГ Глюкоза 2 пируват 2 НАД + 2 НАДН+Н + 2 НАД + 2 НАДН+Н + 2АТФ (3х2=6) (3х2=6) ЦТК + ДЦ 2 ацетил-КоА СО 2 + Н 2 О 12 х 2 = 24 АТФ
Слайд 15: Значение ГНГ
Является важным источником глюкозы в организме Удаляет большую часть лактата, что предохраняет клетки от метаболического ацидоза
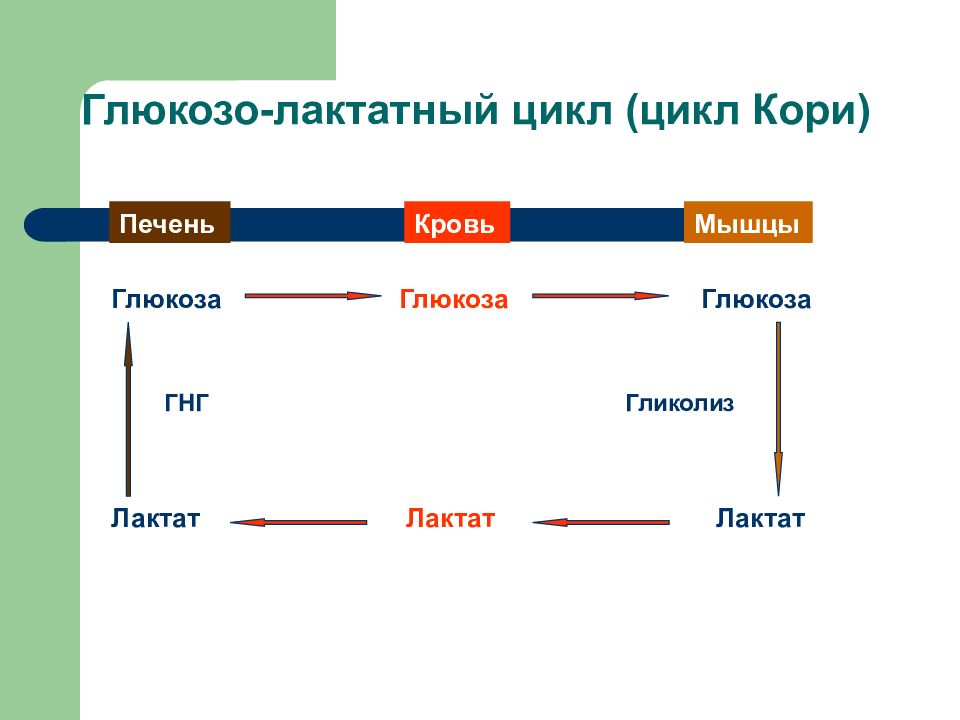
Слайд 16: Глюкозо-лактатный цикл (цикл Кори)
Мышцы Кровь Печень Глюкоза Глюкоза Глюкоза Лактат Лактат Лактат Гликолиз ГНГ
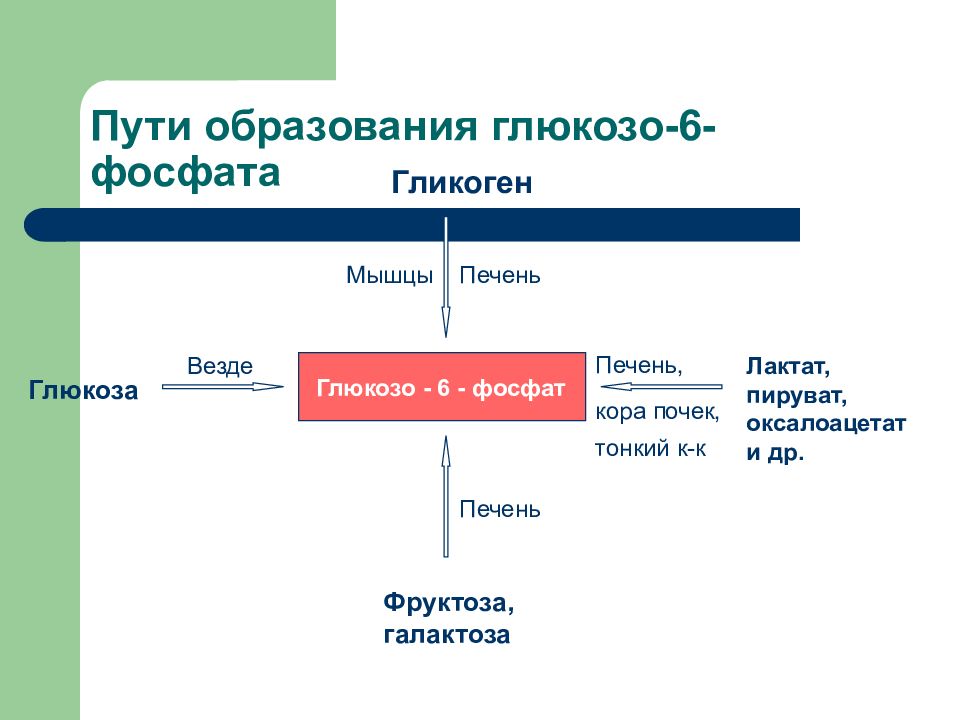
Слайд 17: Пути образования глюкозо-6-фосфата
Глюкозо - 6 - фосфат Глюкоза Гликоген Фруктоза, галактоза Лактат, пируват, оксалоацетат и др. Везде Печень Печень Мышцы Печень, кора почек, тонкий к-к
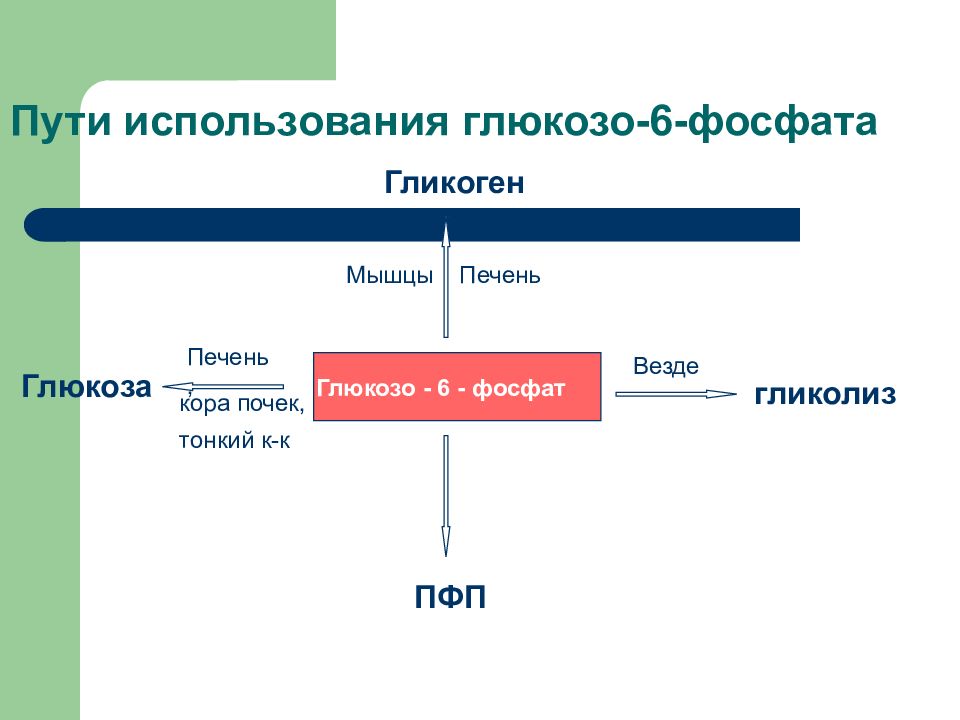
Слайд 18: Пути использования глюкозо-6-фосфата
Глюкозо - 6 - фосфат Глюкоза Гликоген ПФП гликолиз Везде Печень Мышцы Печень, кора почек, тонкий к-к
Слайд 19: Значение пентозофосфатного пути
Амфиболическое – путь распада углеводов и одновременно - образования веществ, используемых в синтетических реакциях (НАДФН и рибозо-5-фосфата)
Слайд 20: Значение пентозофосфатного пути
2) Энергетическое - образующиеся метаболиты окислительной части могут использоваться в гликолизе 3) Синтетическое - связано с использованием рибозо-5-фосфата и НАДФН
Слайд 21: Глюкоза крови
Нормальная концентрация глюкозы в крови составляет 3,3 - 5,5 ммоль/л Постоянство глюкозы обеспечивается двумя противоположно направленными процессами: - Поставляющими глюкозу в кровь - Использующими глюкозу Повышение концентрации глюкозы в крови (> 9 – 10 ммоль/л), сопровождается глюкозурией
Слайд 22: Процессы, поставляющие глюкозу в кровь
Переваривание углеводов в ЖКТ ГНГ Распад гликогена печени
Слайд 23: Процессы, использующие глюкозу в тканях
Гликолиз Синтез гликогена ПФП Синтез жира
Слайд 24: Регуляция глюкозы крови гормонами
Гипогликемический гормон (инсулин) Увеличение проницаемости клеточных мембран для глюкозы Ингибирование процессов, поставляющих глюкозу (ГНГ, распад гликогена печени) Активация процессов, использующих глюкозу (гликолиз, синтез гликогена, ПФП, синтез жира)
Слайд 25: Регуляция глюкозы крови гормонами
Гипергликемические гормоны (глюкагон, КА, ГКС и СТГ) Активация распада гликогена в печени Стимуляция ГНГ
Слайд 26
1) алиментарная (пищевая) 2) сахарный диабет 3) патология ЦНС (менингит, энцефалит) 4) стресс 5) избыток гипергликемических гормонов 6) повреждение островков поджелудочной железы (панкреатит, кровоизлияния) Невысокая и кратковременная гипергликемия не опасна. Причины гипергликемии :
Слайд 27
Длительная гипергликемия приводит - К истощению запасов инсулина (что является одной из причин сахарного диабета) - К потере воды тканями, поступлению ее в кровь, увеличению кровяного давления, увеличению диуреза. Гипергликемия в 50-60 ммоль/л может привести к гиперосмолярной коме.
Слайд 28: Длительная гипергликемия
Приводит к неферментативному гликозилированию белков - плазмы крови - эритроцитов - кровеносных сосудов - почечных канальцев - нейронов - хрусталика - коллагена
Слайд 29: Длительная гипергликемия
Гликозилирование изменяет свойства белков и является причиной тяжелых осложнений : тканевых гипоксий склерозирования сосудов катаракты почечной недостаточности нарушения нервной проводимости снижения срока жизни эритроцитов и т.д.
Слайд 30
Причины гипогликемии : 1) алиментарная (пищевая) 2) усиленное использование глюкозы (при тяжелой мышечной работе) 3) патология ЖКТ (воспалительные процессы) 4) патология печени 5) патология ЦНС
Слайд 31: Причины гипогликемии :
6) недостаток гипергликемических гормонов 7) избыток инсулина (опухоль поджелудочной железы, передозировка инсулина) Гипогликемия очень опасна, так как приводит к гипогликемической коме
Слайд 33: Функции жиров
Энергетическая : при окислении 1 г жира выделяется около 9,3 ккал энергии 2. Резерв эндогенной воды : при окислении 1 г жира образуется 1,07 г воды Источник жирорастворимых витаминов Терморегуляторная 5. Защитная
Слайд 34: Этапы катаболизма (схема)
Жиры Полисахариды Белки Жирные Глицерин Моносахариды Аминокислоты кислоты Пируват Ацетил-КоА HS- КоА CO 2 H 2 Цикл Кребса Дыхательная цепь H 2 O АТФ АТФ оксалоацетат 2оксоглутарат
Слайд 35: Роль желчных кислот в переваривании жира
1. Эмульгирование жира 2. Активация панкреатической липазы 3. Необходимы для всасывания продуктов переваривания жира, жирорастворимых витаминов
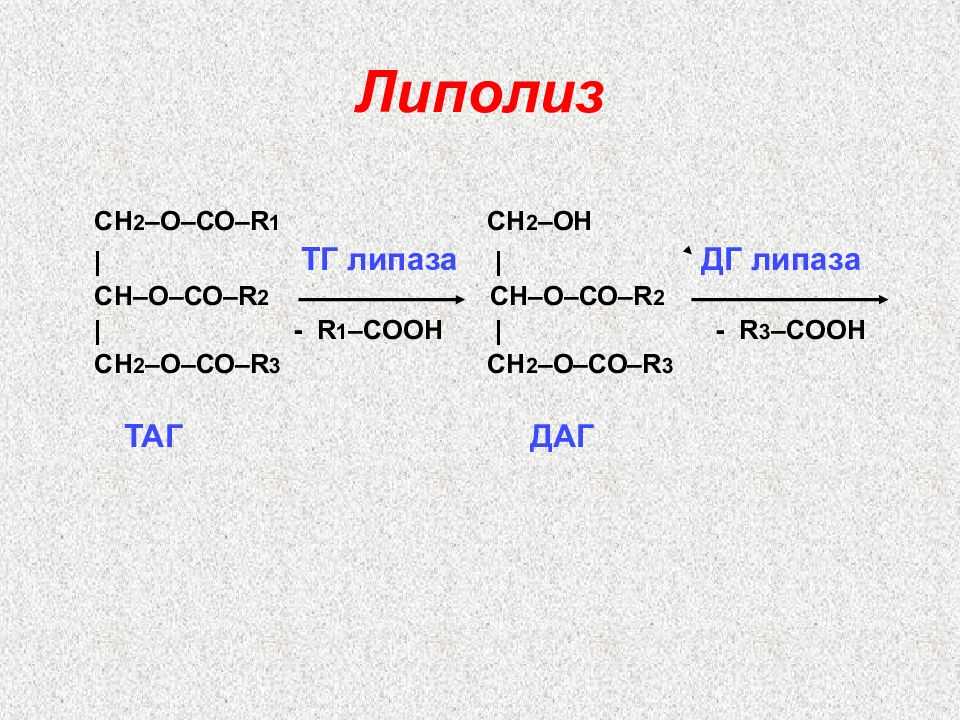
Слайд 36: Липолиз
СН 2 –О–СО– R 1 СН 2 –ОН | ТГ липаза | ДГ липаза C Н–О–СО– R 2 C Н–О–СО– R 2 | - R 1 – C ООН | - R 3 – C ООН СН 2 –О–СО– R 3 СН 2 –О–СО– R 3 ТАГ ДАГ
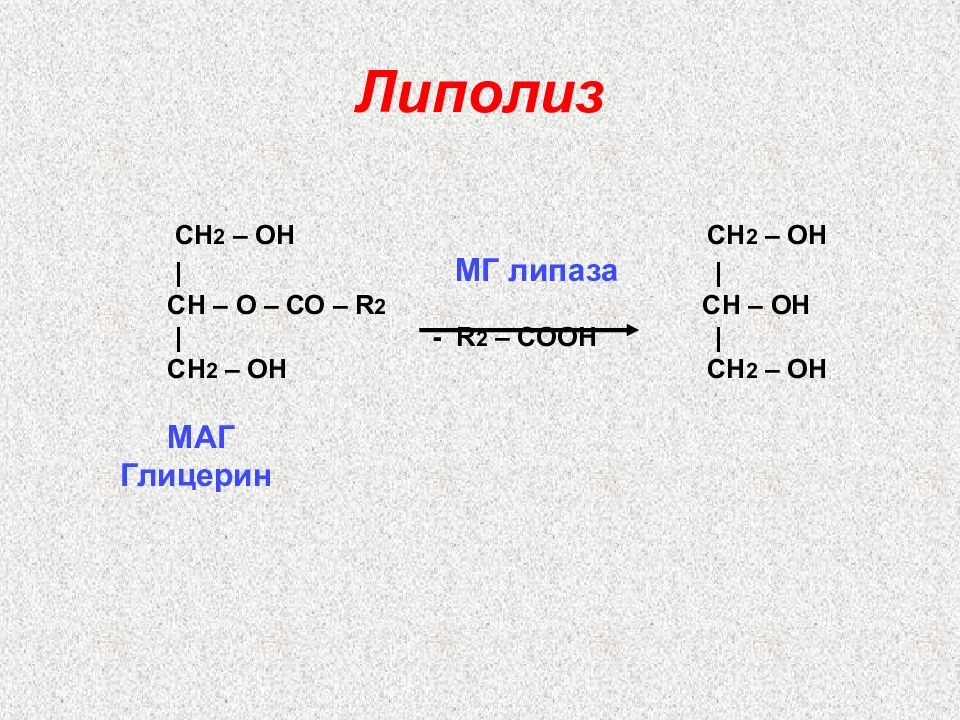
Слайд 37: Липолиз
C Н 2 – ОН C Н 2 – ОН | МГ липаза | C Н – О – СО – R 2 C Н – ОН | - R 2 – C ООН | C Н 2 – ОН C Н 2 – ОН МАГ Глицерин
Слайд 38: Регуляция липолиза
Активаторы: КА, глюкагон, СТГ, АКТГ, тироксин, липотропин гипофиза, цАМФ Ингибиторы: инсулин
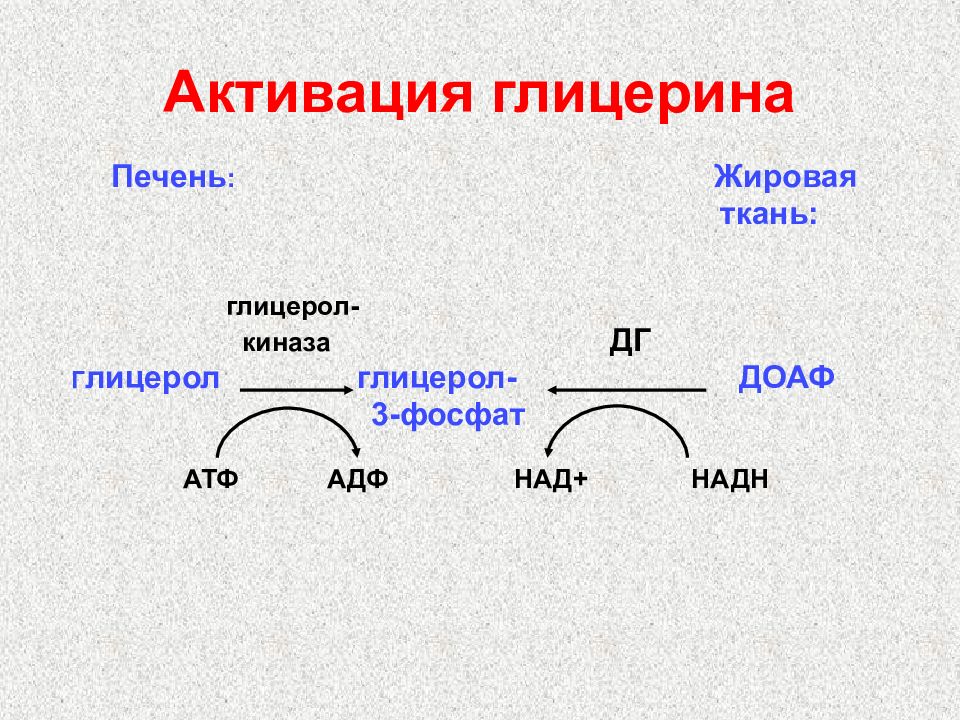
Слайд 39: Активация глицерина
Печень : Жировая ткань: глицерол- киназа ДГ Г лицерол глицерол- ДОАФ 3-фосфат АТФ АДФ НАД+ НАДН
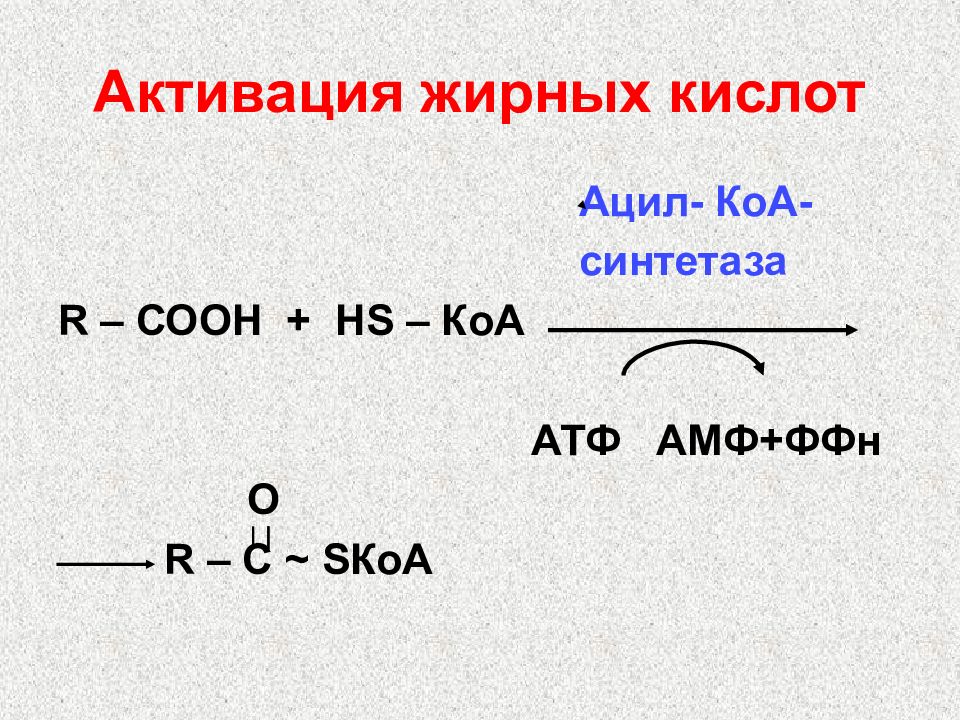
Слайд 40: Активация жирных кислот
Ацил- КоА- синтетаза R – СООН + Н S – КоА АТФ АМФ+ФФн О R – С ~ S КоА
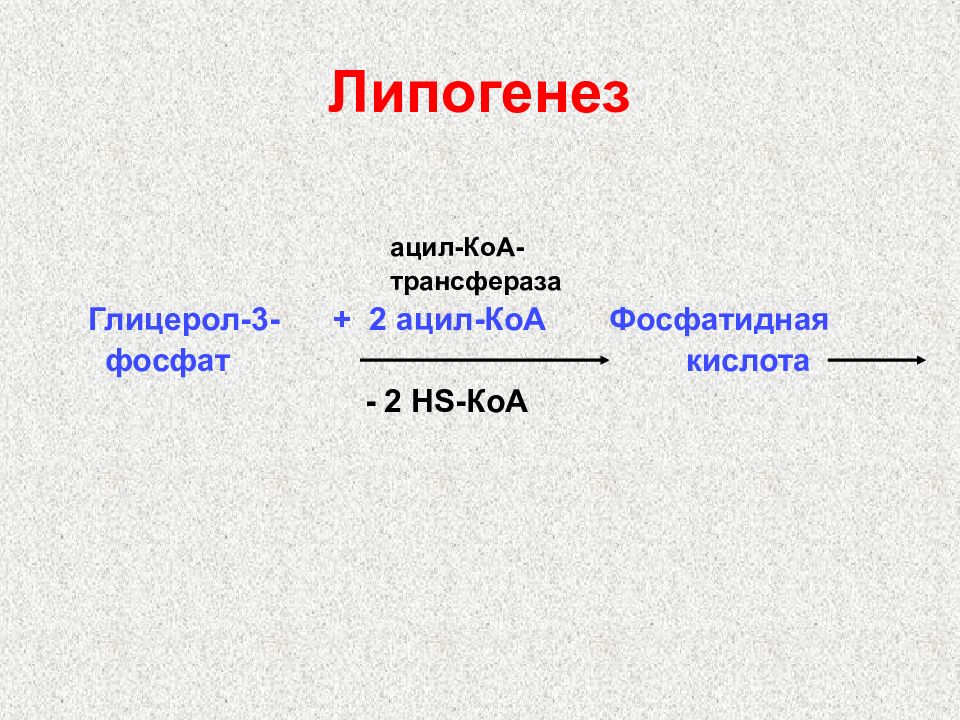
Слайд 41: Липогенез
ацил-КоА- трансфераза Глицерол-3- + 2 ацил-КоА Фосфатидная фосфат кислота - 2 Н S -КоА
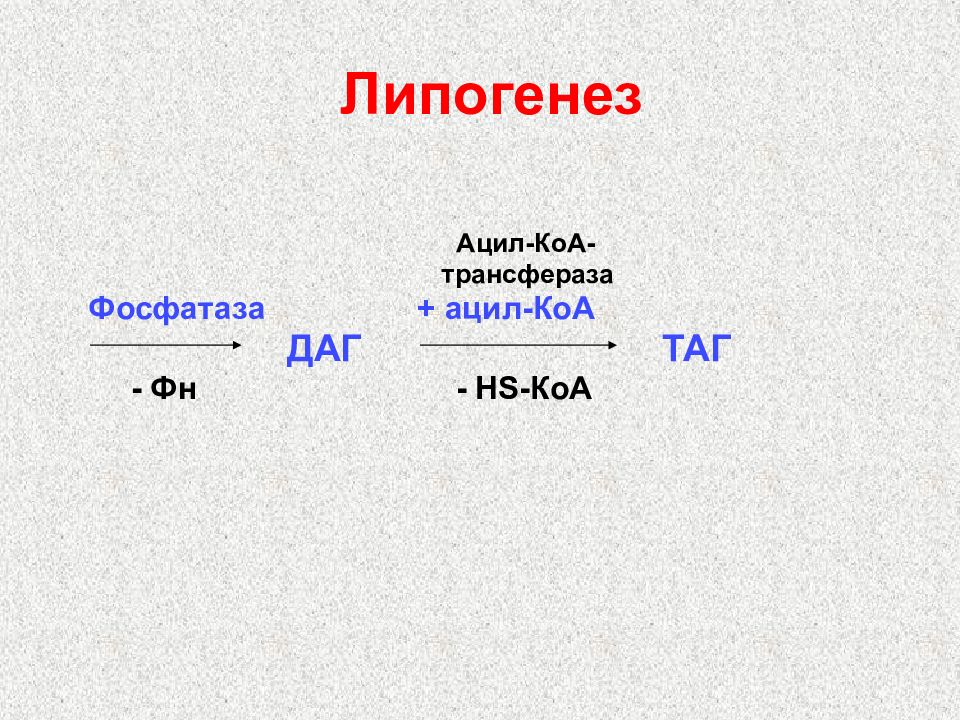
Слайд 42: Липогенез
Ацил-КоА- трансфераза Фосфатаза + ацил-КоА ДАГ ТАГ - Фн - Н S -КоА
Слайд 43: Регуляция липогенеза
Активаторы: инсулин, эстрогены и АТФ Ингибиторы : КА, СТГ, ЙТ, АКТГ, АДФ
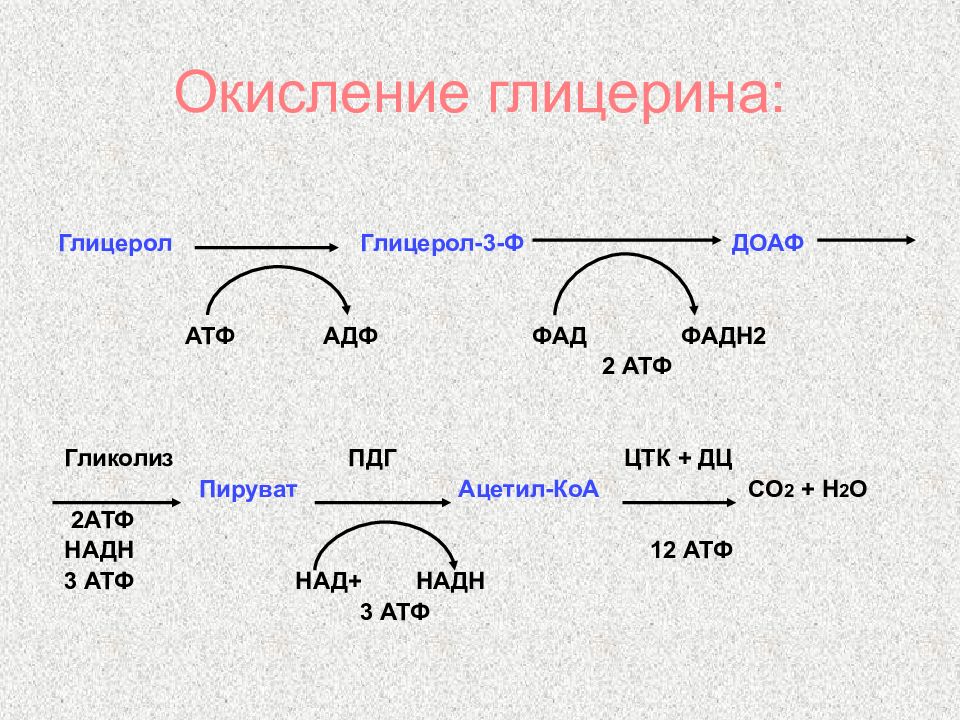
Слайд 44: Окисление глицерина:
Глицерол Глицерол-3-Ф ДОАФ АТФ АДФ ФАД ФАДН2 2 АТФ Гликолиз ПДГ ЦТК + ДЦ Пируват Ацетил-КоА СО 2 + Н 2 О 2АТФ НАДН 12 АТФ 3 АТФ НАД+ НАДН 3 АТФ
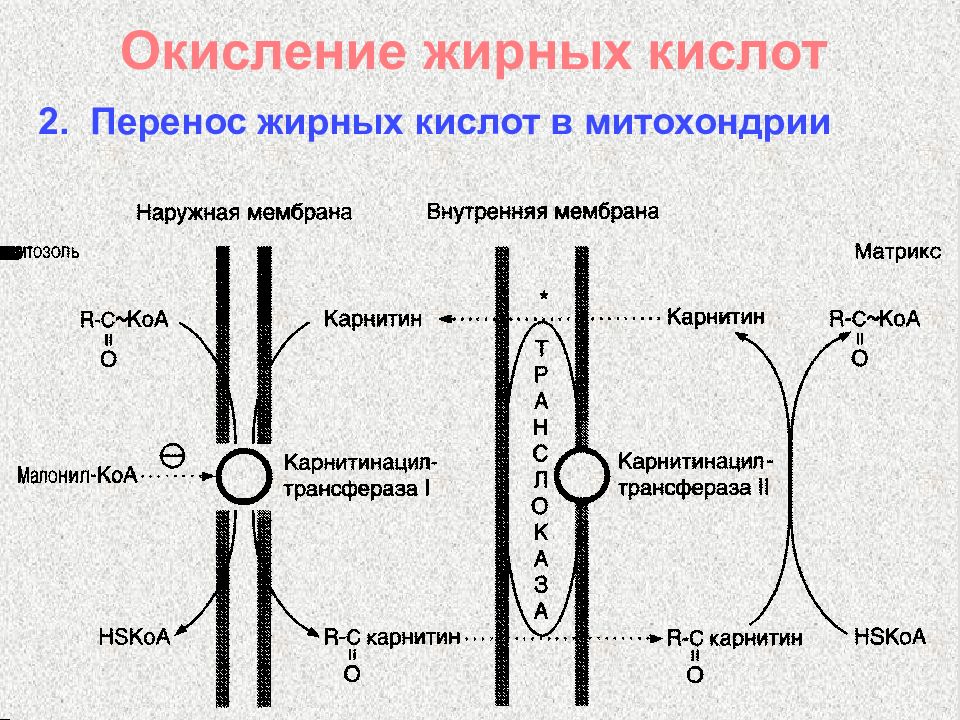
Слайд 45: Окисление жирных кислот
Жирная + Н S -КоА + АТФ кислота Ацил-КоА + АМФ + ФФн ацил-КоА-синтетаза 1. Активация жирных кислот
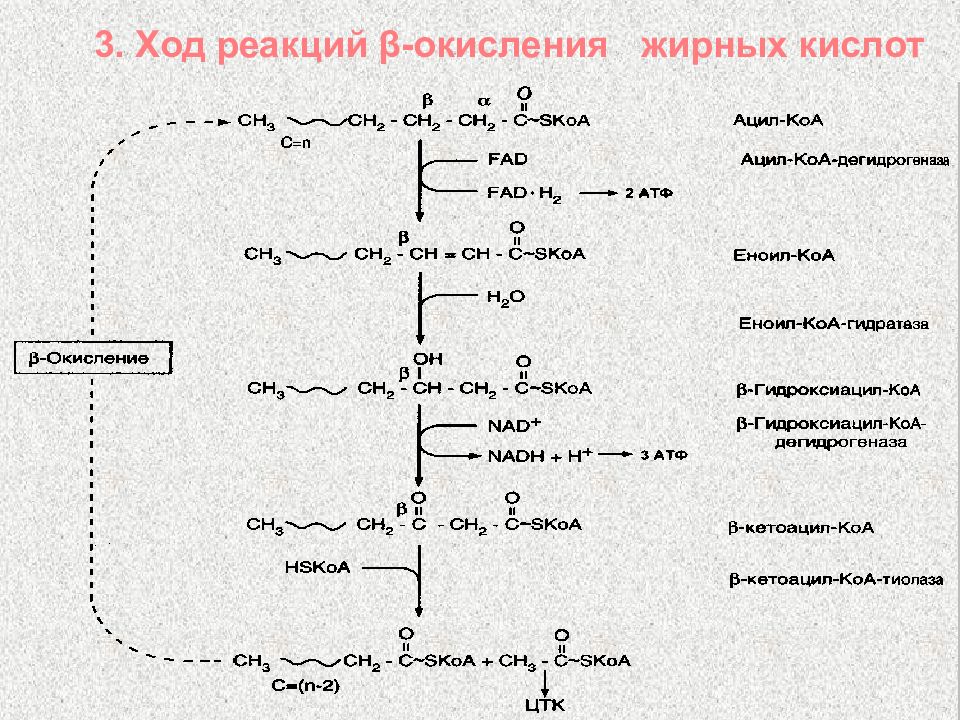
Слайд 48: Общее уравнение β -окисления пальмитиновой кислоты
С 15 Н 31 СО ~ S КоА + 7 ФАД + 7 НАД + + 7 Н S – КоА 8 СН 3 – СО ~ S КоА + + 7 ФАДН 2 + 7 (НАДН + Н + )
Слайд 49: Регуляция β-окисления жирных кислот
активаторы: КА, СТГ, глюкагон инргибиторы: инсулин
Слайд 50: Пути образования ацетил-КоА
1. Из пирувата в ходе ПДГ- реакции 2. β-окисление жирных кислот.
Слайд 51: Пути использования ацетил-КоА
Окисление в цикле Кребса Синтез жирных кислот Синтез холестерина и кетоновых тел
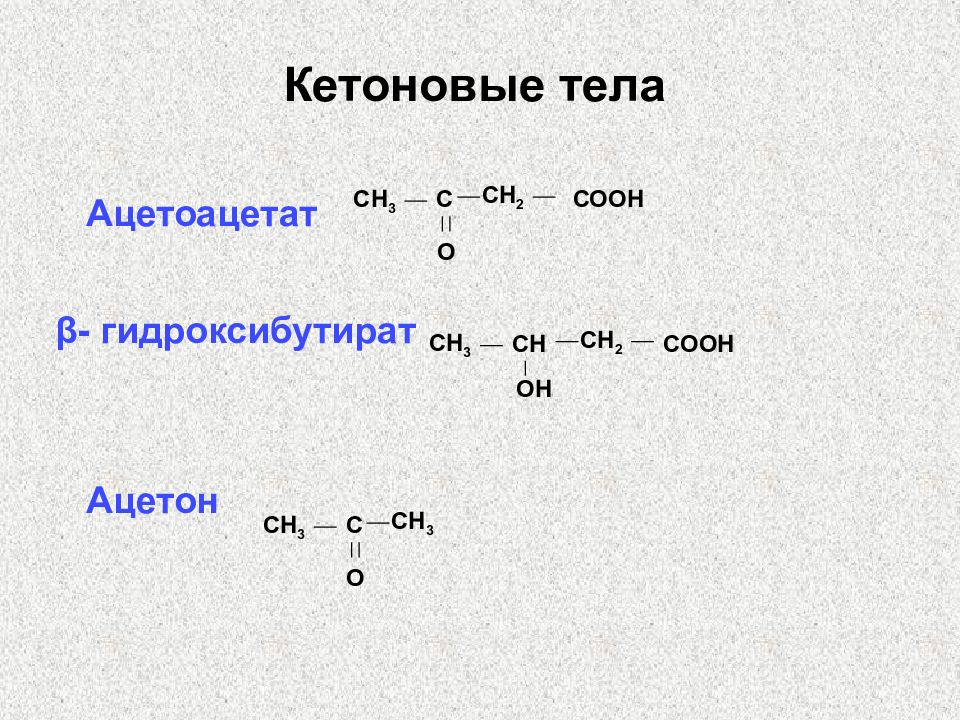
Слайд 52: Кетоновые тела
Ацетоацетат β- гидроксибутират Ацетон CH 2 СН 3 С O СООН CH 2 СН 3 СН O Н СООН CH 3 СН 3 С O
Слайд 53: Функции кетоновых тел
Энергетическая (скелетная и сердечная мышцы, головной мозг и другие внепеченочные ткани) 2. Кетоновые тела необходимы для образования миелиновых оболочек нервов и белого вещества головного мозга
Слайд 54: Кетоз
Кетоз – это накопление кетоновых тел в организме. Сопровождается кетонемией и кетонурией Различают: 1. Физиологический кетоз (голодание, длительная мышечная работа, у новорожденных) 2. Патологический кетоз (сахарный диабет)
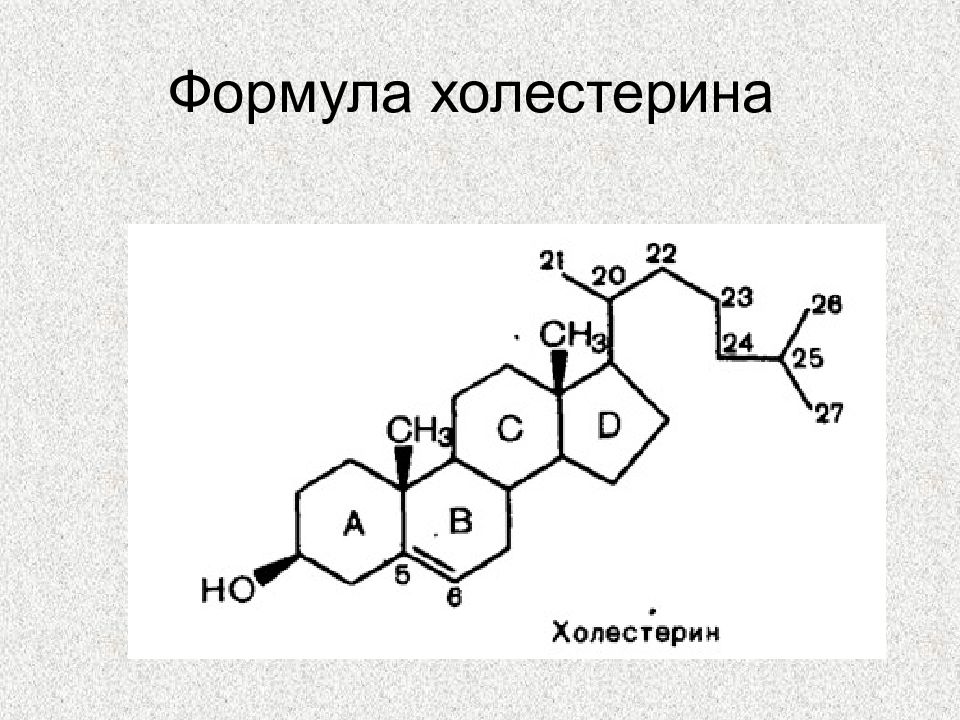
Слайд 56: Роль холестерина в организме
Входит в состав клеточных мембран и обеспечивает их текучесть Синтез желчных кислот в печени Синтез витамина D в коже Синтез стероидных гормонов (половые гормоны, минералокортикоиды, ГКС)
Слайд 57: Источники холестерина
1. Пищевые продукты (желток куриного яйца, головной мозг, печень животных, сливочное масло и др.) 2. Синтез из ацетил-КоА : - в печени (50%) - в слизистой тонкого кишечника (15-20%) - в коже, коре надпочечников, половых железах (30-35%)
Слайд 58: Синтез холестерина
1-й этап: 3 ацетил-КоА ГМГ-КоА мевалоновая кислота 2-й этап: Мевалоновая кислота сквален 3-й этап: Сквален ланостерин ХС
Слайд 59: Регуляция синтеза ХС
Активаторы : КА, СТГ, ГКС, андрогены насыщенные ЖК пища, богатая углеводами стресс гиподинамия
Слайд 60: Регуляция синтеза ХС
Ингибиторы : инсулин, эстрогены ненасыщенные ЖК ХС (по принципу отрицательной обратной связи) желчные кислоты физическая нагрузка
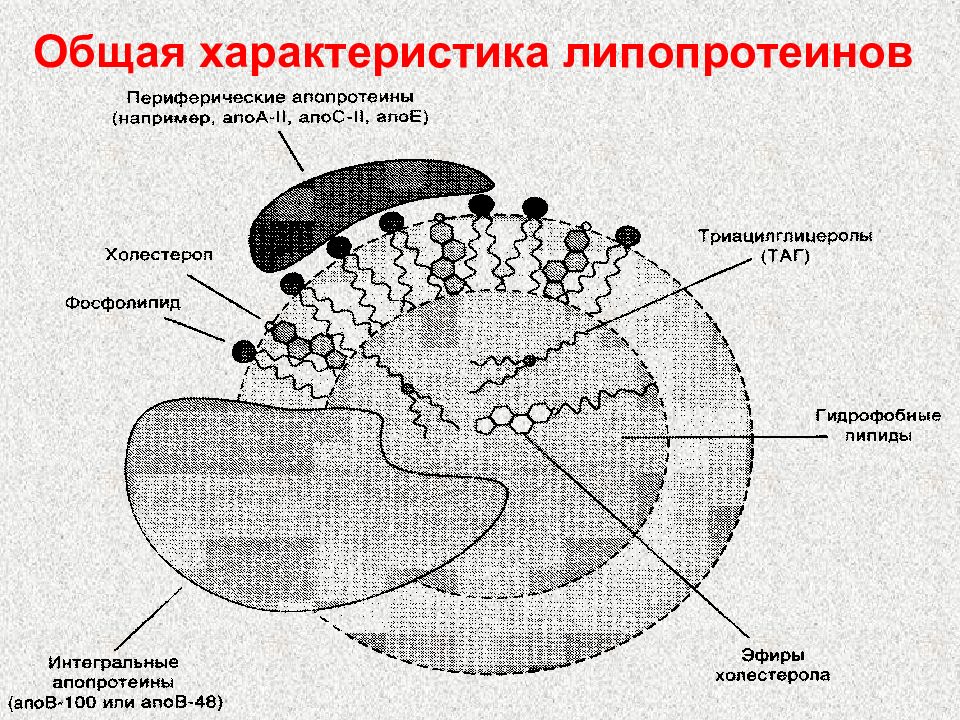
Слайд 62: Липопротеины
хиломикроны (ХМ) Содержат 1-2% белка и 98-99% липидов имеют наименьшую плотность Образуются в стенке кишечника Транспортируют пищевые липиды Метаболизируются липопротеинлипазой
Слайд 63: Липопротеины
пре β-липопротеины (или ЛПОНП) Содержат 10% белка, 90% липидов Образуются в печени и очень мало – в тощем кишечнике Транспортируют эндогенные липиды (в основном жиры) в жировую ткань Частично превращаются в кровяном русле в ЛПНП под действием липопротеинлипазы
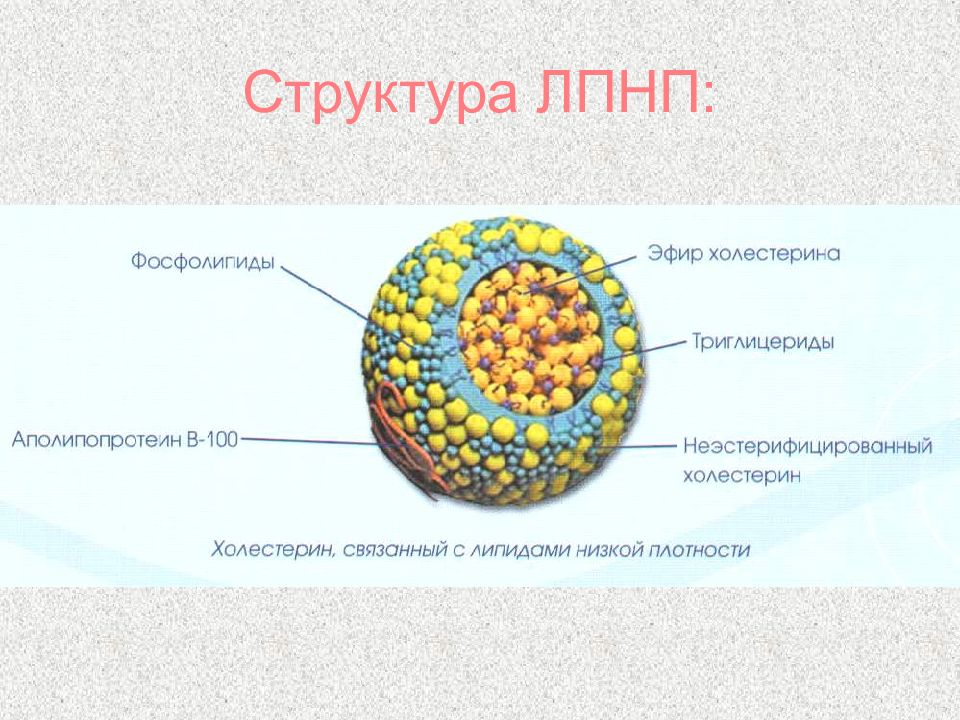
Слайд 64: Липопротеины
β-липопротеины (ЛПНП) Содержат около 25% белка и 75% липидов Главный поставщик ХС в ткани На клеточных мембранах имеются рецепторы для ЛПНП
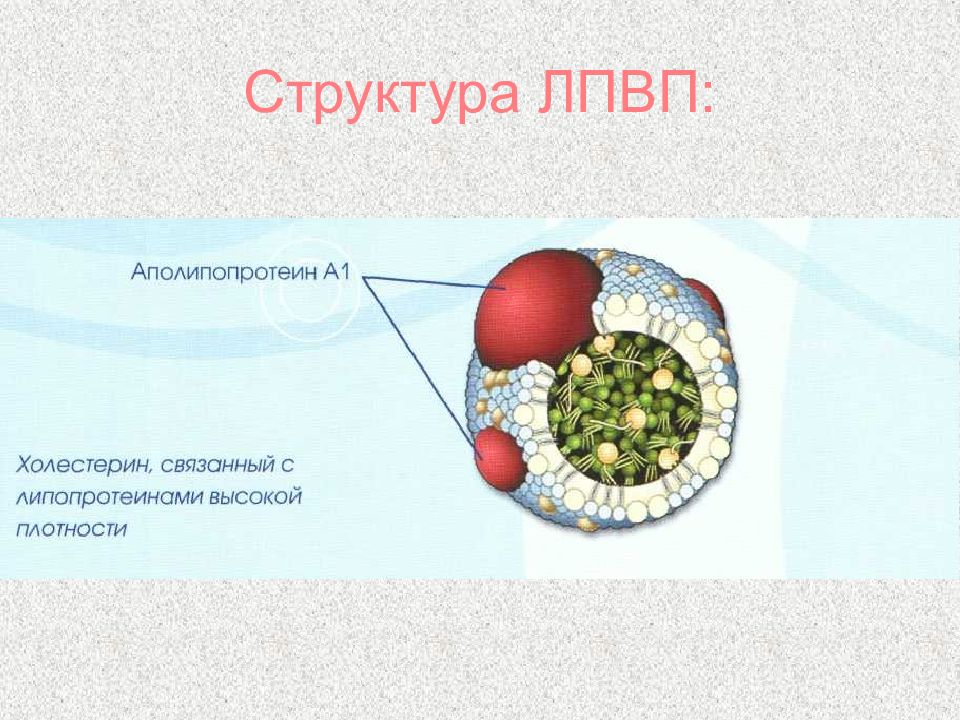
Слайд 66: Липопротеины
α-липопротеины (ЛПВП) Содержат 50% белков, 25% фосфолипидов, 20% эфиров ХС и очень мало триацилглицеринов Образуются главным образом в печени Участвуют в переносе ХС из тканей в печень Содержат лецитинхолестерол-ацилтрансферазу (ЛХАТ) ЛПОНП и ЛПНП считают атерогенными, то есть вызывающими атеросклероз ЛПВП - антитиатерогенными
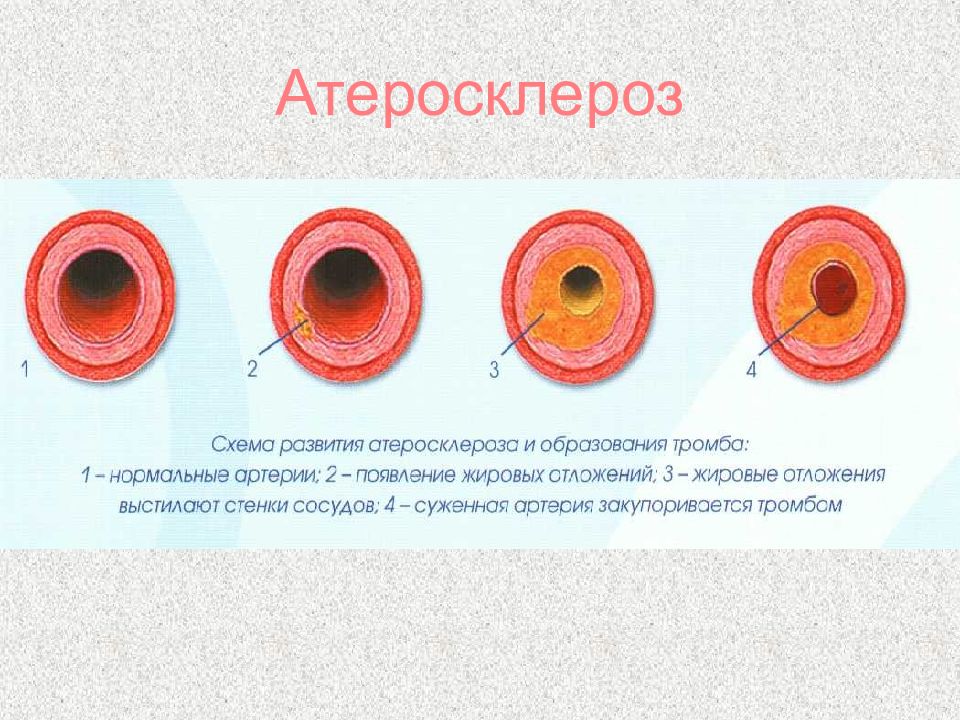
Слайд 70: Механизмы защиты сосудов от атеросклероза
Действие липопротеинлипазы в стенке сосуда Наличие ЛПВП в крови
Слайд 71: Биохимические причины атеросклероза
Увеличение атерогенных липопротеинов (ЛПОНП и ЛПНП) Снижение антиатерогенных ЛПВП Снижение активности липопротеинлипазы Снижение количества и/или чувствительности рецепторов к ЛПНП
Слайд 72: Факторы риска развития атеросклероза
Курение Стресс Переедание (пища, богатая насыщенными ЖК и углеводами)
Слайд 73: Факторы риска развития атеросклероза
Эндокринные факторы: - гипотиреоз - сахарный диабет - андрогены - климакс - гиперфункция гипофиза - гиперфункция надпочечников
Слайд 74: Факторы риска развития атеросклероза
Хронические гипоксии Гиподинамия Семейно-наследственные факторы
Слайд 75: Коэффициент атерогенности
Общий ХС – ХС ЛПВП ХС ЛПВП У здоровых людей это соотношение не должно превышать 3 Если выше – имеется риск ИБС
Слайд 76: Ожирение
Ожирение – это состояние, когда масса тела превышает 20% от «идеальной» для данного человека Причины первичного ожирения: Генетические нарушения (до 80% случаев) Состав и количество потребляемой пищи, метод питания в семье. Переедание Низкий уровень физической активности Психологические факторы
Слайд 77: Липидозы
Болезнь Тея-Сакса (ганглиозидоз) Накопление ганглиозидов в клетках мозга, меньше в других тканях Болезнь Гоше (цереброзидоз) Накопление глюкоцереброзидов в лизосомах печени, селезенки, костного мозга Болезнь Нимана-Пика Накопление лецитинов и сфингомиелинов в лизосомах печени и селезенки
Слайд 79: Этапы катаболизма (схема)
Жиры Полисахариды Белки Жирные Глицерин Моносахариды Аминокислоты кислоты Пируват Ацетил-КоА HS- КоА CO 2 H 2 Цикл Кребса Дыхательная цепь H 2 O АТФ АТФ оксалоацетат 2оксоглутарат
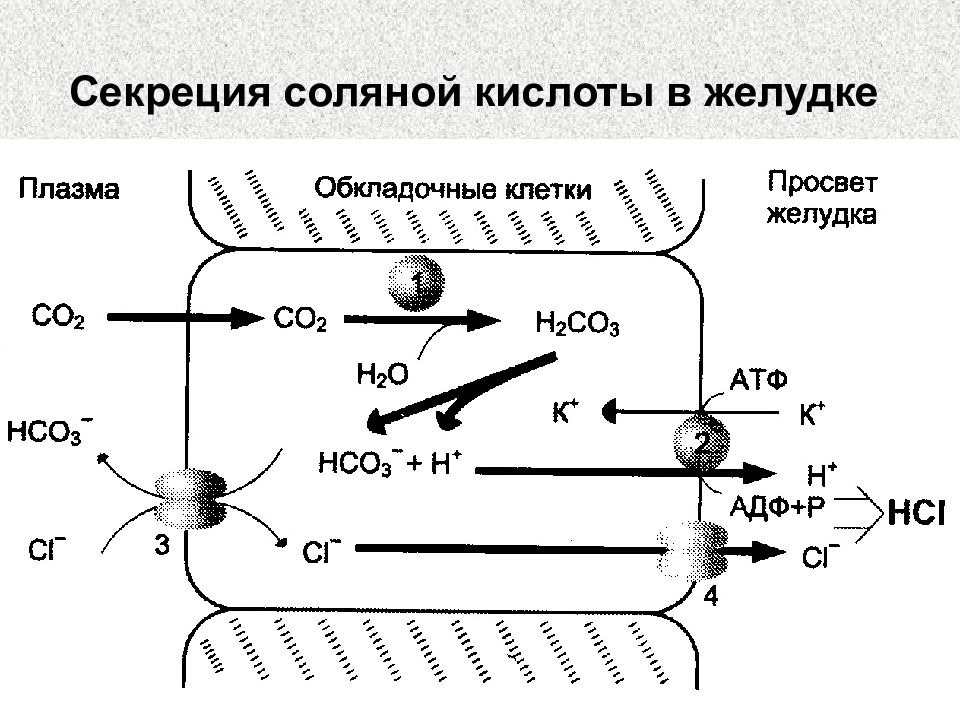
Слайд 81: Роль НС l
Превращение препепсина в пепсин Оптимум рН для работы пепсина Денатурация пищевых белков Бактерицидное действие
Слайд 82: Источники аминокислот
Переваривание пищевых белков в ЖКТ Расщепление клеточных белков лизосомальными пептидазами (катепсинами) Синтез из других аминокислот Образование из безазотистых соединений (кетокислот)
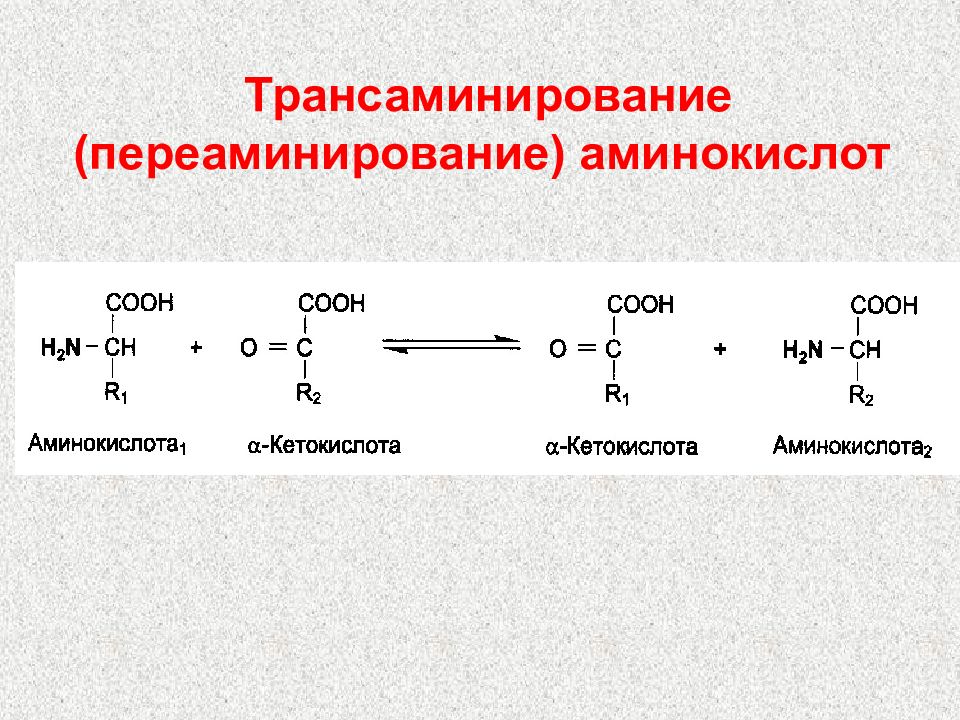
Слайд 83: Пути использования аминокислот
Синтез белков Синтез биологически важных соединений (пуринов, пиримидинов, гормонов, порфиринов и др.) Дезаминирование аминокислот с образованием кетокислот
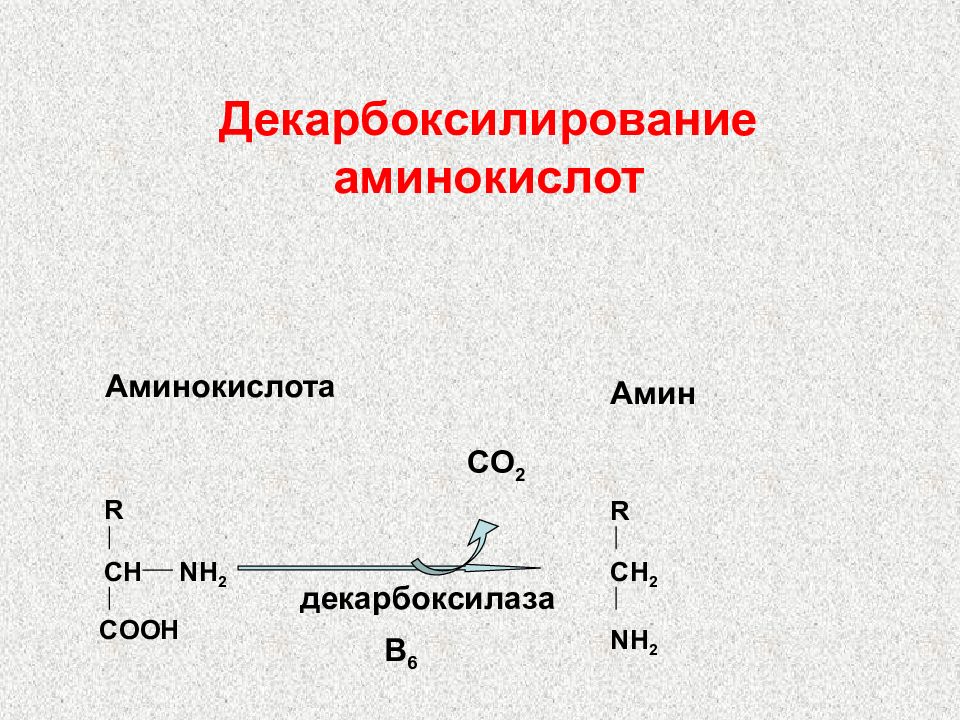
Слайд 84: Декарбоксилирование аминокислот
R CH NH 2 COOH CO 2 R CH 2 NH 2 B 6 декарбоксилаза Аминокислота Амин
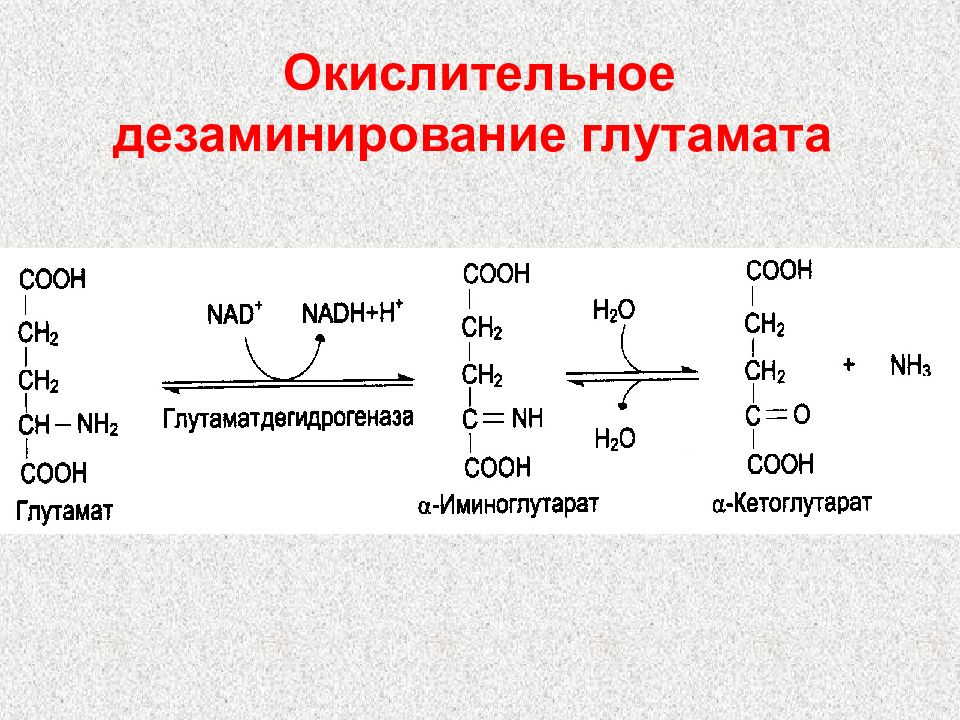
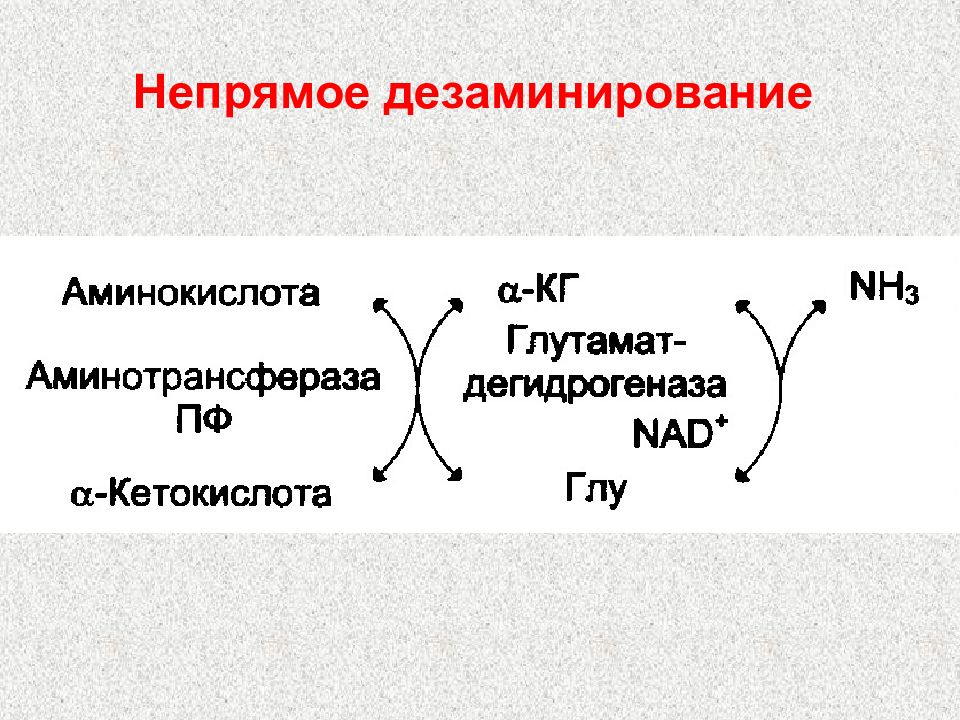
Слайд 89: Продукты непрямого дезаминирования:
α -кетокислота, которая может 1) окисляться в цикле Кребса 2) использоваться в ГНГ на синтез глюкозы 3) превращаться в кетоновые тела НАДН N Н3
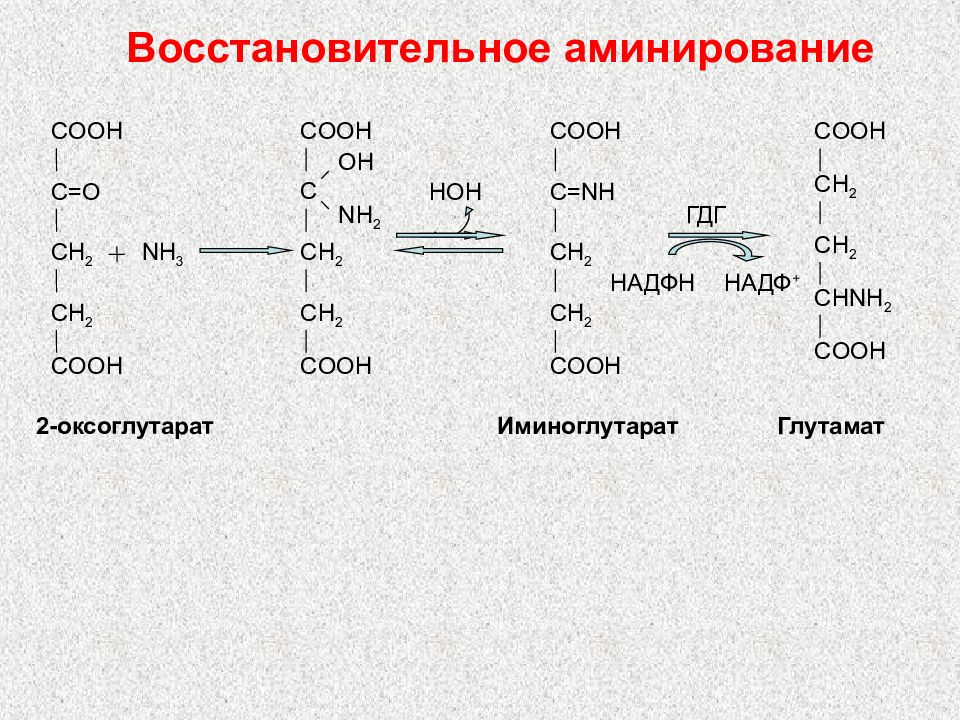
Слайд 90: Восстановительное аминирование
COOH C=O CH 2 CH 2 COOH NH 3 COOH C OH NH 2 CH 2 CH 2 COOH COOH C=NH CH 2 CH 2 COOH COOH CH 2 CH 2 CHNH 2 COOH Глутамат ГДГ НАДФ H НАДФ + 2- оксоглутарат Иминоглутарат HOH
Слайд 91: Источники аммиака :
Реакции дезаминирования аминокислот биогенных аминов (ГА, СТ, КА и др.) пуриновых и пиримидиновых азотистых оснований амидов (глутамина, аспарагина) 2) Образование в кишечнике в результате деятельности микрофлоры (гниение белков) всасывается в кровь воротной вены
Слайд 92: Причины токсичности аммиака
1) Легко проникает через клеточные мембраны 2) Связывается с 2-оксоглутаратом, угнетает обмен аминокислот (переаминирование) и цикл Кребса 3) Усиливает синтез глутамина из глутамата в нервной ткани. В результате снижается синтез ГАМК,что нарушает проведение нервного импульса и вызывает судороги
Слайд 93: Причины токсичности аммиака
4) Накопление иона NH 4 + нарушает трансмембранный перенос ионов Na + и К +, что влияет на проведение нервного импульса 5) Сдвиг рН в щелочную сторону - метаболический алкалоз
Слайд 94: Обезвреживание аммиака
1. Восстановительное аминирование 2. Образование амидов (глутамина и аспарагина) 3. Образование аланина в мышцах 4. Синтез мочевины в печени
Слайд 95: Суммарное уравнение синтеза мочевины:
CO 2 + NH 3 + Аспартат + 3 АТФ + 2 H 2 O = Мочевина + Фумарат + 2(АДФ + H 3 PO 4 ) + АМФ + H 4 P 2 O 7
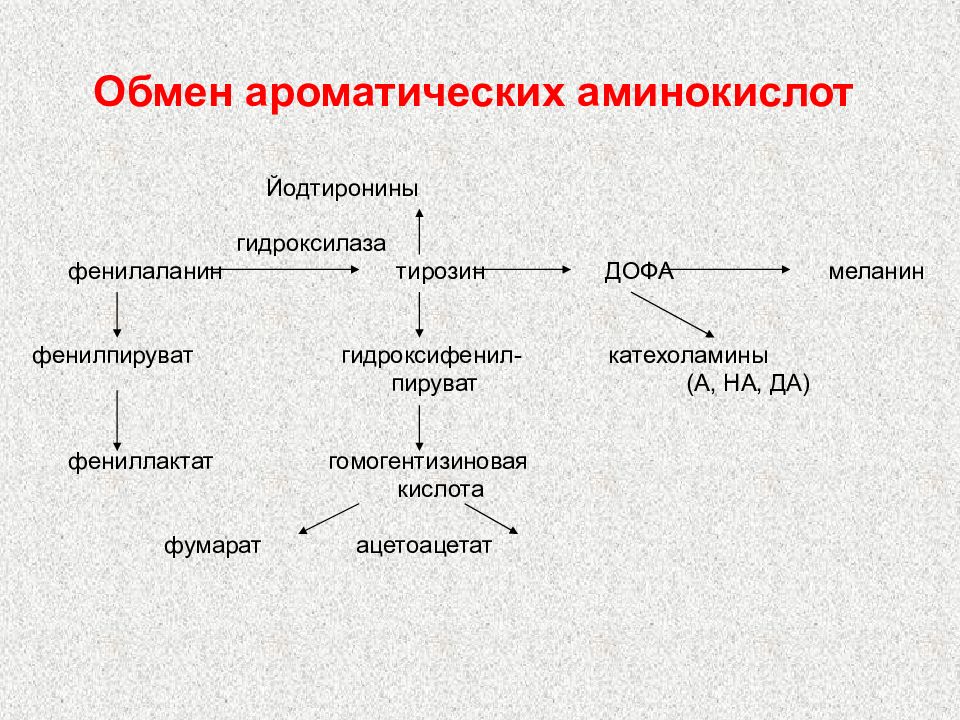
Слайд 97: Обмен ароматических аминокислот
Йодтиронины гидроксилаза фенилаланин тирозин ДОФА меланин фенилпируват гидроксифенил- катехоламины пируват (А, НА, ДА) фениллактат гомогентизиновая кислота фумарат ацетоацетат
Слайд 98: Биологическая роль креатина
В мышцах: Креатин + АТФ Креатинфосфат + АДФ Креатинкиназа В покоящейся мышце В работающей мышце
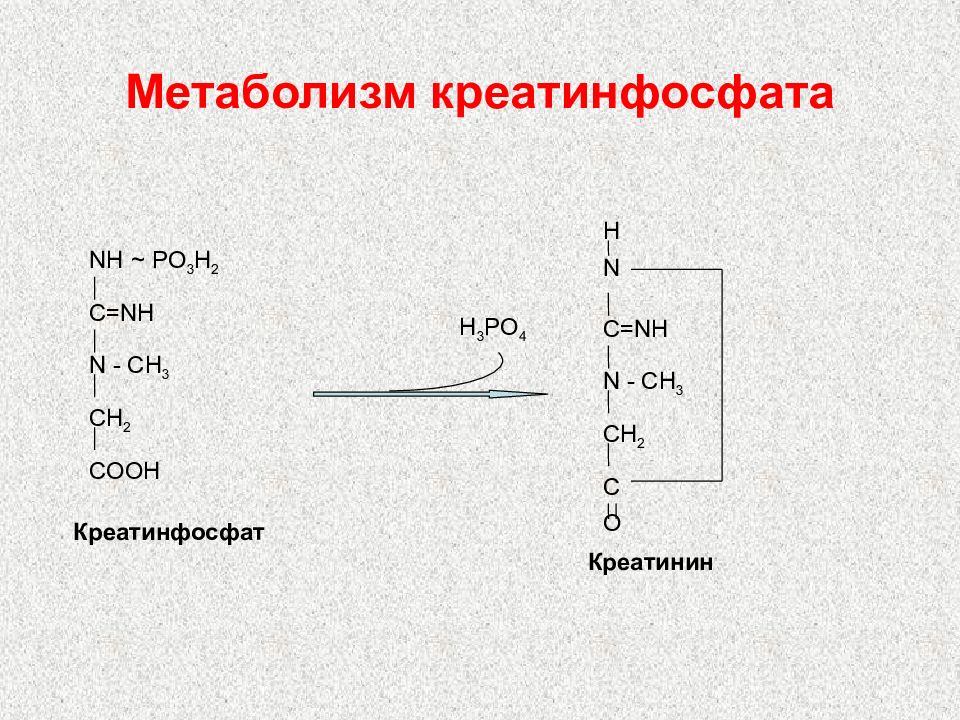
Слайд 99: Метаболизм креатинфосфата
Креатинфосфат NH ~ PO 3 H 2 C=NH N - CH 3 CH 2 COOH H 3 PO 4 H N C=NH N - CH 3 CH 2 C O Креатинин
Слайд 100: Диагностическое значение:
Креатинин мочи Клиренс = ------------------------- х диурез (мин) Креатинин крови
Слайд 101: Диагностическое значение :
Определение активности КК и ее изоферментов в крови используется для диагностики инфаркта миокарда, миопатий, мышечных дистрофий и др.
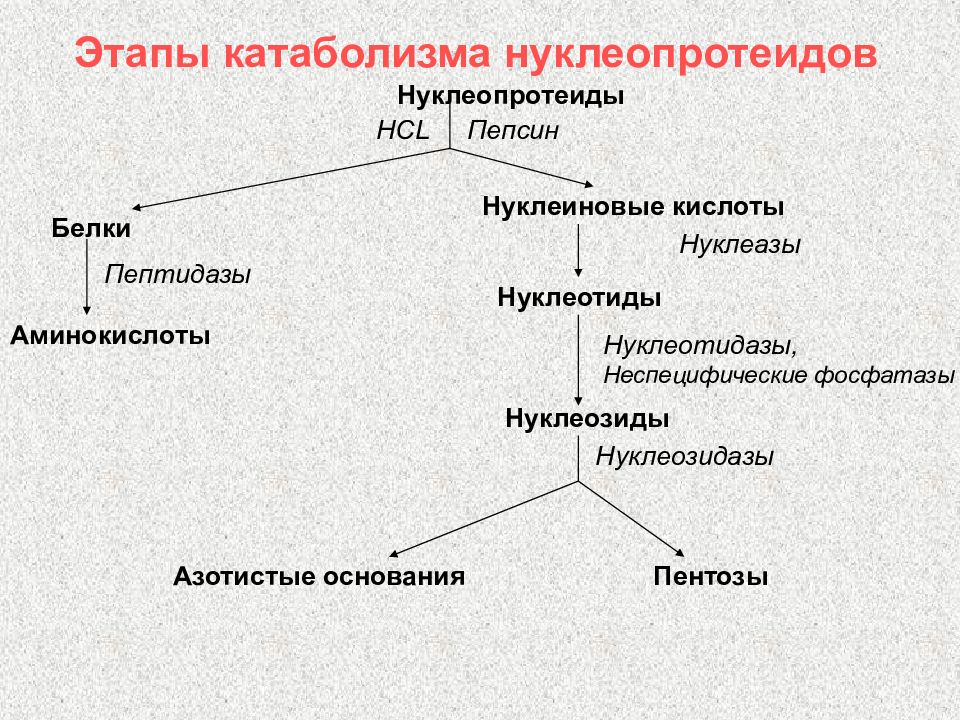
Слайд 103: Этапы катаболизма нуклеопротеидов
Нуклеопротеиды HCL Пепсин Белки Пептидазы Аминокислоты Нуклеиновые кислоты Нуклеазы Нуклеотиды Нуклеотидазы, Неспецифические фосфатазы Нуклеозиды Нуклеозидазы Азотистые основания Пентозы
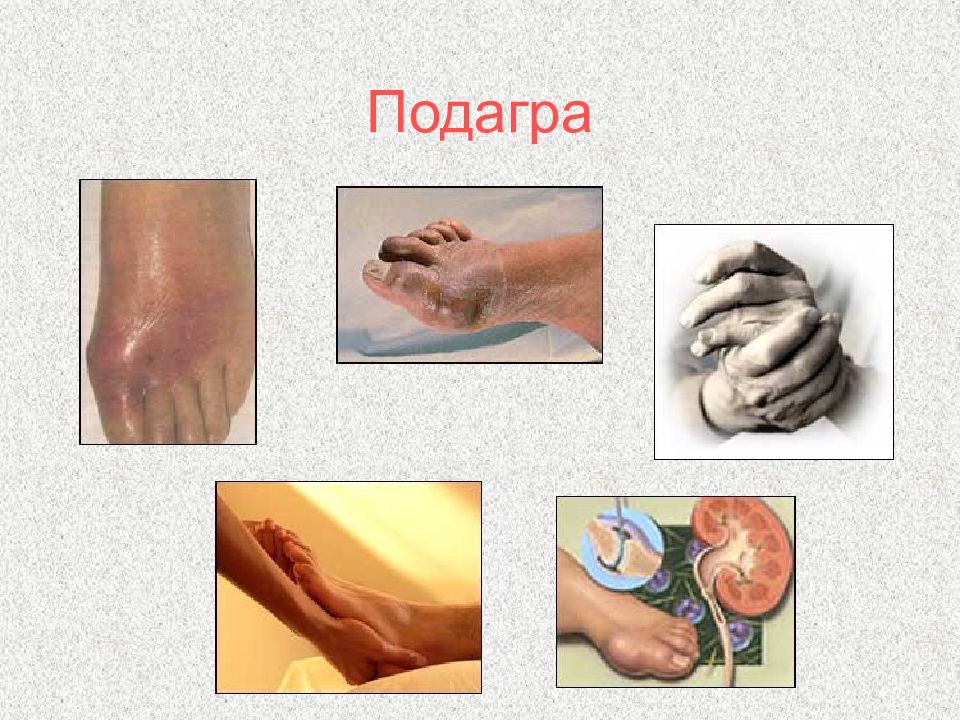
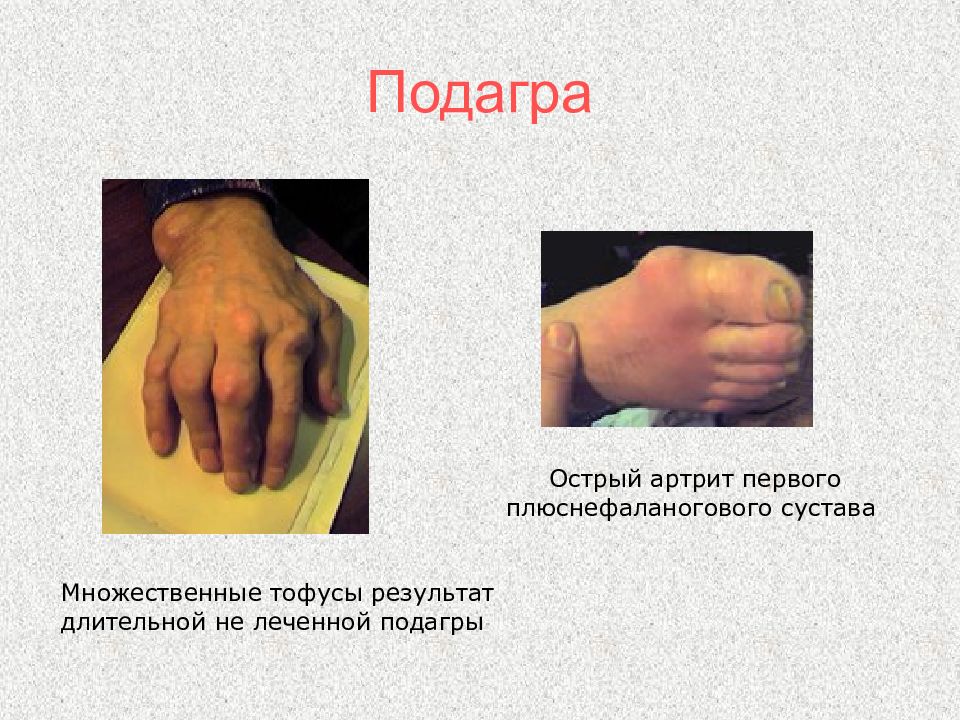
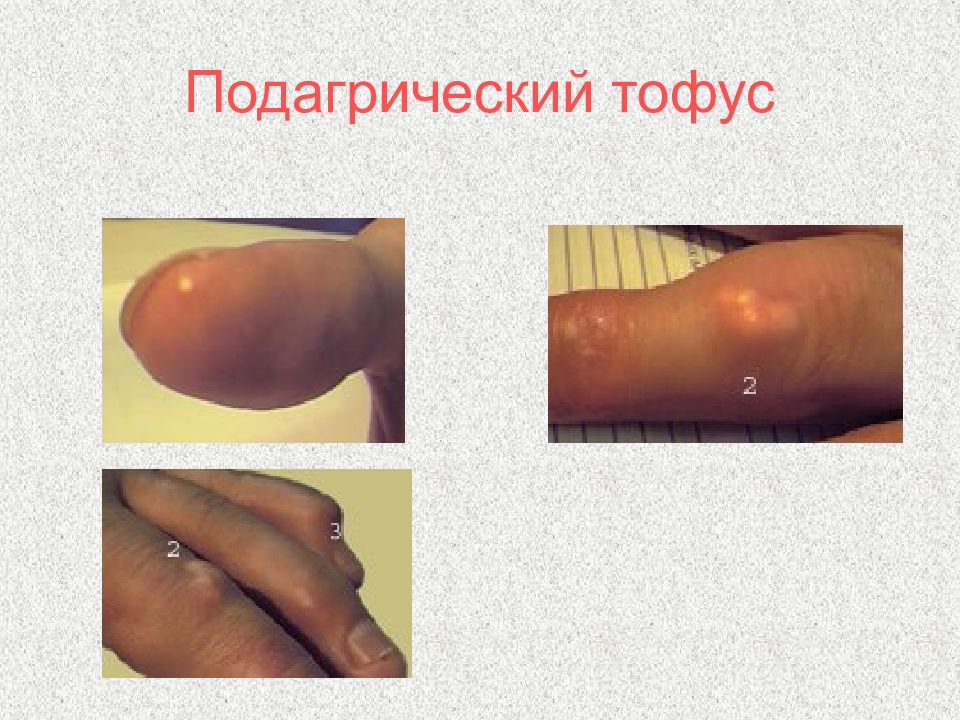
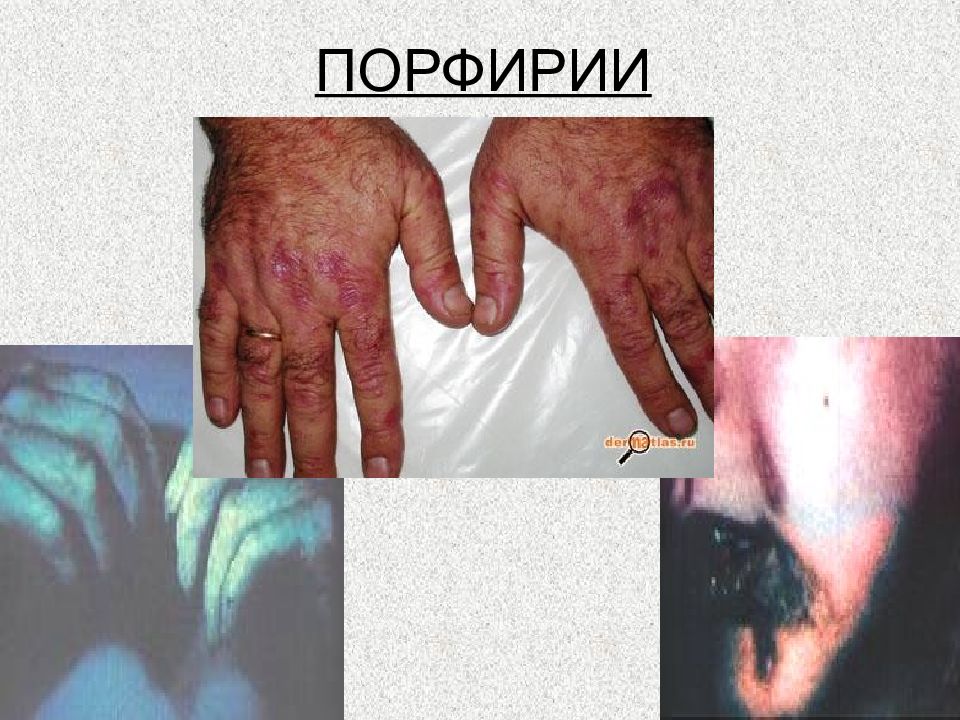
Слайд 105: Подагра
Множественные тофусы результат длительной не леченной подагры Острый артрит первого плюснефаланогового сустава
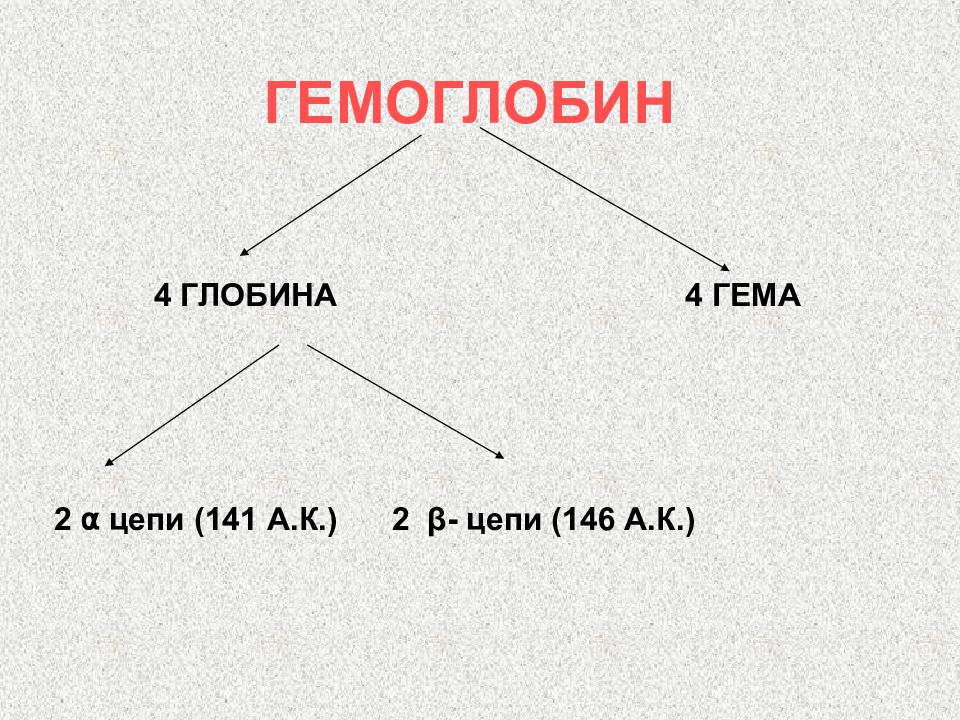
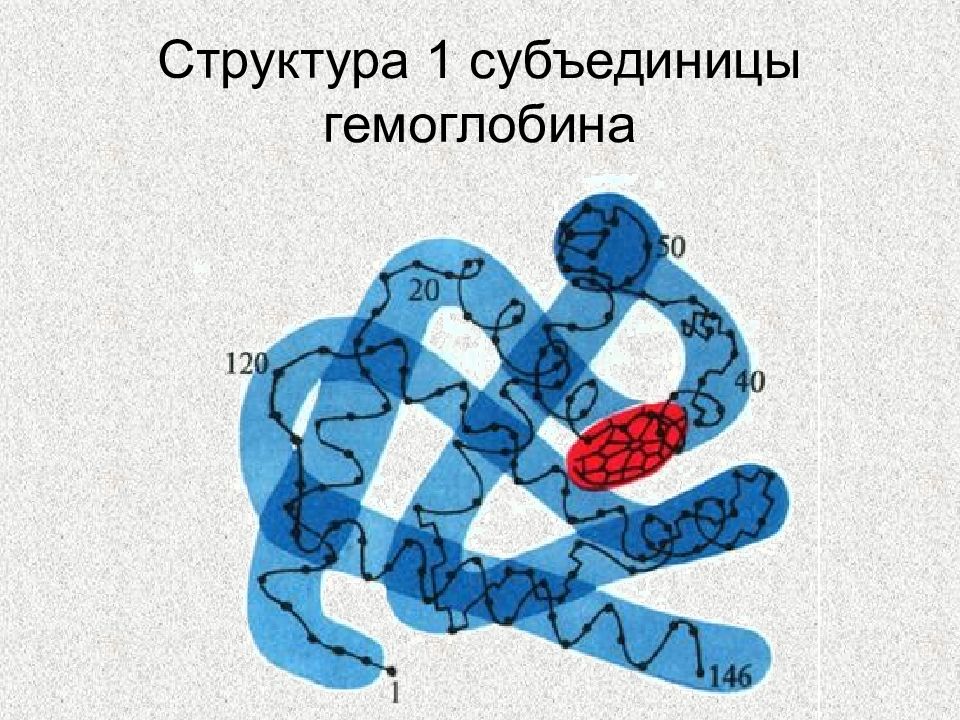
Слайд 107: ХРОМОПРОТЕИДЫ – сложные белки, небелковой частью которых являются окрашенные вещества
ФЛАВОПРОТЕИДЫ ГЕМПРОТЕИДЫ РОДОПСИН И ЙОДОПСИН ХЛОРОФИЛЛ КОБАМИДНЫЕ ФЕРМЕНТЫ
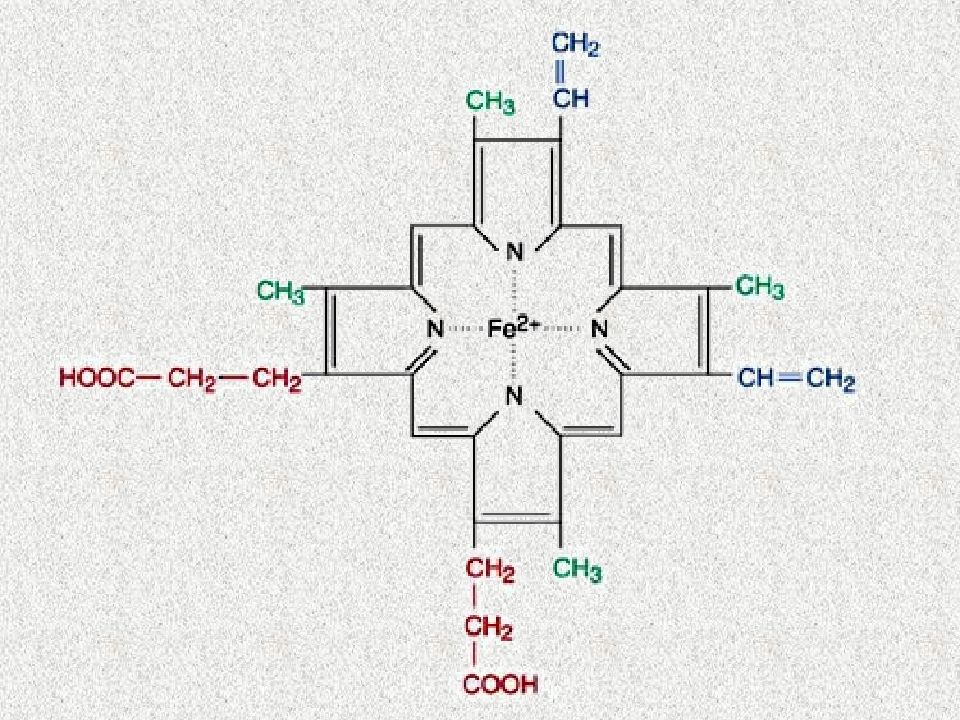
Слайд 111: ДЛЯ СИНТЕЗА ГЕМА ТРЕБУЕТСЯ:
ГЛИЦИН СУКЦИНИЛ-КоА ВИТАМИНЫ В 6, В 12, В 9 (ФОЛИЕВАЯ КИСЛОТА) Fe 2+
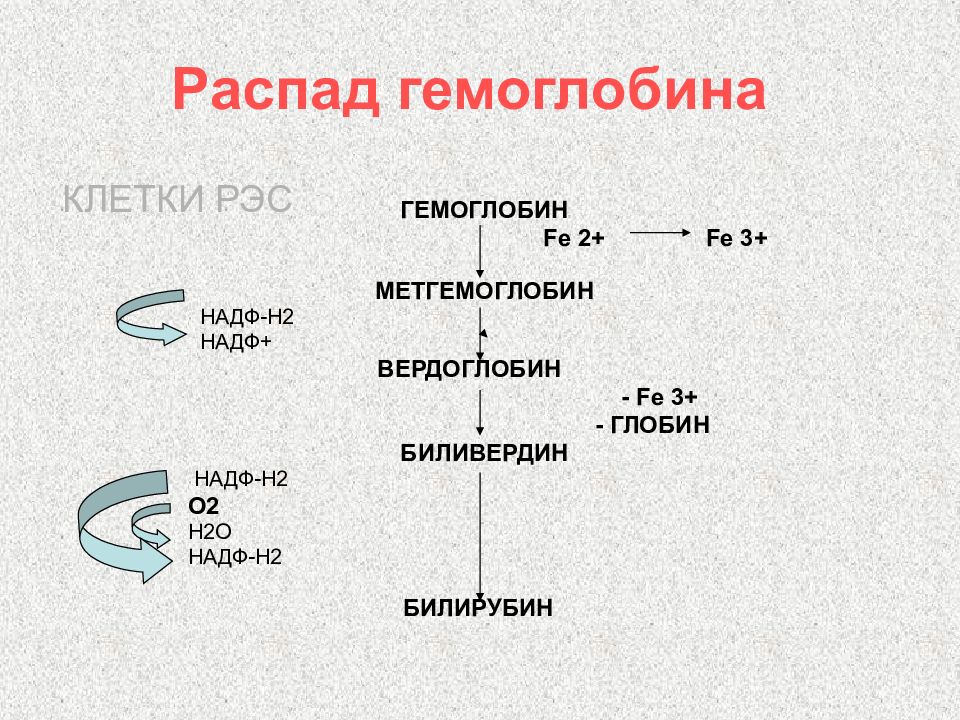
Слайд 113: Распад гемоглобина
ГЕМОГЛОБИН Fe 2+ Fe 3+ МЕТГЕМОГЛОБИН НАДФ-Н2 НАДФ+ ВЕРДОГЛОБИН - Fe 3+ - ГЛОБИН БИЛИВЕРДИН НАДФ-Н2 О2 Н2О НАДФ-Н2 БИЛИРУБИН КЛЕТКИ РЭС
Слайд 114
БИЛИРУБИН УДФ-ГЛЮКУРОНИЛ ТРАНСФЕРАЗА БИЛИРУБИНГЛЮКУРОНИД - ГЛЮКУРОНОВАЯ КИСЛОТА БИЛИРУБИН П Е Ч Е Н Ь Распад гемоглобина
Слайд 115: Распад гемоглобина
БИЛИРУБИН МЕЗОБИЛИРУБИН МЕЗОБИЛИРУБИНОГЕН (УРОБИЛИНОГЕН) СТЕРКОБИЛИНОГЕН СТЕРКОБИЛИН (ФЕКАЛИИ) КИШЕЧНИК Распад гемоглобина
Слайд 116: ФОРМЫ БИЛИРУБИНА:
СВОБОДНЫЙ БИЛИРУБИН (несвязанный, неконъюгированный, непрямой): Не дает прямой реакции с реактивом Эрлиха Не растворим в воде Высоко токсичен Не проходит через мембраны В крови свободного билирубина – 75%
Слайд 117
СВЯЗАННЫЙ БИЛИРУБИН (конъюгированный, прямой) Дает прямую реакцию с реактивом Эрлиха Мало токсичен Растворим в воде Легко проходит через мембраны В крови связанного билирубина – 25%
Слайд 119: БЕЛКИ ПЛАЗМЫ КРОВИ
альбумины 42 г / л - 57 % глобулины 31 г / л - 42% фибриноген 3 г / л - 1%
Слайд 120: Фракции глобулинов
α 1- глобулины 3% 3г / л α 2 -глобулины 9% 6г / л β - глобулины 13% 9г / л γ - глобулины 16% 15 г / л
Слайд 121: Функции альбуминов:
Поддержание онкотического давления Транспорт НЭЖК, билирубина, холестерина, некоторых гормонов, лекарств Резерв аминокислот
Слайд 122: Нарушения белкового состава крови
Гиперпротеинемия – увеличение концентрации белка в крови (почти всегда связана с гиперглобулинемией): относительная (при дегидратации) абсолютая (при активации иммунного ответа, миелопролиферативных заболеваниях)
Слайд 123: Нарушения белкового состава крови
Гипопротеинемия – понижение концентрации белка в крови (почти всегда связана с гипоальбуминемией) – возникает при нефротическом синдроме, печеночно-клеточной недостаточности, голодании, ожоговой болезни, патологии ЖКТ
Слайд 124: Нарушения белкового состава крови
Диспротеинемия – изменение соотношения различных фракций белков плазмы крови Парапротеинемия – появление аномальных форм белков, например, специфических белков при миеломной болезни,представляющих собой цепи иммуноглобулинов
Слайд 125: Отдельные белки крови:
Белки-ферменты Белки-переносчики Белки-ингибиторы ферментов
Слайд 126: Белки-переносчики
Церулоплазмин Трансферрин Гаптоглобин Преальбумин Специфический гликопротеид беременных
Слайд 127: Белки –ингибиторы ферментов
α 1- антитрипсин α 2- макроглобулин Интер- α -трипсиновый ингибитор
Слайд 128: Белки острой фазы
Гаптоглобин Церулоплазмин Трансферрин С- реактивный белок Интерферон Фибриноген
Слайд 130: Фракции остаточного азота
Мочевина - 50% Аминокислоты - 25% Эрготионеин - 8% Мочевая кислота - 4% Креатин – 5% Креатинин - 2,5% Аммиак – 0,2% Индикан – 0,3% Прочие – 5%