Первый слайд презентации
Противоопухолевый иммунитет: иммунодиагностика и иммунотерапия опухолей.
Слайд 2
Главное назначение иммунитета и эволюционное оправдание его возникновения — защита организма от биологической агрессии, осуществляемой в двух основных формах — внешней (инфекции) и внутренней (опухоли). Защита от опухолей – противоопухолевый иммунитет.
Слайд 3
Идея о том, что опухоли, как потенциальные носители соматических мутаций, должны вызывать иммунную реакцию отторжения, впервые была высказана П. Эрлихом в начале ХХ века. Идея была возрождена на новой теоретической основе Л. Томасом (L. Thomas ) в конце 1950-х годов и развита в концепцию иммунного надзора Ф.М. Бернетом (F.M. Burnet ) в 1970 г. Эта концепция предполагает постоянный надзор со стороны Т-лимфоцитов за антигенным составом собственных клеток организма.
Слайд 4
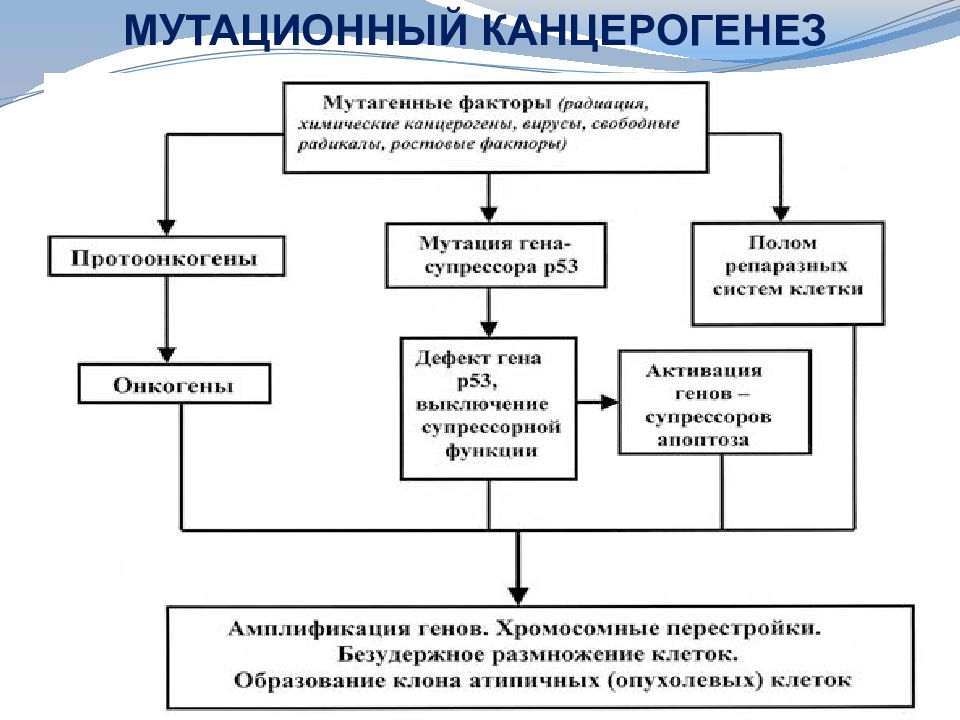
Частота соматических мутаций в организме такова, что за сутки должно возникнуть около миллиона мутантных клеток, среди которых значительная часть должна малигнизироваться. Причину несопоставимо более низкой малигнизации последователи концепции иммунного надзора объясняют элиминацией измененных клеток с помощью иммунологических механизмов вследствие экспрессии ими чужеродных, точнее — «измененных своих» молекул («измененное свое» как объект распознавания, осуществляемого Т-клетками).
Слайд 5
Первое четкое доказательство существования антигенов, связанных со злокачественными опухолями, было получено отечественным ученым Г.И. Абелевым в начале 60-х годов ХХ века. Им было установлено, что в сыворотке крови мышей-носителей первичного рака печени появляется α- фетопротеин — эмбриональный эквивалент сывороточного альбумина.
Слайд 6
мембранные - связанные с опухолевыми клетками ОПУХОЛЬ-СПЕЦИФИЧНЫЕ АНТИГЕНЫ секретируемые - сывороточные: ( раковоэмбриональный антиген, сывороточный специфический антиген простаты - PSA, хорионический гонадотропин) Опухоль-ассоциированные антигены используют в иммунодиагностике опухолей.
Слайд 7
индуцированные канцерогенными факторами - строго индивидуальны. Различны у разных индивидуумов (и в нескольких опухолях у одной и той же особи), даже если опухоли были индуцированы одним и тем же фактором ОПУХОЛЬ-СПЕЦИФИЧНЫЕ АНТИГЕНЫ индуцированные вирусам и - идентичны, как для нескольких опухолей у одного объекта, так и для опухолей у разных особей, если они индуцированы одним и тем же вирусом эмбриональные антигены - характерные для эмбриональной ткани. Голд назвал их карциноэмбриональными антигенами (КЭА)
Слайд 8
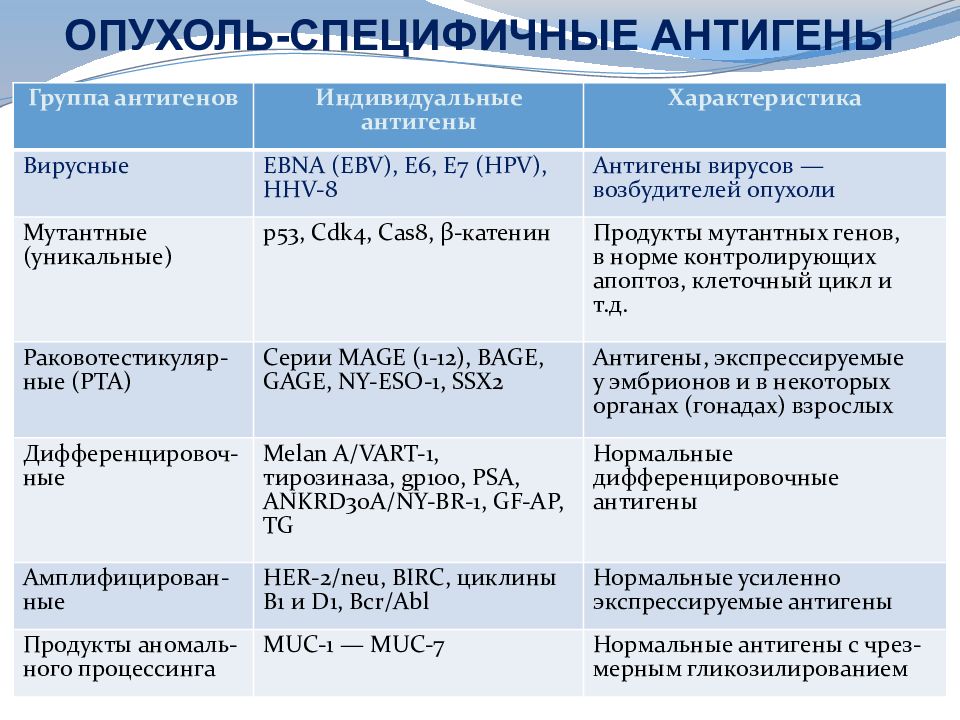
Группа антигенов Индивидуальные антигены Характеристика Вирусные EBNA (EBV), E6, E7 (HPV), HHV-8 Антигены вирусов — возбудителей опухоли Мутантные (уникальные) p53, Cdk4, Cas8, β- катенин Продукты мутантных генов, в норме контролирующих апоптоз, клеточный цикл и т.д. Раковотестикуляр-ные (РТА) Серии MAGE (1-12), BAGE, GAGE, NY-ESO-1, SSX2 Антигены, экспрессируемые у эмбрионов и в некоторых органах (гонадах) взрослых Дифференцировоч-ные Melan A/VART-1, тирозиназа, gp100, PSA, ANKRD30A/NY-BR-1, GF-AP, TG Нормальные дифференцировочные антигены Амплифицирован-ные HER-2/ neu, BIRC, циклины B1 и D1, Bcr / Abl Нормальные усиленно экспрессируемые антигены Продукты аномаль - ного процессинга MUC-1 — MUC-7 Нормальные антигены с чрез- мерным гликозилированием ОПУХОЛЬ-СПЕЦИФИЧНЫЕ АНТИГЕНЫ
Слайд 9
Для выявления опухолевых антигенов используют SEREX-технологию ( Serological expression cloning ). В качестве исходного материала используют библиотеки генов, экспрессируемых в опухолях или (чаще) в таких органах, как семенники (в них экспрессируются многие эмбриональные гены). Продукты генов, клонированных из таких библиотек, скринируют на взаимодействие с аутоантителами, присутствующими в сыворотке крови опухоленосителей. ОПУХОЛЬ-СПЕЦИФИЧНЫЕ АНТИГЕНЫ
Слайд 11
Иммунный ответ на аг опухоли Одна из современных концепций предлагает трехстадийную динамику иммунологических взаимоотношений между опухолью и организмом: удаление ( elimination ) – механизмы иммунологического отторжения чуждых по антигенному составу клеток; равновесие ( equilibrium ) – баланс между системой иммунного надзора и ростом опухоли; ускользание ( escape ) – прогрессирование опухоли, она выходит из под контроля иммунной системы. Она может быть обозначена как «концепция трех Е».
Слайд 12
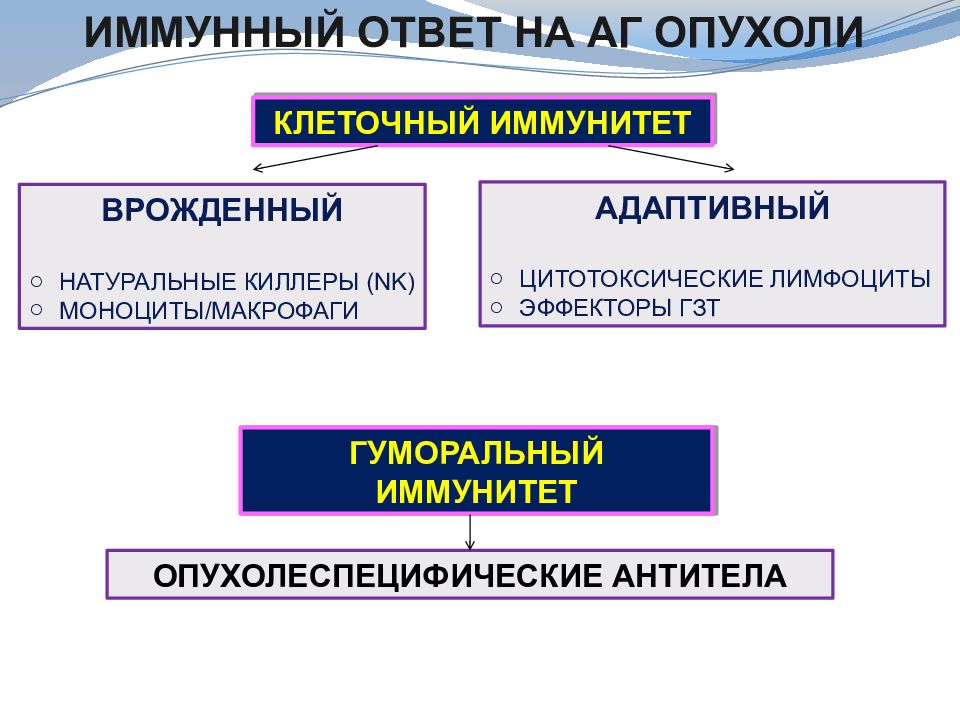
Иммунный ответ на аг опухоли КЛЕТОЧНЫЙ ИММУНИТЕТ ВРОЖДЕННЫЙ НАТУРАЛЬНЫЕ КИЛЛЕРЫ ( NK) МОНОЦИТЫ/МАКРОФАГИ АДАПТИВНЫЙ ЦИТОТОКСИЧЕСКИЕ ЛИМФОЦИТЫ ЭФФЕКТОРЫ ГЗТ ГУМОРАЛЬНЫЙ ИММУНИТЕТ ОПУХОЛЕСПЕЦИФИЧЕСКИЕ АНТИТЕЛА
Слайд 13
Иммунный ответ на аг опухоли Ключевую роль в иммунном повреждении опухолевых клеток играют: естественные киллеры (NK-клетки ) – распознают стрессорные молекулы MICA и MICB, экспрессируемые опухолевыми клетками, реагируют поликлонально без предварительной дифференцировки; цитотоксические Т-лимфоциты - образуются в результате иммунного ответа.
Слайд 14
Иммунный ответ на аг опухоли естественные киллеры (NK-клетки ) используют классический перфорин-гранзимовый механизм контактного цитолиза и Fas -зависимую индукцию апоптоза опухолевых клеток. Индукция апоптоза, опосредуется через взаимодействие молекулы TRAIL (TNF- related apoptosis induсing ligand ) с ее рецептором DR 5 ( Death domain 5). TRAIL спонтанно экспрессируется на NK-клетках, а под влиянием интерферонов I и II типов еще и на моноцитах и дендритных клетках. DR5 экспрессируется на опухолевых клетках. Контактное взаимодействие NK- клеток с опухолевой клеткой обеспечивает передачу летального сигнала.
Слайд 15
Иммунный ответ на аг опухоли (CD8+) цитотоксические Т-лим фоциты распознают опухолевые антигены, презентируемые ДК в составе молекул МНС-I; при этом активируются клетки ограниченного числа клонов, в соответствии со специфичностью их TCR. В активации CD8+ Т-клеток и экспансии их клонов принимают участие CD4+ Th1-клетки. Th1 инициируют «иммунное воспаление», которое сопровождается активацией макрофагов, продукты которых способствуют местным нарушениям кровотока и формированию тромбов. Это приводит к нарушению трофики и служит косвенной причиной гибели опухолевых клеток.
Слайд 16
Иммунный ответ на аг опухоли Показатель вовлечения Т-лимфоцитов в противоопухолевую защиту — инфильтрация опухоли лимфоидными клетками (TIL - Tumor-infiltrating lymphocytes ). Это преимущественно активированные CD8+ Т-клетки. Однако подавляющее большинство этих клеток функционально инертны, поскольку в них блокирована экспрессия цепей TCR-комплекса — обычно ζ-, реже ε-цепи. В окружении опухоли присутствуют активированные формы естественных киллеров — LAK-клеток, для которых характерна более высокая активность и более широкий спектр клеток-мишеней.
Слайд 17
Иммунный ответ на аг опухоли Противоопухолевые факторы IFNγ (его продуцируют NK- и Th1-клетки): подавляет пролиферацию опухолевых клеток; способствует развитию апоптоза опухолевых клеток; индуцирует выработку опухолевыми и стромальными клетками хемокинов CXCL9 (MIG) и CXCL10 (IP-10); подавляет ангиогенез, активирует макрофаги и индуцирует развитие Th1-клеток — Т-хелперов, необходимых для развития и усиления противоопухолевого иммунитета.
Слайд 18
Иммунный ответ на аг опухоли Гуморальные факторы не имеют протективного характера, в связи с: неэффективностью комплемента; слабым уровнем активации клеток врожденного иммунитета; отсутствием должного провоспалительного фона для развития эффективной защитной реакции.
Слайд 19
Под влиянием самых различных канцерогенных факторов, бластомные клетки возникают в организме достаточно часто. Если «иммунологический надзор» действует эффективно, то эти клетки уничтожаются иммунными силами организма, не успев размножиться до такой массы, чтобы превратиться в злокачественную опухоль. И лишь в случае «ускользания» опухолевых клеток из-под надзора иммунной системы, происходит возникновение уже не отдельных опухолевых клеток, а опухоли как целого. Иммунологический надзор и опухолевый рост
Слайд 20
Иммунологический надзор и опухолевый рост В каких же случаях может происходить «ускользание»? Когда иммунный ответ на опухолевый антиген может быть неэффективным?
Слайд 21
1. Потеря клетками злокачественной опухоли своих антигенов, упрощение антигенного состава – один из способов, благодаря которому клетки злокачественных опухолей успешно преодолевают иммунологический надзор организма. Благодаря делеции генов МНС I, клетки злокачественных опухолей лишаются белков этого комплекса на своей мембране и, следовательно, не могут быть обнаружены Т-киллерами. Кроме того, за счет активации в опухолевых клетках специфических ферментов – металлопротеаз, они способны сбрасывать свои антигены (« шеддинг » рецепторы) и, тем самым, становиться неузнаваемыми для иммунной системы организма. ОСОБЕННОСТИ ИммунологическОГО надзорА и опухолевОГО ростА
Слайд 22
ОСОБЕННОСТИ ИммунологическОГО надзорА и опухолевОГО ростА 2. Наблюдается феномен усиления - когда антитела блокируют рецепторы Т-киллеров и обволакивают опухолевые клетки, препятствуя выявлению их антигенов и «усиливая» таким образом опухоль - «эффект усиления опухолевого роста» ( enhancing effect ). Это приводит к защите опухолевой клетки от клеточных эффекторных факторов. Однако по отношению к свободным злокачественным клеткам (лейкозы, метастатические клетки) антитела обладают разрушающим действием.
Слайд 23
Семь возможных причин запаздывания или неэффективного иммунного ответа при злокачественных новообразованиях: Иммунологический надзор и опухолевый рост 1. Иммунная реактивность организма подавляется какими-то неспецифическими (то есть не онкогенными) факторами (хронические заболевания, СПИД, воздействие радиационного фактора и т.д.). 2. Циркулирующие в крови противоопухолевые антитела вызывают «феномен усиления» опухоли. 3. «Противоопухолевые» рецепторы Т-лимфоцитов блокируются опухолевыми антигенами, циркулирующими в крови, в результате чего эти лимфоциты не могут участвовать в процессе отторжения опухоли.
Слайд 24
4. Если опухолевые клетки, образовавшиеся в организме плода, не стали инициаторами канцерогенеза, то к их антигенам развивается явление иммунологической толерантност и и в постнатальном периоде при их новом возникновении эти антигены воспринимаются не как «чужие», а как «свои». Иммунологический надзор и опухолевый рост 5. Опухоли выделяют субстанции, обладающие выраженным иммуннодепрессантным действием (бесспорных доказательств этого явления пока не имеется). 6. Скорость роста опухоли опережает скорость развития иммунного ответа. 7. Дисбаланс взаимодействия иммунной системы и опухоли, который определяется генетически.
Слайд 25
НЕСОСТОЯТЕЛЬНОСТЬ ИММУНИТЕТА И ПРИЧИНЫ РОСТА ОПУХОЛИ Слабая иммуногенность опухолевых антигенов; Постоянная модификация антигенов; Селекция иммунологически устойчивых клеток; Потеря экспрессии антигенов системы HLA I класса; Выделение растворимых опухолевых антигенов; Экспрессия на поверхности опухолевых клеток рецепторов к различным ростовым факторам; Приобретение резистентности к апоптозу : потеря рецептора к ФНО, появление на мембране FacL ; Продукция опухолевыми клетками ИЛ 6, ИЛ 10, ФНО.
Слайд 26
ФАКТОРЫ, ПОДАВЛЯЮЩИЕ ИММУНИТЕТ Супрессивные вещества, продуцируемые лимфоцитами и макрофагами; Блокирующие антитела; Циркулирующие иммунные комплексы (ЦИК); Простагландины (ПГЕ 2); ИЛ 10; Трансформирующий фактор роста бетта ( TGF β ), подавляющий: Продукцию ИЛ 12 Созревание Т-киллеров Экспрессию рецепторов цитокинов
Слайд 27
ФАКТОРЫ, УСИЛИВАЮЩИЕ РОСТ ОПУХОЛИ Фактор некроза опухоли (ФНО), продуцируемый макрофагами; ИЛ 2, ИЛ 6; Гамма- интерферрон ( γ -ИФН); Фактор роста сосудистого эндотелия; Иммунодефицитное состояние: нарушение созревания Т-киллеров нарушение функции антигенпрезентирующих клеток
Слайд 28
Механизмы избегания опухолью иммунологического надзора 1. Иммунологическая толерантность - опухолевые клетки не экспрессируют ПАМП, что влияет на их иммуногенность. Презентирующие опухоль ДК слабо экспрессируют костимулирующие молекулы CD80 и CD86, секретируют мало ИЛ12 и могут вырабатывать ИЛ 10, что слабо активирует Т-клетки. В связи с этим в большинстве случаев к опухолевым антигенам развивается иммунологическая толерантность. Иммунный ответ может запуститься без влияния ПАМП, вероятно под действием кофакторов.
Слайд 29
Механизмы избегания опухолью иммунологического надзора 2. Опухолевые клетки несут на своей поверхности молекулы МНС- I и подвергаются цитотоксическому действия CD 8+ Т-клеток, распознающих классические молекулы МНС- I. NK -лимфоциты не могут лизировать такие клетки, т.к. их активность блокируется молекулами МНС- I. Если опухолевая клетка утратила все молекулы МНС, но экспрессирует стрессорные молекулы, она становится мишенью естественных киллеров. В этой ситуации цитотоксические Т-лимфоциты не могут распознать клетку, лишенную МНС- I. Если опухолевая клетка утратила классические молекулы МНС- I, но сохранила неклассические, она становится недоступной для действия киллеров – ни естественных (их реакция блокирована неклассическими МНС- I ), ни CD 8+ Т-клеточных (распознаваемый ими комплекс антигенного пептида с молекулой МНС- I отсутствует).
Слайд 30
Механизмы избегания опухолью иммунологического надзора 3. Опухолевый антиген, против которого направлены клеточные эффекторные механизмы, может исчезнуть с поверхности клетки в результате мутации или модуляции. 4. Опухолевые клетки секретируют растворимые формы антигенов, которые блокируют защитные факторы или подавляют гуморальный иммунный ответ.
Слайд 31
Механизмы избегания опухолью иммунологического надзора 5. Опухолевые клетки секретируют супрессорные цитокины (ИЛ 10, TGF β и простагландин Е), подавляющие иммунный ответ, особенно его воспалительную форму. Росту опухоли способствует выработка опухолевыми клетками ростовых факторов: Эпидермального Тромбоцитарного Фибробластного Сосудистого. Результатом действия опухолевых клеток, является блокада экспрессии цепей рецепторного комплекса, что сопровождается утратой функциональной активности туморинфильтрирующих лимфоцитов (Т IL ).
Слайд 32
Механизмы избегания опухолью иммунологического надзора 6. При росте опухоли активируются регуляторные Т-клетки: естественные, индуцированные (в частности Th3), секретирующие TGFβ и IL-10, а также регуляторные Т-клетки фенотипа CD4+ CD25hi FOXP3+. Регуляторные Т-клетки сосредотачиваются в окружении опухоли и в региональных лимфатических узлах, напрямую контактируют с ДК и ослабляют иммунный ответ, действуя на эффекторные Т-лимфоциты (как CD8+, так и CD4+).
Слайд 33
Пути активизации противоопухолевой защиты Два основных направления : усиление иммуногенности опухолей; усиление эффекторных механизмов противоопухолевого иммунитета. Усиление результативности эффекторных механизмов, как правило, связано с введением в организм больного эффекторных продуктов или факторов, способствующих их образованию.
Слайд 34: МЕХАНИЗМЫ МЕТАСТАЗИРОВАНИЯ
Существуют три пути метастазирования опухолевых клеток: гематогенный - по кровеносным сосудам; лимфогенный - по лимфатическим сосудам; тканевой - непосредственно от одной соприкасающейся ткани к другой или по межтканевым пространствам. Наиболее часто метастазирование происходит лимфогенным путем, причем в регионарных лимфатических узлах метастазы могут оказаться вскоре после возникновения “материнской” опухоли.
Слайд 35
Иммунодиагностика опухолевого роста Идеальным опухолевым маркером является маркер: выделяемый только из опухолевой ткани, специфичный для данного типа опухоли, определяемый при малом количестве опухолевых клеток, имеющий непосредственное отношение к массе опухолевых клеток, презентирующий у всех больных с данной опухолью. Однако, ни один из опухолевых маркеров не имеет всех необходимых характеристик, обеспечивающих достаточную специфичность или чувствительность для использования в ранней диагностике или в программах массового скрининга рака.
Слайд 36
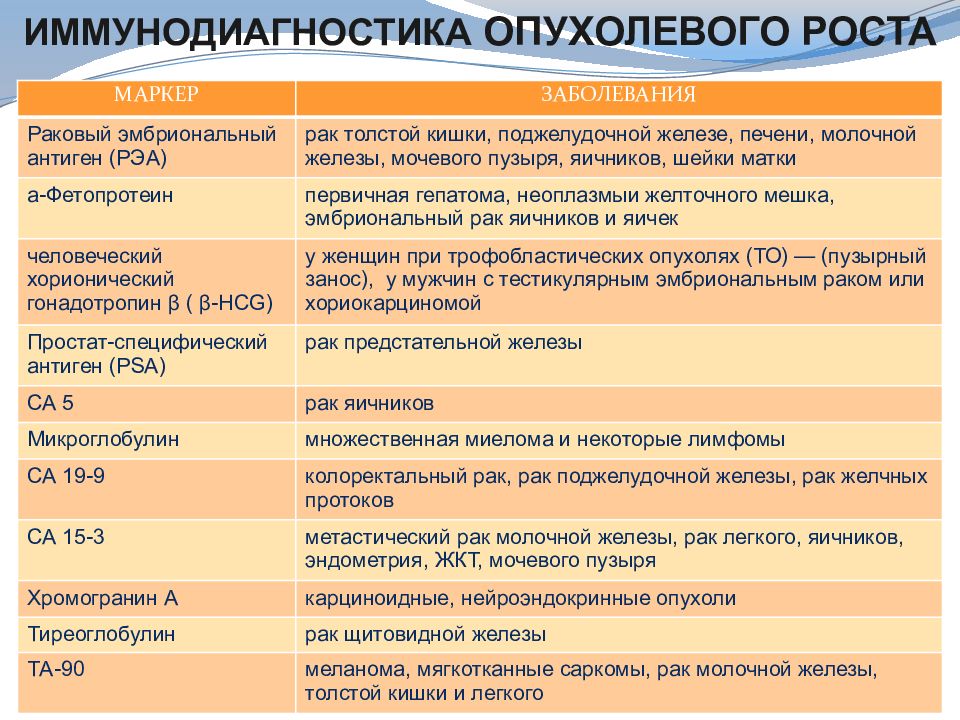
Иммунодиагностика опухолевого роста МАРКЕР ЗАБОЛЕВАНИЯ Раковый эмбриональный антиген (РЭА) рак толстой кишки, поджелудочной железе, печени, молочной железы, мочевого пузыря, яичников, шейки матки а- Фетопротеин первичная гепатома, неоплазмыи желточного мешка, эмбриональный рак яичников и яичек человеческий хорионический гонадотропин β ( β -HCG) у женщин при трофобластических опухолях (ТО) — (пузырный занос), у мужчин с тестикулярным эмбриональным раком или хориокарциномой Простат-специфический антиген (PSA) рак предстательной железы СА 5 рак яичников Микроглобулин множественная миелома и некоторые лимфомы СА 19-9 колоректальный рак, рак поджелудочной железы, рак желчных протоков СА 15-3 метастический рак молочной железы, рак легкого, яичников, эндометрия, ЖКТ, мочевого пузыря Хромогранин А карциноидные, нейроэндокринные опухоли Тиреоглобулин рак щитовидной железы ТА-90 меланома, мягкотканные саркомы, рак молочной железы, толстой кишки и легкого
Слайд 37: Иммунологические маркеры опухолей
РАЗРАБОТАН «Атлас патологии человека» ( Human Pathology Atlas ). Исследованы 17 основных типов рака Проведен анализ экспрессии генов и белков опухолевых клеток в сравнении с нормальными клетками и выживаемостью пациентов. Обнаружено, что гены, участвующие в репликации ДНК, делении клеток и запрограммированной клеточной гибели, как правило, экспрессировались на более высоких уровнях в раковых клетках, чем в неопухолевых клетках. Иммунологические маркеры опухолей
Слайд 38
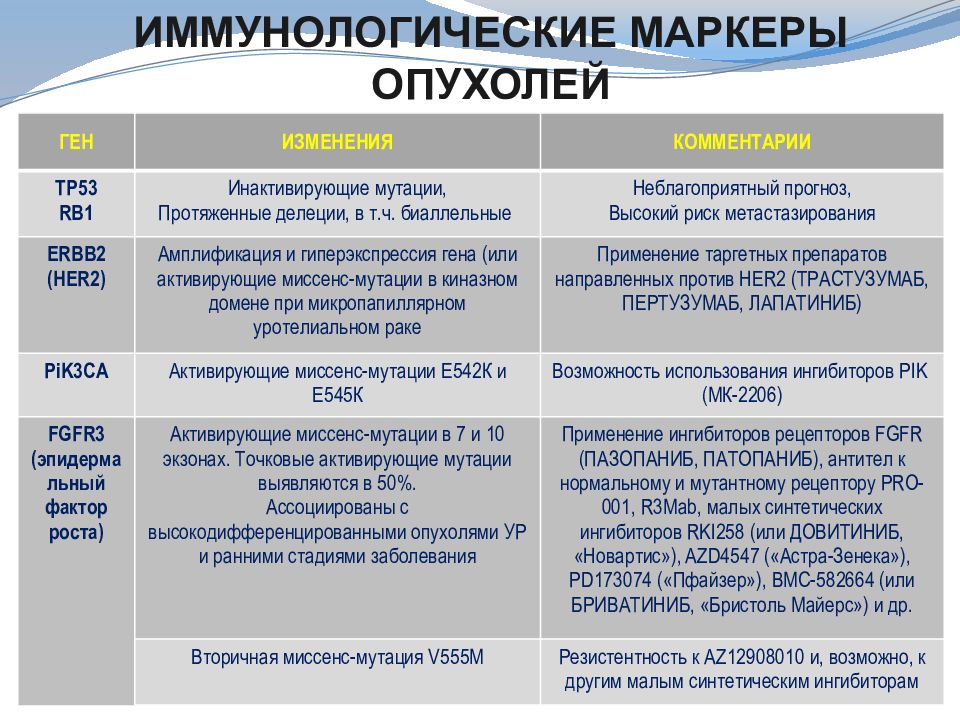
ГЕН ИЗМЕНЕНИЯ КОММЕНТАРИИ TP53 RB1 Инактивирующие мутации, Протяженные делеции, в т.ч. биаллельные Неблагоприятный прогноз, Высокий риск метастазирования ERBB2 ( HER2 ) Амплификация и гиперэкспрессия гена (или активирующие миссенс-мутации в киназном домене при микропапиллярном уротелиальном раке Применение таргетных препаратов направленных против HER 2 (ТРАСТУЗУМАБ, ПЕРТУЗУМАБ, ЛАПАТИНИБ) PiK3CA Активирующие миссенс-мутации Е542К и Е545К Возможность использования ингибиторов PIK (МК-2206) FGFR3 ( эпидермальный фактор роста) Активирующие миссенс-мутации в 7 и 10 экзонах. Точковые активирующие мутации выявляются в 50%. Ассоциированы с высокодифференцированными опухолями УР и ранними стадиями заболевания Применение ингибиторов рецепторов FGFR (ПАЗОПАНИБ, ПАТОПАНИБ), антител к нормальному и мутантному рецептору PRO-001, R3Mab, малых синтетических ингибиторов RKI258 (или ДОВИТИНИБ, « Новартис »), AZD4547 ( «Астра- Зенека »), PD 173074 (« Пфайзер »), ВМС-582664 (или БРИВАТИНИБ, «Бристоль Майерс») и др. Вторичная миссенс-мутация V555M Резистентность к AZ12908010 и, возможно, к другим малым синтетическим ингибиторам Иммунологические маркеры опухолей
Слайд 39
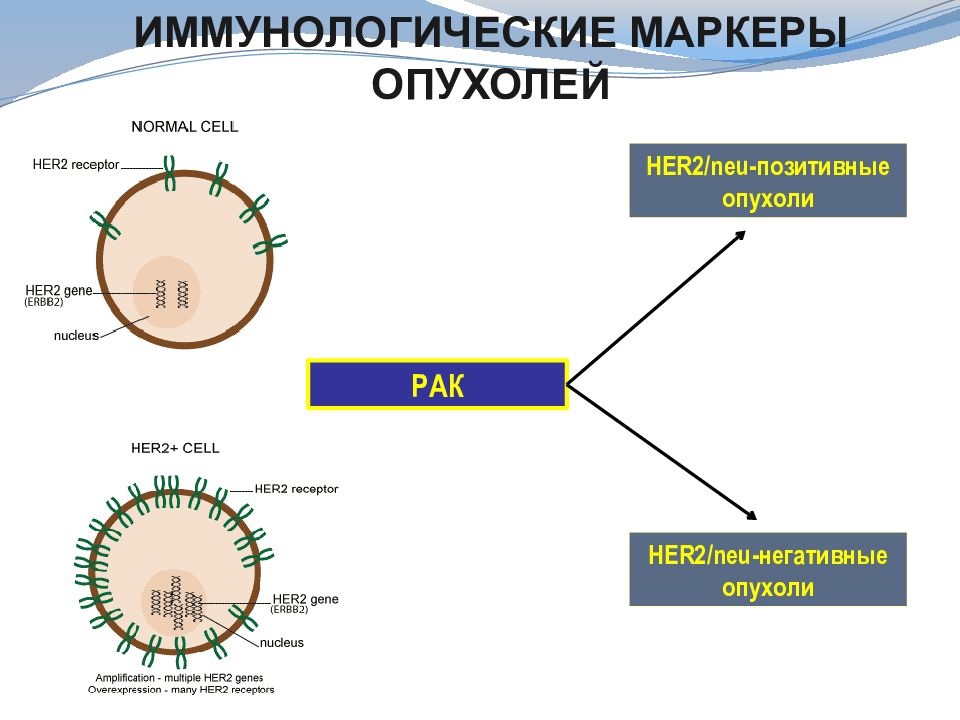
Иммунологические маркеры опухолей РАК HER2/ neu -позитивные опухоли HER2/ neu -негативные опухоли
Слайд 40
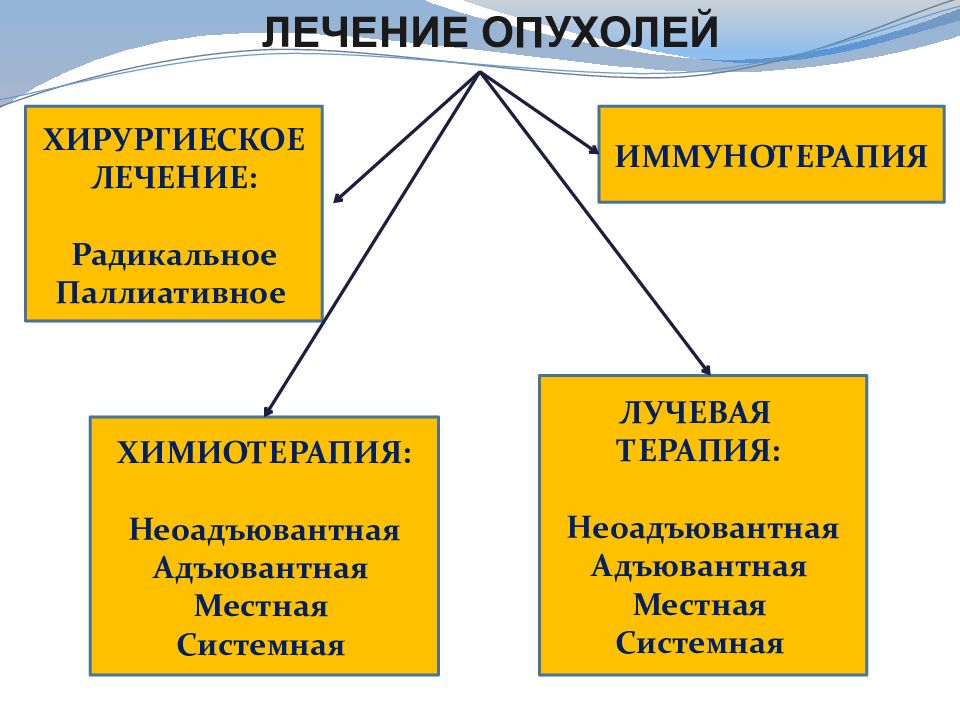
ЛЕЧЕНИЕ опухолей ХИРУРГИЕСКОЕ ЛЕЧЕНИЕ: Радикальное Паллиативное ХИМИОТЕРАПИЯ: Неоадъювантная Адъювантная Местная Системная ИММУНОТЕРАПИЯ ЛУЧЕВАЯ ТЕРАПИЯ: Неоадъювантная Адъювантная Местная Системная
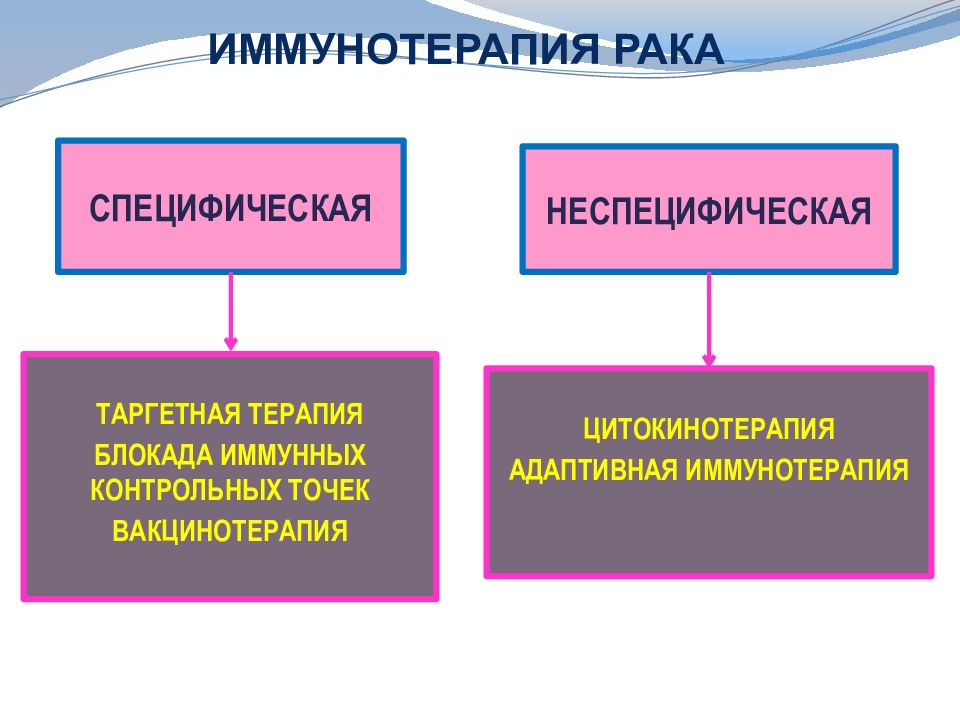
Слайд 41: ИММУНОТЕРАПИЯ РАКА
СПЕЦИФИЧЕСКАЯ НЕСПЕЦИФИЧЕСКАЯ ТАРГЕТНАЯ ТЕРАПИЯ БЛОКАДА ИММУННЫХ КОНТРОЛЬНЫХ ТОЧЕК ВАКЦИНОТЕРАПИЯ ЦИТОКИНОТЕРАПИЯ АДАПТИВНАЯ ИММУНОТЕРАПИЯ
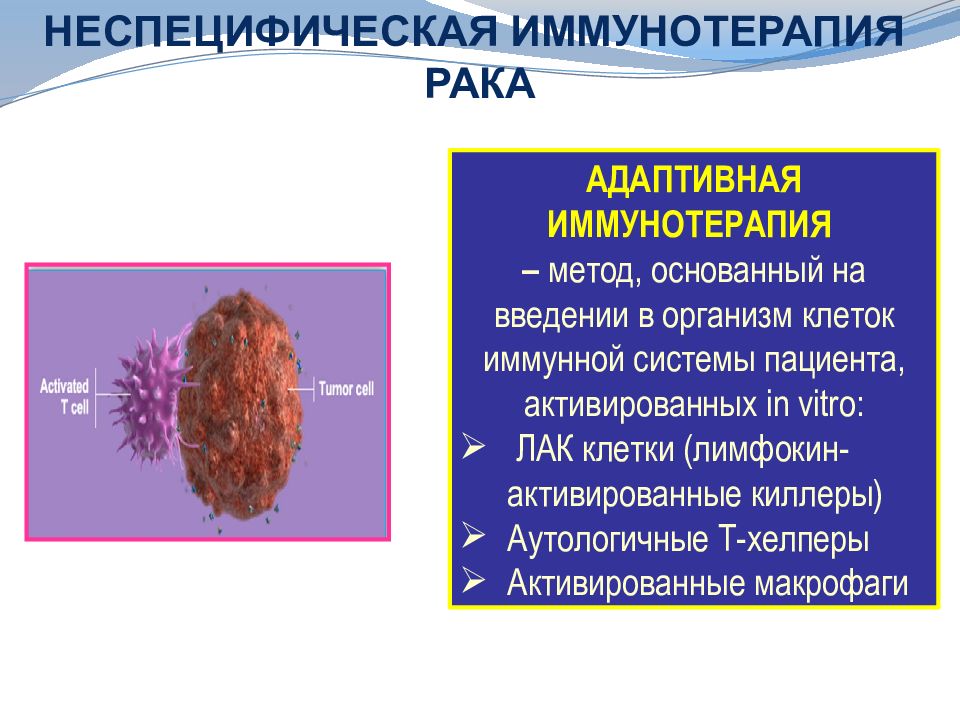
Слайд 42: НЕСПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ РАКА
АДАПТИВНАЯ ИММУНОТЕРАПИЯ – метод, основанный на введении в организм клеток иммунной системы пациента, aктивированных in vitro : ЛАК клетки ( лимфокин - активированные киллеры) Аутологичные Т-хелперы Активированные макрофаги НЕСПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ РАКА
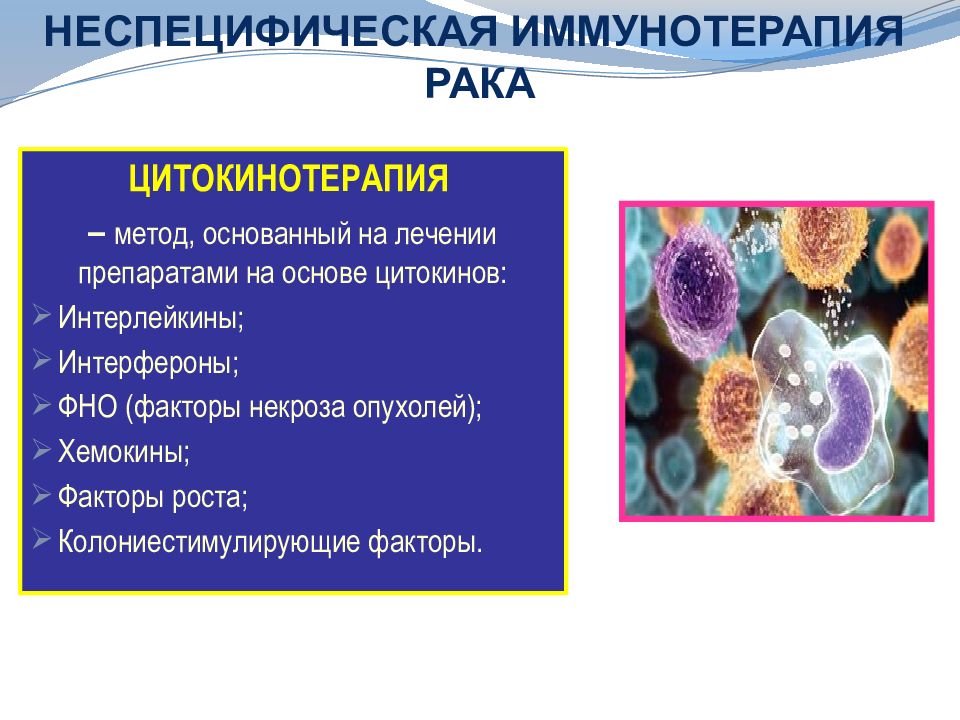
Слайд 43: НЕСПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ РАКА
ЦИТОКИНОТЕРАПИЯ – метод, основанный на лечении препаратами на основе цитокинов: Интерлейкины ; Интерфероны; ФНО (факторы некроза опухолей ); Хемокины ; Факторы роста; Колониестимулирующие факторы. НЕСПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ РАКА
Слайд 44: ТАРГЕТНАЯ ТЕРАПИЯ
МИШЕНЬ ПРЕПАРАТ МЕХАНИЗМ ДЕЙСТВИЯ EGFR ( эпидермальный фактор роста) ГЕФИТИНИБ ЭРЛОТИНИБ селективные ингибиторы тирозинкиназы рецепторов эпидермального фактора роста. ЦЕТУКСИМАБ моноклональные антитела к рецепторам эпидермального фактора роста. Предотвращение сигнальной трансдукции VEGF (фактор роста эндотелия сосудов) АФЛИБЕРЦЕПТ БЕВАЦИЗУМАБ Связывание и инактивация VEGF. Блокирует активацию рецепторов VEGF и пролиферацию эндотелиальных клеток ПАЗОПАНИБ СУНИТИНИБ Инигибитор различных тирозинкиназ : рецептора фактора роста тромбоцитов α и β, фактора роста фибробластов-1 и -3, рецептора цитокина ( Kit), рецептора ИЛ-2, индуцируемого киназой Т-клеток ( Itk ), лейкоцитспецифической протеинтирозинкиназы ( Lck ) erbB2 ( HER2 ) ТРАСТУЗУМАБ рекомбинантное гуманизированное моноклональное антитело IgG1. Ингибитор HER2, активация иммунного ответа. Топоизомераза I ИРИНОТЕКАН Специфический ингибитор топоизомеразы. Препятствует репликации. Гистон деацетилаза ВОРИНОСТАТ Ингибитор гистондиацетилазы, с накоплением ацетилированных белков, включая гистоны, что вызывает транскрипционную активацию генов- супрессоров опухолей 26 S протеосома БОРТЕЗОМИБ протеасомный ингибитор. Вызывает торможение протеолиза, нарушение нормального клеточного гомеостаза. EGFR/ erbB2 ЛАПАТИНИБ селективный ингибитор внутриклеточной тирозинкиназы, связывающийся с рецептором эпидермального фактора роста
Слайд 45: БЛОКАДА ИНГИБИТОРОВ ИММУННОГО ОТВЕТА
АНТИ СТ LA-4 (цитотоксический лимфоцитассоциированный антиген) - ИПИЛИМУМАБ АНТИ PD-1 (рецептор программируемой смерти) - НИВОЛУМАБ, ПЕМБРОЛИЗУМАБ АНТИ PD-L1 ( лиганд рецептора программируемой смерти) - АВЕЛУМАБ, АТЕЗОЛИЗУМАБ
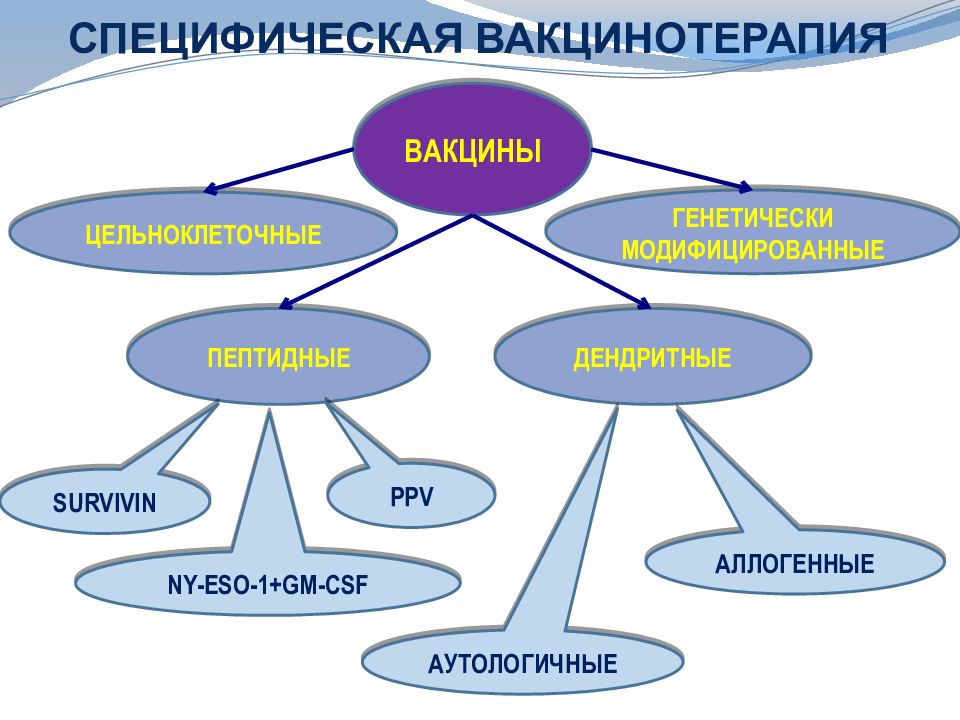
Слайд 46: СПЕЦИФИЧЕСКАЯ ВАКЦИНОТЕРАПИЯ
ЦЕЛЬНОКЛЕТОЧНЫЕ ПЕПТИДНЫЕ ДЕНДРИТНЫЕ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ SURVIVIN NY-ESO-1+GM-CSF PPV АУТОЛОГИЧНЫЕ АЛЛОГЕННЫЕ ВАКЦИНЫ
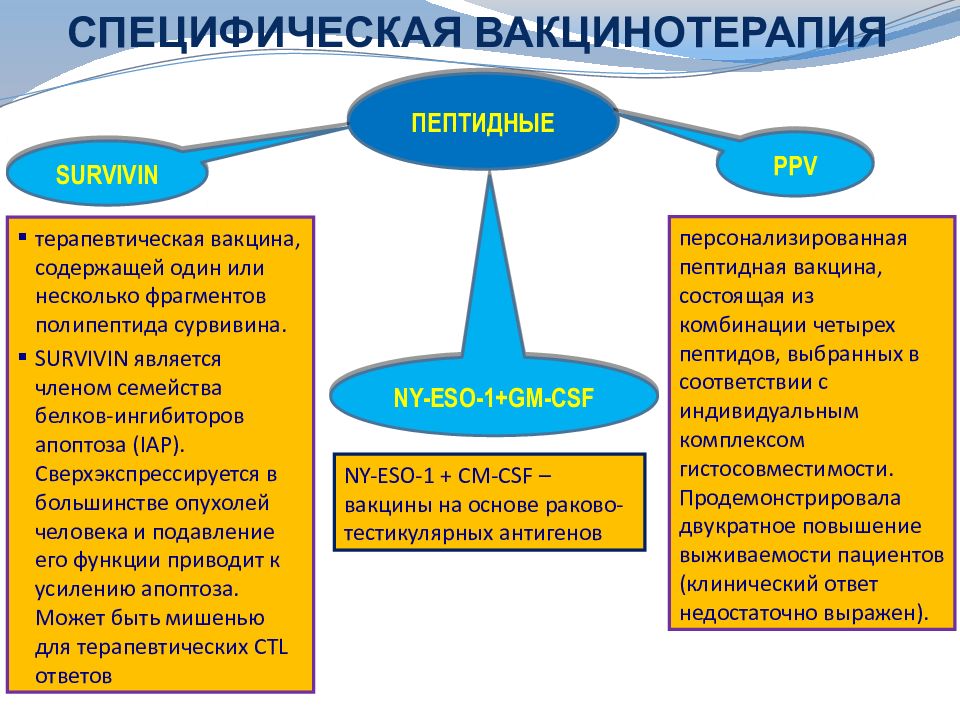
Слайд 47: СПЕЦИФИЧЕСКАЯ ВАКЦИНОТЕРАПИЯ
ПЕПТИДНЫЕ SURVIVIN NY-ESO-1+GM-CSF PPV персонализированная пептидная вакцина, состоящая из комбинации четырех пептидов, выбранных в соответствии с индивидуальным комплексом гистосовместимости. Продемонстрировала двукратное повышение выживаемости пациентов (клинический ответ недостаточно выражен). терапевтическая вакцина, содержащей один или несколько фрагментов полипептида сурвивина. SURVIVIN является членом семейства белков-ингибиторов апоптоза (IAP). Сверхэкспрессируется в большинстве опухолей человека и подавление его функции приводит к усилению апоптоза. Может быть мишенью для терапевтических CTL ответов NY-ESO-1 + CM-CSF – вакцины на основе раково-тестикулярных антигенов
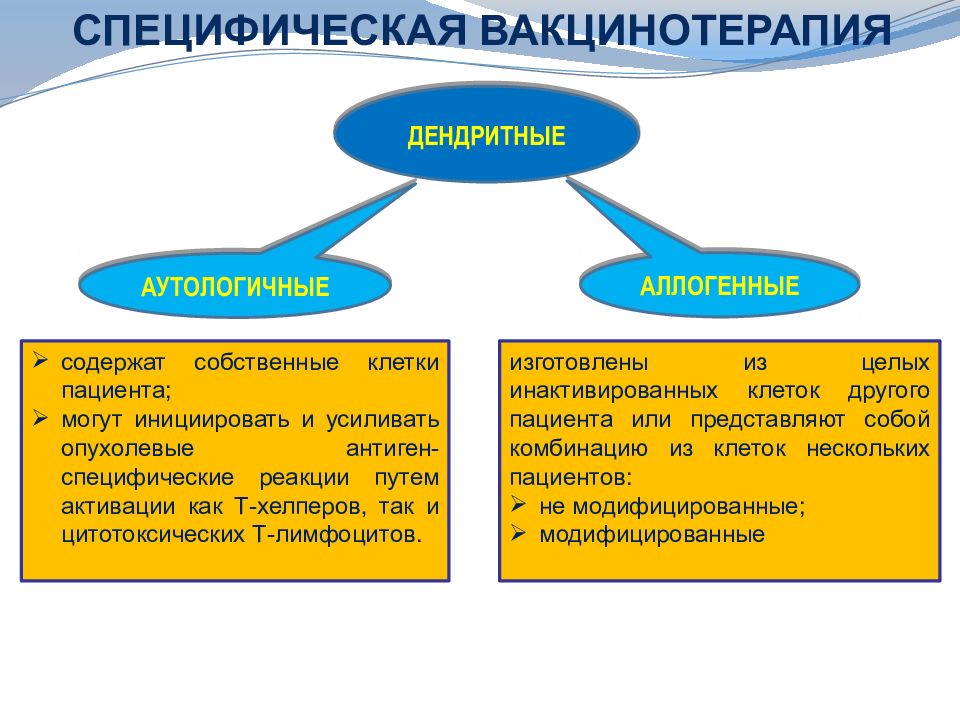
Последний слайд презентации: Противоопухолевый иммунитет: иммунодиагностика и иммунотерапия опухолей: СПЕЦИФИЧЕСКАЯ ВАКЦИНОТЕРАПИЯ
ДЕНДРИТНЫЕ АУТОЛОГИЧНЫЕ АЛЛОГЕННЫЕ содержат собственные клетки пациента; могут инициировать и усиливать опухолевые антиген-специфические реакции путем активации как Т-хелперов, так и цитотоксических Т-лимфоцитов. изготовлены из целых инактивированных клеток другого пациента или представляют собой комбинацию из клеток нескольких пациентов: не модифицированные; модифицированные