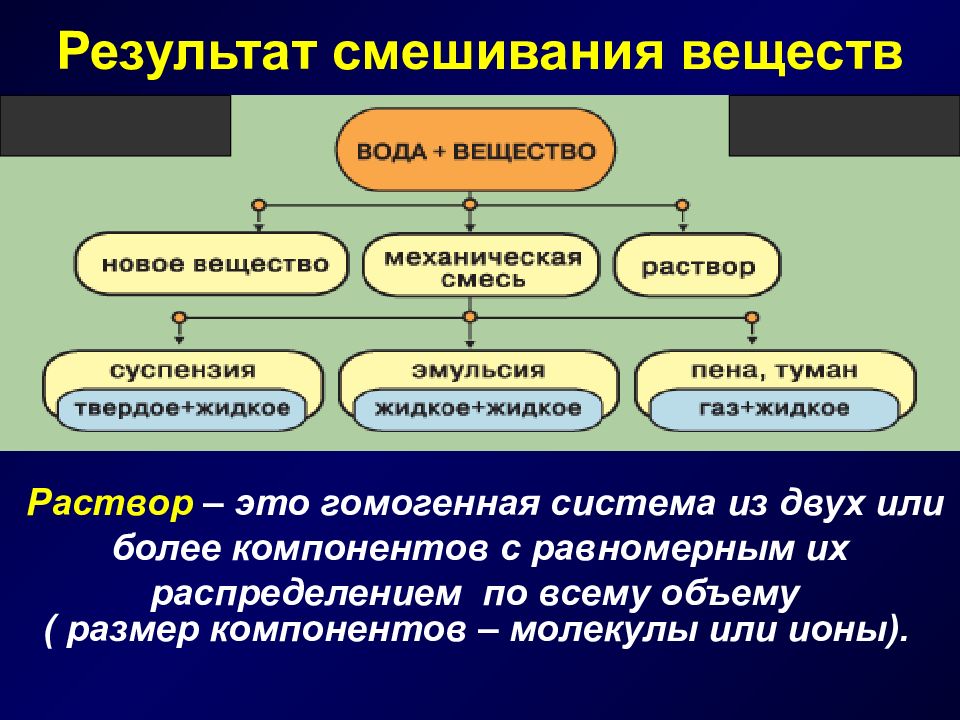
Слайд 2: Результат смешивания веществ
Раствор – это гомогенная система из двух или более компонентов с равномерным их распределением по всему объему ( размер компонентов – молекулы или ионы).
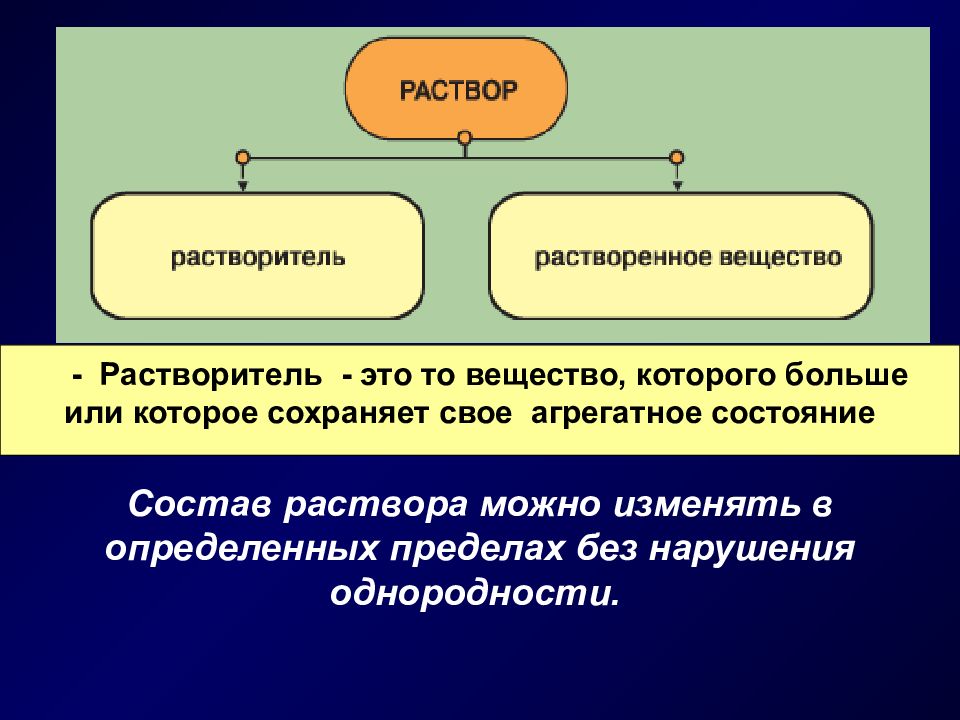
Слайд 3
Состав раствора можно изменять в определенных пределах без нарушения однородности. - Растворитель - это то вещество, которого больше или которое сохраняет свое агрегатное состояние
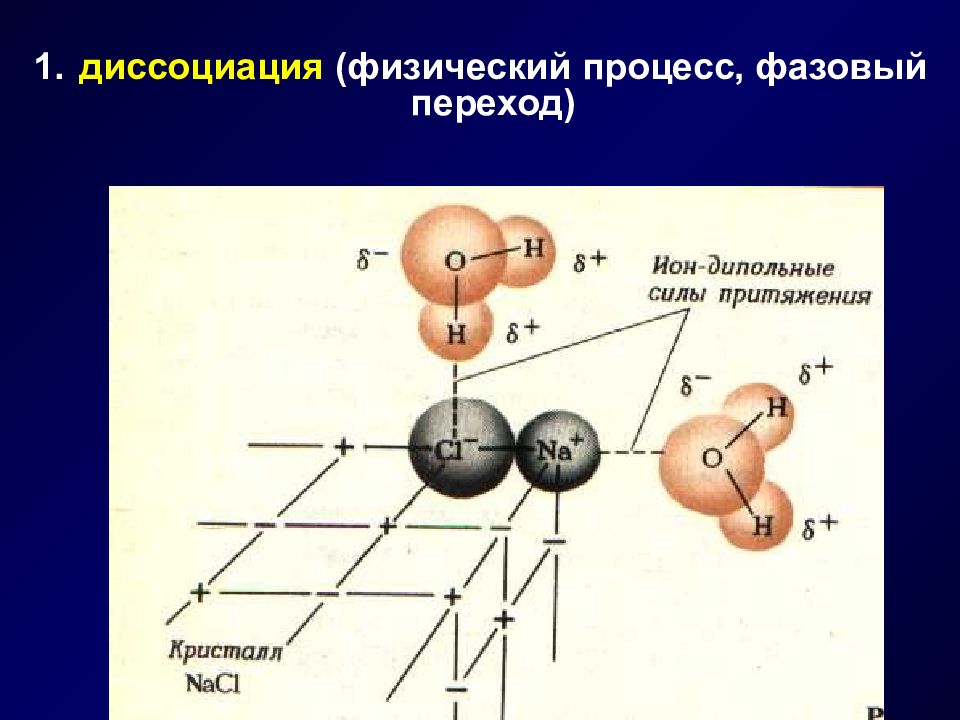
Слайд 4: Механизм растворения
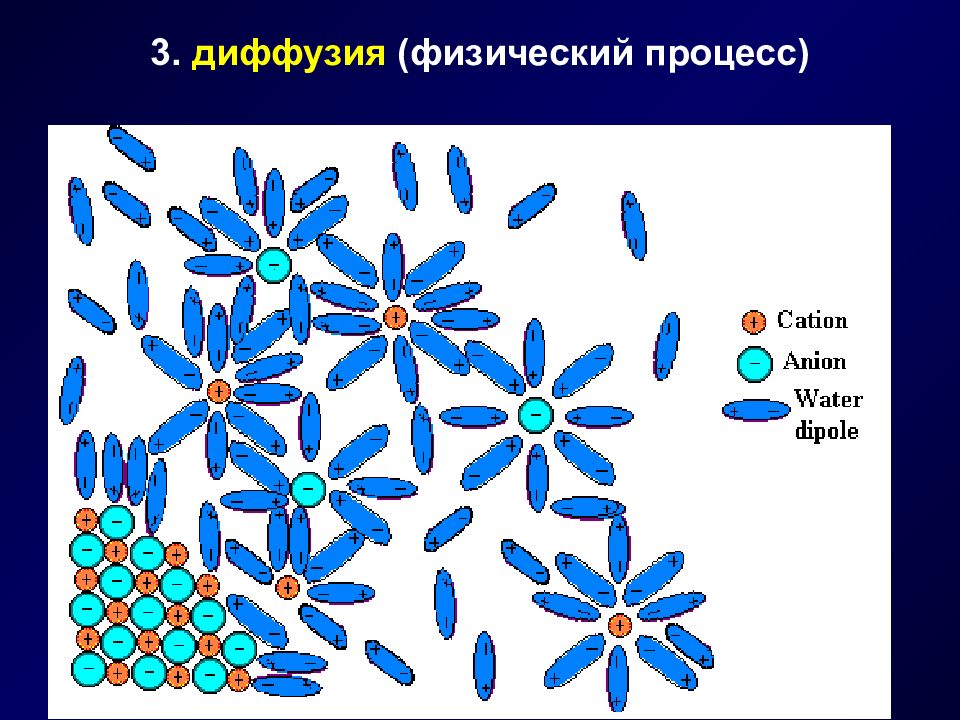
Растворение - это физико-химический процесс, состоящий из стадий : диссоциация сольватация диффузия
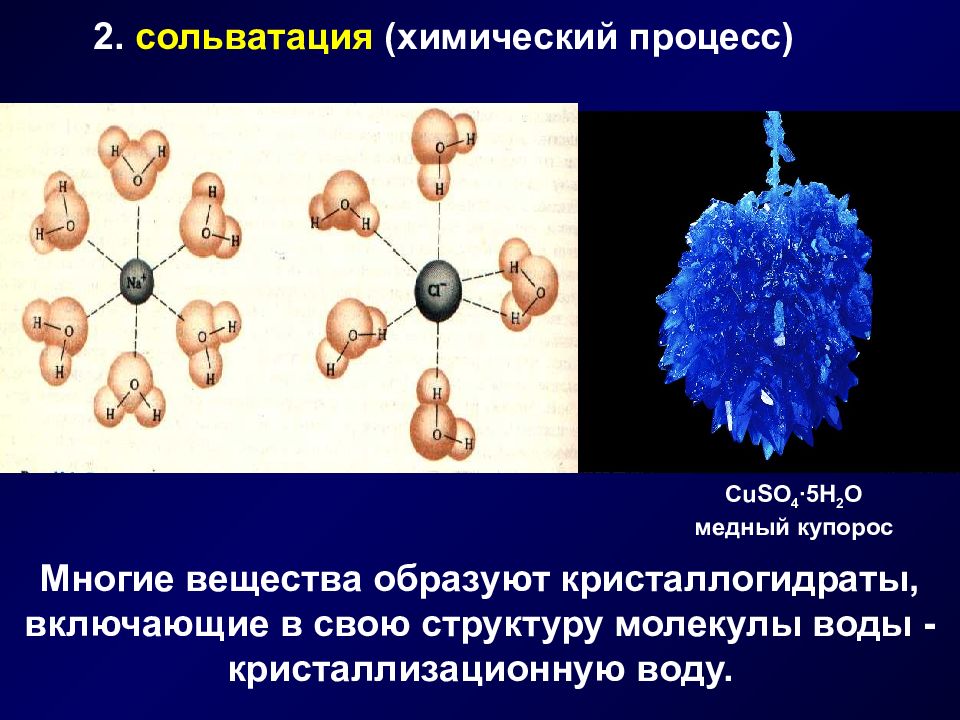
Слайд 6
2. сольватация (химический процесс) CuSO 4 ∙5H 2 O медный купорос Многие вещества образуют кристаллогидраты, включающие в свою структуру молекулы воды - кристаллизационную воду.
Слайд 8: Признаки образования раствора
- изменение температуры раствора - изменение объема раствора - изменение цвета раствора
Слайд 10
Концентрация – это содержание растворенного вещества ( в-ва ) в единице массы или объема раствора ( р-ра ) или растворителя ( р-ля ). в-во + р-ль = р-р Способы выражения концентрации растворов
Слайд 11
Массовые концентрации раствора 1) массовая доля вещества 2) мольная доля вещества 3) моляльная концентрация [%] [ отн. ед. ] моль кг
Слайд 12
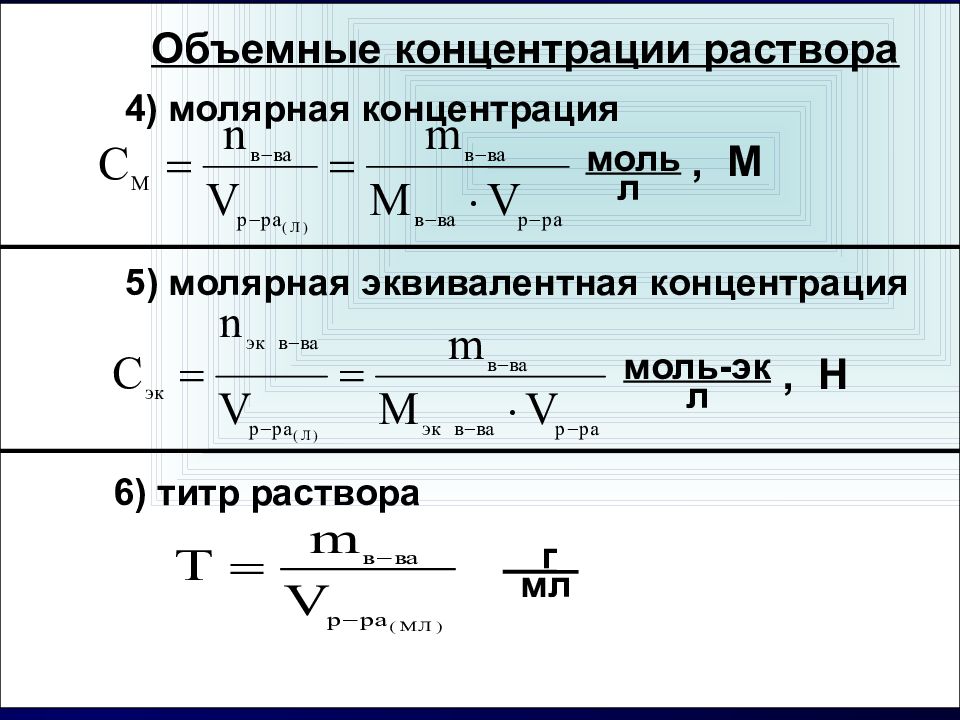
Объемные концентрации раствора 4) молярная концентрация 5) молярная эквивалентная концентрация 6) титр раствора моль л , М моль-эк л , Н г мл
Слайд 13
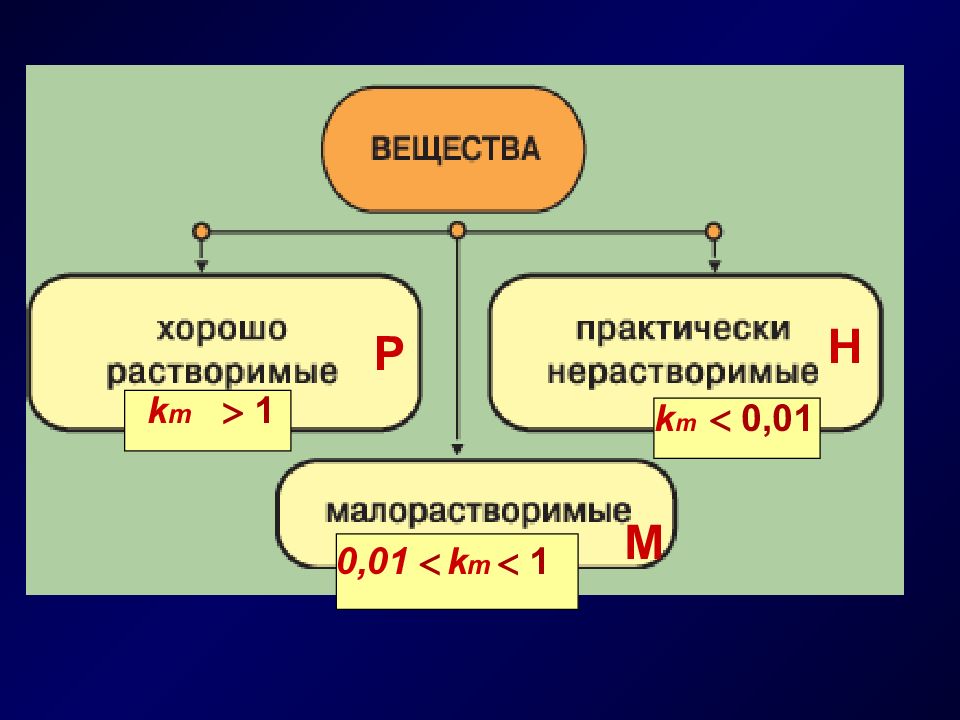
- массовый коэффициент растворимости (тв. в-ва) г 100 г Н 2 О Растворимость ( s ) - это свойство вещества растворяться в том или ином растворителе максимально (до насыщения). Насыщенные растворы - объемный коэффициент растворимости (газы) - коэффициент адсорбции (газы) мл 100 г Н 2 О л 1 л Н 2 О
Слайд 14
Растворимость веществ зависит : - от температуры : S = k ·Т (для Т и Ж ), S = k ·1/Т (для газов) - от давления : S = k · P i - от примесей : примеси уменьшают раствор-сть от природы вещества и растворителя : подобное растворяется в подобном KMnO 4 хорошо растворяется в воде, а растительное масло – не растворяется в воде.
Слайд 16
Произведение растворимости « ПР» (для малорастворимых или практически нерастворимых) ПР - это безразмерная постоянная величина, равная произведению молярных концентраций ионов « С М » (на которые распадается дан. в-во), возведенных в степени, равные числу ионов в формуле вещества.