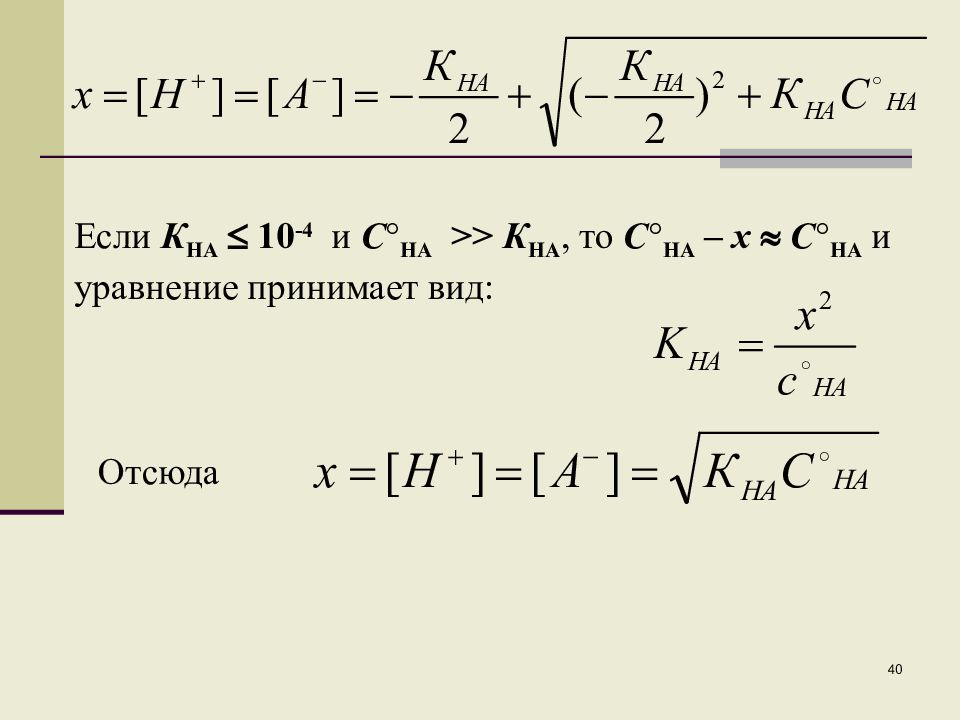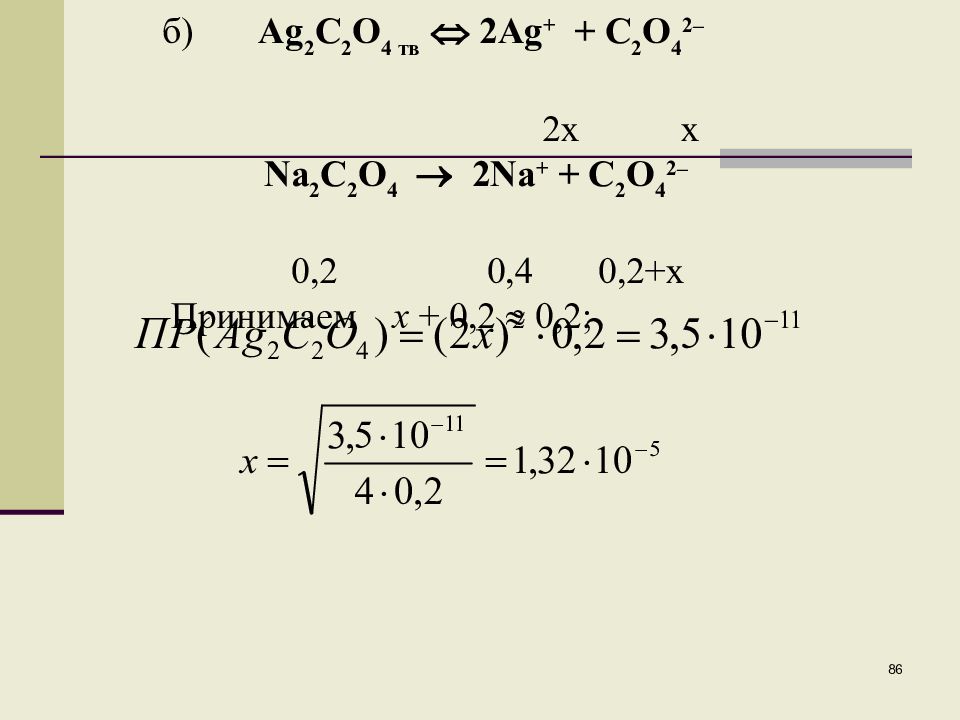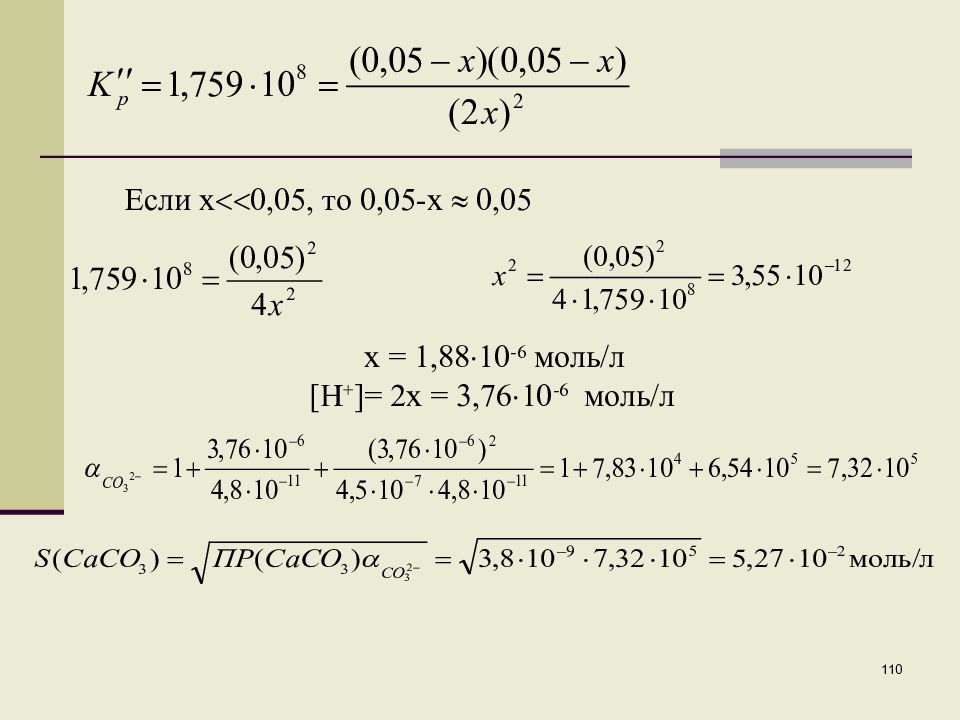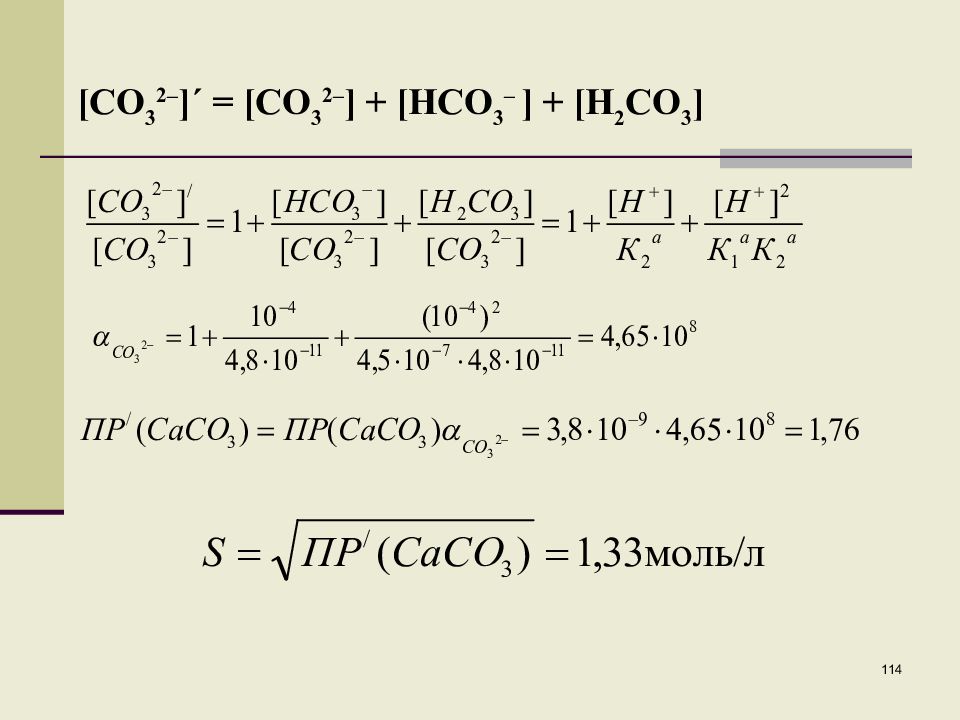Первый слайд презентации: Аналитическая химия (качественный анализ) курс лекций
Горболетова Г.Г., Березина Н.М., Базанов М.И. ФГБОУ ВПО «Ивановский государственный химико-технологический университет» Кафедра аналитической химии
Слайд 4
Аналитическая химия - наука о методах определения химического состава вещества и его структуры. Основные разделы аналитической химии: Качественный анализ; Количественный анализ; Физико-химические методы анализа. Предметом аналитической химии являются разработка методов анализа и их практическое выполнение, а также широкое исследование теоретических основ аналитических методов. 4
Слайд 5
5 Качественный анализ позволяет установить из каких элементов или ионов состоит вещество. Количественный анализ служит для определения содержания отдельных компонентов в пробе в граммах, % и т.д. Для современных физико-химических методов характерно использование оптических, электрохимических и других измерительных приборов. Многие практические аналитические приемы известны с глубокой древности. Они применялись для определения чистоты (пробы) драгоценных металлов – золота и серебра и выполнялись без растворения пробы. Основы современного качественного анализа путем проведения реакций в растворе разработал Роберт Бойль в середине XVII века.
Слайд 6
Аналитическая (или качественная) реакция — это химическая реакция, с помощью которой обнаруживают (открывают или идентифицируют) тот или иной ион в растворе. Следовательно, такая реакция должна сопровождаться каким-либо внешним, видимым эффектом: 1. Образование малорастворимых соединений ; 2. Изменение окраски раствора ; 3. Образование и выделением газов. 6
Слайд 7
7 Наименьшее содержание определяемого компонента (С х ), при котором его можно обнаружить данным методом с заданной доверительной вероятностью (Р), называют пределом обнаружения. Пусть предел обнаружения равен 10 -4 г при доверительной вероятности Р= 0,95. Это означает, что при содержании 10 -4 г определяемого компонента в анализируемой пробе в 95 опытах из 100 получают правильный результат, т.е. обнаруживают искомый компонент. Если С х > 10 -4 г, то вероятность обнаружения становится выше. Если содержание вещества в пробе меньше предела обнаружения, то его нельзя обнаружить данным методом.
Слайд 8
Аналитическая реакция тем чувствительнее, чем ниже предел обнаружения. Предел обнаружения зависит от: - концентрации реагентов ; - присутствия посторонних ионов ; - электролитов или мешающих веществ, среды ; - температуры растворов. 8
Слайд 9
Классификация аналитических реакций: 1. Специфические реакции – это реакции, которые позволяют обнаруживать данный ион в присутствии других ионов. Например, реакция обнаружения иона аммония NH 4 + действием щелочи при нагревании: NH 4 + + OH - NH 3 + H 2 O 2. Селективные или избирательные реакции дают сходный эффект с ограниченным числом ионов. Например, рубеановодородная кислота: Cu 2+ + H 2 ( SCNH ) 2 Cu ( SCN Н) 2 + 2 H + темно-зеленое или черное пятно Co 2+ + H 2 ( SCNH ) 2 Co ( SCN Н) 2 + 2 H + бурое окрашивание Ni 2+ + H 2 ( SCNH ) 2 Ni ( SCN Н) 2 + 2 H + синее или фиолетовое окрашивание 9
Слайд 10
10 3. Реакции с использованием групповых реагентов – реактивов, дающих одинаковую реакцию с большой группой ионов. Например, ионы щелочно-земельных металлов – Са 2+, Sr 2+, Ва 2+ - образуют осадки белого цвета с серной кислотой - CaSO 4, SrSO 4, BaSO 4.
Слайд 11
11 Техника выполнения аналитических реакций По технике выполнения анализа все реакции обнаружения можно разделить на три группы : пробирочные, капельные и микрокристаллоскопические. 1) Пробирочные реакции выполняются путем смешивания анализируемого раствора с реагентами в пробирке. При этом объемы растворов обычно составляют 1-3 капли. Приливать растворы в пробирку следует пипеткой (вакуумным капилляром), не касаясь стенок пробирки во избежание возможных загрязнений реактива. Растворы необходимо перемешивать стеклянной палочкой.
Слайд 12
12 2) Капельные реакции выполняются на маленьком листочке фильтровальной бумаги, имеющем треугольную форму. На кусочек бумаги наносят каплю исследуемого раствора. Затем рядом с нанесенной каплей, на расстоянии 1-1,5мм наносят каплю реактива. В месте перекрывания двух капель наблюдают окраску образующегося соединения и делают соответствующий вывод.
Слайд 13
13 3) Микрокристаллоскопические реакции (мкс) выполняются на предметном стекле, которое должно быть тщательно вымыто, ополоснуто дистиллированной водой и насухо вытерто фильтровальной бумагой. Из капилляра-пипетки выдавливают небольшую каплю исследуемого раствора. Рядом с ней на расстоянии 2-3 мм помещают такую же каплю реагента. Затем с помощью чистой стеклянной палочки соединяют обе капли и помещают стекло на предметный столик микроскопа так, чтобы место слияния капель оказалось под объективом. Отмечают форму и цвет кристаллов, поскольку именно это служит основанием для заключения о присутствии или отсутствии иона.
Слайд 14
14 Условия выполнения аналитических реакций Четкий и однозначный результат анализа может быть получен только при соблюдении строго обозначенных условий проведения реакции. 1. Кислотность раствора. Многие реакции требуют определенной среды раствора, выражаемой значением рН. Ca 2+ + C 2 O 4 2- CaC 2 O 4 - осадок белого цвета. В кислой среде осадок не образуется: C 2 O 4 2- + H + Н C 2 O 4- Ag + + Cl - AgCl - в кислой среде осадок белого цвета. В щелочной среде: AgOH → AgO.
Слайд 15
15 Проверить среду или значение рН можно с помощью индикаторных бумаг. Лакмусовая индикаторная бумага бывает красной и синей. При нанесении капли испытуемого раствора на красную лакмусовую бумагу она окрашивается в синий цвет, если среда раствора щелочная, и остается красной в кислой среде. Синий лакмус, наоборот, краснеет в кислой среде.
Слайд 16
Более подробную информацию дает бумага, пропитанная универсальным индикатором (УИ). При смачивании ее анализируемым раствором она окрашивается в разные цвета, которые обозначены на шкале стандартов, прилагаемой к упаковке универсального индикатора. Сравнивая цвет пятна на бумаге со шкалой, можно определить не только среду раствора, но и примерное значение рН в пределах от 1 до 12. Сравнение со стандартной шкалой УИ необходимо проводить сразу, иначе цвет пятна со временем может измениться. 16
Слайд 17
17 2) Температура раствора. Многие реакции идут при нагревании, о чем обязательно говорится в руководстве. Нагревания требуют все реакции растворения осадков, часто - окислительно-восстановительные реакции, реакции с выделением газов и другие. Pb 2+ + 2 Cl - PbCl 2 осадок белого цвета, растворяется в горячей воде. Нагревание проводят в пробирках, помещаемых в водяную баню, при перемешивании.
Слайд 18
18 3) Количество добавляемого реагента. В отношении количества реактивов надо строго придерживаться прописи. Hg 2+ + 2 I - HgI 2 осадок красного цвета, растворяется в избытке KI. HgI 2 + 2 I - HgI 4 2- - бесцветный раствор. Нужно прибавлять разбавленный раствор KJ по каплям.
Слайд 19
Аналитическая классификация катионов В настоящее время существуют пять методов классификации ионов. Это сероводородный, аммиачно-фосфатный, дифталатный, тиоацетамидный и кислотно-основной методы. Сероводородный метод основан на различной растворимости сульфидов, хлоридов и карбонатов. В дифталатном методе для разделения групп ионов используют дифталат калия с гидроксидом калия или натрия. Тиоацетамидный метод основан на применении в качестве группового реагента тиоацетамида, хлороводородной кислоты и карбоната аммония. В кислотно-основном методе основными реагентами являются кислоты HCl и H 2 SO 4, гидроксиды калия и натрия и водный раствор аммиака.
Слайд 21
Достоинства кислотно-основной классификации: 1) Использует основные свойства элементов – отношение к кислотам и щелочам, способность к комплексообразованию, амфотерность гидроксидов. 2) Аналитические группы в этой классификации ближе совпадают с группами периодической системы. 3) Метод более экспрессный по сравнению с сероводородным и менее токсичный. 21
Слайд 22
Основные типы реакций в растворе 1. Кислотно-основного взаимодействия ; 2. Осаждения и растворения малорастворимых соединений ; 3. Комплексообразования ; 4. Окисления-восстановления. 22
Слайд 23: Реакции кислотно-основного взаимодействия
Содержание понятий «кислота» и «основание» существенно менялось в процессе развития химической науки. По теории Аррениуса кислотами назывались вещества, которые диссоциировали в воде с образованием ионов водорода Н +, а основаниями – вещества, которые диссоциировали с образованием ионов OH ˉ. Однако, классическая теория кислот и о c нований не могла объяснить ряд явлений, происходящих в водных и неводных растворителях. Например, в бензольных растворах HCl не было обнаружено ионов водорода, но металлы в этом растворе растворялись с образованием газообразного водорода, кислотно-основные индикаторы изменяли свой цвет. В водных растворах соли слабых кислот ( Na 2 CO 3, KCN, Na 3 PO 4 и т.д.) проявляли свойства оснований, а кислые соли многоосновных кислот ( Na 2 Н PO 4, KHSO 4 и т.д.) выступали как кислоты.
Слайд 24
Протолитическая теория Бренстеда-Лоури, разработанная в 1923 году, дает более общие представления о кислотах и основаниях по сравнению с классической теорией электролитической диссоциации Аррениуса. Согласно протолитической теории кислот и оснований Бренстеда-Лоури к кислотам относятся вещества, способные отдавать протон; к основаниям – вещества, способные принимать протон. По этой теории кислотами являются, например, HCl, HNO 3, NH 4 +, НСN, а основаниями – ОНˉ, СО 3 2-, РО 4 3-, SCNˉ. Реакции кислотно-основного взаимодействия – это реакции обратимого переноса протона от кислоты к основанию.
Слайд 25
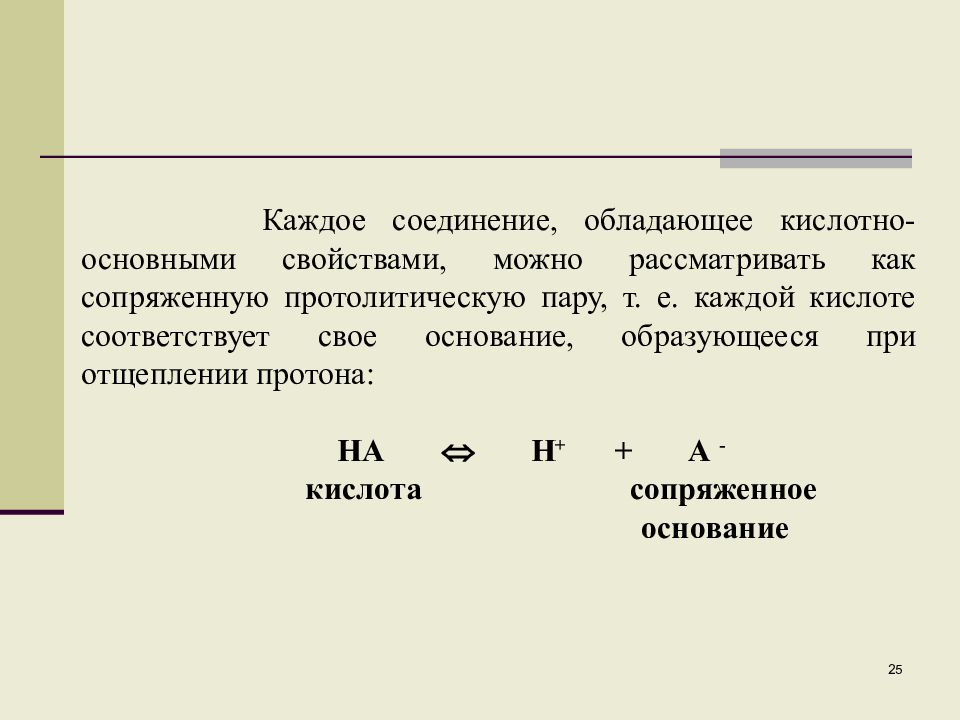
Каждое соединение, обладающее кислотно-основными свойствами, можно рассматривать как сопряженную протолитическую пару, т. е. каждой кислоте соответствует свое основание, образующееся при отщеплении протона: НА Н + + А - кислота сопряженное основание 25
Слайд 26
Тогда реакцию кислотно-основного взаимодействия в общем виде можно представить так: НА + В НВ + + А - кислота основание сопряженная сопряженное кислота основание Например : НCl + OH - Н 2 O + Cl - кислота основание сопряженная сопряженное кислота основание Соединения, которые могут как присоединять, так и отдавать протон, т.е. являются одновременно и кислотами, и основаниями, называются амфолитами. Например, H 2 O, HCO 3 -, Н 2 РО 4 -, НРО 4 2- и т.п.
Слайд 27
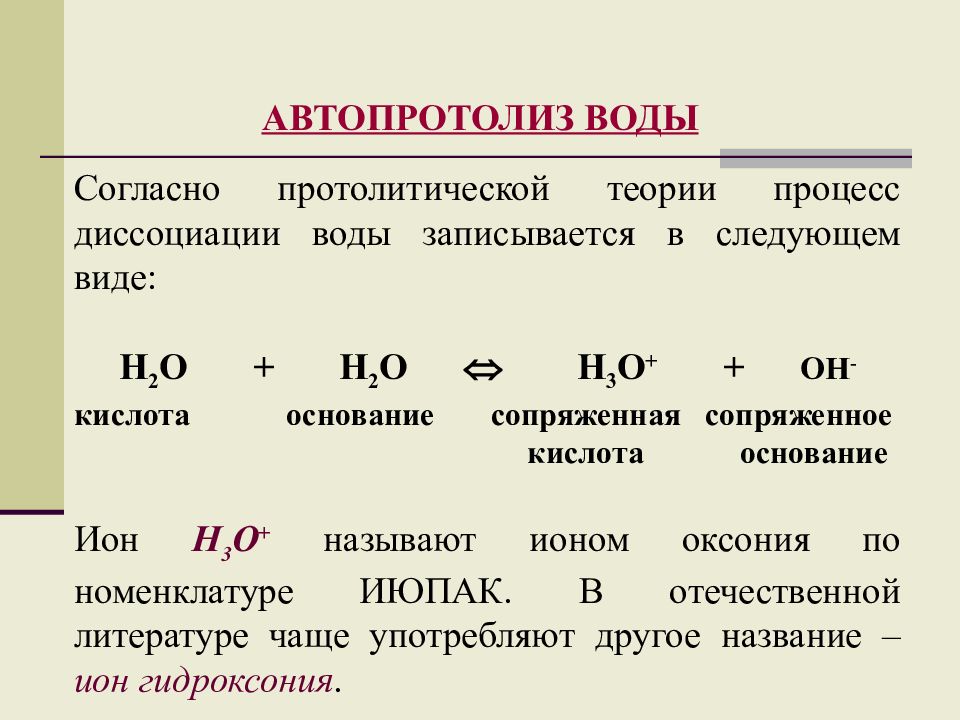
АВТОПРОТОЛИЗ ВОДЫ Согласно протолитической теории процесс диссоциации воды записывается в следующем виде: Н 2 О + Н 2 О Н 3 О + + ОН - кислота основание сопряженная сопряженное кислота основание Ион Н 3 О + называют ионом оксония по номенклатуре ИЮПАК. В отечественной литературе чаще употребляют другое название – ион гидроксония.
Слайд 28
Обозначив ион гидроксония через Н +, записываем схему диссоциации воды упрощенно: Н 2 О Н + + ОН - Константа этого равновесия может быть записана как г де а - активность участников реакции. Поскольку активность воды при данной температуре постоянна, то произведение также будет постоянным. Его называют ионным произведением воды и обозначают символом К w.
Слайд 29
где - коэффициент активности. При температуре 298,15 К значение К w =1,0 10 -14. В разбавленных растворах коэффициенты активности близки к единице, следовательно, можно записать: В химически чистой воде: 29
Слайд 30
Используя понятия показателя константы автопротолиза воды ( рК=-lgK w ), водородного ( рН=-lg[H + ] ) и гидроксидного ( рН=-lg[OH - ] ) показателей, можно записать: pК w = рН + рОН = 14,0 В нейтральной среде рН = рОН = 7,0 В кислой среде рН 7 рОН 7 В щелочной среде рН 7 рОН 7 Процесс диссоциации воды эндотермичен (ΔН w = 56,070 кДж/моль), поэтому с ростом температуры К w увеличивается.
Слайд 31
СИЛЬНЫЕ КИСЛОТЫ И ОСНОВАНИЯ Сильные кислоты и основания при всех концентрациях в растворе диссоциированы практически нацело. К сильным кислотам относятся все галогеноводородные кислоты за исключением HF, хлорная (HClO 4 ), азотная (HNO 3 ) кислоты, серная кислота (H 2 SO 4 ) по первой ступени диссоциации и др. В растворах сильных кислот происходит полная ионизация кислоты по схеме: НА + H 2 O Н 3 O + + А - 31
Слайд 32
Следовательно, концентрация ионов водорода в таких растворах равна концентрации кислоты (в единицах молярности). [H + ]=C НА ; pH=-lg C НА ; pOH=14-(-lg C НА ). Например, в 0,1 М растворе HCl концентрация ионов водорода равна 0,1 моль/л и рН=1,0. 32
Слайд 33
Сильными основаниями являются водные растворы гидроксидов щелочных и щелочно-земельных металлов (КОН, NaOH, Ba ( OH ) 2 и др.). В растворах сильных оснований концентрация гидроксид-ионов вследствие полной ионизации основания в воде равна его общей концентрации. [OH - ]=C B ; pOH=-lg C B ; pH=14-(-lg C B ). Например, в 0,1 М растворе NaOH концентрация ОН - -ионов равна 0,1 моль/л и р O Н=1,0; рН=13,0. 33
Слайд 34
Пример 1. Вычислить [H + ], [OH - ] и рН 0,05 М раствора HNO 3. HNO 3 H + + NO 3 - [H + ]= C (HNO 3 ) =0,05 моль / л ; pH=-lg 0,05 = 1,30; 34
Слайд 35
Пример 2. Вычислить [H + ], [OH - ], рОН и рН 0,003 М раствора КОН. КОН О H ˉ + К + [О H ˉ]= C ( КОН)=0,003 моль/л; p О H =- lg 0,003 = 2,52; рН = - lg 3,33∙10 -12 = 11,48.
Слайд 36
СЛАБЫЕ КИСЛОТЫ И ОСНОВАНИЯ Слабые кислоты и основания диссоциированы в водном растворе неполностью. В водном растворе слабой кислоты существует равновесие: НА + Н 2 О Н 3 О + + А – или упрощенно НА Н + + А -, которое характеризуется термодинамической константой диссоциации : где а – активность участников реакции; - коэффициенты активности; К НА – концентрационная константа кислотной диссоциации.
Слайд 37
В разбавленных растворах коэффициенты активности близки к единице. Для приближенных расчетов принимаем К НА К НА. 37
Правила расчета ионных равновесий
Слайд 39
Т.к. для слабой кислоты К НА 1, обозначаем за х равновесные концентрации продуктов диссоциации: [Н+] = х ; [А–] = х. Равновесная концентрация недиссоциированных молекул кислоты равна: [НА] = С НА – [Н + ] = С НА – х. Подставляем х и С НА – х в выражение для константы диссоциации: и решаем квадратное уравнение относительно х : х 2 + К НА х – К НА С НА = 0;
Слайд 40
Если К НА 10 -4 и С НА >> К НА, то С НА – х С НА и уравнение принимает вид: Отсюда 40
Слайд 41
Процесс диссоциации кислоты характеризуется степенью диссоциации, представляющей собой отношение концентрации диссоциированных молекул кислоты к исходной концентрации кислоты: 41
Слайд 42
Равновесие в растворе слабого основания B + Н 2 О BН + + OH – характеризуется константой основной диссоциации : Обозначаем равновесные концентрации частиц в уравнении: [Н B + ] = х ; [OH – ] = х ; [B] = С B – х и подставляем в выражение для константы диссоциации: Отсюда:
Слайд 43
Если К b B 10 -4 и С B >> К b B, Концентрация ионов водорода будет равна: Например, муравьиная кислота (К а НСООН =1,8 10 –4 ) сильнее, чем уксусная ( 43
Слайд 44
Пример 1. Вычислить концентрацию [Н + ], рН и степень диссоциации 0,1 М раствора уксусной кислоты. СН 3 СООН СН 3 СОО – + Н + 0,1 – х х х Так как К а НА 10 -4, х << 0,1 моль/л, можно принять, что 0,1 – х 0,1. Тогда: рН =- lg [ H + ] = - lg 1,33 10 -3 = 2,88
Слайд 45
Пример 2. Вычислить концентрацию ОН - и рН 0,1 М раствора аммиака. NH 3 + H 2 O NH 4 + + OH - 0,1 – х х х Так как К b (NH 3 ) 10 -4, х << 0,1 моль/л, то 0,1– х 0,1. рН =-lg[H + ] = -lg 7,52 10 -12 = 11,12.
Слайд 46
Пример 3. Вычислить [СH 3 COO - ] и рН 0,1 М раствора уксусной кислоты в присутствии 0,1 М раствора НCl. В растворе смеси сильной и слабой кислот существуют следующие равновесия: СН 3 СООН СН 3 СОО – + Н + 0,1 – х х х HCl Сl – + Н + 0,1 0,1 0,1 Суммарная равновесная концентрация ионов Н + в смеси двух кислот равна х + 0,1.
Слайд 47
Учитывая, что x 0,1, можно упростить уравнение. x = [СН 3 СОО – ] = 1,74 10 -5 моль/л. [H + ] = C°(НСl) = 0,1 моль/л; pH=-lg 0,1 = 1.
Слайд 48
Выводы: 1) Концентрация ацетат-ионов в присутствии сильной кислоты резко уменьшилась (в 100 раз). Следовательно, рН является мощным регулятором концентрации аниона слабой кислоты. 2) Концентрация ионов водорода в смеси сильной и слабой кислот практически полностью определяется концентрацией сильной кислоты. 48
Слайд 49: МНОГООСНОВНЫЕ СЛАБЫЕ КИСЛОТЫ
Многоосновные слабые кислоты диссоциируют в несколько ступеней, каждая из которых характеризуется константой ступенчатой диссоциации: Н 2 А Н + + HА С 0 Н 2 А – х х х НА- Н + + А 2- x - y x + y y где x, y – концентрация ионов водорода при диссоциации кислоты по I и II ступеням диссоциации соответственно.
Слайд 50
Если первая константа диссоциации значительно больше второй, то (x + y) x, (x – y) x; Концентрация ионов водорода в растворе многоосновной кислоты, ступенчатые константы диссоциации которой различаются на четыре и более порядка, определяется диссоциацией кислоты по первой ступени. [Н + ] = 50
Слайд 51
Пример 1. Вычислить концентрацию ионов Н +, Н 2 P O 4-, Н P O 4 2-, P O 4 3- в 0,1М растворе Н 3 P O 4. Диссоциация фосфорной кислоты происходит по трем ступеням: по первой ступени Н 3 P O 4 Н + + Н 2 P O 4 - X x по второй ступени Н 2 P O 4 - Н + + Н P O 4 2- 51
Слайд 52
по третьей ступени Н P O 4 2- Н + + P O 4 3- Поскольку К а 1 > 10 -4 решаем квадратное уравнение: х 2 + 7,6 10 –3 х – 7,6 10 –4 = 0
Слайд 53
Концентрация аниона, образующегося в результате диссоциации фосфорной кислоты по второй ступени, численно равна К а 2. [Н P O 4 2- ] = К а 2 = 6,2 10 –8 моль/л. Подставляя рассчитанные значения [Н + ] и [Н P O 4 2- ] в уравнение диссоциации Н 3 P O 4 по третьей ступени, находим концентрацию иона P O 4 3- :
Слайд 54: СОЛИ СЛАБЫХ КИСЛОТ И ОСНОВАНИЙ
Для сопряженного основания: А - + HOH HА + OH - Чем больше константа кислотной диссоциации кислоты, тем слабее сопряженное с ней основание. C опряженное с муравьиной кислотой основание – формиат-ион НСОО – слабее основания – ацетат-иона СН 3 СОО – 54
Слайд 55
Для сопряженной кислоты: BH + + HOH B + Н 3 O + где [Н + ]=[ H 3 O + ]. Чем больше константа основной диссоциации основания, тем слабее сопряженная с ним кислота. C опряженная с аммиаком кислота – аммоний-катион NH 4 + ( ) слабее кислоты – иона С 2 Н 5 NH 3 + 55
Слайд 56
Пример 1. Вычислить рН и степень основной диссоциации ацетат-иона в 0,1 М СН 3 СООNa. СН 3 СОО – + Н 2 О = СН 3 СООН + ОН – 0,1 – х х х Так как << 10 -4 : рОН = -lg 7,58 10 –6 = 5,12 и рН = 8,88. Степень основной диссоциации иона СН 3 СОО – :
Слайд 57
Пример 2. Вычислить рН 0,01 М раствора СH 3 CH 2 NH 3 С l. СН 3 СН 2 NH 3 + + Н 2 О = СН 3 СН 2 NH 2 + Н 3 О + 0,01-x x x рН = 6,34. 57
Слайд 58: АМФОЛИТЫ
К амфолитам относятся вещества, которые в растворе могут быть как донорами, так и акцепторами протонов. К ним относятся Н 2 О, НСО 3 –, НС 2 О 4 –, Н 2 РО 4 – и др. Например, ион НСО 3 – может как отдавать, так и принимать протоны: НСО 3 – Н + + СО 3 2- (1) 58
Слайд 59
НСО 3– + Н 2 О Н 2 СО 3 + ОН – (2) Гидроксил-ионы, выделяющиеся в процессе (2), взаимодействуют с ионами водорода, образующимися по схеме (1): Н + + ОН - Н 2 О K w = [Н + ][ O Н - ] 59
Слайд 60
По уравнению (1) [Н + ]=[СО 3 2- ], по уравнению (2) [ОНˉ]=[Н 2 СО 3 ], следовательно, равновесная концентрация ионов водорода равна: [Н + ]=[СО 3 2- ]– [Н 2 СО 3 ] (3) Выразим концентрацию ионов СО 3 2- и Н 2 СО 3 из уравнений констант равновесий процессов (1) и (2):
Слайд 62
Если К а 1 << [НСО 3 – ] (концентрация этого иона известна по условию), то величиной К а 1 в знаменателе можно пренебречь. Тогда рН раствора NaHCO 3 равен: Для Na 2 HРO 4 соответственно:
Слайд 63: БУФЕРНЫЕ РАСТВОРЫ
63 Растворы, содержащие либо слабую кислоту и ее соль, либо слабое основание и его соль, называются буферными. Сущность буферного действия заключается в том, что один из компонентов буферной системы может связывать ионы водорода, а другой - гидроксил-ионы в молекулы слабой кислоты, слабого основания и воды.
Слайд 64
64 CH 3 COO – + Н + CH 3 COOH CH 3 COOH + ОН – CH 3 COO – + Н 2 О NH 3 + H + NH 4 + NH 4 + + ОН - NH 3 + Н 2 О Буферные системы характеризуются двумя параметрами: значением создаваемого рН и буферной емкостью. Ацетатный буфер (СН 3 СООН + СН 3 СООNa) ; Аммонийный буфер (NH 4 OH + NH 4 Cl).
Слайд 65
1. Рассчитаем рН ацетатного буферного раствора: CH 3 COOH CH 3 COO – + Н + С к -x х х CH 3 COONa CH 3 COO – + Na + С c С c С c где С к – концентрация кислоты; С с – концентрация соли. Поскольку х << С к и х << C с, С с + х С с, а С к - х С к, тогда
Слайд 66
66 2. Рассчитаем рН аммонийного буферного раствора: NH 3 + HOН NH 4 + + OH С осн - x x x NH 4 Cl NH 4 + + Cl – С с С с С с
Слайд 67
67 Способность буферного раствора поддерживать постоянное значение рН определяется его буферной емкостью. Буферная емкость характеризуется количеством вещества (моль) сильной кислоты или сильного основания, которое требуется ввести в 1 л буферного раствора, чтобы изменить его рН на единицу. Математически буферная емкость равна производной: где d x – концентрация сильной кислоты или сильного основания, введенных в буферную смесь.
Слайд 68
dC x – концентрация введенной сильной кислоты или сильного основания, равная изменению концентрации соответствующего компонента буферного раствора. Учитывая равновесия, возникающие в кислотном буферном растворе при введении в него сильного основания, и проведя соответствующие математические преобразования, можно получить уравнение: + HCl : + NaOH : где K HA – константа диссоциации кислоты; С – общая концентрация буферного раствора ([ HA ]+[ A - ]).
Слайд 69
находится в пределах от 10 до 0.1, что соответствует двум единицам рН, т.е. рН = рК 1 69 Максимальная буферная емкость реализуется при одинаковой концентрации компонентов буферного раствора. Расчеты показывают, что величина рН буферных систем остается практически постоянной, если отношение концентраций компонентов или
Слайд 70
Пример 1. Вычислить рН раствора, состоящего из 0,2 М CH 3 COOH и 0,15 M CH 3 COOК. CH 3 COOH CH 3 COO – + Н + С к -x х х CH 3 COONa CH 3 COO – + Na + С c С c С c В буферном растворе х << 0,15 и 0,15 + х 0,15, а также 0,20 + х 0,20 рН = 4,63.
Слайд 71
71 Кислотно-основные индикаторы Кислотно-основные индикаторы – это органические соединения сложной структуры, которые изменяют свою окраску в зависимости от рН раствора. Согласно ионной теории кислотно-основные индикаторы – слабые кислоты или основания, недиссоциированные молекулы которых и анионы имеют различную окраску. Метиловый оранжевый: HInd H+ + Ind - кр желт
Слайд 72
72 Осаждение и растворение малорастворимых соединений Раствор, находящийся в состоянии равновесия с осадком, называется насыщенным. Равновесие малорастворимого соединения Sr SO 4 с его насыщенным раствором, в котором Sr SO 4 диссоциирует нацело: SrSO 4 ( тв ) Sr 2+ (p) + SO 4 2– (p) количественно характеризуется константой равновесия :
Слайд 73
73 Активность твердого соединения является величиной постоянной, поэтому она может быть включена в константу: Величину ПР°( SrSO 4 ) называют термодинамическим произведением растворимости или произведением активностей. Значения ПР 0 для малорастворимых соединений приводятся в справочниках.
Слайд 74
74 Т.к. активности ионов равны их концентрациям, умноженным на коэффициенты активности, уравнение можно записать: Величину ПР( SrSO 4 )=[ Sr 2+ ][SO 4 2– ] называют концентрационным произведением растворимости. Коэффициенты активности, следовательно, концентрационное произведение растворимости зависят от ионной силы раствора. При нулевой ионной силе численные значения ПР и ПР 0 совпадают.
Слайд 75
75 УСЛОВИЯ ВЫПАДЕНИЯ И РАСТВОРЕНИЯ ОСАДКОВ Свойство насыщенного раствора сохранять постоянным произведение активностей (концентраций) ионов в соответствующих степенях называют правилом произведения растворимости. Если произведение концентраций ионов больше ПР, то такой раствор называют пересыщенным. Пересыщенный раствор может быть метастабильным, из которого осадок самопроизвольно не образуется, и лабильным. В лабильном пересыщенном растворе будет происходить образование осадка и концентрации ионов в растворе будут уменьшаться до тех пор, пока ПИ станет равным ПР.
Слайд 76
76 Если произведение концентраций ионов в растворе меньше ПР, т.е. раствор будет ненасыщенным. Растворение осадка, т.е. переход вещества из твердого состояния в раствор, будет происходить до тех пор, пока произведение концентраций ионов (ПИ) не станет равным ПР.
Слайд 77
77 Пример 1. Выпадет ли осадок Mg(OH) 2 при добавлении к 50 мл 0,2 М раствора MgCl 2 равного объема 0,2 М раствора аммиака? Вычислим концентрации растворов после смешения: Рассчитаем концентрацию [OH – ] в растворе NH 3 : NH 3 + H 2 O = NH 4 + + OH – 0,1 - х х х
Слайд 78
78 поскольку 0,1- х 0,1 ПИ = [Mg 2+ ][OH – ] 2 = 0,1(1,33 10 –3 ) 2 = 1,76 10 –7 ПР(Mg(OH 2 ) = 6 10 –10 Так как произведение концентраций ионов больше произведения растворимости, осадок будет выпадать.
Слайд 79
79 РАСТВОРИМОСТЬ ОСАДКОВ Равновесная концентрация иона стронция в насыщенном растворе, т.е. растворимость SrSO 4 в воде равна: Согласно данному уравнению растворимость зависит от ряда факторов: 1. Природы вещества, т.е. от произведения растворимости малорастворимого соединения. Например, растворимость осадка AgI будет значительно ниже растворимости осадка AgCl
Слайд 80
80 где Н – изменение энтальпии при растворении. Процесс растворения большинства малорастворимых соединений в воде эндотермичен ( Н > 0), поэтому с повышением температуры растворимость осадков, как правило, увеличивается. 2. Температуры. Зависимость ПР от температуры передается уравнением изобары химической реакции
Слайд 81
81 3. Ионной силы раствора. В присутствии посторонних электролитов коэффициенты активности будут уменьшаться, а растворимость возрастать за счет «солевого эффекта». 4. В соответствии с правилом ПР, если концентрация одного из ионов, входящих в выражение ПР, увеличивается, то концентрация другого уменьшается. Поэтому в присутствии одноименного иона растворимость малорастворимого соединения уменьшается. 5. Влиять природа растворителя, образование малодиссоциированных соединений и т.д.
Слайд 82
82 Пример 1. Вычислить растворимость H g 2 Cl 2 в воде. H g 2 Cl 2 тв Hg 2 2+ + 2C l ˉ x 2 x ПР( Hg 2 Cl 2 ) =[ Hg 2 2+ ]. [ Cl ˉ ] 2 = 1,3. 10 –18 ПР( Hg 2 Cl 2 ) = (2 х ) 2 х = 4 х 3 = 1,3. 10 –18
Слайд 83
83 ВЫВОД ОБЩЕГО УРАВНЕНИЯ ДЛЯ РАСЧЕТА РАСТВОРИМОСТИ ПО ДАННЫМ О ПР Равновесие малорастворимого соединения М n A m с его насыщенным раствором выражается урвнением: М n A m = nM + mA Обозначим растворимость соединения через S моль/л. Равновесные концентрации ионов в этом растворе будут равны: [М] = [nS] [А] = [mS] Подставляем эти значения в выражение произведения растворимости ПР° = [nS] n [mS] m n M m A При ионной силе раствора I < 0,001. n M = m A = 1, поэтому ПР = [nS] n [mS] m
Слайд 85
ВЛИЯНИЕ ОДНОИМЕННОГО ИОНА НА РАСТВОРИМОСТЬ ОСАДКОВ Пример 1. Вычислить растворимость Ag 2 C 2 O 4 : а)в воде; б) в 0,2 М Na 2 C 2 O 4. Ag 2 C 2 O 4 тв 2Ag + + C 2 O 4 2– 2x x Растворимость Ag 2 C 2 O 4 в воде составляет 2,05. 10 –4 моль/л.
Слайд 86
86 б) Ag 2 C 2 O 4 тв 2 Ag + + C 2 O 4 2– 2x x Na 2 C 2 O 4 2Na + + C 2 O 4 2– 0,2 0,4 0,2+ x Принимаем х + 0,2 0,2;
Слайд 87: ОСАЖДЕНИЕ КАТИОНОВ ТРЕТЬЕЙ АНАЛИТИЧЕСКОЙ ГРУППЫ (Ca 2+, Sr 2+, Ba 2+ )
87 Для осаждения используют групповой реагент 1,0 М раствор H 2 SO 4. ПР(CaSO 4 ) = 2,5. 10 –5 ; ПР(SrSO 4 ) = 3,2. 10 –7 ; ПР(BaSO 4 ) = 1,1. 10 –10. Наиболее растворимым является сульфат кальция.
Слайд 88
88 Будет ли достигнута полнота осаждения CaSO 4, SrSO 4 и BaSO 4 в 1М растворе H 2 SO 4, если начальные концентрации ионов Ba 2+, Ca 2+ и Sr 2+ равны 0,1 моль/л. В водном растворе H 2 SO 4 преобладает ион HSO 4 – (К а = 1,15. 10 –2 ). При осаждении ионов Ba 2+ устанавливается равновесие: Ba 2+ + HSO 4 - BaSO 4 + H + x 0,9+ x 1,1- x
Слайд 89
89 Если через х обозначим равновесную концентрацию ионов B a 2+, тогда 0,1- х ионов бария выпало в осадок, столько же израсходовалось кислоты и ее равновесная концентрация выразится как [HSO 4 - ] = 1 – (0,1- x ) = 0,9 + x. Соответственно концентрация протонов составит: [H + ] = 1 + (0,1 – x ) = 1,1 – x. Если x << 0,9, то 0,9 + х = 0,9, а 1,1 – х = 1,1. При осаждении ионов Ва 2+ 1М раствором H 2 SO 4 концентрация ионов бария снижается от 0,1 до 1,17. 10 –8 моль/л. В этом случае полнота осаждения достигается, т.к. 1,2. 10 –8 моль/л < 1. 10 –6 моль/л.
Слайд 90
90 Используя аналогичный подход выполним расчеты для осаждения ионов Ca 2+ : Ca 2+ + HSO 4 - CaSO 4 + H + x 0,9+ x 1,1- x Полученное значение [Ca 2+ ] = 2,65. 10 –3 моль/л >> 10 –6 моль/л. Следовательно, осаждение ионов Ca 2+ будет неполным.
Слайд 91
91 При осаждении ионов Sr 2+ : Sr 2+ + HSO 4 – = SrSO 4 + H + x 0,9 +x 1,1 -x Ионы Sr 2+ осаждаются в большей степени, чем ионы Са 2+. Однако и в этом случае полнота осаждения не достигается, поскольку [Sr 2+ ] = 3,4. 10 –5 > 1. 10 –6 моль/л.
Слайд 92: РАЗДЕЛЕНИЕ ИОНОВ МЕТОДОМ ОСАЖДЕНИЯ
92 Разделение ионов методом осаждения основано на различной растворимости соединений с одинаковым анионом. 1. Разделение ионов Ba 2+ и Sr 2+ с использованием сульфата натрия. Если к раствору, содержащему равные количества ионов Ba 2+ и Sr 2+ (0,1 моль/л), постепенно приливать раствор Na 2 SO 4, то первым выпадет осадок BaSO 4, т.к. ПР(BaSO 4 ) = 1,1. 10 –10 меньше ПР(SrSO 4 ) = 3,2. 10 –7. Концентрация сульфат-иона, при которой достигается полнота осаждения иона Ва 2+ (1. 10 –6 моль/л), будет равна:
Слайд 93
93 Рассчитаем, при какой концентрации ионов SO 4 2– начнется осаждение SrSO 4. << 1,1 10 –4 моль/л Таким образом, действием сульфата натрия на смесь катионов бария и стронция отделить барий от стронция нельзя.
Слайд 94
94 2. Разделение ионов Ba 2+ и Sr 2+ с использованием хромата калия. Если к раствору, содержащему равные количества ионов Ва 2+ и Sr 2+, постепенно приливать раствор хромата калия, то первым выпадет осадок ВaCrO 4, т.к. ПР(BaCrO 4 ) = 1,2 10 –10 меньше ПР(SrCrO 4 ) = 3,6 10 –5. Начальные концентрации ионов Ba 2+ и Sr 2+ в растворе равны 0,1 моль/л. Рассчитаем, при какой концентрации хромат-ионов достигается полнота осаждения иона Ва 2+. Рассчитаем, при какой концентрации CrO 4 2– начинается осаждение SrCrO 4 :
Слайд 95
95 3. Разделение ионов Ba 2+ и Sr 2+ с использованием дихромата калия. Растворы дихромата калия имеют кислую реакцию, обусловленную процессами: Cr 2 O 7 2– + H 2 O = 2HCrO 4 – HCrO 4 – = H + + CrO 4 2– Протекание этих реакций зависит от рН раствора.
Слайд 96
96 При осаждении иона бария дихроматом калия устанавливается равновесие: 2Ba 2+ + Cr 2 O 7 2- + H 2 O 2BaCrO 4 + 2H +
Слайд 97
97 Рассчитаем, при каком рН ионы бария будут полностью осаждены 0,05М раствором K 2 Cr 2 O 7 ? [H + ] = 9 10 -5 моль/л, рН=4,05. При каком рН начнется осаждение SrCrO 4 при действии 0,05М раствором K 2 Cr 2 O 7 ? 2Sr 2+ + Cr 2 O 7 2- + H 2 O 2SrCrO 4 + 2H +
Слайд 98
98 [H + ]=3,01 10 -5 моль/л, рН=4,52. Для осаждения ионов бария в присутствии ионов стронция к уксуснокислому раствору добавляют раствор СН 3 СООNa до рН=4,5 по универсальному индикатору, после чего добавляют по каплям раствор К 2 Сr 2 О 7 до тех пор, пока раствор над осадком не окрасится в оранжево-желтый цвет. Появление такой окраски свидетельствует об избытке ионов Cr 2 O 7 2– в растворе. При этом концентрация ионов CrO 4 2– оказывается достаточной только для осаждения ВаСrО 4.
Слайд 99
99 ПРЕВРАЩЕНИЕ ОДНОГО ОСАДКА В ДРУГОЙ (КАРБОНИЗАЦИЯ) В аналитической химии часто применяют реакции, в которых одно малорастворимое соединение при действии соответствующего реагента превращается в другое малорастворимое соединение. Например, осадок SrSO 4 (ПР(SrSO 4 ) = 3,2. 10 –7 ) легко превращается в SrСO 3 (ПР(SrСO 3 ) = 1,1. 10 –10 ) при действии раствором Na 2 CO 3. Для того, чтобы перевести сульфаты бария стронция и кальция в раствор, их сначала превращают в карбонаты – соли, растворимые даже в слабой уксусной кислоте. С этой целью осадки CaSO 4, SrSO 4 и BaSO 4 обрабатывают нагретым насыщенным раствором соды. Этот процесс получил название « карбонизация ».
Слайд 100
100 В процессе карбонизации SrSO 4 устанавливается равновесие: SrSO 4 тв + CO 3 2– SrCO 3 тв + SO 4 2– Величина константы показывает, что это равновесие сдвинуто вправо. Поэтому для перевода SrSO 4 в SrCO 3 достаточно однократного проведения карбонизации. Если сопоставить произведения растворимости BaSO 4 ( ПР ( Ba SO 4 ) = 1,1. 10 –10 ) и BaСO 3 ( ПР ( Ba СO 3 ) = 5,1. 10 –9 ), можно предположить, что перевести сульфат бария в карбонат нельзя.
Слайд 101
101 В процессе карбонизации BaSO 4 устанавливается равновесие: BaSO 4 тв + CO 3 2– BaCO 3 тв + SO 4 2– Величина константы мала. Тем не менее осадок BaCO 3 будет выпадать, если произведение растворимости его оказывается превышенным.
Слайд 102
102 УСЛОВНОЕ ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ Для расчета равновесий в системе раствор – осадок при наличии побочных реакций используют условное произведение растворимости ПР´. Условным произведением растворимости называется произведение суммарной концентрации всех форм существования катиона малорастворимого соединения на суммарную концентрацию всех форм существования аниона этого соединения с учетом стехиометрических коэффициентов. Условное произведение растворимости ПР´ связано с истинным ПР соотношением: ПР ´ = ПР М А где М – коэффициент побочных реакций для катиона; А – коэффициент побочных реакций для аниона.
Слайд 103
103 РАСТВОРЕНИЕ ОСАДКОВ Пример 1. Вычислить растворимость СаС 2 О 4 в 0,1 М растворе НСl. При растворении СаС 2 О 4 в сильной кислоте протекают реакции: СаС 2 О 4 тв = Са 2+ + С 2 О 4 2 – СаС 2 О 4 тв + Н + = Са 2+ + НС 2 О 4 –
Слайд 104
104 СаС 2 О 4 + 2Н + = Са 2+ + Н 2 С 2 О 4 где К 1 а и К 2 а – константы ступенчатой ионизации щавелевой кислоты. Растворимость СаС 2 О 4 равна: S = [Ca 2+ ] = [C 2 O 4 2– ] + [HC 2 O 4 – ] + [Н 2 С 2 О 4 ]
Слайд 105
105 Умножим обе части уравнения на [Са 2+ ] и вынесем за скобки, тогда: Выражение в скобках в уравнении обозначим Уравнение для расчета растворимости оксалата кальция в растворе сильной кислоты имеет вид:
Слайд 106
106 Так как константы К р ´ и К р ´ ´ невелики, то равновесную концентрацию ионов водорода можно приравнять к исходной концентрациии хлороводородной кислоты (с(НСl) = [Н + ] = 0,1 моль/л). Коэффициент равен:
Слайд 107
107 Максимальный вклад дает растворение с образованием щавелевой кислоты. Можно считать преобладающим равновесие: Ca С 2 О 4тв + 2 H + Ca 2+ + H 2 С 2 О 4 0,1-2 x x x x = 2,7 10 -3 моль/л
Слайд 108
108 Пример 2. Рассчитать растворимость СаСО 3 в 0,1М растворе HCl. При растворении карбоната кальция в кислоте протекают реакции: CaCO 3 тв Ca 2+ + CO 3 2– П P(CaCO 3 )=[Ca 2+ ][CO 3 2– ]=3,8 10 -9 CaCO 3 тв + H + Ca 2+ + HCO 3 –
Слайд 109
109 CaCO 3 тв + 2H + Ca 2+ + H 2 CO 3 2x 0,05-x 0,05-x В связи с тем, что К р и К p – большие, расход ионов водорода будет значительным, поэтому необходимо рассчитать равновесную концентрацию ионов водорода. Так как К p значительно больше К р, то расчет проводится по второму уравнению. На растворение одного моля CaCO 3 расходуется два иона водорода. Обозначим через 2x равновесную концентрацию ионов водорода, тогда [Ca 2+ ]=[ H 2 CO 3 ]= (0,05-x)
Слайд 110
110 Если x 0,05, то 0,05-x 0,05 x = 1,88 10 -6 моль/л [H + ]= 2x = 3,76 10 -6 моль/л
Слайд 111
РАСТВОРЕНИЕ ПОД ДЕЙСТВИЕМ СЛАБЫХ КИСЛОТ Пример 1. Рассчитать растворимость СаС 2 О 4 в 0,1 М растворе CH 3 COOH. При растворении протекает реакция: СаС 2 О 4тв + 2СН 3 СООН Са 2+ + 2СН 3 СОО – + Н 2 С 2 О 4 0,1-2 х х 2 х х
Слайд 112
112 Поскольку величина константы равновесия мала, то 0,05-х ≈ 0,05 х = 3,5∙10 -5 моль/л. Растворимость СаС 2 О 4 в 0,1 М растворе СН 3 СООН равна 3,5∙10 -5 моль/л. Оксалат кальция практически нерастворим в 0,1 М растворе СН 3 СООН. Следовательно, для растворения осадка СаС 2 О 4 рекомендуется использовать сильные минеральные кислоты.
Слайд 113
113 Пример 2. Рассчитать растворимость СаСО 3 в буферном растворе при рН=4. CaCO 3 тв + 2H + Ca 2+ + H 2 CO 3 10 -4 x x х = 1,34 моль/л Условное произведение растворимости при рН=4: П P´(CaCO 3 )=[Ca 2+ ][CO 3 2– ]´
Слайд 115
115 Реакции комплексообразования Комплексные (координационные) соединения – это ионы и молекулы, состоящие из центральной частицы и координированных вокруг нее лигандов (аддендов). Комплексные соединения имеют внутреннюю координационную сферу (совокупность непосредственно связанных с центральным ионом лигандов) и внешнюю. [ Cu(NH 3 ) 4 ]SO 4 Na[ Al(OH) 4 ] [ внутренняя ] внешняя внешняя [ внутренняя ] координационные сферы координационные сферы
Слайд 116
116 Координационным числом называют число атомов (или групп их), координируемых центральным ионом в данном соединении. Наиболее часто встречаются комплексы с координационным числом 2, 4, 6. Число атомов лиганда, образующих в данном соединении связи, т.е. число мест, которое занимает лиганд в координационной сфере, называется дентатностью (координационной емкостью). Монодентатные лиганды используют в качестве донорного только один атом и занимают одно координационное место ( F -, Cl -, CN -, SCN -, H 2 O, NH 3 и др.).
Слайд 117
117 Примером полидентатных лигандов являются: оксалат-ион –ООС–СОО– Этилендиамин H 2 NCH 2 – CH 2 NH 2 диметилглиоксим CH 3 - C = NOH CH 3 - C = NOH Полидентатные лиганды образуют координационные соединения, содержащие один или несколько циклов – замкнутых группировок атомов. Такие соединения называют хелатами.
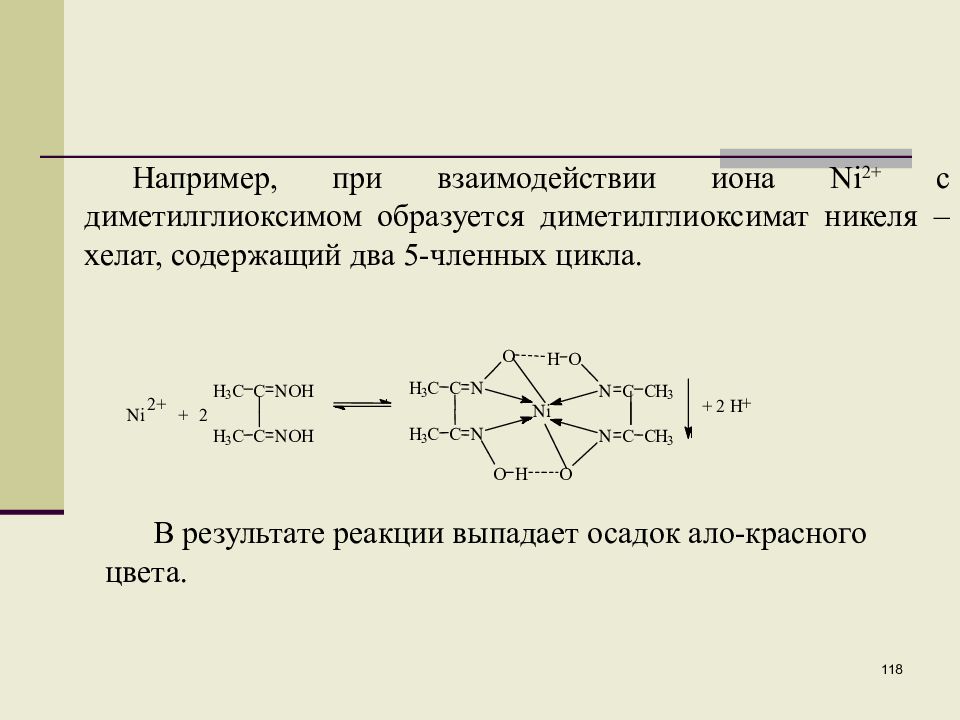
Слайд 118
118 Например, при взаимодействии иона Ni 2+ с диметилглиоксимом образуется диметилглиоксимат никеля – хелат, содержащий два 5-членных цикла. В результате реакции выпадает осадок ало-красного цвета.
Слайд 119
119 РАВНОВЕСИЯ В РАСТВОРАХ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ В общем виде образование комплексного соединения можно представить уравнением: M + nL ML n Константа равновесия реакции комплексообразования называется константой устойчивости комплексного соединения: где n 0 – термодинамическая константа устойчивости комплексного соединения; a MLn, a M, a L – активности комплексного соединения, центрального иона и лиганда соответственно.
Слайд 120
120 В действительности образование в растворе комплексного соединения состава ML n протекает ступенчато: M + L ML ML + L ML 2 ML n-1 + L ML n Константы 1 0, 2 0, …, n 0 называют ступенчатыми константами устойчивости, каждая из которых характеризует равновесие реакции присоединения одного лиганда. …………………………………….
Слайд 121
121 Общая константа устойчивости ( ) характеризует равновесие реакции присоединения к центральному иону данного числа лигандов, которое обычно указывается нижним индексом у символа . M + 2L ML 2 M + 3L ML 3 M + nL ML n …………………………………….
Слайд 122
122 Ступенчатые константы устойчивости связаны с общей константой устойчивости простым соотношением: n 0 = 1 0 2 0 … n 0 Реже используют величину, обратную константе устойчивости, которая называется константой нестойкости : и, соответственно, ступенчатые константы нестойкости:
Слайд 123
123 Учитывая связь активности с концентрацией, термодинамическую константу устойчивости комплексного соединения можно записать в следующем виде: - концентрационная константа устойчивости ; MLn, M, L – коэффициенты активности комплексного соединения, центрального иона и лиганда, соответственно. Коэффициенты активности зависят от ионной силы раствора.
Слайд 124
124 Процесс образования аммиачных комплексов меди в растворе протекает ступенчато:
Слайд 125
125 Общие константы устойчивости ( ) характеризуют реакции присоединения к иону меди нескольких молекул аммиака. Для простейшего комплекса Cu ( NH 3 ) 2+ понятия общей и ступенчатой констант устойчивости совпадают.
Слайд 126
126 Пример 1. Вычислить равновесную концентрацию С d 2+ в растворе, содержащем 0,1 моль/л С d (NO 3 ) 2 и 2 моль/л KI (без учета ступенчатого комплексообразования). Равновесие образования комплекса С dI 4 2- С d 2+ + 4 I - С dI 4 2- x 2-4(0,1- x ) 0,1- x характеризуется константой устойчивости: При достаточно большой константе устойчивости и значительном избытке лиганда можно принять, что [С dI 4 2- ] = C 0 Cd - х = 0,1 моль/л; [ I - ] = =C 0 I - 4C 0 Cd =2 – 4 (0,1- x ) = 1,6 моль/л.
Слайд 127
127 [С d 2+ ]=1,2. 10 -8 моль/л Введение KI в раствор С d (NO 3 ) 2 понизило концентрацию кадмия(II) с 0,1 моль/л до 1,2. 10 - 8 моль/л.
Слайд 128
128 УСЛОВНЫЕ КОНСТАНТЫ УСТОЙЧИВОСТИ В реальных условиях реакция образования координационного соединения может сопровождаться протеканием конкурирующих реакций. Центральный ион может взаимодействовать с другими лигандами (Х), введеными в раствор, например, с компонентами буферной смеси: М + nX MX n Кроме того, лиганды (L) могут взаимодействовать с протонами, находящимися в растворе: L + mH + =H m L m+ Побочные процессы существенно влияют на протекание основной реакции, уменьшая концентрацию центрального иона и лигандов.
Слайд 129
129 Например, рассмотрим процесс взаимодействия иона железа(III) с KSCN. Основная реакция: Fe 3+ + SCN - FeSCN 2+ Это равновесие осложняется побочными реакциями: Fe 3+ + HOH Fe OH 2+ + H + Fe(H 2 O) 6 3+ Fe(H 2 O) 5 OH 2+ + H + Константа кислотной диссоциации по теории Бренстеда-Лоури (константа гидролиза):
Слайд 130
130 Суммарная равновесная концентрация ионов Fe 3+, не связанных в комплекс FeSCN 2+, будет равна:
Слайд 131
В тех случаях, когда реакция комплексообразования в растворе осложняется какими-либо побочными процессами (реакциями протолитического взаимодействия катиона с молекулами воды, или реакциями комплексообразования катиона с дополнительными лигандами, или реакциями протонирования лиганда), то при расчетах равновесий в такой системе можно использовать условную константу устойчивости.
Слайд 132
132 pH [SCN - ] 1 1,1 9∙10 2 0,1 90 2 2 5∙10 2 0,1 50 При рН=2 50% Fe 3+ не связано в комплекс. Вывод : обнаружение Fe 3+ с помощью тиоционата калия следует проводить при рН≤1.
Слайд 133
Для комплексного соединения состава ML n условная константа устойчивости равна: где [M] и [L] – условные концентрации центрального иона и лигандов, соответственно, которые представляют собой суммы равновесных концентраций всех форм существования ионов М и L в растворе, кроме ML n : [M] = [M] + [MX] +[MX 2 ] + …... + [MX n ] [L] = [L] + [HL] + [H 2 L] + …... + [H m L] Для расчета [M] и [L] коэффициенты побочных реакций М и L соответственно равны: где К 1 …,К m – ступенчатые константы диссоциации кислоты.
Слайд 134
134 [M] = [M]∙ M [L] = [L]∙ L Отсюда: Для наиболее часто встречающихся в аналитической практике систем численные значения М и L приведены в литературе. В случае необходимости они легко могут быть рассчитаны при известных значениях , К и задаваемых равновесных концентрациях Х и Н +.
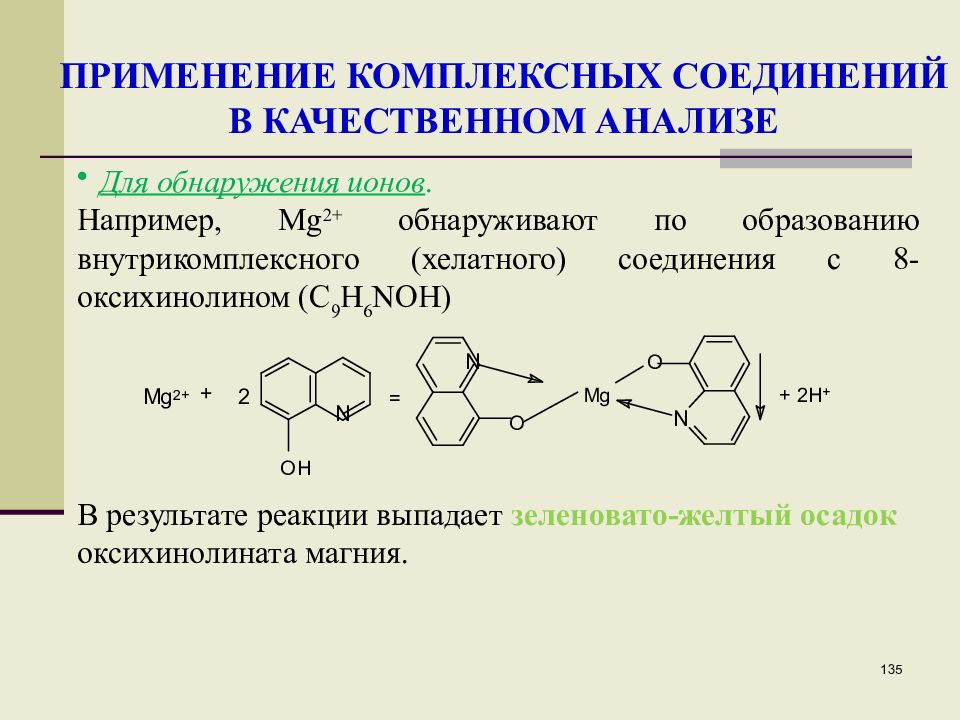
Слайд 135
135 ПРИМЕНЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ В КАЧЕСТВЕННОМ АНАЛИЗЕ Для обнаружения ионов. Например, Мg 2+ обнаруживают по образованию внутрикомплексного (хелатного) соединения с 8-оксихинолином (С 9 Н 6 NOH) В результате реакции выпадает зеленовато-желтый осадок оксихинолината магния.
Слайд 136
136 Для маскировки мешающих ионов. Катионы Co 2+, Zn 2+, Cd 2+, Cu 2+ (M 2+ ) обнаруживают с реактивом (NH 4 ) 2 [Hg(SCN) 4 ]. M 2+ + [Hg(SCN) 4 ] 2- = M[Hg(SCN) 4 ] В результате реакций образуются осадки, состоящие из кристаллов характерной формы и цвета. Однако в присутствии ионов Fe 3+ образуются тиоцианатные комплексы железа (III), которые окрашивают раствор в красный цвет и тем самым мешают обнаружению вышеперечисленных ионов. Добавлением фторид-ионов маскируют ионы Fe 3+, связывая их в прочный бесцветный комплекс: Fe 3+ + 6F - = [FeF 6 ] 3- В этом случае устраняется мешающее влияние иона Fe 3+. Способ «маскировки» часто используется как в качественном, так и в количественном анализе.
Слайд 137
Для изменения кислотно-основных свойств. Отщепление протона от координированного лиганда происходит, обычно при более низком значении рН, чем от свободного. Например, если в слабой кислоте HF F ˉ ион связать в комплекс SiF 6 2-, то получаем более сильную кислоту H 2 SiF 6. Для изменения окислительно-восстановительных свойств. Связывание ионов в комплексные соединения может существенно изменить ряд активности металлов. Например, железо не вытесняет медь из аммиачных растворов медного купороса, цинк не восстанавливает платину из растворов H 2 [Pt(CN) 4 ]. В растворах, содержащих комплексообразующие реагенты растворяются даже благородные металлы. Общеизвестно растворение золота в цианидных ваннах под действием кислорода воздуха: 4Au + 8CN - + O 2 + 2H 2 O = 4[Au(CN) 2 ] - + 4OH - или окисление золота азотной кислотой в присутствии HCl.
Слайд 138
•Для разделения ионов. Отделение катионов IV аналитической группы от V в ходе систематического анализа основано на растворении их гидроксидов в избытке NaOH вследствие амфотерности. При этом образуются гидроксокомплексы Al(OH) 4 -, Zn(OH) 4 2-, Cr(OH) 4 - ; в присутствии H 2 O 2 ион Cr(OH) 4 - окисляется до CrO 4 2-. Катионы V аналитической группы выпадают в осадок в виде Mg(OH) 2, MnO(OH) 2, Fe(OH) 3. Рассчитаем, при каком рН осаждается гидроксид магния, а алюминий в виде Al(OH) 4 - остается в растворе. Начальные концентрации ионов алюминия и магния равны 0,1моль/л. рОН = -lg 2,45. 10 -2 = 1,61 рН = 14 - 1,61 = 12,39
Слайд 139
При действии щелочи на ионы Al 3+ сначала выпадает осадок гидроксида алюминия: Al 3+ + 3OH - = Al(OH) 3тв Выпавший осадок растворяется в избытке щелочи: Al(OH) 3тв + ОН - = Al(OH) 4 - Найдем, какой избыток гидроксид-ионов необходимо добавить, чтобы полностью растворить осадок, т.е. чтобы концентрация Al(OH) 4 - составила 0,1моль/л. рОН = -lg 0,3 = 0,52 рН = 13,48 Таким образом, при рН = 13,48 происходит полное осаждение ионов магния, а ионы алюминия остаются в растворе в виде Al(OH) 4 -.
Слайд 140
140 • Для растворения осадков. Осаждение и растворение хлоридов Пример 1. Вычислить растворимость PbCl 2 в 1 М HCl. а) без учета комплексообразования; б) с учетом комплексообразования. а) В растворе над осадком существует равновесие: PbCl 2 ( тв ) Pb 2+ + 2Cl – x 1+2x Т.к. 1+2 x ≈1,
Слайд 141
141 б) Если при расчете растворимости PbCl 2 в растворе НС l принимать во внимание образование хлоридных комплексов свинца, то необходимо учитывать протекание следующих процессов: PbCl 2 (тв) Pb 2+ + 2 Cl – Pb 2+ + Cl – PbCl + Pb 2+ + 2Cl – PbCl 2 Pb 2+ + 3Cl – PbCl 3 -
Слайд 142
142 Растворимость PbCl 2 можно представить как сумму равновесных концентраций всех форм существования свинца в растворе: S = [Pb 2+ ] + [PbCl + ] + [PbCl 2 ] + [PbCl 3 – ] Принимая равновесную концентрацию [ Cl - ] = 1 моль/л, получаем:
Слайд 143
143 Пример 2. Вычислить растворимость AgCl в 1 М HCl. В системе имеют место равновесия: AgCl Ag + + Cl – ПР = [Ag + ][Cl – ] = 1,78 10 –10 Ag + + Cl – AgCl Ag + + 2Cl – AgCl 2 ˉ Ag + + 3 Cl – AgCl 3 2-
Слайд 144
144 Растворимость AgCl в 1 М HCl невелика. Для отделения серебра от хлоридов катионов II группы осадок обрабатывают раствором аммиака.
Слайд 145
145 Пример 3. Вычислить растворимость AgCl в 0,1 М NH 3. а) с учетом ступенчатого комплексообразования; б) без учета ступенчатого комплексообразования. а) Если не учитывать комплексообразование ионов серебра с ионами С l -, равновесные процессы в растворе, содержащем AgCl и NH 3, можно представить следующими уравнениями: AgCl Ag + + Cl – ПР = [Ag + ][Cl – ] = 1,78 10 –10 Ag + + NH 3 AgNH 3 + Ag + + 2NH 3 Ag(NH 3 ) 2 +
Слайд 146
146 Растворимость определяется суммой равновесных концентраций всех форм ионов серебра в растворе или равной ей концентрацией хлорид-ионов. S = [Ag + ] + [Ag(NH 3 ) + ] + [Ag(NH 3 ) 2 + ] = [Cl - ] Принимаем [NH 3 ] = 0,1 моль/л
Слайд 147
147 б) Растворимость AgCl в NH 3 обусловлена преимущественным образованием комплекса состава Ag ( NH 3 ) 2 +. AgCl↓ + 2NH 3 Ag(NH 3 ) 2 + + Cl - 0,1-х х х Обозначим [ Ag ( NH 3 ) 2 + ] = [ Cl - ] = х; [( NH 3 )] = 0,1 - 2х х = 4,94. 10 -3 моль/л
Слайд 148
148 В отличие от AgCl осадок Hg 2 Cl 2 не растворим в аммиаке. При действии водного раствора аммиака он чернеет. При этом сначала образуется комплексное соединение ртути ( I ): Hg 2 Cl 2 + 2NH 3 [Hg 2 NH 2 ]Cl + NH 4 + + Cl - Оно неустойчиво и быстро распадается: [ Hg 2 NH 2 ] Cl HgNH 2 Cl + Hg Почернение осадка происходит вследствие образования металлической ртути.
Слайд 149
149 Осаждение и растворение гидроксидов Отделение катионов IV аналитической группы в ходе систематического анализа кислотно-основным методом основано на растворении гидроксидов в избытке NaOH вследствие их амфотерности. Пример 1. Рассчитать растворимость Zn(OH) 2 при значении рН раствора, равном 13. В данных условиях в растворе протекают следующие процессы: Zn ( OH ) 2 Zn 2+ + 2 OH -
Слайд 150
Принимаем при рН = 13 [ OH ˉ] = 0,1 моль/л Растворимость осадка Zn(OH) 2 можно представить как сумму равновесных концентраций всех форм существования цинка в растворе: S = [Zn 2+ ] + [ZnOH + ] + [Zn(OH) 2 ] + [Zn(OH) 3 - ] + [Zn(OH) 4 2- ]
Слайд 151
151 Подставим численные значения: Сопоставление слагаемых при расчете Zn показывает, что основной вклад в растворение Zn(OH) 2 в щелочной среде вносит образование комплекса Zn(OH) 4 2-, т.е. расчет можно упростить, ограничиваясь рассмотрением лишь последней реакции.
Слайд 152
152 Пример 2. Рассчитать растворимость Al (OH) 3 при значении рН раствора, равном 13. По аналогии с Zn(OH) 2 основной вклад в растворение Al (OH) 3 в щелочной среде вносит образование комплекса Al (OH) 4 -. Поэтому ограничимся рассмотрением реакции: Al(OH) 3 ↓ + OH - Al(OH) 4 - 0,1-х х
Слайд 153
153 Пример 3. Рассчитать растворимость Al (OH) 3 в 0,1 М NH 3. Доминирующая реакция: Al(OH) 3 ↓ + NH 3 + H 2 O Al(OH) 4 - + NH 4 + 0,1-х х x
Слайд 154
Пример 3. Рассчитать рН раствора, при котором Al ( OH ) 4 - полностью переходит в осадок Al ( OH ) 3. Al ( OH ) 4 - + H + Al ( OH ) 3 ↓ + Н 2 О 1∙10 -6 х рН = 7
Слайд 155
Пример 4. Какую концентрацию NH 4 Cl нужно создать для полного превращения Al ( OH ) 4 - в осадок Al ( OH ) 3, если с°( Al ( OH ) 4 - ) = 0,01 моль/л. Al(OH) 4 - + NH 4 + Al(OH) 3 ↓ + NH 3 + H 2 O 1∙10 -6 х 0,01-10 -6 с°( NH 4 + ) = 0, 0 1 + 1, 76 = 1, 77 моль/л Для отделения ионов аллюминия к раствору смеси катионов IV аналитической группы при перемешивании прибавляют небольшими порциями кристаллический NH 4 Cl до запаха NH 3. Смесь нагревают.
Слайд 156
156 Образование аммиачных комплексов при осаждении и растворении гидроксидов При добавлении к раствору смеси катионов IV аналитической группы кристаллического NH 4 Cl гидроксокомплекс Zn(OH) 4 2- переходит в аммиачный комплекс Zn( N H 3 ) 4 2+. Пример 1. Какую концентрацию NH 4 + создать в растворе, чтобы полностью превратить Zn(OH) 4 2- в Zn( N H 3 ) 4 2+, если с°( Zn ( OH ) 4 2- ) = 0,1 моль/л. Zn(OH) 4 2- + NH 4 + Zn(NH 3 ) 4 2+ + H 2 O 1∙10 -6 х 0,1-10 -6
Слайд 157
157 с°( NH 4 + ) = 0,1 + 4 x = 0,3 моль/л Гидроксиды катионов VI аналитической группы в результате систематического анализа остаются в растворе в виде аммиачных комплексов: Cu ( NH 3 ) 4 2+, Cd ( NH 3 ) 4 2+, Co ( NH 3 ) 6 2+, Ni ( NH 3 ) 6 2+, Hg ( NH 3 ) 4 2+.
Слайд 158
158 Пример 2. Вычислить растворимость Cu ( OH ) 2 в 25% NH 3, если в растворе образуются только комплексные ионы Cu ( NH 3 ) 4 2+. Реакцию растворения Cu (ОН) 2 в приведенных условиях без учета ступенчатого комплексообразования можно представить следующим образом: Cu( ОН ) 2 + 4NH 3 Cu(NH 3 ) 4 2+ + 2OH – 13,32- 4 х х 2 х Пересчет процентной концентрации NH 3 в молярную проводят используя справочник Ю.Ю.Лурье по аналитической химии: с( NH 3 )=13,32моль/л. х = 0,0571 моль/л
Слайд 159
159 Реакции окисления-восстановления Реакции окисления-восстановления характеризуются переносом электронов от одного иона к другому. Окислитель – это вещество, которое принимает электроны, и в результате его степень окисления понижается Fe 3+ + e = Fe 2+ Восстановитель отдает электроны, и степень его окисления повышается Zn 0 – 2e = Zn 2+ 2Fe 3+ + 2e = 2Fe 2+ Zn 0 – 2e = Zn 2+ В результате протекает реакция: 2Fe 3+ +Zn 0 = 2Fe 2+ + Zn 2+ или Cr 3+ + 8OH - - 3e = CrO 4 2- + 4H 2 O 2 H 2 O 2 + 2e = 2OH - 3 2Cr 3+ + 10 OH - + 3H 2 O 2 = 2CrO 4 2- + 8H 2 O
Слайд 160
160 Если в другой сосуд, содержащий вторую редокс-пару (Sn 2+ и Sn 4+ ), также поместить инертный электрод, замкнуть электроды на гальванометр и соединить сосуды солевым мостиком, то прибор покажет наличие тока в цепи. Такое устройство называется гальваническим элементом. В гальваническом элементе химическая энергия превращается в электрическую. Электродвижущая сила (ЭДС) гальванического элемента является разностью потенциалов двух электродов: ЭДС = Е 1 – Е 2 где Е 1 – потенциал окислителя, Е 2 – потенциал восстановителя.
Слайд 161
161 Стандартный водородный электрод представляет собой пластинку из платинированной платины, погруженную в раствор кислоты с активностью протонов равной 1, омываемую газообразным водородом при давлении 1,013 10 5 Па (1атм.). Адсорбированный платиной газообразный водород находится в равновесии с ионами водорода: Н 2 (г) = 2Н + + 2е Потенциал стандартного водородного электрода принят равным нулю при всех температурах.
Слайд 162
162 Зависимость окислительно-восстановительного потенциала от природы веществ, их концентрации и температуры передается уравнением Нернста. где Е 0 – стандартный окислительно-восстановительный потенциал; R – универсальная газовая постоянная (8,314 Дж/(моль К)); Т – абсолютная температура; F – постоянная Фарадея (96495 Кл/моль); n – число электронов, участвующих в электродном процессе; a ox, a red – активности окисленной и восстановленной форм вещества, соответственно.
Слайд 163
При подстановке численных значений констант и переходе от натуральных логарифмов к десятичным при температуре 298 К получим: а = с - коэффициент активности В разбавленных растворах величины коэффициентов активности близки к единице.
Слайд 164
164 Если все участники полуреакции находятся в стандартном состоянии ( а ox = a red = 1), т.е. растворенные вещества находятся в гипотетическом одномолярном растворе, а чистые вещества в устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении, то Наиболее сильным окислителем является редокс-пара F 2 /2 F – ( =+2,87 B ), а наиболее сильным восстановителем редокс-пара Li + / Li ( = -3,02 B ).
Слайд 165
165 Sn 4+ + 2 e Sn 2+ Т.к., ион Fe 3+ - окислитель, ион Sn 2+ - восстановитель, т.е. реакция протекает именно таким образом: 2 Fe 3+ + Sn 2+ 2 Fe 2+ + Sn 4+ С помощью стандартных окислительно-восстановительных потенциалов можно заранее оценить, будет ли протекать та или иная редокс-реакция. Например: Fe 3+ + 1 e Fe 2+
Слайд 166
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ВОДЫ Т.к. многие окислительно-восстановительные реакции протекают в водных растворах, то очень важна характеристика окислительно-восстановительных свойств воды. Уравнение Нернста для водородного электрода (2H + /H 2 ) при 298 К и Р(Н 2 )=1атм имеет вид: В химически чистой воде а Н + = 1 10 –7, и потенциал водородного электрода равен Следовательно, восстановители, имеющие Е° < –0,413 В, могут разлагать воду с выделением водорода.
Слайд 167
167 Вода может окисляться до кислорода, т.е. может проявлять восстановительные свойства: 2Н 2 О 4Н + + О 2 + 4е Стандартный потенциал редокс-пары (О 2 /Н 2 О) в воде а Н + = 1. 10 -7, тогда Таким образом, окислители, с величиной стандартного потенциала Е° 0,82 В, могут окислять воду с выделением кислорода.
Слайд 168
168 ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ПОТЕНЦИАЛА Кислотность раствора. При участии Н + или ОН - ионов в окислительно-восстановительной полуреакции их равновесные концентрации должны включаться в уравнение Нернста, то есть кислотность влияет на величину потенциала. Например, для полуреакции NO 3 - + 3H + + 2e - = HNO 2 + H 2 O потенциал будет равен
Слайд 169
169 Изменение кислотности среды может оказывать существенное влияние на величину потенциала, что приводит к изменению направления окислительно-восстановительной реакции. Так, в соответствии со стандартными потенциалами и в кислом растворе происходит окисление I - -ионов мышьяковой кислотой: 2I - + H 3 AsO 4 + 2H + = I 2 + H А sO 2 + 2H 2 O Если эту реакцию проводить в присутствии избытка NaHCO 3, который поддерживает рН = 8, то понижение концентрации ионов Н + до 10 -8 моль/л существенно снижает величину потенциала пары H 3 AsO 4 /HAsO 2 и практически не сказывается на потенциале пары I 2 /2I -.
Слайд 170
170 В соответствии с уравнением Нернста или Так как величина 0,088В меньше стандартного потенциала пары I 2 /2I -, то в этих условиях уже не H 3 AsO 4 будет окислять ионы I - до I 2, а наоборот, иод будет окислять HAsO 2 до H 3 AsO 4, т.е. будет протекать реакция: HAsO 2 + I 2 + 2H 2 O = H 3 AsO 4 + 2H + + 2I -
Слайд 171
171 В некоторых случаях рН среды влияет на потенциал, хотя концентрации ионов Н +, ОН - и не входят непосредственно в уравнение Нернста. Это связано с тем, что кислотность влияет на формы существования ионов в растворе. Например, ионы Fe 3+ в большей степени склонны к образованию гидроксокомплексов чем ионы Fe 2+ Поэтому увеличение кислотности раствора приводит к большему увеличению концентрации ионов Fe 3+. В результате этого потенциал системы Fe 3+ /Fe 2+ увеличивается.
Слайд 172
172 Реакции комплексообразования. Потенциал пары Hg 2+ /Hg в отсутствие комплексообразования будет равен При введении в раствор комплексообразователя ( I - -ионов) равновесная концентрация Hg 2+ уменьшается за счет протекания следующей реакции: Hg 2+ + 4 I – = Hg I 4 2–
Слайд 173
173 Равновесная концентрация [Hg 2+ ] становится равной Подставив эту величину в уравнение Нернста, получим: Если концентрации комплекса [Hg I 4 2- ] и лиганда [I - ] равны 1, то потенциал будет равен разности двух констант и может рассматриваться как стандартный потенциал полуреакции: HgI 4 2- + 2e = Hg + 4I -
Слайд 174
174 В общем виде где - константа устойчивости комплекса; Е 0 1 – стандартный потенциал редокс-пары в отсутствие комплексообразователя. Последнее уравнение показывает, что чем больше прочность комплекса, тем сильнее это влияние на величину редокс-потенциала. Так, металлическая ртуть не растворяется в минеральных кислотах (HCl, H 2 SO 4 ), так как , но в присутствии иодида растворение идет с выделением водорода: Hg 2+ + 4 I – + 2Н + = Hg I 4 2– + Н 2 так как
Слайд 175
175 Образование малорастворимых соединений. Например, потенциал пары Ag + /Ag выражается уравнением Нернста: При введении в раствор Cl - -ионов образуется осадок AgCl, равновесную концентрацию [Ag + ] можно рассчитать по ПР AgCl : Подставляя это выражение в уравнение Нернста, получим:
Слайд 176
176 По аналогии с предыдущим примером, приняв равновесную концентрацию Cl - -ионов за единицу, можно представить потенциал как сумму двух констант. Этот потенциал может рассматриваться как стандартный потенциал полуреакции: AgCl (тв) + e = Ag (тв) +Cl - Введение в раствор хлорид-ионов приводит к значительному снижению потенциала пары Ag + /Ag.
Слайд 177
КОНСТАНТЫ РАВНОВЕСИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Рассмотрим окислительно-восстановительную реакцию: aOx 1 + bRed 2 bOx 2 + aRed 1 Константа равновесия этой реакции имеет вид: Запишем в соответствии с уравнением Нернста редокс-потенциалы пар - участников данной реакции: aOx 1 + ne aRed 1 bRed 2 – ne bOx 2
Слайд 178
178 Если участники этой реакции находятся в химическом равновесии, то E 1 = E 2.
Слайд 179
179 После преобразования и объединения логарифмических членов получим: где m - наименьшее общее кратное числа отданных и принятых электронов.
Слайд 180
180 ПРИМЕНЕНИЕ РЕАКЦИЙ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В КАЧЕСТВЕННОМ АНАЛИЗЕ 1. Для обнаружения ионов : а ) Hg 2+ + Cu Cu 2+ + Hg В присутствии ионов ртути на поверхности медной пластинки появляется блестящий налет. б ) 2Mn 2+ + 5PbO 2 + 4H + 2MnO 4 - + 5Pb 2+ + 2H 2 O Окрашивание раствора в малиновый цвет свидетельствует о присутствии в исследуемом растворе ионов марганца. в ) 2Cr(OH) 4 – + 3H 2 O 2 + 2OH – 2CrO 4 2– + 8H 2 O В присутствии ионов хрома ( ) в результате реакции исследуемый раствор окрашивается в желтый цвет.
Слайд 181
181 2. Для разделения ионов: Например, в ходе анализа катионов V аналитической группы ионы Fe 3+, М g 2+ и Mn 2+ осаждают в виде гидроксидов при наличии окислителя ( H 2 O 2 ). Fe 3+ + 3ОН – Fe (ОН) 3 М g 2+ + 2ОН – М g (ОН) 2 Mn 2+ + H 2 O 2 + 2ОН – МnO(OH) 2 + H 2 O Полученный осадок гидроксидов обрабатывают 3М раствором HNO 3. При этом ионы Fe 3+ и М g 2+ переходят в раствор, а М nO ( OH ) 2 остается в осадке.
Слайд 182
182 3. Для растворения малорастворимых соединений: Осадок М nO ( OH ) 2, полученный при отделении иона Mn 2+ от ионов М g 2+ и Fe 3+, переводят в раствор обработкой 3М HNO 3 в присутствии нескольких капель H 2 O 2. МnO(OH) 2 + 2H + + H 2 O 2 Mn 2+ + 3H 2 O + O 2
Слайд 183
РАСЧЕТ РАВНОВЕСИЙ В РЕДОКС-СИСТЕМАХ Пример 1. Вычислить потенциал водородного электрода в растворе, полученном при смешении 50 мл 0,2 М раствора NaOH с 50 мл 0,4 М раствора СН 3 СООН. Суммарный объем после смешения равен 100 мл. Рассчитаем концентрации реагентов после смешения: Протекает реакция: СН 3 СООН +ОН – СН 3 СОО – + H 2 O Так как концентрация кислоты была в два раза выше концентрации щелочи, то концентрации оставшейся кислоты и образовавшейся соли будут равны
Слайд 184
184 Концентрация ионов Н + в ацетатном буферном растворе определяется равновесием: СН 3 СООН СН 3 СОО – + Н + 0,1-х 0,1+ х х Если х 0,1, то 0,1-х 0,1, 0,1+х 0,1.
Слайд 185
185 Окислительно-восстановительный потенциал водородного электрода рассчитывается по уравнению: Подставляем величину [H + ] в уравнение Нернста :
Слайд 186
186 Пример 2. Вычислить ЭДС гальванического элемента: Hg Hg 2 Cl 2 тв, 0,1 моль/л К Cl 0,1 моль/л Н Cl Н 2 ( Pt ) На электродах протекают полуреакции: Hg 2 2+ + 2е 2 Hg ; Н 2 2Н + + 2е; Окислительно-восстановительные потенциалы этих электродов рассчитывают по уравнениям:
Слайд 187
187 Сначала находят значения равновесных концентраций Hg 2 2+ и Н +. Концентрация ионов Hg 2 2+ определяется равновесием: Hg 2 Cl 2 2Cl - + Hg 2 2+ Следовательно
Слайд 188
188 Равновесная концентрация ионов Н + равна концентрации кислоты НС l [H + ] = 0,1 моль/л. Отсюда ЭДС гальванического элемента составляет:
Слайд 189
189 Пример 3. Вычислить равновесные концентрации ионов MnO 4 –, Mn 2+, HNO 2, NO 3 – в растворе, полученном при смешении равных объемов 0,4М KMnO 4 и 1М HNO 2 при рН = 0. В результате смешения растворов концентрации реагентов будут равны: Взаимодействие MnO 4 – и HNO 2 в кислой среде протекает по уравнению 2MnO 4 – + 5HNO 2 + Н + = 2Mn 2+ + 5NO 3 – + 3Н 2 О 2 х 5 х 0,2-2 х 0,5-5 х MnO 4 – + 8Н + + 5 e = Mn 2+ + 4Н 2 О HNO 2 + Н 2 О -2 e = NO 3 – + 3Н + 2 5
Слайд 190
190 Запишем выражение константы равновесия этого процесса: Численное значение константы найдем по уравнению: Следовательно, величина К = 1. 10 96,6. С учетом значения К обозначим равновесные концентрации реагирующих частиц: [ MnO 4 – ] = 2 х ; [ HNO 2 ] = 5 х ; [ Mn 2+ ] = 0,2-2 х ; [ NO 3 – ] = 0,5-5 х.
Слайд 191
Подставим эти значения в выражение для константы равновесия: Так как K =10 96,6 – очень большая, то x 0,1 и (0,1- х ) 0,1. x =1,58 10 -15 моль/л;
Слайд 192
192 Таким образом, равновесные концентрации реагентов равны: [ MnO 4 – ] = 2. 1,58. 10 –15 = 3,16. 10 –15 моль/л; [ HNO 2 ] = 5. 1,58. 10 –15 = 7,90. 10 –15 моль/л; [ Mn 2+ ] = 0,2 моль/л; [ NO 3 – ] = 0,5 моль/л.
Слайд 193
Пример 4. Использование реакций окисления-восстановления нередко является единственным путем растворения малорастворимых соединений. Рассмотрим это на примере растворения CuS в 10М растворе HCl и в 0,8М растворе HNO 3. Процесс растворения CuS в HCl можно представить уравнением: CuS +2H + Cu 2+ + H 2 S 10-2x x x
Слайд 194
194 Согласно величине К=4,85 10 -16 обозначим равновесные концентрации реагирующих частиц. Если 2 x 10, то (10-2 х ) 10. x=2,2 10 -7 = [Cu 2+ ] моль/л Расчет показывает, что сульфид меди практически нерастворим в 10 М HCl. Растворение сульфида меди в азотной кислоте описывается уравнением: 3CuS +8H + + 2NO 3 - 3Cu 2+ + 2NO + 3S + 4H 2 O (1)
Слайд 195
195 Реакцию (1) можно представить как сумму процессов: (2) CuS Cu 2+ + S 2- K 2 = ПР CuS = [Cu 2+ ][ S 2- ] (3) S 2- + 2H + H 2 S (4) 3H 2 S +2H + + 2NO 3 - 2 NO + 3S + 4H 2 O Для нахождения численного значения константы К 4 уравнение (4) запишем в виде полуреакций: H 2 S – 2e 2H + + S E 0 1 =0,171 B NO 3 - + 4H + + 3e NO + 2H 2 O E 0 2 =0,96 B
Слайд 196
Константу равновесия процесса (4) вычислим по формуле: К 4 = 1. 10 79. Константа равновесия процесса (1) равна: Если обозначить равновесную концентрацию ионов водорода [H + ] = 8x, то по условию задачи, (0,8-8x) ионов водорода прореагирует и прореагирует нитрат-ионов, тогда: [ NO 3 - ] = 0,8 – (0,2 - 2 x ) = 0,6 +2 x.
Слайд 197
197 Рассуждая аналогичным образом, получаем: Подставляя значения равновесных концентраций в выражение константы равновесия уравнения (1), получим: Пренебрегаем малыми величинами 3x и 2x:
Слайд 198
198 Таким образом, концентрация ионов меди в растворе составляет: [ Cu 2+ ] = 0,3 - 3 2,15 10 -6 = 0,3 - 6,45 10 -6 = 0,29999 моль/л. Полученная величина практически не отличается от теоретически возможного значения 0,3 моль/л. Расчет показывает, что даже в разбавленной азотной кислоте сульфид меди хорошо растворяется.
Слайд 199
199 Пример 5. Растворимость малорастворимого соединения значительно возрастает, когда одновременно протекают реакции кислотно-основного взаимодействия, окисления-восстановления и комплексообразования. Рассчитать константу равновесия при растворении сульфида ртути в «царской водке». Реакция растворения описывается суммарным уравнением: 3HgS +8H + + 2NO 3 - +12Cl - 3HgCl 4 2- + 2NO + 3S + 4H 2 O (1)
Слайд 200
200 Реакцию (1) можно представить как сумму процессов: (2) HgS Hg 2+ + S 2- K 2 = ПР HgS = [Hg 2+ ][ S 2- ]=4 10 -53 (3) S 2- + 2H + H 2 S (4) 3H 2 S +2H + + 2NO 3 - NO + 3S + 4H 2 O Значение K 4 вычислено в примере 4. (5) Hg 2+ + 4Сl - HgCl 4 2-
Последний слайд презентации: Аналитическая химия (качественный анализ) курс лекций
201 Большое значение константы равновесия показывает, что равновесие сдвинуто вправо, т.е. под действием сильной кислоты, реакций окисления-восстановления и комплексообразования легко растворяется HgS. В качестве окислителей в аналитических лабораториях применяют чаще всего H 2 O 2, KClO 3, Na 2 S 2 O 8, NaBiO 3, PbO 2, HNO 3, KMnO 4, хлорную и бромную воду. Менее сильными окислителями являются ионы Ag +, Hg 2+, Cu 2+, Fe 3+ и др. В качестве восстановителей применяют : металлические цинк, железо, алюминий, а также SnCl 2, H 2 S, Na 2 SO 3, Na 2 S 2 O 3 и др.