Первый слайд презентации: Лекция 4 Растворы
Раствор – однофазная система переменного состава, состоящая из 2 или более компонентов.
Слайд 2
Раствор состоит из растворенного вещества и растворителя. Растворителем считают тот компонент, агрегатное состояние которого не изменяется при образовании раствора. Если агрегатное состояние компонентов совпадает, то растворителем считается компонент, находящийся в большем количестве.
Слайд 3
В зависимости от агрегатного состояния растворителя растворы бывают : газовые ( воздух –растворенные друг в друге азот, кислород, водород, углекислый, инертные и др. газы); жидкие; твердые (сплавы металлов).
Слайд 4
Вода – бесцветная, прозрачна жидкость, может существовать в 3 агрегатных состояниях – жидком, твердом (лед) и газообразном (пар). Плотность воды при переходе от жидкого состояния к твердому уменьшается, максимальная плотность наблюдается при 4 0 С, когда вода находится в жидком состоянии ( ρ = 1000 кг/м 3 ).
Слайд 5
Кристаллизация воды сопровождается увеличением объема. Кристаллы воды образуют решетку молекулярного типа. Слабый электролит. Сравнительно высокая температура кипения ( 100 0 С ) объясняется сильным межмолекулярным взаимодействием, вызванным водородными связями.
Слайд 6
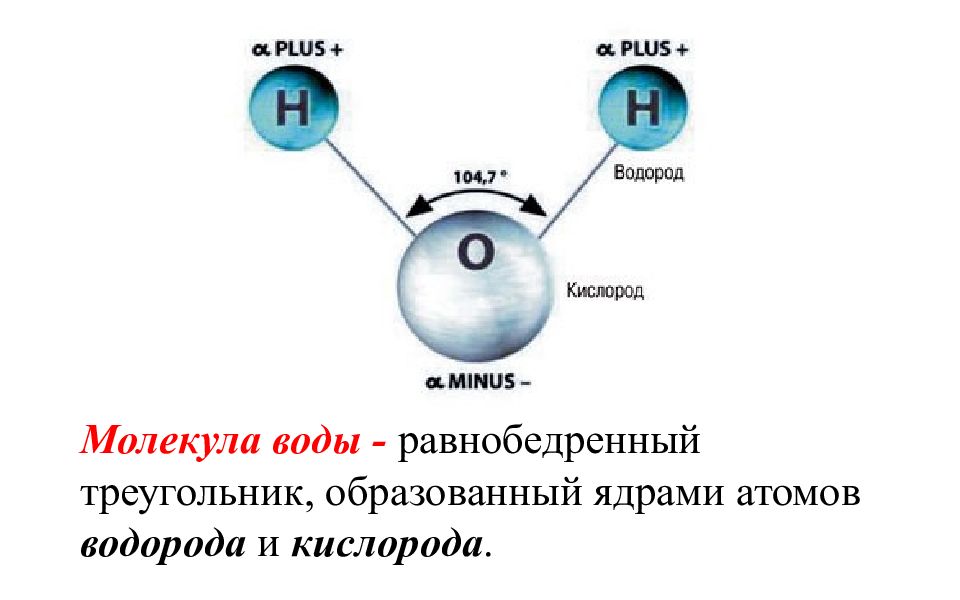
Молекула воды - равнобедренный треугольник, образованный ядрами атомов водорода и кислорода.
Слайд 7
Связь ковалентная полярная, что приводит к асимметрии распределения зарядов и полярности молекулы – молекула диполь. У атома кислорода на внешнем слое есть неподеленная электронная пара, способная к образованию донорно-акцепторных связей.
Слайд 8
Химическая теория растворов Д.И. Менделеева Растворение – физико-химический процесс, который в зависимости от природы веществ – либо экзо-, либо эндотермический. Д. И. Менделеев (1834 -1907гг)
Слайд 9
Растворение сопровождается увеличением энтропии системы (Δ S > 0), с этим связана самопроизвольность процесса растворения, даже, если теплота при этом поглощается. Процесс растворения сопровождается уменьшением энергии Гиббса ( Δ G < 0).
Слайд 10
Химическая теория растворов Д.И. Менделеева: вещества растворяясь в воде образуют с ней химические соединения – гидраты, этот процесс называется гидратацией ; если растворителем является не вода, то соединения называются сольватами, а процесс сольватацией ;
Слайд 11
сольваты и гидраты образованы либо силами электростатического притяжения ( диполь - дипольное взаимодействие ), либо донорно-акцепторным взаимодействием; гидраты и сольваты, как правило, не стойкие вещества;
Слайд 12
гидраты, у которых вода входит в состав кристаллов растворенного вещества называются кристаллогидратами, а содержащаяся в них вода называется кристаллизационной. Пример : медный купорос CuSO 4 · 5 H 2 O (кристаллогидрат сульфата меди); глауберова соль Na 2 SO 4 · 10 H 2 O (кристаллогидрат сульфата меди).
Слайд 13
Растворимость веществ Растворимость ( коэффициент растворимости β [ г/100г H 2 O] ) – это масса вещества, которая может раствориться при данной температуре в 100 г растворителя, образуя насыщенный раствор.
Слайд 14
По растворимости в воде вещества делятся на: растворимые ( Р ) – β >1 [ г/100г H 2 O] ; малорастворимые ( М ) – β = 1÷0,01 [ г/100г H 2 O] ; нерастворимые ( Н ) – β < 0,01 [ г/100г H 2 O].
Слайд 15
Растворимость зависит от: природы растворенного вещества; природы растворителя; температуры; давления.
Слайд 16
1 и 2. Сходство химической природы веществ усиливает их взаимную растворимость: вещества, состоящие из полярных молекул или с ионным типом связи, лучше растворяются в полярных растворителях ; неполярные вещества – лучше растворяются в неполярных растворителях (бензол С 6 Н 6, сероуглерод СS 2 ).
Слайд 17
3 и 4. Влияние Т и Р на растворимость регулируется принципом Ле Шателье: при увеличении температуры увеличивается растворимость тех веществ, растворение которых сопровождается поглощением тепла; если при растворении уменьшается объем системы, то растворимость будет расти с увеличением атмосферного давления (для газовых растворов);
Слайд 18
В зависимости от количества вещества, растворенного в растворителе различают: насыщенные растворы – содержащие максимальное количество растворенного вещества при данной температуре; ненасыщенные растворы – содержат растворенного вещества меньше, чем насыщенные при данной температуре.
Слайд 19
Ненасыщенные растворы с содержанием растворенного вещества менее 1 моль на 1 литр раствора называются разбавленными, более 1 моль/л – концентрированными.
Слайд 20
Способы выражения количественного состава растворов 1) Массовая доля Показывает сколько граммов растворенного вещества содержится в 100 г раствора.
Слайд 21
2) Мольная доля Отношение числа молей растворенного вещества (или растворителя) к сумме молей растворенного вещества и растворителя.
Слайд 22
3) Молярная концентрация (молярность) Отношение количества вещества к объему раствору, показывает число молей растворенного вещества в 1 литре раствора. С М = 0,2 моль/л или 0,2 М
Слайд 23
4) Эквивалентная или нормальная концентрация (нормальность) Отношение количества эквивалентов вещества к объему раствору, показывает число эквивалентов растворенного вещества в 1 литре раствора. С Н = 0,2 моль/л или 0,2 н
Слайд 24
5) Моляльная концентрация (моляльность ) Отношение количества растворенного вещества к массе растворителя, показывает сколько молей растворенного вещества содержится в 1 кг растворителя.