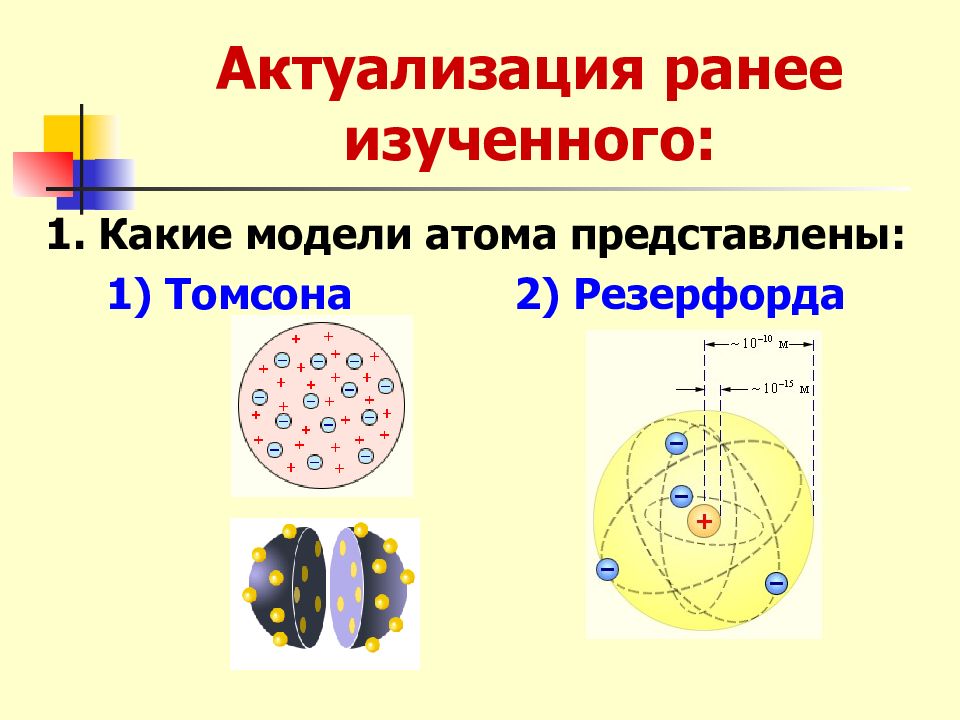
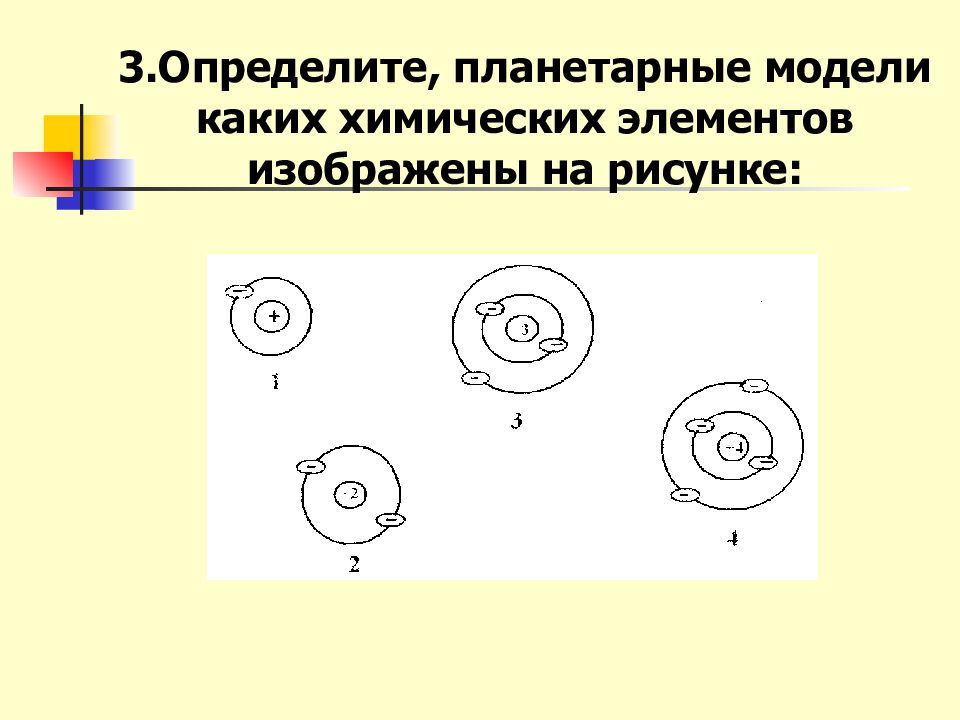
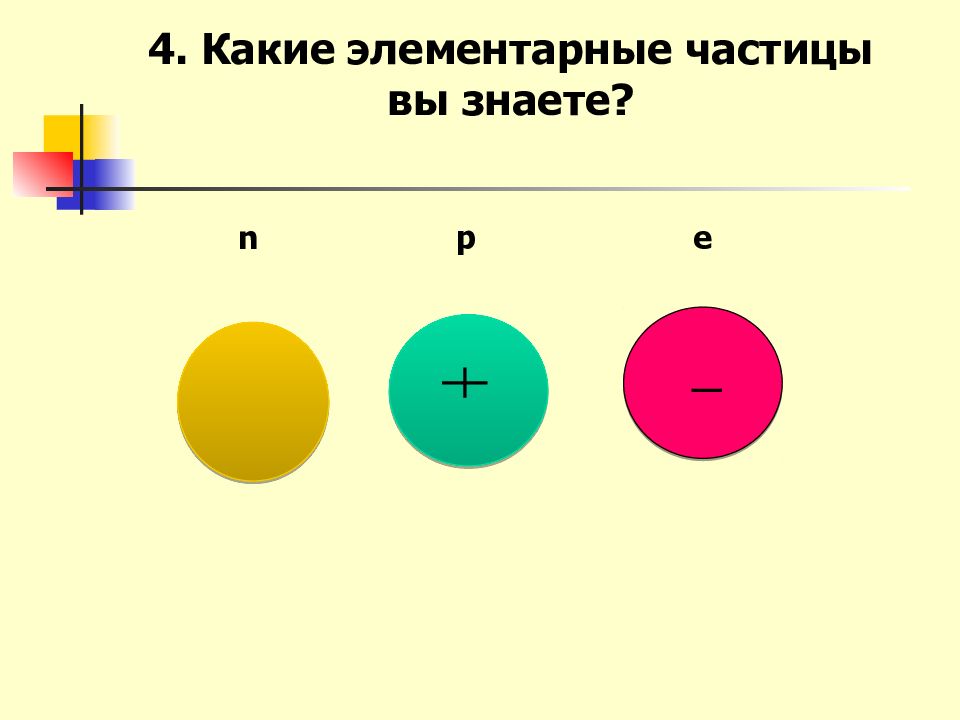
Слайд 2: Актуализация ранее изученного:
1. Какие модели атома представлены: 1) Томсона 2) Резерфорда
Слайд 6: Строение атомного ядра
Вернер Карл Гейзенберг (1901-1976) Дмитрий Дмитриевич Иваненко (1904-1994) Советский физик Д. Д. Иваненко и немецкий физик В. Гейзенберг предложили протонно-нейтронную модель ядра
Слайд 7: Строение атомного ядра
Атомное ядро состоит из частиц двух типов: протонов и нейтронов. Протоны и нейтроны называются нуклонами.
Слайд 9
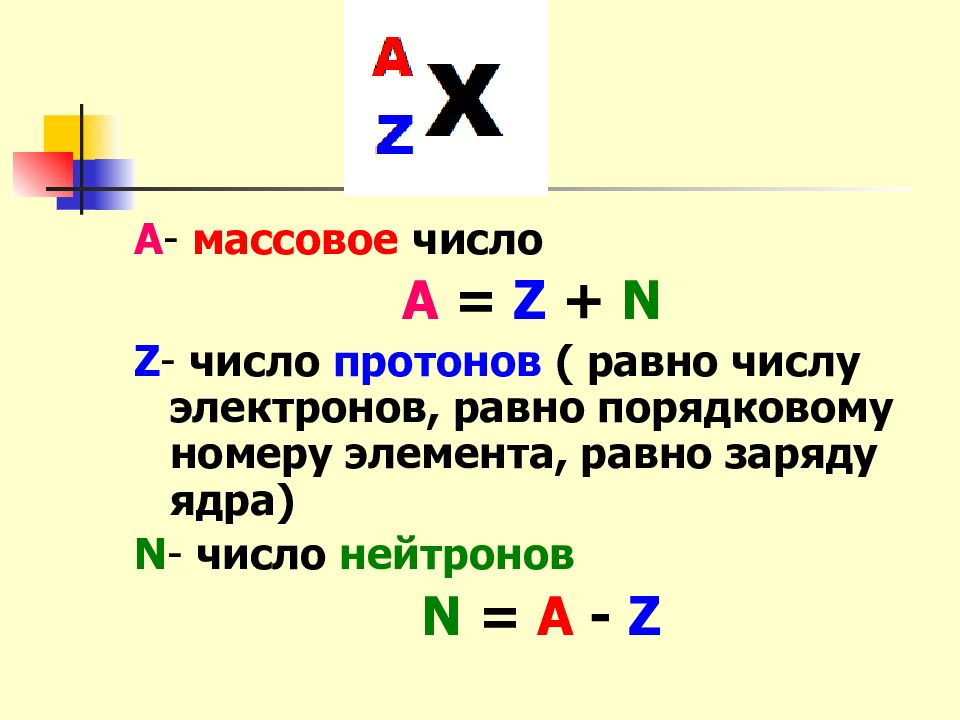
А - массовое число А = Z + N Z - число протонов ( равно числу электронов, равно порядковому номеру элемента, равно заряду ядра) N - число нейтронов N = A - Z
Слайд 10: Решение задач:
№1. Сколько нуклонов содержат ядра фтора 9 19 F, меди 29 64 Cu, хрома 24 52 С r, вольфрама 74 184 W. №2. Определите нуклонный состав ядер: неона, ванадия, ртути, олова, урана.
Слайд 11
- символ нейтрона Открытие нейтрона Нейтрон нестабильная частица: свободный нейтрон за время около 15 мин распадается на протон, электрон и нейтрино – безмассовую нейтральную частицу. Заряд нейтрона равен нулю, а относительная масса – примерно единице.
Слайд 12: Искусственное превращение атомных ядер
Впервые искусственное превращение ядер осуществил Резерфорд в 1919 г. Для разрушения или преобразования ядра нужна очень большая энергия. Носителями такой энергии могут быть альфа-частицы, вылетающие из ядер при радиоактивном распаде. m p = 1,67262·10 –27 кг = 1,007276 а. е. м. = 1836,1 m e q p = 1,60217733·10 –19 Кл
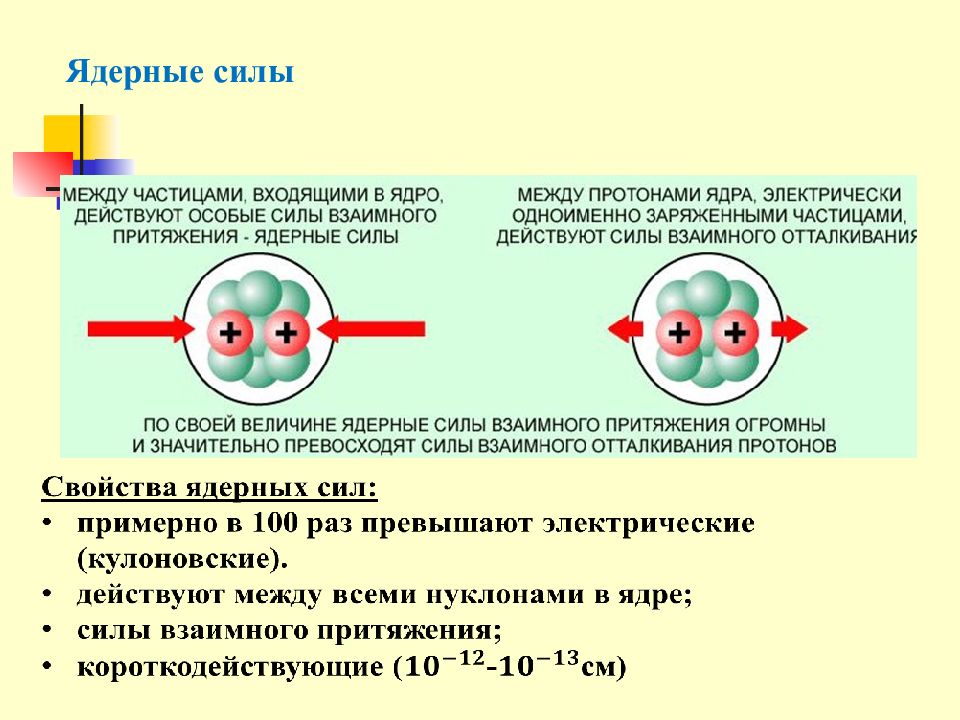
Слайд 13: Ядерные силы
Слайд 14
Плотность ядерного вещества примерно одинакова для всех ядер и ≈1017кг/м3, что значительно больше плотности обычных веществ. нейтрон: mn =1,6748·10-27 кг, заряд qn =0; mp ≈ mn ≈1840 me.
Слайд 15: Изотопы
Изотопы - атомы одного элемента, имеющие одинаковый заряд ядра, но разные массовые числа. Изотопы содержат одинаковое число протонов, но разное число нейтронов. Изотопы имеют одинаковые химические свойства (обусловлены зарядом ядра),но разные физические свойства (обусловлено массой). Все химические вещества имеют изотопы. Заряды атомных ядер изотопов одинаковы, но массы ядер различны.
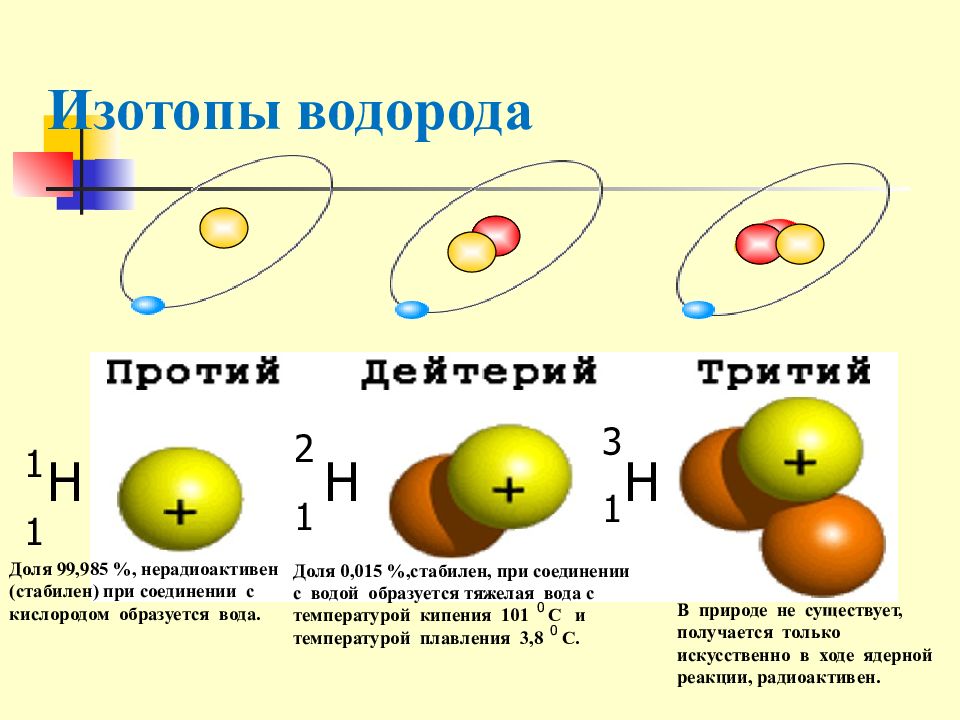
Слайд 16: Изотопы водорода
Доля 99,985 %, нерадиоактивен (стабилен) при соединении с кислородом образуется вода. Доля 0,015 %,стабилен, при соединении с водой образуется тяжелая вода с температурой кипения 101 С и температурой плавления 3,8 С. 0 0 В природе не существует, получается только искусственно в ходе ядерной реакции, радиоактивен. H H H 1 1 2 1 1 3
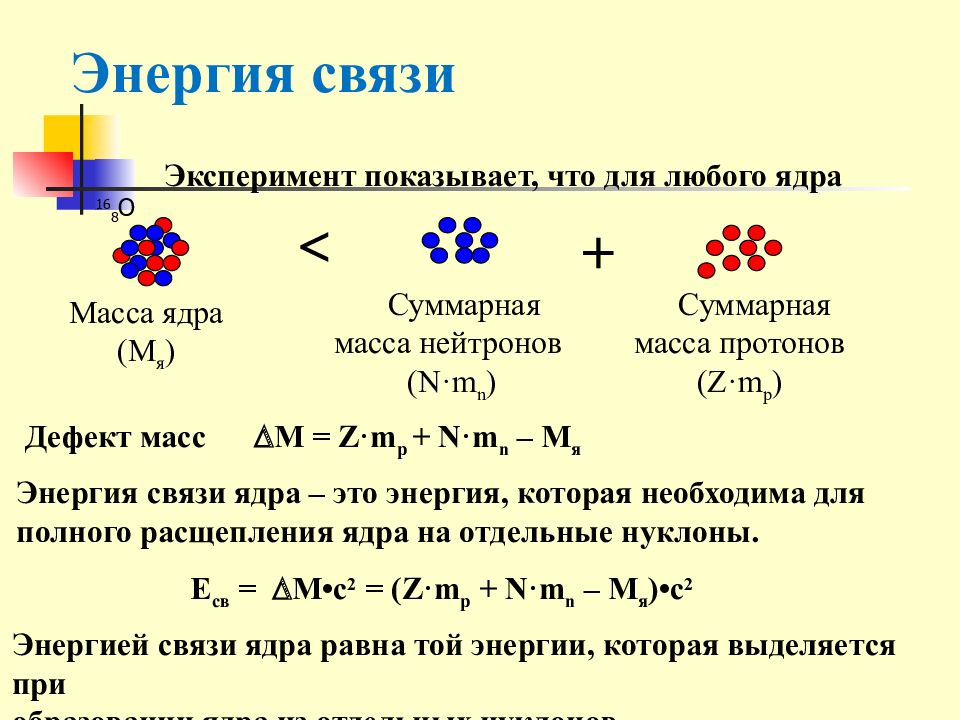
Слайд 17: Энергия связи
Эксперимент показывает, что для любого ядра 16 8 О Масса ядра ( M я ) < + Суммарная масса нейтронов ( N·m n ) Суммарная масса протонов ( Z·m р ) Дефект масс M = Z·m p + N·m n – M я Энергией связи ядра равна той энергии, которая выделяется при образовании ядра из отдельных нуклонов. Е св = M• с 2 = ( Z·m p + N·m n – M я ) •с 2 Энергия связи ядра – это энергия, которая необходима для полного расщепления ядра на отдельные нуклоны.
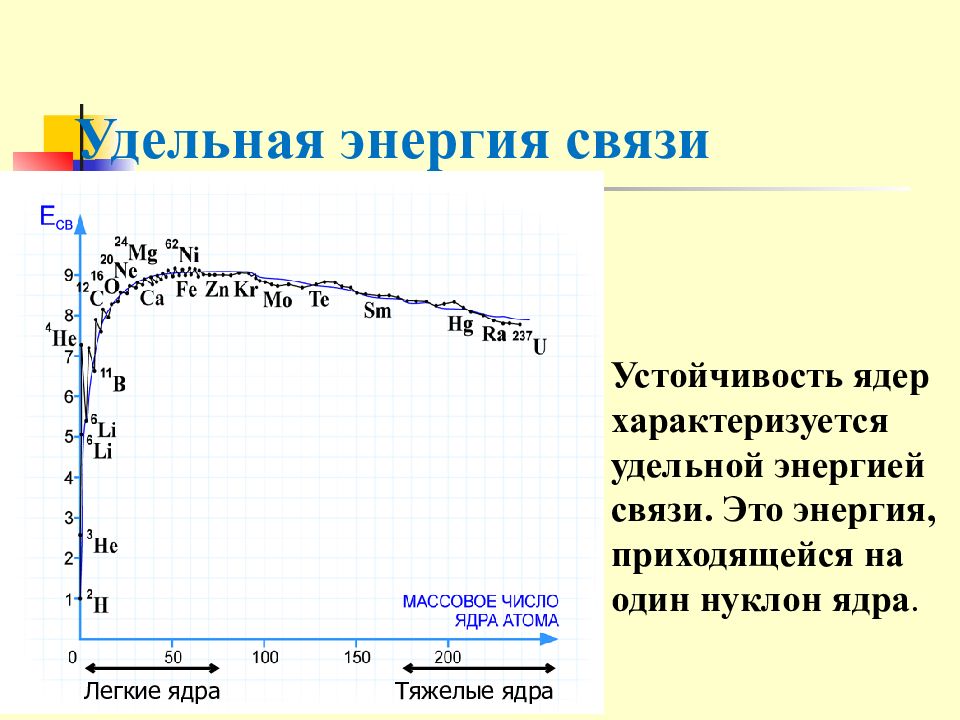
Слайд 18: Удельная энергия связи
Тяжелые ядра Легкие ядра Устойчивость ядер характеризуется удельной энергией связи. Это энергия, приходящейся на один нуклон ядра.
Слайд 19: ДОМАШНЕЕ ЗАДАНИЕ
ИЗУЧИТЬ В УЧЕБНИКЕ ПАРАГРАФ 78. ОТВЕТИТЬ НА ВОПРОСЫ (СЛАЙД 24, 25, 26).
Слайд 20: Решение задач:
№3. Назовите химический элемент, в атомном ядре которого содержатся нуклоны: а) 20р + 20 n ; б) 40р + 51 n ; в) 33р + 42 n ; г) 76р + 114 n.
Слайд 21: Решение задач:
№4 Найти: 1.Массовое число 2.Число протонов 3.Число нейтронов 4.Число электронов 5.Число нуклонов Для следующих элементов: цирконий, германий, фосфор