Первый слайд презентации: Лекция №3 химия «СТРОЕНИЕ АТОМОВ»
Преподаватель: Пашкова Е.В.
Слайд 3
АТОМ - электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. ЯДРО АТОМА - положительно заряженная часть атома, расположена в центре атома, состоит из протонов ( ) и нейтронов ( ). Протон имеет относительную массу 1 и относительный заряд +1. Нейтрон имеет относительную массу 1 и заряд 0.
Слайд 4
ХАРАКТЕРИСТИКА ЯДРА: а) положительный заряд определяется числом протонов в нем и равен порядковому номеру элемента в периодической системе; б) массовое число – А (относительная масса ядра) равно сумме протонов ( Z ) и нейтронов ( N ): A = Z + N, N = A – Z
Слайд 5
ИЗОТОПЫ - атомы одного элемента, имеющие одинаковый заряд ядра, но разное массовое число. У изотопов одного элемента одинаково число протонов, но разное число нейтронов. протий Z = 1 N = 0 дейтерий Z = 1 N = 1 тритий Z = 1 N = 2 Изотопы одного элемента имеют одинаковые хим. св-ва, обозначаются одним химическим символом, занимают одно место в ПС.
Слайд 6
Так как масса атома практически равна массе ядра (масса электронов ничтожно мала), то каждый изотоп элемента характеризуется, как и ядро, массовым числом, а элемент – атомной массой. АТОМНАЯ МАССА ЭЛЕМЕНТА – это среднее арифметическое между массовыми числами изотопов элемента с учетом процентного содержания каждого изотопа в природе. ИЗОБАРЫ - изотопы разных элементов, имеющих одинаковое массовое число, но разный заряд ядер – хим. св-ва отличаются. Таким образом, существование изотопов и изобаров показывает, что свойства атома определяются зарядом ядра.
Слайд 7
ЭЛЕКТРОН, ē - элементарная частица с ничтожно малой массой: m ē = 9,1·10 -23 г, заряд q ē =1,6·10 -19 Кл, относительный заряд ē = -1. Число ē в атоме равно порядковому номеру элемента. Электрон имеет двойственную природу, обладает свойствами волны (дифракция, интерференция) и частицы (имеет массу, производит давление).
Слайд 8
Принцип неопределенности Гейзенберга - движение носит вероятностный характер, нельзя установить координаты нахождения электрона в атоме, можно говорить о вероятности его нахождения в той или иной области. АТОМНАЯ ОРБИТАЛЬ это область пространства, в которой с наибольшей вероятностью может находиться электрон.
Слайд 9
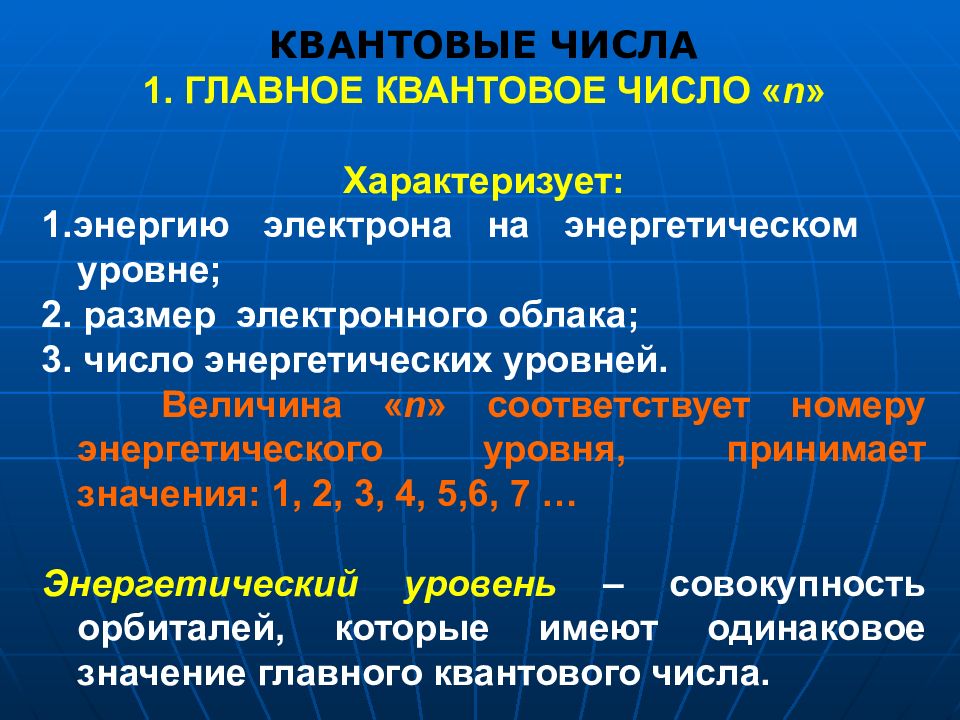
КВАНТОВЫЕ ЧИСЛА 1. ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО « n » Характеризует: 1.энергию электрона на энергетическом уровне; 2. размер электронного облака; 3. число энергетических уровней. Величина « n » соответствует номеру энергетического уровня, принимает значения: 1, 2, 3, 4, 5,6, 7 … Энергетический уровень – совокупность орбиталей, которые имеют одинаковое значение главного квантового числа.
Слайд 10
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО УРОВНЯМ: 1. число электронов равно порядковому номеру элемента; 2. число энергетических уровней в атоме равно номеру периода периодической системы, в котором находится элемент; 3. максимальное число ē на уровне определяется по формуле N =2 n 2, где n – номер уровня, значение главного квантового числа; 4. уровень с максимальным числом ē называется завершенный
Слайд 11
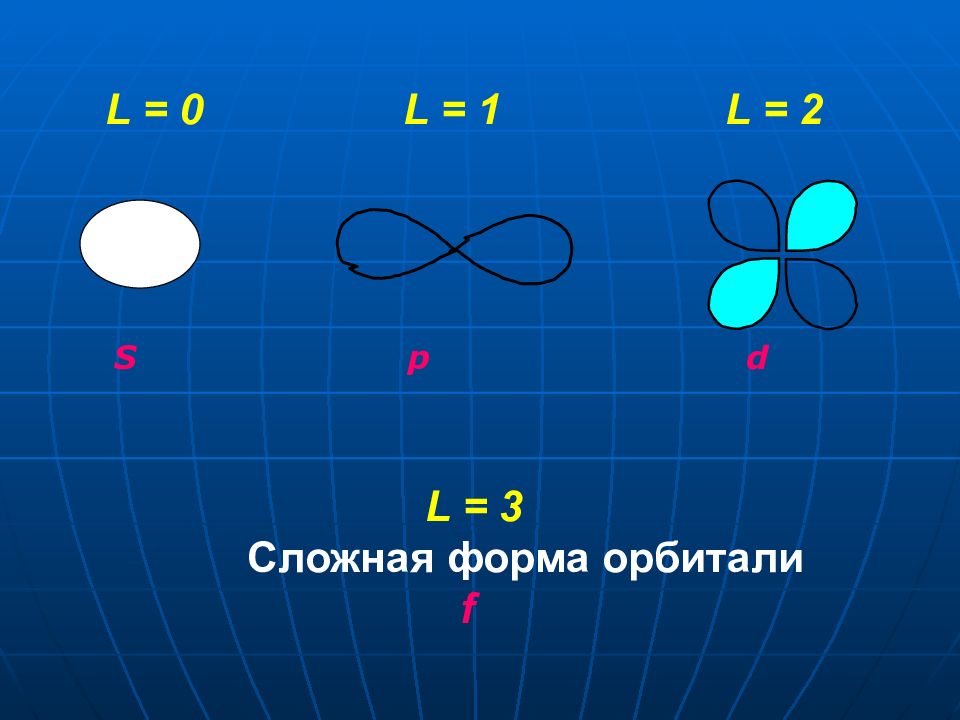
2. ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО « L » Характеризует: 1. энергию электрона на подуровне; 2. форму электронной орбитали; 3. число подуровней на данном уровне l – принимает значение от 0 до n - 1. Каждому значению соответствует определенная форма орбитали, которую принято обозначать буквами ( s, p, d, f ) и называть подуровнями
Слайд 13
n = 1 l = 0 1s n = 2 l = 0, 1 2 s 2 p n = 3 l = 0, 1, 2 3s 3p 3d n = 4 l = 0, 1, 2, 3 4 s 4 p 4 d 4 f ЧИСЛО ПОДУРОВНЕЙ НА КАЖДОМ УРОВНЕ Распределение электронов по уровням: 1. число подуровней на уровне равно номеру уровня; 2. подуровни заполняются электронами в порядке возрастания энергии s p d f ; 3. максимальное число ē на подуровнях следующее: s 2 p 6 d 10 f 14
Слайд 14
3. МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО « m ». Характеризует: расположение орбитали в пространстве показывает число атомных орбиталей на данном подуровне m – принимает значения (- l …0…+ l ) Графически изображается в виде квадратика ,называется магнитной квантовой ячейкой. Одну ячейку максимально могут занимать 2 ē. Число ячеек на подуровнях следующее: s 2 - , p 6 - , d 10 - , f 14 -
Слайд 15
4. СПИНОВОЕ КВАНТОВОЕ ЧИСЛО « m S » Характеризует движение электрона вокруг собственной оси, не связанное с его движением вокруг ядра. m S - принимает значения +1/2 и –1/2. В электронно-графических формулах обозначается ↑ или ↓.
Слайд 16
1. ПРИНЦИП МИНИМАЛЬНОЙ ЭНЕРГИИ из всех свободных орбиталей электрон занимает ту, которая имеет наименьшую энергию. 2. ПРИНЦИП ПАУЛИ в атоме не может быть даже двух электронов с одинаковыми значениями всех четырех квантовых чисел. ПРИНЦИПЫ И ПРАВИЛА РАСПРЕДЕЛЕНИЯ ЭЛЕКТРОНОВ В АТОМЕ
Слайд 17
3. ПРАВИЛО ГУНДА орбитали подуровня заполняются электронами таким образом, чтобы суммарное спиновое число было максимально. Другими словами, квантовые ячейки одного подуровня заполняются сначала по одному электрону, а затем по второму с противоположно направленным спином. ПРИНЦИПЫ И ПРАВИЛА РАСПРЕДЕЛЕНИЯ ЭЛЕКТРОНОВ В АТОМЕ
Слайд 18
4. ПРАВИЛО КЛЯЧКОВСКОГО заполнение электронных уровней атомов с увеличением порядкового номера происходит последовательно с ростом суммы n + l, а при равных значениях n + l осуществляется то, которому соответствует большее число l. 1 s n + l = 1 + 0 = 1 заполняется раньше 2 s n + l = 2 + 0 = 2 4 s n + l = 4 + 0 = 4 заполняется раньше 3 d n + l = 3 + 2 = 5