Слайд 2: Истинная масса атомов
Истинные массы атомов очень малы масса атома водорода – 1,66 10 -24 г масса атома углерода – 2 10 -23 г масса атома кислорода – 2,66 10 -23 г
Слайд 3
Единица сравнения это - Атомная Единица Массы (а.е.м.) 1 а.е.м. = 1/12 массы атома углерода.
Слайд 4
Абсолютная масса атома равна относительной атомной массе, умноженной на 1 а.е.м.
Слайд 5: Относительная атомная масса показывает, насколько масса атома больше 1/12 массы атома углерода
Относительная атомная масса обозначается А r.
водород 1 1,00797 кислород углерод 15,9994 12,01115 8 6 А r (Н) =1 А r (С) =12 А r (О) =16
Слайд 8: Дробное значение А r
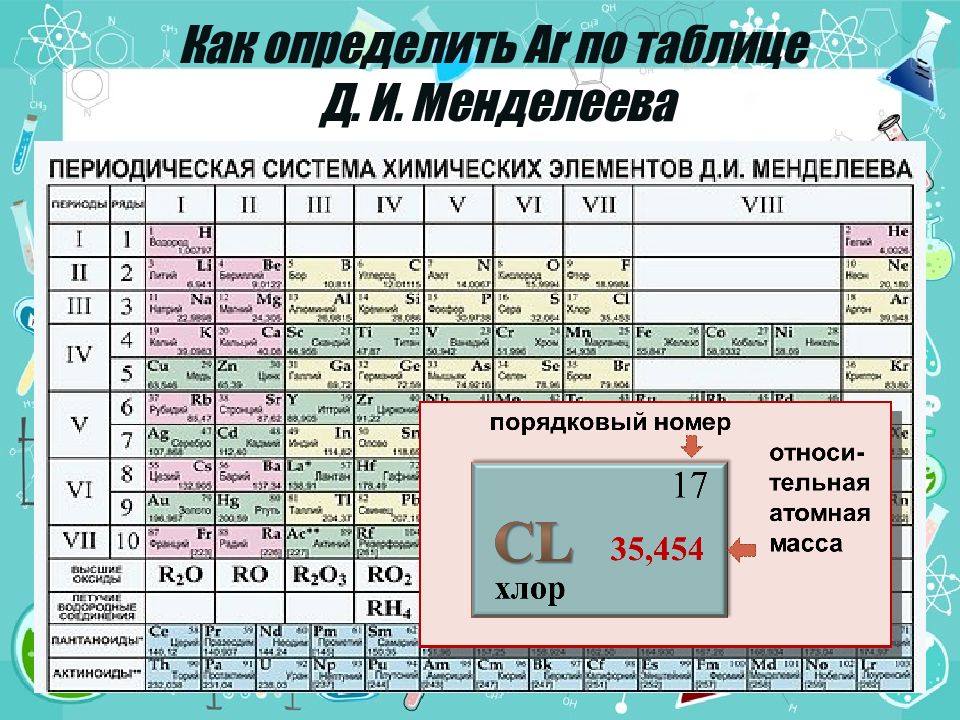
хлор 17 35,454 В расчётах используют значения относительных атомных масс, округлённые до целых чисел, но в случае с хлором для более точных вычислений пользуются дробной величиной А r (С l )=35,5
Слайд 9
Относительная молекулярная масса -ЭТО ЧИСЛО, КОТОРОЕ ПОКАЗЫВАЕТ ВО СКОЛЬКО РАЗ МАССА МОЛЕКУЛЫ ДАННОГО ВЕЩЕСТВА БОЛЬШЕ 1/12 МАССЫ ИЗОТОПА УГЛЕРОДА-12. Буквенное обозначение Mr Безмерная величина
Слайд 10
Вычислить относительную молекулярную массу веществ М r( Н 2 О)=2хА r( Н) +А r( О) =2х1+16 =18 М r( СО 2 )= А r( С)+ 2 хА r( О) = 12+ 2х16 = 44 М r( К 3 РО 4 )= 3хА r( К) + А r( Р)+4хА r( О) = 3х39+31+4 х16=202 Самостоятельное решение в тетради СаСО 3, С u О, NaNO 3, H 2 SO 4