Первый слайд презентации: Термодинамика негіздері
Молекулалардың еркіндік дәрежесі. Молекулалардың еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы Термодинамиканың бірінші бастамасы Газдың көлемі өзгергендегі жұмысы Жылу сыйымдылық Термодинамиканың бірінші бастамасын изопроцестерге қолдану Адиаба талық процесс. Политроп тық процесс Циклдік процесс. Қайтымды және қайтымсыз процес тер Энтропия Термодинамиканың екінші бастамасы Жылу қозғалтқыштары және мұздатқыш машиналар. Карно циклі және оның идеал газдағы п.ә.к-і
Слайд 2: Молекулалардың еркіндік дәрежесі
Термодинамикалық жүйенің U ішкі энергиясы – жүйе микробөлшектерінің (атомдардың, молекулалардың, электрондардың, ядролардың және т.б.) бейберекет (жылулық) қозғалысының және осы бөлшектердің өзара әсерлесуінің э нергиясы болып табылады. Еркіндік дәрежесінің саны – бұл жүйенің кеңістіктегі орнын анықтайтын тәуелсіз айнымалылардың (координаттардың) саны. i = 5 i = 3 i = 6
Слайд 3
Молекулалардың еркіндік дәрежесі бойынша энергияның біркелкі таралуының Больцман заңы : термодинамикалық тепе-теңдік күйдегі статистикалық жүйе үшін, әрбір ілгерілмелі немесе айналмалы қозғалыстың еркіндік дәрежесіне орташа алғанда kT/ 2-ге тең кинетикалық энергиядан келеді, ал әрбір тербелмелі еркіндік дәрежесі – орташа kT -ға тең энергияға ие. – молекуланың орташа энергиясы – газдың бір молінің ішкі энергиясы – газдың кез-келген массасының ішкі энергиясы
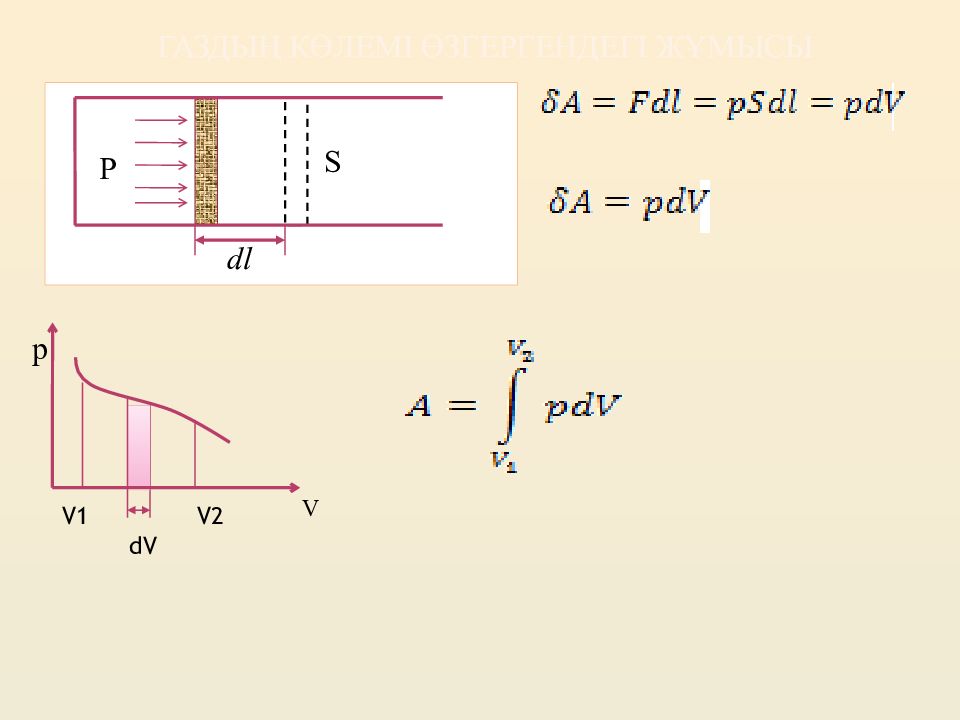
Слайд 4: Термодинамиканың бірінші бастамасы
Термодинамиканың бірінші бастамасы : жүйеге берілетін жылу, оның ішкі энергиясын өзгертуге және сыртқы күштерге қарсы жасалған жұмысына кетеді. Егер жүйе периодты түрде бастапқы күйге келетін болса, оның ішкі энергиясының өзгерісі U =0. Сонда, термодинамиканың бірінші бастамасына сәйкес, яғни, бірінші текті мәңгі қозғалтқыш — сырттан берілетін энергиядан көп мөлшерде жұмыс жасайтын қозғалтқыштың болуы мүмкін емес.
Слайд 6: Жылу сыйымдылық
Заттың меншікті жылу сыйымдылығы Мол ьдік жылу сыйымдылық Меншікті жылу сыйымдылық с пен мольдік С m жылу сыйымдылық арасындағы байланыс: Майер теңдеуі
Слайд 7: Термодинамиканың бірінші бастамасын изопроцестерге қолдану
Изохор алық процесс P V 1 2 3 Изобар алық процесс p V V1 V2 1 2
Слайд 8
Изотерми ялық процесс p V Адиабат алық деп жүйе мен қоршаған орта арасында жылу алмасуынсыз ( Q = 0) өтетін процесті айтамыз. адиабаталық процестің теңдеуі
Слайд 9
p V V1 V2 Жылу сыйымдылық тұрақты болып қалатын процесс политроп тық деп аталады. – политропа көрсеткіші
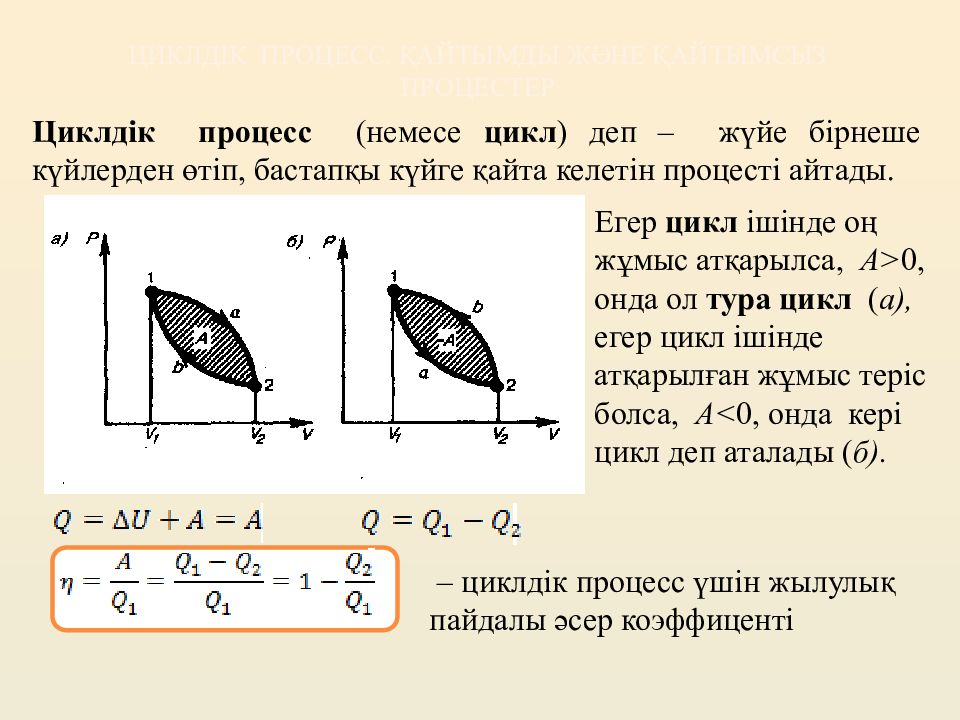
Слайд 10: Циклдік процесс. Қайтымды және қайтымсыз процес тер
Циклдік процесс (немесе цикл ) деп – жүйе бірнеше күйлерден өтіп, бастапқы күйге қайта келетін процесті айтады. Егер цикл ішінде оң жұмыс атқарылса, A> 0, онда ол тура цикл ( а ), егер цикл ішінде атқарылған жұмыс теріс болса, A< 0, онда кері цикл деп аталады ( б ). – циклдік процесс үшін жылулық пайдалы әсер коэффиценті
Слайд 11: Энтропия
Э нтропи я түсінігін 1865 жылы Р. Клаузиу с енгізген болатын. Оның физикалық мағынасын түсіндіру үшін изотермиялық процесс кезінде дененің алған Q жылу мөлшерінің жылу беретін дененің Т температурасына қатынасын қарастырады, оны келтірілген жылу мөлшері деп атайды. Дифференциалы Q / T болып табылатын күй функциясы энтропи я деп аталады және S деп белгіленеді. Қайтымды процестер үшін энтропия өзгерісі: Қайтымсыз циклды орындайтын жүйенің энтропиясы: Клаузиус теңсіздігі : Энтропия аддити втік қасиетке ие: жүйенің энтропия сы жүйеге кіретін денелердің энтропияларының қосындысына тең. Больцман формуласы энтропияға статистикалық тұрғыда түсіндіруге мүмкіндік береді: энтропия жүйенің ретсіздік шамасы болып табылады.
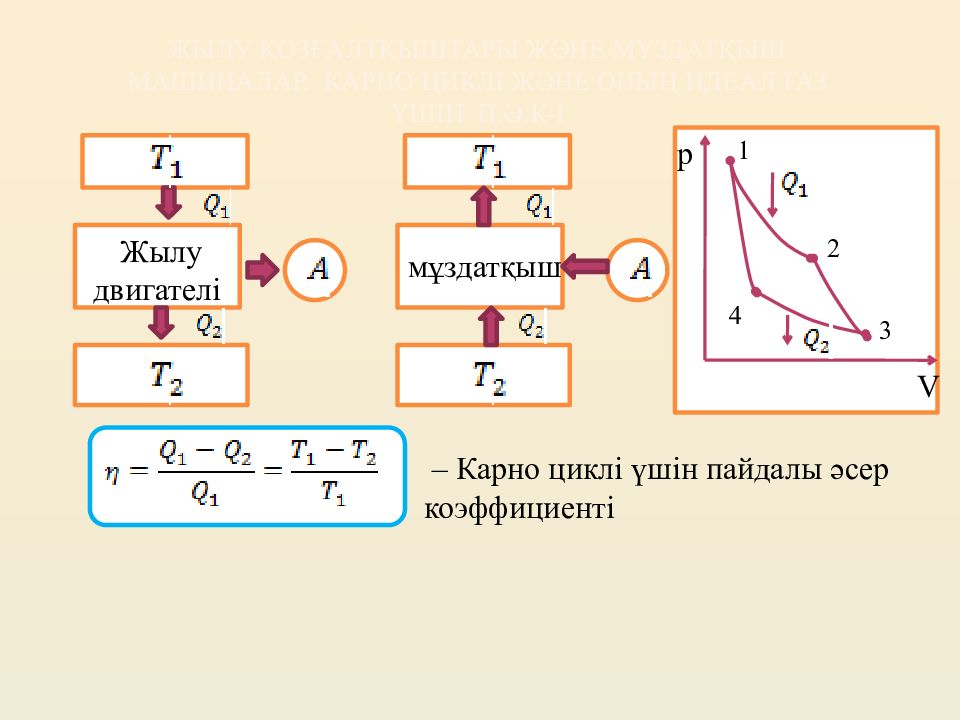
Слайд 12: Термодинамиканың екінші бастамасы
Термодинамиканың екінші бастамасының қысқаша тұжырымдамасы: тұйық жүйеде жүретін процестерде, энтропия кемімейді. 1) Кельвин бойынша: жалғыз нәтижесі – қыздырғыштан алынған жылуды жұмысқа айналдыру болып табылатын циклдік процестің болуы мүмкін емес 2) Клаузиус бойынша: жалғыз нәтижесі – жылудың суық денеден ыстық денеге өтуі болып табылатын циклдік процестің болуы мүмкін емес. Термодинамиканың үшінші бастамасы немесе Нернст — Планк теоремасы: температура ноль Кельвинге жуықтаған сайын, тепе-теңдік күйдегі барлық денелердің энтропиясы нолге ұмтылады: