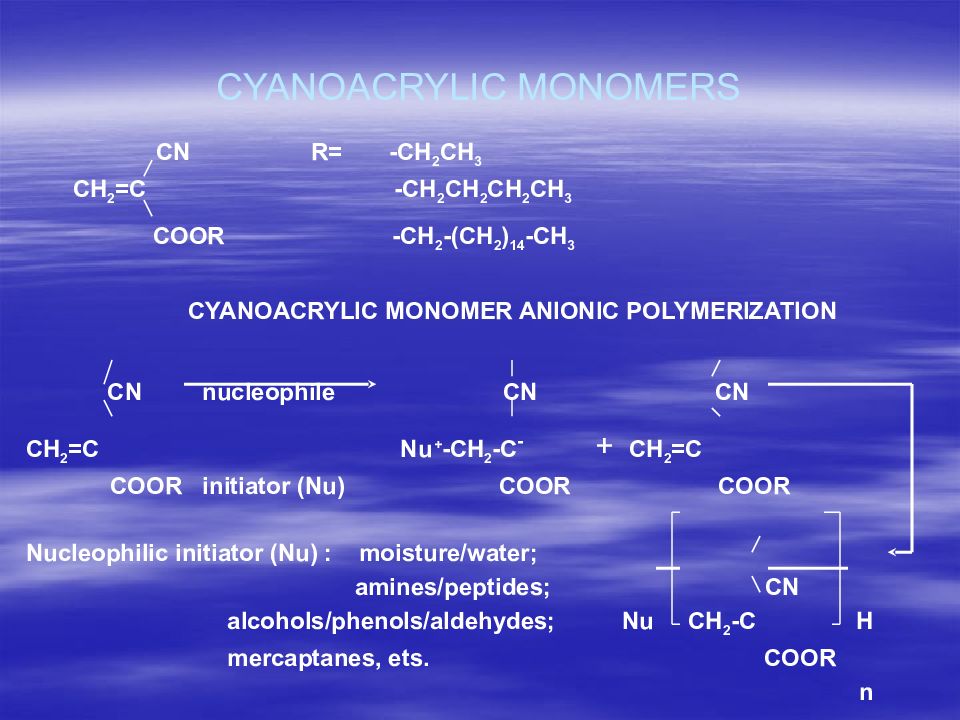
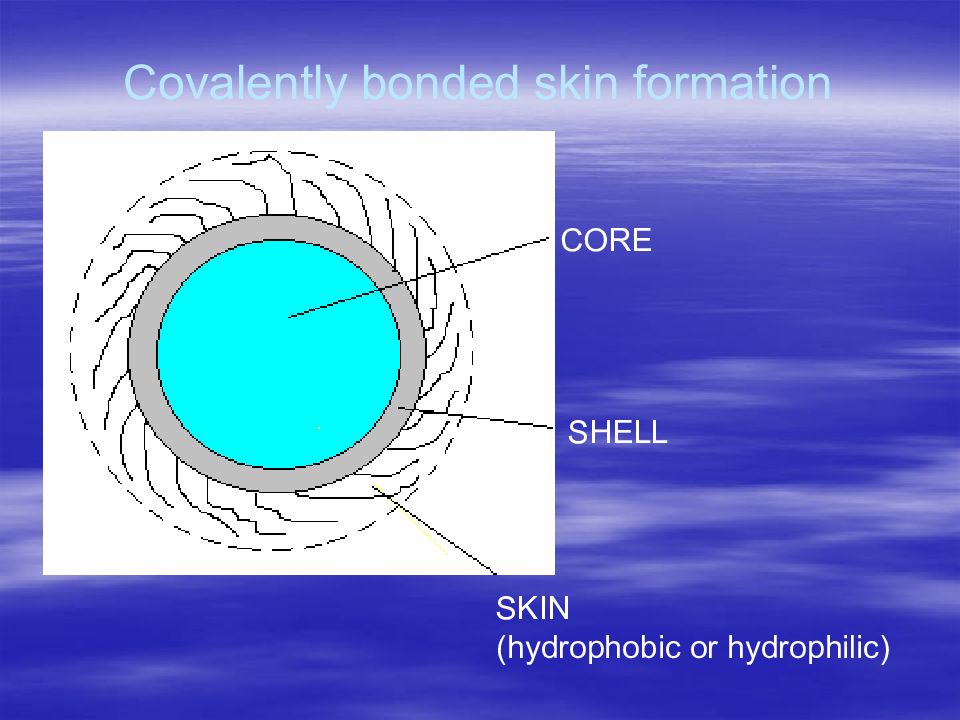
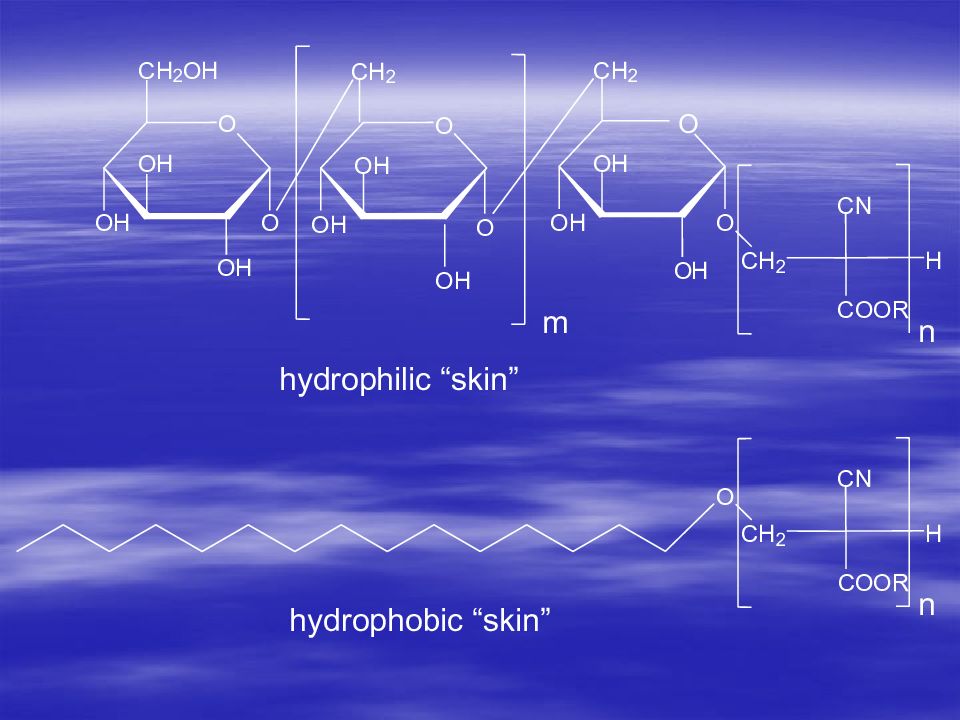
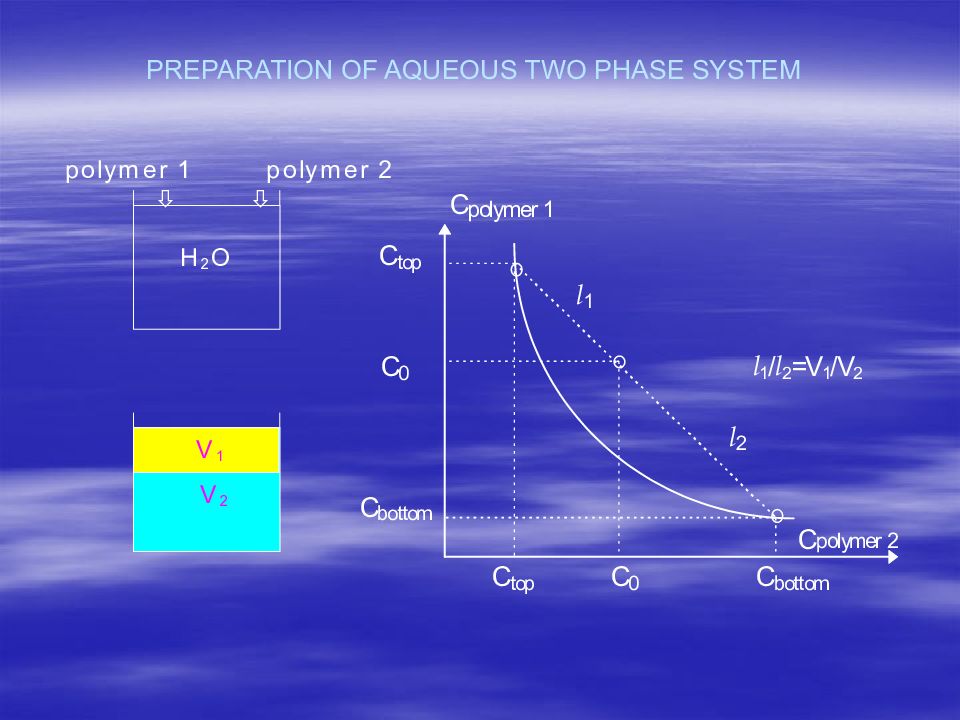
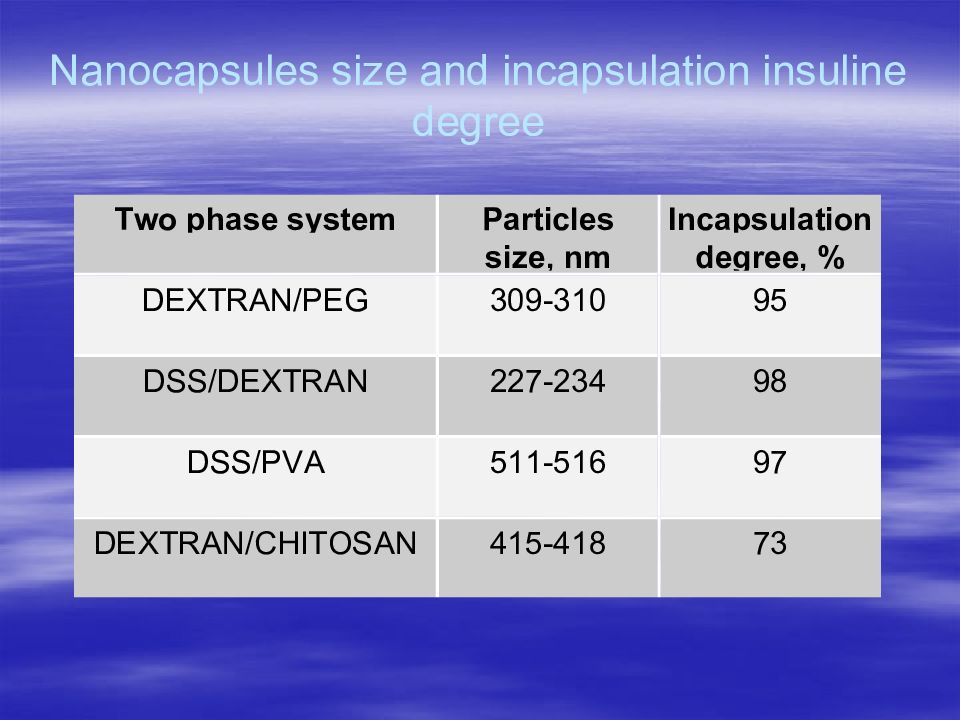
Первый слайд презентации: В.А.Дятлов Введение в технологию полимеров медико-биологического назначения
1 В.А.Дятлов Введение в технологию полимеров медико-биологического назначения. Курс для специальности 25.02, специализации 25.05.04 Федеральное агентство по образованию Российской Федерации Российский Химико-технологический Университет им. Д.И.Менделеева Кафедра Химической технологии пластических масс Москва, 2010
Слайд 2
2 Введение в технологию полимеров медико-биологического назначения Часть 1 Введение. Тема 1 Основные понятия и термины. «Биополимеры» и «Медицинские полимеры» Понятия, характеризующие взаимодействие полимера с организмом. Применение полимеров в медико-биологических областях. Рынок медицинских полимеров и изделий из них.
Слайд 3: Введение. Основные понятия и термины
3 Введение. Основные понятия и термины «Биополимеры» - природные высокомолекулярные соединения, образующиеся в результате жизнедеятельности живых организмов или их синтетические аналоги. «Медицинские полимеры» - любые типы природных или синтетических полимеров приготовленные для использования в медицинских целях. Полимеры медико-биологического назначения – любые типы природных или синтетических полимеров приготовленные для применения связанного с жизнедеятельностью животных или растительных биологических систем. «Медицинские полимеры» Водорастворимые – полимеры, выполняющие свою основную функцию в виде водного раствора, либо в виде гидрогеля. Вводимые в организм (в кровь)в виде раствора Выделяющиеся в раствор (кровь) из нерастворимого носителя Нерастворимые – полимеры, выполняющие свою основную функцию в твердом стеклообразном, либо в высокоэластическом состоянии. Сохраняют твердое состояние как можно дольше (протезы костей и т.д.) Растворяются (рассасываются) после выполнения своей функции (шовный материал, замещение кожи).
Слайд 4: Введение
4 Введение. Области применения полимерных материалов классифицируемые как Медико-биологические Материалы, применяемые для замещения (замены) и при хирургическом лечении органов и тканей (имплантаты, протезы). Полимеры для биологически активных систем (компонентов лекарственных систем, вакцин, полимерных биоцидов, биорегуляторов). Материалы для биоинженерных методов (полимеры носители, среды). Носители биокатализаторов. Мембранные и сорбционные материалы для разделения и очистки биологически активных веществ (диализаторы, гемосорбенты и т.д.). Полимерные материалы для биоанализа (диагностикумы, биосенсоры) Полимерные материалы для создания изделий медицинского назначения и медицинской техники, используемых вне организма (трубки, катетеры, электроды, белье и т.д.). Полимеры для растениеводства. Полимерные компоненты применяемые в пищевой промышленности. Компоненты косметических материалов (шампуней, декоративной косметики) и трансдермальных терапевтических систем (мазей, кремов, пластырей).
5 Введение. Рынок медицинских полимеров и изделий из них. Рынок некоторых изделий медицинского назначения производимых с использованием медицинских полимеров в США в 2002-2003 г Объем продаж в год $MM Общие расходы на здравоохранение 1,400,000 Медицинских полимеров в общем 9,000 Изделия для кардиологии и кардиохирургии 6,000 Изделия для хирургии опорно-двигательного аппарата 4,700 Изделия для лечения ран 3,700
Слайд 6: Введение. Рынок медицинских полимеров и изделий из них
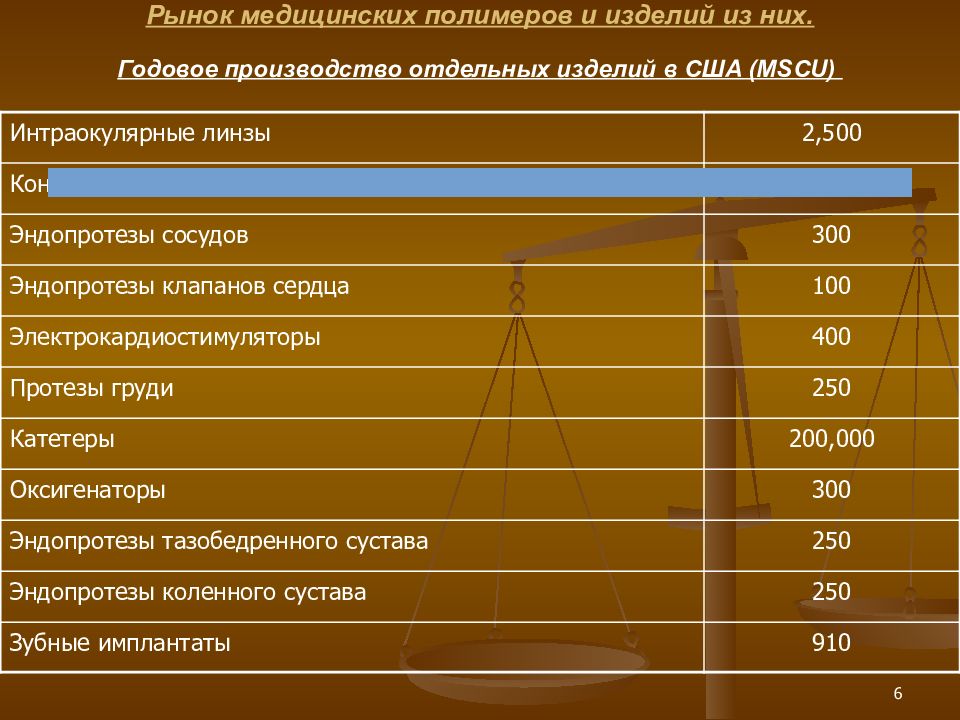
6 Введение. Рынок медицинских полимеров и изделий из них. Годовое производство отдельных изделий в США ( MSCU ) Интраокулярные линзы 2,500 Контактные линзы 30,000 Эндопротезы сосудов 300 Эндопротезы клапанов сердца 100 Электрокардиостимуляторы 400 Протезы груди 250 Катетеры 200,000 Оксигенаторы 300 Эндопротезы тазобедренного сустава 250 Эндопротезы коленного сустава 250 Зубные имплантаты 910
7 Введение. Основные понятия и термины. Понятия, характеризующие взаимодействие полимера с живым организмом Биологическая инертность (биоинертность) – свойство полимера (материала) не оказывать биологического действия на окружающие ткани и организм в целом и быть устойчивым к воздействию со стороны организма. Биоинертный полимер (материал) – материал способный, находясь в контакте с организмом, никак с ним не взаимодействовать. Биологическая совместимость ( биосовместимость) – свойство полимера (материала) выполнять определенную функцию в организме в течение требуемого времени без вреда для организма. Биодеградация – способность полимера (материала) к уменьшению массы (размера) в процессе функционирования в организме. Старый термин – рассасываемость. Биоэрозия - частный случай биодеградации. Распад твердого импланта с поверхности.
Слайд 8: Введение. Основные понятия и термины. Понятия, характеризующие взаимодействие полимера с живым организмом
8 Введение. Основные понятия и термины. Понятия, характеризующие взаимодействие полимера с живым организмом Биореакционная способность ( biotransformation) – способность полимера вступать в химические реакции под воздействием окружающих тканей и сред. Биодеструкция ( biodegradation) – частный случай биореакционной способности. Распад основной или боковой цепи полимера. Биозамещение ( biosubstitution ) – относится к импланту и отражает процесс замещения материала живой тканью. Биозамещение обычно идет параллельно с биодеградацией но не обязательно. Гемосовместимость ( hemocompatibility) – способность полимера (материала) не оказывать вредного воздействия на кровь. Тромборезистентность (атромбогенность) – частный случай гемосовместимости, свойство материала не инициировать образование тромба. Тромбогенный материал – материал вызывающий тромбоз и инициирующий свертывание крови.
Слайд 9: Введение. Основные понятия и термины. Термины принятые для описания материалов, применяемых для замещения (замены) и при хирургическом лечении органов и тканей
9 Введение. Основные понятия и термины. Термины принятые для описания материалов, применяемых для замещения (замены) и при хирургическом лечении органов и тканей. Имплантат – медицинский объект, изготовленный из неживых природных или синтетических материалов, помещенный в человеческое тело для выполнения той или иной функции, и находящийся в контакте с кровью и лимфой. Имплантат – чужеродный объект, вводимый в организм на срок не менее 30 дней ( US Society of Biomaterials 1998). Имплантат может быть погружен в ткани организма полностью или частично. Эндопротез – частный случай имплантата - изделие вводимое в организм для замены (замещения) поврежденного (или удаленного) органа или части органа и выполняющее в той или иной мере его функции. Заменители жидких тканей крови и лимфы – не являются имплантатами и рассматриваются как отдельная группа лекарственных средств. Зкзопротезы – внешние ортопедические протезы, а так же искусственные органы используемые екстракорпорально (вне организма), не являются имплантатами.
Слайд 10
10 Введение в технологию полимеров медико-биологического назначения Часть 1 Введение. Тема 2 Иерархия элементов организма. Элементы общей морфологии клетки. Морфология тканей. Строение и функция некоторых органелл участвующих в отторжении медицинских полимеров.
Слайд 11
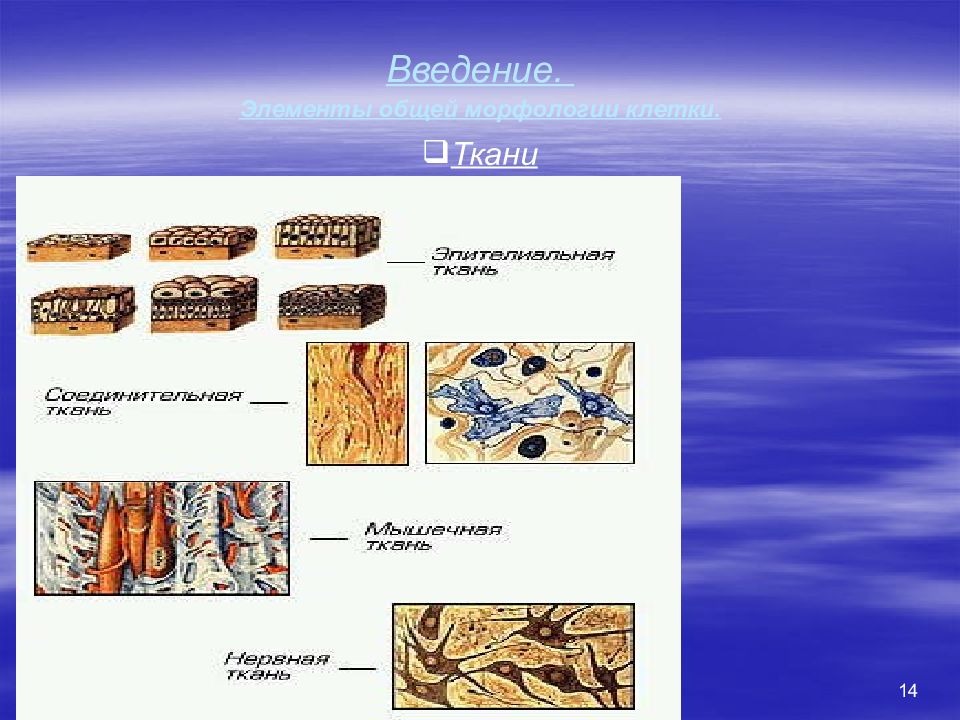
11 Введение. Иерархия элементов организма. Клетки Ткани Эпителиальная. Соединительная. Собственно соединительная. Костная. Хрящевая. Жировая. Жидкие ткани (кровь, лимфа). Мышечная. Нервная. Органы Сердце. Почки и т.д. Системы органов Пищеварительная. Имунная. Ретикуло-эндотелиальная.
Слайд 12
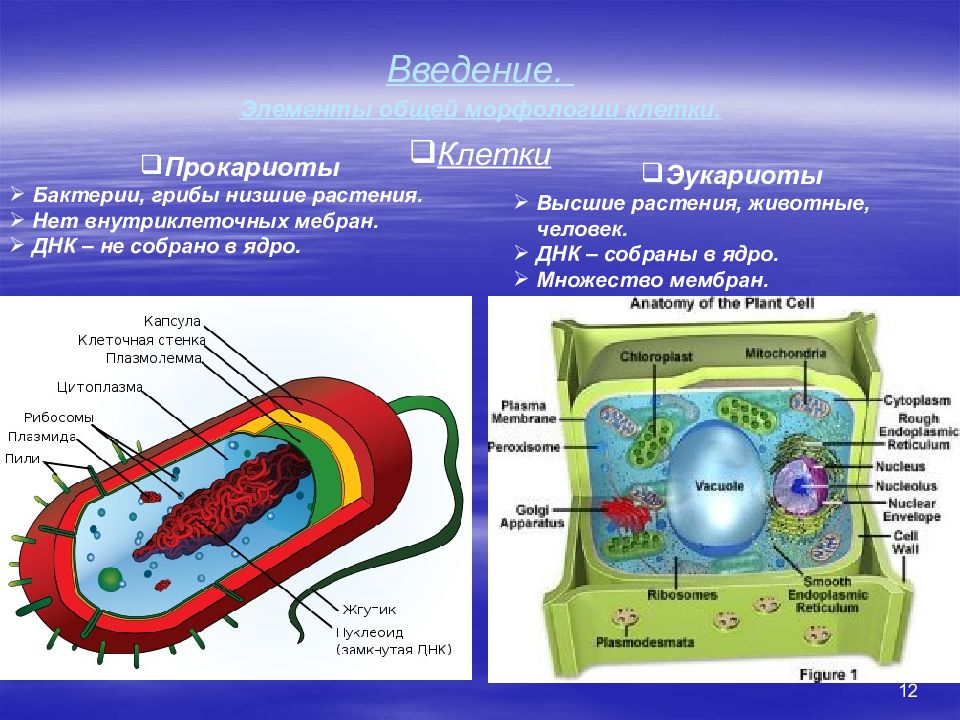
12 Введение. Элементы общей морфологии клетки. Клетки Прокариоты Бактерии, грибы низшие растения. Нет внутриклеточных мебран. ДНК – не собрано в ядро. Эукариоты Высшие растения, животные, человек. ДНК – собраны в ядро. Множество мембран.
Слайд 13
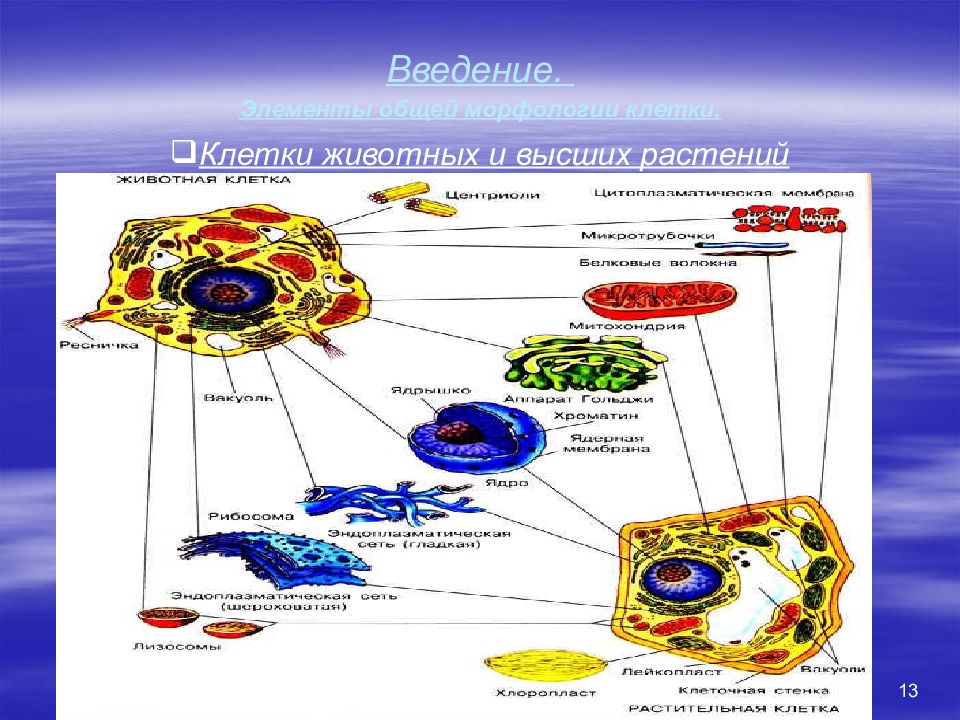
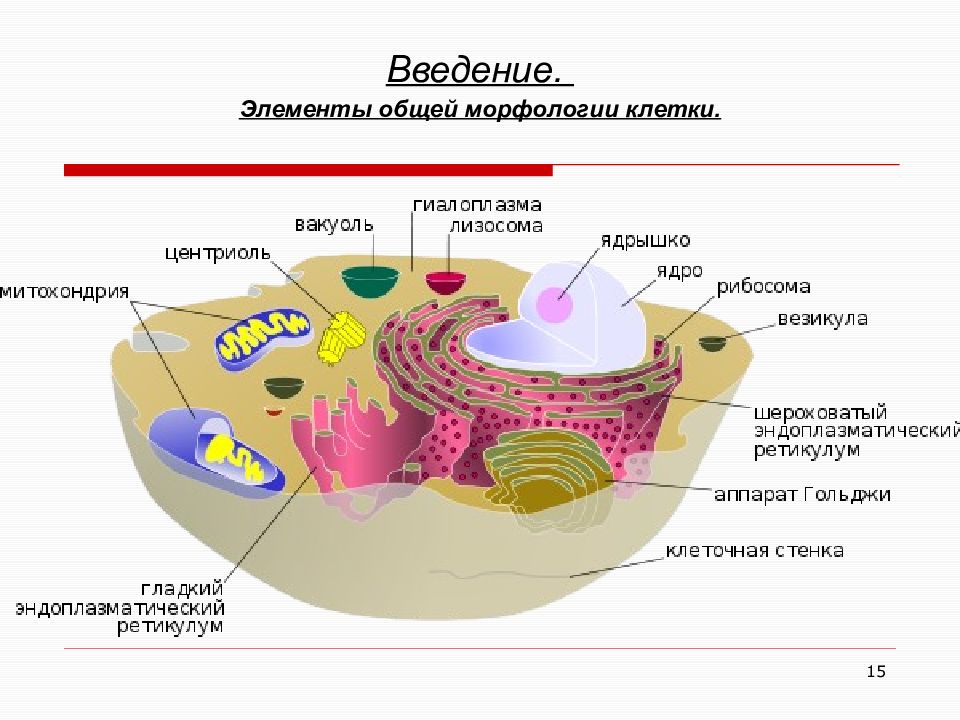
13 Введение. Элементы общей морфологии клетки. Клетки животных и высших растений
Слайд 16
16 Введение. Элементы общей морфологии клетки. Органелла Функция Клеточная стенка, Поверхностный Аппарат Клетки (ПАК) Изолирующая, транспортная, каталитическая, рецепторно-сигнальная и контактная Ядрышко Комплекс рибонуклеиновых кислот с белками. Синтез рибосом. Ядро Вместилище всего генного аппарата. Ядерная оболочка Мембрана, ограничивающая ядро и ДНК. Цитоплазма Жидкая среда клетки Центросома, центриоли Центр митоза (транспорт при делении) Микроворсинки Увеличивают поверхность мембраны Эндоплазматический ретикулум складчатый (шероховатый) Крепление рибосом и «созревание» белков Вакуоли Вместилише для хранения и транспорта Внутриклеточные белковые нити и трубочки Внутриклеточный скелет, сократительный аппарат и транспорт. Лизосома Апоптоз, лизис. Митохондрия Цикл Кребса, синтез АТФ (прокариот). Пероксисома Перекисное окисление. Рибосома Синтез белка и ферментов. Эндоплазматический ретикулум гладкий Транспорт белка против градиента, единое с мембраной ядра, нейтрализация ядов, депо кальция
Слайд 17
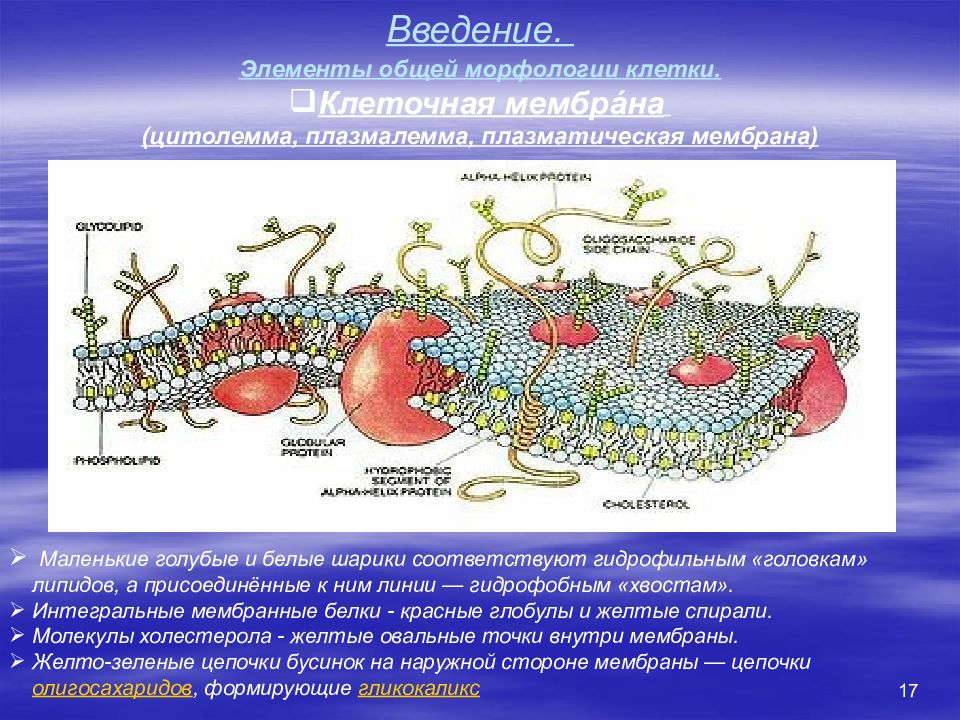
17 Введение. Элементы общей морфологии клетки. Клеточная мембра́на (цитолемма, плазмалемма, плазматическая мембрана) Маленькие голубые и белые шарики соответствуют гидрофильным «головкам» липидов, а присоединённые к ним линии — гидрофобным «хвостам». Интегральные мембранные белки - красные глобулы и желтые спирали. Молекулы холестерола - желтые овальные точки внутри мембраны. Желто-зеленые цепочки бусинок на наружной стороне мембраны — цепочки олигосахаридов, формирующие гликокаликс
Слайд 18
18 Введение. Элементы общей морфологии клетки. Поверхностный аппарат клетки (ПАК) В поверхностный аппарат клетки (ПАК) входят связанные друг с другом: Надмембранный комплекс, или гликокаликс. Наружная клеточная мембрана, или плазмалемма. Субмембранный комплекс. Плазмалемма Основу клеточной мембраны составляет билипидный слой, Белки мозаично расположены в билипидном слое отдельными молекулами и комплексами. Соотношение белков к липидам у эукариот 1:1 Молекулы интегральных белков могут пересекать билипидный слой. Полуинткгральные - частично погружены в липидный слой. Периферические - располагаются на поверхности. Холестерол – располоден внутри билипидного слоя между жирными хвостами гликолипидов и фосфолипидов. Обеспечивает жесткость мембране. Надмембранный комплекс (гликокаликс) У эукариот состоит из углеводов - компонентов гликолипидов и гликопротеинов плазмалеммы. Кроме углеводов, в состав гликокаликса относят периферические белки над билипидным слоем. Более сложные варианты надмембранного комплекса встречаются у растений (клеточная стенка из целлюлозы), грибов и членистоногих (наружный покров из хитина). Субмембранный комплекс Характерен только для эукариотических клеток. Состоит из разнообразных белковых нитевидных структур: Тонких фибрилл. Микрофибрилл. Скелетных фибрилл и микротрубочек. Они связаны друг с другом белками и формируют опорно-сократительный аппарат клетки ПАК представляет собой структурно целостную систему. Субмембранный комплекс связан с белками плазмалеммы, которые, в свою очередь, связаны с надмембранным комплексом. Это позволяет ему выполнять функции: изолирующую, транспортную, каталитическую, рецепторно-сигнальную и контактную.
Слайд 19
19 Введение. Элементы общей морфологии клетки. Функции Мембран Мембрана наружная - плазмолемма - входит в состав ПАК. Внутриклеточные мембраны - разделяют клетку на специализированные замкнутые отсеки - органеллы в которых поддерживаются определенные условия внутриклеточной среды. Функции Барьерная (изолирующая) — обеспечивает регулируемый, избирательный, пассивный и активный обмен веществ с окружающей средой.Например, мембрана пероксисом защищает цитоплазму от опасных для клетки пероксидов. Избирательная проницаемость - проницаемость мембраны для различных атомов или молекул зависит от их размеров, заряда и свойств. Избирательная проницаемость обеспечивает отделение клетки и клеточных компартментов от окружающей среды и снабжение их необходимыми веществами. Матричная — обеспечивает определенное взаиморасположение и ориентацию мембранных белков, их оптимальное взаимодействие; Механическая — обеспечивает автономность клетки, ее внутриклеточных структур, также соединение с другими клетками (в тканях). Транспортная — через мембрану происходит транспорт веществ в клетку и из клетки. Транспорт через мембраны обеспечивает: доставку питательных веществ, удаление конечных продуктов обмена, секрецию различных веществ, создание ионных градиентов, поддержание в клетке соответствующего pH и ионной концентрации, которые нужны для работы клеточных ферментов. Частицы не способные пересечь фосфолипидный бислой, но необходимые для клетки, могут проникнуть сквозь мембрану через специальные белки-переносчики (транспортеры) и белки-каналы или путем эндоцитоза. Пассивный транспорт - вещества пересекают липидный бислой без затрат энергии, путем диффузии. Облегчённая диффузия - веществу помогает пройти через мембрану какая-либо специфическая молекула. У этой молекулы может быть канал, пропускающий вещества только одного типа. Активный транспорт - требует затрат энергии, так как происходит против градиента концентрации. На мембране существуют специальные белки-насосы, в том числе АТФаза, которая активно вкачивают в клетку ионы калия и выкачивают из неё ионы натрия. Энергетическая — при фотосинтезе в хлоропластах и клеточном дыхании в митохондриях в их мембранах действуют системы переноса энергии, в которых также участвуют белки; Рецепторно -сигнальная — некоторые белки, находящиеся в мембране, являются рецепторами (молекулами, при помощи которых клетка воспринимает те или иные сигналы). Осуществление генерации и проведения биопотенциалов. Проведение нервного импульса за счет Na-K потенциала. Ферментативная — мембранные белки нередко являются ферментами. Например, плазматические мембраны эпителиальных клеток кишечника содержат пищеварительные ферменты. Контактная (маркировка клетки) — на мембране есть антигены, действующие как маркеры — «ярлыки», позволяющие опознать клетку. Это гликопротеины, играющие роль «антенн».Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. Контакт клеток - с помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей. Распознавание - позволяет иммунной системе распознавать чужеродные антигены.
Слайд 20
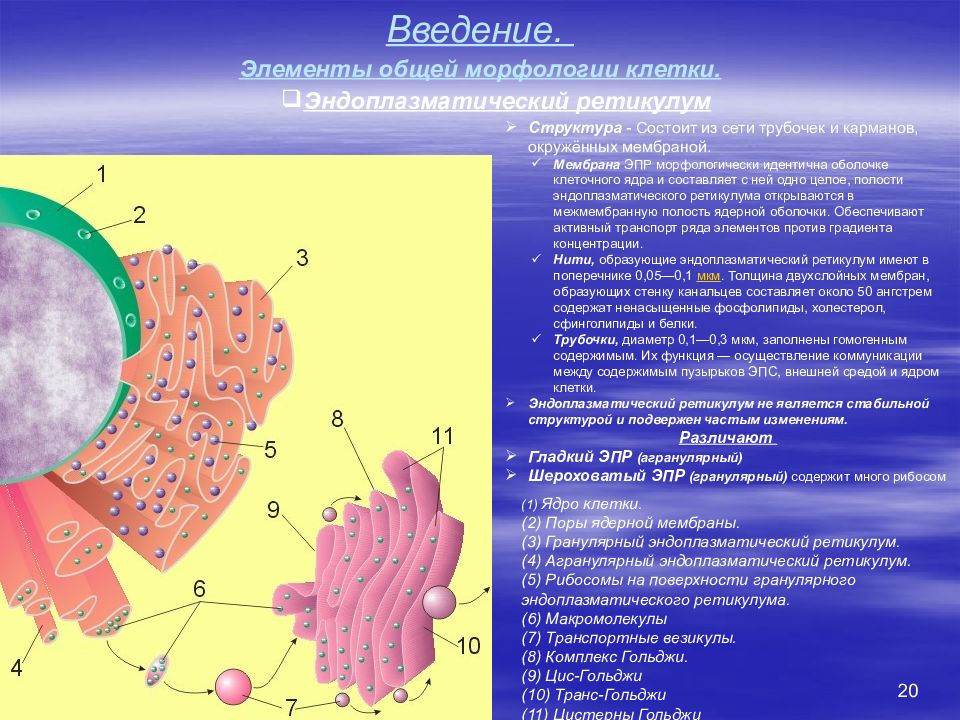
20 Введение. Элементы общей морфологии клетки. (1) Ядро клетки. (2) Поры ядерной мембраны. (3) Гранулярный эндоплазматический ретикулум. (4) Агранулярный эндоплазматический ретикулум. (5) Рибосомы на поверхности гранулярного эндоплазматического ретикулума. (6) Макромолекулы (7) Транспортные везикулы. (8) Комплекс Гольджи. (9) Цис-Гольджи (10) Транс-Гольджи (11) Цистерны Гольджи Структура - Состоит из сети трубочек и карманов, окружённых мембраной. Мембрана ЭПР морфологически идентична оболочке клеточного ядра и составляет с ней одно целое, полости эндоплазматического ретикулума открываются в межмембранную полость ядерной оболочки. Обеспечивают активный транспорт ряда элементов против градиента концентрации. Нити, образующие эндоплазматический ретикулум имеют в поперечнике 0,05—0,1 мкм. Толщина двухслойных мембран, образующих стенку канальцев составляет около 50 ангстрем содержат ненасыщенные фосфолипиды, холестерол, сфинголипиды и белки. Трубочки, диаметр 0,1—0,3 мкм, заполнены гомогенным содержимым. Их функция — осуществление коммуникации между содержимым пузырьков ЭПС, внешней средой и ядром клетки. Эндоплазматический ретикулум не является стабильной структурой и подвержен частым изменениям. Различают Гладкий ЭПР (агранулярный) Шероховатый ЭПР (гранулярный) содержит много рибосом Эндоплазматический ретикулум
Слайд 21
21 Введение. Элементы общей морфологии клетки. Нейтрализация ядов Гладкий эндоплазматический ретикулум клеток печени принимает активное участие в нейтрализации всевозможных ядов. Ферменты гладкого ЭПР присоединяют к молекулам токсичных веществ гидрофильные радикалы, в результате чего повышается растворимость токсичных веществ в крови и моче, и они быстрее выводятся из организма. При непрерывном поступления ядов, медикаментов или алкоголя образуется большее количество агранулярного ЭПР, что повышает дозу действующего вещества, необходимую для достижения прежнего эффекта. Роль ЭПР как депо кальция Концентрация ионов кальция в гладком ЭПР может достигать 10 −3 моль, в то время как в цитозоле составляет порядка 10 −7 моль (в состоянии покоя). Высвобождение ионов кальция из ЭПР происходит под действием инозитолтрифосфата и многих других стимуляторов, кальций высвобождается из ЭПР способом облегченной диффузии в комплексе с белком кальмодулином. Возврат кальция в ЭПР обеспечивается активным транспортом. При этом мембрана ЭПР обеспечивает активный перенос ионов кальция против градиентов концентрации больших порядков. Поступление кальция в ЭПР, и освобождение ионов кальция из ЭПР находится во взаимосвязи с физиологическими механизмами возбуждения различных систем клетки. Изменение концентрация ионов кальция в цитозоле влияет на множество внутриклеточных и межклеточных процессов, таких как: Активация или инактивация ферментов. Экспрессия генов. Синаптическая пластичность нейронов. Сокращения мышечных клеток. Освобождение антител из клеток иммунной системы. Некоторые функции гладкого эндоплазматического ретикулума.
Слайд 22
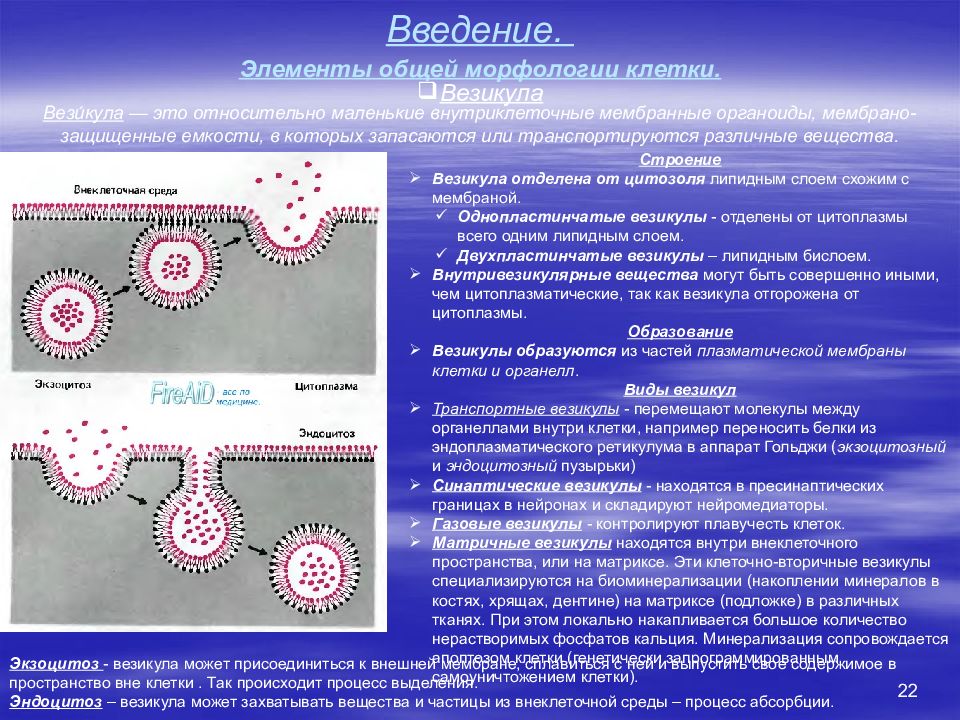
22 Введение. Элементы общей морфологии клетки. Везикула Строение Везикула отделена от цитозоля липидным слоем схожим с мембраной. Однопластинчатые везикулы - отделены от цитоплазмы всего одним липидным слоем. Двухпластинчатые везикулы – липидным бислоем. Внутривезикулярные вещества могут быть совершенно иными, чем цитоплазматические, так как везикула отгорожена от цитоплазмы. Образование Везикулы образуются из частей плазматической мембраны клетки и органелл. Виды везикул Транспортные везикулы - перемещают молекулы между органеллами внутри клетки, например переносить белки из эндоплазматического ретикулума в аппарат Гольджи ( экзоцитозный и эндоцитозный пузырьки) Синаптические везикулы - находятся в пресинаптических границах в нейронах и складируют нейромедиаторы. Газовые везикулы - контролируют плавучесть клеток. Матричные везикулы находятся внутри внеклеточного пространства, или на матриксе. Эти клеточно-вторичные везикулы специализируются на биоминерализации (накоплении минералов в костях, хрящах, дентине) на матриксе (подложке) в различных тканях. При этом локально накапливается большое количество нерастворимых фосфатов кальция. Минерализация сопровождается апоптозом клетки (генетически запрограммированным самоуничтожением клетки). Вези́кула — это относительно маленькие внутриклеточные мембранные органоиды, мембрано-защищенные емкости, в которых запасаются или транспортируются различные вещества. Экзоцитоз - везикула может присоединиться к внешней мембране, сплавиться с ней и выпустить свое содержимое в пространство вне клетки. Так происходит процесс выделения. Эндоцитоз – везикула может захватывать вещества и частицы из внеклеточной среды – процесс абсорбции.
Слайд 23
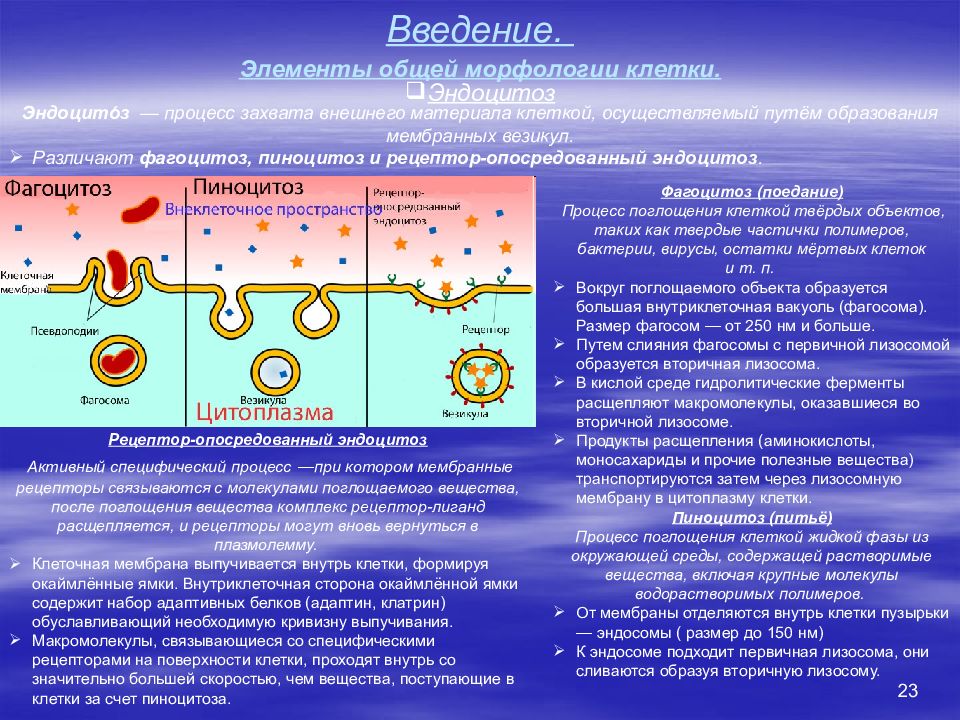
23 Введение. Элементы общей морфологии клетки. Эндоцитоз Эндоцито́з — процесс захвата внешнего материала клеткой, осуществляемый путём образования мембранных везикул. Различают фагоцитоз, пиноцитоз и рецептор-опосредованный эндоцитоз. Фагоцитоз (поедание) Процесс поглощения клеткой твёрдых объектов, таких как твердые частички полимеров, бактерии, вирусы, остатки мёртвых клеток и т. п. Вокруг поглощаемого объекта образуется большая внутриклеточная вакуоль (фагосома). Размер фагосом — от 250 нм и больше. Путем слияния фагосомы с первичной лизосомой образуется вторичная лизосома. В кислой среде гидролитические ферменты расщепляют макромолекулы, оказавшиеся во вторичной лизосоме. Продукты расщепления (аминокислоты, моносахариды и прочие полезные вещества) транспортируются затем через лизосомную мембрану в цитоплазму клетки. Пиноцитоз (питьё) Процесс поглощения клеткой жидкой фазы из окружающей среды, содержащей растворимые вещества, включая крупные молекулы водорастворимых полимеров. От мембраны отделяются внутрь клетки пузырьки — эндосомы ( размер до 150 нм) К эндосоме подходит первичная лизосома, они сливаются образуя вторичную лизосому. Рецептор-опосредованный эндоцитоз Активный специфический процесс —при котором мембранные рецепторы связываются с молекулами поглощаемого вещества, после поглощения вещества комплекс рецептор-лиганд расщепляется, и рецепторы могут вновь вернуться в плазмолемму. Клеточная мембрана выпучивается внутрь клетки, формируя окаймлённые ямки. Внутриклеточная сторона окаймлённой ямки содержит набор адаптивных белков (адаптин, клатрин) обуславливающий необходимую кривизну выпучивания. Макромолекулы, связывающиеся со специфическими рецепторами на поверхности клетки, проходят внутрь со значительно большей скоростью, чем вещества, поступающие в клетки за счет пиноцитоза.
Слайд 24
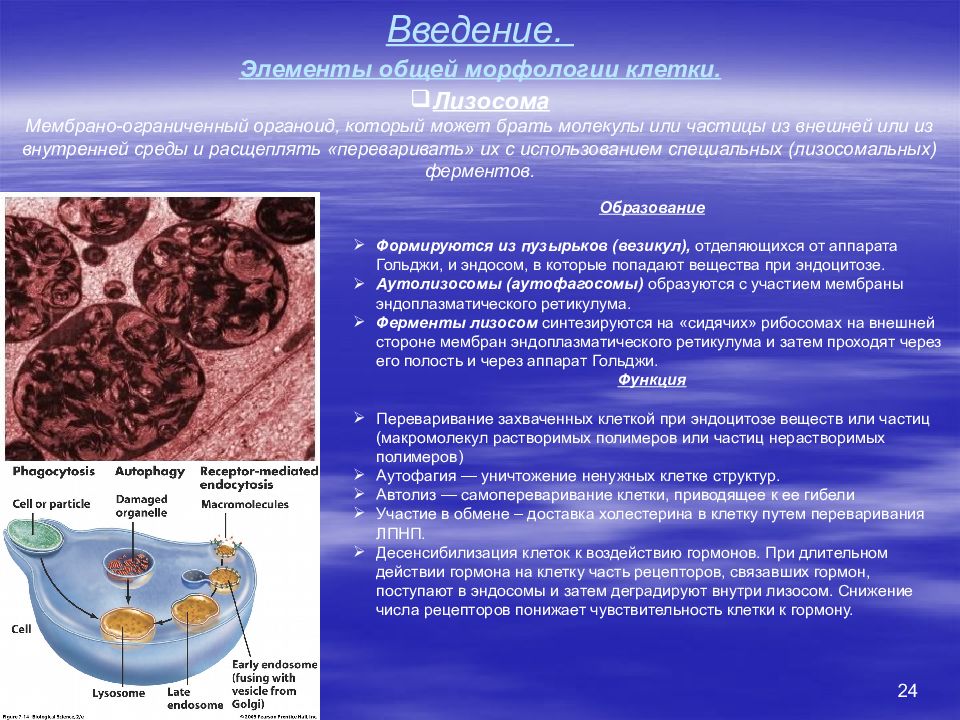
24 Введение. Элементы общей морфологии клетки. Лизосома Мембрано-ограниченный органоид, который может брать молекулы или частицы из внешней или из внутренней среды и расщеплять «переваривать» их с использованием специальных (лизосомальных) ферментов. Образование Формируются из пузырьков (везикул), отделяющихся от аппарата Гольджи, и эндосом, в которые попадают вещества при эндоцитозе. Аутолизосомы (аутофагосомы) образуются с участием мембраны эндоплазматического ретикулума. Ферменты лизосом синтезируются на «сидячих» рибосомах на внешней стороне мембран эндоплазматического ретикулума и затем проходят через его полость и через аппарат Гольджи. Функция Переваривание захваченных клеткой при эндоцитозе веществ или частиц (макромолекул растворимых полимеров или частиц нерастворимых полимеров) Аутофагия — уничтожение ненужных клетке структур. Автолиз — самопереваривание клетки, приводящее к ее гибели Участие в обмене – доставка холестерина в клетку путем переваривания ЛПНП. Десенсибилизация клеток к воздействию гормонов. При длительном действии гормона на клетку часть рецепторов, связавших гормон, поступают в эндосомы и затем деградируют внутри лизосом. Снижение числа рецепторов понижает чувствительность клетки к гормону.
Слайд 25
25 Введение. Элементы общей морфологии клетки. Пероксисома Функция Набор функций пероксисом различается в клетках разных типов. Инактивация инфекций, разрушение токсичных соединений Окисление жирных кислот, синтез желчных кислот, холестерина, эфиросодержащих липидов, построение миелиновой оболочки нервных волокон, метаболизм фетановой кислоты и т. д. Генерируют активные формы кислорода: синглетный кислород, супероксид анион радикалы O 2. и гидроксид анион радикалы OH -. используемые клетками клеточного иммунитета для инактивации инфекций и мусора нерастворимого в лизосомах. Наряду с митохондриями пероксисомы являются главными потребителями O2 в клетке. В пероксисоме обычно присутствуют ферменты генерирующие перекись водорода : RH2 + O2 → R + H2O2 Каталаза - использует образующуюся H2O2 для окисления множества субстратов : H2O2 + R`H2 --> R`+ 2H2O Этот тип окислительных реакций особенно важен в клетках печени и почек, пероксисомы которых обезвреживают яды. Кроме того, реакция важна для детоксикации клетки от самой перекиси водорода. Обязательная одномембранная органелла эукариотической клетки, в которой сосредоточены окислительно-восстановительные реакции не имеющие энергетического значения Строение Размер от 0,2 до 1,5 мкм, отделена от цитоплазмы одной мембраной. Содержит большое количество ферментов, катализирующих окислительно-восстановительные реакции (оксидазы D- аминокислот, уратоксидазы и каталазы). Кристаллическое образование внутри, нередко заполняющее почти все внутреннее пространство образовано каталазой в смеси с другими пероксисомальными белками. Образование Образуется делением предшествующих пероксисом или из везикул, отделяющихся от гладкого эндоплазматического ретикулума. Набор ферментов в неактивном виде синтезируется вне ее в рибосомах и Для их переноса из цитозоля внутрь органеллы мембраны пероксисом имеют систему избирательного транспорта.
Слайд 26
26 Введение в технологию полимеров медико-биологического назначения Часть 1 Введение. Тема 3 Иммунная система. Состав крови. Форменные элементы крови
Слайд 27
27 Введение. Состав крови. Клеточные элементы крови Пла́зма кро́ви Жидкая часть крови 52-60% объема, в которой взвешены форменные элементы. Гистологически плазма является межклеточным веществом жидкой ткани крови. Состав – 1 литр плазмы человека содержит 900—910 г воды, 65—85 г белка и 20 г низкомолекулярных соединений. Плотность плазмы составляет от 1,025 до 1,029, pH — 7,34—7,43 белки (7-8 % от массы плазмы). Основными белками плазмы являются альбумины- 4-5 %, глобулины- 3 % и фибриноген- 0,2-0,4 %. Низкомолекулярные питательные вещества: глюкоза и липиды, Гормоны, витамины, ферменты. Промежуточные и конечные продукты обмена веществ, Неорганические ионы 0.9%. Эритроциты В составе крови выделяют Плазма крови Форменные элементы крови Эритроциты (нефагоцитирующие клетки) Тромбоциты (нефагоцитирующие клетки) Лейкоциты Гранулоциты (фагоцитирующие клетки) Нейтрофилы • Эозинофилы • Базофилы Агранулоциты Лимфоциты (нефагоцитирующие клетки) T-лимфоциты B-лимфоциты NK-лимфоциты Моноциты (фагоцитирующие клетки) Лейкоцит
Слайд 28
28 Введение. Форменные элементы крови. Эритроциты Красные кровяные тельца — клетки крови содержащие гемоглобин. Функции: Дыхательная (газообмен) - перенос кислорода из лёгких к тканям тела и транспорт диоксида углерода (CO2) в обратном направлении. Буферная - участвуют в регулировке кислотно-щелочного равновесия; Изотоническая - поддерживают изотонию крови и тканей; Питательная адсорбируют из плазмы крови аминокислоты, липиды и переносят их к тканям перенося их таким образом в ткани от органов пищеварения. Защитная - связывют токсины за счёт наличия на их поверхности специальных антител. Ферментативная - эритроциты являются носителями разнообразных ферментов. Тромбоци́ты Постклеточные структуры, представляющие собой окружённые мембраной и лишённые ядра фрагменты цитоплазмы гигантских клеток костного мозга — мегакариоцитов. Образуются в красном костном мозге. Жизненный цикл циркулирующих тромбоцитов составляет около 7 дней (с вариациями от 1 до 14 дней), затем они утилизируются ретикулоэндотелиальными клетками печени и селезёнки. В среднем количество тромбоцитов в крови составляет 1,4—3,4 Г/л. Различают 5 форм тромбоцитов: юные (10 %), зрелые (80-85 %), старые (5-10 %), формы раздражения и дегенеративные формы Функции тромбоцитов Главная функция тромбоцитов — участие в процессе свёртывания крови гемостазе предотвращающем большую кровопотерю при ранении сосудов. Оно характеризуется следующими процессами: адгезия, агрегация, секреция, ретракция, спазм мелких сосудов и вязкий метаморфоз, образование белого тромбоцитарного тромба в сосудах микроциркуляции с диаметром до 100 нм. Ангиотрофическая функция — питание эндотелия кровеносных сосудов. Ранозаживление и регенерация поврежденных тканей. Освобождают из себя в раневые ткани факторы роста, которые стимулируют деление и рост поврежденных клеток. Факторы роста - полипептидные молекулы различного строения и назначения. К важнейшим факторам роста относятся тромбоцитарный фактор роста (PDGF), трансформирующий фактор роста (TGF-β), фактор роста эндотелия сосудов (VEGF), фактор роста эпителия (EGF), фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF).
Слайд 29
29 Введение. Форменные элементы крови. Лейкоциты Белые кровяные клетки - неоднородная группа различных по внешнему виду и функциям клеток крови, выделенная по признаку отсутствия самостоятельной окраски и наличия ядра. Главная сфера действия — защита. Все виды лейкоцитов способны к активному движению и могут переходить через стенку капилляров и проникать в ткани. Количество лейкоцитов В крови взрослого человека лейкоцитов содержится в 1000 раз меньше, чем эритроцитов, и в среднем их количество составляет 4—9×10 9 /л. Содержание лейкоцитов в крови не является постоянным, а динамически изменяется в зависимости от времени суток и функционального состояния организма. По морфологическим признакам лейкоциты, окрашенные по Романовскому делят на две группы: Зернистые лейкоциты, или гранулоциты — клетки имеющие крупные сегментированные ядра и обнаруживающие специфическую зернистость цитоплазмы которые их по способности воспринимать красители подразделяют на нейтрофильные, эозинофильные и базофильные. Незернистые лейкоциты, или агранулоциты — клетки, не имеющие специфической зернистости и содержащие простое несегментированное ядро, к ним относятся лимфоциты и моноциты. Нейтрофилы – клетки мусорщики Подвид гранулоцитарных лейкоцитов, названный нейтрофилами за то, что при окраске по Романовскому они интенсивно окрашиваются как кислым красителем эозином, так и основными красителями. Продуцируются костным мозгом. Зрелые нейтрофилы имеют сегментированное ядро, являются основным видом лейкоцитов крови и составляютя от 47% до 72% общего количества лейкоцитов. Еще 1-5% в норме составляют юные, функционально незрелые нейтрофилы называемые палочкоядерные нейтрофилы. Нейтрофилы способны к активному амебоидному движению, к экстравазации (эмиграции за пределы кровеносных сосудов), и к хемотаксису (преимущественному движению в направлении мест воспаления или повреждения тканей). Нейтрофилы способны к фагоцитозу, причём являются микрофагами, то есть способны поглощать лишь относительно небольшие чужеродные частицы или клетки. После фагоцитирования чужеродных частиц нейтрофилы погибают, высвобождая большое количество биологически активных веществ, повреждающих бактерии и грибы, усиливающих воспаление и хемотаксис иммунных клеток в очаг. Нейтрофилы содержат большое количество миелопероксидазы, фермента, который способен окислять анион хлора до гипохлорита — сильного антибактериального агента. Миелопероксидаза - гем-содержащий белок имеет зеленоватый цвет, что определяет зеленоватый оттенок самих нейтрофилов, цвет гноя и некоторых других выделений, богатых нейтрофилами.
Слайд 30
30 Введение. Форменные элементы крови. Эозинофилы Эозинофильные гранулоциты — подвид гранулоцитарных лейкоцитов крови названый так потому, что при окраске по Романовскому интенсивно окрашиваются кислым красителем эозином и не окрашиваются основными красителями. Эозинофилы способны к активному амебоидному движению, к экстравазации и к хемотаксису. Эозинофилы, как и нейтрофилы, способны к фагоцитозу, причём являются микрофагами, то есть способны, в отличие от макрофагов, поглощать лишь относительно мелкие чужеродные частицы или клетки. Базофилы Подвид гранулоцитарных лейкоцитов. Содержат S-образное ядро, не видимое из-за перекрытия цитоплазмы гранулами аллергомедиаторов. Названы базофилами т.к. при окраске по Романовскому поглощают основной краситель и не окрашиваются кислым эозином. Продуцируются костным мозгом. Базофилы — очень крупные клетки, крупнее и нейтрофилов, и эозинофилов. Гранулы базофилов содержат большое количество гистамина, серотонина, лейкотриенов, простагландинов и других медиаторов аллергии и воспаления. Базофилы принимают активное участие в развитии аллергических реакций немедленного типа. Способны к экстравазии. Попадая в ткани, базофилы превращаются в резидентные тучные клетки (лаброциты), содержащие большое количество гистамина — вещества стимулирующего развитие аллергии. Благодаря базофилам яды насекомых или животных сразу блокируются в тканях и не распространяются по всему телу. Базофилы регулируют свертываемость крови при помощи гепарина. Базофилы как и лаброциты несут на поверхности IgE-иммуноглобулин и способны к дегрануляции (высвобождению содержимого гранул во внешнюю среду) или аутолизу (растворению, лизису клетки) при контакте с антигеном-аллергеном. При этом высвобождается большое количество гистамина, серотонина, лейкотриенов, простагландинов и других медиаторов воспаления. Базофилы обладают способностью к хемотаксису и фагоцитозу, но они не является ни основной, ни естественной активностью. Способны поглощать и связывать гистамин и ряд других медиаторов аллергии и воспаления. Они также обладают способностью при необходимости высвобождать эти вещества, подобно базофилам. То есть эозинофилы способны играть как про-аллергическую, так и защитную анти-аллергическую роль. Процентное содержание эозинофилов в крови увеличивается при аллергических состояниях, они менее многочисленны, чем нейтрофилы. Большая их часть недолго остаётся в крови и, попадая в ткани, длительное время находится там. Нормальный уровнем для человека 120—350 эозинофилов на микролитр. Эозинофилы также обладают цитотоксической активностью в отношении многих видов паразитов, в частности гельминтов, и играют важную роль в защите организма хозяина от паразитарных инвазий.
Слайд 31
31 Введение. Форменные элементы крови. Лимфоциты Лимфоциты — клетки иммунной системы, представляющие собой разновидность лейкоцитов группы агранулоцитов Лимфоциты — главные клетки иммунной системы, обеспечивают гуморальный иммунитет (выработка антител), клеточный иммунитет (контактное взаимодействие с клетками-жертвами), а также регулируют деятельность клеток других типов. В норме в крови на лимфоциты приходится 20—35 % всех белых клеток крови или в абсолютном виде 1000—3000 кл/мкл. При этом в свободной циркуляции в крови находится около 2 % лимфоцитов, находящихся в организме, а остальные 98 % находятся в тканях. По функциональным признакам различают три типа лимфоцитов: B-клетки, T-клетки, NK-клетки. В-лимфоциты распознают чужеродные структуры (антигены) вырабатывая при этом специфические антитела (белковые молекулы, направленные против чужеродных структур). Т-лимфоциты выполняют функцию регуляции иммунитета. Т-помощники стимулируют выработку антител, а Т-супрессоры тормозят её. NK-лимфоциты осуществляют контроль над качеством клеток организма. При этом NK-лимфоциты способны разрушать клетки, которые по своим свойствам отличаются от нормальных клеток, например, раковые клетки. Содержание Т-лимфоцитов в крови составляет 65—80 % от общего количества лимфоцитов, В-лимфоцитов — 8—20 %, NK-лимфоцитов — 5—20 %. [1] T-лимфоциты Т-клетки — лимфоциты, развивающиеся в тимусе из предшественников — претимоцитов, поступающих в него из красного костного мозга. В тимусе T-лимфоциты дифференцируются, приобретая Т-клеточные рецепторы (TCR) и поверхностные маркеры. Играют важную роль в приобретённом иммунном ответе. Обеспечивают распознавание и уничтожение клеток, несущих чужеродные антигены, усиливают действие моноцитов, NK-клеток, принимают участие в переключении изотипов иммуноглобулинов (в начале иммунного ответа B-клетки синтезируют IgM, позже переключаются на продукцию IgG, IgE, IgA). У всех T-лимфоцитов в мембране присутствует комплекс CD3 связанный с TCR и обеспечивающий передачу сигнала о взаимодействии TCR c антигеном. В зависимости от типа T-лимфоцита у него на поверхности имеются молекулы CD4 (Т-хелпер) или CD8 (Т-киллер). Существует 6 видов Т-лимфоцитов: Т-киллеры; Т-хелперы; Т-регуляторы: Т-амплифайеры: Т-контрсупрессоры: Т-клетки памяти
Слайд 32
32 Введение. Форменные элементы крови. Моноциты Моноци́т крупный зрелый одноядерный лейкоцит группы агранулоцитов диаметром 12—20 мкм. Как и лимфоциты, моноциты имеют несегментированное ядро. Моноцит — наиболее активный фагоцит периферической крови. В его цитоплазме имеется множество лизосом. В норме моноциты составляют от 3 % до 11 % общего количества лейкоцитов крови. Помимо крови, эти клетки всегда присутствуют в больших количествах в лимфатических узлах, стенках альвеол и синусах печени, селезенки и костного мозга. Моноциты образуются в костном мозге. В кровь выходят не окончательно созревшие клетки, которые обладают самой высокой способностью к фагоцитозу. В крови моноциты находятся в крови 2-3 дня, затем они выходят в окружающие ткани, где, достигнув зрелости, превращаются в тканевые макрофаги — гистиоциты. Гистиоциты вблизи воспалительного очага они могут размножаться делением. Моноциты также являются предшественниками клеток Лангерганса, клеток микроглии и других клеток, способных к переработке и представлению антигена. Свойства моноцитов Способны к активному амебоидному движению благодаря выростам цитоплазмы - псевдоподиям, к экстравазации и к хемотаксису, но главным свойством моноцитов является способность к фагоцитозу. Моноциты являются макрофагами, то есть могут поглощать относительно крупные частицы и клетки или большое количество мелких частиц и не погибают после фагоцитирования. Эти клетки образуют отграничивающий вал вокруг неразрушаемых инородных тел. Активированные моноциты и тканевые макрофаги осуществляют противоопухолевый, противовирусный, противомикробный и противопаразитарный иммунитет, производя цитотоксины, интерлейкин (ИЛ-1), фактор некроза опухолей (ФНО), интерферон. Участвуют в регуляции кроветворения. Участвуют в формировании специфического иммунного ответа организма. Синтез биологически активных факторов Моноциты секретируют растворимые цитокины, отдельные компоненты системы комплемента. Они распознают антиген и переводят его в иммуногенную форму (презентация антигена Т-лимфоцитам). Моноциты продуцируют как факторы, усиливающие свертывание крови (тромбоксаны, тромбопластины), так и факторы, стимулирующие фибринолиз (активаторы плазминогена). В отличие от В- и Т-лимфоцитов, макрофаги и моноциты не способны к специфическому распознаванию антигена.
Слайд 33
33 Введение. Форменные элементы крови. В- лимфоциты Функциональный тип лимфоцитов, играющих ключевую роль в обеспечении гуморального специфического иммунитета. B-лимфоциты образуются в красном костном мозге затем переходят во вторичные лимфоидные органы (селезёнку и лимфатические узлы), где происходит их дальнейшее созревание, При контакте с антигеном (антиген-презентирование) или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти. В-клетки памяти Активированные В-лимфоциты, посредством кооперации с Т-клетками вновь перешедшие в стадию малых лимфоцитов. Долгоживущий клоном В-клеток, обеспечивает быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. Названы клетками памяти, так как позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения действия антигена. Плазматические клетки Являются последний этапом дифференцировки активированных В-клеток после контакта с антигеном. Несут мало мембранных антител, но способны секретировать растворимые антитела за счет развитого синтетического аппарата - шероховатый эндоплазматический ретикулум занимает почти всю цитоплазму, также развит и аппарат Гольджи. Являются короткоживущими клетками (2-3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ. В-клетки подразделяют на две субпопуляции: B-2 и В-1 клетки. В-1 очень сильно отвечают на полисахаридные антигены и значительно хуже отвечают на антигены белковой природы. В-1 составляют 5% от общей популяции B-клеток. Появляются в течение эмбрионального периода. На своей поверхности они экспрессируют IgM и не экспрессируют IgD. Маркером этих клеток является CD5. находятся в лимфоузлах и в селезёнке. В эмбриональном периоде В-1 клетки появляются из стволовых клеток костного мозга, в постнатальном периоде их популяция обновляется за счёт собственной пролиферации. В-2 – 95% популяции экспрессируют на мембране оба IgM и не экспрессируют IgD. В основном активны против белковых антигенов.
Слайд 34
34 Введение. Форменные элементы крови. Активация В-лимфоцитов Стадии активирования для случая полипептидных антигенов, относительно неустойчивых к фагоцитарному процессингу - т. н. тимус-зависимых антигенов Антиген-презентирующая клетка которой может быть: макрофаг, клетка Купфера, фолликулярная дендритная клетка, интердигитальная дендритная клетка и т. д. процессирует (переваривает) патоген. Вскоре после процессирования патогена выносит эпитопы на поверхность клетки при помощи МНС II, делая их доступными для Т-клеток. Т-хелпер при помощи Т-клеточного рецептора распознаёт комплекс эпитоп-МНС. Активированный Т-хелпер выделяет цитокины, усиливающие антиген-презентирующую функцию, а также цитокины, активирующие В-лимфоцит - индукторы активации и пролиферации. В-лимфоциты присоединяются при помощи мембрано-связанных антител, выступающих в роли рецепторов, к "своему" антигену и в зависимости от получаемых от Т-хелпера сигналов пролиферируют и дифференцируются в плазматическую клетку, синтезирующую антитела, либо перерождается в В-клетку памяти. При этом от качества и количества антигена будет зависеть исход данной трёхклеточной системы взаимодействия. Стадии активирования для синтетических полимеров Синтетические полимеры относят к т.н. тимус-независимым антигенам они содержат повторяющиеся полимерные звенья, которые являются эпитопами т.е. обладают антигенностью. Полимерная цепь относительно устойчива к фагоцитарному перевариванию. Такие полимеры обладают свойством митогенности (вызывают размножение – деление клеток лимфоцитов). В этом случае участия Т-хелпера не требуется - активация В-лимфоцитов происходит по тимус-независимому пути, В-лимфоциты связываются напрямую с данными антигенами, Связывание происходит неспецифически т.е. связывается не один специфический В-лимфоцит заточенный на данный антиген, а любой, тоесть все сразу. За счёт собственной митогенной активности В-лимфоцитов происходит пролиферация В-лимфоцитов и их активация – синтез антител. Роль В-лимфоцитов в презентации антигена В-клетки способны поглощать свои мембранные иммуноглобулины вместе со связанным ими антигеном, а затем презентировать фрагменты антигена в комплексе с молекулами МНС класса II. При низкой концентрации антигена и при вторичном иммунном ответе В-клетки могут выполнять роль основных антигенпрезентирующих клеток.
Слайд 35
35 Введение. Форменные элементы крови. NK -лимфоциты Нормальные киллеры или NK (natural killer ) - большие зернистые лимфоциты выполняющие цитотоксические функции НК-клетки составляют примерно 5% лимфоцитов периферической крови. Происходят из больших гранулярных лимфоцитов, т.е. относятся к самостоятельной линии дифференцировки. Свойства НК не имеют антигенраспознающих рецепторов, не увеличиваются количественно после взаимодействия с чужеродным (например, вирусным) антигеном и не способны к формированию иммунологической памяти. Активность NK повышается под влиянием цитокинов Т-клеток ( Гамма интерферона ) Функция Основная функция - выявлять и уничтожать дефектные собственные клетки организма NK уничтожают Опухолевые клетки, Измененные клетки Клетки, зараженные вирусами, Эмбриональные клетки. Способы уничтожения Узнавание клетки-мишени и сближение с ней происходит за счет рецепторов NK. В результате NK активируются, и содержимое гранул выбрасывается во внеклеточное пространство. Гранулы содержат Перфорин - встраивается в мембрану клетки- мишени и образовывает трансмембранные поры, что приводит к гибели клетки. Две сериновые протеинкиназы, растворяющие (лизирующие) мишень. Хондроитинсульфат A - гликопротеин, устойчивый к протеинкиназам, – защищает NK от автолиза.
Слайд 36
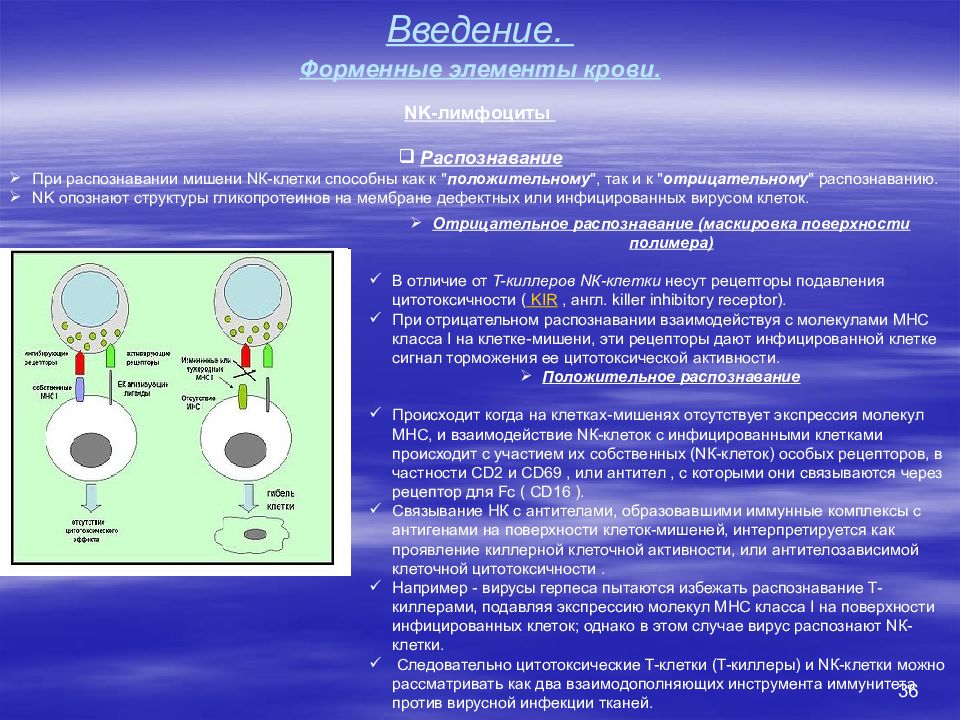
36 Введение. Форменные элементы крови. NK -лимфоциты Распознавание При распознавании мишени N К-клетки способны как к " положительному ", так и к " отрицательному " распознаванию. NK опознают структуры гликопротеинов на мембране дефектных или инфицированных вирусом клеток. Отрицательное распознавание (маскировка поверхности полимера) В отличие от T-киллеров N К-клетки несут рецепторы подавления цитотоксичности ( KIR, англ. killer inhibitory receptor). При отрицательном распознавании взаимодействуя с молекулами MHC класса I на клетке-мишени, эти рецепторы дают инфицированной клетке сигнал торможения ее цитотоксической активности. Положительное распознавание Происходит когда на клетках-мишенях отсутствует экспрессия молекул MHC, и взаимодействие N К-клеток с инфицированными клетками происходит с участием их собственных ( N К-клеток) особых рецепторов, в частности CD2 и CD69, или антител, с которыми они связываются через рецептор для Fc ( CD16 ). Связывание НК с антителами, образовавшими иммунные комплексы с антигенами на поверхности клеток-мишеней, интерпретируется как проявление киллерной клеточной активности, или антителозависимой клеточной цитотоксичности. Например - вирусы герпеса пытаются избежать распознавание T-киллерами, подавляя экспрессию молекул MHC класса I на поверхности инфицированных клеток; однако в этом случае вирус распознают N К-клетки. Следовательно цитотоксические T-клетки (T-киллеры) и N К-клетки можно рассматривать как два взаимодополняющих инструмента иммунитета против вирусной инфекции тканей.
Слайд 37
37 Введение в технологию полимеров медико-биологического назначения Часть 1 Введение. Тема 6 Механизмы взаимного влияния иммунной системы и полимеров внутри организма. .
Слайд 38
38 Введение. Иммунная система. Это защитная подсистема организма, объединяющая органы и ткани, которые изолируют, идентифицируют и уничтожают чужеродные тела полимеры и молекулы, опухолевые клетки и патогены от вирусов до червей. Иммунная система защищает организм в несколько этапов, при этом с каждым уровнем повышается специфичность защиты. Первый уровень - Барьеры Поверхностные Физические или механические Постоянно действующие - кожа, реснички трахеи, слизь в ЖКТ, промывание слезами и т.д. Аварийные механизмы очистки организма, такие как кашель, чихание, рвота и диарея Химические Кожа секретирует антимикробные бета-дефенсины, в слюне, слезах молоке – ферменты, в желудке – кислота, в сперме – дефенсины и цинк Биологические В ЖКТ и мочеполовой системах – дружественная флора (комменсалы) Барьеры между кровью и органами. Состоят из нескольких слоев клеток (билипидных мембран). Не пропускают в органы гидрофильные вещества, высокомолекулярные полимеры и частицы. Гематоэнцефалический. Плацентарный. Офтальмологический. Легочный. Тканевой. Второй уровень – врожденный иммунитет. Неспецифическая реакцию врожденной иммунной системы. Немедленная и максимальная реакция Третий уровень - приобретенный иммунитет. Позволяет реагировать на конкретный чужеродный материал и запоминать его, существенно усиливая интенсивность ответной реакции на вторжение при повторном контакте с этим же материалом. Развивается во времени. Адаптирует реакцию для лучшего распознавания агрессора. Обладает иммунной памятью.
Слайд 39
39 Введение. Иммунная система. Анатомия иммунной системы Клетки и гуморальные факторы иммунной системы присутствуют почти во всех органах и тканях организма. Исключение - органы огражденные от иммунной системы тканевым барьером. Некоторые отделы глаз. Яички у мужчин. Щитовидная железа. Головной мозг. Клетки иммунной системы (различные виды лейкоцитов) циркулируют в крови и переходят в ткани, осуществляя постоянный надзор за антигенным составов тканей. Кроме клеток, в крови циркулирует большое количество разнообразных антител (гуморальные, жидкостные факторы), которые также способны распознавать и уничтожать чужеродные структуры. Центральные органы иммунной системы Костный мозг (красный костный мозг ) – в нем происходит формирование клеток иммунной системы из так называемых стволовых клеток, которые дают начало всем клеткам крови (эритроциты, лейкоциты, тромбоциты). Вилочковая железа (тимус) - расположена в грудной клетке, сразу позади грудины. В тимусе происходит дифференциация лимфоцитов – специфических клеток иммунной системы. В процессе дифференциации лимфоциты «учатся» распознавать «свои» и «чужие» структуры. Периферические органы иммунной системы Лимфатические узлы - представляют собой скопление лимфоидной ткани (на самом деле скопление клеток иммунной системы) окруженные оболочкой. В лимфатический узел входят лимфатические сосуды, по которым течет лимфа. Внутри лимфатического узла лимфа фильтруется и очищается от всех чужеродных структур (вирусы, бактерии, раковые клетки). Сосуды выходящие из лимфатического узла сливаются в общий проток, который впадает в вену. Селезенка – это большой лимфатический узел весом в сотни граммов, расположена в брюшной полости слева от желудка. В сутки через селезенку прокачивается большое количество крови, которая, подобно лимфе в лимфатических узлах, подвергается фильтрации и очищению. Также в селезенке запасается определенное количество крови, в котором организм на данный момент не нуждается. Во время физической нагрузки или стресса селезенка сокращается и выбрасывает кровь в кровеносные сосуды, для того чтобы удовлетворить потребность организма в кислороде. Лимфоидная ткань - рассеяна по всему организму в виде маленьких узелков. Функция – обеспечение местного иммунитета. Крупные скопления лимфоидной ткани расположены в области рта, глотки и кишечника (зоны скопления бактерий). Мезенхимальные клетки, - расположены в различных органах, могут выполнять иммунную функцию. Много таких клеток в коже, печени, почках.
Слайд 40
40 Введение. Иммунная система. Видовой иммуннитет. Видовой иммунитет состоит из нескольких факторов неспецифической защиты, Система комплимента. Лизоцим, Трансферин. С-реактивный белок. Интерфероны. Комплимент. Система белков крови, которая активируется при попадании в организм различных чужеродных материалов. Активация системы комплимента запускает иммунный ответ, а в некоторых случаях может привести к разрушению чужеродного организма (бактерия или паразит). Биосовместимый полимер не активирует комплимент. Лизоцим. Специфический фермент, который разрушает стенки бактерий. В больших количествах лизоцим содержится в слюне, чем объясняются ее антибактериальные свойства. Трансферин. Белок, который конкурирует с бактериями за захват определенных веществ (например, железо ), необходимых для их развития. В результате этого рост и размножение бактерий замедляется. С-реактивный белок. Активируется, подобно комплименту, при попадании в кровь чужеродных структур. Присоединение этого белка к бактериям делает их уязвимыми для клеток иммунной системы. Биосовместимый полимер не сорбирует и не активирует С-реактивный белок. Интерфероны. Сложные гликопротеины, которые выделяются клетками в ответ на проникновение в организм вирусов. Сорбируются на плазмолемме и блокируют сайты, через которые вирус, прикрепившись, проникает в клетку. В результате вирус не может закрепиться на мембране. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу.
Слайд 41
41 Введение. Иммунная система. Анатомия иммунной системы Клетки иммунной системы Общее название клеток иммунной системы это лейкоциты. Различают два основных типа лейкоцитов: зернистые и незернистые. Зернистые лейкоциты Нейтрофилы - борются с бактериями. Эозинофилы - борются с паразитами) Базофилами - эти клетки осуществляют защиту тканей. Незернистые Лимфоциты Моноциты. Нейтрофилы – наиболее многочисленные представители лейкоцитов. Эти клетки содержат вытянутое ядро, разделенное на несколько сегментов, поэтому иногда их называют сегментоядерными лейкоцитами. Как и все клетки иммунной системы, нейтрофилы образуются в красном костном мозге и после созревания попадают в кровь. Время циркуляции нейтрофилов в крови не велико. В течение нескольких часов эти клетки проникают через стенки сосудов и переходят в ткани. Пробыв некоторое время в тканях, нейтрофилы могут вновь вернуться в кровь. Нейтрофилы чрезвычайно чувствительны к наличию в организме очага воспаления и способны направленно мигрировать в воспаленные ткани. Попадая в ткани, нейтрофилы меняют свою форму – из круглых превращаются в отростчатые. Основная функция нейтрофилов обезвреживание различных бактерий. Для передвижения в тканях нейтрофил снабжен своеобразными ножками, которые представляют собой выросты цитоплазмы клетки. Придвигаясь к бактерии нейтрофил, окружает ее своими отростками, а затем «заглатывает» и переваривает ее при помощи специальных ферментов. Отмершие нейтрофилы скапливаются в очагах воспаления (например, в ранах) в виде гноя. Количество нейтрофилов крови увеличивается во время различных воспалительных заболеваний бактериальной природы. Эозинофилы менее многочисленны, чем нейтрофилы. Большая часть эозинофилов проводит в крови лишь небольшое время и, попадая в ткани, остается там, на долгое время. Функция эозинофилов заключается в разрушении чужеродных белков, а так же в обеспечении антипаразитарной защиты. Количество эозинофилов значительно увеличивается во время аллергии или при таких заболеваниях, как бронхиальная астма. Базофилы принимают активное участие в развитии аллергических реакций немедленного типа. Попадая в ткани базофилы, превращаются в тучные клетки, содержащие большое количество гистамина – биологически активного вещества, которое стимулирует развитие аллергии. Благодаря базофилам яды насекомых или животных сразу блокируются в тканях и не распространяются по всему телу. Также базофилы регулируют сворачиваемость крови при помощи гепарина.
Слайд 42
42 Введение. Иммунная система. Иммунная система подразделяется на гуморальный и клеточный иммунитет. К гуморальному относятся Антитела ( иммуноглобулины) растворенные в сыворотки крови и на поверхности слизистых оболочек. Белки системы комплемента. Комплемент - один из ключевых факторов неспецифической защиты организма от инфекции. Представляет из себя комплекс сывороточных белков способных каскадно активироваться. Клеточный состоит из иммунокомпетентных клеток. Хотя функции гуморального и клеточного иммунитета различны, разделение иммунной системы на два звена весьма условно, так как оба они тесно взаимосвязаны. Аантитела являются продуктом синтетической активности клеток – В-лимфоцитов, Развитие гуморальных реакций невозможно без помощи иммунокомпетентных клеток и наоборот, без участия антител не развиваются полноценные клеточные реакции. Гуморальный иммунитет играет основную роль в защите организма от бактерий находящихся во внеклеточном пространстве и крови. В основе гуморального иммунитета лежит специфическое взаимодействие антител с антигенами. Антигены – это чужеродные молекулы или их части (чаще всего белки или другие высокомолекулярные соединения) А нтитела – это специальные белки синтезируемы активированными В-лимфоцитами, основным отличительным свойством которых является способность узнавать антигенные структуры и отличать их от собственных структур организма. Функции антител: Нейтрализация токсинов, макромолекул и вирусов находящихся вне клеток (за счет связывания с их активными центрами и поверхностными структурами). Склеивание (преципитация, агглютинация) антигенов, в результате чего они теряют свою растворимость в сыворотке и межклеточной жидкости. Это облегчает их захват фагоцитами. Опсонизация антигенов. «Облепленный» антителами антиген, становятся более доступными для фагоцитов за счет того что, фагоциты имеют специальные рецепторы к антителам. То есть антитело, в данном случае, выступает промежуточным звеном для захвата и поглощения антигена фагоцитирующими клетками. Активация системы комплемента. Совместное с комплементом уничтожение бактериальных клеток. Гуморальный иммунитет.
Слайд 43
43 Введение. Иммунная система. Система комплемента — комплекс белков проферментов последовательно активируемых путем протеолиза. Белки постоянно присутствующих в крови 5% от глобулиновой фракции сыворотки. Это каскадная система протеолитических ферментов, предназначенная для защиты организма от действия чужеродных полимеров и клеток. Является важным компонентом как врождённого, так и приобретённого иммунитета. Гуморальный иммунитет. Система комплемента. Комплемент , включает около 20 взаимодействующих компонентов: С1 (комплекс из трех белков), С2, СЗ, …, С9, фактор В, фактор D и ряд регуляторных белков, дезактивирующих систему. Все компоненты — растворимые белки с мол. массой от 24 000 до 400 000, циркулирующие в крови и тканевой жидкости. Белки комплемента синтезируются в основном в печени. Большинство из них неактивны до тех пор, пока не будут приведены в действие. Ключевой белок С3. Белки активизируют последовательно друг друга путем протеолиза молекулы на две части. Одна как правило становится активным ферментом а другая сигнальным белком инициирующим воспаление через тучные клетки. Три пути активации: Классический – с участием антител – приобретенный иммунный ответ Альтернативный и лектиновый пути– без участия антител, прямым взаимодействием с антигеном – врожденный иммунный ответ. Конечный результат активации - последовательное объединение так называемых поздних компонентов (С5, С6, С7, С8 и С9) в большой белковый комплекс, вызывающий лизис клеток (литический, или мембраноатакующий комплекс), буквально протыкающий мембрану клетку бактерии и вызывающий осмотический лизис.
Слайд 44
44 Введение. Иммунная система. Антитела (иммуноглобулины) — это растворимые гликопротеины,, которые распознают и связывают антигены. Гуморальный иммунитет, антитела. Общая схема строения иммуноглобулинов: 1) Fab ; 2) Fc ; 3) Тяжелая цепь к ней присоединен ковалентно олигосахарид; 4) Легкая цепь; 5) Антиген-связывающийся участок; 6) Шарнирный участок Синтезируются В-лимфоцитами (плазматическими клетками) в ответ на антигены. Каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов. Разделяются на 5 классов и 9 подклассов (изотипов) антител. Присутствуют в свободном виде В сыворотке крови класс IgG, 4 подкласса –(IgG1, IgG2, IgG3, IgG4), М w 14 6кда, единственный проникает через плацентарный барьер В тканевой жидкости класс IgM – 970 кДа – первичный ответ на неизвестный антиген. В серозных секретах, слюне, молоке класс I gA – два подкласса (IgA1, IgA2) Мембранно связаны Класс IgD – на мембране В лимфоцитов – антигенный рецептор В лимфоцитов не представленных антигену Класс IgE – на мембране базофилов и тучных клеток (признак аллергии). Функции: антиген-связывающую функция - распознает и связывает антиген эффекторная - например запуск классической схемы активации комплемента и связывание с клетками, усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов. Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма.
Слайд 45
45 Введение. Иммунная система. Классификация и специфичность антител. Гуморальный иммунитет, антитела. Классификация по антигенам: Антиинфекционные или антипаразитарные. Антитоксические - не убивают возбудитель, но связываются с токсинами, которые он выделяет. Антитела-свидетели заболевания - связываются со второстепенными белками возбудителя. Аутоагрессивные антитела, аутологичные, аутоантитела - запускают механизм развития аутоиммунных заболеваний. Аллореактивные или гомологичные — антитела против антигенов тканей или клеток других организмов того же биологического вида играют важную роль в процессах отторжения аллотрансплантантов. Гетерологичные или изоантитела — антитела против антигенов тканей или клеток организмов других биологических видов. Запрещают пересадку органов от приматов и других животных. Антиидиотипические антитела — антитела против антител, вырабатываемых самим же организмом, играют важную роль в связывании и обезвреживании избытка антител. Спецефичность антител Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном. Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют. Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности. Лимфоциты, связавшие антиген, проходят стадию пролиферации (размножения) и формируют большой клон плазматических клеток. Плазматические клетки - потомство лимфоцита -синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит предшественник. Сигналами к пролиферации служат цитокины (сигнальные пептиды), которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Слайд 46
46 Введение. Иммунная система. Этапы дифференцировки в-лимфоцитов из стволовой кроветворной клетки в костном мозге. Стволовая кроветворная (гемопоэтическая) клетка - общий предшественник для всех видов клеток крови. Общий лимфоидный предшественник B-клеток и T-клеток. Для B- и T-клеточного пути развития - наиболее ранняя лимфоидная клетка, для которой еще не определилось одно из двух направлений развития. Про-В-клетка Ранняя про-В-клетка - ближайший потомок предыдущего клеточного типа и предшественник последующих, продвинутых в дифференцировке клеточных типов (приставка "про" от англ. progenitor). Поздняя про-В-клетка ; Пре-В-клетка - клеточный тип, окончательно вышедший на В-клеточный путь развития (приставка "пре" от англ. precursor). Незрелая В-клетка - завершающая костномозговое развитие клеточная форма, активно экспрессирует поверхностный иммуноглобулин и находится в стадии отбора на способность взаимодействовать с собственными антигенами. Зрелая В-клетка - клеточный тип периферии, способный взаимодействовать только с чужеродными антигенами; Плазматическая клетка (плазмоцит) - эффекторная, антителопродуцирующая клеточная форма, которая образуется из зрелой В-клетки после ее контакта с антигеном. В-система иммунной защиты –часть гуморального иммунитета - главный и единственный продуцент антител. Центральным органом системы является костный мозг - основное место генерации B-клеток. Клеточный состав представлен B-лимфоцитами различной степени зрелости Заключительной формой в гистогенезе В-клеток являются – плазмоциты – вид В-лимфоцитов активно синтезирующих и секретирующих антитела - специфические иммуноглобулины. В процессе развития B-лимфоцитов в костном мозге происходит реорганизация генов для синтеза тяжелой и легкой цепей иммуноглобулинов. В результате такой реорганизации генов одна клетка синтезирует только одну по специфичности тяжелую цепь и одну легкую цепь из множества возможных. Образующийся из такой клетки клон несет иммуноглобулиновый рецептор, способный реагировать только на один антигенный эпитоп. Клоны, экспрессирующие иммуноглобулиновые рецепторы к своим собственным антигенам, уничтожаются и не принимают участия в дальнейшем становлении системы. Создание толерантности к собственным антигенам осуществляется на территории костного мозга. В результате на периферии оказываются клетки, рецепторы которых реагируют только на чужеродные антигены.
Слайд 47
47 Введение. Иммунная система. Клеточный иммунитет. Клеточный иммунитет является основным фактором защиты организма чужеродных клеток и тканей, растворимых макромолекул и трансплантатов. Основными эффекторными (исполнительными) клетками клеточного иммунитета являются макрофаги и два типа Т-киллеров. Основу клеточного иммунитета составляют лимфоциты, которые для своего созревания переселяются из костного мозга в тимус (вилочковая железа). Эта ветвь лимфоцитов получила название тимус-зависимые, или Т-лимфоциты. Для различения популяций лимфоидных клеток используются специфические белки на поверхности каждой из них. Такие белки-метки получили название CD (групповой маркер). Известно около 200 маркеров. Например, маркером для Т-клеток-хелперов служит белок, названный CD4. Т-лимфоциты многократно покидают лимфоидные органы, попадая сначала в лимфу, затем в кровь, а из крови снова возвращаются в органы. В тимусе формируются около 200 видов Т-клеток. Т-хелперы координируют работу всех клеток, задействованных в иммунной реакции. Они первыми распознают чужеродные антигены. Т-хелперы не способны вырабатывать антитела и убивать клетки-мишени, но, распознавая чужеродный антиген, они реагируют на него выработкой различных факторов, которые необходимы для размножения и созревания В-клеток и Т-киллеров. Они оказывают помощь В-клеткам в образовании антител. По их командам иммунная система направляет Т-лимфоцитов-киллеров, задача которых убивать зараженные клетки. Т-супрессоры подавляют активность иммунного ответа, когда необходимость в нем отпадает. Если иммунные клетки будут продолжать работать, то будут поражаться собственные здоровые клетки организма, что приведет к развитию различных болезней (их называют аутоиммунными). Т-киллеры опознают антиген, расположенный на поверхности чужеродной клетки или протеза. С помощью рецепторов вступают в контакт с мишенью, прикрепившись таким образом, они выделяют в просвет между собой и мишенью белок, "продырявливающий" мембрану клетки-мишени, в результате чего клетка гибнет. Затем они открепляются от мишени и переходят на другую клетку, и так несколько раз. Кроме того Т-киллер может уничтожать клетку с помощью специальных токсических веществ или дает ей сигнал к апоптозу (запрограммированной клеточной гибели). Т-цитотоксические лимфоциты киллеры - Каждая клетка имеет один тип специфических рецепторов, распознающих единственный тип антигенов. Естественные или натуральные киллеры (NK-клетки), в основном, обладает теми же свойствами что и Т-цитотоксические лимфоцит, но для распознавания чужеродных антигенов они не использую специфические рецепторы, а реагирую на наиболее часто встречающиеся антигены. В результате этого они осуществляют свою функцию намного раньше, чем цитотоксические лимфоциты, и являются «первой линией» обороны организма. Иммунитет, опосредованный клетками. Противоинфекционный или противоопухолевый иммунный ответ, в котором антителам принадлежит не ведущая, а вспомогательная роль.
Слайд 48
48 Введение. Иммунная система. Взаимосвязь клеточного и гуморального иммунитета. Полностью разделить клеточный иммунитет и гуморальный невозможно: В инициации образования антител участвуют клетки, В некоторых реакциях клеточного иммунитета важную связующую функцию выполняют антитела. Не существует клеточного иммунитета без образования антител, которые способны различными путями модифицировать опосредованный клетками иммунный ответ. При скоординированном иммунном ответе происходит многосторонний обмен сигналами между различными типами вступающих в него лейкоцитов и тканевыми клетками. Существенную роль в работе иммунной системы играют так называемые дендритные (ветвистые) клетки, часть которых находится непосредственно под кожей и слизистой оболочкой человека. Такие клетки (антигенпредставляющие) захватывают микробы и вирусы, проникающие через слизистую, а затем переносят в лимфоузлы, где "представляют" их В- и Т- лимфоцитам, которые их атакуют. Т-лимфоциты способны выполнять свои функции только при определенных условиях и поддержке других клеток, таких как В-лимфоциты и различные фагоцитирующие клетки, в первую очередь макрофаги - большие по размерам клетки, поглощающие и переваривающие микробы и другие погибшие клетки, которые так же являются антигенпредставляющими. Макрофаги могут уничтожать инфицированные или измененные клетки, если на их поверхности прикрепились антитела (антитело-зависимая клеточная цитотоксичность) или поглощая их и переваривая в специальных фаголизасомах. Захват бактерий или антигенов существенно облегчается после опсонизации их комплементом или антителами. Ретикулоэндотелиальная (макрофагическая) система (РЭС). С овокупность защитных клеток в организме способных к фагоцитозу (гистиоциты соединительной ткани, моноциты крови, эндотелий капилляров, купферовские клетки печени). К РЭС относят клетки ретикулярной ткани, эндотелия синусоидов (расширенных капилляров) кроветворных и др. органов, а также все виды макрофагов, объединяемых на основании общего происхождения из стволовой кроветворной клетки в систему мононуклеарных (одноядерных) фагоцитов Функция - з ахватывают и переваривают бактерии и различные чужеродные или токсичные частицы, участвуют в кроветворении и выработке антител.
Слайд 49
49 Введение. Презентация антигена Процесс представления антигена (доминантного пептида) в комплексе с молекулами Главного Комплекса Гистосовмести (МНС – Main Histocompatibility Complex) на поверхности П A К клетки-мишени. В ходе презентации антилена компоненты системы врожденного иммунитета, стимулируют иммунный ответ системы приобретенного иммунитета путем представления (презентации) захваченного ими антигена патогенного микроба Т-лимфоцитам. Способностью презентировать антиген и активировать приобретенный иммунитет обладает большинство клеток организма. Кроме того существуют специализированные клетки иммунной системы, для которых презентация антигена Т лимфоцитам является их главной функцией это макрофаги, В-лимфоциты и дендритные клетки. Собственные клетки организма, в частности, экспрессируют (производят) специальные антигены, позволяющие отличать их от чужих. Кроме того, собственные клетки, зараженные вирусами, либо раковые перестают экспрессировать антигены для опознавания иммунной системой и также подвергаются атаке как чужие. Презентация антигена. Сверху -Чужеродный антиген (1) захватывает и поглощает антиген-презентирующая клетка (2 ), которая его расщепляет и частично экспонирует на своей поверхности в комплексе с молекулами MHC II (3). Внизу весь чужеродный антиген связывается поверхностными антителами (5) В-лимфоцита (6), также поглощается и процессируется им (7), после чего часть чужеродной молекулы презентируется в комплексе с молекулами MHC II (8). После контакта (10) с Т-лимфоцитом хелпером, 4), уже активированным антиген-презентирующей клеткой (2), В-лимфоцит начинает секретировать антитела в кровь (9). Презентация антигена стимулирует дифференцировку незрелых Т-лимфоцитов в T- киллеры CD8+ клетки или Т-хелперы CD4+. Опознавание антигена В-лимфоциты способны опознавать антиген непосредственно, Т-лимфоциты в отсутствие презентации антигена на это не способны (MHC-рестрикция) за исключением полимеров с антигеном в цепи, которые вызывают неспецифическую активацию лимфоцитов с массированным выбросом цитокинов. Рецепторы Т-лимфоцитов взаимодействуют с антигеном только в том случае, если он связан молекулой главного комплекса гистосовместимости (MHC).
Слайд 50
50 Введение. Презентация антигена Главный Комплекс Гистосовместимости МНС- II и МНС- I Внутриклеточные антигены: класс I Если клетка заражена то МНС-1 синтезируются с вирусного генома реплицирующегося внутри клетки хозяина Либо с антигенов внутриклеточных паразитов С некоторых собственных белков здоровой клетки для опознавания клетки. Все цитоплазматические белки со временем обновляются, и часть их подвергается протеолизу до коротких пептидов в специальных структурах, протеасомах. Специальный белковый комплекс, транспортер, эндоплазматический ретикулум, где они ассоциируются с главным комплексом гистосовместимости (MHC) класса I и вместе с ним попадают на поверхность клетки. Молекулы MHC класса I презентируют Т-лимфоцитам киллерам. MHC класса I экспрессируется всеми клетками организма хозяина (кроме эритроцитов). T- киллеры способны индуцировать гибель собственных клеток организма в ответ на опознавание антигенных пептидов в комплексе с MHC -I, специфичных для клеток, зараженных вирусом, внутриклеточным паразитом или каким-либо еще способом поврежденных и неправильно функционирующих. Внеклеточные антигены: класс II Дендритные клетки (DC) фагоцитируют внеклеточные патогены, такие как бактерии, грибки, полимеры или токсины, Мигрируют в лимфатическую систему, подвергаются созреванию, теряют способность к фагоцитозу и вступают во взаимодействие с Т-лимфоцитами. В своих лизосомах DC процессируют (переваривают) фагоцитированные патогены, белки которых расщепляются до мелких пептидов. Оказавшись в лимфатическом узле, DC представляют эти пептиды на поверхности клетки в комплексе с МHC класса II. Их опознают Т-лимфоциты-хелперы CD4+. По сравнению с MHC класса I, экспрессия молекул MHC класса II существенно ограничена и характерна только для дендритных клеток, активированных макрофагов, В-лимфоцитов, в условиях воспалительного процесса. Молекула класса - I ( MHC -1 ) состоит из тяжелой цепи, включающей три домена: альфа1, альфа2 и альфа3, и одной легкой цепи - бета2-микроглобулина. Связывание антигенного пептида происходит в антиген- связывающей щели,образованной альфа-спиральными участками альфа1- и альфа2-доменов.
Слайд 51
51 Введение в технологию полимеров медико-биологического назначения Тема 7 Влияние полимеров на, систему гемостаза
Слайд 52
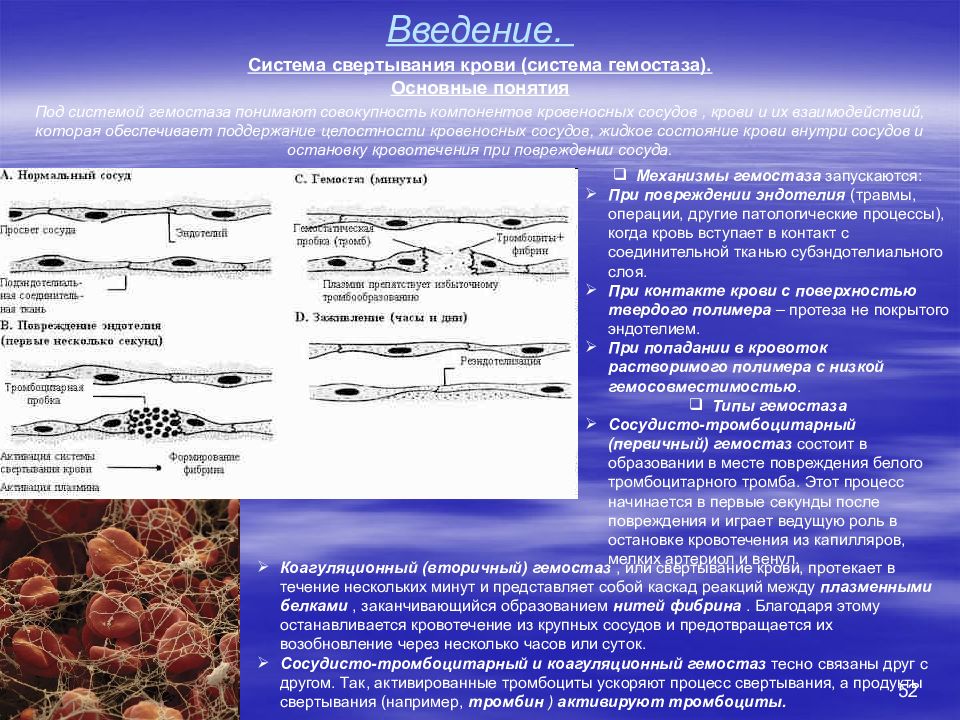
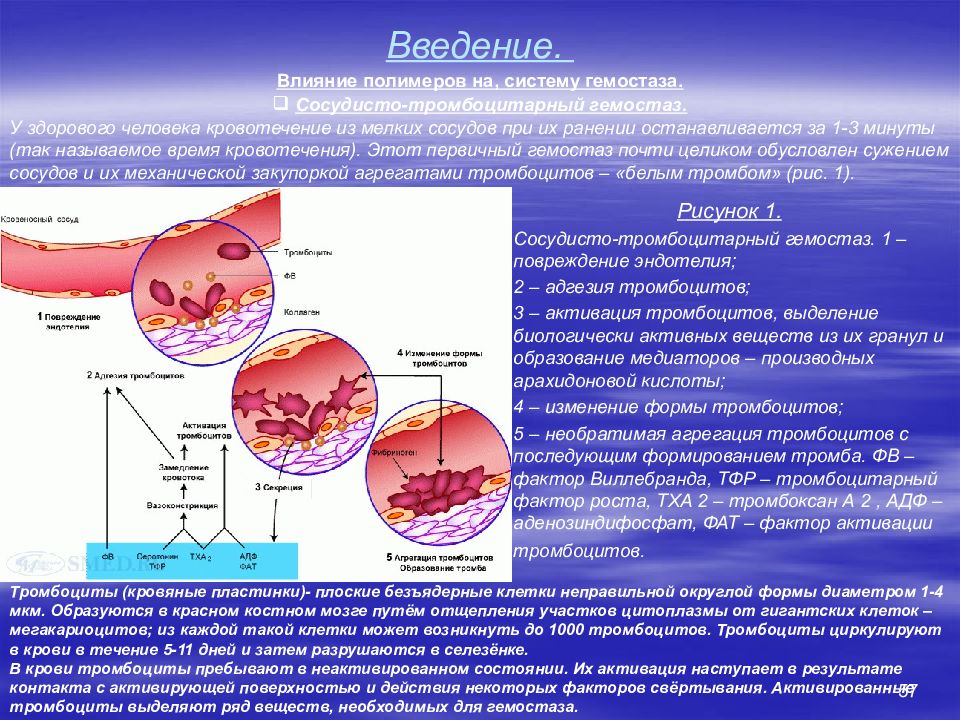
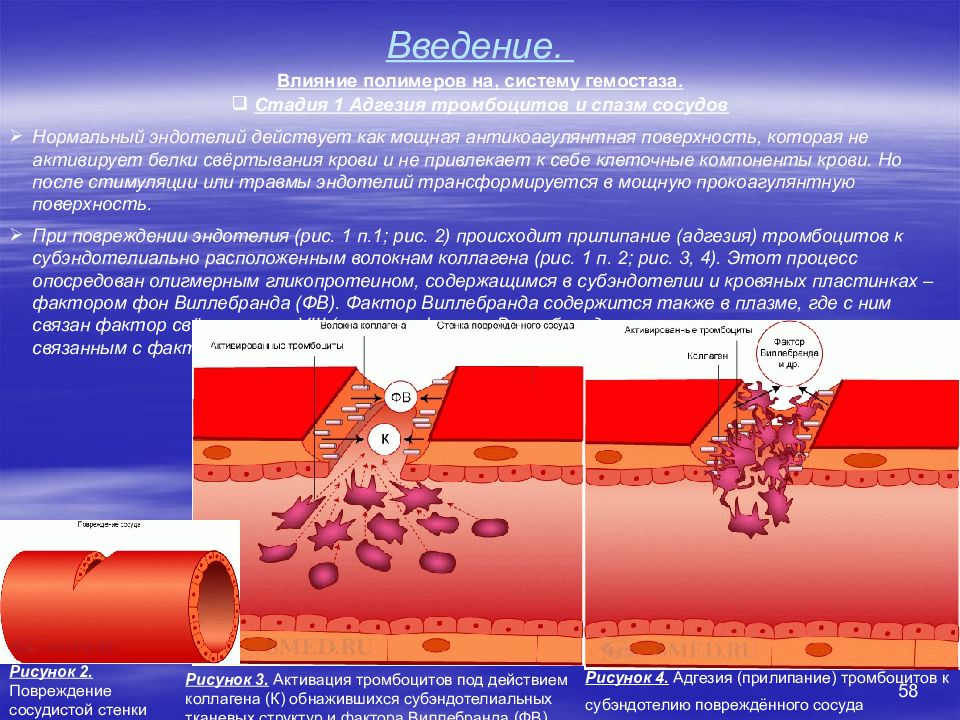
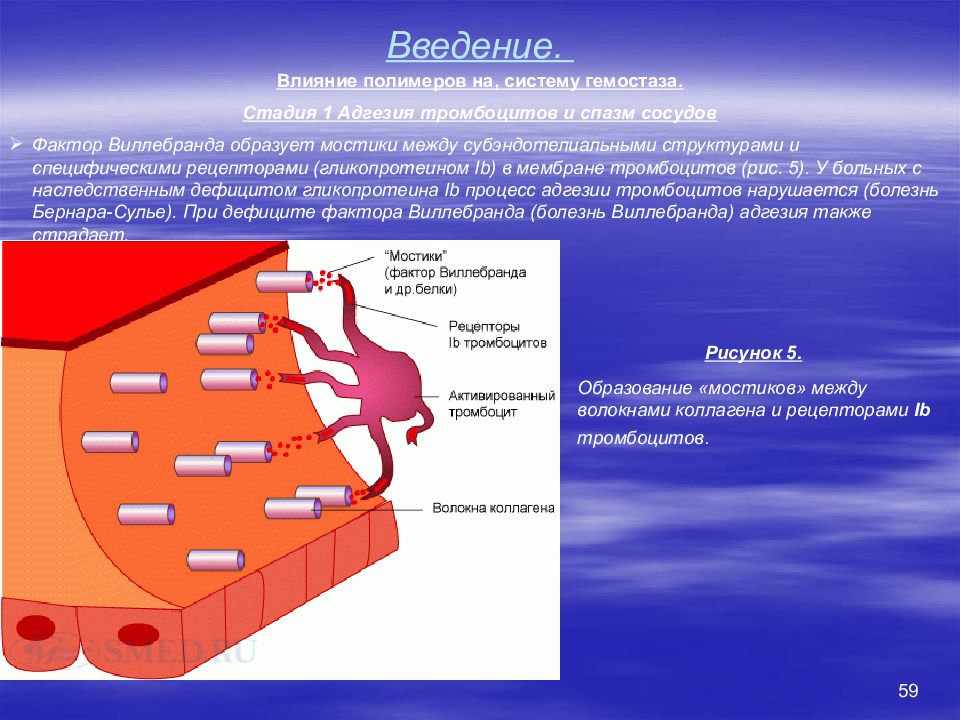
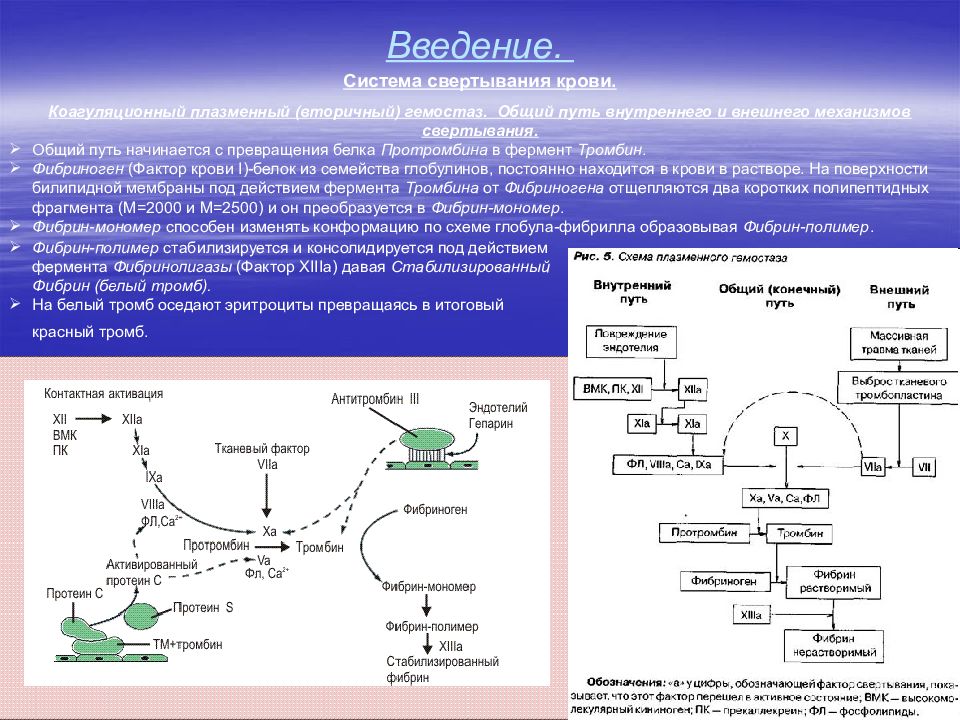
52 Введение. Система свертывания крови (система гемостаза). Основные понятия Под системой гемостаза понимают совокупность компонентов кровеносных сосудов, крови и их взаимодействий, которая обеспечивает поддержание целостности кровеносных сосудов, жидкое состояние крови внутри сосудов и остановку кровотечения при повреждении сосуда. Механизмы гемостаза запускаются: При повреждении эндотелия (травмы, операции, другие патологические процессы), когда кровь вступает в контакт с соединительной тканью субэндотелиального слоя. При контакте крови с поверхностью твердого полимера – протеза не покрытого эндотелием. При попадании в кровоток растворимого полимера с низкой гемосовместимостью. Типы гемостаза Сосудисто-тромбоцитарный (первичный) гемостаз состоит в образовании в месте повреждения белого тромбоцитарного тромба. Этот процесс начинается в первые секунды после повреждения и играет ведущую роль в остановке кровотечения из капилляров, мелких артериол и венул. Коагуляционный (вторичный) гемостаз, или свертывание крови, протекает в течение нескольких минут и представляет собой каскад реакций между плазменными белками, заканчивающийся образованием нитей фибрина. Благодаря этому останавливается кровотечение из крупных сосудов и предотвращается их возобновление через несколько часов или суток. Сосудисто-тромбоцитарный и коагуляционный гемостаз тесно связаны друг с другом. Так, активированные тромбоциты ускоряют процесс свертывания, а продукты свертывания (например, тромбин ) активируют тромбоциты.
Слайд 53
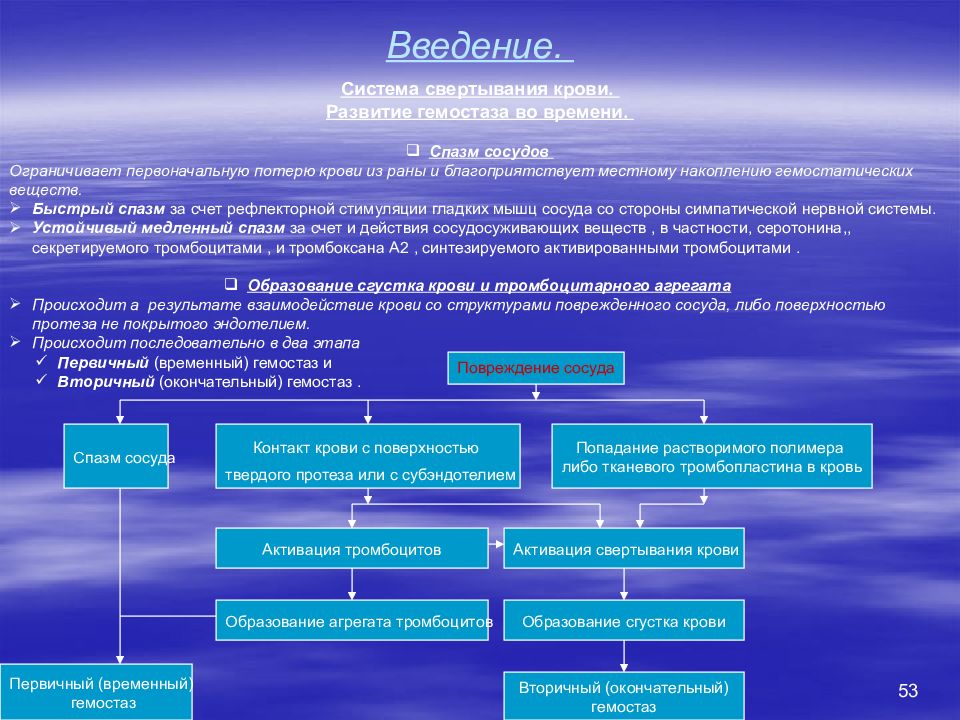
53 Введение. Система свертывания крови. Развитие гемостаза во времени. Спазм сосудов Ограничивает первоначальную потерю крови из раны и благоприятствует местному накоплению гемостатических веществ. Быстрый спазм за счет рефлекторной стимуляции гладких мышц сосуда со стороны симпатической нервной системы. Устойчивый медленный спазм за счет и действия сосудосуживающих веществ, в частности, серотонина,, секретируемого тромбоцитами, и тромбоксана А2, синтезируемого активированными тромбоцитами. Образование сгустка крови и тромбоцитарного агрегата Происходит а результате взаимодействие крови со структурами поврежденного сосуда, либо поверхностью протеза не покрытого эндотелием. Происходит последовательно в два этапа Первичный (временный) гемостаз и Вторичный (окончательный) гемостаз. Повреждение сосуда Спазм сосуда Контакт крови с поверхностью твердого протеза или с субэндотелием Попадание растворимого полимера либо тканевого тромбопластина в кровь Образование сгустка крови Вторичный (окончательный) гемостаз Активация тромбоцитов Активация свертывания крови Образование агрегата тромбоцитов Первичный (временный) гемостаз
Слайд 54
54 Введение. Система свертывания крови. Сосудисто тромбоцитарный (первичный) гемостаз. Primary (temporary) hemostasis - спазм кровеносного сосуда и образования тромбоцитного агрегата - " первичной гемостатической пробки" в зоне контакта крови с нерастворимым полимером либо в зоне повреждения сосуда. Обеспечивают полную остановку кровотечения из капилляров и венул, но кровопотеря из вен, артериол и артерий прекращается лишь частично. Это обусловлено тем, что кровь в них движется под относительно высоким давлением, и поэтому рыхлая структура тромбоцитного агрегата не образует непроницаемую преграду для истечения крови (она проницаема тем более, чем выше давление в сосуде). Является временным и обратимым. Рыхлый тромбоцитарный агрегат проницаем для клеток крови. Начинается в первые секунды после контакта полимерв с кровь либо повреждения сосуда Три этапа сосудисто-тромбоцитарного гемостаза : Адгезия тромбоцитов, Активация и дегрануляция тромбоцитов, Агрегация тромбоцитов.
Слайд 55
55 Введение. Основные механизмы деятельности системы регуляции агрегатного состояния крови: Механизмы гемостаза (их несколько) обеспечивают остановку кровотечения. Механизмы антисвёртывания поддерживают жидкое состояние крови. Механизмы фибринолиза обеспечивают растворение тромба (кровяного сгустка) и восстановление просвета сосуда (реканализацию). В обычном состоянии слегка преобладают противосвёртывающие механизмы, однако при необходимости предотвратить кровопотерю физиологический баланс быстро смещается в сторону прокоагулянтов. Если этого не происходит, развивается повышенная кровоточивость (геморрагические диатезы), преобладание прокоагулянтной активности крови чревато развитием тромбозов и эмболий. Три группы причин, ведущих к развитию тромбоза (триада Вирхова): Повреждение сосудистой стенки (имплантация полимера – контакт нерастворимого полимера с кровью). Изменение состава крови (введение в кровь водорастворимого полимера). Замедление кровотока (стаз в результате воспаления при контакте имплантата с кровью). В структуре артериальных тромбозов преобладает первая причина (атеросклероз); Замедление кровотока и преобладание прокоагулянтных факторов – основные причины венозных тромбозов. Различают два механизма гемостаза: Сосудисто-тромбоцитарный (микроциркуляторный, первичный). Коагуляционный (вторичный, свёртывание крови). Влияние полимеров на систему гемостаза.
Слайд 56
56 Введение. Сосудисто-тромбоцитарный механизм гемостаза обеспечивает остановку кровотечения в мельчайших сосудах (в сосудах микроциркуляторного русла), где имеются низкое кровяное давление и малый просвет сосудов (до 100 мкм). В них остановка кровотечения может произойти за счёт: Сокращения стенок сосудов. Образования тромбоцитарной пробки. Сочетания того и другого. Коагуляционный гемостаз обеспечивает остановку кровотечения в более крупных сосудах (артериях и венах). В них остановка кровотечения осуществляется за счёт свёртывания крови (гемокоагуляции). Полноценная гемостатическая функция возможна только при условии тесного взаимодействия сосудисто-тромбоцитарного и гемокоагуляционного механизмов гемостаза. Тромбоцитарные факторы принимают активное участие в коагуляционном гемостазе, обеспечивают конечный этап формирования полноценной гемостатической пробки – ретракцию кровяного сгустка. В то же время плазменные факторы непосредственно влияют на агрегацию тромбоцитов. При ранениях как мелких, так и крупных сосудов происходит образование тромбоцитарной пробки с последующим свёртыванием крови, организацией фибринового сгустка, а затем – восстановление просвета сосудов (реканализация путём фибринолиза). Реакция на повреждение сосуда зависит от процессов взаимодействия между сосудистой стенкой, циркулирующими тромбоцитами, факторами свёртывания крови, их ингибиторами и фибринолитической системой. Гемостатический процесс регулируется посредством положительной и отрицательной обратной связи, которая поддерживает стимуляцию констрикции (сокращение) сосудистой стенки и образование комплексов тромбоциты-фибрин, а также растворение фибрина и релаксацию сосудов, что позволяет вернуться к нормальному состоянию. Для того чтобы кровоток в обычном состоянии не нарушался, а при необходимости наступало эффективное свёртывание крови, необходимо поддержание равновесия между факторами плазмы, тромбоцитов и тканей, способствующими свёртыванию и тормозящими его. Если это равновесие нарушается, возникает либо кровотечение, либо повышенное тромбообразование. Влияние полимеров на, систему гемостаза.
Слайд 57
57 Введение. Влияние полимеров на, систему гемостаза. Сосудисто-тромбоцитарный гемостаз. У здорового человека кровотечение из мелких сосудов при их ранении останавливается за 1-3 минуты (так называемое время кровотечения). Этот первичный гемостаз почти целиком обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов – «белым тромбом» (рис. 1). Рисунок 1. Сосудисто-тромбоцитарный гемостаз. 1 – повреждение эндотелия; 2 – адгезия тромбоцитов; 3 – активация тромбоцитов, выделение биологически активных веществ из их гранул и образование медиаторов – производных арахидоновой кислоты; 4 – изменение формы тромбоцитов; 5 – необратимая агрегация тромбоцитов с последующим формированием тромба. ФВ – фактор Виллебранда, ТФР – тромбоцитарный фактор роста, TXA 2 – тромбоксан А 2, АДФ – аденозиндифосфат, ФАТ – фактор активации тромбоцитов. Тромбоциты (кровяные пластинки)- плоские безъядерные клетки неправильной округлой формы диаметром 1-4 мкм. Образуются в красном костном мозге путём отщепления участков цитоплазмы от гигантских клеток – мегакариоцитов; из каждой такой клетки может возникнуть до 1000 тромбоцитов. Тромбоциты циркулируют в крови в течение 5-11 дней и затем разрушаются в селезёнке. В крови тромбоциты пребывают в неактивированном состоянии. Их активация наступает в результате контакта с активирующей поверхностью и действия некоторых факторов свёртывания. Активированные тромбоциты выделяют ряд веществ, необходимых для гемостаза.
Слайд 58
58 Введение. Влияние полимеров на, систему гемостаза. Стадия 1 Адгезия тромбоцитов и спазм сосудов Нормальный эндотелий действует как мощная антикоагулянтная поверхность, которая не активирует белки свёртывания крови и не привлекает к себе клеточные компоненты крови. Но после стимуляции или травмы эндотелий трансформируется в мощную прокоагулянтную поверхность. При повреждении эндотелия (рис. 1 п.1; рис. 2) происходит прилипание (адгезия) тромбоцитов к субэндотелиально расположенным волокнам коллагена (рис. 1 п. 2; рис. 3, 4). Этот процесс опосредован олигмерным гликопротеином, содержащимся в субэндотелии и кровяных пластинках – фактором фон Виллебранда (ФВ). Фактор Виллебранда содержится также в плазме, где с ним связан фактор свёртывания VIII (поэтому фактор Виллебранда раньше называли антигеном, связанным с фактором VIII). Рисунок 4. Адгезия (прилипание) тромбоцитов к субэндотелию повреждённого сосуда Рисунок 3. Активация тромбоцитов под действием коллагена (К) обнажившихся субэндотелиальных тканевых структур и фактора Виллебранда (ФВ) Рисунок 2. Повреждение сосудистой стенки
Слайд 59
59 Введение. Влияние полимеров на, систему гемостаза. Стадия 1 Адгезия тромбоцитов и спазм сосудов Фактор Виллебранда образует мостики между субэндотелиальными структурами и специфическими рецепторами (гликопротеином Ib) в мембране тромбоцитов (рис. 5). У больных с наследственным дефицитом гликопротеина Ib процесс адгезии тромбоцитов нарушается (болезнь Бернара-Сулье). При дефиците фактора Виллебранда (болезнь Виллебранда) адгезия также страдает. Рисунок 5. Образование «мостиков» между волокнами коллагена и рецепторами Ib тромбоцитов.
Слайд 60
60 Введение. Стадия 2 Активация тромбоцитов В процессе адгезии происходит активация тромбоцитов. Изменяется их форма (рис.1 п. 4) – они становятся округлыми клетками с шиповидными отростками, с помощью которых связываются с другими тромбоцитами – начинается их агрегация. Коллаген субэндотелия и образующийся локально тромбин (см. раздел коагуляционный гемостаз) заставляют прилипшие тромбоциты секретировать содержимое гранул (рис.1 п. 3; рис. 6): фактор Виллебранда усиливает адгезию, сосудосуживающие вещества (серотонин, катехоламины, тромбоцитарный фактор роста - ТФР) уменьшают просвет сосудов, который перекрывается массой тромбоцитов, прилипших к коллагеновым волокнам. Кровоток замедляется. Влияние полимеров на, систему гемостаза. Рисунок 6. Последствия реакции освобождения биологически активных веществ из поврежденной ткани и тромбоцитов. АДФ – аденозиндифосфат, КА – катехоламины, С – серотонин. Точная последовательность событий, происходящих при активации тромбоцитов, пока не выяснена. Это связано, в частности, с тем, что на некоторых этапах существует положительная обратная связь – активированные тромбоциты выделяют вещества, которые в свою очередь вызывают активацию тромбоцитов. В качестве примеров можно привести действие АДФ и петлю обратной связи, включающую активацию тромбоцитарного фактора 3 и эффект тромбина (рис. 8). Эти взаимодействия приводят к лавинообразному усилению процесса, т.е. тромбоциты всё быстрее вовлекаются в реакцию.
Слайд 61
61 Введение. Влияние полимеров на, систему гемостаза. Стадия 3 Агрегация тромбоцитов Коллаген и тромбин также стимулируют фосфолипазы тромбоцитарной мембраны, освобождая арахидоновую кислоту из её фосфолипидного слоя. Арахидоновая кислота посредством тромбоцитарной циклооксигеназы (ЦОГ-1) превращается в простагландины H 2 и G 2 (PGH 2 и PGG 2 ), из которых образуются тромбоксаны A 2 (TxA 2 ) и B 2 (TxB 2 ) (рис. 1, рис. 8). Указанные простагландины, TxA 2 вместе с выделяемыми из гранул тромбоцитов аденозиндифосфатом (АДФ) и фактором активации тромбоцитов (ФАТ) (рис. 1 п. 3) инициируют необратимую агрегацию циркулирующих тромбоцитов (из которых, в свою очередь, также выделяются биологически активные вещества) и закрытие участка поражения тромбоцитарной «пробкой» (рис. 1. п. 5; рис. 7). Тромбоксан А 2, кроме того, усиливает суживание сосудов. При распаде тромбоцитов в среду выходят фосфолипопротеины их мембраны – тромбоцитарный фактор 3, участвующий в коагуляционном гемостазе (служит матрицей, на поверхности которой происходит формирование теназного и протромбиназного комплексов). Для необратимой агрегации тромбоцитов необходим также фибриноген. Это вещество не только служит предшественником фибрина, образующего сеть, в которой запутываются тромбоциты в ходе образования сгустка (коагуляционный гемостаз), но также вступает в специфическую реакцию с рецепторами активированных кровяных пластинок (гликопротеинами IIb и IIIa). Эти гликопротеины также обеспечивают взаимодействие тромбоцитов с субэндотелиально расположенным фибронектином, способствуя адгезии. Полагают, что подобно фибриногену действуют гликопротеины фибронектин и тромбоспондин, содержащиеся в альфа-гранулах кровяных пластинок. На периферии тромбоцитарной пробки происходит дезагрегация тромбоцитов из-за выделения антиагрегантов, в частности простациклина (PGI2), окиси азота (NO), аденозиндифосфотазы (АДФазы) и других ферментов, синтезируемых интактными соседними эндотелиальными клетками.
Слайд 62
62 Введение. Влияние полимеров на, систему гемостаза. Стадия 3 Агрегация тромбоцитов Рисунок 7. Агрегация тромбоцитов и образование тромбоцитарного тромба («белого тромба») Такой первичной тромбоцитарной пробки достаточно для того, чтобы начался гемостаз, и незамедлительно остановилось развившееся кровотечение, но сама по себе она не в состоянии длительное время поддерживать целостность сосуда.
Слайд 63
63 Введение. Влияние полимеров на, систему гемостаза. Рисунок 8. Схема адгезии, активации и агрегации тромбоцитов. Пояснения в тексте. АДФ – аденозиндифосфат; PGG 2 и PGH 2 – простагландины G 2 и H 2. Антиагреганты Ацетилсалициловая кислота (аспирин) селективно и необратимо ацетилирует фермент циклооксигеназу (ЦОГ), катализирующую первый этап биосинтеза простаноидов из арахидоновой кислоты. В невысоких дозах препарат влияет преимущественно на изоформу ЦОГ-1. В результате в циркулирующих в крови тромбоцитах прекращается образование тромбоксана A 2, обладающего проагрегантным и сосудосуживающим действием. Метаболиты производных тиенопиридина ( клопидогрел, тиклопидин ) необратимо модифицируют рецепторы 2PY 12 на мембране тромбоцитов, в результате блокируется связь АДФ с его рецептором на мембране тромбоцита, что приводит к угнетению агрегации тромбоцитов. Дипиридамол угнетает фермент фосфодиэстеразу в тромбоцитах, что приводит к накоплению в тромбоцитах цАМФ, обладающего антиагрегантным действием. Блокаторы гликопротеинов IIb/IIIa тромбоцитов ( абциксимаб, тирофибан и эптифибатид ) воздействуют на конечную стадию агрегации, блокируя участок взаимодействия гликопротеинов IIb/IIIa на поверхности тромбоцитов с фибриногеном и другими адгезивными молекулами. Активаторы агрегации К агрегации тромбоцитов даже в отсутствии внешних повреждений могут приводить дефекты эндотелиальной оболочки сосудов или поверхность протеза. В качестве местного кровоостанавливающего средства используется губка гемостатическая коллагеновая, усиливающая адгезию и активацию тромбоцитов, а также запускающая коагуляционный гемостаз по внутреннему пути.
Слайд 64
64 Введение. Влияние полимеров на, систему гемостаза. Коагуляционный гемостаз После того как образуется тромбоцитарный сгусток, степень сужения поверхностных сосудов уменьшается, что могло бы привести к вымыванию сгустка и возобновлению кровотечения. Однако к этому времени уже набирают достаточную силу процессы коагуляции фибрина в ходе вторичного гемостаза, обеспечивающего плотную закупорку повреждённых сосудов «красным тромбом», содержащим не только тромбоциты, но и другие клетки крови, в частности эритроциты. Постоянная гемостатическая пробка формируется при образовании тромбина посредством активации свёртывания крови. Тромбин играет важную роль в возникновении, росте и локализации гемостатической пробки. Он вызывает необратимую агрегацию тромбоцитов (неразрывная связь коагуляционного и сосудисто-тромбоцитарного звеньев гемостаза) (рис. 8) и отложение фибрина на тромбоцитарных агрегатах, образующихся в месте сосудистой травмы. Фибрино-тромбоцитарная сеточка является структурным барьером, предотвращающим дальнейшее вытекание крови из сосуда, и инициирует процесс репарации ткани. Свёртывающая система крови – это фактически несколько взаимосвязанных реакции, протекающих при участии протеолитических ферментов. На каждой стадии данного биологического процесса профермент (неактивная форма фермента, предшественник, энзимоген) превращается в соответствующую сериновую протеазу. Сериновые протеазы гидролизуют пептидные связи в активном центре, основу которого составляет аминокислота серин. Тринадцать таких белков (факторы свёртывания крови) составляют систему свёртывания их принято обозначать римскими цифрами, активированную форму обозначают прибавлением индекса «а» (ФVIIа – активированный фактор VIII). Из них семь активируются до сериновых протеаз (факторы XII, XI, IX, X, II, VII и прекалликреин), три являются кофакторами этих реакций (факторы V, VIII и высокомолекулярный кининоген ВМК), один – кофактор/рецептор (тканевой фактор, фактор III), ещё один – трасглутаминаза (фактор XIII) и, наконец, фибриноген (фактор I) является субстратом для образования фибрина, конечного продукта реакций свёртывания крови (таблица 1). Для пострибосомального карбоксилирования терминальных остатков глутаминовой кислоты факторов свёртывания II, VII, IX, X (витамин К-зависимые факторы), а также двух ингибиторов свёртывания (протеинов C (си) и S) необходим витамин К. В отсутствии витамина К (или на фоне приёма непрямых антикоагулянтов, например, варфарина) печень содержит лишь биологически неактивные белковые предшественники перечисленных факторов свёртывания. Витамин К – необходимый кофактор микросомальной ферментной системы, которая активирует эти предшественники, превращая их множественные N-концевые остатки глутаминовой кислоты в остатки γ -карбоксиглутаминовой кислоты. Появление последних в молекуле белка придёт ему способность связывать ионы кальция и взаимодействовать с мембранными фосфолипидами, что необходимо для активации указанных факторов. Активная форма витамина К – восстановленный гидрохинон, который в присутствии O 2, CO 2 и микросомальной карбоксилазы превращается в 2,3-эпоксид с одновременным γ-карбоксилированием белков. Для продолжения реакций γ –карбоксилирования и синтеза биологически-активных белков витамин К опять должен восстановиться в гидрохинон. Под действием витамин-К-эпоксидредуктазы (которую ингибируют терапевтические дозы варфарина) из 2,3-эпоксида вновь образуется гидрохиноновая форма витамина К (рис. 13). Для осуществления многих реакций коагуляционного гемостаза необходимы ионы кальция (Ca ++, фактор свёртывания IV, рис. 10). Связывание кальция останавливает гемостаз.
Слайд 65
65 Введение. Система свертывания крови. Коагуляционный плазменный (вторичный) гемостаз. Общий путь внутреннего и внешнего механизмов свертывания. Общий путь начинается с превращения белка Протромбина в фермент Тромбин. Фибриноген (Фактор крови I )-белок из семейства глобулинов, постоянно находится в крови в растворе. На поверхности билипидной мембраны под действием фермента Тромбина от Фибриногена отщепляются два коротких полипептидных фрагмента (М=2000 и М=2500) и он преобразуется в Фибрин-мономер. Фибрин-мономер способен изменять конформацию по схеме глобула-фибрилла образовывая Фибрин-полимер. Фибрин-полимер стабилизируется и консолидируется под действием фермента Фибринолигазы (Фактор Х III а ) давая Стабилизированный Фибрин (белый тромб). На белый тромб оседают эритроциты превращаясь в итоговый красный тромб.
Слайд 66
66 Введение. Система свертывания крови. Регуляция свертывания Процесс свертывания крови регулируется весьма точно. Такая регуляция чрезвычайно важна - свертывающий потенциал одного миллилитра крови достаточен для свертывания всего фибриногена в организме за 10-15 с. Лишь небольшая часть факторов свертывания превращается в активную форму. Благодаря этому тромб не распространяется за пределы области повреждения сосуда по сосудистой системе, а тромбоцитный агрегат, становится локальным полем для взаимодействия факторов свертывания крови, адсорбированых на мембранах клеток. Жидкое состояние крови поддерживается благодаря: Движению крови(снижающему концентрацию реагентов). Адсорбции факторов свертывания эндотелием а также тромбина фибрином. Благодаря естественным антикоагулянтам. Естественные антикоагулянты Антитромбин III связывает все активированные факторы свертывания, относящиеся к сериновым протеазам, за исключением фактора VII. Его активность резко увеличивается гепарином и гепариноподобными молекулами на поверхности эндотелия. Это свойство гепарина лежит в основе его антикоагулянтного действия. Протеин С превращается в активную протеазу тромбином после связывания обеих молекул с тромбомодулином - белком на мембране эндотелиальных клеток. Активированный протеин С разрушает путем частичного протеолиза фактор Va и фактор VIIIa, замедляя две ключевые реакции свертывания. Кроме того, протеин С стимулирует выделение тканевого активатор плазминогена эндотелиальными клетками. Протеин S служит кофактором протеина С. Все естественные антикоагулянты, ингибиторы тромбина, гепарин и его производные и другие кофакторы используются для придания тромборезистентных свойств полимерам.
Слайд 67
67 Введение. Система свертывания крови. Растворение тромба – фибринолиз. Фибринолиз и восстановление стенки сосуда начинаются сразу же после образования фибринового тромба Активаторы фибринолиза Фрагменты фактора XII, Урокиназа и – Тканевый активатор плазминогена. Механизм фибринолиза Активаторы выходят из эндотелиальных клеток и превращают адсорбированный на нитях фибрина плазминоген в плазмин. Плазмин расщепляет фибрин-полимер на мелкие фрагменты, которые затем поглощаются макрофагами. Хотя плазмин может расщеплять также и фибриноген, в норме этот процесс всегда ограничен, поскольку: Тканевой активатор плазминогена лучше активирует плазминоген, если он адсорбирован на нитях фибрина. При попадании плазмина в кровоток он быстро связывается и нейтрализуется альфа2-антиплазмином Эндотелиальные клетки выделяют антиактиватор плазминогена 1, который блокирует действие плазмина. Ингибиторы плазминогена и урокиназа используются в полимерных лекарствах для растворения тромбов, а так же для тромборезистентных покрытий протезов Эндотелий - тромборезистентные свойства Высокой тромборезистентностью в кровотоке обладают протезы, поверхность которых способна обрастать эндотелием. Эндотелий - моносло эндотелиальных клеток - уплощенных, полигональных, удлиненных клеток, - выстилающий внутреннюю поверхность кровеносных сосудов. При отсутствии каких-либо повреждений эндотелиоциты обладают тромборезистентными свойствами связанными со следующими его особенностями: Отрицательным зарядом нма поверхности, обращенной в сторону просвета сосуда (внешние мембраны тромбоцитов имеют такой же заряд); Наличием в нем фермента ( АДФ-аза ), вызывающего расщепление АДФ, сильного стимулятора агрегации тромбоцитов; Способностью синтезировать вещества, угнетающие функциональную активность тромбоцитов ( простациклин, NO и 13-гидрокси-9,11- октадекадиеновая кислота. Способностью связывать и инактивировать тромбин (посредством тромбомодулина ); Наличием в нем ингибиторов протеаз системы свертывания крови ( антитромбин III и альфа2-макроглобулин ); 6) способностью синтезировать гликозаминогликаны, в результате активности которых ускоряют свое действие естественные антикоагулянты ; Способностью синтезировать и высвобождать в кровоток активатор плазминогена ( тканевой активатор плазминогена ).
Слайд 68
68 Введение. Влияние полимеров на, систему гемостаза. Антикоагулянты Гепарины(нефракционированный гепарин – НФГ и низкомолекулярные гепарины – НМГ), взаимодействует с АТ III и селективно ингибирует ФXa, Варфарин - прямой ингибитор тромбина: липерудин, аргатробан, бивалирудин. Ингибиторы фактора IIa (дабигатран) и фактора Xa (ривароксабан, апиксабан). Тромболитики Рекомбинантный тканевой активатор плазминогена, стрептокиназа, урокиназа. Препараты способствующие свертыванию крови. Коллагеновая кровоостанавливающая губка способствует местному гемостазу за счёт активации тромбоцитов и факторов свёртывания контактной фазы (внутренний путь активации гемостаза). Препараты, подавляющие фибринолиз (гемостатические средства). ε-аминокапроновая кислота блокирует лизинсвязывающие участки плазминогена и плазмина, препятствуя их соединению с фибрином. В качестве её аналога применяется транексамовая кислота (циклокапрон). Апротинин – природный ингибитор протеаз, получаемый из бычьих лёгких. Он подавляет действие многих веществ, участвующих в воспалении, фибринолизе, образовании тромбина. К числу этих веществ относятся калликреин и плазмин.
Слайд 69
69 Введение в технологию полимеров медико-биологического назначения Часть2 Полимерные имплантаты. Тема 2 Гемосовместимые (тромборезистентные) полимеры.
Слайд 70
70 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Гемосовместимость – свойство полимеров не вызывать изменения функций крови. Трамборезистентность – частный случай гемосовмемтимости – способность полимера не везывать образования тромба в условиях контакта с кровью Гемосовместимые материалы должны: Не провоцировать образование тромбов Не активировать систему гемостаза и систему комплемента Не оказывать воздействие на белки и клетки крови Не влиять на электролитный баланс крови Ни сами полимеры, ни компоненты выделяющиеся из полимеров, не должны быть аллергенны, канцерогенны, токсичны, тератогенны и т.д. Факторы влияющие на тромборезистентные свойства протеза: Характер потока – пульсирующий непульсирующий Профиль потока (ламинарный, турбулентный, наличие застойных зон) Скорость потока Особенности взаимодействия материала с кровью Наличие общего воспаления Физико-химические свойства материала Химическое строение поверхности ( наличие «узнаваемых» групп, специфичность во взаимодействии с белками и клетками крови, полярные –неполярные группы, гидрофильно-гидрофобный балланс) Микроструктура поверхности, проявляющаяся в соотношении кристаллических и аморфных доменов Топография поверхности – шероховатость, пористость, дефекты и газовые включения (чем более гладкая тем лучше. Молекулярная подвижность макромолекул и их концов в поверхностном слое. Способность материала к биодеградации (растворению) или к кальцификации (для нерастворимых). Поверхность протеза находится в прямом контакте с потоком крови первые несколько минут, затем покрывается слоем белка, затем клеток и уже этот слой взаимодействует с потоком крови.
Слайд 71
71 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Принципиальные подходы к созданию гемосовместимых материалов. Создание материала с низкой сорбцией на поверхности белков и форменных элементов крови. Отсутствие групп афинных к белку (полярных, биоспецифических) Углеродные волокна. Полностью «искусственная» неузнаваемая поверхность: Политетрафторэтилен, Полигексафторпропилен, Силоксаны Скорость смывания белка выше скорости абсорбции. Низкая адгезия. Отсутствие многоточечного связывания с «разбавленным» водой полимерным гидрогелем. Создание материалов, при осаждении на поверхность которого компонентов крови, образуется тонкий равномерный тканевой слой. Микронеоднородные поверхности при контакте с которыми белки крови при сорбции не изменяют свою конформацию (сегментированные полиуретаны ). Поверхность похожа на поверхность мембраны эпителиальных клеток. Поверхности способные к фибринолизу. Поверхности способные к биоспецифическому взаимодействию с компонентами крови ( гепариноподобные ) поверхности.
Слайд 72
72 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Гидрогели Полимеры, содержащие большое количество воды (до 99%) Низкая адгезия к гидрогелевой поверхности белков и клеток крови Низкая степень нарушения конформации белков при сорбции вследствие большая подвижность цепей гидрогеля на поверхности и низкой плотностью связей гель – белок вследствие рыхлой структуры геля. Облегченное смывание адсорбированных форменных элементов током крови. Из за низкой прочности гели требуют подложки на которую прививаются химически. Гелями покрывают катеттеры проводники провода и другой инструмент для кардиохирургии Примеры- сшитые водорастворимые полимеры Полиэтиленоксид и взаимно проникающие сетки полиэтиленоксида с полидиметилсилоксанами Полисахариды – декстран, каррагеннан, альгиновая кислота. А вот гели Поли-( N- винил )-2- пирролидона не обладают тромборезистентными свойствами из за комплексообразования с белками крови. Поли-(2-гидроксиэтил)-метакрилат и его сополимеры со стиролом Полиакриламид и его сополимеры с малеиновым ангидридом Поливиниловый спирт
Слайд 73
73 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Неполярные полимеры с неузнаваемой поверхностью Полимеры не имеющие узнаваемых функциональных групп подобных природным полимерам. Полное отсутствие афинной – специфической абсорбции белков крови. Адсорбируют на поверхности тонкий слой альбумина с неизмененной четвертичной структурой. Альбумин – глобулярный амфифильный полимер имеющий как гидрофильные, так и гидрофобные области. При абсорбции на гидрофобную поверхность взаимодействует с ней гидрофобными областями, взаимодействие низко энергетическое, не происходит разворачивания клубка. Примеры- неполярные полимеры. Политетрафторэтилен, вспененный политетрафторэтилен Полигексафторпропилен Полидиметилсилоксан Поли- [ (3,3,3-трифторпропил) метилсилоксан ] Углеродное волокно
Слайд 74
74 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Полимеры с микронеоднородной поверхностью. Имеют на поверхности микронеоднородности чередующиеся с периодом 10-50 нм. Микронеоднородности – чередование липофильных и гидрофильных доменов. Период соответствует периоду чередования гидрофильно – липофильных областей в альбумине и фибронектине, что способствует многоточечному «комплементарному» взаимодействию с образованием тонкого слоя без существенного изменения четвертичной структуры белка при адсорбции. Фибронектин – белок ингибирующий адгезию клеток, если он не изменен, и активирующий, если изменен. Полярность поверхностных групп должна быть низкой и сбалансирована так, чтобы не уродовать альбумин сильным связыванием. Поверхность создают как синтезом сополимеров так и плазменной обработкой через «маску». Наиболее распространенные полимеры – сегментированные полиуретаны имеющие в структуре чередующиеся гибкие и жесткие сегменты. Гибким сегментом может быть блок полисилоксана, поликарбоната или полиэфира
Слайд 75
75 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Полимеры с микронеоднородной поверхностью. Сигментированные полиуретаны, Исходные вещества. Олигомеры простых и сложных полиэфиров, полидиметилслоксанов и поликарбонатов с концевыми гидроксильными группами. Диизоцианаты: 2,4-толуилендиизоцианат 4,4 ’- дифенилметандиизоцианат, 4,4 ’- дициклогексилметандиизоцианат. Удлиннители цепи: зтилендиамин, 1,4-бутандиамин Функциональные группы образующиеся при синтезе сегментированных полиуретанов.. Уретановая Мочевинная Амидная
Слайд 76
76 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Примеры-сигментированных полиуретанов. Cardiothane (Avco US) - 90% простого полиэфира, 10% полидиметилсилоксана и ароматического диизоцианата – перерабатывается из раствора Pellethane (Dow Chemical US) – политетраметиленоксид, 1, 4- бутандиол и дифенилметан -4,4 ’ -диизоцианат. TecoflexTM (Thermedics US) – простой полиэфир, циклогексилметан -4,4 ’ – диизоцианат и может быть добавлен полидиметилсилоксан. Перерабатывается экструзией и из раствора. Biomer (Ethicon US) политетраметиленоксид, этилендиамин и дифенилметан -4,4 ’ -диизоцианат. Vascugraf (Braun Germany) – полиуретанкарбонат для хирургических волокон. Биодеградация в организме Полиуретаны способны к гидролизу с участием неспецифических протеолитических ферментных систем (папаина, химотрипсина, трипсина, катепсина С, фицина. Устойчивы к специфическим протеазам коллагеназе, оксидазам – ксантиноксидазе, цитохром С оксидазе. Не подвергаются распаду в среде острой воспалительной реакции. Уретановая группа разлагается папаином – NH-C(O)-O- + H 2 O = -NH 2 + CO 2 + HO- Мочевинная группа разлагается уреазой – NH-C(O)-NH- + H 2 O = -NH 2 + CO 2 + H 2 N- Введение простых эфирных групп уменьшает устойчивость к окислению, особенно в присутствии ионов металлов (композиционные материалы), для предотвращения вводят антиоксиданты – витамин Е. Скорость биодеградации можно регулировать меняя соотношение уретановых гидролизуемых и полиэфирных (простых) негидролизуемых групп. Может меняться от нескольких недель для губок до десятков лет для кардио протезов. Модификация свойств Введение фторсодержащих сомономеров повышает устойчивость к лизосомальным ферментам. Модификация концевых групп повашает стойкость к окислению. Сополимеры с простыми эфирными сомономнрами более стойки к биоразложению по сравнению с силоксановыми и олигокарбонатными. Скорость деструкции может быть существенно увеличена введением в основную цепь сахаров, капролактона, диуретановых групп на основе моноэтаноламина, желатиновых фрагментов.
Слайд 77
77 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Полимеры с поверхностью, способной к биоспецифическому взаимодействию с кровью. Покрытие гепарином Прививка салициловой кислоты (препятствует аггрегации тромбоцитов) Покрытие холестерином, мукополисахаридом из утиных яиц, линейными и циклическими олигопептидами, олигосахаридами напоминающими мембранный гликокаликс. Гепаринизация поверхности. Гепарин синтезируется в тучных клетках, скопления которых находятся в органах животных, особенно в печени, лёгких, стенках сосудов. По химической природе гепарин — серосодержащий мукополисахарид, состоящий из глюкозамина, глюкуроновой кислоты и связанных с ними остатков серной кислоты. Молекулярная масса около 20 000 Да. Прерывает процесс свертывания крови путем многократного повышения активности антитромбина, который ингибирует тромбин – фермент вызывающий образование нерастворимого фибрина. В крови разрушается ферментом – гепариназой. Способы связывания гепарина с поверхностью. Сорбция за счет сил межмолекулярного взаимодействия – кратковременная гепаринизация. Образование ионного комплекса. Включение в сшитые гелевые слои – активно до 30-40 дней в условиях артериального кроаотока. Ковалентное связывание с материалом поверхности в том числе с использованием макромономеров. Связывание в два этапа. Сначала покрытие поверхности полимером с введенным в структуру полимера веществом афинным гепарину, а затем связывание гепарина внешнего либо собственного из крови. Гепариноподобные поверхности и полимеры. Поверхности гидрогелей, содержащих сульфогруппы особенно на основе полисахаридов. Сульфированный хитозан, комплексы альбумин – хитозан, каппа каррагеннан. Полимеры содержащие сульфогруппы – SO 3 H, сульфамидные -NH-SO 3 H, сульфоэфирные –O-SO 3 H. П-сульфостирол, винилсульфокислоты, сульфированные и карбоксилированные сополимеры изопрена со стиролом, сегментированные полиуретаны сульфированные 1,3-пропансульфоном или натриевой солью 3-амино-1-пропансульфоновой кислоты, полиуретаны с привитой 2-акриламидо-2-метилпропансульфоновой кислотой либо окссиэтилированные с концевой сульфогруппой.
Слайд 78
78 Часть 2 Полимерные имплантаты. Гемосовместимые и тромборезистентные материалы. Поверхности способные к фибринолизу. Фибриолиз – способность ряда протеолитических ферментов растворять фибрин тромба. Ферменты связывают (иммобилизуют) на поверхности тем самым временно повышая ее тромборезистентность. Иммобилизация трипсина на ПЭТФ – замедляет тромбообразование на 3-6 месяцев. Полимеры обрабатываемые: ПЭТФ, полиамиды, полиуретаны, сшитый коллаген, полигликолиды. Ферменты – стрептокиназа, урокиназа, плазминоген, трипсин совместно с гепарином. Поверхности моделирующие поверхность эндотелия. Моноклональные антитела к клеткам эндотелия пришитые к поверхности полимера. Моноклональные антитела к фибробластам с последующим обрастанием слоем эндотелия Липидные слои имитирующие мембраны. Введение в полимер фосфолипидов, способных к полимеризации. Сополимеры на основе метакрилоилоксиэтилфосфатидилхолина и акрилатов: н- бутилметакрилата, додецилметакрилата, 2-этилгексилметакрилата, 2-гидроксиэтилметакрилата, циклогексилметакрилата. Введение этих сополимеров в сегментированные полиуретаны.
Слайд 79
79 Часть2 Полимерные имплантаты. Введение в технологию полимеров медико-биологического назначения Тема 1 Процессы, протекающие в системе полимерный имплантат – живой организм.
Слайд 80
80 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Основные Термины
Слайд 81
81 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Введение имплантата в организм – хирургическая операция с нарушеием целостности живой ткани Основные процессы. Воспалительный процесс. Биодеградация имплантата. Изоляция имплантата - образование тканевой капсулы. Основные процессы начинаются одновременно, но затем какой либо из процессов становится главным. Побочные процессы. Исторжение – выталкивание имплантата в ближайшую полость. Некроз окружающей ткани – отторжение имплантата. Внутренний кальциноз или образование внешней кальций фосфатной капсулы Динамическое взаимодействие с окружающими тканями Выделение токсинов из имплантата
Слайд 82
82 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Воспалительный процесс Воспаление - это местная реакция тканей на повреждение, которая характеризуется нарушением микроциркуляции, изменением реакции соединительной ткани и элементов системы крови. Реакция направлена на ограничение, локализацию очага повреждения, уничтожение повреждающего фактора и восстановление поврежденной ткани. Организм жертвует частью ради сохранения целого. Именно развитие воспалительного процесса определяет дальнейшую судьбу имплантата. Приживется, покроется капсулой, деградирует (растворится) или будет отторгнут с некрозом окружающих тканей. Явления при воспадении (все эти явления взаимосвязаны, идут параллельно), Альтерация (повреждение окружающих тканей) Первичная – разрушение в результате травмы Вторичная – повреждение ткани в результате воспаления Экссудация (нарушение микроциркуляции) Пролиферация (восстановление поврежденных тканей). Первая немедленная реакция на травму – локальный спазм сосудов замедление кровотока. Кислородное голодание тканей,нарушение работы митохондрий, переход к гликолизу (анаэробное неполное окисление) накопление молочной кислоты, закисление тканевой жидкости. При несильном воспалении нет значительного закисления (на периферии очага воспаления) нет летальных повреждений клеток кислотой, более того незначительный сдвиг рН стимулирует разрастание грануляционной ткани - образуется грануляционный вал на периферии, здоровая ткань ограничивается от поврежденной. Она богата фиксированными макрофагами, способна поглощать поврежденные клетки, токсины, очищая очаг. Активируются тромбоциты, образуются локальные тромбы вслед за этим тромбоциты освобождают из себя факторы ранозаживления, Равновесие сдвигается на путь инкапсулирования имплантата в тканевую капсулу. При усиливающемся воспалении. Медленно расширяются мелкие артериолы, в них усиливается кровоток, Растягиваются стенки артерий, увеличивается их проницаемость для белков и клеток крови. В ткань выходит белок и все виды клеток иммунной системы способные к хемотаксису (движению в очаг воспаления) – Экссудация, отек, покраснение, повышение температуры. На этой стадии еще возможно избежать отторжения трансплантата. Сильное воспаление, белок в тканях блокирует вены – кровоток падает нарастает дефицит кислорода гликолиз достигает pH =6-5.8 активируются кислые ферменты. Это убивает клетки, начинается некроз тканей – вторичная альтерация. Из клеток выходит белок, соли митохондриальные и лизосомальные ферменты, повышается осмотическое давление и концентрация белка это усиливает некроз по кругу. На этой стадии возможно только отторжение имплантата.
Слайд 83
83 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Воспалительный процесс Экссудация (нарушение микроциркуляции) Атака имплантата клетками крови Через растянутые стенки сосуда в поврежденную ткань вокруг протеза выходят ( экстравазация ) все виды гранулоцитарных лейкоцитов: Нейтрофилы Эозинофилы и Базофилы. Они способны к амебообразному движению в очаг воспаления ( хемотаксис ). Так же выходят агранулоциты – моноциты, которые в тканях превращаются в тканевые макрофаги. Нейтрофилы фагоцитируют мелкий мусор (микрофаги), атакуют протез протеолитическими ферментами и гипохлоритом при помощи фермента миелопероксидазы (зеленый гной), после атаки гибнут оставляя кристаллик фосфата кальция. Могут возвращаться в кровоток из ткани. Эозинофилы – фагоцитируют мелкие частицы и белки, выделяют гистамин – медиатор воспаления, могут поглощать гистамин и уменьшать воспаление. Могут возвращаться в кровоток из ткани. Базофилы – очень слабо фагоцитируют, содержат много медиаторов воспаления гистамина, серотонина, лейкотриенов и простагландинов. Уходя в ткани становятся тучными клетками, назад не возвращаются, способны к дегрануляции с выбросом медиаторов. Вызывают мгновенный локальный спазм с отеком блокирующий распространение интоксикации. Моноциты – очень сильно фагоцитируют крупные частицы. Мигрируют из кровотока в ткани и становятся тканевыми макрофагами, Именно тканевые макрофаги образуют отграничивающий вал вокруг неразрушаемых инородных тел. После фагоцитоза не гибнут в отличие от нейтрофилов. Содержат много лиосомальных ферментов. NK – лимфоциты. Не фагоцитируют но продуцируют Перфорин и две сериновые протеазы. Состав активной среды вокруг имплантата при воспалении. рН – кислый до 5.8; кислоты: фосфорная, соляная, молочная. Высокая концентрация антител – белков, способных связывать и осаждать продукты деградации имплантата. Лизосомальные ферменты (в основном протеазы) из фагоцитов. Медиаторы воспаления. Сериновые протеазы и перфорин. Гипохлорит, миелопероксидаза. Весь комплекс ферментов митохондрий погибших клеток включая оксиредуктазы, гидролазы сахаров, фосфатазы пероксидазы. Ферменты пероксисом: каталаза, супероксиддисмутаза, перекись водорода, супероксиданион радикалы, ОН радикалы.
Слайд 84
84 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Скорость атаки имплантата. Уровень развития воспаления оценивают по уровню активации макрофагов Скорость атаки имплантата целиком зависит от качества поверхности и от места введения имплантата. Образование капсулы. Начинается если имплантат не подвержен биодеградации (растворению) и достаточно биосовместим Макрофаги начинают выделять интерлейкин-1 стимулирующий фибробластов. Через неделю число макрофагов на поверхности снижается и увеличивается число фибробластов – клеток синтезирующих коллаген Лимфоциты и лейкоциты мигрируют из лимфы и крови соответственно и становятся форменными элементами «рыхлой соединительной ткани» - основы капсулы. Клетки внедряются в каналы и поры имплантата прорастают сосудами (вспененный ПТФЭ). В костной системе капсула сначала состоит из соединительной ткани а затем замещается на костную. На образование капсулы влияют: Размер имплантата. Химическое строение материала и покрытия поверхности Фрагментирование поверхности ворсистость, поры. Инфицированность и антигенность поверхности. Место имплантации. Степень биодеградации поверхности. Ослажнения при длительном пребывании Выталкивание (исторжение) имплантата. Некроз окружающих тканей (при инфицировании или выделении токсинов из имплантата. Образование злокачественной опухоли (вибросаркомы) из за механического воздействия на ткани. Чем крупнее имплантат тем вероятнее. Кальцификация – при контакте с кровью – один из аспектов гемосовместимости.
Слайд 85
85 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Взаимосвязь капсулирования и биодеградации Капсулирование- альтернатива биодеградации, причем для организма биодеградация предпочтительнее. Процессы идут параллельно, но с участием разных ферментных систем. Высокая активность кислой фосфатазы – признак деградации Активность щелочной фосфатазы в тканях признак образования новой соединительной ткани. Биодеградация имплантата– рассасывание. Уменьшение массы и размера имплантата в результате двух явлений : Непосредственного перехода в раствор исходных полимеров или продуктов гидролиза Достижения такого уровня фрагментации поверхности, который позволяет фагоцитирующим клеткам удалять выступающие микроучастки. Для водорастворимых полимеров биодеградация – любое изменение химической или физической структуры макромолекулы или агрегата. Рассасывающиеся имплантаты. Шовные материалы. Пленочные материалы для закрытия ран и ожогов. Детали для восполнения недостающей кости. Пеноматериалы для заполнения полостей. Клеящие композиции. Скорость рассасывания должна соотноситься со скоростью замещения живой тканью. Два периода в работе биодеградабельного полимерного материала Функциональный период когда материал выполняет свою функцию. Пассивный период биоразрушения.
Слайд 86
86 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Гидрофильность поверхности, гидролиз. Скорость гидролиза и биодеградации зависит в первую очередь от химического строения полимера Увеличение гидрофильности поверхности ускоряет биодеградацию. Гидрофилизация за счет гидролиза и окисления, появление кислых групп, аминогрупп, спиртовых, групп способных к ионизации, диссоциации и образованию водородных связей с водой. Снижение степени кристалличности ускоряет гидролиз и биодеградацию. Снижение молекулярной массы ускоряет гидролиз. Чем больше в гидрогеле воды, тем быстрее он растворяется при биодеградации. Катализ – общий кислотный, основной, нуклеофильный мицеллярный, межфазный, катализ ионами металлов, но чаще всего ферментативный. Полимеры, способные к быстрой биодеградации Сложные эфиры. Полимеры оксикарбоновых кислот гликолевой и молочной. Полимеры и сополимеры капролактона, полипропиленфумараты Полиангидридимиды и полиангидриды Полиуретаны, блоксополимеры, содержащие уретановые и мочевинные фрагменты, сахаридные группы. Влияние модельной среды на скорость потери массы волокон из полигликолида. 1- 1М карбонатный буфер, 2- Подкожная ткань крыс, 3- 1М Фосфатный, 4 -0.5М фосфатный, 5- вода Схемы гидролиза
Слайд 87
87 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Продукты биодеградации Продукты биодеградации циркулируют с кровью и лимфой, Могут подвергаться дальнейшим превращениям ацилированию, окислению, гидроксилированию, алкилированию, общее неправление – гидрофилизация и деградация. Могут вступать в нормальный метаболизм, сгорать в цикле креббса: гликолевая, молочная кислоты сахара, Выводятся в основном через почки и печень, полисахариды – только через печень, карбоцепные – через почки, причем ВМ фракция забивает почечные канальцы. Продукты деструкции некоторых гетероцепных полимеров Группы продуктов биодеградации Нетоксичные продукты гидролиза включающиеся в нормальный метаболизм сахара, молочная кислота Продукты (мономеры) принимающие участие в дальнейших превращениях (этиленгликоль – окисляется до муравьиной и щавелевой кислот) Нерастворимые продукты выводимые в неизменном виде через печень (коньюгат с желчью) Водорастворимые продукты выводимые в неизменном вида (ПВС) Продукты оседающие в тканях
Слайд 88
88 Часть 2 Полимерные имплантаты. Процессы, протекающие в системе полимерный имплантат – живой организм. Неклеточная и клеточная биодеградация имплантатов. Два механизма распада полимеров после стадии капсулирования Деградация с поверхности – во внешнем диффузно кинетическом слое. ММ и другие свойства в массе не меняются. Деградация в объеме – характерно для быстро набухающих – гидрогелей. Неклеточная деградация с поверхности Если полимер не вызывает воспаления, не иммуногенен и не привлекает фагоцитирующие клетки то начинается с поверхности со стадии неклеточной деградации. Результат – микроэрозия поверхности. Эрозия протекает по гидрофильным и аморфным областям. Образуется губчатый слой. Возрастает поверхность увеличивается скорость выхода продуктов гидролиза. Продукты гидролиза привлекают клетки – мусорщики. Стадия клеточной деградации Обычно клеточная деградация начинается через год и более. Протез атакуют в основном тканевые макрофаги Атакующие ферменты – лизосомальные протеолитические и митохондриальные оксиредуктазы естеразы и гидралазы. Макрофаги прикрепляются к поверхности и могут отрывать частички 20-30 мкм. После фагоцитоза частички макрофаг не гибнет продукты либо усваиваются, либо выбрасываются экзоцитозом (зависит от химического строения). Последовательность процессов при клеточной деградации Концентрирование макрофагов вокруг имплантата Появление фагоцитов и фибробластов Активация макрофагов слияние и появление гигантских клеток Активация митохондрий макрофагов прилипших к имплантату. Обволакивание фрагментов имплантата макрофагами. Включение в гидролиз ферментативных систем лизосом и митохондрий. Полный распад имплантата. Метаболизм клетками продуктов распада
Слайд 89
89 Введение в технологию полимеров медико-биологического назначения Часть 2 Полимерные имплантаты. Тема 5 Основные способы замещения органов и тканей. Типы имплантатов и требования к ним. Реакция организма на имплантат. Введение в технологию полимеров медико-биологического назначения Часть 3. Физиологически активные полимеры. Тема 1 Основные понятия. Классификация Физиологически активных полимеров.
Слайд 90
90 Физиологически активные полимеры. Основные понятия. Физиологически активное вещество (ФАВ) – вещество, независимо от молекулярного веса, которое является действующим началом и обеспечивает главную активность. Физиологически активный полимер (ФАП) – синтетический или искусственный полимер (высокомолекулярное соединение), которое может быть использовано в качестве действующего начала в лекарственном средстве. Лекарственная форма состоит из: ФАВ или ФАП. Средств доставки. Вспомогательных веществ: Загустители. Эмульгаторы. Наполнители. Консерванты. Пролонгаторы. Покрытия для таблеток и т.д. Лекарственное средство – ФАВ или ФАП в лекарственной форме (таблетка, инъекционный раствор, пластырь, мазь, назальные или глазные капли, аэрозоль для ингаляций и т.д.) Фармакокинетика – наука изучающая процессы взаимодействия ФАВ с организмом развивающиеся во времени после введения ФАВ в организм: Поступление в кровь (орган). Накопление в органах. Перераспределение по органам и тканям. Биодеградация метаболизм. Выведение из организма. Биодоступность – отношение количества ФАВ осуществившего свое физиологическое действие к общему количеству ФАВ введенного в организм.
Слайд 92
92 Физиологически активные полимеры. Классификация физиологически активных полимеров (ФАП) Первый ФАП в России создан в 40х годах ХХ столетия – ранозаживляющее средство на основе поливинилбутиловый эфир (винилин) – Бальзам Шостаковского. В Германии в это же время – кровезаменитель поливинилпирролидон. Простой эфир Большинство современных синтетических лекарств – НМ вещества известной химической структуры. Лекарственные вещества природного происхождения в основном смеси либо биополимеры (белки, полисахариды, пептиды). ФАП с собственной активностью Активность возникает только на полимерном уровне и зависит как от химической структуры, так и от молекулярной массы и от ММР. Часто можно выделить минимальный повторяющийся фрагмент необходимый для проявления активности, но низкомолекулярные аналоги не обладают тем же видом активности, что и полимер. Механизм действия не связан с распадом молекул, обусловлен свойствами макромолекул в частности с кооперативными взаимодействиями
Слайд 93
93 Физиологически активные полимеры. Классификация физиологически активных полимеров (ФАП) ФАП прививочного типа Состоят из комбинации полимера-носителя, ФАВ (низкомолекулярного или высокомолекулярного) и вспомогательных групп присоединенных (привитых) к главной цепи полимера. В результате включения ФАВ в полимерную систему ФАП обладает физиологической активностью присоединенного вещества и физико-химическими и биологическими свойствами системы в целом. Прививка ФАВ на носитель позволяет Конструировать ФАП с заданной активностью. Регулировать фврмакокинетику. Изменять длительность действия. Изменять распределение в организме. Осуществлять направленный транспорт ФАВ в орган мишень. Замедлять скорость метаболизма Управлять воздействием ФАП на организм при помощи группировок присоединенных наряду с ФАВ. Использовать специфические свойства макромолекул. Ограниченное распространение при введении в организм Экранирование боковых привитых групп от среды организма Кооперативное взаимодействие с другими макромолекулами.
Слайд 94
94 Введение в технологию полимеров медико-биологического назначения Часть 3. Физиологически активные полимеры. Тема 2 Способы введения полимера в организм. Преодолеваемые биологические барьеры и особенности распределения полимеров в организме.
Слайд 95
95 Физиологически активные полимеры. Способы введения лекарств в организм. Основные: внутривенное введение, внутримышечное, подкожное, внутрибрюшинное, пероральное. Вспомогательные: ректальное, вагинальное. Специальные: инголяционное, нозальное, трансдермальное, внутриглазное. По уменьшению скорости всасывания и ухудшению биодоступности способы введения ФАП в организм в целом можно расположить в следующем порядке: Основные способы введения в кровоток Внутривенное (парэнтеральное ) введение Достоинства: Самый быстрый способ. Действие начинается через несколько секунд. Позволяет ввести полимер в обход всех общих барьеров. За редким исключением самая высокая биодоступность для гидрофильных веществ в отсутствие целевого транспорта. Недостатки: Сложный технически способ, требует вмешательства медицинского персонала. Болезненный. Сопряжен с риском инфицирования. Невозможно повторять много раз. Невозможно подавать ФАВ в обход ГЭБ в мозг, в обход глазного и плацентарного барьеров.
Слайд 96
96 Физиологически активные полимеры. Способы введения лекарств в организм. Внутримышечное. Занимает промежуточное положение. Действие начинается через 1-5 минут. Позволяет ввести полимер в обход всех общих барьеров кроме ретикулоэндотелиальной системы. ФАП подвергается атаке всей макрофагическ ой систем ы кроме макрофагов ЖКТ. В ней участвуют гистиоциты соединительной ткани, моноциты крови, эндотелий капилляров, купферовские клетки печени. Высокая биодоступность меньшая, чем при внутривенном введении, для гидрофильных веществ в отсутствие целевого транспорта. Недостатки. Сложный технически (требует вмешательства медицинского персонала). Болезненный. Сопряжен с риском инфицирования. Не позволяет вводить единовременно более 20 мл. Невозможно подавать ФАВ в обход ГЭБ в мозг, в обход глазного и плацентарного барьеров. Подкожное. Мало отличается от внутримышечного. Действие начинается через 10-60 минут и.длится дольше за счет замедленного поступления в кровь. Биодоступность ниже, чем при внутримышечном введении. Не позволяет вводить единовременно более 5 мл. Внутрибрюшинное (интерперитонеальное). Примерный эквивалент подкожного введения. Позволяет вводить значительно больший объем раствора ФАВ по сравнению с внутримышечным и подкожным.
Слайд 97
97 Физиологически активные полимеры. Способы введения лекарств в организм. Пероральное введение 99% случаев приема лекарств приходится на пероральное применение. Достоинства: Самый простой безболезненный способ. Не требует вмешательства мед персонала. Нет повышенного риска инфицирования. Возможно многократное повторение введения. В зависимости от лекарства и места всасывания действие может начинается через несколько секунд, а может через несколько часов. Максимальное время пребывания ФАВ а ЖКТ 24 часа. ФАВ можно экстренно удалить из организма (КЛИЗМА). Позволяет ввести полимер в обход поверхностных барьеров.. Средняя биодоступность для гидрофильных веществ и высокая биодоступность для гидрофобных веществ. Позволяет вводить даже мелкие нерастворимые частицы. Практически это три разных способа введения при которых ФАВ подвергается весьма разнообразным воздействиям. Недостатки: Низкая биодоступность при введении гидролитически и ферментно лабильных ФАВ. Все ФАВ поступают в организм только пройдя через печень. Не позволяет обойти РЭС, и барьеры в желудке и ЖКТ. Невозможно подавать ФАВ в обход ГЭБ в мозг, в обход глазного и плацентарного барьеров
Слайд 98
98 Физиологически активные полимеры. Способы введения лекарств в организм. Пероральное введение Введение через слизистую полости рта. ФАВ поступает в кровь минуя печень. Слабая протеазная, средняя гидролазная активность в полости рта. Барьер из трех слоев клеток слизистой не пропускает полимеры массой больше 0.5-2 кДа. Сильная атака со стороны ретикулоэндотелиальной системы после всасывания. Полимеры без расщепления, частицы и гидрофобные вещества не всасываются совсем. Общая скорость всасывания крайне низкая однако высокоактивные нитраты всасываются за 30 сек до терапевтических доз (0.1 мг). Введение через желудок. Сильно кислая среда ( pH=3) Невысокая скорость всасывания Сильная протеазная, сильная гидролазная и липазная активность Время пребывания ФАВ в желудке 10-60 минут. Всасывание за счет диффузии без эндоцитоза, Полимеры и частицы не всасываются. Все вещества поступают в кровь через печень. Введение через тонкий кишечник. Нейтральная среда Огромная скорость всасывания Средняя протеазная, средняя гидролазная, сильная липазная активность Время пребывания ФАВ 10-24 часа, Всасывание за счет диффузии и эндоцитоза ресничками. Всасываются растворимые полимеры до 5 кДа, нерастворимые частицы и капли жира. Все вещества поступают в кровоток через печень.
Слайд 99
99 Физиологически активные полимеры. Способы введения лекарств в организм. Вспомогательные способы введения в кровоток (ректальный, вагинальный). Достоинства: Простой безболезненный способы. Не требуют вмешательства мед персонала. Нет повышенного риска инфицирования. Максимальное время пребывания ФАВ до 24 часов. ФАВ можно экстренно удалить из организма. Недостатки: Разовый вводимый объем ограничен 10 – 20 мл. Невозможно многократное повторение введения. Биодоступность средняя для гидрофильных веществ и низкая для гидрофобных веществ. Полимеры без расщепления, частицы и гидрофобные вещества не всасываются совсем. Не позволяет обойти РЭС. Невозможно подавать ФАВ в обход ГЭБ в мозг, в обход глазного и плацентарного барьеров. Ректальное введение ФАП. Является вариантом введения через слизистую оболочку. ФАВ поступает в кровь через печень. Слабая протеазная, слабая липазная отсутствует гидролазная активность pH=6.5-7. Сильная атака со стороны ретикулоэндотелиальной системы после всасывания. Общая скорость всасывания высокая. Действие начинается через 20 -30 минут. Максимальное время пребывания ФАВ 24 час. Всасывание обычно завершается через 1-2 часа. Вагинальное введение ФАП. Является вариантом введения через слизистую оболочку. ФАВ поступает в кровь минуя печень. Очень слабая ферментативная активность, высокая диффенсиновая активность, pH=5-6. Умеренная атака со стороны ретикулоэндотелиальной системы после всасывания. Общая скорость всасывания низкая. Действие начинается через 20 -30 минут. Максимальное время пребывания ФАВ 0.5-2 часа.
Слайд 100
100 Физиологически активные полимеры. Способы введения лекарств в организм. Специальные и локальные способы введения ФАВ в организм Инголяционное введение ФАВ– способ введения в кровоток Достоинства: Простой безболезненный способ. Не требует вмешательства мед персонала. Нет повышенного риска инфицирования. Возможно многократное повторение введения. Действие может начинается очень быстро, через несколько секунд. Позволяет ввести полимер в обход всех поверхностных барьеров, минуя печень. Высокая биодоступность как для гидрофильных, так и для и гидрофобных веществ. Позволяет вводить мелкие твердые и нерастворимые частицы. Практически это три разных способа введения при которых ФАВ подвергается весьма разнообразным воздействиям. Изменяя размер частиц (капель) аэрозоля, можно регулировать место и условия введения ФАВ. Возможность введения любых веществ в виде паров Недостатки: Очень маленькие разовые дозы (мг). Трудность точного дозирования введенного препарата. Требует специального оборудования (нибулайзер). ФАВ невозможно экстренно удалить из огганизма. Невозможно подавать ФАВ в обход ГЭБ в мозг, в обход глазного и плацентарного барьеров.
Слайд 101
101 Физиологически активные полимеры. Способы введения лекарств в организм. Специальные и локальные способы введения ФАВ в организм Введение в трахею. Не позволяет обойти РЭС и ГЭБ. В трахее оседают крупные частицы и капли диаметром более 15мкм. Газы не всасываются. Всасывание очень медленное, только за счет диффузии через мукозный слой из за этого низкая биодоступность. Ферментативная активность мукозного слоя аналогична активности ротовой полости за вычетом ферментов слюны. С мукозным слоем все перетекает в пищевод. Время пребывания ФАВ от 1до 30 мин. Введение в бронхи Не позволяет обойти РЭС и ГЭБ. В бронхах оседают частицы и капли диаметром от 15 да 3мкм. Газы всасываются слабо Нерастворимые частицы и полимеры исторгаются с мукозным слоем ресничками. Жидкие капли, растворимые полимеры активно поглощаются и быстро всасываются. Ферментативная активность аналогична бронхам. Время пребывания ФАВ от 30 мин до 6-8 часов. Введение в альвиолы. Позволяет обойти РЭС Не позволяет обойти ГЭБ. В бронхах оседают частицы и капли диаметром от менее 5мкм. Газы всасываются очень активно Нерастворимые частицы и полимеры оседают и выводятся очень медленно (годы). Жидкие капли, растворимые полимеры активно поглощаются и быстро всасываются. Ферментативная активность практически отсутствует..
Слайд 102
102 Физиологически активные полимеры. Способы введения лекарств в организм. Специальные и локальные способы введения ФАВ в организм Назальное введение – способ введения в мозг. Уникальный способ введения ФАВ в мозг минуя ГЭБ. Достоинства: Простой безболезненный способ. Возможно многократное повторение введения. Позволяет вводить полимеры с МВ до 20 кДа. Действие начинается очень быстро, через несколько секунд. Позволяет ввести полимер в обход всех поверхностных барьеров, РЭС, ГЭБ и печень. Очень высокая биодоступность, выше, чем при внутривенном введении (по пептидам более 60%). Ферментативная активность всех видов отсутствует, присутствует деффенсиновая активность. Недостатки: Позволяет вводить только растворы. Невысокая скорость абсорбции ФАВ. Максимальная разовая дозы до 2-5 мг по действующему веществу или 300мкл раствора. Трудность точного дозирования введенного препарата. ФАВ невозможно экстренно удалить из организма, но можно остановить подачу ФАВ. Трансдермальное введение – способ введения в кровоток. Слабо изученный способ введения
Слайд 103
103 Физиологически активные полимеры. Способы введения лекарств в организм. Специальные и локальные способы введения ФАВ в организм Трансдермальное введение ФАВ – способ введения в кровоток. Очень старый но слабо изученный способ введения ФАВ. Достоинства: Очень простой безболезненный способ (мази), болезненный (пластыри). Возможность постепенного длительного введения ФАВ в течение нескольких недель. Позволяет вводить полимеры с МВ до 5-7 кДа. Биодоступность средняя. Позволяет ввести полимер в обход печени. Ферментативная активность всех видов отсутствует, присутствует деффенсиновая активность. Недостатки: Круг используемых ФАВ весьма ограничен (гидрофильно-гидрофобный балланс). Требует создания специальных трансдермальных средств доставки ТДС. Не позволяет ввести полимер в обход поверхностных барьеров, РЭС и ГЭБ. Позволяет вводить в основном низкомолекулярные ФАВ устойчивые к биодеградации. Очень низкая скорость абсорбции ФАВ. Скорость введения 2-5 мг в час с дм2 кожи по действующему веществу однако суммарная суточная доза может достигать 200 мг за счет больших поверхностей. Трудность точного дозирования и регулирования скорости введения от пациента к пациенту. Можно экстренно остановить подачу ФАВ в организм. Внутриглазное введение ФАВ – способ локального введения. Слабо изученный способ введения
Слайд 104
104 Физиологически активные полимеры. Способы введения лекарств в организм. Специальные и локальные способы введения ФАВ в организм Внутриглазное введение ФАВ – способ локального введения. Используется так же для введения в кровоток малых доз высокомолекулярных гормонов. Достоинства: Очень простой безболезненный способ капли, специальные глазные пластыри. Возможность постепенного введения ФАВ в течение 10-12 часов. Позволяет вводить полимеры с МВ до 5-7 кДа. Возможность многократного введения. Биодоступность высокая. Позволяет ввести полимер в обход поверхностных барьеров печени и РЭС. Ферментативная активность всех видов отсутствует. Присутствует антибактериальная активность слезы. Недостатки: Требует создания специальных глазных средств доставки ТДС. Низкая скорость абсорбции ФАВ. Маленькая разовая доза 100-200 мкл раствора. Трудность точного дозирования в случае глазных капель. ФАВ невозможно экстренно удалить из организма но можно остановить подачу в случае с пластырем.
Слайд 105
105 Введение в технологию полимеров медико-биологического назначения Часть 3. Физиологически активные полимеры. Тема 3 Физиологически активные полимеры с собственной активностью.
Слайд 106
106 Физиологически активные полимеры. ФАП с собственной активностью. Собственная активность связана с полимерным состоянием и не свойственна Низкомолекулярным аналогам. Физические эффекты, связанные с большой массой Осмотическое давление Конформационные перестройки (эффекты соседних групп и эффекты клубков. Многоточечные интерполимерные взаимодействия с биополимерами. Нейтральные полимеры с неспецифической активностью Активность обусловлена физико-химические свойствами (М w, ММР). Не специфична к конкретной структуре. Незначительное взаимодействие с клеточными мембранами, полимерами. Поликатионы. Активность в первую очередь зависит от плотности заряда. От структуры М w, ММР, гидрофильно- липофильного балланса. Кооперативно взаимодействуют с белками. Образуют полиэлектролитные комплексы (биополимеры - полианионы). Сильно связываются с плазмолеммой. Полианионы. Конкурируют с биополимерами в природных полиэлектролитных комплексах. Полимеры с различными другими функциональными группами В отличие от привирочных полимеров нельзя выделить фармфактор полностью ответственный за активность. НМ аналоги не обладают активностью. Важную роль играют кооперативные взаимодействия. Синтетические аналоги нуклеиновых кислот Вместо углевод-фосфатного скелета находится цепочка синтететического полимера Взаимодействие между парами пуриновых и пиримидиновых оснований.
Слайд 107
107 Физиологически активные полимеры. ФАП с собственной активностью. Полимеры с неспецифической активностью. Противошоковые кровезаменители – поддержание объема и осмотического давления крови 1-2 суток. Очень большие дозы 100г. Высокие требования к апирогенности, токсичности, антигенности. М w и ММР определяют время циркуляции в крови, разветвленные иммуногенены. «Полиглюкин» декстран 1,6- α - D глюкопиранозид 0-(2- гидроксиэтил)крахмал Содержит 7% 1,4-; 1,2- связей, 1,3- связей нет. Полиглюкин М w= 60 ± 10 кДа, продуцент Leuconostoc mtsenteroides. Полиглюкин М w= 35 ± 5 кДа. М w>200 кДа токсичен. М w> 5 0 кДа выводится почечной фильтрацией. Большие массы полностью выводятся после ферментативного гидролиза. Высокая капиллярная проницаемость при низкой вязкости. Получают алкилированием амилопектинового крахмала этиленоксидом 85% в положение С (2), остальное С (6). Степень замещения 0.6-0.8, М w =-40-450 кДа. Компенсирующее действие 1-1.5 суток. Расщепляется в крови амилолитическими ферментами. Алкилирование замедляет расщепление.
Слайд 108
108 Физиологически активные полимеры. ФАП с собственной активностью. Небиоразлагаемые кровезаменители Поли – αβ - ( N -гидроксиэтил)аспартамид Поли - N -(2- гидроксипропил)метакриламид
Слайд 109
109 Физиологически активные полимеры. ФАП с собственной активностью. Плазмозаменители дезинтоксикаторы. Образуют комплексы за счет водородных связей, гидрофобных и др. нековалентных взаимодействий. М w полимера и его комплексов не должно превышать 110 кДа М w<25 кДа ваводятся через 2-3 суток путем клубочковой фильтрации, 25-100кДа –несколько месяцев, М w>110 кДа годы и забивают канальцы почек. Способны образовывать комплексы с лекарствами. «Иодинол» иод с ПВС, «Амилоидин» комплекс иода с крахмалом «Иодпирон» иод с ПВП. На самом деле в комплексах не I 2 а I 3 - антисептик без общетоксического действия. Увеличивают время действия в 2-3 раза, снижают токсичность, «Морфолонг» ПВП с морфином Поли- ( N -винил)пирролидон «Гемодез»ПВП М w= 12.6 ± 2.7кДа М w узкое не больше 40кДа. Поливиниловый спирт »Полидез» ПВС М w= 8-12кДа М w узкое не больше 25кДа. Способен к образованию ассоциатов за счет сетки межмолекулярных водородных связей. Большую роль играет число остаточных ацетильных групп и их распределение по цепи.
Слайд 110
110 Физиологически активные полимеры. ФАП с собственной активностью. Поликатионы. Образуют прочные интерполимерные комплексы с полианионами - мембранами, белками, нуклеиновыми кислотами, некоторыми полисахаридами. Взаимодействие кооперативное равновесное, с конкуренцией со стороны полианионов. Вызывают фазовые переходы в липидах. Сшивают электроотрицательные области мембран. Стягивают мембраны, изменяют проницаемость мембран, образуя дефекты. Активность всех поликатионов однотипна, количественно зависит от плотности заряда и мол массы. Ионены Гетероцепные полимеры, содержащие четвертичные атомы азота в основной цепи на определенном расстоянии друг от друга. Поликонидин Поли-( N,N’- этиленпиперазин)
Слайд 111
111 Физиологически активные полимеры. ФАП с собственной активностью. Поликатионы. Физиологическая активность ионенов Сильная бактерицидная активность (в отличие от НМ аналогов) бензалконий хлорид. Бактерицидность зависит от структуры m=n=6 вдвое менее активен чем 3-3 и 6-10. Два механизма бактерицидности. Дестабилизация клеточной мембраны. Наиболее вероятно - проникновение в клетку, образование прочного полиэлектролитного комплекса с ДНК. Стимулируют РНК синтезирующие ферменты и нарушают митоз. Курареподобная активность. 10-10 ионен активнее ганглиоблокирующего ФАВ «Декаметония». Механизм – взаимидействие с мембраной аксона и блокирование передачи нервного сигнала. Антигепариназная активность. Образуют неактивный ИПК с гепарином. «Полибрен» - 3-6 ионен. Нет риска передозировки. Наибольшая активность при степени полимеризации х=25. Использование в онкологии. Способность связываться с мембранами зависит как от плотности заряда ионена, так и от заряда мембраны Селективно взаимодействуют с опухолевыми клетками (имеют больший отрицательный заряд по сравнению со здоровыми). Используются в диагностике. Избирательно цитотоксичны по отношению к лейкозным клеткам.
Слайд 112
112 Физиологически активные полимеры. ФАП с собственной активностью. Полианионы. Большинство биополимеров – полианионы поэтому физиологическая активность ФАП на основе полианионов связана с конкурентными механизмами связывания. Сходна с активностью гликопротеинов и нуклеиновых кислот включает противоопухолевое, противовирусное, иммуномодулирующее, интерфероногенное, и др. При парентеральном введении быстро попадают в РЭС. Пероральное введение не эффективно. Влияние на РЭС зависит от М w и ММР, могут подавлять или стимулировать фагоцитоз. Подавляют митоз (противоопухолевое действие) Гепариноподобное действие. Снижают вязкость крови. Блокируют адренокортикоидную систему. Увеличивают внутриклеточное содержание кальция. Влияют на изоэлектрическую точку белков ( добавляют кислые группы). Вызывают анемию, увеличивают содержание лейкоцитов, сенсибилизация по отношению к эндотоксинам. Снижают скорость метаболизма лекарств в печени. (Пролонгируют барбитураты, блокируют процесс их детоксикации в печени). Чем ниже М w тем меньше многоточечное связывание, меньше токсичность, ниже активность. Токсичность с увеличением М w возрастает очень сильно. Используют полианионы со средней М w узкого ММР.
Слайд 113
113 Физиологически активные полимеры. ФАП с собственной активностью. Полианионы. Полианионы, содержащие сульфогруппы. Обладают гепариноподобным действием, противоопухолево активностью, индукторы интерферона. Побочное действие – запуск системы высвобождения гистамина, слишком высокая токсичность, Активность ниже, чем у гепарина, зависит от содержания N- сульфатных групп. Небиодеградирующие, карбоцепные: Поливинилсульфонат «Пергален» поливинилсульфат. Биодеградирующие: сульфат декстрана, хитозансульфат.
Слайд 114
114 Физиологически активные полимеры. ФАП с собственной активностью. Полианионы. Полианионы, содержащие кислотные группы. Менее токсичны, чем полисульфаты. Для противовирусных и противоопухолевых свойств существенны плотность заряда и М w. Аналоги мукополисахаридов – окисленные полисахариды – дикарбоксил полисахариды Исходные полимеры для окисления: Амилоза М w =150 кДа, декстран, карбоксиметил целлюлоза КМЦ, карбоксиметил крахмал, оксиэтилкрахмал, оксиэтилдекстран, инулин и т.д. Биодеградирующие поликислоты на основе природных полисахаридов: альгиновая кислота, сульфат декстрана, фосфат декстрана. Ингибируют рост опухолей. Индукторы интерферона. Не токсичны. Противовирусная активность если 65% сахарных групп окислено.
Слайд 115
115 Физиологически активные полимеры. ФАП с собственной активностью. Полианионы. Карбоцепные небиодеградирующие поликислоты и полиангидриды. Те же виды активности, противовирусная, противоопухолевая. Весьма существенны плотность заряда (чем выше, тем активней) и М w (не менее 1 кДа) Выводятся через почки, фракции с высокой М w блокируют почечные канальцы. Токсичны. «Пирановый» сополимер (дивиниловый эфир с малеиновым ангидридом 1:2) Полиакриловая, полиметакриловая кислоты. Время действия 2-3 месяца. Индуктор интерферона и активатор макрофагов. Антибактериальное действие против грамположительных и грамотрицательных бактерий. Токсичность появляется при М w> 18-20 кДа.
Слайд 116
116 Физиологически активные полимеры. ФАП с собственной активностью. Полианионы. Виды активности и механизм. Первая стадия взаимодействия полианиона с клеткой – многоточечное взаимодействие с мембраной Если клетка фагоцитирующая, то ФАП может быть фагоцитирован внутри фагосомы. Второй по значимости механизм проникновения ФАП в клетку после эндоцитоза, главный для нефагоцитирующих клеток, основан на проникновении ФАП через мембрану без фагосомы. Многоточечное взаимодействие с мембраной приводит к кратковременному местному повышению проницаемости мембран. Отрицательно заряженная мембраны имеют изолиованные поликатионные области на них и сорбируются полианионы, образуются дефекты в липидном слое – каналы - через которые полианион проходит внутрь, белок наружу, а затем каналы быстро заплавляются белками крови. Механизмы токсичности полианионов Выход белка из клетки через дефект в мембране. Нарушение натрий калиевого баланса вызывает ингибирование синтеза белка. Полианионы внутри клетки ингибируют многие ферменты. Ведут себя внутри клетки аналогично вирусной ДНК – природный полианион. Механизмы противовирусного действия Активация макрофагов. Общее иммуностимулирующее действие. Ингибирование репликации вирусов на ранней стадии инфекции. Интерфероногенная (двунитчатый полинуклеотид поли-И поли-Ц, поли-Г поли-Ц, поли-А поли-у напоминающие ДНК и РНК вируса, но устойчивые к нуклеазам) Иммуноадьювантная (иммуностимулирующая) активность. Связана с отрицательным зарядом. Реализуется через непосредственное действие на В- и Т-лимфоциты и макрофаги. Противоопухолевая. Осуществляется за счет активации макрофагов (избирательно поглощают опухолевые клетки). Ингибируют митоз – деление клеток. Противогрибковая, антибактериальная. За счет связывания с мембраной патогена. Антикоагулянтное действие. Гепатиноподобное – препятствует адгезии тромбоцитов, ингибирует ферменты каскада свертывания.
Слайд 117
117 Физиологически активные полимеры. ФАП с собственной активностью. Полианионы. Зависимость активности и токсичности поликислот и полиангидридов от М w. Активность обусловлена многоточечным связыванием и зависит от Mw. Зависимость данного вида активности от М w носит предельный характер, но с увеличением М w появляются новые виды активности. Противоопухолевая а ктивность возрастает до М w 5-10 кДа, далее не меняется, Противовирусная начинается с 30 кДа, после 50 кДа постоянна Токсичность сильно возрастает после 50 кДа Пирановый сополимер с М w =500 кДа: Вызывает агрегацию эритроцитов, Изменения в морфологии тромбоцитов и лейкоцитов их соотношения и распределения по органам. Ингибирует микросомальные ферменты Подавляет ретикулоэндотеоиальную систему (не может переварить) в то время как М w=5 кДа активирует (инверсия активности). Время действия зависит от М w и скорости биодеградации для деградирующих и только от М w для карбоцепных. Для карбоцепных с точки зрения времени циркуляции в организме идеальное М w =30-50 кДа. Пирановый сополимер высокого М w находят в организме крысы через 9 месяцев после введения.
Слайд 118
118 Физиологически активные полимеры. ФАП с собственной активностью. Синтетические аналоги нуклеиновых кислот (САНК). Природные нуклеиновые кислоты содержат два главных структурных элемента: Сахарфосфатный полианионный скелет Гетероциклические основания, способные в спиральной структуре образовывать комплементарные пары. В САНК - сахарфосфатная главная цепь заменена цепью синтетического полимера, которая может быть: Нейтральной. Полианионной. Поликатионной. Сохраняют способность к комплементарным взаимодействиям, могут служить матрицами для связывания с полинуклеотидами.
Слайд 119
119 Физиологически активные полимеры. ФАП с собственной активностью. Синтетические аналоги нуклеиновых кислот (САНК). Нейтральные. Легко образуют комплексы с полинуклеотидами т.к. отсутствует електростатическое отталкивание основных цепей Слабо взаимодействуют с ферментами действующими на нуклеиновые кислоты Блокируют нуклеиновую матрицу в биосинтезе, ингибиторы биосинтеза. По строению основной цепи наиболее известны Поливиниловые Поли(мет)акрилатные. Поли(мет)акриламидные. Полиаминокислоты Полианионные. Более слабые кислоты чем полифосфаты. Ассоциация с полинуклеотидами незначительна (одноименно заряжены – нет ассоциации основных цепей, нестереорегулярны – нет ассоциации по нуклеотидной части). Сильно связываются с ферментами нуклеинового обмена как полианионы. Поликатионные. Сильно связываются с полинуклеотидами в полиэлектролитный комплекс. Взаимодействия неспецифичны. Взаимодействия между основаниями носят второстепенный характер
Слайд 120
120 Физиологически активные полимеры. ФАП с собственной активностью. Биологическая активность Синтетические аналоги нуклеиновых кислот (САНК). Нейтральные. Не влияют на иммунную систему и макрофаги, поглощающие твердые частицы. После введения быстро попадают в эндоцитирующие (пиноцитирующие) клетки в местах их созревания и локализации - в печень, селезенку, тимус и костный мозг. Почки и легкие – свободны. В легких – фагоцитирующие клетки поглощающие твердые частицы. Противовирусная активность при высоких дозах – подавляют репликацию некоторых вирусов в селезенке. Полианионные Ведут себя подобно другим полианионам. Противовирусная и противоопухолевая активность. Не проявляют селективного действия, свойственного их основаниям. Поликатионные. Хиральные Имеют спиралевидную структуру. Используются для перезапуска механизма старения при клонировании. Используются в герантологии. Обладают противоопухолевой активностью.
Слайд 121
121 Физиологически активные полимеры. ФАП с собственной активностью. Полимеры с различными функциональными группами. Поли– N- оксиды третичных аминов Содержат N- оксидные группы в основной или в боковой цепи. Поли-2-винилпиридин- N- оксид (аминогруппа в боковой цепи) противосиликозное действие преперат Р-204. Введение ингаляционное или внутривенное. Рекомбинирует радикалы локально образующиеся при атаке кварцевого песка клетками мусорщиками. Оптимальное Mw =30-150 кДа. Кооперативно связываются с поверхностью SiO2 и с клетками. Не подвержены биодеструкции, накапливаются в организме. Полимерные N- оксиды с группой в основной цепи обладают антифиброзной и противоопухолевой активностью Mw =20-40 кДа. Подвержены биодеструкции Аминогруппа в основной цепи Полиэтиленпиперазин N - оксид Поликонидин N - оксид Коповитан – сополимер винилпирролидона с 1,1-ди-(метиламинокарбонилоксиметил) этиленом. очень активен против опухолей Mw= 12 кДа доза 0.25-25 кг/кг, низкая токсичность 4-10 гГ/кг
Слайд 122
122 Введение в технологию полимеров медико-биологического назначения Часть 3. Физиологически активные полимеры. Тема 4 ФАП прививочного типа. Молекулярное конструирование полимерных производных физиологически активных веществ.
Слайд 124
124 Физиологически активные полимеры. ФАП прививочного типа. Состав ФАП прививочного типа. ФАП прививочного типа сочетает в себе действующее начало ФАВ и «лекарственную форму» (различные дополнительные группы, участвующие в действии ФАВ) объединенные на молекулярном уровне. ФАВ – физиологически активное вещество (действующее начало). Л – лиофилизующий фрагмент ФАП, обеспечивающий тропность (сродство) ФАП к той или иной ткани. Липофильность – топность к жировой ткани; Гидрофильность – водорастворимость. Изменяет, если требуется тропность (растворимость) ФАВ (с липофильной на гидрофильную и наоборот) В – вектор, обеспечивающий целевой транспорт в орган мишень ( обычно антитело или сахаридный остаток тропный к гликокаликсу. Х – Гидролизуемые вставки, обеспечивающие всвобождение ФАВ в органе (клетке) мишени, расщепление и выведение носителя из организма по окончании срока действия.
Слайд 125
125 Физиологически активные полимеры. ФАП прививочного типа. Типы ФАП прививочного типа по механизму действия ФАП действующие как единое целое без отщепления ФАВ («истинные» ФАП). Полимерные производные белков, Конъюгированные антигены. ФАП, отщепляющие ФАВ. При пероральном введении Выполняют транспортную функцию Отщепление в заданном отделе ЖКТ Пролонгация действия до 24 часов. При парэнтеральном введении 1. Отщепление ФАВ от ФАП в кровяном русле при контакте с целевыми клетками около их поверхности (гелевые покрытия протезов). Создает локальную повышенную концентрацию ФАВ. 2. Отщепление ФАВ от ФАП в кровяном русле до контакта с целевыми клетками (ФАП пролекарства – депо). Пролонгация действия. Сглаживание пиковых концентраций. ФАП действующие на ЦНС (полимеры туда не проникают), ФАП действующие на мишени в кровяном русле (антагонисты гепарина). Гормоны, рецепторы которых трудно доступны для полимеров.
Слайд 126
126 Физиологически активные полимеры. ФАП прививочного типа. Типы ФАП прививочного типа по механизму действия ФАП отщепляющие ФАВ. Парэнтеральное введение 3. Отщепление ФАВ внутри клетки под действием лизосомальных ферментов либо отщепление в Гольджи. Полимеры не активны в кровяном русле и становятся активными только после распада в лизосомах. Полимерное пролекарство, превращающееся в лекарство внутри клетки. Увеличивается время действия Снижаются побочные эффекты, токсичность. Метаболизм ФАП в кровяном русле замедлен, пиковые концентрации отсутствуют, снижается доза, повышается терапевтическая широта. Общие эффекты ФАП прививочного типа Фармакокинетика ФАП отличается от фармакокинетики НМ ФАВ и может быть специально подобрана, меняя конструкцию ФАВ (лимфотропность, придают антибиотикам). Оптимально – концентрировать ФАП в органе-мишени. По окончании действия ФАП и его фрагменты должны быть полностью выведены из организма. Скорость отщепления ФАВ не должна быть ниже скорости распада носителя и скорости его выведения из русла. Не должны образовываться коньюгаты ФАВ с короткими фрагментами носителя, активность которых трудно предсказать.
Слайд 127
127 Физиологически активные полимеры. ФАП прививочного типа. Модель ФАП прививочного типа (Модель Рингсдорфа) Полимер – носитель Физиологически активное вещество Лиганд – вектор, обеспечивающий целенаправленный транспорт макромолекулы. Лиофильные группы (гидрофильные, липофильные, холеотропные и др.), обеспечивающие растворимость (тропность) макромолекулы в тех или иных средах в организме. «Вставка спейсер» между полимером-носителем и ФАВ. Х - Ковалентная связь между полимером-носителем и «вставкой». Х ’ - Ковалентная связь между «вставкой» и ФАВ.
Слайд 128
128 Физиологически активные полимеры. ФАП прививочного типа. Особенности проявления физиологической активности полимеров по сравнению с низкомолекулярными ФАВ. «ПОЛИМЕРНЫЕ ЭФФЕКТЫ» Аддитивность свойств ФАП. Физико-химические свойства системы определяет полимер носитель. Физиологическую активность системы определяет ФАВ. Позволяет придать растворимость нерастворимым ФАВ. Позволяет регулировать распределение ФАВ по органам в организме. Пониженная способность проникать через клеточные мембраны и барьеры в организме. Ограниченное распространение ФАП в организме Фармакокинетика ФАВ коренным образом меняется при присоединении к полимеру. Взаимодействие ФАВ с субстратами сохраняется прежним. Снижение токсичности ФАВ. Пролонгирование действия ФАВ за счет удержания в почках и в клетках РЭС. ФАП плохо абсорбируются из ЖКТ их приходится вводить внутривенно, внутримышечно и т.д. Сниженная способность к метаболизму. ФАП худшие субстраты для ферментов Иные чем у низкомолекулярных ФАП пути проникновения в клетку. Эндоцитоз для полимеров и простая диффузия для НМ ФАВ Мишени вне клеток, на поверхности и внутри клеток по разному доступны для НМ ФАВ и ФАП. Физиологические эффекты свободного ФАВ и связанного с полимером могут быть совершенно разными вплоть до полной инверсии активности, вследствие воздействия на разные субстраты.
Слайд 129
129 Физиологически активные полимеры. ФАП прививочного типа. Особенности проявления физиологической активности полимеров по сравнению с низкомолекулярными ФАВ. «ПОЛИМЕРНЫЕ ЭФФЕКТЫ» Иное по сравнению со свободным ФАВ взаимодействие с субстратами в организме. Появляется способность к кооперативным взаимодействиям. Полимеры способны вызывать перегруппировку рецепторов клеточной мембраны, образовывать кластеры. Полимеры неспособны проникать внутрь клеток это отсекает взаимодействия с внутриклеточными мембранами. По сравнению с ФАВ не связанным с полимером изменяется взаимодействие с рецептором: Специфичность взаимодействия с рецептором. Сродство к рецептору Кинетика взаимодействия с рецептором.
Слайд 130
130 Физиологически активные полимеры. ФАП прививочного типа. ФАП прививочного типа действующих вне клеток. К ним относятся Ингибиторы, блокирующие нежелательные ферменты при патологических процессах (воспаление, шок, ожег. Антикоагулянты и их нейтрализаторы. Ферменты, действующие на субстраты в плазме. Антибиотики, действующие на внеклеточные бактерии. ФАВ медленно выделяется, поддерживая минимальную терапевтическую концентрацию в плазме. ФАП должен иметь большие размеры, чтобы длительно циркулировать в «камерах» полостях благодаря низкой проницаемости через капиллярный барьер ( Mw>60 кДа). Скорость эндоцитоза должна быть минимальной, взаимодействие с мембранами – минимальное. Химические связи между полимером-носителем и ФАВ должны расщепляться с такой скоростью, чтобы: ФАВ успела отщепиться за время циркуляции ФАП, Скорость поступления ФАВ с носителя в кровь не превысила скорость выведения или метаболизма ФАВ до неактивных продуктов. ФАП должен быть не активен и не «фонить». Кинетика отщепления зависит от конструкции узла X’. Солевые и некоторые ковалентные (альдиминовая) связи гидролизуются без участия ферментов. Большинство связей гидролизуются только ферментативно. На скорость гидролиза сильно влияют : Пространственные факторы. Заряд соседей. Порядок реакции обычно первый.
Слайд 131
131 Физиологически активные полимеры. ФАП прививочного типа. ФАП прививочного типа, действующие на поверхности клетки. Взаимодействуют с рецепторами на поверхности клеток, проникновение внутрь не требуется. Полимерные производные инсулина. Стимуляторы роста в имплантатах. ФАВ в связанном с носителем состоянии должны сохранять способность взаимодействовать с рецептором. Сохранение зарядов в нужных точках ФАВ. Возможность принять нужную конформацию. Длинная, гибкая вставка. ФАВ на полимере не активна, не щепится в кровотоке, на поверхности клетки мишени отщепляется под действием мембранных ферментов клетки. Очень редкий случай. Цитостатики на поверхности «сайферов». Гелевая антибактериальная обработка биопротезов.
Слайд 132
132 Физиологически активные полимеры. ФАП прививочного типа. ФАП прививочного типа, действующие внутри клетки. Проникают внутрь через клеточную мембрану, должны связываться с мембраной. Неспецифическое взаимодействие – за счет зарядов Специфическое – засчет биоспецифическго связывания. Антибактериальные вещества и противоопухолевые – разрушают мембраны Обычно – разрушение мембран нежелательно. Неспецифический жодкофазный эндоцитоз (пиноцитоз) 1-ФАП 2-поверхность клетки 3-лизосома 4-лизосомальные ферменты Стадии А- обволакивание Б – абсорбция внутрь клетки В-слияние фагосомы с лизосомой Г-переваривание, высвобождение ФАВ Д- выброс ФАВ в цитоплазму. Лизосомотропные ФАВ. Скорость эндоцитоза разная для разных клеток (селективная доставка). Можно вводить вещества, которые не проходят через мембрану. Гидролиз в лизосоме в кислой среде затем ФАВ должно выйти через мембрану. Необходима прочная связь ФАВ-Полимер не разрушающаяся при транспорте до лизосомы, но разрушающаяся вместе с носителем в лизосоме.
Слайд 133
133 Физиологически активные полимеры. ФАП прививочного типа. ФАП прививочного типа, действующие внутри клетки. Рецепторно - медиируемый (адсорбтивный) эндоцитоз. Может быть использован для высоко специфического транспорта ФАВ в составе ФАП. Единственный способ поступления ФАВ в клетку, который можно регулировать по принципу обратной связи. Механизм характерен для проникновения эндогенных ФАВ (белков, гормонов). В качестве носителя В ФАП часто используется белок, либо на носитель присоединяют гормон. Скорость значительно выше. Разные клетки эндоцитируют с весьма разной скоростью. Можно использовать для целевого транспорта. Рецепторы на поверхности клетки отражают ее текущее физиологическое состояние (потребность в том или ином гормоне, патологическое изменение и т.д.) . 1-Поверхность клетки 2.-Рецептор 3.-ФАП 2-Поверхность клетки. 3-Лизосома. 4-Лизосомальные ферменты. Стадии А- взаимодействие с рецептором на поверхности мембраны клетки. Б – группировка ФАВ в кластеры. В- абсорбция внутрь клетки в виде рецептосом-вакуолей покрытых клатрином. В-слияние фагосомы с лизосомой Г-транспорт в аппарат Гольджи, слияние с Гольджи. Д- Отсоединение от Гольджи в виде лизосомы. Иногда десорбция недеградировавшего ФАВ в цитоплазму без лизосомальной атаки.
Слайд 134
134 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Выбор ФАВ, полимера носителя и связывающего узла Х. Выбор определяется Локализацией места воздействия. Способом проникновения (доставки)ФАП к мишени. Механизмом действия ФАВ Выбор сязи ФАВ – полимер по гидролитической стабильности Гидролитическая стабильность связи ФАВ – полимер определяется: Типом связи. Участием соседних групп (обычно карбоксильных, гидроксильных или аминных). Пространственными и гидрофобными эффектами. Плотностью заряда. Выбор вставки (спейсера) Х Вводят, чтобы свести к минимуму трудно-учитываемые пространственные и гидрофобные взаимодействия между ФАВ и носителем. Х – часто бифункциональный реагент Если связь Х прочная – постоянная вставка (часть полимера носителя). Если связь Х способна к гидролизу – временная вставка – должна быть физиологически инертна. Х должна быть длинной и гибкой, чтобы уменьшить полимерный эффект. Особенно важно для ферментативного отщепления и взаимодействия с рецепторами на поверхности клетки.
Слайд 135
135 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Выбор ФАВ, полимера носителя и связывающего узла Х. Выбор ФАВ Не целесообразно присоединять ФАВ Расчитанные на кратковременное действие Медленно метаболизирующие, медленно выводимые. Малоактивные, требующие больших доз. Целесообразно применять ФАВ используемые в лечении хронических заболеваний, требующие частого и длительного приема. Быстро метаболизирующие. ФАВ с маленькой терапевтической широтой (химиотерапия). Высокоактивные биорегуляторы (гормоны, витамины, коферменты) вводимые малыми дозами постоянно. ФАВ применяемые местно – для предупреждения распространения по организму, снижения побочных эффектов. ФАВ, которые в свободном состоянии неустойчивы (ферменты). Удельная Физиологическая Активность ФАВ. Понижение удельной активности при присоединении к носителю. Неполная доступность ФАВ для рецептора. Неполное отщепление. Транспортные ограничения связанные с полимерностью. Повышение удельной активности. ФАП концентрируется в месте действия. Сниженный метаболизм. Снижение пиковых концентраций.
Слайд 136
136 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Простое электровалентное связывание Недостаточно прочно. рН- зависимое выделение лекарств. Полиэлектролитное связывание белков. Гидрофобное взаимодействие (связывание белков) Выделение лекарств в зависимости от ионной силы. Нестехиометрические полиэлектролитные комплексы выделяющие лекарства из «петель» при перестройке комплекса. Функциональные группы в составе ФАВ необходимые для электровалентного связывания. Карбоксильные Аминные. Аммониевые. Типы связей, используемых для присоединения ФАВ.
Слайд 137
137 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Ковалентное связывание Лабильные – гидролизуюься при физиологических значениях рН без участия ферментов. Альдиминовя (стабилизированная сопряжением с двойной связью или хелатообразованием). Кетиминова я Относительно лабильные – медленно гидролизуются без участия гидролаз и быстро с участием гидролаз. Сложноэфирная. Карбонатная Иминоуретановая. Относительно стабильные связи – гидролизуются только ферментативно. Уретановая. Амидная. Тиомочевинная. Мочевинная. Стабильные связи – не гидролизуются Азосвязь. Аминная. Простая эфирная. Углерод-углеродная. Функциональные группы в составе ФАВ необходимые для электровалентного связывания. Гидроксильная –ОН, Тиольная (меркаптановая) – SH, Аминная – NH, - NR2, Амидная _ - NHR, Альдегидная – CHO, Кислотная, сложно эфирная – С OR, - COOH. При гидролитическом механизме действия можно использовать те группы ФАВ, которые отвечают за активность. В остальных случаях они должны быть свободны. Если подходящие группы отсутствуют, их можно ввести. Типы связей, используемых для присоединения ФАВ.
Слайд 138
138 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Присоединение ФАВ по концевым группам полимера носителя. Используют короткие полимеры типа ПЭГ Вводят кластерирующие реагенты (трисгидроксиметиламинометан). Если ФАВ белок, присоединяют много полимерных цепей – получают звездообразный полимер. Полимеризация ФАВ За счет собственных групп – β -адреноблокатор алпренолол (аллильная группа). Макромономеры – ФАВ (белки) со специально введенной двойной связью или эпоксидной группой. Поликумарины – гипотензивная активность. Сшивание ФАВ за счет бифункциональных реагентов. Нестехиометрические интерполимерные комплексы как ФАВ. Комплекс полиметакриловой кислоты и поли- N -этил-винилпиридинийбромида – антагонист гепарина. Альтернативные модели ФАП отличающиеся от модели Рингсдорфа.
Слайд 139
139 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Общие требования Полимер должен растворяться в воде. М w и ММР полимера должны обеспечивать длительную циркуляцию, эндоцитоз и основная цепь желательно должна быть биодеструктирующей. Оптимально М w 20-80 кДа для биодеструктирующих и 30 для небиодеструктирующих. Носитель должен содержать функциональные группы для присоединения ФАВ. Полимер должен быть биосовместим. Не взаимодействовать с кровью Не быть токсичным. Не быть антигенным. Используют нейтральные, или активные полимеры: альбумин, гепарин, пирановай сополимер, поли- L- лизин. Полимер должен быть доступен. Полимеры носители.
Слайд 140
140 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Карбоцепные носители. Гидрофильные и гидрофобные водорастворимые сомономеры. Винилпирролидон, акрилпмид N- (2-гидроксипропил)акриламид 2-гидроксиэтилметакрилат Аминоэтилметакрилат Реакционноспособные сомономеры Акролеин Кротоновый альдегид (мет)акриловая кислота. Кротоновая кислота. Малеиновый ангидрид. Эпоксипропилметакрилат Носители, получаемые полимер-аналогичными превращениями. Поливиниламин Виниловый спирт Полимеры носители.
Слайд 141
141 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Гетероцепные носители. Полиэтиленимин. Линейный (вторичные аминогруппы) Разветвленный с первичными и третичными аминогруппами Полиэтиленгликоль. Поли- α - L- аминокислоты. Поли- L- лизин. Поли- L- глутаминовая кислота. Поли- D,L- аминокислоты. Полисукцинимид. Поли- D,L- αβ -аспартамид. Полиэфирамины Поликонидин сополимер с β -пропиолактоном. Поли- α - L- оксикислоты. Поливалерат. Полипропионат. Полилактид. ПЛГА полигликолидлактид. Полиамиды. Полиэфиры. Полифосфазены. Линейные. Гидрофильные. Гидрофобные С дефектами в основной цепи Полимеры носители.
Слайд 142
142 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Носители на основе биополимеров. Полисахариды. Декстран. Диальдегиддекстран. Крахмал (амилоза). О-(2-гидроксиэтил)крахмал. Карбоксиметилкрахмал. Карбоксиметилцеллюлоза. Диальдегид карбоксиметилцеллюлоза. Альгиновая кислота. Каррагинан. Пектин. Хитозан. Фиколл (сахароза сшитая эпихлоргидрином) Белки (присоединяют ФАВ по концевым группам лизина. Иммуноглобулины. Альбумин. Апирогенный желатин. Колаген. Нвуклеиновые кислоты. Только для противоопухолевых ФАВ для придания им лизосомотропности. Комплексы ФАВ с ДНК очень прочные в кровотоке, но разрушаются в лизосомах. Биодеструктирующие носители. Полимеры носители.
Слайд 143
143 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Целевой транспорт это селективная доставка (селективное взаимодействие) ФАП в один или несколько типов органов или клеток. Различают три уровня селективности Первый – самый низкий. Полимерный носитель только препятствует взаимодействию ФАП с одним или немногими видами нецелевых клеток. Второй. Повышенная концентрация ФАП в органе мишени. Концентрация ФАВ вне органа мишени такая же или ниже, чем при использовании НМ ФАВ. Третий – высший уровень селективности. ФАП действует только на целевые клетки или клетки органа-мишени. Для ФАП действующих вне клеток возможны только первый и второй уровни селективности За счет конкретного гидрофильно-гидрофобного балланса – регулировать распределение между лимфой, плазмой, межклеточной жидкостью. За счет низкой проницаемости ФАП через мембраны можно превратить ФАВ системного действия в ограниченно или местно-действующее (местные анастетики и местные антимикробные (ототоксичность). ФАП с катехоламинами – действуют только на рецепторы на поверхности клеток и не действуют на внутренние. ФАП не проходят через гематоэнцефалический барьер, в виде макромолекул не действуют на ЦНС. Введение в орган мишень в виде микрочастиц эмболизирующих капилляры в органе мишени. Внутриопухолевое введение растворимых ФАП – коньюгат дауномицина с антифибриновыми антителами, митомицин С с сукцинированным димером гликопротеина конкавалина А. Ковалентное связывание реакционноспособных ФАП с опухолью – не получилось. Целевой транспорт ФАП в организме.
Слайд 144
144 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Целевой транспорт это селективная доставка (селективное взаимодействие) ФАП в один или несколько типов органов или клеток. Для ФАП действующих внутри клеток возможны все три уровня селективности Первый и второй достигаются дополнительно з а счет изменения способа проникновения в клетку. Клетки, способные к усиленному эндоцитозу (опухолевые) поглощают больше ФАВ. Полианионы и белки способны к быстрому эндоцитозу позволяют достичь 2го уровня селективности. Препятствие – усиленный захват клетками РЭС. Можно обойти способом введения, чтобы ФАП сначала поступал в кровоток а уже потом в печень. Третий уровень селективности. Распознавание ФАП единичных типов клеток и взаимодействие с ними. ФАП должен содержать вектор. Распознавание на уровне клеточной мембраны. Реакции антиген-антитело, гормон-рецептор. Учет иммунной специфичности поверхности клетки-мишени. Гепатоциты – специфично фагоцитируют гликопептиды с концевыми галактозными остатками. Макрофаги – специфично фагоцитируют полимеры с концевыми остатками L- фруктозы или D- галактозы. Альбумин лактозоаминированный – направляет полимеры в гепатоциты. Альбумин с 6-фосфо- α - D -маннопиранозидом – направляет в фибробласты. Лектины Элементы вирусов (фрагменты, отвечающие за клеточную фиксацию). Целевой транспорт ФАП в организме.
Слайд 145
145 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Целевой транспорт это селективная доставка (селективное взаимодействие) ФАП в один или несколько типов органов или клеток. Наиболее эффективные векторы Антитела. Самые дорогие векторы и самые еффективные. Проблема высокой моно специфичности. Чем больше на него посажено молекул ФАВ тем сильнее оно модифицировано и менее специфично. Посадка ФАВ на ФАП а его уже к антителу. Решает проблему химической модификации, но антитело – белок + полимером = гаптен. Появляется антигенность. Проблема выбора высокоспецифического антигена на поверхности клетки и минимальное перекрестное взаимодействие с другими антигенами. Гормоны, которые имеют рецептор на мембране. Тип и количество рецепторов зависит от состояния клетки.Можно организовывать обратную связь. Поглощение за счет рецепторно-медиируемого эндоцитоза. Белковые гормоны дешевле антител. Небелковые гормоны устойчивы химически. Нет проблемы антигенности. α - фетапротеин вектор для опухолевых клеток. Целевой транспорт ФАП в организме.
Слайд 146
146 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Варианты фармакодинамики НМ ФАВ и ФАП в организме после введения. Могут быстро, в течение нескольких часов, без изменения выйти через почки (Только молекулы с ограниченной М w ). Могут быстро метаболизировать (молекулы с высокой М w ) и образовавшиеся фрагменты невысокой М w выводиться через почки. Могут быстро, без изменения, быть удалены респираторно через легкие ( только перфторуглероды с невысокой М w ). Могут выводиться медленно через печень с желчью но без ограничения по Mw. Могут отложиться в органах, а затем выводиться постепенно (недели, месяцы, годы). Велик риск патологических процессов. Требование безопасности: Любой ксенобиотик введенный в организм должен быть полностью выведен в разумные сроки либо как таковой, либо в виде метаболитов. Биодеструктируемость ФАП в организме. Пути распределение ФАП в организме из кровотока в ткани после внутривенного введения. Легко поступают в печень, селезенка, костный мозг. Трудно поступают в эндокринные железы, мышцы. Очень трудно в ЦНС.
Слайд 147
147 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Биодеструктирующие биополимеры Белки (альбумин, антитела). Скорость биоразложения зависит от степени модификации белка снижающей субстратную специфичность, вплоть до полной устойчивости к биоразложению. Полисахприды. Химическая модификация сильно снижает способность к ферментативной биодеструкции. Нуклеиновые кислоты. Только для противоопухолевых ФАВ. Биодеструктирующие синтетические полимеры Поли- L -аминокислоты. Полифосфазены. Полицианакрилаты !!! (единственный известный биодеструктирующий карбоцепной полимер) Способность полимеров к биодеструкции. Определяется химическим строением и специфичностью (силой) ферментов, с которыми он контактирует. Механизм биодеструкции ферментативный. Деструкция с концевой группы. Медленный процесс Прерывается на первом же дефекте. (поли- D,L- α, β - аспартамид) Деструкция в середине цепи по закону случая или по остаткам специфичным для данного фермента. Приводит к резкому падению М w. Скорость сильно зависит от соседних звеньев (комплементарность сайту фермента. Биодеструктируемость ФАП в организме.
Слайд 148
148 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Примеры фармакодинамики полимеров. Полисахарид декстран. Mw<50 кДа выводится через почки полностью, Mw=70 кДа за 6ч выводится с мочей 30% полимера, за сутки 70%. Деструкция в РЭС под действием декстраназы до глюкозы. О-(2-гидроксиэтил)крахмал. Выводится через почки.Скорость биодеструкции можно регулировать меняя степень замещения. Чем выше степень замещения, тем ниже скорость ферментативного гидролиза Окисленные полисахариды: диальдегиддекстран, диальдегидцеллюлоза, диальдегидкрахмал. Гидролизуется без участия ферментов. Карбоксиметилцеллюлоза. Небиодеструктирующий полимер, вызывает сильную иммунную реакцию. Поли- L- α -аминокислоты поли- L- лизин, поли- L- глутаминовая кислота Скорость биодеструкции зависит от степени модификации структуры и от фермента. Биодеструктирующие полимеры. Поливинилпмрролидон. Небиодеструктирующий полимер Mw= 25кДа – выводится через почки за 3 суток, Mw= 25 -1 10кДа выводится через почки по ионному механизму (не за счет клубочковой фильтрации). Mw>110 кДа оседают в клетках РЭС выводятся через печень очень медленно (годы). Поливиниловый спирт. Полимер с Mw= 10-15кДа выводится через почки за 3 суток. Пирановый сополимер Оптимальное по соотношению физиологической активности, времени циркуляции в крови (зависит от Mw ) и скорости выведения Mw= 30-50кДа. Биодеструктируемость ФАП в организме.
Слайд 149
149 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Олигопептиды, соединенные легко расщепляемыми остатками. Сополимеры N- (2-гидроксипропил)метакриламида с n -нитрофениловыми эфирами N- метакрилоилоолигопептидов сшитые этилендиамином Сополимеры с биодеструктирующими блоками в основной цепи. Инициаторы сополимеризации с концевыми аминогруппами. А-Б и А-Б-А по которым затем вставляют аминокислотный остаток через поликонденсацию карбоксиангидрида аминокислоты Биодеструктируемость ФАП в организме. Сополимеры N- (2-гидроксипропил)метакриламида с фермент специфическими последовательностями в боковой цепи. Химотрепсин щепит последовательности соседние с остатком фенилаланина. Гидролизуются лизосомальными ферментами (тиольная протеаза катепсин В ). Не гидролизуются в кровотоке. Максимальная скорость протеолиза у последовательности Gly-Phe-Tyr-Ala Минимальная скорость протеолиза у последовательности Gly-Phe-Ley-Gly Недостаток всех полимеров с олигопептидными вставками – появление иммуногенности.
Слайд 150
150 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Возможность конструирования ФАП возникает вследствие аддитивности свойств фап таких как: Физиологическая активность Физико-химические характеристики Целеспецифичность. Параметры, обуславливающие проникновение в клетку. Применение принципов молекулярной сборки позволяет вести направленный синтез ФАП, сочетая в одной макромолекуле фрагменты с известными свойствами. ФАП прививочного типа не являются совершенно новыми веществами с новой физиологической активностью. Цель создания ФАП прививочного типа – принципиальное улучшение свойств ФАВ. Связывание ФАВ с полимером позволяет использовать те ФАВ, которые нельзя использовать в традиционных лек формах. Взаимодействие ФАВ с полимерами – известный физиологический процесс. Образование комплексов с альбумином и белками крови важный процесс превращения ксенобиотиков в эндогенные вещества. Функция этих комплексов транспортная, принципиально сравнима с ФАП прививочного типа. Слабые комплексы ФАВ с белками отдают ФАВ в печени чтобы подвергнуть метаболизму, а сам белок циркулирует дальше. Прочные комплексы с белками целиком метаболизируют в клетках печени без отщепления. Некоторые выводы.
Слайд 151
151 Физиологически активные полимеры. Конструкция ФАП прививочного типа. Дауномицин. Обратимо встраиваются в ДНК (интеркалируют между) Г и Ц, меняют структуру матричной ДНК препятствуют митозу (не дают ДНК разойтись). Препятствует синтезу ДНК и белка (ингибирует репликацию и транскрипцию). Митомицин. Трифункциональный алкилирующий агент. Сшивает матричную ДНК Препятствует синтезу ДНК и белка (ингибирует репликацию и транскрипцию). Противораковые антибиотики Дауномицин, (Даунорубицин) Митомицин α -Фетапротеин. Белок секретируемый клетками печени при их быстром делении (регенерация поврежденной печени). Секретируется всеми клетками (и раковыми) при быстром делении. Секретируется при развитии плода (белок плода). Используется как маркер рака, способен активировать ген апоптоза раковых клеток. лектины и лектиноподобные компоненты выполняют множество разнообразных физиологических функций, в частности, в регуляции клеточной адгезии, синтеза гликопротеинов или уровня белка в крови. Например, они оказывают влияние на процессы активации лимфоцитов в процессе иммунного ответа, а также на эффекторные фазы — комплемент-зависимую и Т-клеточную цитотоксичность. Лектины оказывают митогенный эффект и вызывают бласт-трансформацию лейкоцитов (когда лейкоцит превращается в лейкобласт и начинает делиться). Некоторые лектины, находясь на поверхности клеток печени, связывают галактозу, удаляя ее из крови. Другие лектины являются рецепторами ферментов, содержащих остатки маннозы. Одним из самых известных лектинов, связывающих маннозу, является компонент лектинового пути активации комплемента, который составляет часть системы врожденного иммунитета
Слайд 152
152 Введение в технологию полимеров медико-биологического назначения Часть 3. Физиологически активные полимеры. Тема 5 Синтез физиологически активных полимеров.
Слайд 153
153 Физиологически активные полимеры. Синтез физиологически активных полимеров. Отличия критериев выбора стратегии синтеза ФАП от синтеза низкомолекулярных ФАВ Для синтеза НМ ФАВ важна финальная химическая структура, и не столь важно как и через какие стадии с какими выходами к ней пришли (хотя иногда микропримеси весьма важны) все равно на конечной стадии вещество тщательно очищают. Критерии выбора пути синтеза - экономические: Дешевизна и доступность исходных. Выход конечного продукта. Легкость очистки. При синтезе ФАП продукты побочных реакций и примеси оказываются химически связанными с полимером и не могут быть отделены от продукта. Критерии выбора пути синтеза – однозначность структуры получаемого полимера. Мягкие условия, отсутствие побочных реакций, выход. Влияние на ММР, композиционную и структурную неоднородность полимера. Экономические соображения. Создание основной цепи Полимеризацией (виниловые, аллильные, акриловые мономеры). Поликонденсацией (ПЛГА). Химическая модификация готовых полимеров. Страрегия и тактика синтеза ФАП.
Слайд 154
154 Физиологически активные полимеры. Синтез физиологически активных полимеров. Синтез ФАП (Со)Полимеризацией Стратегия и тактика синтеза ФАП. Синтез макромономеров для (Со)полимеризации. Введение Ненасыщенной связи в ФАВ. Использование функциональной группы ФАВ. Несущественной для физиологической активности. Любой (для ФАП с гидролитическим механизмом действия). Создание вставки. Желательно сначала присоединить вставку к ненасыщенному остатку а уж потом к ФАВ. ω -аминокислоты (аминокапроновая). α, ω -дикислоты (янтарная, глутаровая). α, ω -диамины (этилендиамин, гексаметимендиамин). Диальдегиды (терефталевый, глутаровый). Введение солюбилизирующей части Отдельным сомономером (акриламид, диметакриламид, винилпирролидон, N-( 2-гидроксипропил)метакриламид, 2-метилсульфоксиэтилакрилат, 2-оксиэтилметакрилат, ди и триэтиленгликоль метакрилат, диметиламинометилметакрилат, акрилоилхолин, акриловая, метакриловая, кротоновая, малеиновая кислоты. Избытком мономера без вставки. Сополимеризация Обычно с избытком солюбилизирующего мономера для предотвращения стерических затруднений.
Слайд 155
155 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Схема синтеза ФАП сополимеризацией Преимущества синтеза ФАП сополимеризацией. Простота и универсальность метода для карбоцепных полимеров. Возможность варьирования структуры в широких пределах. Недостатки. Трудность контроля ММР и микроструктуры цепи. Трудность контроля прочности связи ФАВ с полимером. Пригоден только для получения карбоцепных полимеров.
Слайд 156
156 Физиологически активные полимеры. Синтез физиологически активных полимеров. Схема синтеза ФАП химической модификацией готовых полимеров. Страрегия и тактика синтеза ФАП. Присоединение к полимеру готового блока ФАВ-вставка (предпочтительно). Проблема – многие ФАВ полифункциональны получение блока и связывание с ФАП сопряжено с побочными реакциями, применение защитных групп осложнено необходимостью их снятия из коньюгата с полимером в жестких условиях). Последовательное построение всей структуры Проблема - каждая стадия вносит разнозвенность. Меняется ММР и разветвленность. Возможна сшивка.
Слайд 157
157 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Модификация функциональных полимеров. Желательно проводить в растворе. Желательно в воде. Контроль за М w и композиционной неоднородностью путем ГПХ с многопараметровым детектированием фракций. Очистка (диализ, ультрафильтрация, переосаждение, ГПХ). Охарактеризовывание. Светорассеяние, ЯМР, ИК, УФ, ГПХ Реакции, применяемые при синтезе ФАП. Требования к реакциям Высокие выходы т.к. ФАВ и особенно ФАВ со вставкой обычно дороги. Мягкие условия реакции не вызывающие сшивания и деструкции полимера Минимум побочных реакций. Однозначность протекания реакции – единственный тип связи ФАВ с носителем. Часто используют методы разработанные для синтеза и иммобилизации пептидов. Полимеры носители должны быть химически инертны в физиологических условиях. Их приходится активировать для посадки ФАВ, что приводит к разнозвенности, сшивке и т.д. Вместо ФАП можно активировать ФАВ если это возможно, при этом достоинства: Продукты побочных реакций могут быть отделены при очистке. Сшивки не образуются нет проблем с модификацией полимера. Но ФАВ часто полифункционально и их молекулы подвергаются разнообразным превращениям при активации поэтому активацию ФАВ используют редко.
Слайд 158
158 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. О-, С-, N -, S- алкилирование Неактивированные алкилгалогениды не используют. Тозилаты – редко – т.к. условия реакции слишком жесткие Используют α -галогенкислоты (хлоруксусная). Используют N- алкилирование – для получения четвертичных солей. Используют присоединение эпоксидов – мягкий метод. Восстановительное N- алкилирование Двойная связь способна к комплексообразованию, можно регулировать склонность к гидролизу. Алкилирование в присутствии цианоборгидрида.
Слайд 159
159 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Реакция Манниха. Применяют для связывания карбонильных соединений и фенолов с аминами. Метод азосочетания. Используют для присоединения фенолов или другиз ароматических соединений с активированным ядром. Реакцию проводят в водной среде на холоду. Выходы хорошие. Побочные реакции – образование фенолов из диазосоединений. Два соседних ароматических ядра часто приводят к сильным гидрофобным взаимодействиям и агрегации полимера.
Слайд 160
160 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Ацилирование. Используют активирование карбоксильной группы (увеличение положительного заряда на углероде). Хлорангидридный метод. Требует защиты других функциональных групп ФАВ. Хлорангидриды в водной среде легко ацилируют амины, труднее спирты. В органической среде в присутствии трет аминов ацилируют легко все, но неспецифически. Ангидридный метод. Симметричные ангидриды мене активны, но устойчивы при хранении и более селективны. Смешанные ангидриды – очень удобный метод. Ацилазидный метод – ангидриды карбоновой и азотистоводородной кислот. Специфичны во взаимодействии с аминами. Трудно получать, нестабильны, многостадийный синтез.
Слайд 161
161 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Ацилирование Карбодиимидный метод ацилирования. Применяют для связывания кислот с аминами спиртами и фенолами. В безводной и водно-органической средах – дициклогексилкарбодиимид В водной и органической средах N- этил- N’-( 3-диметиламинопропил) карбодиимид и «ЦМЭК» N- циклогексил- N’[2-(N- метилморфолиний) этил ] карбодиимид. В водной среде реактив Вудворда. Селективность зависит от среды и температуры. В водных и водно-органических средах без нагревания амины реагируют значительно быстрее чем гидроксильные. Побочная реакция – образование N- ацилмочевин, которые остаются на полимере (там где была кислотная группа). Образуются ангидриды и оксазолоны.
Слайд 162
162 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Ацилирование Метод активированных эфиров. Наиболее мягкий и селективный способ введения ФАВ. Применяют для селективного связывания кислот с аминами. В безводной среде в присутствии имидазола способны связываться со спиртами и фенолами. Возможно введение сомономеров содержащих вставку, содержащую на конце активированную группу. Возможно введение активированных сложноэфирных групп в готовый полимер. Азолидный (имидазолидный) метод. Мягкий метод аналог метода активированных эфиров. Реакция с аминогруппой предпочтительнее чем со спиртовой, может быть проведена селективно.
Слайд 163
163 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Методы активирования полисахаридов. Частичное периодатное окисление. Приводит к образованию диальдегидов Пригодно только для полисахаридов в молекуле которых есть две соседние ОН группы в цикле. Применяют для связывания с аминами с образованием вторичных аминов циклов или альдиминов. Продуктов реакции много ( не однозначная реакция). Реакция может быть обратимой (альдимины). Основной полимер частично гидролизуется со снижением М w. Протекает в мягких условиях.
Слайд 164
164 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Методы активирования полисахаридов. Цианурхлоридный метод. Атомы хлора реагируют в разных условиях, позволяет избежать сшивки. Триазиновое кольцо – жесткая вставка, физиологически инертна (аналог меламина). Пригодно для всех полисахаридов.
Слайд 165
165 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Методы активирования полисахаридов. Метод циклических карбонатов. Пригоден для всех полисахаридов имеющих две гидроксигруппы в цикле. Ацилирование полисахарида алкилхлорформиатом в присутствии триэтиламина с последующим аминолизом циклического карбоната с образованием уретана. Возможно образование карбонатных сшивок вплоть до образования геля. Пригоден для присоединения аминов и редко первичных спиртов. Метод смешанных карбонатов Ацилирование хлорформиатами активированных эфиров в присутствии пиридина. Проходит в более мягких условиях промежуточный продукт смешанный карбонат затем аминолиз с образованием уретана. Нет сшивок, присоединение спиртов невозможно, избыток сложноэфирных групп удаляется гидролизом без сшивки.
Слайд 166
166 Физиологически активные полимеры. Синтез физиологически активных полимеров. Стратегия и тактика синтеза ФАП. Реакции, применяемые при синтезе ФАП. Методы активирования полисахаридов. Бромциановый метод. Пригоден для всех полисахаридов имеющих две гидроксигруппы в цикле. Пригоден для присоединения аминов и редко первичных спиртов. Требует специальных мер для предотвращения сшивки Снижение рН, разбавление. Сшивки можно разрушить добавлением того же или более сильного амина. Структура продуктов неоднородна. Присоединенное аминосоединение может быть вытеснено в физиологических условиях избытком другого амина, например белка.
Слайд 167
167 Введение в технологию полимеров медико-биологического назначения Часть 3. Физиологически активные полимеры. Тема 6 Полимерные производные низкомолекулярных физиологически активных веществ.
Слайд 168
168 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Полимерные производные веществ, действующих на нервную систему. Производные местных анестетиков. Производные веществ действующие на ЦНС. Производные нейромедиаторов. Производные местных анестетиков. Действие только за счет отщепления от полимера. Мишень – нервные окончания. Высокие локальные концентрации. Посадкой на полимер достигается. Замедленная скорость рассасывания (распространения по организму). Пролонгация действия. Снижение токсичности. Соль Новокаина с карбоксиметилцеллюлозой Mw= 26 кДа «Целлновокаин» – превосходит по силе анестезии новокаин в 3 раза, по длительности в 2-3 раза. Выпущен «Целлтримекаин».
Слайд 169
169 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные веществ действующие на ЦНС. Полимеры не проходят в ЦНС (через гемато-энцефалический барьер). Действие только за счет отщепления от полимера. Прямое, без вставки, присоединение мескалина, серотонина, тироксина к ПВП убивает их активность полностью. Присоединение антагонистов морфина на акриловые полимеры гидролизуемой связью увеличивает время действия в 2-30 раз. (4.19) Присоединение нейролептика фторфеназина к акриловым сополимерам и к декстрану гидролизуемой связью увеличивает время действия до 2-30 суток. Присоединение мескалина с пептидной вставкой увеличивает время действия с 16 часов до 17 суток.
Слайд 170
170 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов. Взаимодействуют с рецепторами самой разной локализации (на разных клетках). На поверхности мембран клеток. Внутри мембран. Внутри клеток. Связывание ФАВ с полимером позволяет изменять сродство к рецепторам данного вида локализации например связываться только с рецепторами на поверхности мембраны и не пускать внутрь мембраны. Последовательный ответ рецептора на вещество с ним связывающееся. Специфическое связывание с рецептором. Индуцированный физиологический ответ. Вещество специфически связывающееся с рецептором называется его лигандом Если лиганд специфически связывается и вызывает физиологический ответ за счет нужных изменений в рецепторе его называют агонистом рецептора. Если лиганд специфически связывается но не вызывает физиологический ответ его называют антагонистом данного рецептора. Если антагонист связывается сильнее, чем обычные агонисты – его называют блокатором В зависимости от способности вытеснять агонист из рецептора блокаторы делятся на конкурентные или неконкурентные, обратимые и необратимые. Связывание ФАП прививочного типа с рецептором еще не означает активности.
Слайд 171
171 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов - катехоламинов. Гормоны надпочечников адаптогены участвующие в регуляции стресса пульса, давления, нервной передаче. Место действия α - и β - адренорецепторы на поверхности клеток сердца и сосудов. На мембранах синапсов. Действуют на фермент способствующий высвобождению энергии (аденилатциклазу) внутри клеток эритроцитов увеличивает концентрацию ц-АМФ. Присоединение к полимеру разными связями (гидролизуемыми и негидролизуемыми позволяет разделить эти активности Присоединение гидролизуемой связью позволяет создать повышенную локальную концентрацию. Адреналин, норадреналин, дофамин, изопротеренол - агонисты рецепторов, пропранолол антагонист (снижает давление, пульс). 4.1-4.3 Подобные соединения – гистамин, триптамин.
Слайд 172
172 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Сайты для иммобилизации и их влияние на активность. Катехоламины имеют следующие сайты для ковалентного связывания Активированное ароматическое ядро ( три сайта) ОН- группы кольца. ОН- группа алифатическая. Алифатический радикал Аиногруппа. ОН – ароматического кольца (катехольная система)замещение вызывает потерю активности). Алкилирование ядра вызывает потерю активности (на примере изопротеренола). Сохранение заряда ( пары)) на аминоруппе – критично для активности. Альдимины – активны за счет отщепления. Амиды не расщепляемые неактивны. Описаны агонисты антагонисты и полностью неактивные полимеры. Амида за исключением амида гистамина неактивны. Вторичные и третичные амины – активны, но бывают и антагонисты (глутаровый альдегид с последующим восстановлением, алкилирование дофамина и норадреналина декстраном приводит к их превращению в гипотензивные препараты). Замещение в алифатической части изменяет активность. Введение большого алкильного заместителя по ОН норадреналина повышает активность по отношению к β -адренорецепторам а маленького снижает вплоть до полной потери. Азосочетание в ядро в положение - 6 – приводит к сохранению активности в низкомолекулярном аналоге, но на полимере к полной потере (нет ясности в этом вопросе). Реакция Гомберга в 6 положение– сохранение активности. Имунологическая специфичность не меняется при связывании по С 6 ядра по реакции Манниха, антитела распознают арильную и алифатическую части и отличают катехоламины друг от друга.
Слайд 173
173 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Разделение активности. Функциональные виды активности катехоламинов Катехоламины имеют несколько функциональных видов активности На поверхности клетки – сигнальная - связываются с адренорецепторами нескольких типов. Внутри клетки взаимодействуют с внутриклеточными ферментами (аденозилциклаза) инициируют расходование енергии. Комбинированная функция. Мембранный фермент тирозингидроксилаза. Дофамин сначала ингибирует фермент снаружи как субстрат, затем проникает через мембрану (через канал фермента) и связывается изнутри активирует как кофермент (кофактор). Ограничение проникновения в клетку и внутрь мембраны позволяет разделить эти виды активности Присоединение к полимеру разными связями (гидролизуемыми и негидролизуемыми с длинными и короткими вставками) позволяет получать ФАП в которых катехоламин Взаимодействует только с поверхностью мембранного белка, не проникает ни в клетку ни внутрь канала мембранного белка - обладает только сигнальной активностью (негидролизуемая короткая вставка). Не проникает внутрь клетки но взаимодействует с мембранным белком и может проникать в канал (негидролизуемая длинная гибкая вставка). Способен отщепляться и проникать как внутрь мембранного белка так и внутрь клетки (гидролизуемая вставка любой длины).
Слайд 174
174 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Разделение активности. Дофамин на ДАД может быть присоединен двумя связями Гидролизуемой альдиминной Негидролизуемой восстановленной вторичной аминной Дофамин на негидролизуемом полимере связывается с изолированной тирозингидроксилазой, но на модели синаптосом (фермент в мембране) связывается только снаружи как судстрат внутрь не проходит не связывается как кофактор. Негидролизуемый полимер с изопротеренолом присоединенном прочной азосвязью на короткой жесткой вставке взаимодействовал только с β -адренорецептором истинный ФАП с поверхностным действием.
Слайд 175
175 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Наличие вставки. Длинная вставка позволяет алпренольным остаткам селективно сорбировать β -дренорецепторы (белок) из раствора. По сравнению с исходным ФАВ они взаимодействуют в 8000, 600 и 10 раз слабее соответственно. Взаимодействие усиливается с увеличением длины вставки от 4 до 13 атомов соответственно. Страдает только специфическое рецепторное связывание. Указанные полимеры одинаково связывают антитела к низкомолекулярному ФАВ. Антитела распознают арильную и алифатическую части и отличают катехоламины друг от друга. Таким образом удается отделить рецепторную специфичность от иммунологической
Слайд 176
176 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Выводы. Селективное действие на разные популяции рецепторов, видовая специфичность, рассовая специфичность. Наличие вставки позволяет алпренольным группам селективно взаимодействовать с белком β -адренорецепторами длина вставки позволяет различать субпопуляции β -адренорецепторов. Конкурирующие лиганды более сильные агонисты могут вытеснять ФАП. Лиганды агонисты в порядке уменьшения сродства к рецептору: Изопротеренол. Адреналин. Норадреналин. альпренолол. То же касается α -адренорецепторов. Адренорецепторы существуют в виде субпопуляций с которыми катехоламины и ФАП взаимодействуют с разной силой. Субпопуляции отличаются не структурой рецептора а окружением. У животных существует рассовая специфичность рецепторов.ФП с разной длины вставками позволяет изменять силу взаимодействия с рецепторами разных популяций. Адренорецепторы локализованы в разных органах и в разных местах внутри и вне клеток. ФАП с позволяет селективно действовать на рецепторы разной локализации (мембранные например). Регуляция функций организма предусматривает конкурентное связывание с рецепторами и вытеснение из рецепторов разными катехоламинами. Создание ФАП позволяет создать инверсию вытеснения (инверсию в ряду силы лигандов). Причем эти эффекты рассово зависимые. Создание повышенных локальных концентраций на поверхности клетки при отщеплении ФАВ с ФАП не подтверждено экспериментально
Слайд 177
177 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Многоточечное связывание. Использовали β -адреноблокаторы: алпренолол, метопролол и пропранолол присоединеные к олигомерным пропиленоксидам каждая молекула содержала от 1 до 4 лигандов. Специфическое связывание (сродство) олигомеров с рецептором в 5-10 4 раз слабее чем у аналогичных низкомолекулярных ФАВ. Легко смываются с рецептора НМ аналогом низкой концентрации. Устойчивость связывания с рецептором т.е способность к неспецифической элюции выше в 3-5 раз. Вслед за первоначальным слабым специфическим связыванием с рецептором в одной точке следует дополнительное связывание в нескольких точках или рецептором или мембраной. Размер рецептора как правило сильно больше размера макромолекулы и сайт у него часто только один. Полимерный эффект заключается в кластеррировании (агрегации в группу) рецепторов полимерами на поверхности мембраны с последующим рецепторно медиируемым эндоцитозим рецепторов внутрь клетки. Многоточечное связывание ФАП с окружением определяемым рецептора видовой специфичностью и типом субпопуляции в комбинации с ослабым специфическим связыванием дает возможность синтеза селективных ФАП отличающих рецепторы. Основные НМ нейромедиаторы не селективны. Метапролол Пропранолол Алпренолол
Слайд 178
178 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные низкомолекулярных физиологически активных веществ. Производные нейромедиаторов – катехоламинов. Влияние дальнего окружения, гидрофильно-липофильного балланса и М w. Дальнее окружение Для изопротеренола модифицированного по аминогруппе. Карбоксильные производные неактивны независимо от длины вставки т.к. электронейтральны при физиологичесом рН. Для паратолуидинов с n =4 активность в 10-100 раз выше чем у НМ изопротеренола, остальные в 500 раз менеее активны. Дополнительные группы в кольце влияют на вктивность Желательно для присоединения к ФАВ использовать п- аминофенилаланин а не лизин. Существенно влияние гидрофильно-липофильного балланса, заряда и М w. Рис 4.15 Подход к конструированию ФАП взаимодействующих с рецептором должен включать: Соэдание фармакофора, способного в связанном состоянии взаимодействовать с выбранным рецептором. Создание окружения фармакофора, включая дальнее, регулирующее сродство к ркцептору и необходимую селективностьрецепторного взаимодействия. Создание системы в целом, обладающей необходимым зарядом, М w, ММР, и гидрофильно-липофильным баллансом, чтобы обеспечить необходимую фармакокинетику и метаболизм.
Слайд 179
179 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Классификация и стратегия создания. Опухолевая клетка может быть разрушена В результате нарушения жизненно важных процессов на молекулярном уровне (подавления химических превращений. В результате нарушения целостности клетки – клеточный уровень - нарушение структуры плазматической мембраны ( полимерные липосомы). Полимеры, действующие на молекулярном уровне. Полиэлектролиты. Иммунотоксины - антитела (белки) с ковалентно связанными токсинами. Полимерные производные фермента аспарагиназы с пришитыми токсинами. Микрочастицы и микрокапсулы – носители противоопухолевых средств. Водорастворимые полимеры прививочного типа, содержащие остатки противоопухолевых средств. Классификация противоопухолевых ФАВ по механизму действия. Алкилирующие агенты. Взаимодейсвуют с важнейшими полимерами внутри клетки (нуклеиновае кислоты, ферменты, Производные ипприта, 2-хлорэтиламина, 2,2-бис (хлорэтил)амина, этиленимина. Сшивают биополимеры, препятствуют выполнению функций. Антиметаболиты. Структурные аналоги веществ участвующих в нормальном метаболизме (пуринов, пиримидинов фолиевой кислоты и т.д.) Включаются в метаболизм и останавливают процесс. Меркаптопурин, 5-фторурацил, метотрексат. Противоопухолевые ФАВ с иным механизмом действия. Действуют в основном на нуклеиновые кислоты в стадии митоза. Противоопухолевые антибиотики, «Цисплатин».
Слайд 180
180 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Классификация и стратегия создания. Противораковая трапия направлена в основном против диффузных и метастазирующих злокачественных новообразований. Недостаток всех противоопухолевых антибиотиков – слишком маленькая терапевтическая широта и неизбирательная токсичность. Задача создания полимерных противоопухолевых средств – целевой транспорт ФАВ в опухолевые клетки. Создание транспортных форм цитотоксических веществ, обладающих повышенным сродством к опухолевым клеткам и возможностью проникновения в них. Известно около 20 различий в характеристиках здоровых и опухолевых клеток. Высокая скорость митоза. Повышенный эндоцитоз. Повышенный суммарный поверхностный зарая. Наличие опухоль специфических антигенов на поверхности. К сожалению отличия непостоянны. Стратегия синтеза противоопухолевых ФАП. Противоопухолевое ФАВ соединяют через полимер с лигандом, специфичным (в той или иной степени) для опухолевых клеток данного вида С остатком стероидного гормона к которому на поверхности клетки много рецепторов. С антителом Используют свойства полимера. Склонность к эндоцитозу. Регулируемый заряд, липофильно-гидрофильный баланс и Mw. Кооперативные взаимодействия.
Слайд 181
181 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Классификация и стратегия создания. Общий механизм действия противоопухолевых ФАП прививочного типа. ФАП связывается с клетками в соответствии: Со своим суммарным зарядом. Липофильно-гидрофильным баллансом. С помощью биоспецифического лиганда. ФАП пдвергается эндоцитозу. Разлагается в лизосомах (желательно использовать биоразлагаемые носители). В результате происходит внутриклеточное выделение ФАВ и гибель клетки. Роль носителя Целевой транспорт Облегчение проникновения в быстро эндоцитирующие клетки. Основные канцеролитики. Сарколизин Метотрексат Циклофосфамид Хлорамбуцил Дегранол Цисплатин Фторурацил
Слайд 182
182 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Алкилирующие ФАП. Алкилирующие противоопухолевые ФАП прививочного типа с собственной активностью. Известно, что алкилирующие ФАВ активны только при наличие двух хлоров. Сарколизин с негидролизуемыми носителями активен даже когда остается только 1 хлор. 4.38, 4. 39 Аналогично получены ФАП с дегранолом, и метатрексатом. Малотоксичны, увеличенная терапевтическая широта. Противоопухолевые ФАП прививочного типа высвобождающие ФАВ при гидролизе. Альдиминового типа. 4.40 Сложноэфирного типа 4.41
Слайд 183
183 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Алкилирующие ФАП. Алкилирующие противоопухолевые ФАП прививочного типа высвобождающие ФАВ при гидролизе,. ФАП, содержащие хлорамбуцил и дополнительно катионную группу для связывания с мембраной.4.42 4.43 Важность знания механизма действия ФАВ ФАП на основе циклофосфана – слабая противоопухолевая активность. Циклофосфан – пролекарство неактивное само по себе, цитотоксично производное 6-гидроксициклофосфан, метаболит который образуется в организме. Посадка на полимер затрудняет метаболизм и образование токсичного метаболита. Производные содержащие 6-тиоциклофосфан образующий токсичное 6-гидрокси замещенное активны.4.49
Слайд 184
184 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Алкилирующие ФАП. Влияние полимера носителя Использование полианиона (даже с собственной активностью) вместо поликатиона снижает противоопухолевую активность ФАП (хуже связываются с мембраной). Использование полианионов – белков (альбумин), РНК, олигорибонуклеотидов хорошо связывающихся с мембраной усиливает действие. Инверсия влияния длины вставки на скорость гидролиза ФАП содержащих алкилирующие ФАВ. Длиннее вставка – гидрофобнее полимер. Медленнее гидролиз Ферменты не могут отщеплять алкилирующие ФАВ. Теряют ферментативную активность вследствие сшивания алкилирующими ФАВ в момент отщепления. 4.47
Слайд 185
185 Физиологически активные полимеры. Синтез физиологически активных полимеров. ФАП содержащий алкилирующий ФАВ N,N- бис (2-хлорэтил) фенилендиамин и специфические имуноглобулины к опухоли соединенные бромциан активированным декстраном – 100% выживаемость животных с экспериментальной опухолью, 80% животных не имели опухоли. Замена специфического иммуноглгбулина на нормальный – потеря активности Декстран с ФАВ но без иммуноглобулина – неактивен. Терапевтическая активность системы в целом значительно выше, чем отдельных частей или неполных комбинаций. Проблемы Малая доступность иммуноглобулинов и изменчивость опухоль специфических антигенов на поверхности раковых клеток от пациента к пациенту. Невозможно создать специфичное антитело к виду опухоли, можно только к опухоли данного больного. Протеворечивость требований к имуноглобулинам. Антитело должно нести максимум ФАП присоединенного к нему С увеличением количества полимера связянного с антителом ухудшается его специфичность по отношению к антигену на поверхности опухолевой клетки. Если антитела внешние (не свои собственные) то они как любой чужеродный белок будут вызывать иммунный ответ, т.е. образование антител к ним самим. При модификации своих антител полимером носителем они становятся чужими и вызывают ответ. Полимерные производные веществ с противоопухолевой активностью. Избирательность действия алкилирующих ФАП. Конструирование ФАП, содержащих узнающие компоненты. Лизосомотропия Еединственный эффективный механизм попадания противоопухолевых ФАВ в клетки. Это эндоцитоз ФАВ, связанного с полимером носителем с последующим перевариванием в лизосомах и внутриклеточным выделением свободного ФАВ. Медиируется белками (рецепторно медиируемый эндоцитоз) в особенности антителами.
Слайд 186
186 Физиологически активные полимеры. Синтез физиологически активных полимеров. Влияние носителя очень сильно На нейтральном полимере метатрексат малоактивен. Полимер только депо ФАВ. На белковых носителях (поли L- лизин) высокоактивен за счет быстрого рецепторно-медиируемого эндоцитоза. На поли D – лизине метотрексат проникает в клетку, но не отщепляется – неактивен. Полимер – носитель последовательно выполняет следующие функции. Транспорт к поверхности клеток мишеней Закрепление на мембране (за счет положительного зарада) Рецпторно-медиируемый эндоцитоз внутрь клетки. Деградация за счет лизосомальных ферментов, чем полнее и быстрее тем активнее ФАП. Целевой транспорт метатрексата достигнут с помощью лектинов и опухоль специфических антител. Метотрексат – подавляет иммунитет. Попытались скомпенсировать путем присоединения на пирановый полимер, который является стимулятором иммунитета. Результат – полная потеря иммунитета. Пирановый полимер тащит токсичное ФАВ в макрофаги и убивает их 4.53 4.54 Полимерные производные веществ с противоопухолевой активностью. Антиметаболиты. Метотрексат антагонист фолиевой кислоты. Ингибирует фолят редкутазу.4.52 Механизм транспорта сходен с ФАП на основе алкилирующих ФАВ – лизосомотропные ФАП неактивные сами по себе но активирующиеся в лизосомах.
Слайд 187
187 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Антиметаболиты. Противоопухолевые антибиотики Дауномицин, Адриамицин (доксорубицин), Актиномицин. Угнетают синтез ДНК. Очень низкая терапевтическая широта. Механизм транспорта сходен с ФАП на основе алкилирующих ФАВ – лизосомотропные ФАП неактивные сами по себе но активирующиеся в лизосомах. Применяют в виде комплекса с ДНК и синтетическими аналогами ДНК. Кроме транспорта в лизосомы (выше противоопухолевая активность) это меняет фармакокинетику ФАВ (не накапливается в сердечной мышце) ниже токсичность. Коньюгаты с белками классический пример лизосомотропных ФАП. Эффективно выделяют ФАВ только полимеры с три и тетрапептидной вставками 60 и 75% за 10 часов соответственно 4.55.
Слайд 188
188 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Целенаправленный транспорт.. Целевой транспорт - главная проблема для противоопухолевых средств В простейшем случае достигается подбором полимера носителя. Ограниченное распространение от места введения достигается комплексообразованием. Лимфотропность (болеомицин с сульфатом декстрана). Липофильность сополимеры пропиленгликоля с этиленгликолем. ФАП с биоспецифическими лигандами «векторами» – полимерные афинные лекарства Биоспецифические лиганды: Гормоны имеющие рецепторы на поверхности клеток мишеней. Лектины Антитела к специфическим антигенам на поверхности опухолевых клеток. Недостаток антител – низкая емкость по ФАВ. Больше присоединенного ФАВ хуже специфичность так как белок сильно модифицирован. Поэтому много молекул ФАВ присоединяют к ФАП а уже его один раз к антителу. Недостаток всех афинных лекарств – низкая емкость по ФАВ обычно 1.0- 2 максимум 60 моль ФАВ на моль антител М w антител – 150 кДа – 3 000 кДа. М w ФАВ обычно 500 Да тоесть весовое содержание ФАВ в самом лучшем случае 1 %.
Слайд 189
189 Физиологически активные полимеры. Синтез физиологически активных полимеров. Полимерные производные веществ с противоопухолевой активностью. Целенаправленный транспорт. Строение и свойства некоторых противоопухолевых ФАП с целенаправленным транспортом в клетки мишени.
Слайд 190
190 Введение в технологию полимеров медико-биологического назначения Часть 4. Полимерные корпускулярные носители: микрочастицы, микрокапсулы, липосомы. Тема 1 Физиологически активные полимерные микрочастицы.
Слайд 191
191 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Классификация корпускулярных носителей, принципы создания и использования. Корпускулярные физиологически активные полимеры - нерастворимые полимерные производные низкомолекулярных ФАВ в виде очень мелких частиц представляющие собой отдельную фазу к которым присоединены или в которые включены ФАВ. Корпускулярные ФАП циркулляционного типа - могут быть непосредственно введены в кровяное русло и там циркулировать поглощаясь клетками за счет фагоцитоза. Имплантируемые корпускулярные ФВП - их имплантируют в организм где они разлагаются выделяя ФАВ. По типу системы, управляющей целевой доставкой или выделением ФАВ подразделяются на типы. Имеется весьма значительное разнообразие транспортных систем с использованием корпускулярных ФАП, значительно больше, чем для растворимых ФАП. Магнитные – управляемые. Электромагнитные управляемые. Микроэмболы (забивают мелкие сосуды) Управляемые депо ФАВ ( pH зависимые, светозависимые, управляемые лазером). По биоразлагаемости. Биодеструктирующие - белковые, полигликолидлактидные, полицианакрилатные, полисахаридные. Небиодеструктирующие – акрилатные, поливинилпиролидоновые. По форме и размеру. Микрочастицы, наночастицы. Микросферы наносферы. Микрокапсулы, нанокапсулы. Липосомы. Отдельная область. Микро или нанореакторы в которых происходит каскад химических превращений. Липосомы изготовленные из куска мембраны клеток со встроенными рецепторами – биосенсоры. Микро диагностические частицы.
Слайд 192
192 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Нециркулирующие микрочастицы, растворяющиеся в организме. Лекарственная форма ФАВ для локального применения, латентации и постепенного высвобождения ФАВ, крупные частицы до 100 мкм. Фибринолитический препарат Фибринолизин, Химотрипсин и Стрептокиназа на окисленном сефадексе. Размер гранул 80 мкм – больше, чем диаметр капилляров (10-20 мкм). После иммобилизации фермент теряет 70% активности (неактивен в иммобилизованном состоянии) но восстанавливает активность после отщепления. Ввводят местно – в сердечную (коронарную) артерию в место действия. Растворение происходит не за счет неограниченного набухания а за счет сшелушивания с поверхности без увеличения размера частиц. Скорость растворения МЧ и скорость выхода ФАВ тем больше чем выше степень окисления. Происходит медленная (несколько недель) деградация носителя с выделением растворимого коньюгата ФАВ – углевод способного растворять тромб. Локальная концентрация фермента в очаге поражения высокая. Нет повышения концентрации в организме. При внутрикаронарном введении полное разрушение тромба и восстановление кровотока, количество нативного фибринолизина необходимое для достижения того же эффекта в 100 раз больше, кроме того достаточно одного введения микрочастиц. ФАВ вводится в латентном состоянии Переходит в активное состояние после отщепления с носителя. Можно вводить одновременно очень большие дозы ФАВ. Рис 6.1. Инсулин на окисленном сефадексе при подкожном введении. Время проявления активности увеличивается с 6 до 16 часов. Адриамицин на Сефадексе Местное введение в опухоль Пониженная токсичность и некротический эффект.
Слайд 193
193 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Циркулирующие микрочастицы. Размер частиц – механизм избирательной подачи ФАВ. Мелкие корпускулы 0.1-1 мкм. Эндоцитируются клетками, либо сорбируются на плазмолеме без фагоцитоза либо накапливаются в межклеточной жидкости. Мишень – лизосомы и другие клеточные компоненты, лизосомотропные ФАВ. Скорость фагоцитза зависит от поверхности, от размера и множества других факторов. Введение мелких МЧ сначала активирует РЭС а избыток подавляет (перегружает).Предварительная блокада печени МЧ без ФАВ (декстран сульфат, технический углерод) перед введением противоракового препарата – прием позволяющий частично защитить печень от токсичных ФАВ. Крупные 12 мкм фильтруются легочными капиллярами причем если не могут растворяться – это приводит к нарушению гемодинамики. Покрытие МЧ неионогеннными ПАВ уменьшает их накопление в печени за счет фагоцитоза и увеличивает накопление в легких и в мозгу. Если размер порядка 10 мкм и боле то МЧ могут использоваться для эмболизации (частичного закупоривания) сосудов в органе мишени. Эмболы омываются кровью, постепенно растворяются и выделяют ФАВ в орган мишень (используется для лечения опухолей. Митомицин Ц в желатиновых МЧ размером 0,28 мкм поступает в печень и селезенку а 12,9 в легкие. Строение циркулирующих МЧ. Могут содержать на поверхности или в массе реакционноспособные группы для ковалентного связывания ФАВ и узнающих цель молекул. Могут содержать физически связанное ФАВ в своей массе. Материалы Альбумин сшитый. Акрилаты (полигидроксиэтилметакрилат, акриламид, цианакрилаты. Полистирол (гидрофобные частицы). Полигликолидлактид.
Слайд 194
194 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Циркулирующие микрочастицы. Биодеструкция МЧ. Не должны выделять ФАВ при хранении и в ходе циркуляции, если специально для этого не предназначены. В клетке должны постепенно деструктировать. Скорость биодеструкции прочность связи ФАВ -МЧ. Если ФАВ механически включено в массу МЧ, то скорость деструкции определяет скорость подачи ФАВ. Если ФАВ сорбировано на поверхности – скорость подачи выше скорости деструкции и МЧ могут отщеплять ФАВ во время циркуляции. Если ФАВ ковалентно связано, то скорость подачи либо больше, либо равна скорости деструкции. Прочность связи ФАВ-МЧ оказывает решающее влияние на механизм действия. Если связь не расщепляется до попадания МЧ в клетку – лизосомотропия и ФАВ выделяется в клетке. Если расщепление в кровотоке до попадания в клетку – МЧ просто депо ФАВ. Фармакодинамика небиодеградирующих МЧ на примере меченных 3 Н МЧ из полиакриламида диаметром 0.25-0.3 мкм. Период полуисчезновения из кровотока – 40 мин (поглощение макрофагами печени и селезенки 50%). Через 1 час МЧ появились в костном мозге ( из оставшихся 50%). Через 1.5 часа агрегаты МЧ появились в легких (из оставшихся 50%). Через 16 часов радиоактивность резко снизилась в печени и селезенке (частицы выброшены с желчью) и увеличилась в стенках кишечника. Через 2 месяца спала радиоактивность стенок кишечника. Фармакодинамика легкобиодеградирующих МЧ с ферментом аспарагиназой. Внутривенное введение – активность 4-5 суток – так же как и у несвязянного ФАВ (даже не депо). Внутрибрюшинное введение – 14 суток – депо. Магнитные МЧ содержащие Fe2O4. Прикладывая магнитное поле можно концентрировать до 50% частиц с адриамицином в опухоли. Скорость кровотока в артериях 15-20 см/с, в капиллярах 0.05 см/с. Там и удерживают частицы.
Слайд 195
195 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Полимерные липосомы и мицеллы. Липосомы это моно- или полиламелярные фосфолипидные полые карпускулы микроразмеров. Полимерные мицеллы это моно- или полиламелярные карпускулы со стенкой из упорядоченных поверхностно активных полимеров жидкокристаллического типа любого состава. Обычно все мицеллы независимо от их природы (фосфолипидной или просто поверхностно- активной) называют липосомами. Каждая ламель – замкнутая бислойная мембрана в которой фосфолипидные (ПАВ) молекулы обращены полярными концами в водную фазу а гидрофобными навстречу друг другу. Минимальный размер 25 нм, максимальный 10-20мкм. Обычные липосомы Не имеют полимерной ковалентносвязанной структуры. Мембрана фактически жидкая (ЖК) структурирована за счет гидрофобных контактов между хвостами. Рис 6.2. Механизм биологического действия. При использовании в качестве транспортной системы При контакте с клеткой ПЛ сливается с с мембраной клетки вследствие слабых гидрофобных связей между молекулами внутри ламелей. Содержимое липосомы при слиянии попадает в клетку. При использовании в качестве депо. Слабый контакт обусловливает выход из липосомы ФАВ как при хранении так и при циркуляции в русле. Новые противораковые лекарства на основе липосом. Липосомы дестабилизируют мембрану сливаясь с клеткой. Липосомы с ПАВ внутри. Мембрана липосомы должна быть прочнее мембраны клетки Не содержат противоопухолевых ФАП. Подход используется для антибактериальных средств катионного типа (бензалконий хлорид)
Слайд 196
196 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Полимерные липосомы и мицеллы. Упрочненные мицеллы и липосомы. Способы упрочнения липосом и мицелл. Создание ковалентных связей между молекулами ПАВ (фосфолипидов), находящихся в ориентированном состоянии. Использование второго полимерного покрывающего слоя (мяч в сетке). Взаимодействие может носить ковалентный или электростатический характер (псевдополиэлектролитный комплекс между полимером и псевдополимером). Если упрочняющий полимер гребнеобразный – содержит гидрофобные хвосты, он встраивается и образуются рН чувствительная система. Проницаемость резко зависит от изменения рН в узком интервале рН=6-7 – система целевой доставки в воспаленный орган. Рис 6.3
Слайд 197
197 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Полимерные липосомы и мицеллы. Упрочненные мицеллы и липосомы. Мономеры используемые для создания упрочненнных полимерных мицелл. Рис 6.4
Слайд 198
198 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Полимерные липосомы и мицеллы. Упрочненные мицеллы и липосомы. Используют в основном: акриловые, диеновые и ацетиленовые производные. Полимеризуют после образования упорядоченных мицелл фотохимически. Стр 234 Гребнеобразные мицеллы упрочненные поликонденсацией аминокислотных остатков.стр 235 При полимеризации акриловых производных М w образующихся полимеров до 2 000 кДа, n=500-800. На каждую моноламелярную липосому приходится 20-600 цепей. 6.1 6.2 стр 235
Слайд 199
199 Полимерные корпускулярные носители. Физиологически активные полимерные микрочастицы. Полимерные липосомы и мицеллы. Модель физиологиески-активной липосомы. Основные компоненты мембраны Укрепленный полимерный бислой. Рецепторы для узнавания поверхности клетки например гликолипиды – лектины с вставленными акриловыми полимеризующимися группами. Неполимеризующиеся гликолипиды вставленные в слой. Ферменты – белки деструктирующие мембрану клетки мишени но не деструктирующие липосому (фосфолипаза, лизофосфолипиды). ПАВ либо ФАВ внутри липосомы. Незаполимеризованные окна способные открываться под действием внешнего сигнала (рН, гипертермия и т.д.). Рис 6.4.
Слайд 200: BENEFITS OF ENCAPSULATION
sustained /prolonged release of active increased stability of active, protection from degradation increased/changed solubility of lipophilic active in the aqueous “solution” target delivery external signal activated release of active (pH, osmotic pressure, specific ion, microwave, ultrasound, affinity, enzymes, etc. ) masking taste, odor, toxicity, etc
Слайд 201: The level of glycemia concentration of glucose in blood mmol/l for diabetic rats after single intragastric injection of 50 U/kg encapsulated insulin
Слайд 202: Nanocapsules for Enzymatic Bleaching Goal: to apply atmospheric oxygen for bleaching of fabrics
Filaments of fabric to be bleached Filament affinity “skin” containing bleach catalys (Fe dextran) Hydrophobic shell impermiable for anion radicals Aqueous core containing Laccase, Superoxide dismutase and quinine
Слайд 203: Capsules with Ion/pH controlled release
osmotic presure controled release pH dependent release - a) dissolution of special interpolymer complex inclusions in the shell b) dissolution of polymer shell ion dependent release - dissolution of core made from ion dependent hydrogel
Слайд 204
porous porous nanocapsules self nanoparticles nanoparticles arranged with closed with open micelle type pores pores nanocapsules d nm = 200-1000 200-1000 50-800 10-200 carrier/active ratio 10:1 10:1 1:3 1:10
Слайд 207: Nanoparticles type I type II
active ð solid ð liquid ð solution of active ð liquid active
Слайд 208: NANOPARTICLES PREPARATION - EMULSION POLYMERIZATION
ACTIVE IN MONOMER - TYPE I NANOPARTICLES ACTIVE IN POLYM. MEDIUM - TYPE II NANOPARTICLES
Слайд 210: NANOCAPSULES PREPARATION - INTERFACIAL POLYMERIZATION
I. Preparation of the two phase polymerization medium. II. Concentrating of active inside droplets. III. Conditioning of polymerization of the monomer in the interphase layer. IV. Covering nanocapsules with desirable “skin” (if necessary).
Слайд 212: TYPES OF NANOCAPSULES
AQUEOUS FILED nanocapsules reverse phase regular
Слайд 213: TYPES OF NANOCAPSULES
OIL FILLED nanocapsules organic emulsion regular
Слайд 215: SHELL FORMATION
TO ORGANIZE POLYMERIZATION IN THE INTERPHASE LAYER: Initiator of polymerization to be concentrated into droplet Retard polymerization in the bulk TO FORM POROUS SHELL USING ADDITIVES TO MONOMER WITH: bulk soluble substances with low dissolving rate pH dependent solubility
Слайд 217: CYANOACRYLIC MONOMERS
CN R= -CH 2 CH 3 CH 2 =C -CH 2 CH 2 CH 2 CH 3 COOR -CH 2 -(CH 2 ) 14 -CH 3 CYANOACRYLIC MONOMER ANIONIC POLYMERIZATION CN nucleophile CN CN CH 2 =C Nu + -CH 2 -C - + CH 2 =C COOR initiator (Nu) COOR COOR Nucleophilic initiator (Nu) : moisture/water; amines/peptides; CN alcohols/phenols/aldehydes; Nu CH 2 -C H mercaptanes, ets. COOR n
Слайд 218: ADVANTAGES OF CYANOACRYLATE MONOMERS FOR SHELL FORMATION :
Self-sterile polymer, no issue with sterilization of suspension No special initiator is required for polymerization No aggressive radicals formed during polymerization process Instant polymerization in mild condition at room temperature There are possibilities to control lipophilic-hydrophilic balance of the nanocapsules shell There are possibilities to form covalent bonded surface/skin modificator Polymer is biodegradable, easy to control the rate of biodegradation
Слайд 219: DEGRADATION in vivo TWO MECHANISMS: a) formaldehyde and alkylcyanoacetate b) primary alcohol and poly-(2-cyanoacrylic) acid
Слайд 220: TOXICOLOGY OF POLYMERS
POLYMETHYL-, POLYBUTYL-, POLYHEXYLCYANOACRYLATES STUDIED in vitro ISOLATED RAT HEPATOCYTES: PARTICLES POORLY TAKEN UP TOXICITY, 2X10 4 per cell LD 50’S 0.4 mg (2x10 6 ) per cell, polybutyl 1.0 mg (2x10 6 ) per cell, polyhexyl ISOLATED MOUSE MACROPHAGES: 1% conc. toxic in 1 hour, polymethyl 1% conc. not toxic in 1 hour, polyisobutyl CONCLUSION: toxicity inversely proportional to rate of degradation, size of alkyl chain determines rate of degradation. AMES TEST: not mutagenic, polybutyl, polymethyl; HISTOTOXICITY: no hypersensitivity, s.c. polyisobutyl;
Слайд 221: Covalently bonded skin formation
CORE SHELL SKIN (hydrophobic or hydrophilic)
Слайд 222
O O H O H O H C H 2 C H 2 O H O H O H O O O H O O O H C H 2 O O H O H C H 2 C O O R C N H n m n O C H 2 C O O R C N H hydrophilic “skin” hydrophobic “skin”
Слайд 223: ENCAPSULATION OF INSULIN into aqueous filed nanocapsules
Insulin is polypeptide of middle molecular weight. It contains S-S bond, and it is soluble in the water. Highly sensitive, easy to inactivate during manipulation Solvent dependent activity due to irreversible changes in chain conformation Inactivated even being frozen
Слайд 225: EXAMPLES OF THE TWO PHASE IMMISCIBLE AQUEOUS SOLUTIONS
dextran sodiumsulphate / polyethylene glycol dextran sodiumsulphate / polyvinylalcohol poliglykin / polyvinylpyrrolidon dextran sodiumsulphate / methylcellulose poliglykin / polyvinylalcohol poliglykin / polyethylene glycol poliglykin /methylcellulose poliglykin / ficoll poliglykin /chitosan
Слайд 226: CONCENTRATING OF INSULIN INSIDE DROPLETS
M w depended distribution between two phases system used dextran/PEG K distrib. =4.4 attract insulin into discrete phase in form of a polyelectrolyt complex system used DSS/PVA K distrib. =124.3 push OUT insulin from continuous phase - it is insoluble in the polycation solutions system used dextran/chitosan K distrib. =11.9
Слайд 227: Conditioning of polymerization of the monomer in the interphase layer
INHIBIT POLYMERIZATION IN THE BULK 1. Cyanoacrylate monomer instantly polymerizes in the presence of moisture (even traces) 2. Acidic inhibitors retarding polymerization were developed. Depending on the monomer, polymerization can be retarded up to 8 hours INITIATION OF POLYMERIZATION IN THE INTERPHASE 1. Some nucleophiles initiate polymerization even in the presence of acidic inhibitors (e.g. ternary amines) 2. Process of polymerization initiated by surface active nucleophiles take plase in the interphase layer 3. Monomer is concentrated in the interphase layer of two phase immiscible aqueous system, and is polymerized forming insoluble polymer shell
Слайд 229: NOVEL SURFACE ACTIVE CYANOACRYLIC MONOMERS
CH 2 =C-COO-CH 2 - (CH 2 ) 14 -CH 3 CH 2 =C-COO-CH 2 CH 2 O-(CH 2 CH 2 O) 9 CN CN CH 3 CH 3 CH 3 H 3 C H 3 C CH 3 -(CH 2 ) 14 -CH 2 -O-CH 2 -CH-COOH CH 3 -(CH 2 ) 14 -CH 2 -O-CH 2 -CH-COO-C 2 H 5 CH 3 -(CH 2 ) 14 -CH 2 -O-CH 2 -CH-COO -CH 2 - (CH 2 ) 14 -CH 3 CN CN CN CYANOACRYLIC MONOMER PRECURSORS
Слайд 230
100 200 300 400 500 10 20 30 40 50 60 Surface Pressure / mNm -1 Area / cm 2 CH 3 (CH 2 )14CH2O-CH2-CH-COOH (8x10 -5 mol/L) CN
Слайд 231
100 200 300 400 500 Area / cm 2 Surface Pressure / mNm -1 CH 3 (CH 2 ) 14 CH 2 O-CH 2 -CH-COOC 2 H 5 (6x10 -5 mol/L) 10 20 30 40 50 60 70 CN
Слайд 232
100 200 300 400 500 Area / cm 2 Surface Pressure / mNm -1 10 20 30 40 50 60 70 CH 3 (CH 2 ) 14 CH 2 O CH 2 -CH-COOCH 2 (CH 2 ) 14 CH 3 (8x10 -5 mol/L) CN