Слайд 2: Биохимия – это наука
изучающая химический состав и структуру веществ, содержащихся в живых организмах, пути и способы регуляции их метаболизма, а также энергетическое обеспечение процессов, происходящих в клетке и организме
Слайд 3: Задачи изучения дисциплины:
получить знания об основных классах биомолекул, их свойствах и функциях иметь понятие об основных путях метаболизма биомолекул, а также способах регуляции процессов жизнедеятельности в организме познакомиться с основными биохимическими методами исследований, приборами и аппаратами, их роли в общебиологических исследованиях
Слайд 4: Аминокислоты
Аминокислоты – это строительные блоки макромолекул белков. По строению они являются органическими карбоновыми кислотами В аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа (NH2), асимметричный атом углерода и боковая цепь (радикал R). Именно строением боковой цепи аминокислоты и отличаются друг от друга.
Они нужны для образования нейромедиаторов в ЦНС ( гистамин, серотонин, гамма-аминомасляная кислота, дофамин, норадреналин ) некоторые сами являются нейромедиаторами ( глицин, глутаминовая кислота ). есть группы аминокислот, которые необходимы для синтеза п уриновых и пиримидиновых оснований без которых нет нуклеиновых кислот а/к используются для синтеза низкомолекулярных биологически важных соединений (н.р карнитин)
Слайд 6: Значение АК для организма
Аминокислота тирозин целиком входит в состав гормонов щитовидной железы и мозгового вещества надпочечников С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма ( цистиноз, гомоцистеинемия, лейциноз, тирозинемии и др) Самым известным примером является фенилке- тонурия.
Слайд 7: Аминокислоты используются в качестве лекарств
Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты В реакциях биосинтеза белка метионин является инициирующей аминокислотой Он участвует в процессах обезвреживания токсинов в печени Метионин и его активные производные (как вещество "адеметионин" в составе препарата " Гептрал ") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов
Слайд 8: Аминокислоты используются в качестве лекарств
Глутаминовая кислота – является предшественником гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы Сам глутамат также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот, что активно используется в спортивной медицине Потребность организма в глутаминовой кислоте намного выше потребности в остальных аминокислотах
Слайд 9: Аминокислоты используются в качестве лекарств
Глицин является медиатором ЦНС тормозного действия Улучшает метаболизм в тканях мозга Оказывает успокаивающее действие Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния Цистеин участвует в метаболизме хрусталика глаза Цистеин часто применяют на начальных стадиях развития катаракты
Слайд 10: Аминокислоты используются в качестве лекарств
Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п. Препараты для парентерального питания : полиамид (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого
Слайд 11: Классификация аминокислот
В зависимости от положения аминогруппы по отношению к С2 (α-углеродный атом) на α-аминокислоты, β-аминокислоты и др. По абсолютной конфигурации молекулы на L- и D-стереоизомеры По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH2-группы По кислотно-основным свойствам – нейтральные, кислые, основные По необходимости для организма – заменимые и незаменимые
Слайд 12: Аминокислоты (по участию в синтезе белка)
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков ( протеиногенные аминокислоты ) Все протеиногенные аминокислоты являются α-аминокислотами Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот Названия аминокислот обычно сокращаются до 3-х буквенного обозначения В профессионалной молекулярной биологии также используются однобуквенные символы для каждой аминокислоты
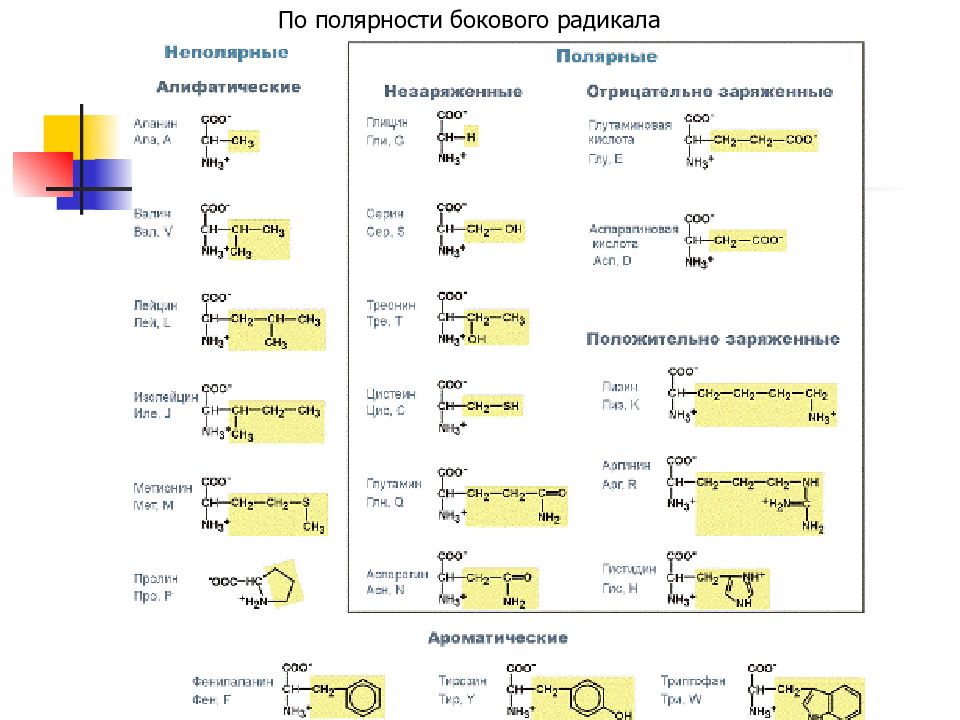
Слайд 13: По строению бокового радикала
Выделяют: алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин), ароматические (фенилаланин, тирозин, триптофан), серусодержащие (цистеин, метионин), содержащие ОН-группу (серин, треонин, опять тирозин), содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты) дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
Слайд 15: По кислотно-основным свойствам
Подразделяют: нейтральные (большинство) кислые (аспарагиновая и глутаминовая кислоты) основные (лизин, аргинин, гистидин) аминокислоты.
Слайд 16: По необходимости для организма
Выделяют Незаменимые аминокислоты, которые не синтезируются в организме и должны поступать с пищей: лейцин, изолейцин валин, фенилаланин триптофан, треонин лизин, метионин К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты (аланин, пролин, тирозин, глицин, серин, цистин, глютамин, аспарагин, глютаминоваяк-та, аспарагиновая к-та ). две аминокислоты являются условно незаменимыми ( аргинин, гистидин ), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей
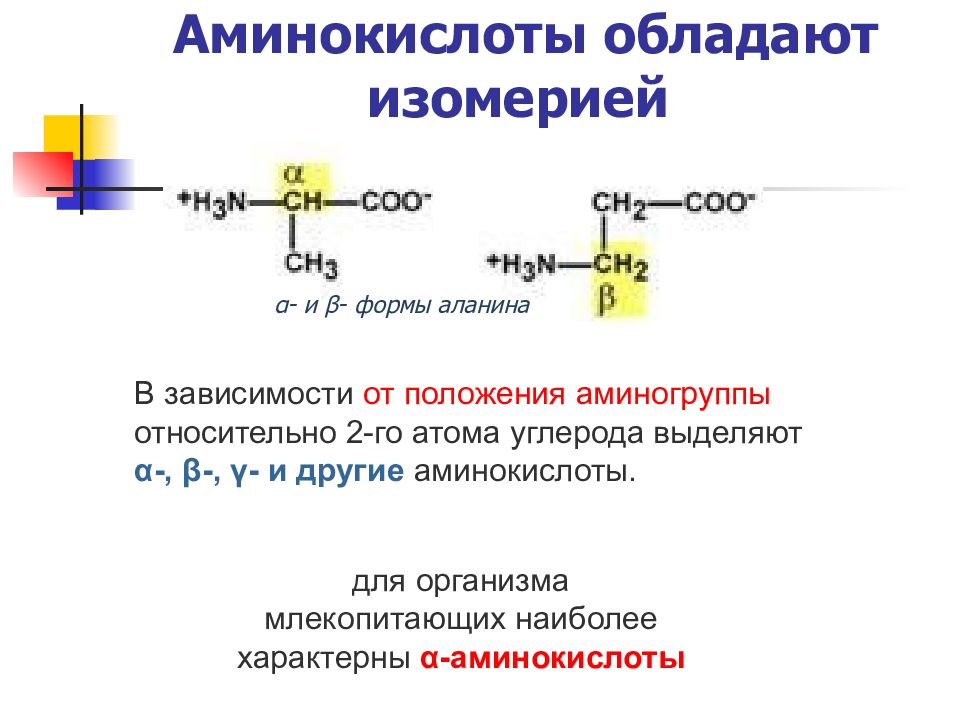
Слайд 17: Аминокислоты обладают изомерией
В зависимости от положения аминогруппы относительно 2-го атома углерода выделяют α-, β-, γ- и другие аминокислоты. для организма млекопитающих наиболее характерны α-аминокислоты α- и β- формы аланина
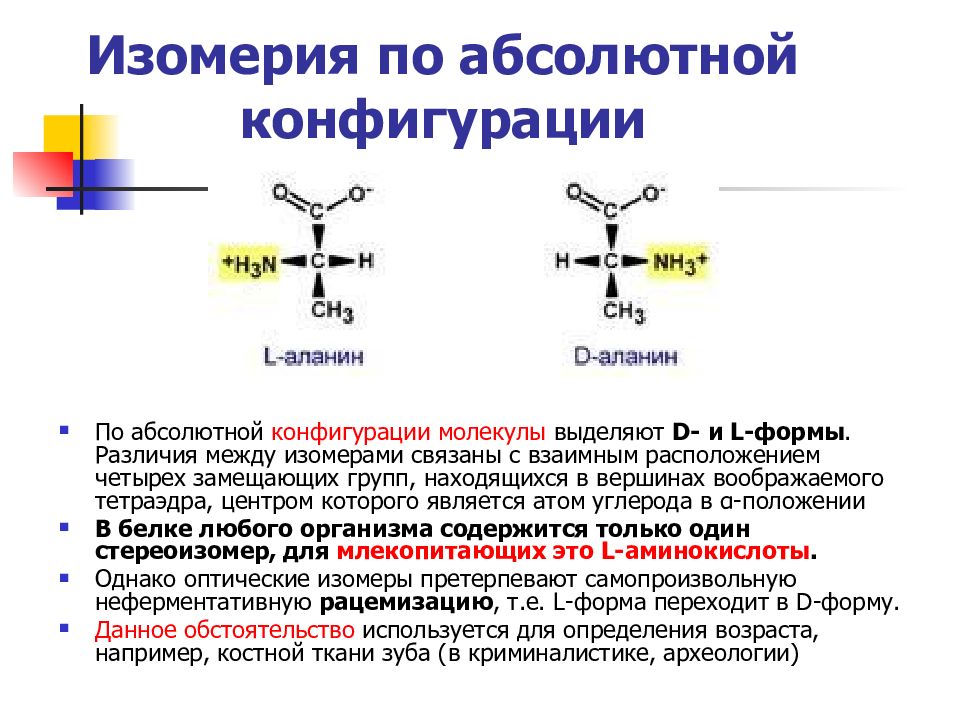
Слайд 18: Изомерия по абсолютной конфигурации
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α-положении В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму. Данное обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии)
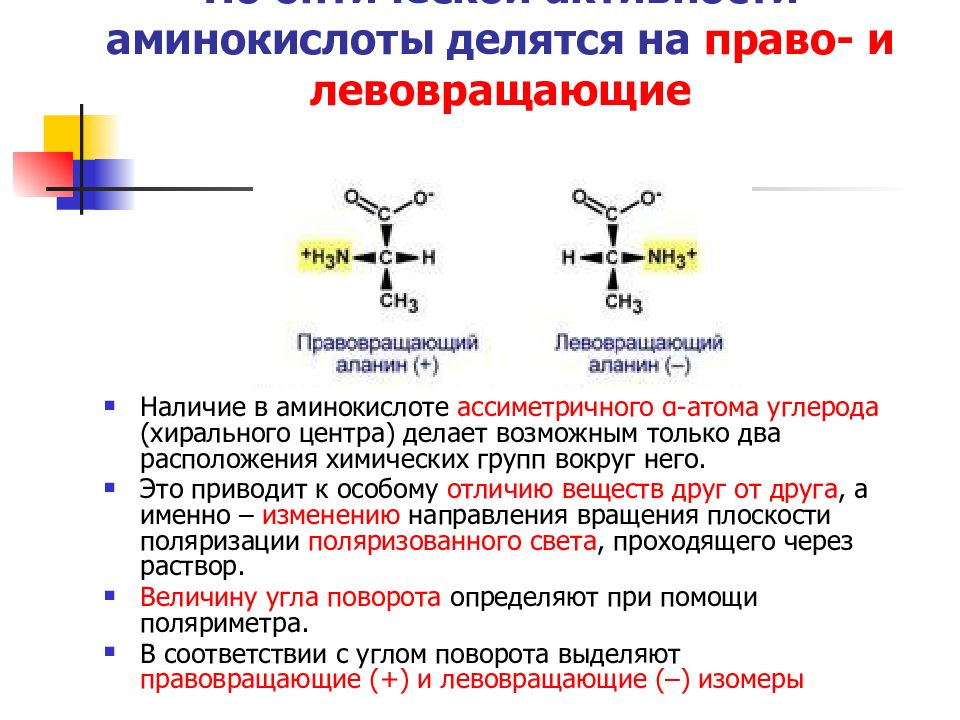
Слайд 19: По оптической активности аминокислоты делятся на право- и левовращающие
Наличие в аминокислоте ассиметричного α-атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры
Слайд 20: Основным физико-химическим свойством аминокислот является амфотерность
Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин)
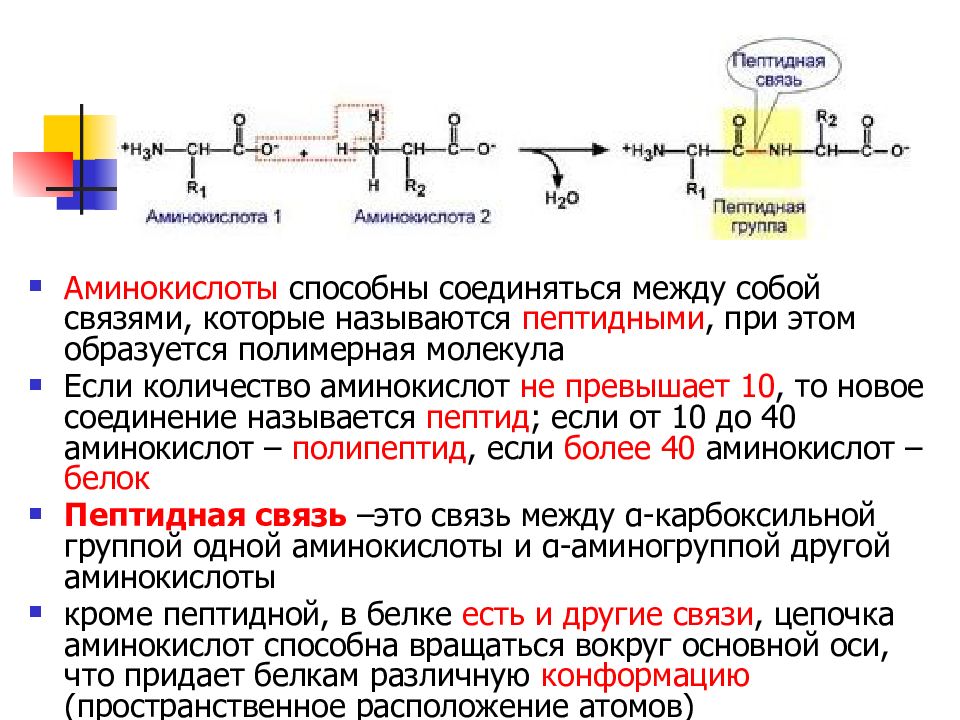
Слайд 21
Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула Если количество аминокислот не превышает 10, то новое соединение называется пептид ; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов)
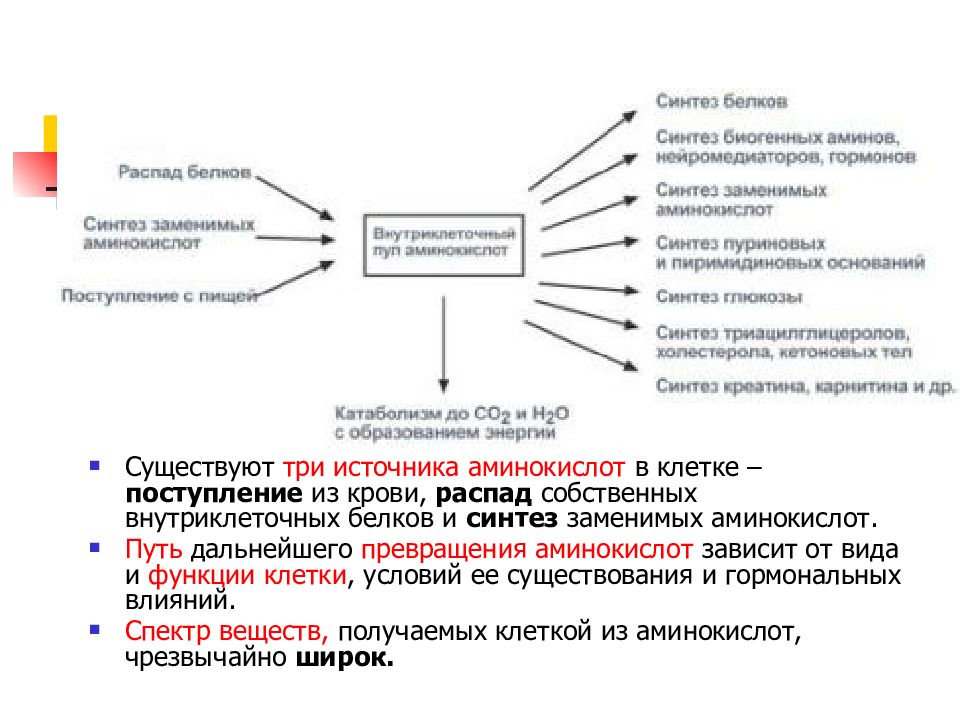
Слайд 22: метаболизм аминокислот
Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Слайд 23: Транспорт аминокислот через мембраны
Перенос аминокислот через мембраны клеток, как при всасывании из полости кишечника в энтероциты, так и при переходе из крови в клетки различных тканей, осуществляется при помощи двух механизмов: 1.вторичный активный транспорт 2.глутатионовая транспортная система
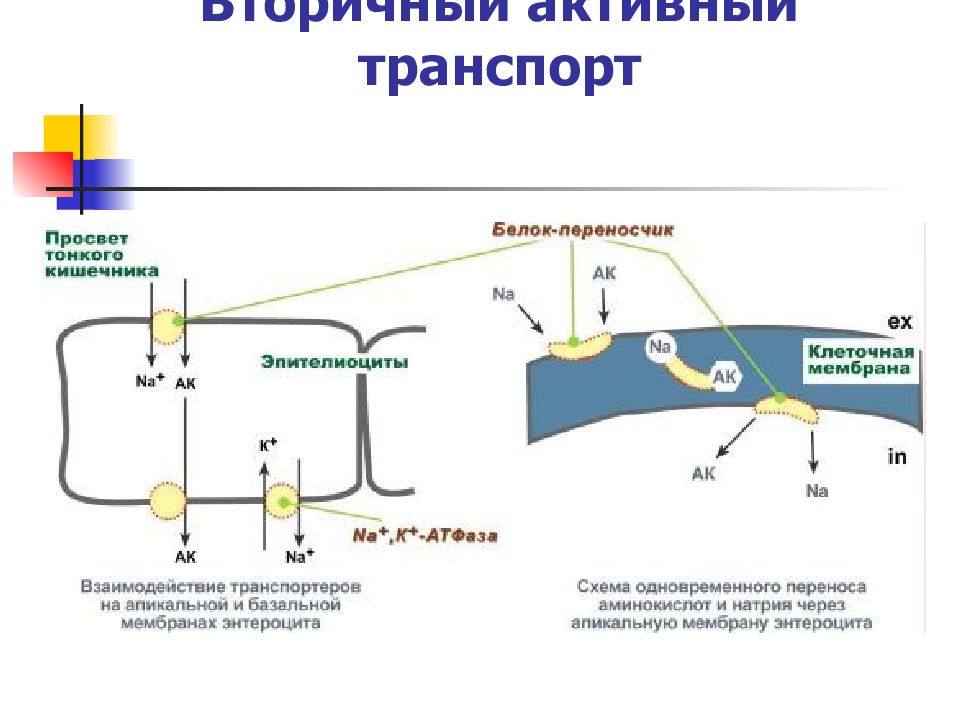
Слайд 24: Вторичный активный транспорт
– это перенос веществ, в данном случае аминокислот, с использованием градиента концентрации натрия между внутренней и наружной сторонами клеточной мембраны. Вторичный активный транспорт основан на использовании низкой концентрации ионов натрия внутри клеток, создаваемой мембранным ферментом Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Важно то, что в отсутствие натрия аминокислота не в состоянии связаться с белком-переносчиком. Затем, изменив свое положение в мембране, белок отдает ион натрия в цитозоль по градиенту концентрации. Сразу после этого аминокислота теряет связь с белком и остается в цитоплазме.
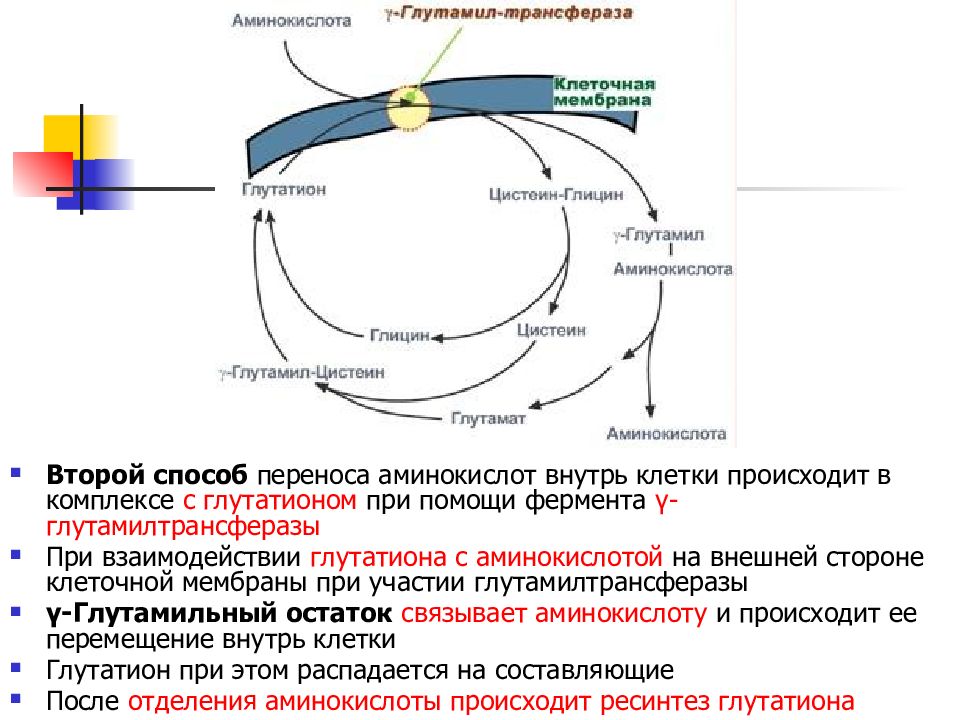
Слайд 26
Второй способ переноса аминокислот внутрь клетки происходит в комплексе с глутатионом при помощи фермента γ-глутамилтрансферазы При взаимодействии глутатиона с аминокислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы γ-Глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки Глутатион при этом распадается на составляющие После отделения аминокислоты происходит ресинтез глутатиона
Слайд 27
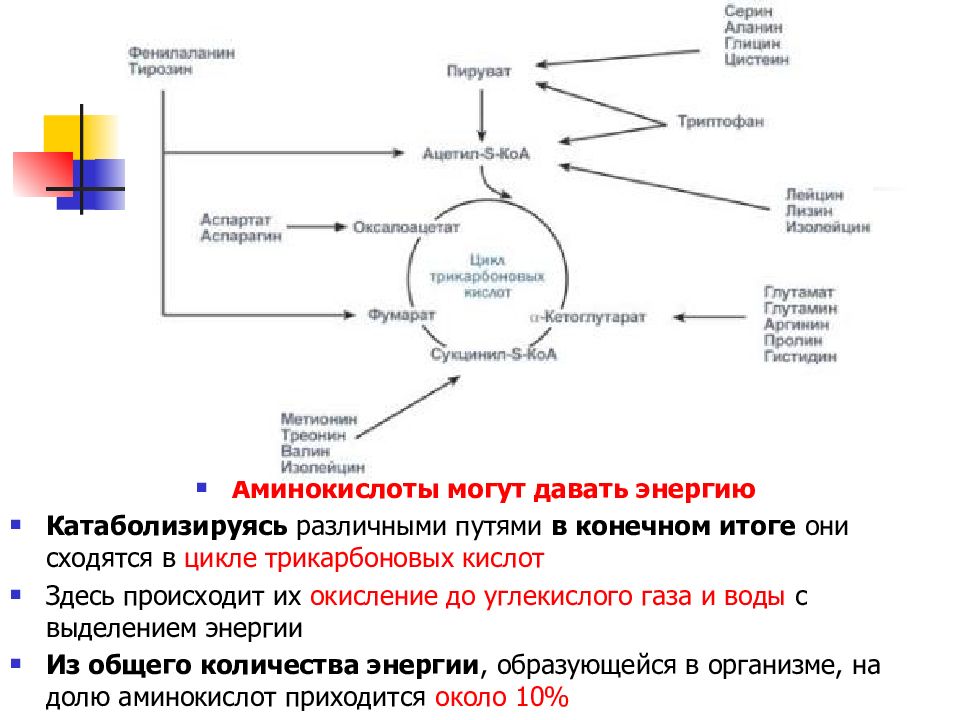
Аминокислоты могут давать энергию Катаболизируясь различными путями в конечном итоге они сходятся в цикле трикарбоновых кислот Здесь происходит их окисление до углекислого газа и воды с выделением энергии Из общего количества энергии, образующейся в организме, на долю аминокислот приходится около 10%
Слайд 28: Другие превращения АК
При определенных условиях углеродный скелет аминокислот не распадается, а участвует в синтезе углеводов ( глюкогенные аминокислоты ) и липидов ( кетогенные аминокислоты ). К глюкогенным относятся аминокислоты (их большинство), при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат. Строго кетогенными являются лизин и лейцин, при их окислении образуется исключительно ацетил-S-КоА. Он принимает участие в синтезе кетоновых тел, жирных кислот и холестерола. Также выделяют небольшую группу смешанных аминокислот, из них образуется пируват, метаболиты ЦТК и ацетил-S-КоА ( фенилаланин, тирозин, изолейцин, триптофан ).
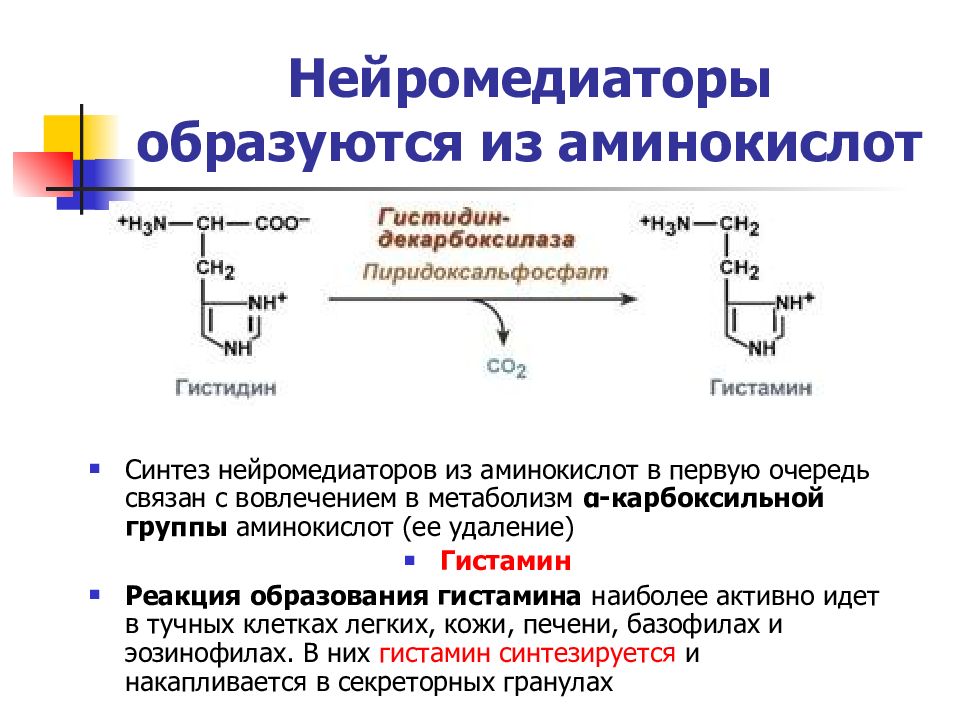
Слайд 29: Нейромедиаторы образуются из аминокислот
Синтез нейромедиаторов из аминокислот в первую очередь связан с вовлечением в метаболизм α-карбоксильной группы аминокислот (ее удаление) Гистамин Реакция образования гистамина наиболее активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах
Слайд 30: Физиологические эффекты гистамина
расширение артериол и капилляров и, как следствие, покраснение кожи, снижение артериального давления повышение проницаемости стенки капилляров и, как следствие, выход жидкости в межклеточное пространство ( отечность, повышение ВЧД ), снижение артериального давления увеличивает тонус гладких мышц бронхов, как следствие – спазм и удушье слабо повышает тонус мышц желудочно-кишечного тракта стимулирует секрецию слюны и желудочного сока
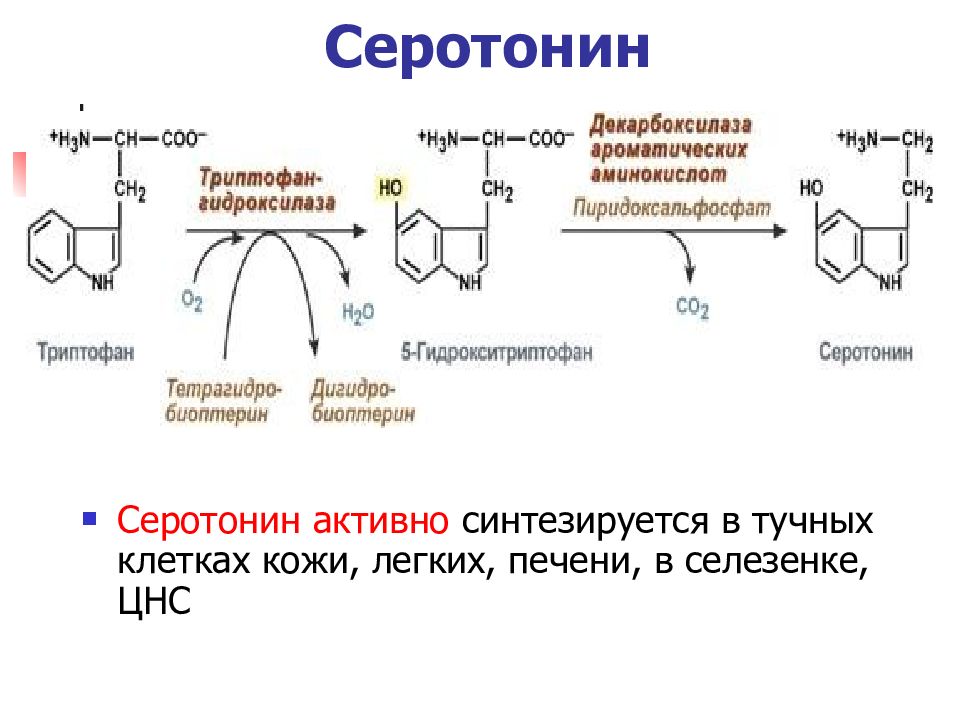
Слайд 31: Серотонин
Серотонин активно синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС
Слайд 32: Физиологические эффекты серотонина
стимулирует сокращение гладких мышц желудочно-кишечного тракта и, как следствие, повышение перистальтики ЖКТ выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов миокарда и скелетных мышц и, как следствие, повышение артериального давления слабо увеличивает тонус гладких мышц бронхов в центральной нервной системе является тормозным медиатором в периферических нервных окончаниях обуславливает возникновение боли и зуда (например, при укусе насекомых)
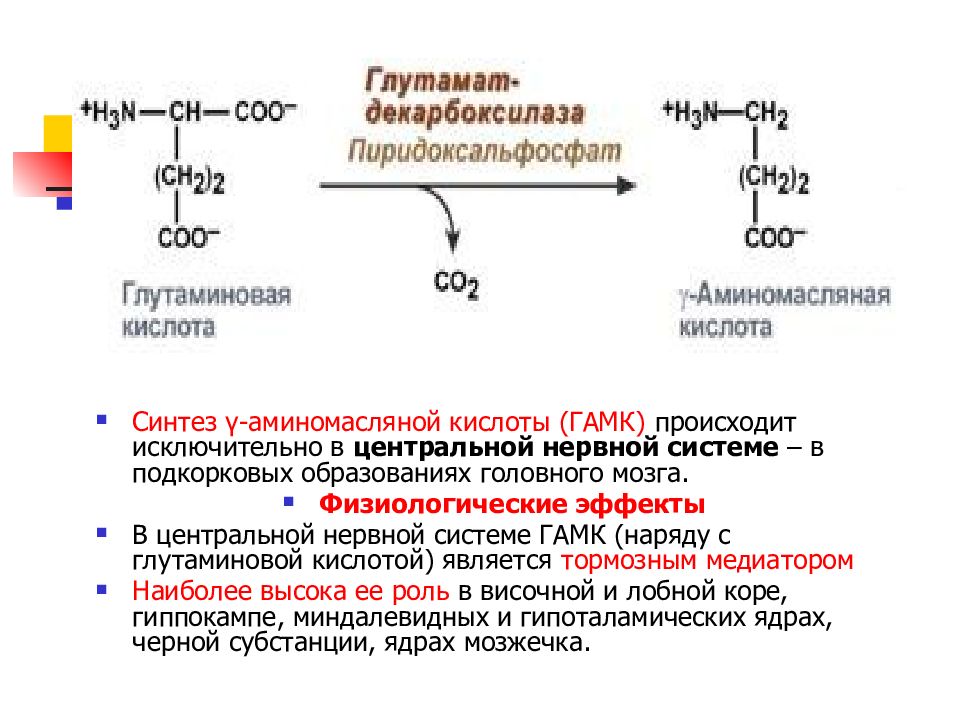
Слайд 33
Синтез γ-аминомасляной кислоты (ГАМК) происходит исключительно в центральной нервной системе – в подкорковых образованиях головного мозга. Физиологические эффекты В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка.
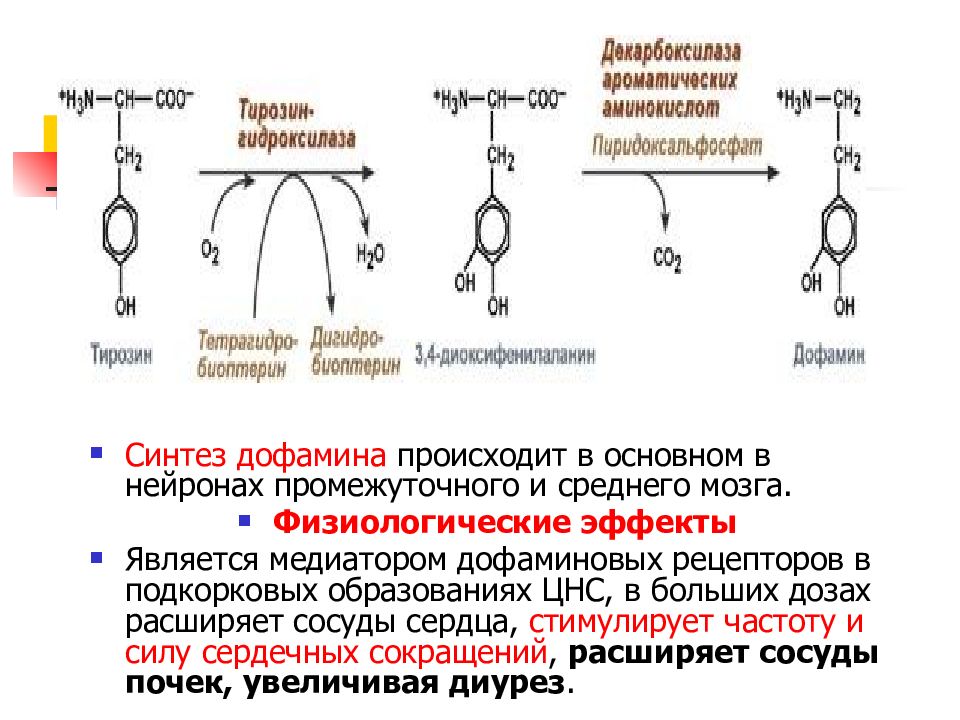
Слайд 34
Синтез дофамина происходит в основном в нейронах промежуточного и среднего мозга. Физиологические эффекты Является медиатором дофаминовых рецепторов в подкорковых образованиях ЦНС, в больших дозах расширяет сосуды сердца, стимулирует частоту и силу сердечных сокращений, расширяет сосуды почек, увеличивая диурез.
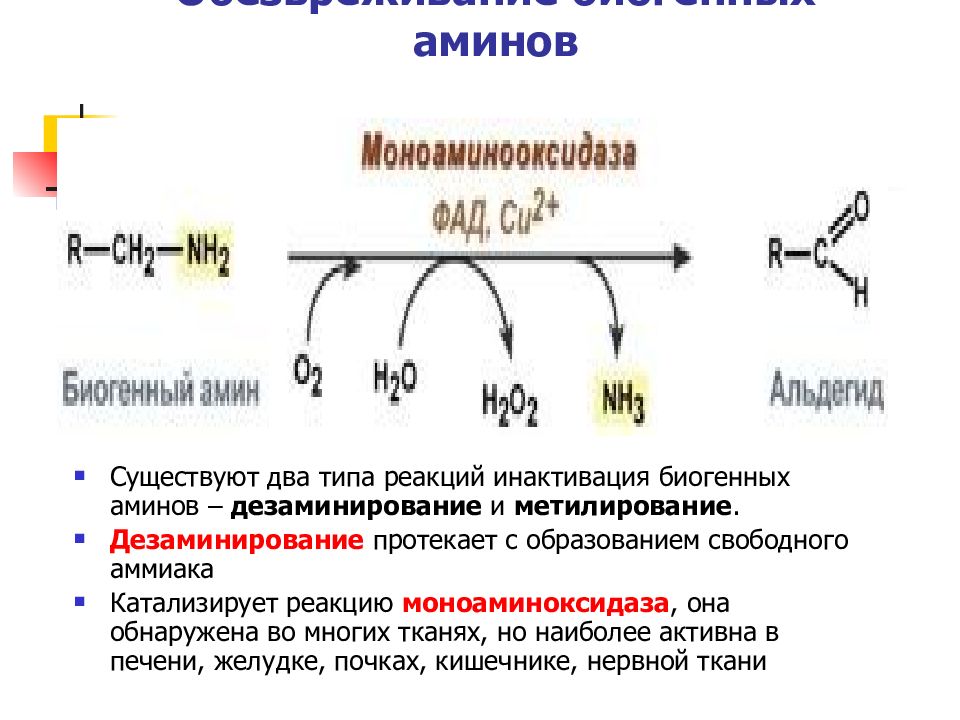
Слайд 35: Обезвреживание биогенных аминов
Существуют два типа реакций инактивация биогенных аминов – дезаминирование и метилирование. Дезаминирование протекает с образованием свободного аммиака Катализирует реакцию моноаминоксидаза, она обнаружена во многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной ткани
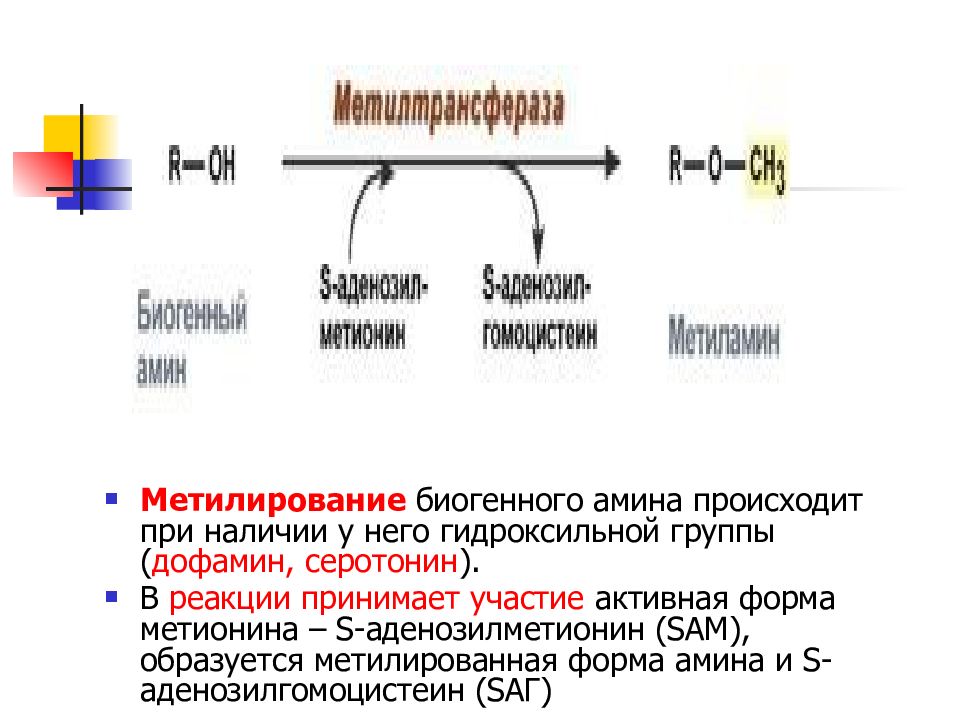
Слайд 36
Метилирование биогенного амина происходит при наличии у него гидроксильной группы ( дофамин, серотонин ). В реакции принимает участие активная форма метионина – S-аденозилметионин (SAM), образуется метилированная форма амина и S-аденозилгомоцистеин (SАГ)
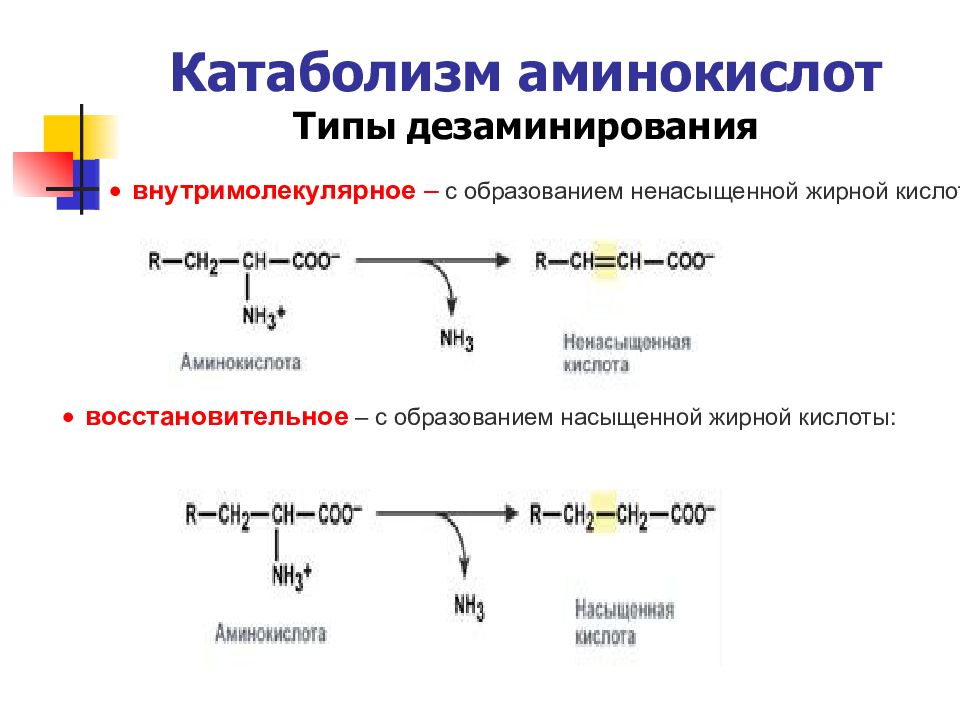
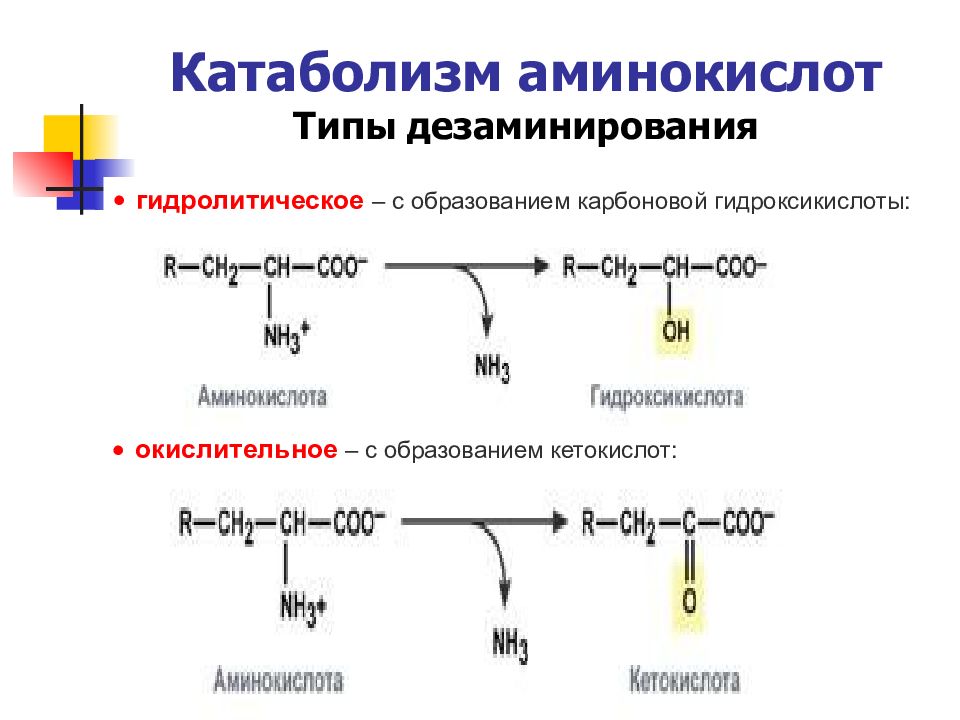
Слайд 37: Катаболизм аминокислот Типы дезаминирования
внутримолекулярное – с образованием ненасыщенной жирной кислоты: восстановительное – с образованием насыщенной жирной кислоты:
Слайд 38: Катаболизм аминокислот Типы дезаминирования
гидролитическое – с образованием карбоновой гидроксикислоты: окислительное – с образованием кетокислот:
Слайд 39: NB!
У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Однако такие аминокислоты как серин и гистидин могут терять аминогруппу с использованием других типов дезаминирования, треонин сразу подвергается прямому расщеплению до глицина и ацетальдегида
Слайд 40: В мышце дезаминирование аминокислот идет особым образом
Так как в скелетных мышцах нет глутаматдегидрогеназы и нет возможности производить прямое дезаминирование аминокислот, то для этого существует особый путь. В мышечных клетках при интенсивной работе, когда идет распад мышечных белков, активируется альтернативный способ дезаминирования аминокислот – цикл АМФ-ИМФ с образованием свободного аммиака. Процесс носит защитный характер, т.к. при мышечной работе выделяется молочная кислота. Аммиак, связывая ионы Н+, предотвращает закисление цитозоля миоцитов.
Слайд 41: В клетках постоянно образуется аммиак
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы. Основные источники аммиака Основными источниками аммиака являются следующие реакции: неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени, окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках, дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках, катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани, жизнедеятельность бактерий толстого кишечника, распад пуриновых и пиримидиновых оснований – во всех тканях.
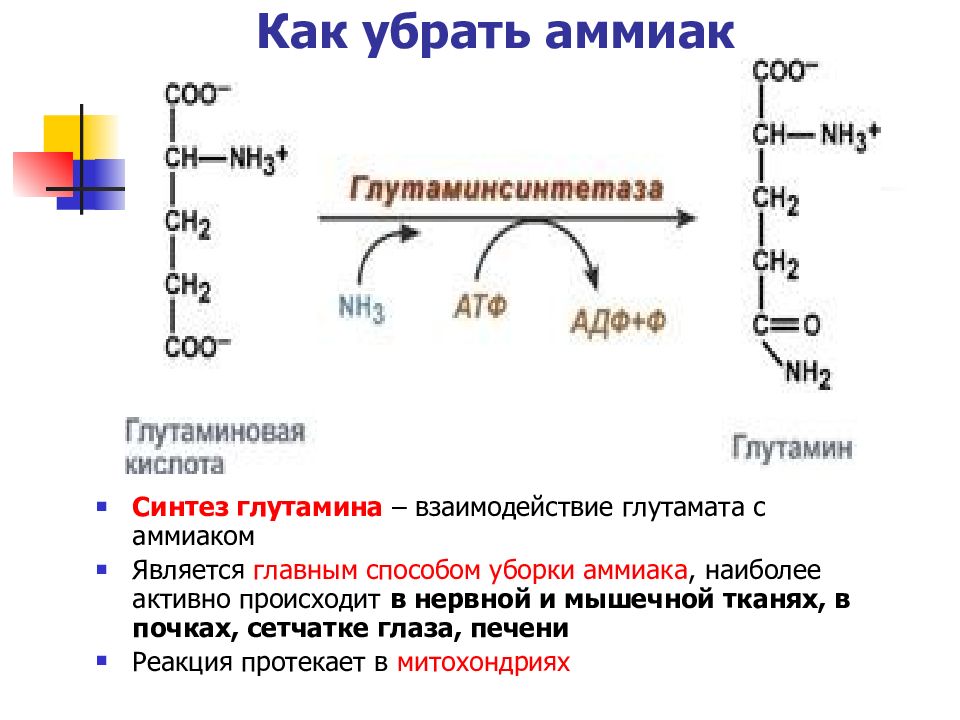
Слайд 42: Как убрать аммиак
Синтез глутамина – взаимодействие глутамата с аммиаком Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени Реакция протекает в митохондриях
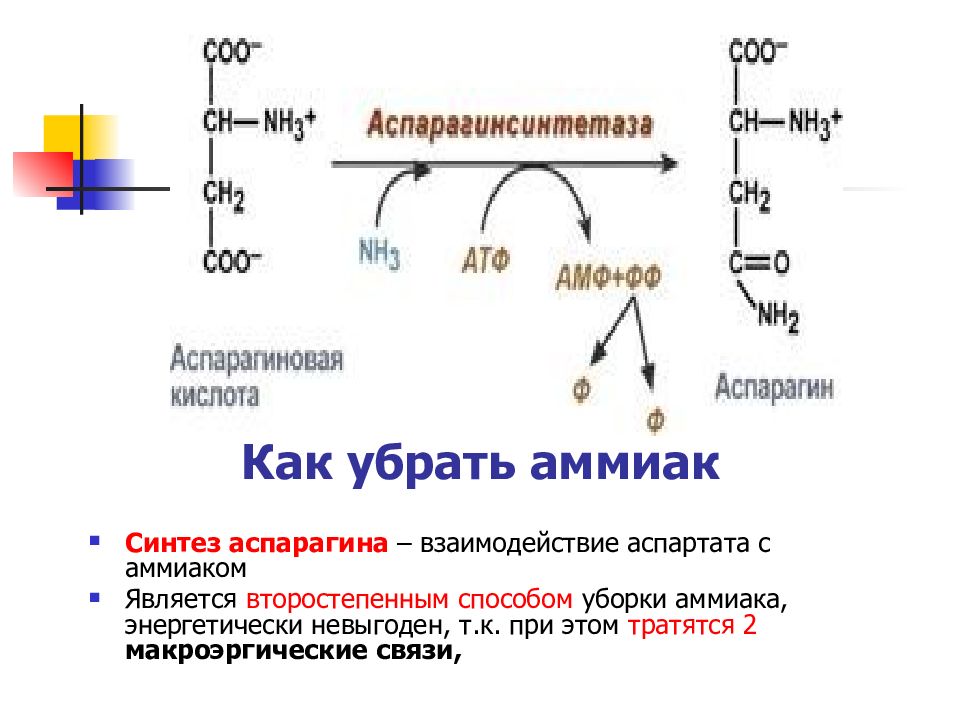
Слайд 43
Синтез аспарагина – взаимодействие аспартата с аммиаком Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи, Как убрать аммиак
Слайд 44: Транспорт аммиака
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аммиак от мышц и стенки кишечника. Целевыми органами для транспорта аммиака являются печень, почки и кишечник.
Слайд 45: Накопление аммиака представляет проблему
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака ( гипераммониемия ) до предельных величин может наступить кома и смерть При хронической гипераммониемии развивается умственная отсталость
Слайд 46: Как удалить аммиак из организма
Практически весь аммиак удаляется из организма через почки в виде мочевины, которая синтезируется в печени. Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей.
Слайд 47: Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма.
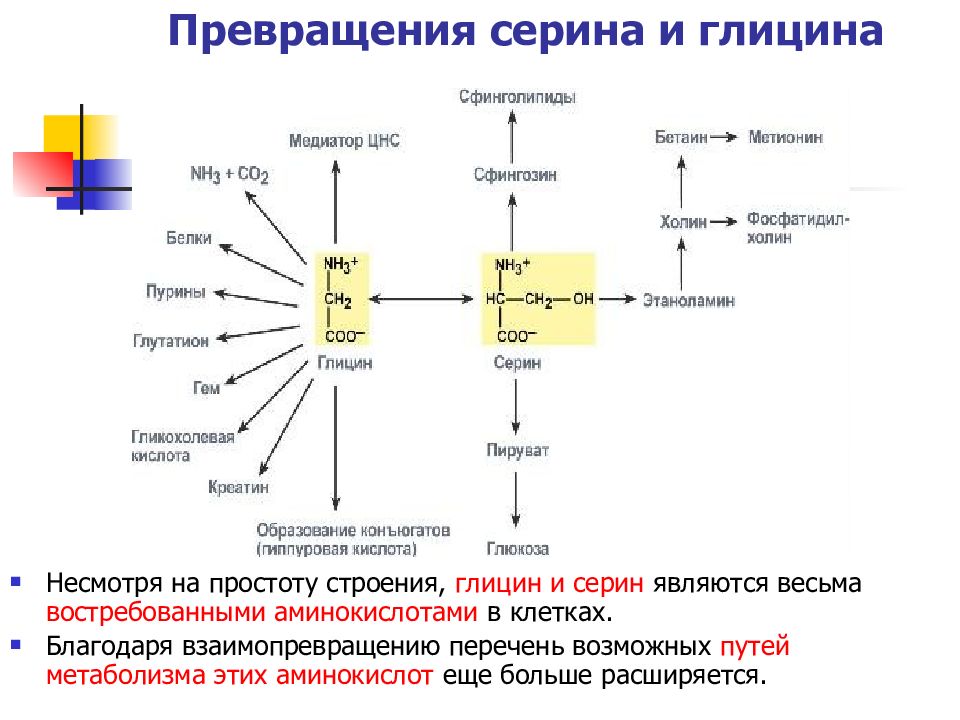
Слайд 48: Превращения серина и глицина
Несмотря на простоту строения, глицин и серин являются весьма востребованными аминокислотами в клетках. Благодаря взаимопревращению перечень возможных путей метаболизма этих аминокислот еще больше расширяется.
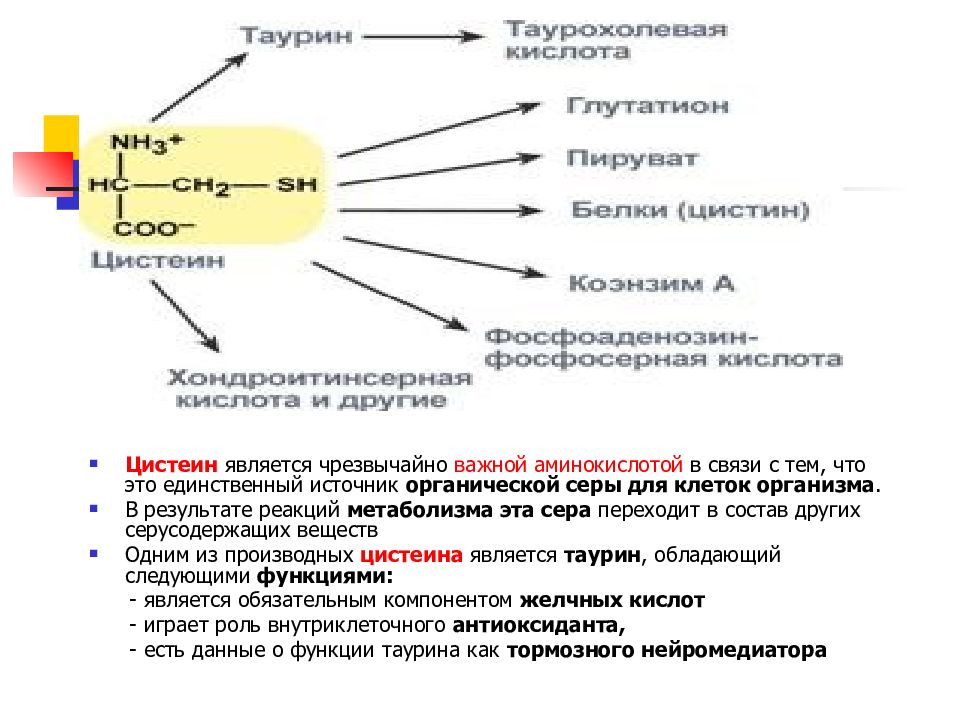
Слайд 49
Цистеин является чрезвычайно важной аминокислотой в связи с тем, что это единственный источник органической серы для клеток организма. В результате реакций метаболизма эта сера переходит в состав других серусодержащих веществ Одним из производных цистеина является таурин, обладающий следующими функциями: - является обязательным компонентом желчных кислот - играет роль внутриклеточного антиоксиданта, - есть данные о функции таурина как тормозного нейромедиатора
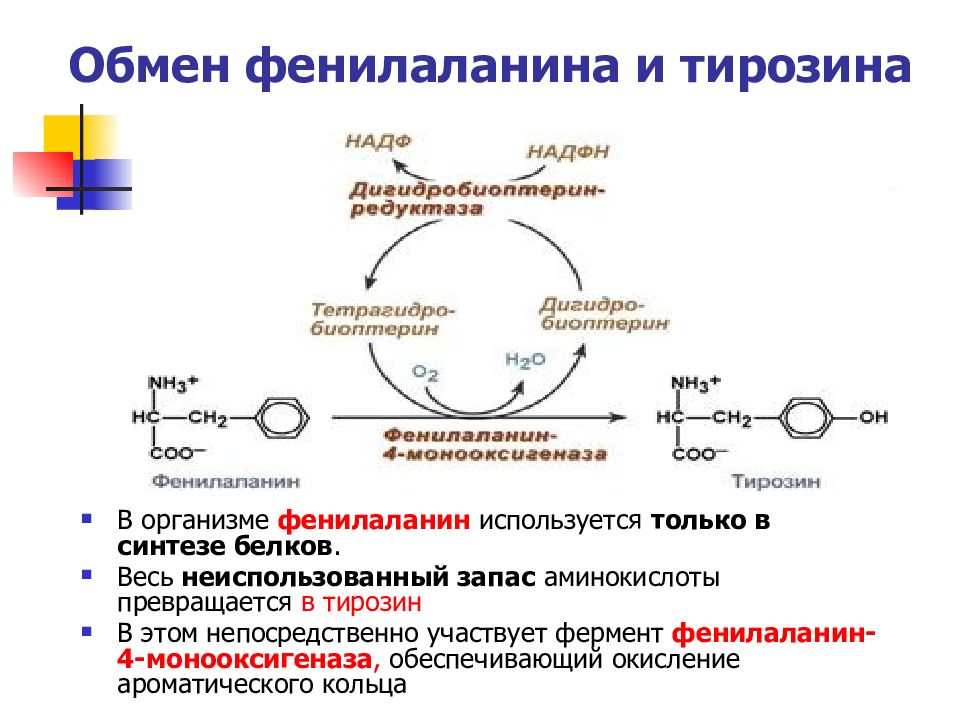
Слайд 50: Обмен фенилаланина и тирозина
В организме фенилаланин используется только в синтезе белков. Весь неиспользованный запас аминокислоты превращается в тирозин В этом непосредственно участвует фермент фенилаланин-4-монооксигеназа, обеспечивающий окисление ароматического кольца
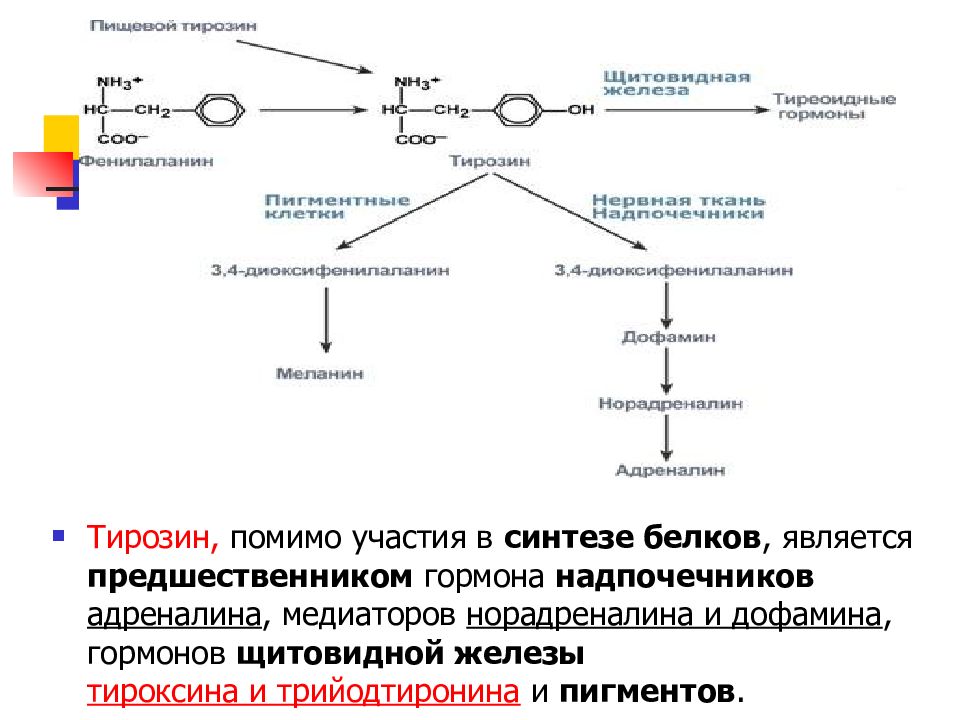
Слайд 51
Тирозин, помимо участия в синтезе белков, является предшественником гормона надпочечников адреналина, медиаторов норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигментов.
Слайд 53: Белки
Определение Ф.Энгельса "Жизнь есть способ существования белковых тел" до сих пор, по прошествии почти полутора веков, не потеряло своей правильности и актуальности. В основе структуры любого организма и всех протекающих в нем жизненных реакций лежат белки. Любые нарушения в этих белках приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций. Белки - высокомолекулярные, полимерные соединения, состоящие из аминокислот.
Слайд 54: Задание на 9 октября
Ферменты Кинетика ферментативных реакций Коферменты Витамины
Слайд 56: Функции белков
Структурная Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны. Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности), К данной функции можно отнести участие в создании органелл – рибосомы. Ферментативная Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью. Гормональная Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулин и глюкагон.
Слайд 57
Рецепторная Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны - Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки). Резервная В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Слайд 58
Сократительная Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл ( тубулин, актин, миозин ). Защитная Защитной функцией при инфекциях обладают иммуноглобулины крови, при повреждении тканей - белки свертывающей системы крови. Механическую защиту и поддержку клеток осуществляют протеогликаны.
Слайд 59: Как формируется молекула белка?
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями. Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид ; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
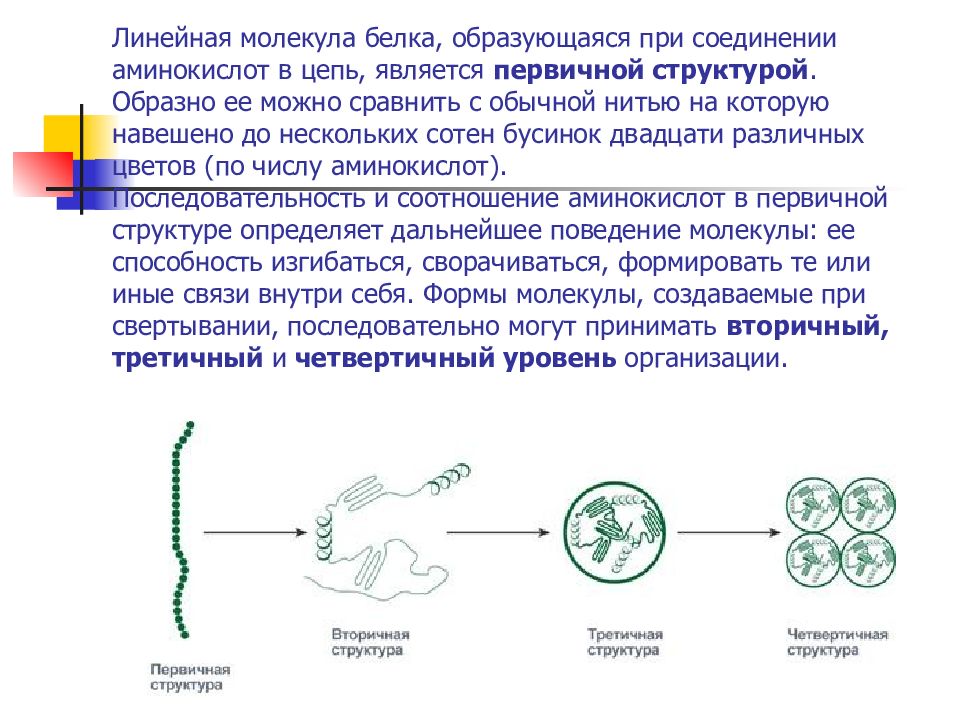
Слайд 60: Линейная молекула белка, образующаяся при соединении аминокислот в цепь, является первичной структурой. Образно ее можно сравнить с обычной нитью на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот). Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровень организации
Слайд 61
На уровне вторичной структуры белковые "бусы" способны укладываться в виде спирали (подобно дверной пружине) и в виде складчатого слоя, когда "бусы" уложены змейкой и удаленные части бус оказываются рядом. Укладка белка во вторичную структуру плавно переходит к формированию третичной структуры. Это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка. Некоторые белковые глобулы существуют и выполняют свою функцию
Слайд 62: Главное в белке - последовательность аминокислот
Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка. Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала) (пептидные связи выделены желтым цветом, аминокислоты - красной рамкой) Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
Слайд 63
Например, при серповидноклеточной анемии в шестом положении β-цепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S ( HbS ) – такого гемоглобина, который в дезоксиформе полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и при прохождении через капилляры разрушаются. Это в итоге приводит к снижению оксигенации тканей и их некрозу. Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.