Первый слайд презентации
Высокопроизводительные о mics - технологии, применяемые в системной биологии
Слайд 2
Omics -технологии – это оценка больших массивов данных о генах, белках или метаболитах биологического объекта путем обработки переменных средствами многомерной статистики, дисперсными регрессионными анализами, а так же программами распознавания образов.
Слайд 3
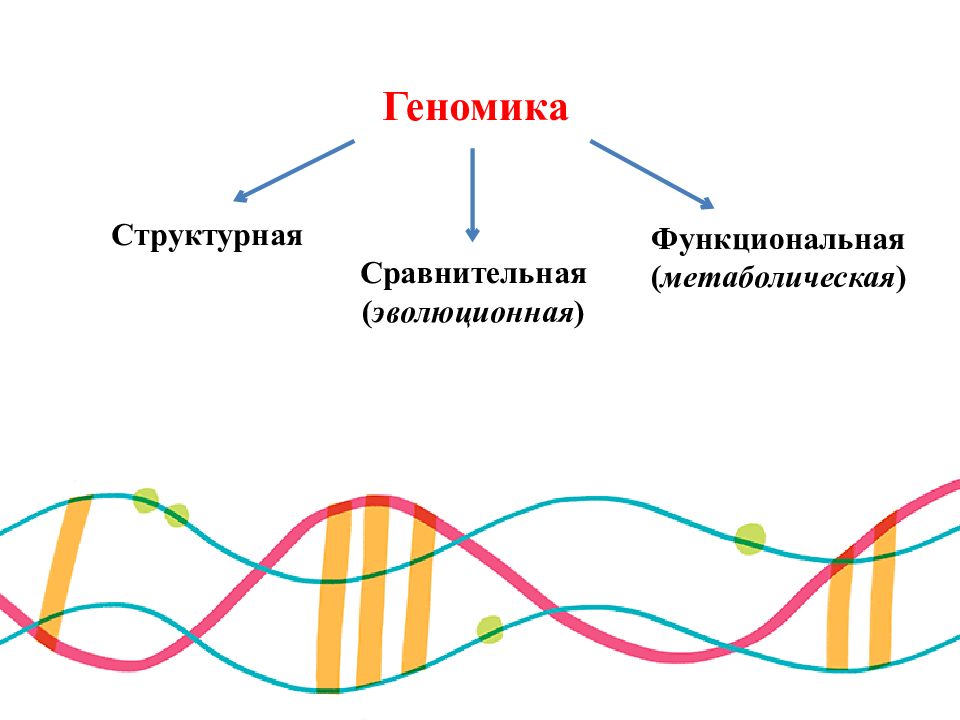
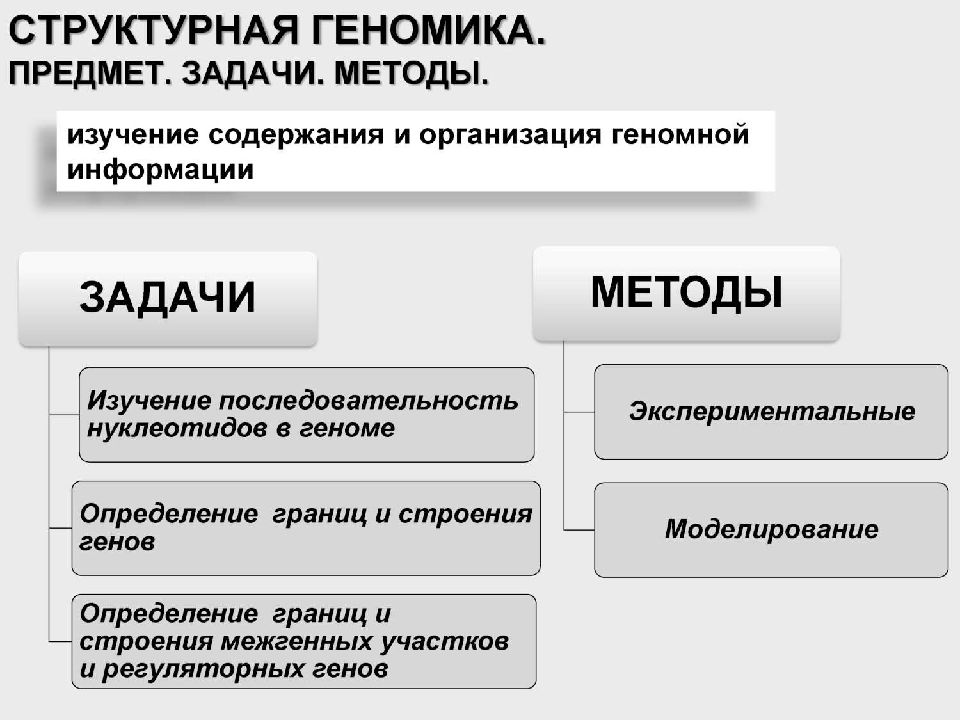
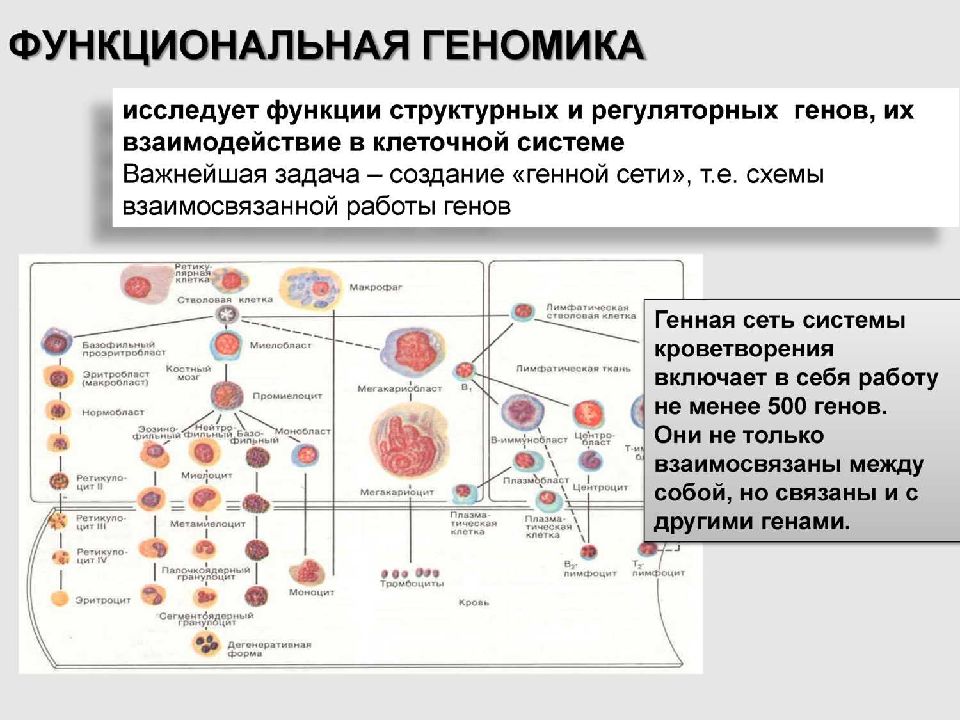
1 ГЕНОМИКА Это область молекулярной генетики, посвящённая исследованию генома и генов живых организмов. Цель геномики – получение информации обо всех потенциальных свойствах клетки, которые не реализуются на данный момент, например, «молчащие гены». Задача геномики – установление полной генетической характеристики всей клетки: количества содержащихся в ней генов, нуклеотидов и их последовательности, определение функций каждого гена по отношению к метаболизму организма или применительно к его жизнедеятельности.
Слайд 4
Геномика Структурная Сравнительная ( эволюционная ) Функциональная ( метаболическая )
Слайд 10
Это область геномики, исследующая, каким образом совокупность наследственной информации человека может влиять на эффект от принимаемых этим человеком лекарств. ФАРМАКОГЕНОМИКА Фармакогеномика связывает экспрессию конкретного гена или однонуклеотидного полиморфизма в геноме человека с эффективностью или токсичностью лекарства для того, чтобы разработать рациональные средства оптимизации фармакотерапии, и учитывает генотипы людей для обеспечения максимальной эффективности при минимальных побочных действиях (« персонифицированная медицина »).
Слайд 11
Это научное направление, изучающее геномы с точки зрения их реакции на разные стрессорные условия окружающей среды и токсины, роль генно-средовых взаимодействий в развитии разного рода заболеваний и дисфункций. ТОКСИКОГЕНОМИКА Цель токсикогеномики – найти корреляцию между реакциями на токсиканты и изменениями в генетических профилях объектов, подвергнутых воздействию таких токсикантов. Основным инструментом токсикогеномики является ДНК-чип, который используют для одновременного мониторинга уровня экспрессии сотен и тысяч генов.
Слайд 12
Изучает гены и некодирующие последовательности, необходимые для развития и функционирования головного мозга. КОГНИТИВНАЯ ГЕНОМИКА ( геном и сознание ) Сопоставляя геномы разных животных, можно определить, какие гены обеспечивают особенности нервной системы человека, его поведение и интеллектуальные способности. Эти подходы используются и для выявления генетических факторов развития болезней нервной системы (синдрома Дауна, болезни Альцгеймера и др.).
Слайд 13
ЭПИГЕНОМИКА / ЭПИГЕНЕТИКА Это область генетики, изучающая изменения экспрессии генов или фенотипа клетки, вызванных механизмами, не затрагивающими последовательности ДНК (например, метилирование ДНК и деацетилирование гистонов). Методы эпигенетических исследований: Иммунопреципитация хроматина (различные модификации ChIP-on-chip и ChIP-Seq ); гибридизация in situ ; чувствительные к метилированию рестриктазы, идентификации ДНК- аденинметилтрансферазы ( DamID ); бисульфитное секвенирование ; методы биоинформатики (компьютерная эпигенетика ).
Слайд 14
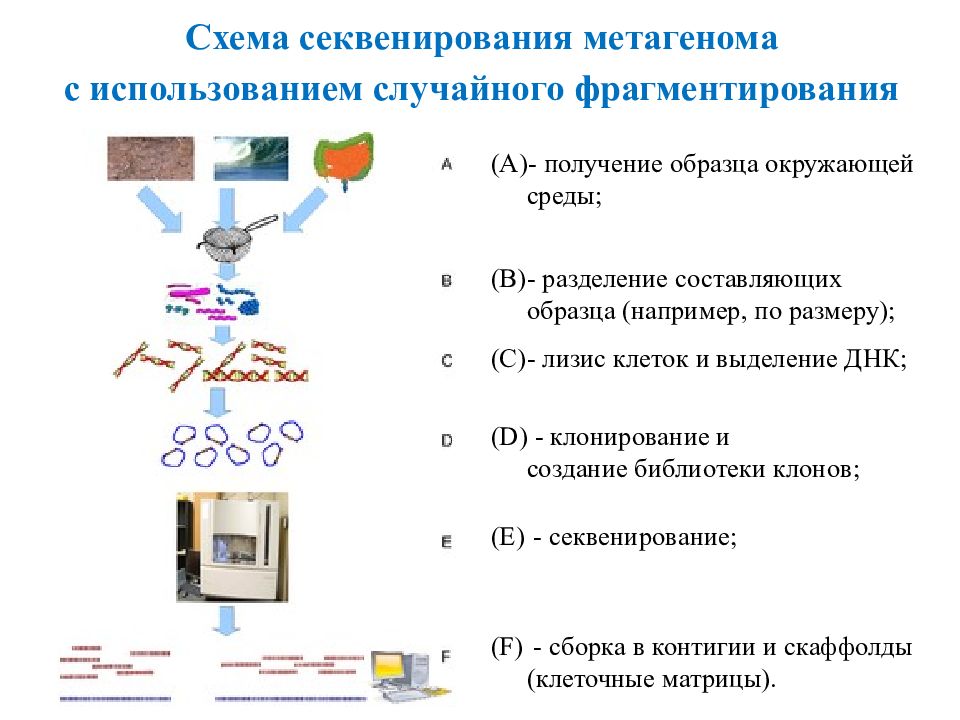
Это раздел молекулярной генетики, изучающий генетический материал всех микроорганизмов, находящихся в образце среды ( метагеном ). 2 МЕТАГЕНОМИКА Метагеномный анализ позволяет определить видовое разнообразие некультивируемых бактерий наравне с культивируемыми. Метагеномику применяют для решения практических проблем в медицине (проекты « Микробиом Человека» и « MetaHit »), инженерии, сельском хозяйстве и экологии. Расшифровка метагенома заключается в секвенировании нуклеотидных последовательностей в молекулах ДНК.
Слайд 15
- получение образца окружающей среды; - разделение составляющих образца (например, по размеру); - лизис клеток и выделение ДНК; - клонирование и создание библиотеки клонов; - секвенирование; - сборка в контигии и скаффолды (клеточные матрицы). Схема секвенирования метагенома с использованием случайного фрагментирования
Слайд 16
[от лат. transcriptio – переписывание] – это идентификация всех матричных РНК, кодирующих белки, определение количества каждой индивидуальной мРНК и закономерностей экспрессии всех генов, кодирующих белки. 3 ТРАНСКРИПТОМИКА
Слайд 17
Методы транскриптомики SAGE ( Serial analysis of gene expression ) - серийный анализ экспрессии генов; ESTs ( Expressed Sequence Tags ) - прочитанные фрагменты экспрессированных последовательностей; MPSS ( Massively Parallel Signature Sequencing ) - массовое одновременное секвенирование характерных фрагментов; метод ДНК- биочипов или ДНК- микроматриц ( DNA microarray, DNA biochip, oligonucleotide microarray, cDNA microarray ). Задача транскриптомики - выявление и изучение не зависящих от геномных сигналов факторов, влияющих на формирование структуры и динамики транскриптома, и, в конечном счете, протеома.
Слайд 18
« Серийный анализ экспрессии генов » ( SAGE ) — молекулярно-генетический метод, позволяющий одновременно количественно и качественно охарактеризовать экспрессию тысяч различных генов путем анализа их транскриптов. Два основных принципа лежат в основе SAGE : короткие нуклеотидные последовательности ДНК («ярлыки») (10-14 п.н.), достаточные для идентификации индивидуальных генных продуктов; связывание таких ярлыков друг с другом в одну последовательность, что многократно увеличивает эффективность идентифицирования экспрессированной мРНК в библиотеках.
Слайд 19
«Прочитанные фрагменты экспрессированных последовательностей» ( ESTs ) Это очень мощный метод для глобального компьютерного анализа структуры транскриптов, реконструкции структуры генов и измерения уровней экспрессии генов. ESTs – это короткие (обычно около 300-500 bp), прочитанные за один раз фрагменты кДНК. Они представляют собой «слепок», «отпечаток» с продуктов гена, проэкспрессированных в определенной ткани или на определенной стадии развития. Они являются метками (tags) экспрессии гена для определенной библиотеки кДНК.
Слайд 20
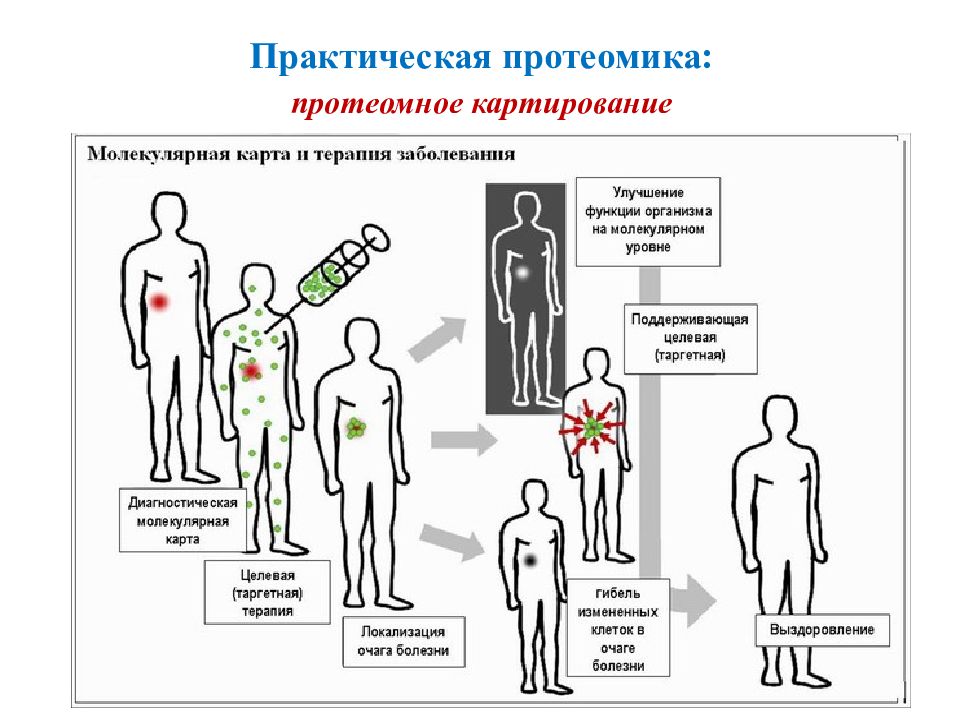
Это наука, изучающая белковый состав биологических объектов, а также структурно-функциональные свойства белковых молекул. 4 ПРОТЕОМИКА Задача протеомики – идентификация и количественное определение совокупных индивидуальных белков, которые содержатся в биологических образцах ( сыворотке крови, спинномозговой жидкости, моче, биоптатах ) на разных стадиях развития заболевания, а также на фоне проводимой терапии. Цель протеомики – установление и характеристика полного набора белков организма.
Слайд 22
Структурная протеомика Цель структурной протеомики – установление структуры всех белков живого организма. Задачи структурной протеомики : выделение и очистка белков протеома ; идентификация белков протеома ; определение первичной, вторичной, третичной структуры белков; исследование внутиримолекулярной динамики белков. Первая белковая структура - структура бактериородопсина, полученная на основе данных электронной микроскопии (1975 г.)
Слайд 23
Функциональная протеомика Цель функциональной протеомики - определение функциональных свойств протеома. Задачи функциональной протеомики : установление функций каждого из белков протеома ; предсказание функциональной роли отдельных белков путем сопоставления их качественного и количественного состава в клетке на разных стадиях и в разных состояниях ее развития; анализ межбелковых взаимодействий; выяснение взаимосвязи между структурой и функцией белков; изучение механизмов функционирования белков.
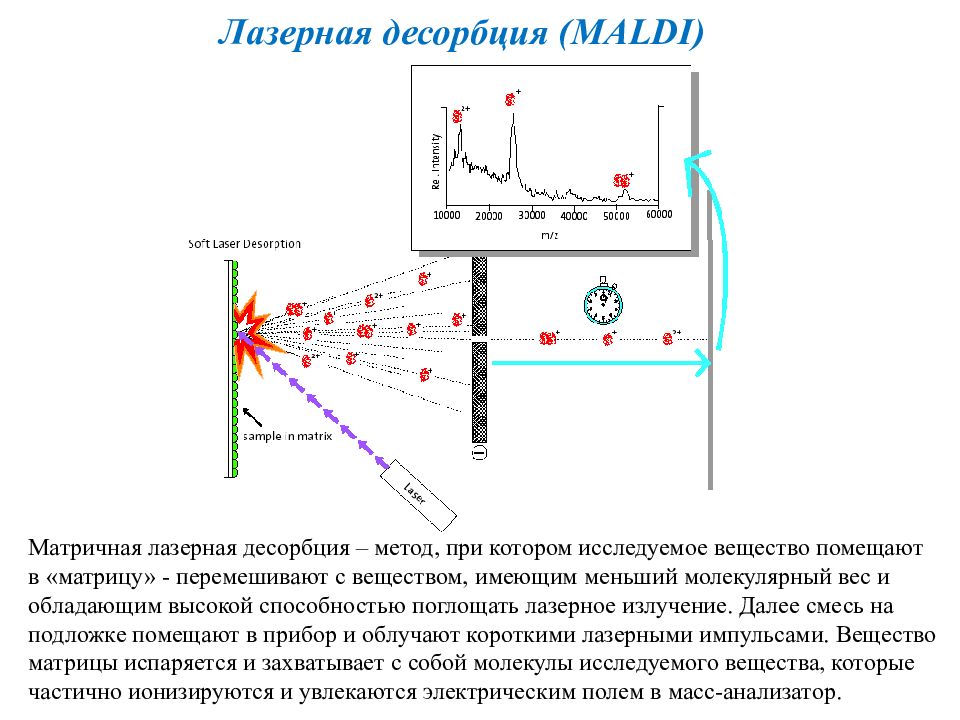
Слайд 27
Лазерная десорбция ( MALDI) Матричная лазерная десорбция – метод, при котором исследуемое вещество помещают в «матрицу» - перемешивают с веществом, имеющим меньший молекулярный вес и обладающим высокой способностью поглощать лазерное излучение. Далее смесь на подложке помещают в прибор и облучают короткими лазерными импульсами. Вещество матрицы испаряется и захватывает с собой молекулы исследуемого вещества, которые частично ионизируются и увлекаются электрическим полем в масс-анализатор.
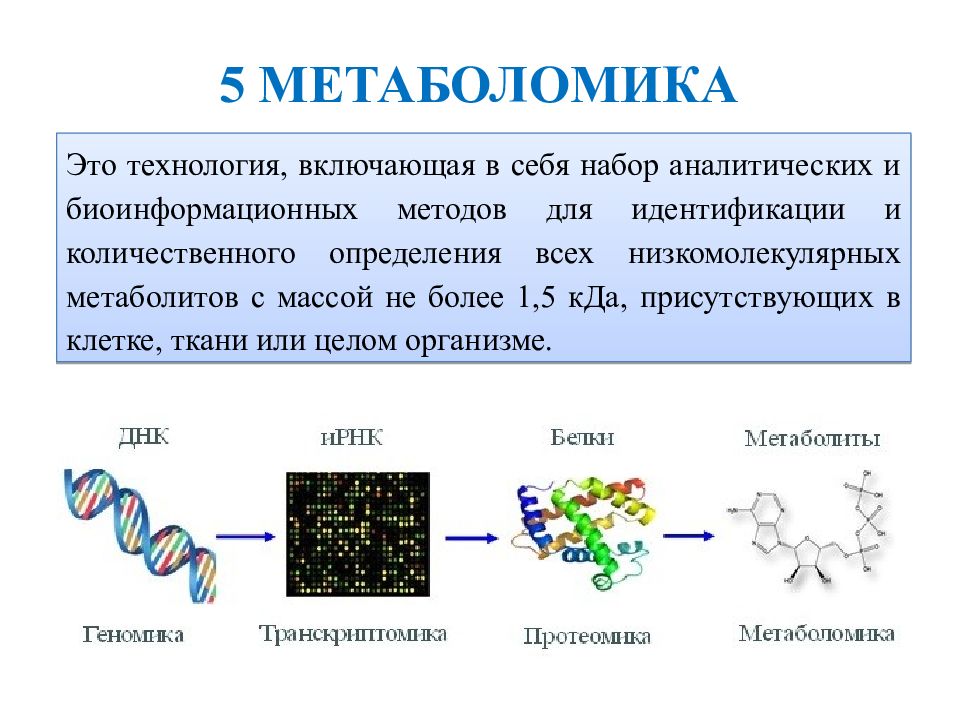
Слайд 29
Э то технология, включающая в себя набор аналитических и биоинформационных методов для идентификации и количественного определения всех низкомолекулярных метаболитов с массой не более 1,5 кДа, присутствующих в клетке, ткани или целом организме. 5 МЕТАБОЛОМИКА
Слайд 30
Это количественное измерение динамического многопараметрического метаболического ответа живых систем на патофизиологические воздействия или генные модификации. МЕТАБОНОМИКА Метабономика использует метаболические профили для получения информации об изменениях метаболизма, связанных с внешними факторами окружающей среды, патологическими процессами и негенетическими изменениями.
Слайд 31
Это раздел метаболомики, основанный на анализе влияния ксенобиотиков на изменения метаболических процессов в организме человека. На этой основе проводится молекулярная диагностика патологий, обусловленных ксенобиотиками. КСЕНОМЕТАБОЛОМИКА Ксенобиотики (греч. xenos - «чужой», bios - «жизнь») – это любые чуждые для организма химические вещества, вызывающие нарушения процессов жизнедеятельности ( тяжелые металлы, лекарственные средства, синтетические органические продукты бытовой и промышленной химии, синтетические полимерные материалы, нефтепродукты, пестициды, синтетические ПАВы ).
Слайд 32
Аналитические методы метаболомики / метабономики 1. Методы разделения: - газовая хроматография; - высокоэффективная жидкостная хроматография; - капиллярный электрофорез. 2. Методы обнаружения: - масс-спектрометрия; - ядерный магнитный резонанс. 3. Статистические методы.
Слайд 33
Это систематическое изучение всех гликановых структур клетки или организма ( более 16 млн. структурных единиц ). 6 ГЛИКОМИКА Гликаны — полисахариды или олигосахариды, полимеры, состоящие из моносахаридных звеньев, соединенных O- гликозидными связями. Задачи гликомики - высокоэффективное определение структуры углеводных цепей гликоконъюгатов и изучение функциональных свойств таких белков, как лектины и гликозилтрансферазы, с помощью углеводных зондов.
Слайд 34
Методы в гликомике Биоинформационные методы для анализа гликановых структур: 1) анализ гликозилирования ; 2) масс-спектральный анализ; 3) прогнозирование гликановых маркеров; 4) анализ гликановой структуры; 5) анализ экспрессии гликогенных генов; 6) создание гликановой структуры. Флуоресцентное мечение; Тонкослойная хроматография (ТСХ); Высокоэффективная жидкостная хроматография (ВЭЖХ); Ионообменная жидкостная хроматография; различные варианты электрофореза, включая капиллярный.
Слайд 35
Это наука о липидах, основанная на исследовании идентификации и количественном определении различных клеточных липидов, их взаимодействии с другими метаболитами. 7 ЛИПИДОМИКА Липиды (от др.-греч. λί πος - жир) - обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот, сложных - из спирта, высокомолекулярных жирных кислот и других компонентов. Содержатся во всех живых клетках.
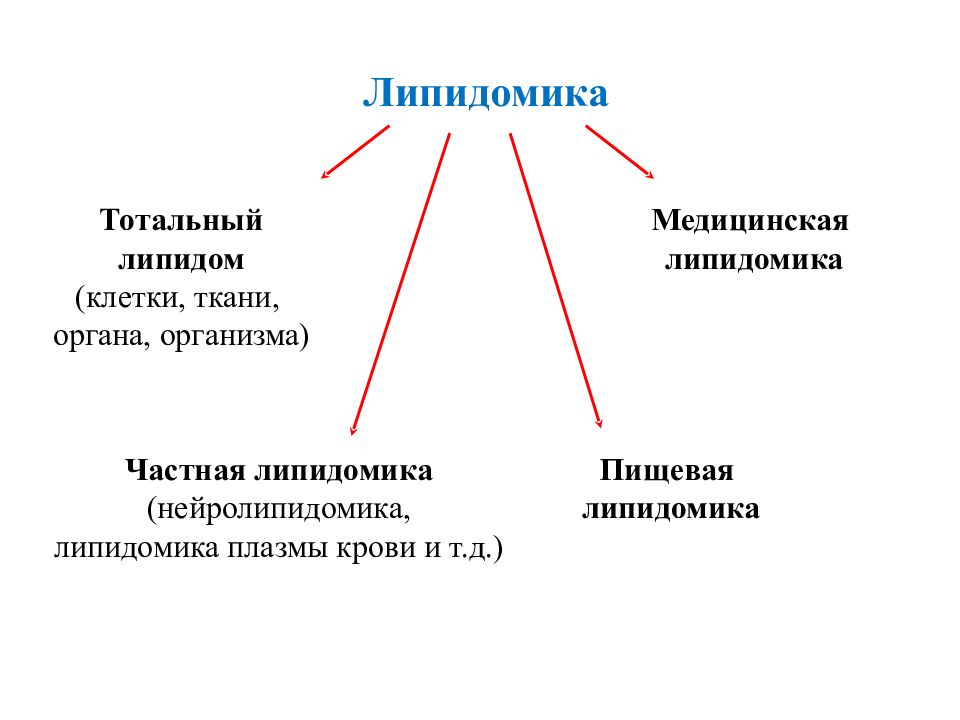
Слайд 36: Липидомика
Тотальный липидом (клетки, ткани, органа, организма) Частная липидомика (нейролипидомика, липидомика плазмы крови и т.д.) Пищевая липидомика Медицинская липидомика
Слайд 37
Методы, применяемые для анализа липидов - твердофазная экстракция; - тонкослойная хроматография (ТСХ); - ИК-спектроскопия (применяется для определения транс -изомеров); - газожидкостная хроматография (ГЖХ); - высокоэффективная жидкостная хроматография (ВЭЖХ); - масс-спектроскопия; - ЯМР-спектроскопия.
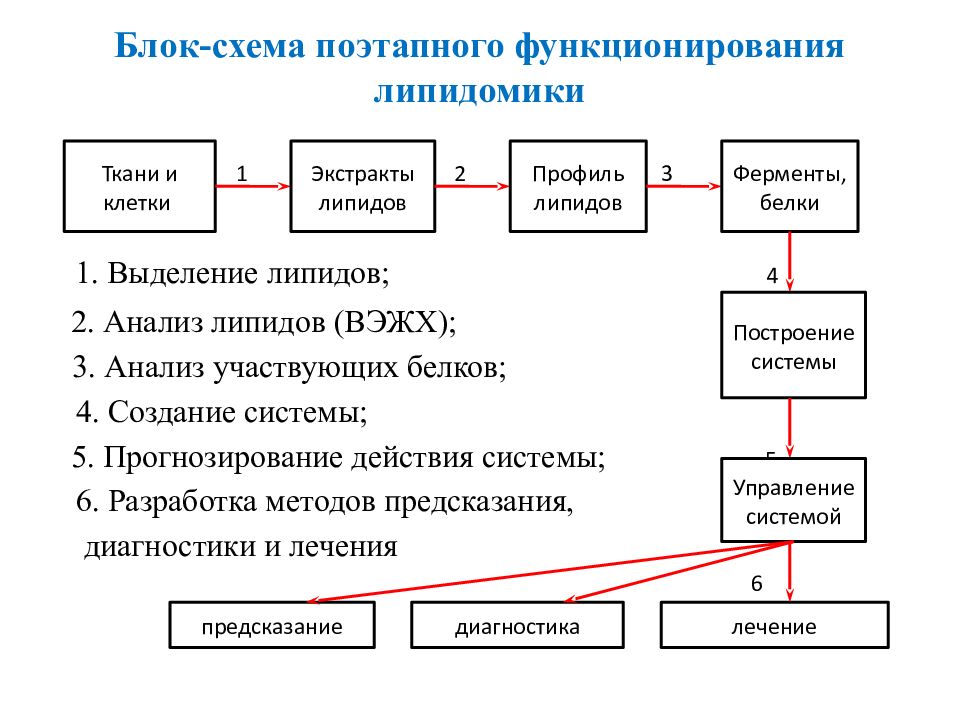
1 2 3 1. Выделение липидов; 4 2. Анализ липидов (ВЭЖХ); 3. Анализ участвующих белков; 4. Создание системы; 5. Прогнозирование действия системы; 5 6. Разработка методов предсказания, диагностики и лечения 6 Ткани и клетки Экстракты липидов Профиль липидов Ферменты, белки Построение системы Управление системой предсказание диагностика лечение
Слайд 39
Применение липидомики: идентификация новых липидных молекул; использование липидов в качестве биомаркеров (медицинская липидомика ); выявление регуляторной роли липидов в общей системе регуляции организма, липидной защитной системы.
Слайд 40
Это область биоинформатики и системной биологии, идея которой заключается в объединении данных молекулярных взаимодействий на уровнях от метаболома и до регуляции эпигенома в единые схемы. 8 ИНТЕРАКТОМИКА Интерактомика обобщает представления о биосистемах или организмах. Цель интерактомики – сравнение сетей взаимодействий ( интерактомов ) у различных видов, для того чтобы узнать какие черты таких сетей сохранились или изменились.
Слайд 41
Методы анализа интерактома афинная очистка и последующая масс-спектрометрия ; валидация - путем сравнения его с уже известными взаимодействиями, которые были найдены и подтверждены независимыми исследованиями; предсказание белок-белковых взаимодействий (ББВ) - ББВ из одного организма используются для предсказания взаимодействий между гомологичными белками в другом организме (« интерологи »); интеллектуальный анализ текста – получение ББС взаимодействий напрямую из научной литературы; предсказание функции белка основано на предположении, что неохарактеризованные белки имеют похожие функции, что и белки, взаимодействующие с ними.
Слайд 42
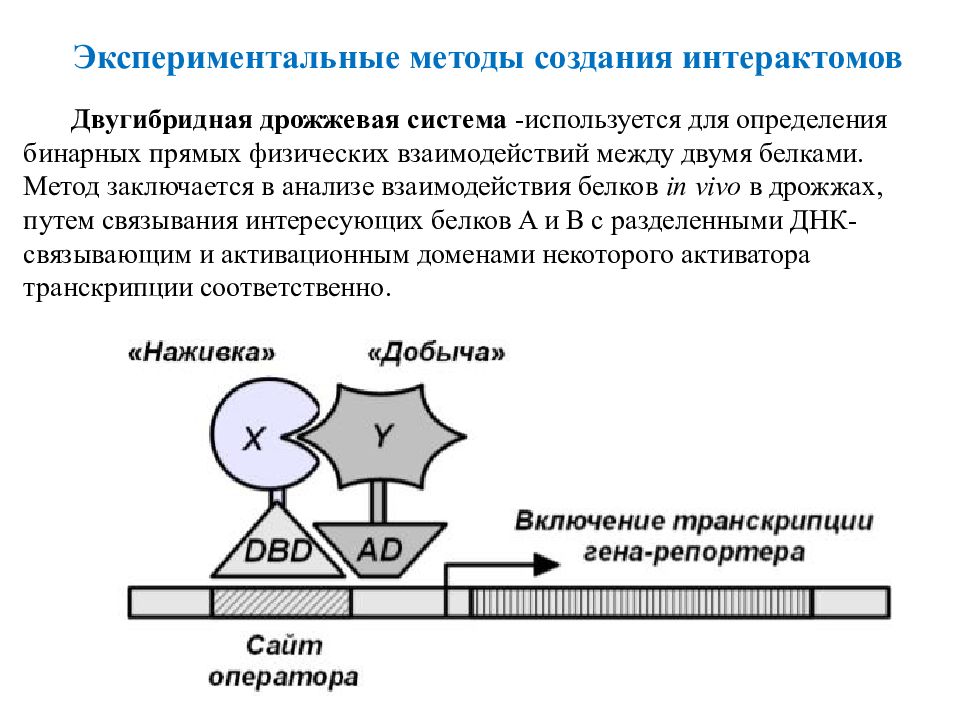
42 Двугибридная дрожжевая система -используется для определения бинарных прямых физических взаимодействий между двумя белками. Метод заключается в анализе взаимодействия белков in vivo в дрожжах, путем связывания интересующих белков A и B с разделенными ДНК-связывающим и активационным доменами некоторого активатора транскрипции соответственно. Экспериментальные методы создания интерактомов
Слайд 43
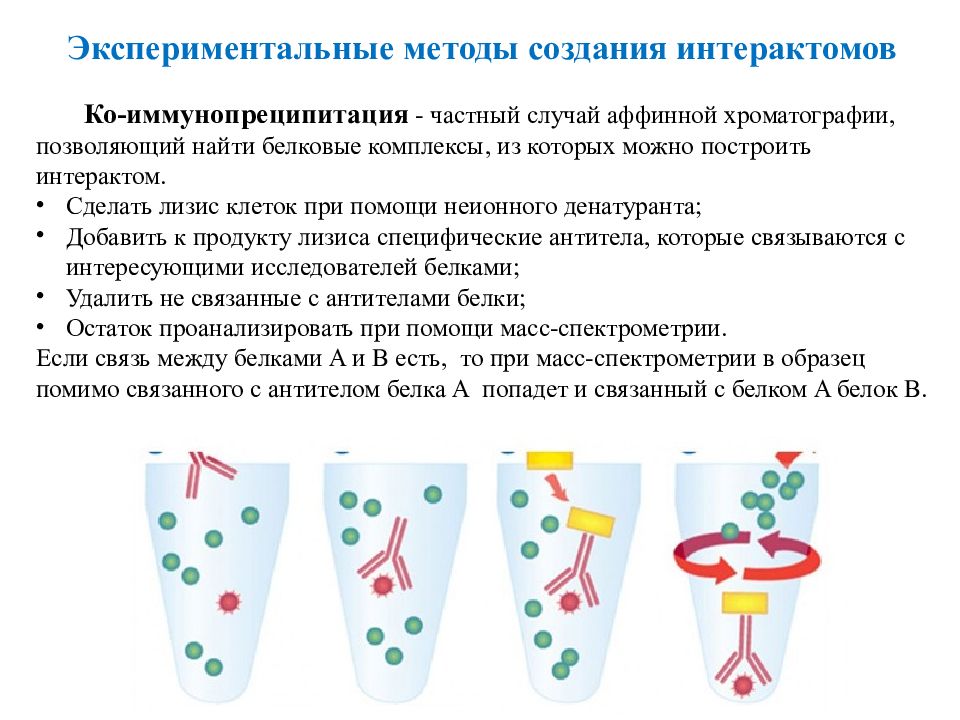
43 Ко- иммунопреципитация - частный случай аффинной хроматографии, позволяющий найти белковые комплексы, из которых можно построить интерактом. Сделать лизис клеток при помощи неионного денатуранта ; Добавить к продукту лизиса специфические антитела, которые связываются с интересующими исследователей белками; Удалить не связанные с антителами белки; Остаток проанализировать при помощи масс-спектрометрии. Если связь между белками A и B есть, то при масс-спектрометрии в образец помимо связанного с антителом белка A попадет и связанный с белком A белок B. Экспериментальные методы создания интерактомов
Слайд 44
Это суммарный анализ, используемый для персонифицируемой медицины и объединяющий данные о геноме, нуклеотидных последовательностях мРНК, белках, их метаболизме и антителах, обнаруживаемых в организме на протяжении длительного времени (М. Снайдер, 2012 г.). 9 ИНТЕГРОМИКА Интегромика осуществляет процесс статистического комбинирования данных из разных источников для обеспечения единого взгляда на весь геном и крупномасштабного статистического вывода.
Слайд 45: Ключевые стадии интеграции данных:
Step 1 Формулировка проблемы Step 2 Определение типов данных (характеристик) Step 3 Предварительная обработка данных Step 4 Интеграция данных Step 5 Интерпретация полученных данных (толкование) Ключевые стадии интеграции данных: