Первый слайд презентации: Лекция 3. Гемоглобин и миоглобин. Протеомика. Переваривание белков
Слайд 2
1. Миоглобин и гемоглобин. Гемоглобин: структура, свойства, виды, возрастные изменения качественного и количественного состава в крови. Гемоглобин А I С и его клиническое значение. 2. Производные гемоглобина. Аномальные гемоглобины. Серповидно-клеточная анемия и талассемия. 3. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3–бисфосфоглицерата. 4. Роль протеомики в оценке патологических состояний. Понятие об азотистом балансе. Переваривание и всасывание пищевых белков. Протеиназы желудочно-кишечного тракта: пепсин, гастриксин, ренин, трипсин, химотрипсин, экзопептидазы. Гастроинтестинальные гормоны, их роль. 5. Бактериальное расщепление невсосавшихся в кишечнике аминокислот.
Слайд 4
К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний) порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций.
Слайд 5
Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина. Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет.
Слайд 6
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов, соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином.
Слайд 7
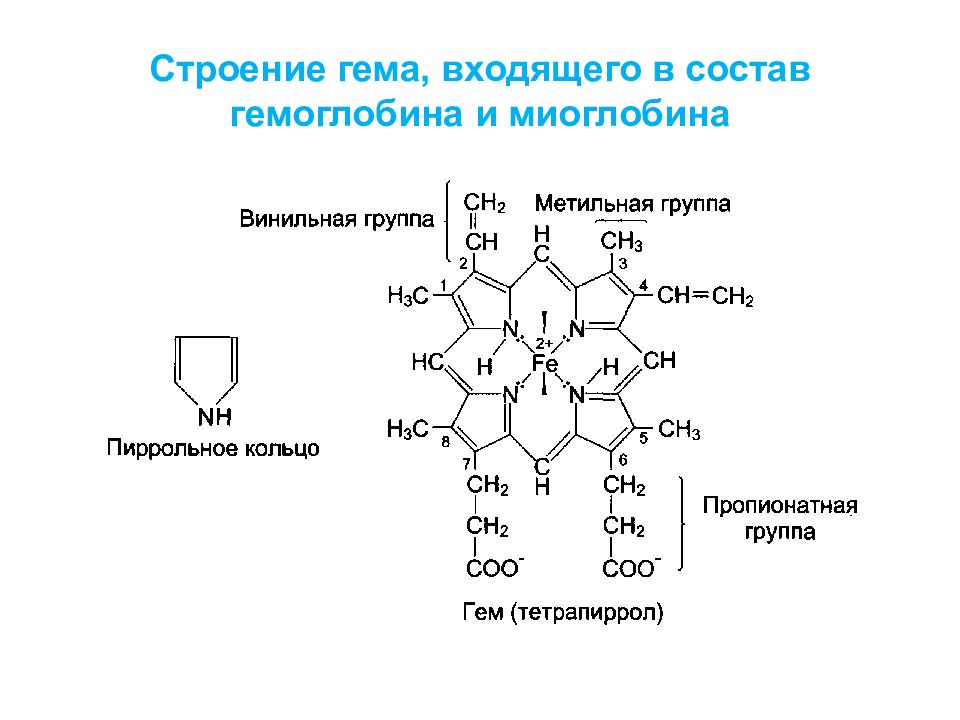
В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН 3 ), две винильные группы (—СН=СН 2 ) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем. Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c 1.
Слайд 8
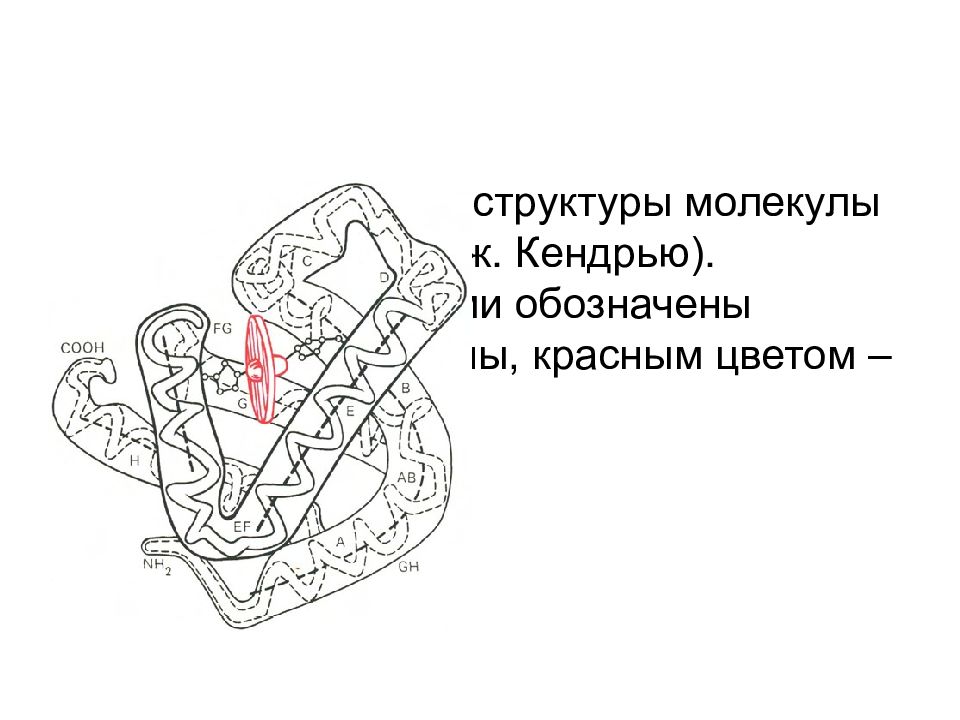
Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем.
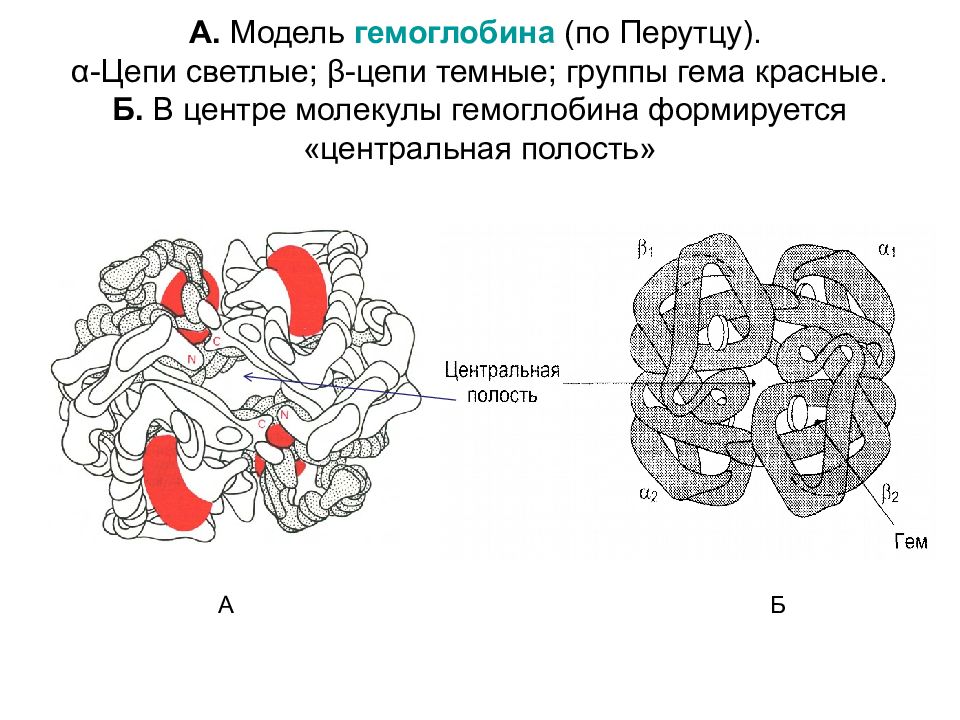
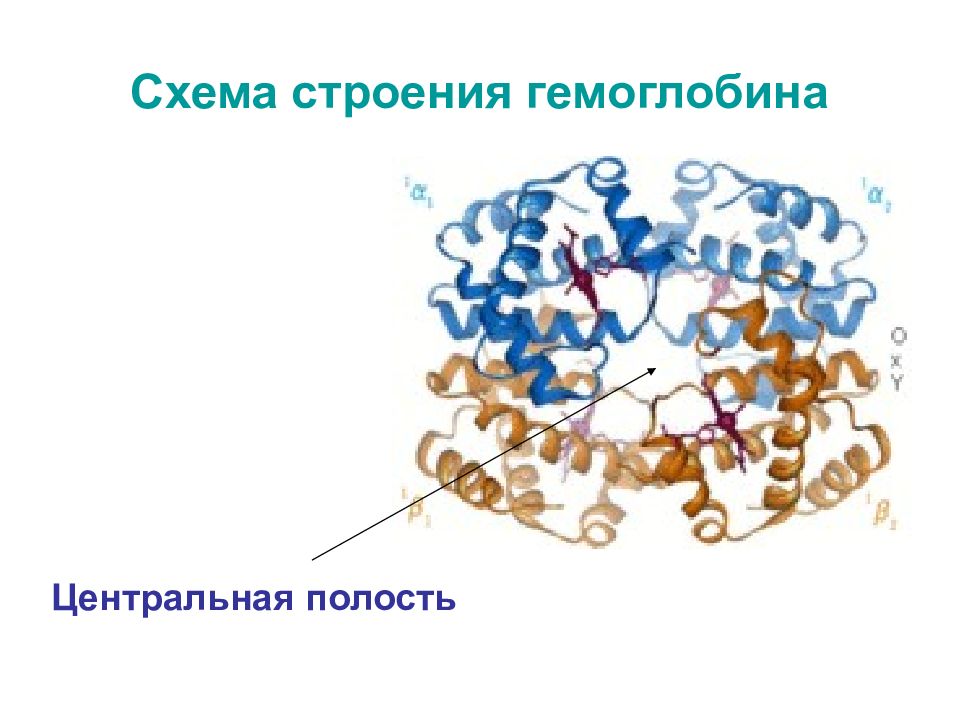
Слайд 9: А. Модель гемоглобина (по Перутцу). α-Цепи светлые; β-цепи темные; группы гема красные. Б. В центре молекулы гемоглобина формируется «центральная полость»
А Б
Слайд 12
Миоглобин – содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О 2 освобождается из комплекса с миогобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
Слайд 13
Гемоглобины – структурно-родственные белки, находящиеся в эритроцитах позвоночных. Они выполняют две важные биологические функции: 1) переносят О 2 из легких к периферическим тканям; 2) переносят СО 2 и протоны от периферических тканей к дыхательным органам для последующего выведения из организма. Гемоглобин связывает четыре молекулы кислорода на тетрамер (по одной на гем в каждой субъединице); особенно важным отличием его от миоглобина является характерная кривая насыщения кислородом, которая имеет сигмоидную форму.
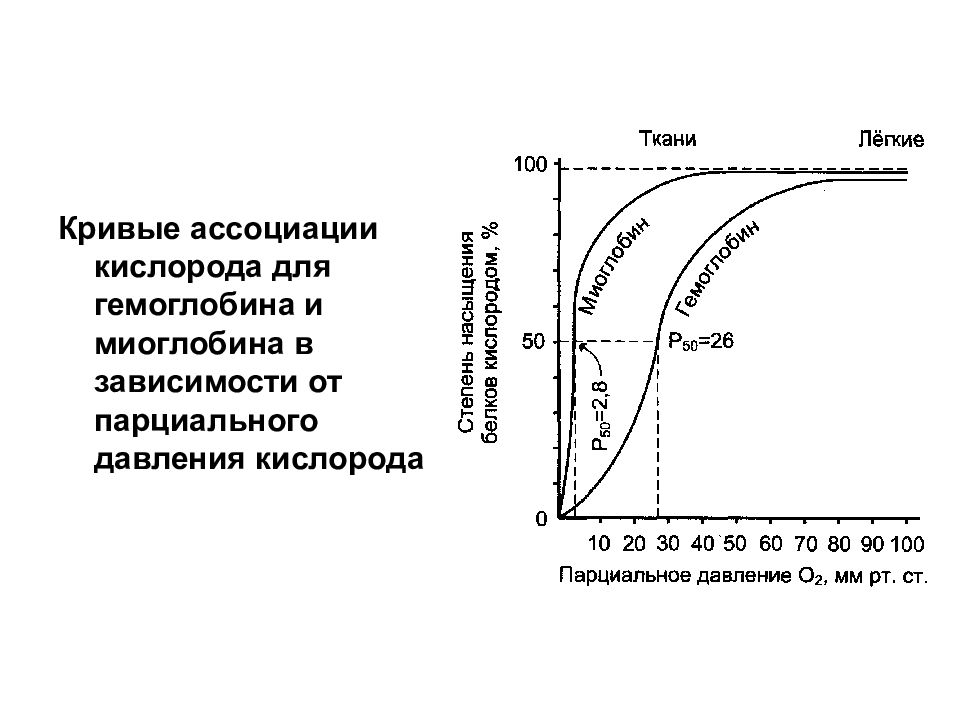
Слайд 14
Кривые ассоциации кислорода для гемоглобина и миоглобина в зависимости от парциального давления кислорода
Слайд 15
Наиболее распространенные гемоглобины имеют следующую тетрамерную структуру: НЬА (нормальный гемоглобин взрослого человека) – α 2 β 2. Это основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина; HbA 2 (минорный гемоглобин взрослого человека) – α 2 δ 2 Он находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина; Гемоглобин А I c – гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (гликозилированный гемоглобин); Эмбриональный гемоглобин – синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения – ξ 2 ε 2. Через 2 недели после формирования печени плода в ней начинает синтезироваться гемоглобин F; HbF (фетальный гемоглобин) – α 2 γ 2 ; HbS (гемоглобин при серповидно-клеточной анемии) – α 2 S 2.
Слайд 16: 2. Производные гемоглобина. Аномальные гемоглобины. Серповидно-клеточная анемия и талассемия
Слайд 17
Мутантные (М) гемоглобины человека Мутации генов, кодирующих α- и β-цепи, могут существенным образом сказываться на их биологической функции. Известно несколько сот мутантных гемоглобинов человека (в большинстве случаев функционально активных), и о некоторых из них, отличающихся сильным изменением биологических функций, речь пойдет ниже. Патологическое состояние, при котором мутация вызывает изменение биологической функции гемоглобина, называют гемоглобинопатией.
В гемоглобине S остаток Glu A 2 (6)β замещен на Val. Остаток А 2 (Glu или Val) располагается на поверхности молекулы гемоглобина и контактирует с водой, и замещение полярного остатка Glu на неполярный Val приводит к появлению на поверхности β-субъединицы «липкого участка».
Слайд 19: Различия в строении молекул гемоглобинов
1 2 3 4 5 6 7 8 Hb A : Вал-Гис-Лей-Тре-Про- Глу -Глу-Лиз… Hb S : Вал-Гис-Лей-Тре-Про- Вал -Глу-Лиз…
Слайд 20
Этот липкий участок присутствует как в оксигенированном, так и в дезоксигенированном гемоглобине S (в гемоглобине А он отсутствует). На поверхности дезоксигенированного гемоглобина существует комплементарный участок, способный прочно связываться с липким участком β-субъединицы, тогда как в оксигенированном гемоглобине этот участок маскируется другими группами.
Слайд 21
Когда гемоглобин S переходит в дезоксигенированное состояние, его липкий участок связывается с комплементарным участком на другой молекуле дезоксигенированного гемоглобина. Происходит полимеризация дезоксигемоглобина S и его осаждение в виде длинных волокон. Волокна дезоксигемоглобина S механически деформируют эритроцит, придавая ему серповидную форму, что приводит к лизису клеток и множеству вторичных клинических проявлений.
Слайд 23
Другая важная группа нарушений, связанных с аномалиями гемоглобина – талассемии. Для них характерна пониженная скорость синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к анемии, которая может принимать очень тяжелую форму. В последние годы достигнут ощутимый прогресс в выяснении молекулярных механизмов, ответственных за развитие талассемии.
Слайд 24: 3. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3–бисфосфоглицерата
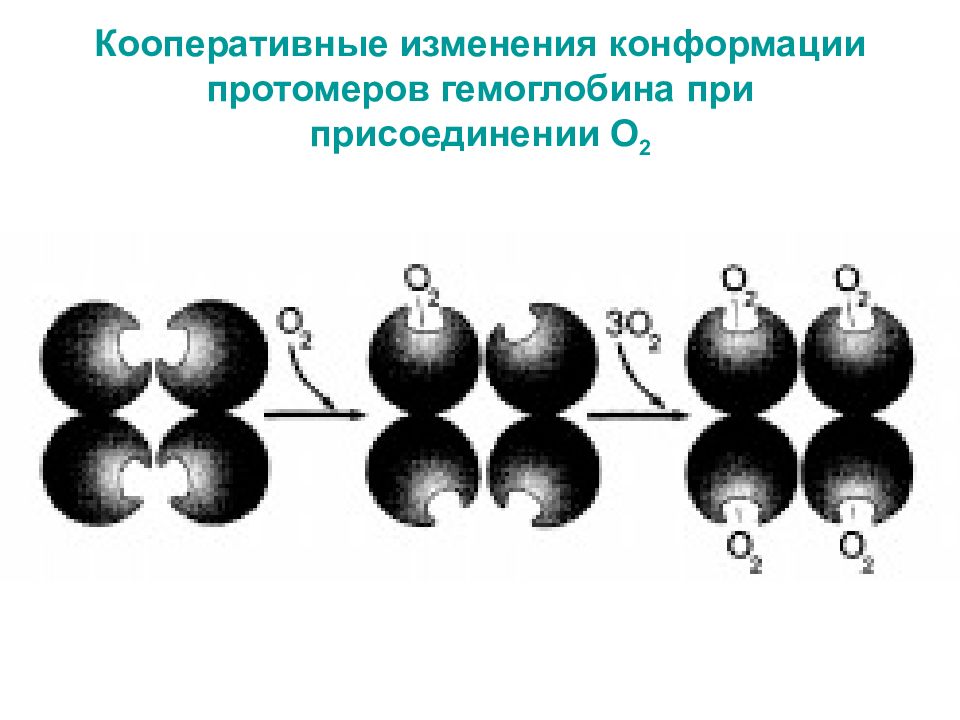
Слайд 25: Кооперативные изменения конформации гемоглобина
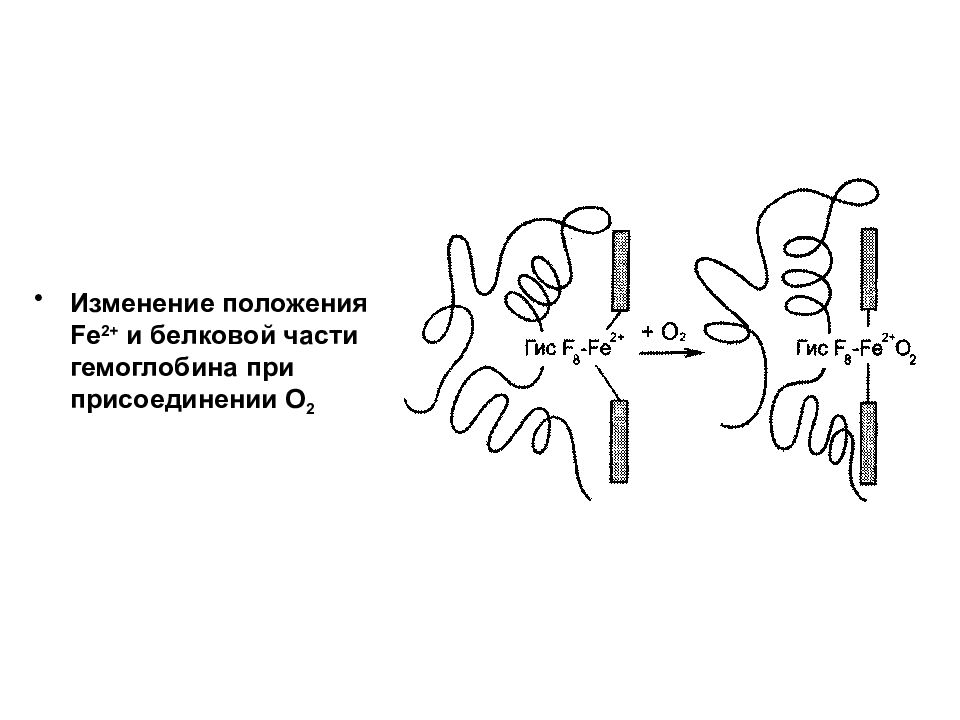
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe 2+ выступает из плоскости гема в направлении Гис F 8. Присоединение О 2 к атому Fe 2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F 8 и полипептидная цепь, в состав которой он входит. Т.к. протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка.
Слайд 26
Изменение положения Fe 2+ и белковой части гемоглобина при присоединении О 2
Слайд 27: Кооперативные изменения конформации протомеров гемоглобина при присоединении О 2
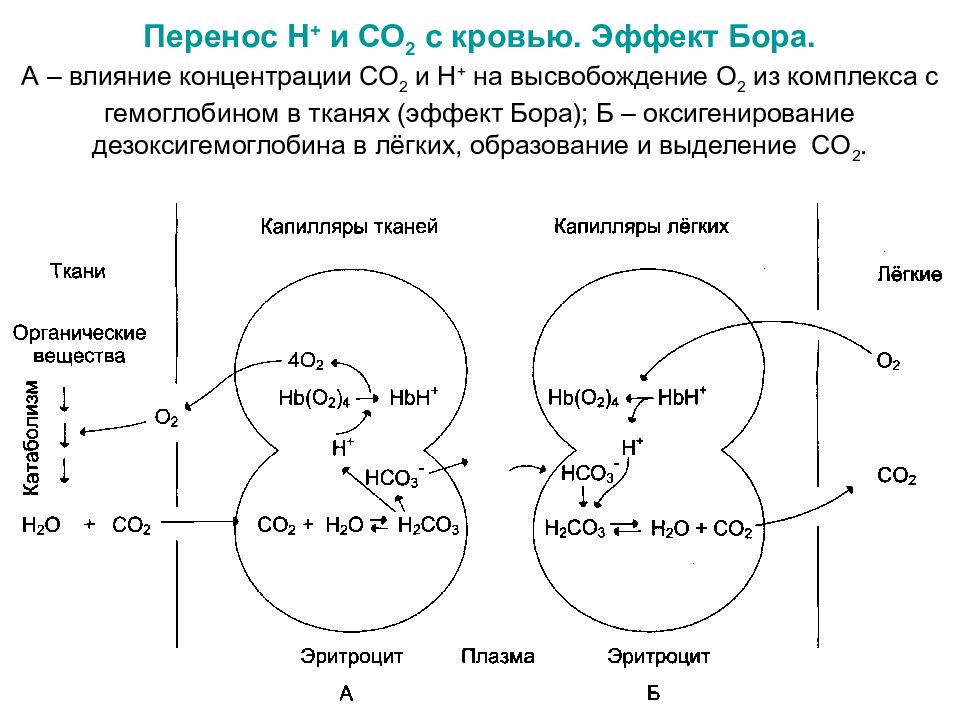
Слайд 28: Перенос Н + и СО 2 с кровью. Эффект Бора. А – влияние концентрации СО 2 и Н + на высвобождение О 2 из комплекса с гемоглобином в тканях (эффект Бора); Б – оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО 2
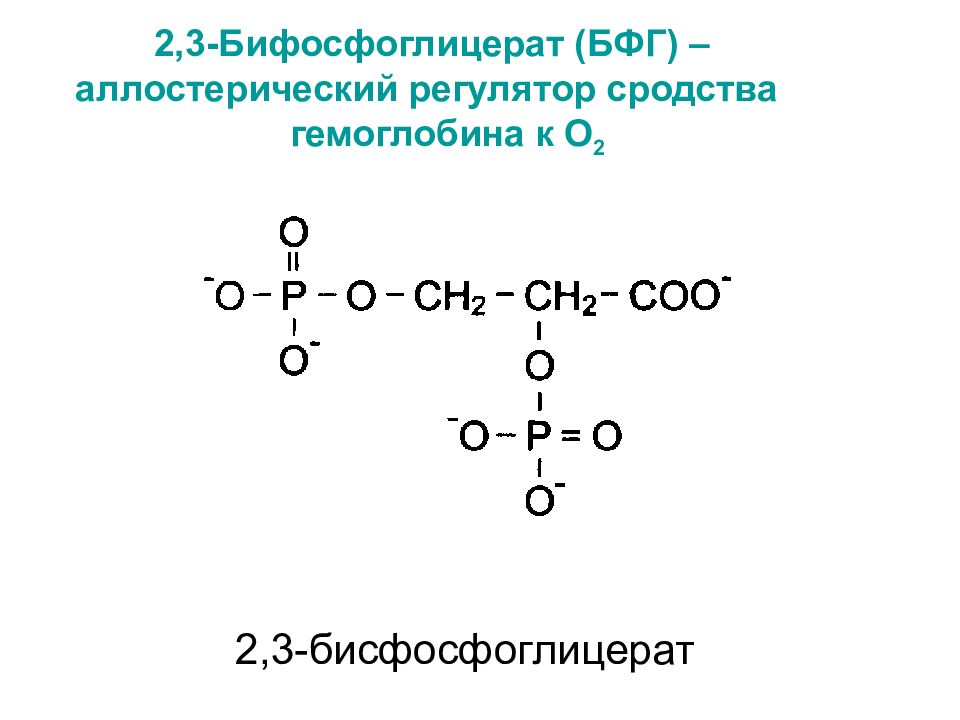
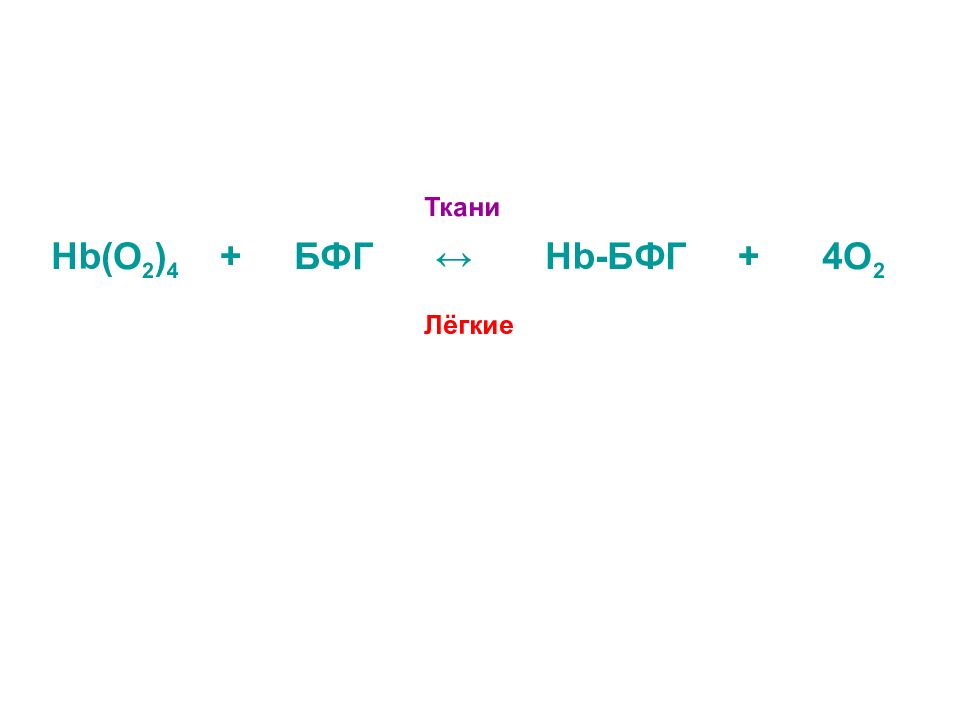
Слайд 29: 2,3-Бифосфоглицерат (БФГ) – аллостерический регулятор сродства гемоглобина к О 2
2,3-бисфосфоглицерат
Слайд 31: 4. Роль протеомики в оценке патологических состояний. Понятие об азотистом балансе. Переваривание и всасывание пищевых белков. Протеиназы желудочно-кишечного тракта: пепсин, гастриксин, ренин, трипсин, химотрипсин, экзопептидазы. Гастроинтестинальные гормоны, их роль
Слайд 32: Протеомика – наука, основным предметом изучения которой являются белки, их функции и взаимодействия в живых организмах, в том числе – в человеческом
Слайд 33
Основная задача протеомики – количественный анализ экспрессии белков в клетках в зависимости от их типа, состояния или влияния внешних условий. Протеомика осуществляет сравнительный анализ больших групп белков – от всех белков, вовлеченных в тот или иной биологический процесс до полного протеома. Преимуществом протеомики перед геномикой является тот факт, что наличие какого-либо гена в геноме не означает, что с него производится транскрипция, а наличие транскрипта не означает, что с него происходит трансляция, а даже если происходит, то транскрипт не позволяет однозначно говорить о структуре белка, его созревании и локализации.
Слайд 34: Азотистый баланс означает разность между общим количеством азота, поступившим в организм человека (или другой организм), и общим количеством экскретируемого азота
Слайд 35: Если азота поступает больше, чем экскретируется, говорят, что данный индивидуум имеет положительный азотистый баланс. Примеры: период роста и беременности. Азотистый баланс положителен как у здорового растущего ребенка, так и у здоровой беременной женщины
Слайд 36: Взрослый человек в норме находится в состоянии азотистого равновесия : потребление азота уравновешивается его выделением в составе фекалий и мочи
Слайд 37: В состоянии отрицательного азотистого баланса количество выделяемого азота превышает количество азота, потребляемого организмом. Важным примером служат больные, потребляющие недостаточное количество азота с пищей (например, при квашиоркоре). Такое же состояние наблюдается при прогрессирующих формах рака и в ряде случаев в послеоперационном периоде
Слайд 38: Переваривание пищевых белков
Переваривание белков, входящих в состав пищи, происходит в различных отделах ЖКТ с участием протеиназ.
Слайд 39: Пепсин
Основная пищеварительная функция желудка заключается в том, что в нем начинается переваривание белка. Пепсин продуцируется главными клетками в виде неактивного зимогена, пепсиногена. Пепсиноген активируется в пепсин ионами Н +, которые отщепляют защитный полипептид, «раскрывая» активный пепсин, а также самим пепсином, вызывающим быструю активацию дополнительных молекул пепсиногена (аутокатализ).
Слайд 40
Пепсин преобразует денатурированный белок в протеозы и затем в пептоны —большие полипептидные производные. Он представляет собой эндопептидазу, поскольку осуществляет гидролиз пептидных связей в составе главной полипептидной структуры, а не N- или С-концевых последовательностей, что характерно для экзопептидаз. Пепсин специфически атакует пептидные связи, образуемые с участием ароматических аминокислот (например, тирозина) или дикарбоновых аминокислот (например, глутамата).
Слайд 41
Гастриксин – протеолитический фермент (катализирующий расщепление белка пищи) желудочного сока, проявляющий максимальную активность при pH, равном 3,0-3,5. Гастриксин по своим функциям и эволюции в желудке близок к пепсину, поэтому иногда называется пепсин С или парапепсин II и относится к изопепсинам. Профермент гастриксина – прогастриксин – секретируется главными клетками фундальных желёз дна, тела и интермедиальной зоны желудка, а также клетками пилорических желёз и активируется, также как и профермент пепсина пепсиноген, соляной кислотой желудочного сока.
Слайд 42
Гастриксин, в отличие от пепсина, протеолетически активен в менее кислой среде. Гастриксин является вторым по объёму после пепсина среди содержащихся в желудочном соке протеолитических ферментов. Количество гастриксина в желудочном соке здорового взрослого человека составляет 20-50 % от количества пепсина. Гастриксин вместе с пепсином обеспечивают до 95 % всей протеолитической активности желудочного сока.
Слайд 43
Реннин (химозин, сычужный фермент). Этот фермент вызывает створаживание молока. Он чрезвычайно важен для процессов пищеварения у младенцев, поскольку предотвращает быстрый выход молока из желудка. В присутствии кальция реннин вызывает необратимые изменения казеина молока, превращая его в параказеин, который затем подвергается действию пепсина. В желудке взрослых людей реннин, по-видимому, отсутствует. Реннин используется при производстве сыра.
Слайд 44: Трипсин, химотрипсин и эластаза
Протеолитическое действие панкреатического секрета обусловливается тремя эндопептидазами – трипсином, химотрипсином и эластазой, которые расщепляют белки и полипептиды, поступающие из желудка, с образованием полипептидов, пептидов или тех и других. Трипсин специфически действует на пептидные связи, образуемые основными аминокислотами, химотрипсин – на связи между остатками незаряженных аминокислот (например, ароматических), в то время как эластаза вопреки своему названию обладает довольно широкой специфичностью, расщепляя связи, примыкающие к остаткам малых аминокислот, таких, как глицин, аланин и серии.
Слайд 45
Все три фермента секретируются в виде зимогенов. Активация трипсиногена осуществляется другим протеолитическим ферментом, энтерокиназой, секретируемой слизистой кишечника. Она гидролизует лизиновую пептидную связь в зимогене, высвобождая малый полипептид, что приводит к разворачиванию молекулы в активный трипсин. Образовавшийся трипсин действует не только на новые молекулы трипсиногена, но и на другие зимогены панкреатического секрета – химотрипсиноген, проэластазу и прокарбоксипептидазу – с высвобождением соответственно химотрипсина, эластазы и карбоксипептидазы.
Слайд 46: Карбоксипептидаза
Дальнейшее расщепление полипептидов, образовавшихся под действием эндопептидаз, осуществляет экзопептидаза – карбоксипептидаза, которая атакует С-концевую пептидную связь, высвобождая одиночные аминокислоты.
Слайд 47: Переваривание секретом кишечника
Кишечный сок, секретируемый железами Бруннера и Либеркюна, также содержит пищеварительные ферменты, в число которых входят: 1) аминопептидаза, представляющая собой экзопептидазу, которая гидролизует пептидные связи за N-концевыми аминокислотами полипептидов и олигопептидов; дипептидазы различной специфичности, некоторые из них могут находиться внутри кишечного эпителия; они завершают расщепление дипептидов до свободных аминокислот; 2) специфические дисахаридазы и олигосахаридазы, такие, как α-глюкозидаза (мальтаза), удаляющая единичные глюкозные остатки из α1→4-связанных олигосахаридов и дисахаридов начиная с нередуцирующих концов, изомальтаза (а-декстриназа), которая гидролизует 1→6-связи α-декстринов; β-галактозидаза (лактаза), удаляющая галактозу из лактозы; сахараза, гидролизующая сахарозу, и трегалаза. расщепляющая трегалозу;
Слайд 48: Переваривание секретом кишечника
3) фосфатаза, удаляющая фосфат из некоторых органических фосфатов (гексозофосфаты и глицерофосфат) и из нуклеотидов пищевого происхождения или образующихся из нуклеиновых кислот в результате их переваривания нуклеазами; 4) полинуклеотидазы, которые расщепляют нуклеиновые кислоты на нуклеотиды; 5) нуклеозидазы (нуклеозидфосфорилазы), катализирующие фосфоролиз нуклеозидов с образованием свободных азотистых оснований и пентозофосфатов; 6) кишечный секрет, по-видимому, содержит также фосфолипазу, которая действует на фосфолипиды с образованием глицерола, жирных кислот, фосфорной кислоты и оснований, таких, как холин.
Слайд 49: Всасывание аминокислот и белка
В нормальных условиях пищевые белки почти полностью расщепляются на составляющие их аминокислоты, которые затем быстро всасываются в кишечнике. Возможно, что некоторые гидролитические процессы (например, в случае дипептидов) полностью завершаются в кишечной стенке. Потребность животных в белке может с успехом удовлетворяться скармливанием полной смеси аминокислот.
Слайд 50: Изменения белкового состава организма
Изменение белкового состава клеток в процессе их дифференцировки. Наследственные протеинопатии. Приобретённые протеинопатии.
Слайд 52: Процессы гниения и брожения в кишечнике
Большая часть потребленной пищи всасывается в тонком кишечнике. Остальная часть попадает в толстый кишечник. Именно здесь происходит значительное всасывание воды и полужидкое кишечное содержимое постепенно становится более твердым. В этот период проявляется бактериальная активность. В ходе вызываемых бактериями процессов брожения и гниения образуются различные газы, такие, как СО 2, метан, водород, азот и сероводород, а также уксусная, молочная и масляная кислоты.
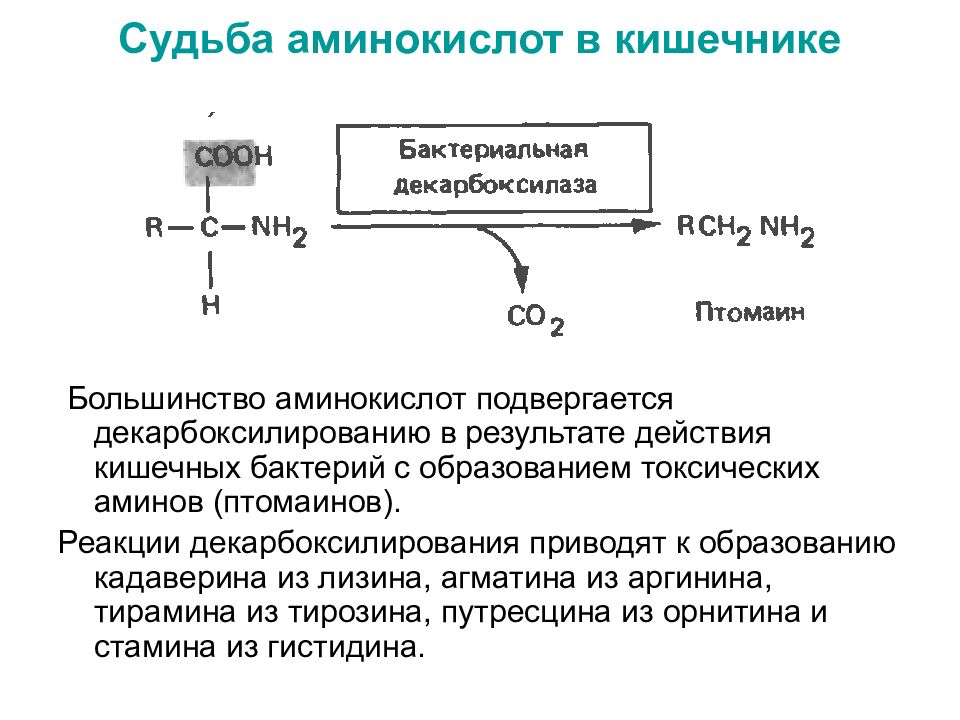
Слайд 53: Судьба аминокислот в кишечнике
Большинство аминокислот подвергается декарбоксилированию в результате действия кишечных бактерий с образованием токсических аминов (птомаинов). Реакции декарбоксилирования приводят к образованию кадаверина из лизина, агматина из аргинина, тирамина из тирозина, путресцина из орнитина и стамина из гистидина.
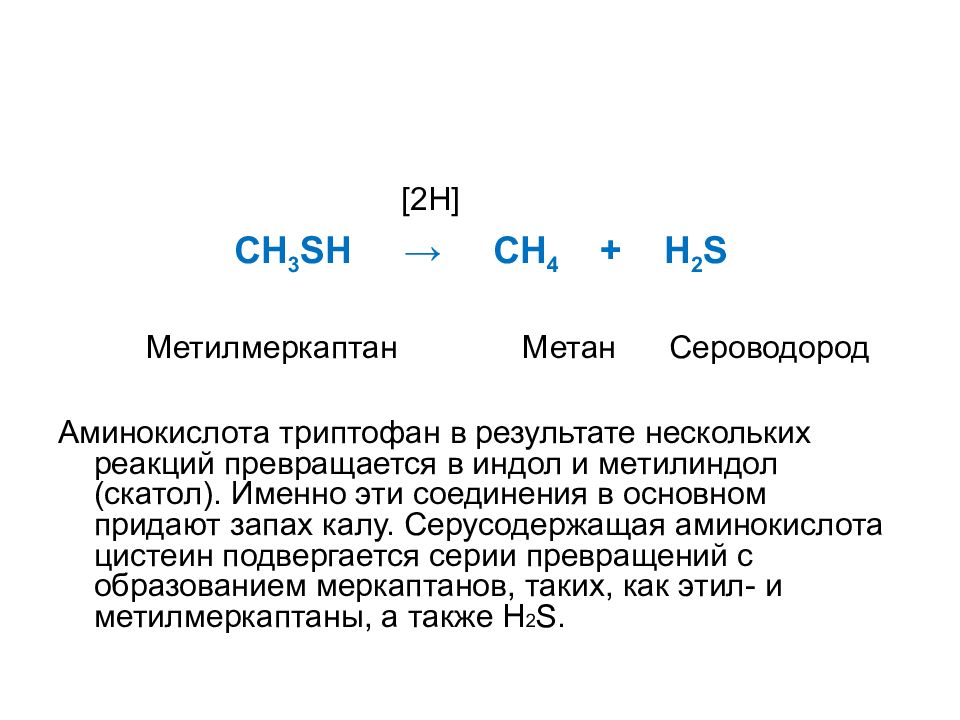
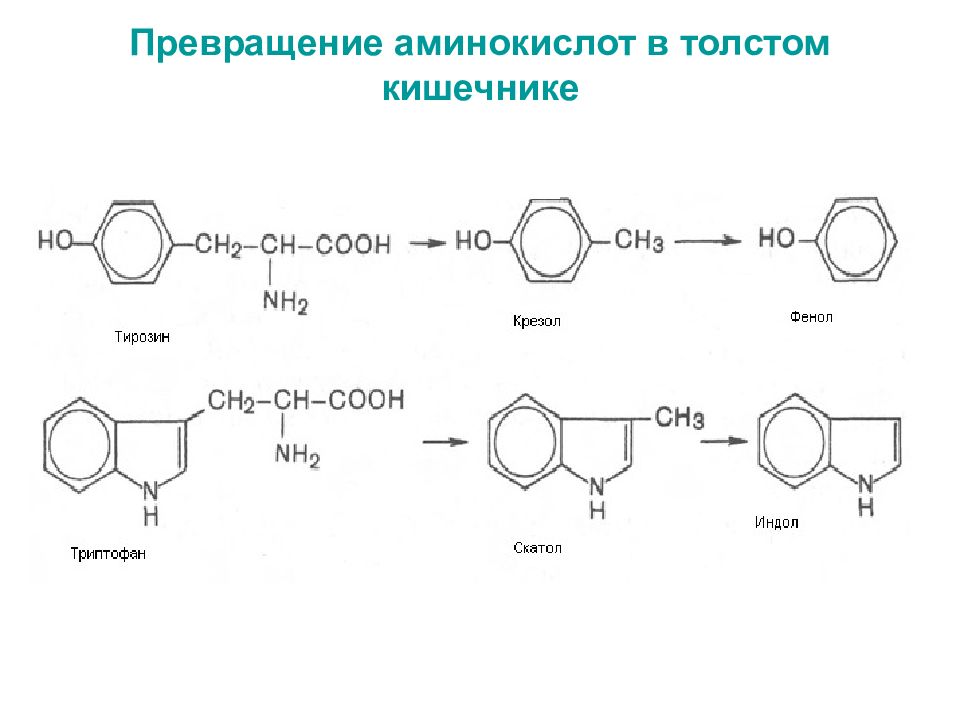
Слайд 54
[2 H ] CH 3 SH → CH 4 + H 2 S Метилмеркаптан Метан Сероводород Аминокислота триптофан в результате нескольких реакций превращается в индол и метилиндол (скатол). Именно эти соединения в основном придают запах калу. Серусодержащая аминокислота цистеин подвергается серии превращений с образованием меркаптанов, таких, как этил- и метилмеркаптаны, а также H 2 S.
Последний слайд презентации: Лекция 3. Гемоглобин и миоглобин. Протеомика. Переваривание белков: Кишечные бактерии
Кишечный микробоценоз может составлять значительную часть (до 25%) сухого веса кала. У травоядных, пища которых состоит большей частью из целлюлозы, бактерии кишечника или рубца играют важную роль в пищеварении, поскольку они расщепляют полисахариды и тем самым способствуют их всасыванию. Кроме того, эти бактерии осуществляют синтез незаменимых аминокислот и витаминов. Для людей кишечный микробоценоз не столь важен, как для травоядных. Однако бактериальная активность вносит определенный полезный вклад в питание человека, ибо с ней связан синтез витаминов К и В 12, а возможно, и других витаминов группы В, которые далее усваиваются организмом.