Первый слайд презентации: Введение в биологическую химию Энзимология
Лекция для студентов медико-профилактического факультета, обучающихся по специальности 32.05.01 «Медико-профилактическое дело » Дисциплина С2.Б5 Биологическая химия Лектор – ст.преподаватель Тюрина Е.Э. ФГБОУ ВО НГМУ Медико-профилактический факультет Кафедра медицинской химии
Слайд 2: Актуальность темы
Изучение ферментов необходимо для понимания связи между ферментами и наследственными болезнями обмена веществ Изучение ферментов позволяет расширять область их использования в медицине Успехи биохимии, молекулярной биологии и медицины связаны с развитием энзимологии
Слайд 3: План лекции
1. Свойства ферментов как белковых катализаторов 2. Активный центр: специфичность действия ферментов 3. Механизм действия ферментов 4. Кофакторы и коферменты 5. Классификация и номенклатура ферментов 6. Основы кинетики ферментативного катализа 7. Регуляция активности ферментов 8. Ингибиторы активности ферментов 9. Применение ферментов в медицине 10. Энзимопатии
Слайд 4: Цели лекции
Знать: 1. Особенности строения ферментов как белковых катализаторов. 2. Виды специфичности ферментов. 3. Основы классификации ферментов, классы ферментов, примеры катализируемых ферментами реакций. 4. Строение коферментов и кофакторов и их роль в ферментативном катализе, роль витаминов в этом процессе. 5. Способы регуляции активности ферментов. 6. Применение ферментов в медицине.
Слайд 5
Ферменты - это белковые катализаторы, ускоряющие химические реакции в живых клетках. Они обладают всеми свойствами, характерными для белков, и определенными особенностями строения, обусловливающими их каталитические свойства. Ферменты подчиняются общим законам катализа и обладают свойствами, характерными для небиологических катализаторов: ускоряют энергетически возможные реакции, сохраняют энергию химической системы постоянной, не расходуются в процессе реакции.
Уникальность структуры Высокая эффективность катализа Высокая специфичность действия Конформационная лабильность Регулируемая активность Проявляют активность в оптимальных для организма условиях
Слайд 7: Активный центр
Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра, с которым взаимодействует определенный лиганд. Лиганд, взаимодействующий с активным центром фермента, называется субстратом.
Слайд 8
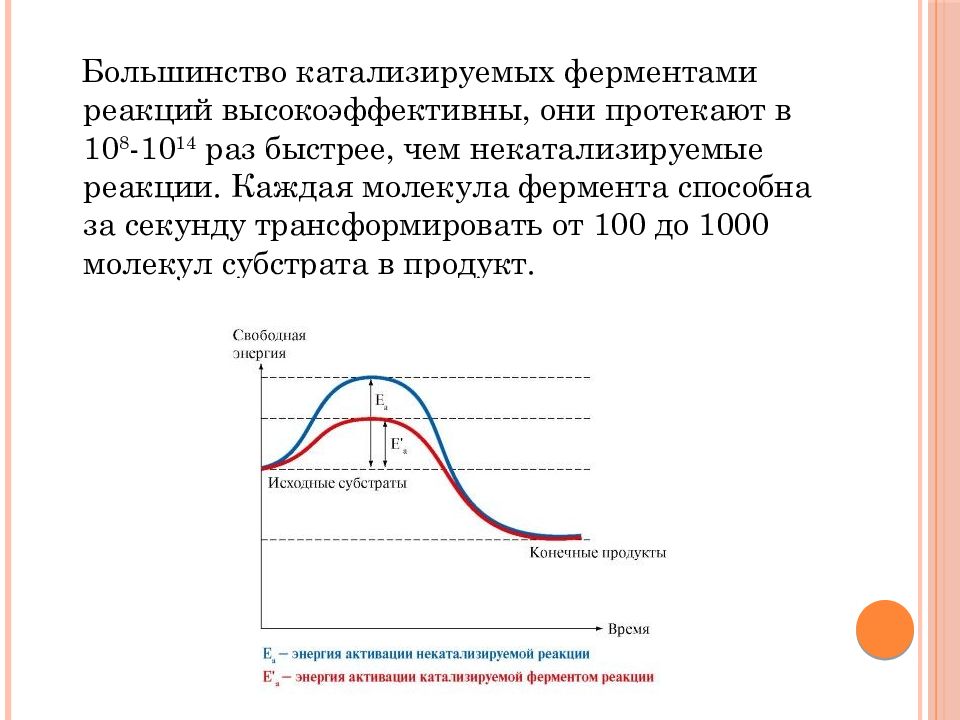
Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 10 8 -10 14 раз быстрее, чем некатализируемые реакции. Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт.
Слайд 9: Активный центр ферментов
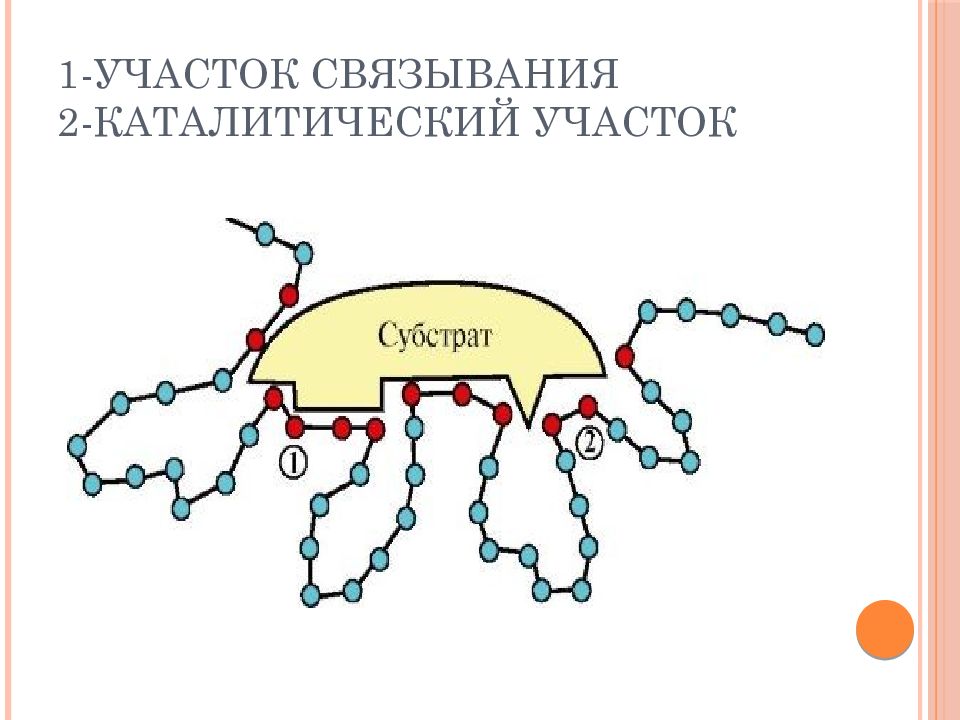
это определенный участок белковой молекулы, способный комплементарно связываться с субстратом и обеспечивающий его каталитическое превращение. Структура активного центра сформирована радикалами аминокислот, так же как и в случае активного центра любого белка. В активном центре фермента имеются аминокислотные остатки, функциональные группы которых обеспечивают комплементарное связывание субстрата (участок связывания), и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата
Слайд 11: Специфичность
Различают субстратную и каталитическую специфичности фермента, которые определяются строением активного центра. Под субстратной специфичностью понимается способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами.
Слайд 12: Различают:
абсолютную субстратную специфичность, если активный центр фермента комплементарен только одному субстрату; групповую субстратную специфичность, если фермент катализирует однотипную реакцию с небольшим количеством (группой) структурно похожих субстратов; стереоспецифичность, если фермент проявляет абсолютную специфичность только к одному из существующих стереоизомеров субстрата.
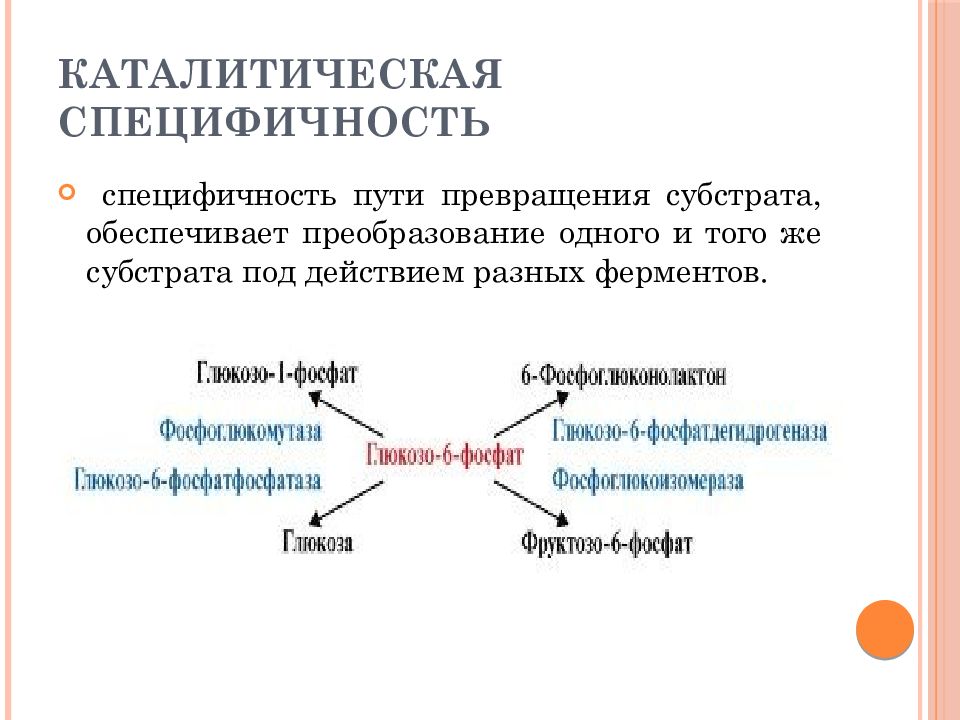
Слайд 13: Каталитическая специфичность
специфичность пути превращения субстрата, обеспечивает преобразование одного и того же субстрата под действием разных ферментов.
Слайд 14: МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Схематично процесс катализа можно представить следующим образом:
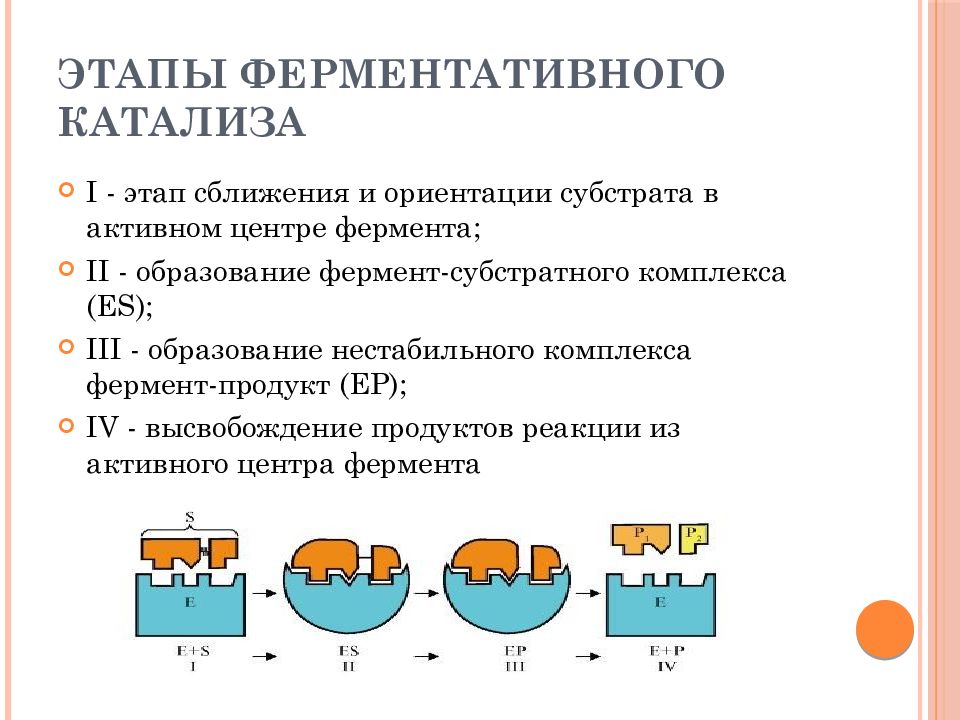
Слайд 15: Этапы ферментативного катализа
I - этап сближения и ориентации субстрата в активном центре фермента; II - образование фермент-субстратного комплекса (Е S ); III - образование нестабильного комплекса фермент-продукт (ЕР); IV - высвобождение продуктов реакции из активного центра фермента
Слайд 16: Простые и сложные ферменты
В состав простых ферментов входят только α - L -аминокислоты, в состав сложных – небелковый компонент – кофактор Простыми являются пищеварительные ферменты Большинство ферментов – сложные, олигомерные Различают две группы кофакторов : ионы металлов и коферменты.
Слайд 17: Ионы металла участвуют в функционировании фермента различными способами:
Изменяют конформацию молекулы субстрата Обеспечивают нативную конформацию активного центра фермента Стабилизируют конформацию белковой молекулы фермента Непосредственно участвуют в ферментативном катализе
Слайд 18: Cu, Zn-супероксиддисмутаза (СОД)
Zn необходим для стабилизации молекулы Cu – активный участник в реакции дисмутации супероксид-аниона : О 2 - + О 2 - + 2Н + = Н 2 О 2 + О 2 1) О 2 - + Cu 2+ + Н + = Cu 1+ + О 2 2) О 2 - + Cu 1+ + Н + = Cu 2+ + Н 2 О 2
Слайд 19: Коферменты
Коферменты являются органическими веществами, чаще всего производными витаминов (нуклеотидов, гема ), которые непосредственно участвуют в ферментативном катализе, так как находятся в активном центре ферментов. Фермент, содержащий кофермент и обладающий ферментативной активностью, называют холоферментом. Белковую часть такого фермента называют апоферментом, который в отсутствие кофермента не обладает каталитической активностью.
Слайд 20: Классификация коферментов по прочности связи
Слабые химические взаимодействия - кофермент связывается с белковой частью фермента только в момент реакции Ковалентная связь с апоферментом – в этом случае кофермент называется простетической группой
Слайд 21: Коферменты, обратимо связанные с апоферментом
NAD +, NADP + – кофермент оксидоредуктаз, источник синтеза – никотиновая кислота ( vit РР) HS - CoA (кофермент А) - кофермент ацилтрансфераз, источник синтеза – пантотеновая кислота ( vit B 5 ) тетрагидрофолат (Н 4 – фолат ) - кофермент трансфераз - переносчиков С1-фрагментов, источник синтеза – фолиевая кислота ( vit B 9 )
Слайд 22: Простетические группы
флавиновые нуклеотиды FAD, FMN – коферменты оксидоредуктаз, источник синтеза - рибофлавин ( vit В 2 ) пиридоксальфосфат - кофермент аминотрансфераз, источник синтеза - пиридоксин ( vit В 6 ) тиаминпирофосфат - кофермент оксидоредуктаз в реакциях окислительного декарбоксилирования кетокислот и кетосахаров, источник синтеза – тиамин ( vit В 1 ) биоцитин - кофермент лигаз, образующих связи С – С, источник синтеза - биотин ( vit Н)
Слайд 23: Задание для самостоятельной работы
Кофермент Витамин Тиаминдифосфат В 1 1. Заполните таблицу 2. Дайте определение понятия « Мультиферментный комплекс» и приведите примеры таких комплексов в клетке.
Слайд 24: КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
В названии большинства ферментов содержится суффикс «аза», присоединенный к названию субстрата реакции уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определенного субстрата лактатдегидрогеназа, аденилатциклаза, фосфоглюкомутаза пируваткарбоксилаза
Слайд 25: Международный союз биохимии и молекулярной биологии (IUBMB) в 1961 г
Все ферменты делятся на шесть основных классов в зависимости от типа катализируемой химической реакции Каждый из шести классов имеет свой порядковый номер, строго закрепленный за ним: 1-й класс - оксидоредуктазы ; 2-й класс - трансферазы ; 3-й класс - гидролазы; 4-й класс - лиазы ; 5-й класс - изомеразы ; 6-й класс - лигазы.
Слайд 26: 1. Оксидоредуктазы катализируют различные окислительно-восстановительные реакции. Класс делится на подклассы:
а) дегидрогеназы катализируют реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа, изоцитратдегидрогеназа, сукцинатдегидрогеназа и др.;
Слайд 27: Например, фермент маладегидрогеназа L-малат : NAD-оксидоредуктаза кодовое число - 1.1.1.38
первая цифра означает номер класса ферментов (в данном случае цифра 1 свидетельствует, что фермент относится к классу оксидоредуктаз ); вторая цифра указывает на тип катализируемой реакции (в данном примере окислению подвергается гидроксильная группа); третья цифра означает наличие кофермента (в данном случае - кофермент NAD+); последняя цифра - это порядковый номер фермента в данной подгруппе.
Слайд 28
б) оксидазы - катализируют реакции окисления с участием молекулярного кислорода
Слайд 29
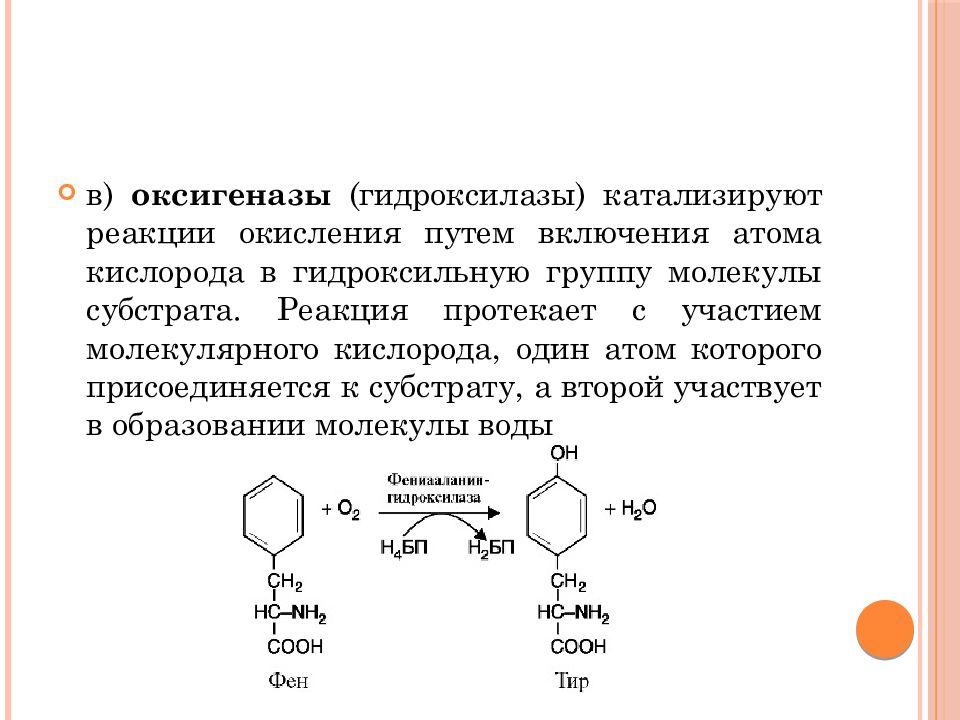
в) оксигеназы ( гидроксилазы ) катализируют реакции окисления путем включения атома кислорода в гидроксильную группу молекулы субстрата. Реакция протекает с участием молекулярного кислорода, один атом которого присоединяется к субстрату, а второй участвует в образовании молекулы воды
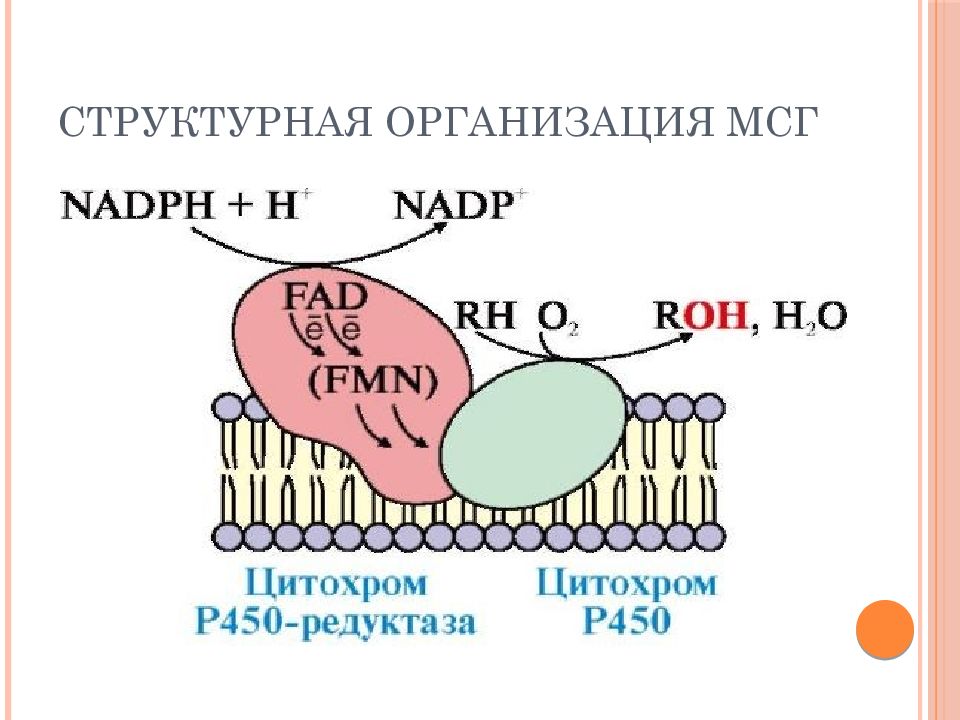
Слайд 30: Монооксигеназы как ферменты микросомальной системы гидроксилирования (МСГ)
цитохром Р-450-содержащие монооксигеназы микросом печени – ферменты метаболизма ксенобиотиков (например, лекарственных препаратов) R -Н +О 2 +2 Fe 2+ (Р-450) +2H+ → R -ОН +Н 2 О+2 Fe 3 + R-H – субстрат окисления (ксенобиотик, гидрофобный) R-OH – метаболит микросомального окисления (гидрофильный за счет образования -ОН, что способствует его выведению из организма)
Слайд 32
г) гидропероксидазы субстрат: Н 2 О 2 продукт: Н 2 О ферменты: ГПО, каталаза Пример: глутатиопероксидаза (ГПО) кофермент-донор водорода: глутатион GS - H ( трипептид : γ - глутамил-цистеинил-глицин ) кофактор : селен Н 2 О 2 + 2 GS - H → 2Н 2 О + GSSG GS - H – восстановленный глутатион GSSG – окисленный глутатион Восстановление глутатиона после реакции обеспечивает глутатион редуктаза (донор водорода - NADPH)
Слайд 33: Задания для самостоятельной работы:
Используя текст учебника, охарактеризуйте другие классы ферментов, приведите примеры реакций; Для трансфераз, гидролаз и лиаз приведите примеры подклассов.
Слайд 34: Скорость ферментативной реакции
Скорость ферментативной реакции определяется уменьшением количества молекул субстрата или увеличением количества молекул продукта за единицу времени. Скорость ферментативной реакции является мерой каталитической активности фермента и обозначается как активность фермента.
Слайд 35
На практике пользуются условными величинами, характеризующими активность фермента: 1 международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 минуту при оптимальных условиях (температура 37°С, оптимальное значение рН раствора)
Слайд 36
Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность ( Уд.Ак.) фермента, численно равную количеству превращенного субстрата (в мкмолях ) за единицу времени одним миллиграммом (мг) белка (фермента, выделенного из ткани):
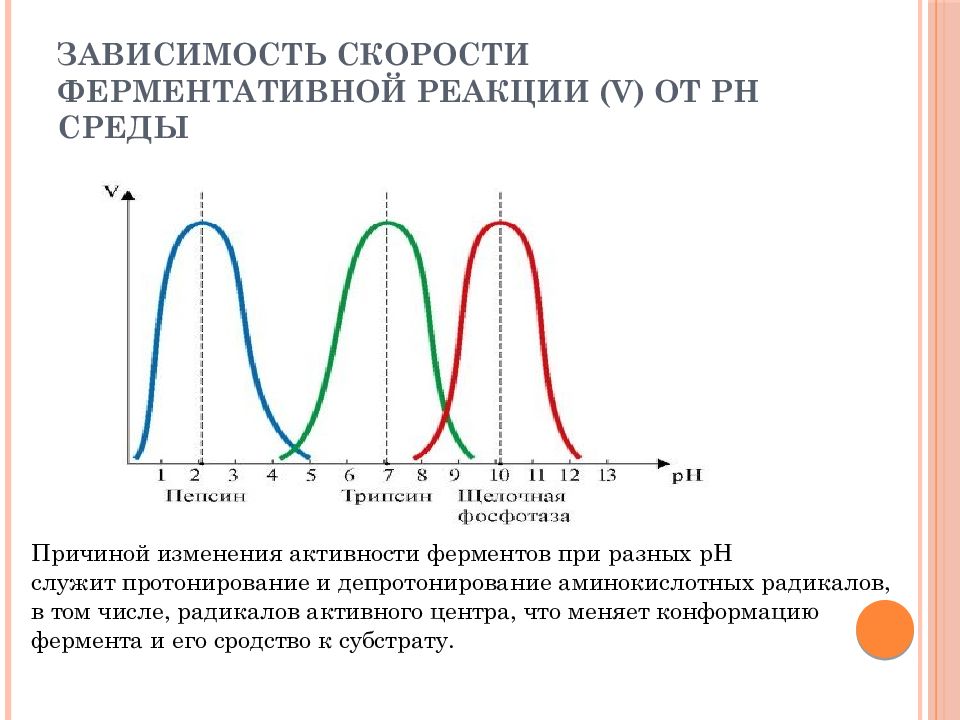
Слайд 38: Зависимость скорости ферментативной реакции (V) от рН среды
Причиной изменения активности ферментов при разных рН служит протонирование и депротонирование аминокислотных радикалов, в том числе, радикалов активного центра, что меняет конформацию фермента и его сродство к субстрату.
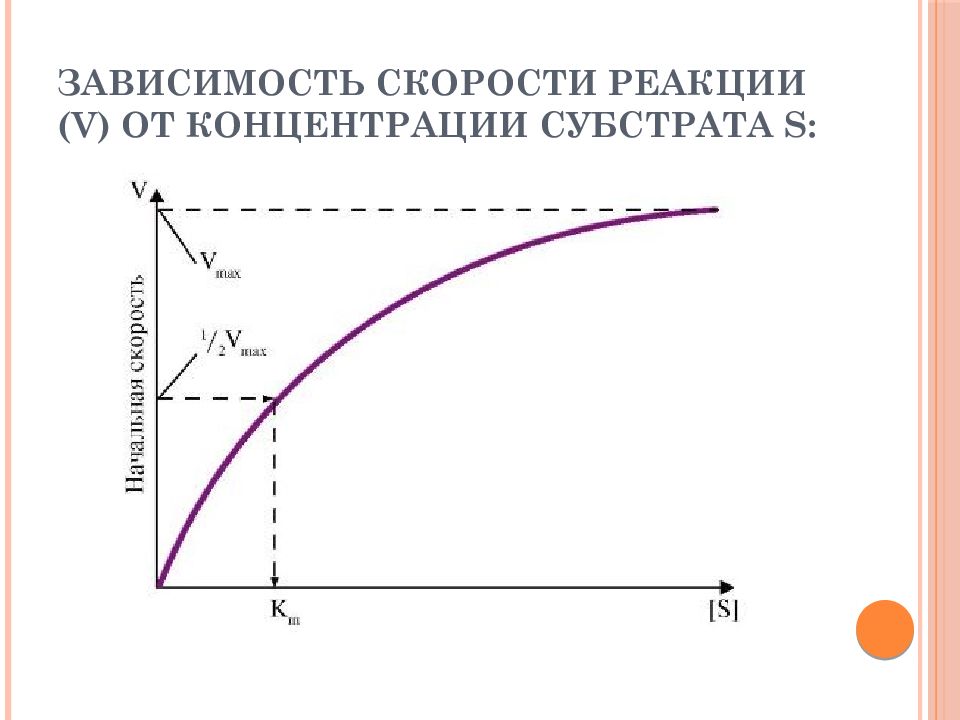
Слайд 40: Основной кинетической характеристикой эффективности фермента является константа Михаэлиса - K m
Константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. K m характеризует сродство данного фермента к данному субстрату и является величиной постоянной. Чем меньше K m, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции, и наоборот, чем больше K m, тем меньше сродство фермента к субстрату и меньше начальная скорость реакции.
Слайд 41: Важнейшим отличием ферментов от неорганических катализаторов является их регулируемость
Способ регуляции Характеристика Изменение количества молекул фермента Количество молекул фермента в клетке определяется соотношением двух процессов: синтеза и распада. Наиболее изучен механизм регуляции синтеза фермента на уровне транскрипции (синтеза мРНК ), который регулируется определенными метаболитами, гормонами и рядом биологически активных молекул
Слайд 42
Способ регуляции Характеристика Доступность молекул субстрата и кофермента Важный параметр, контролирующий протекание ферментативной реакции, - наличие субстрата и кофермента. Чем больше концентрация исходного субстрата, тем выше скорость реакции
Слайд 43
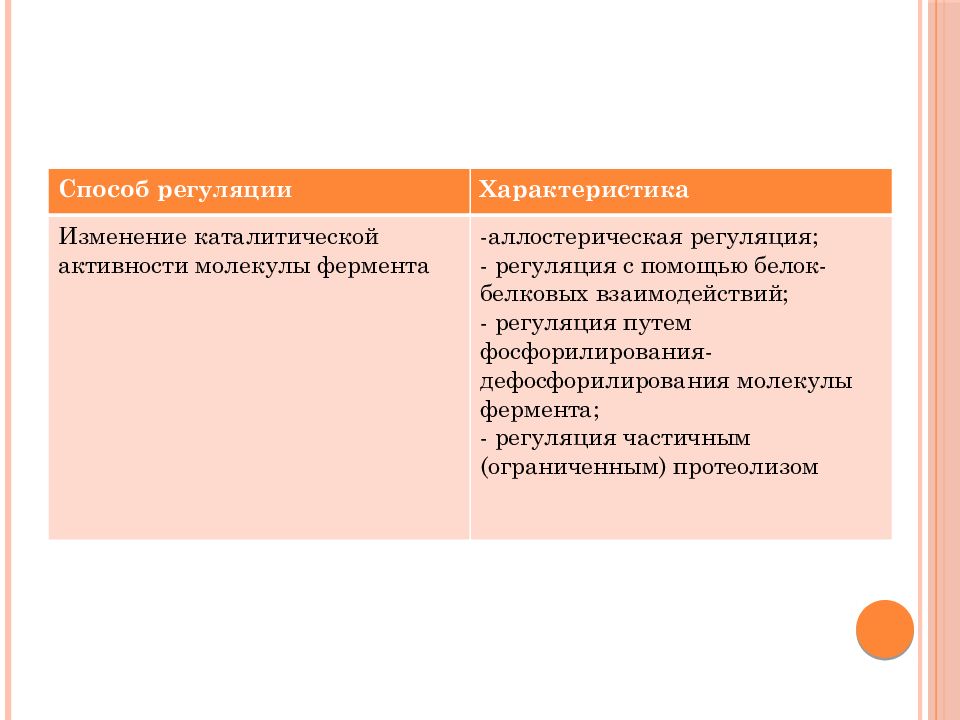
Способ регуляции Характеристика Изменение каталитической активности молекулы фермента - аллостерическая регуляция; - регуляция с помощью белок-белковых взаимодействий; - регуляция путем фосфорилирования-дефосфорилирования молекулы фермента; - регуляция частичным (ограниченным) протеолизом
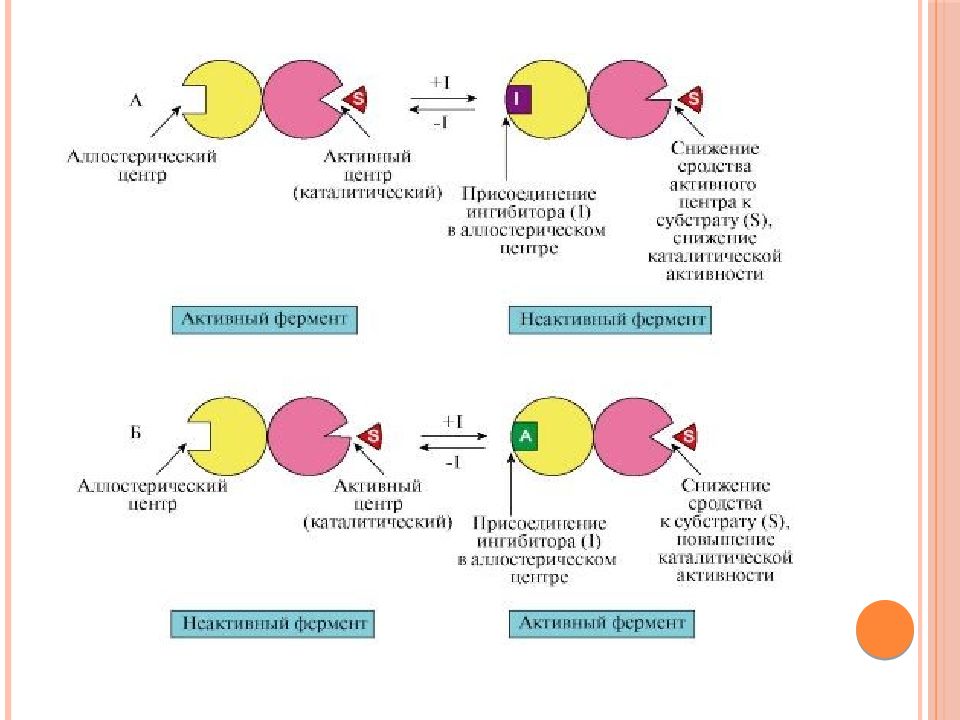
Слайд 44: Аллостерическая регуляция
Аллостерическими ферментами называют ферменты, активность которых может регулироваться с помощью веществ-эффекторов; Участвующие в аллостерической регуляции эффекторы - это клеточные метаболиты; Эффектор, который вызывает снижение (ингибирование) активности фермента, называется ингибитором. Эффектор, который вызывает повышение (активацию) активности ферментов, называют активатором.
Слайд 45: Аллостерические ферменты имеют определенные особенности строения:
- обычно являются олигомерными белками, состоящими из нескольких протомеров ; - имеют аллостерический центр, пространственно удаленный от каталитического активного центра; - эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах.
Слайд 47: Особенности функционирования аллостерических ферментов
Аллостерические ферменты обладают свойством кооперативности : взаимодействие аллостерического эффектора с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату Регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента. Аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
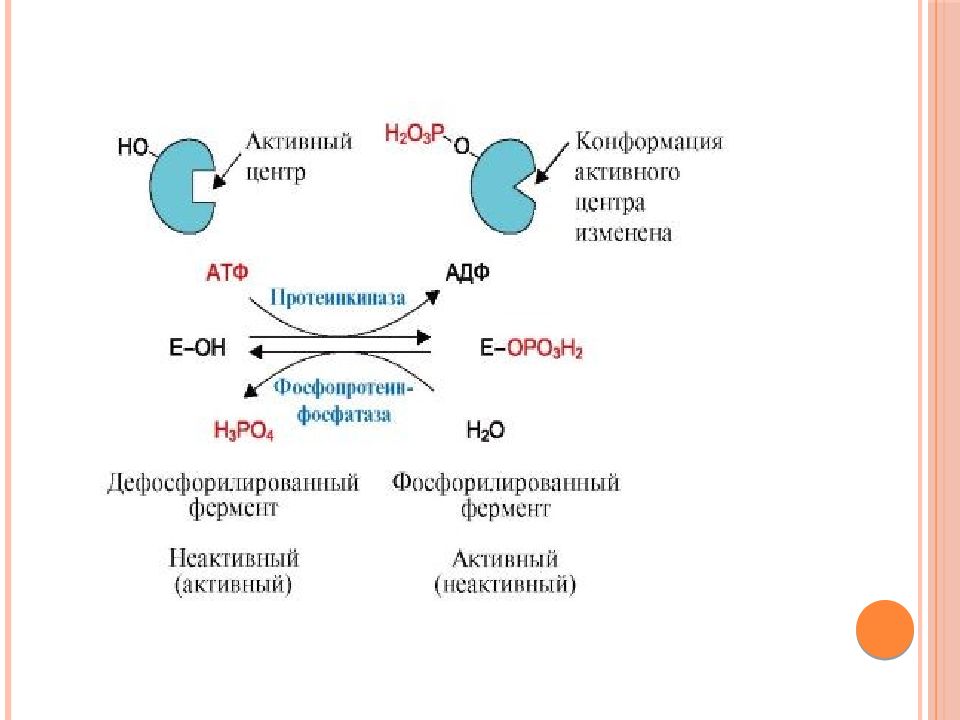
Слайд 48: Регуляция путём фосфорилирования-дефосфорилирования
Фосфорилирова-нию подвергаются ОН-группы фермента, которое осуществляется ферментами протеинкиназами ( фосфорилирование ) и фосфопротеинфосфатазами ( дефосфорилирование ) Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными
Слайд 50: Регуляция при помощи белок-белковых взаимодействий
активация ферментов в результате присоединения белков-активаторов; изменение каталитической активности в результате ассоциации и диссоциации протомеров
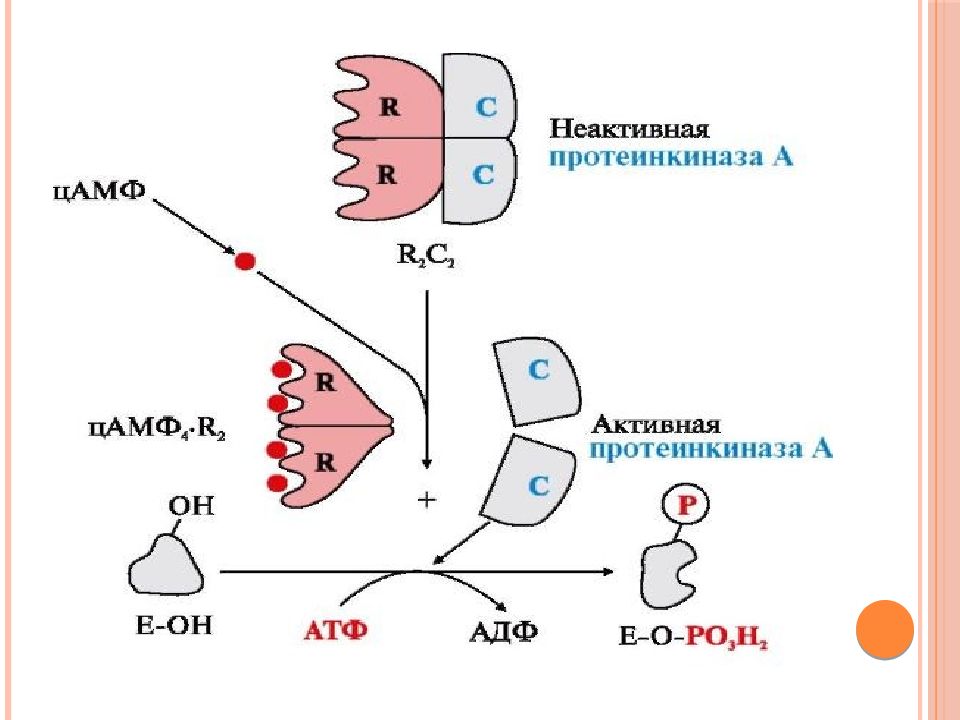
Слайд 51: Протеинкиназа А
( цАМФ-зависимая ) состоит из четырех субъединиц двух типов: двух регуляторных (R) и двух каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ ( цАМФ ) (по два на каждую субъединицу). Присоединение четырех молекул цАМФ к двум регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса; при этом высвобождаются две активные каталитические субъединицы
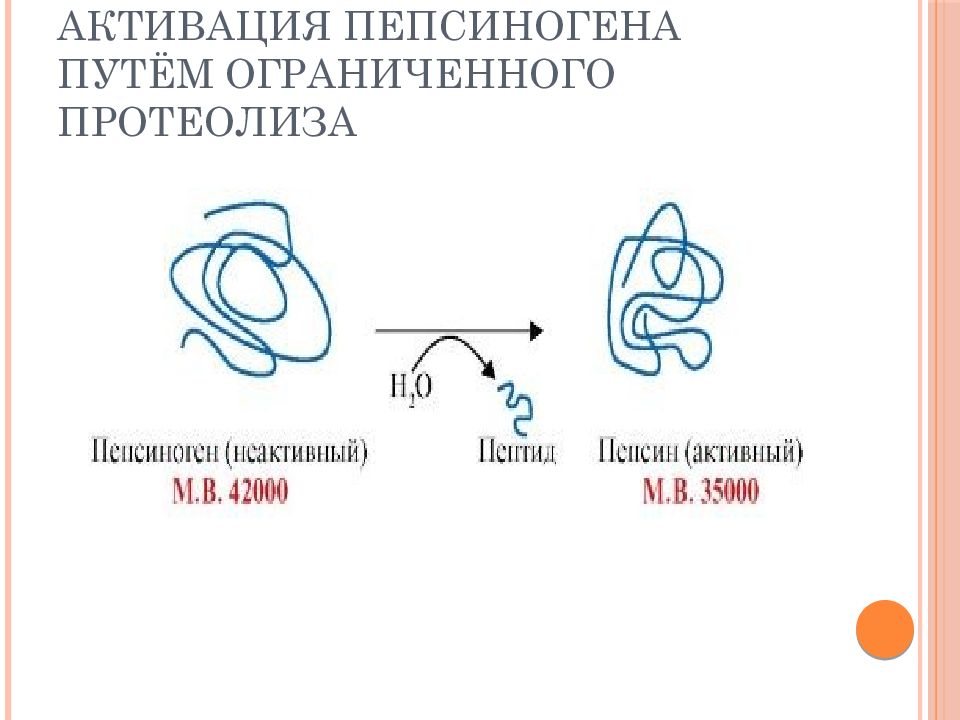
Слайд 53: Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Ферменты ЖКТ синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определенных пептидных связей, который приводит к отщеплению части молекулы. В оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента
Слайд 55: Ингибиторы активности ферментов – снижают скорость химической реакции
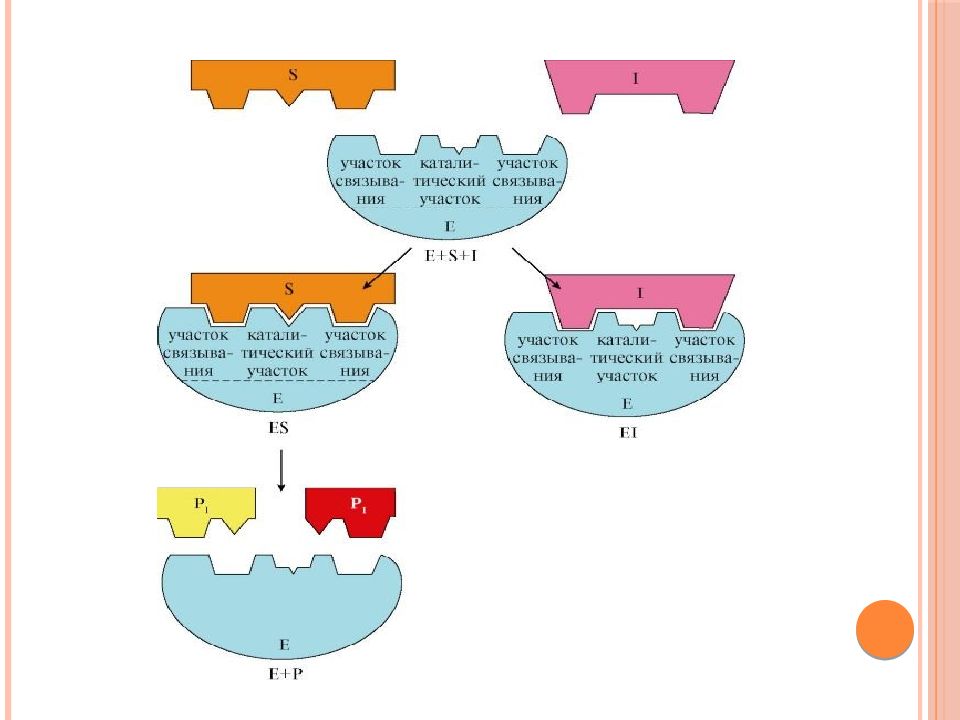
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определенных условиях легко отделяются от фермента. Обратимый ингибитор не изменяет структуры фермента. Поэтому при высоких концентрациях субстрата скорость реакции достигает максимума, т.е. конкурентный ингибитор не изменяет V max, но повышает K m. Необратимое ингибирование наблюдается в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента.
Слайд 56
По механизму действия обратимые ингибиторы подразделяются на конкурентные и неконкурентные. Конкурентный ингибитор является структурным аналогом субстрата; в результате возникает конкуренция молекул субстрата и ингибитора за связывание с активным центром фермента.
Слайд 58
Неконкурентным обратимым называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата; присоединение неконкурентного ингибитора к ферменту изменяет конформацию активного центра и уменьшает скорость ферментативной реакции, Примером неконкурентного ингибитора может быть действие ионов тяжелых металлов, которые взаимодействуют с функциональными группами молекулы фермента, препятствуя катализу.
Слайд 59: ПРИМЕНЕНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
Широкое применение в медицинской практике ферменты находят в качестве диагностических ( энзимодиагностика ) и терапевтических ( энзимотерапия ) средств. Ферменты также используются в качестве специфических реактивов для определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови.
Слайд 60: Ферменты как реагенты
Рестриктазы бактерий (специфические эндонуклеазы ) используются в пренатальном скрининге наследственных заболеваний Taq - полимераза термофилов ( Thermus aquaticus ) необходима для проведения ПЦР-анализа в диагностике наследственных и инфекционных заболеваний, определении родства, судебной медицине
Слайд 61: Энзимодиагностика - постановка диагноза на основе определения активности ферментов в биологических жидкостях человека
Секреторные (функциональные) ферменты синтезируются в печени «работают» в крови (субстрат фермента находится в крови) активность в крови такая же или выше, чем в ткани характеризуют белок-синтезирующую функцию печени ПРИМЕРЫ: псевдохолинэстераза (ПХЭ) липопротеинлипаза ( ЛП-липаза ) лецитин: холестерол ацилтрансфераза (ЛХАТ) проферменты свертывающей системы крови
Слайд 62
Экскреторные ферменты Секретируются экзокринными железами Активность в крови незначительная и обусловлена диффузией фермента Активность в крови повышается при воспалении железы, затруднении оттока секрета ПРИМЕРЫ: щелочная фосфатаза (печень) амилаза, липаза (поджелудочная железа) кислая фосфатаза (простата)
Слайд 63
Внутриклеточные ферменты: цитоплазматические: лактатдегидрогеназа (ЛДГ), аланин ( аспартат ) аминотрансфераза (АЛТ, АСТ), креатинкиназа (КК) митохондриальные : АСТ лизосомные : кислая фосфатаза Активность в ткани высокая Активность в крови незначительная и является следствием нормально идущих процессов разрушения клеток (например, эритроцитов), повышенной проницаемости мембран в детском возрасте, выполнения тяжелой физической работы (повышение активности креатинкиназы ) Значительное повышение активности в крови – признак патологии (воспаление, цитолиз, некроз) Появление в крови цитозольных ферментов свидетельствует о воспалительном процессе, митохондриальных или ядерных – цитолизе, некрозе
Слайд 64: Изоферменты в энзимодиагностике
Ферменты, катализирующие одну и ту же химическую реакцию, но с разной первичной структурой белка, называют изоферментами. Изоферменты часто являются органоспецифичными, так как в каждой ткани содержится преимущественно один тип изоферментов. Следовательно, при повреждении органа в крови появляется соответствующая форма изофермента. Обнаружение определенных изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
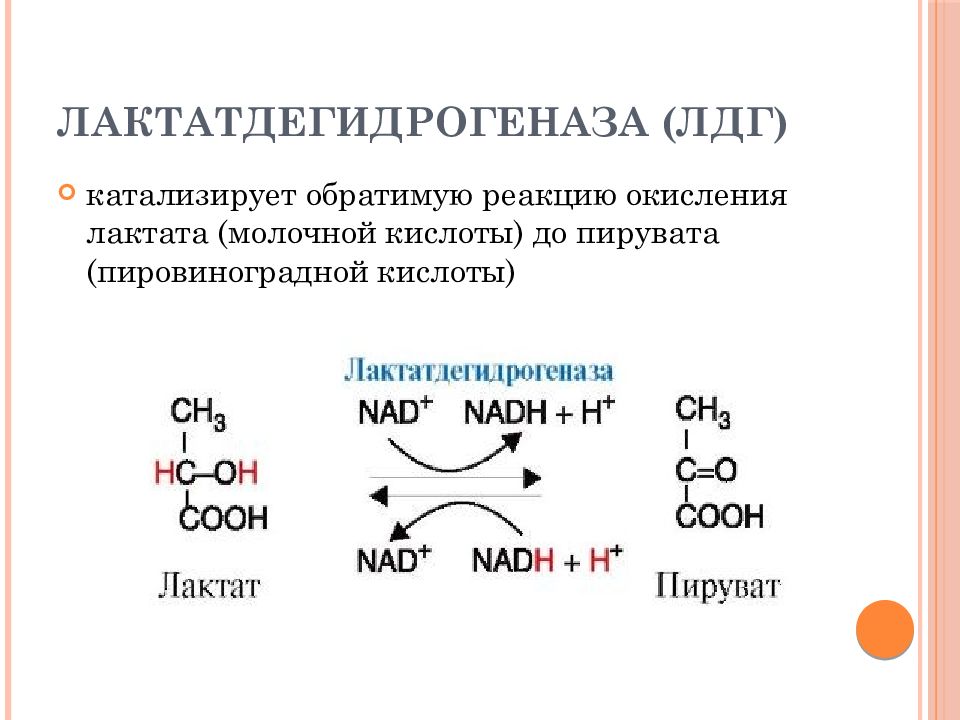
Слайд 65: лактатдегидрогеназа (ЛДГ)
катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
Слайд 66: Лактатдегидрогеназа (структура)
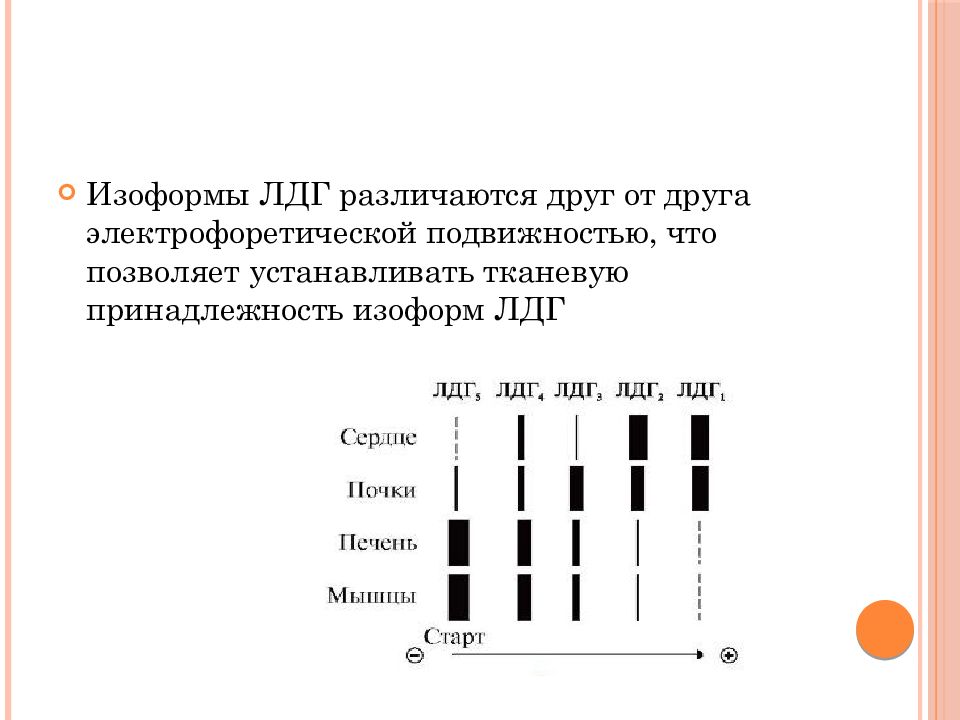
олигомерный белок с мол. массой 134 000, состоящий из четырех субъединиц двух типов - М (от англ. muscle - мышца) и Н (от англ. heart - сердце). комбинация этих субъединиц лежит в основе формирования пяти изоформ ЛДГ ЛДГ 1 и ЛДГ 2 наиболее активны в сердечной мышце и почках, ЛДГ 4 и ЛДГ 5 - в скелетных мышцах и печени.
Слайд 67
Изоформы ЛДГ различаются друг от друга электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ
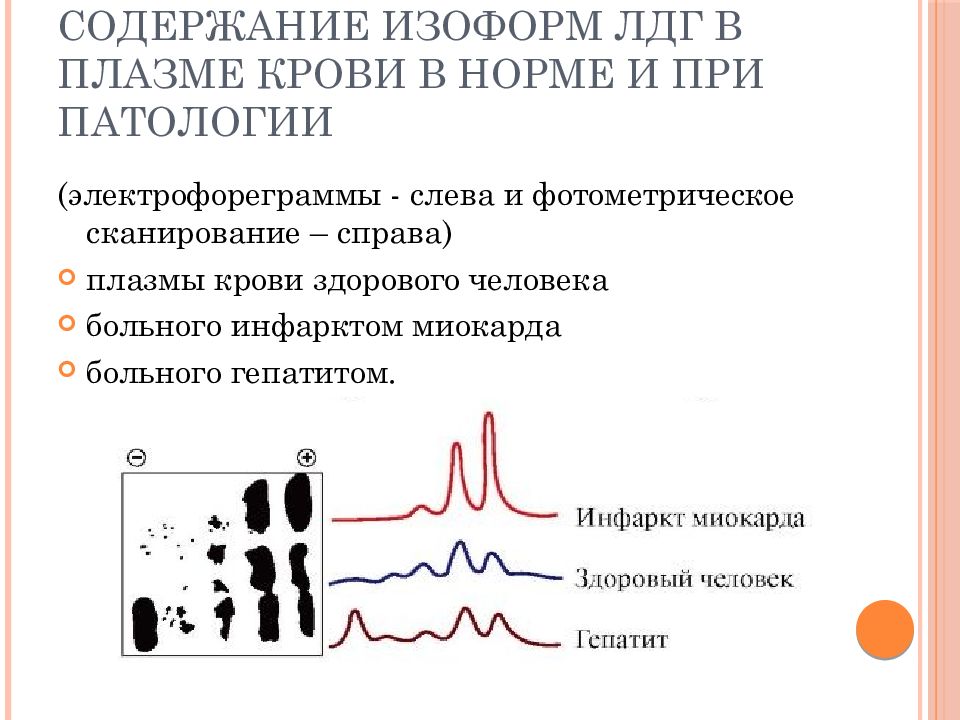
Слайд 68: содержание изоформ ЛДГ в плазме крови в норме и при патологии
( электрофореграммы - слева и фотометрическое сканирование – справа) плазмы крови здорового человека больного инфарктом миокарда больного гепатитом.
Слайд 69: Применение ферментов в качестве лекарственных препаратов
заместительная терапия - использование ферментов в случае их недостаточности; элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Слайд 70
Например, пепсин используют при гастритах со сниженной секреторной функцией. Дефицит панкреатических ферментов -прием внутрь препаратов, содержащих основные ферменты поджелудочной железы ( фестал, энзистал, мезимфорте и др.).
Слайд 71
Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеаза и дезоксирибонуклеаза используются в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитах.
Слайд 72
С целью разрушения тромба при тромбозах и тромбоэмболиях используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы. Фермент гиалуронидазу ( лидазу ), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания спаек и рубцов после ожогов и операций.
Слайд 73
Фермент аспарагиназа (разрушает аминокислоту Асн в крови) используется при онкологических заболеваниях крови, ограничивая поступление аминокислоты Асн в опухолевые клетки. Лейкозные клетки не способны к самостоятельному синтезу этой аминокислоты, поэтому снижение ее содержания в крови нарушает опухолевый рост.
Слайд 74: ЭНЗИМОПАТИИ - нарушение функционирования ферментов в клетке
первичные (наследственные) и вторичные (приобретенные). При первичных энзимопатиях дефектные ферменты наследуются в основном, по рецессивно-аутосомному типу. При этом нарушается метаболический путь, содержащий дефектный фермент, следовательно: • нарушается образование конечных продуктов, что вызывает недостаток определенных веществ (например, при альбинизме не вырабатывается пигмент в клетках кожи); • накапливаются субстраты-предшественники, оказывающие токсическое действие на организм (например, при алкаптонурии накапливается промежуточный метаболит - гомогентезиновая кислота, которая откладывается в суставах, вызывая воспалительные процессы).
Слайд 75: Задания для самостоятельной работы
Используя литературу и сеть интернет, опишите современные методы биохимии: иммуноферментный анализ, электрофорез, ПЦР-реакции. Раскройте значение этих методов для профилактики заболеваний человека.
Последний слайд презентации: Введение в биологическую химию Энзимология: Литература
Список основной литературы Биологическая химия с упражнениями и задачами : учебник / ред. С. Е. Северин. - М. : ГЭОТАР-Медиа, 2013. - 624 с. Список дополнительной литературы Биохимия : учебник для вузов / ред. Е. С. Северин. - М. : ГЭОТАР-Медиа, 2007. - 784 с. Биологическая химия : учебник для студ.мед.вузов / А. Я. Николаев. - М. : Мед.информ.агентство, 2007. - 568 с. Клиническая биохимия : электронное учебное издание / сост. И. В. Пикалов, Э. Я. Журавская, В. В. Кузьмина [и др.]. - Новосибирск : Центр очно-заочного образования ГОУ ВПО НГМУ Росздрава, 2008 Вторично-активный транспорт [Электронный ресурс] / Ю. И. Савченков, Ю. И. Савченков. - б/м : б/и, 2012 Биохимия / Г. Е. Осипова,. Г. Осипова. - Новосибирск : НГПУ, 2014. - 182 с.