Первый слайд презентации: ЛЕКЦИЯ № 1
Введение в биохимию. Ферменты 1. ГБОУ ВПО УГМУ Минздрава РФ Кафедра биохимии Екатеринбург, 2015г Дисциплина: Биохимия Лектор: Гаврилов И.В. Факультет: лечебно-профилактический, Курс: 2
Слайд 2: План лекции
Биохимия – как наука. Предмет, цели и задачи биохимии. Метаболизм. Основные понятия. Виды метаболических реакций. Ферменты – природные катализаторы. Ферменты. Определение, химическая природа, физико-химические свойства, биологическое значение. Сравнение ферментов и неорганических катализаторов Строение ферментов
Слайд 3: Биохимия – наука, изучающая вещества, входящие в состав живых организмов, их превращения, а также взаимосвязь этих превращений с деятельностью органов и тканей
Биохимия – молодая наука, около ста лет назад она возникла на стыке физиологии и органической химии. Термин биохимия ввел в 1903г молодой немецкий биохимик Карл Нейберг (1877-1956). I. БИОХИМИЯ
Слайд 4
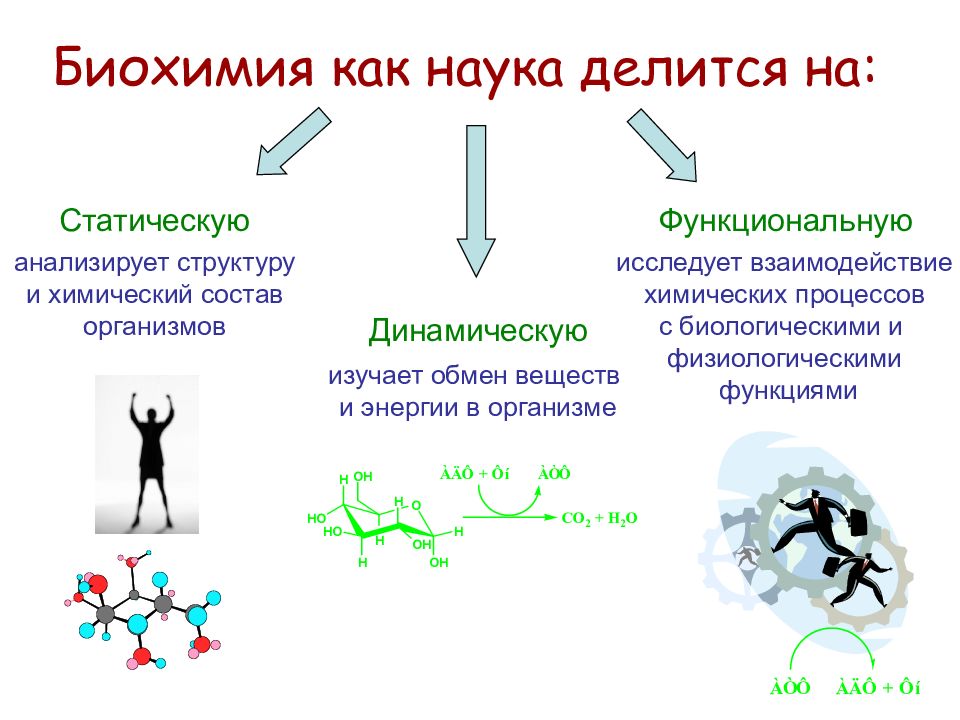
Биохимия как наука делится на: Статическую анализирует структуру и химический состав организмов Динамическую изучает обмен веществ и энергии в организме Функциональную исследует взаимодействие химических процессов с биологическими и физиологическими функциями
Слайд 5: По объектам исследования, биохимия делится на:
биохимию человека и животных; биохимию растений; биохимию микроорганизмов; биохимию вирусов Мы с вами будем заниматься медицинской биохимией, одним из разделов биохимии человека и животных
Слайд 6
Объектом медицинской биохимии является человек Целью курса медицинской биохимии является изучение: молекулярных основ физиологических функций человека; молекулярных механизмов патогенеза болезней; биохимических основ предупреждения и лечения болезней; биохимических методов диагностики болезней и контроля эффективности лечения ( клиническая биохимия) Задачи курса медицинской биохимии: изучить теоретический материал; получить практический навык биохимических исследований; научиться интерпретировать результаты биохимических исследований
Слайд 7: II. Метаболизм
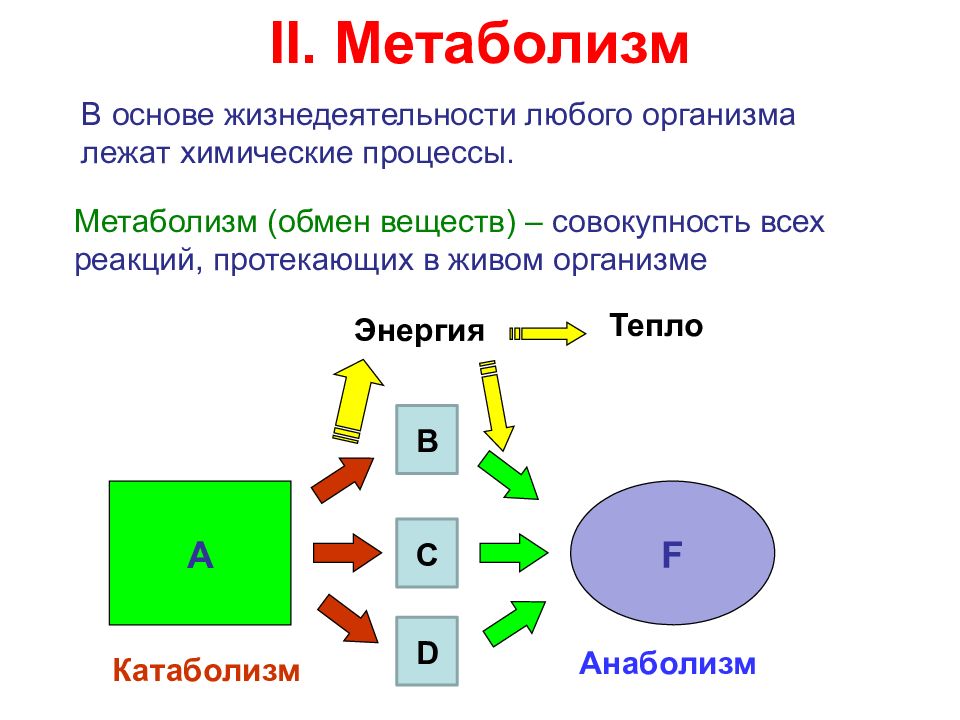
В основе жизнедеятельности любого организма лежат химические процессы. Метаболизм (обмен веществ) – совокупность всех реакций, протекающих в живом организме А F B C D Энергия Тепло Катаболизм Анаболизм
Слайд 8
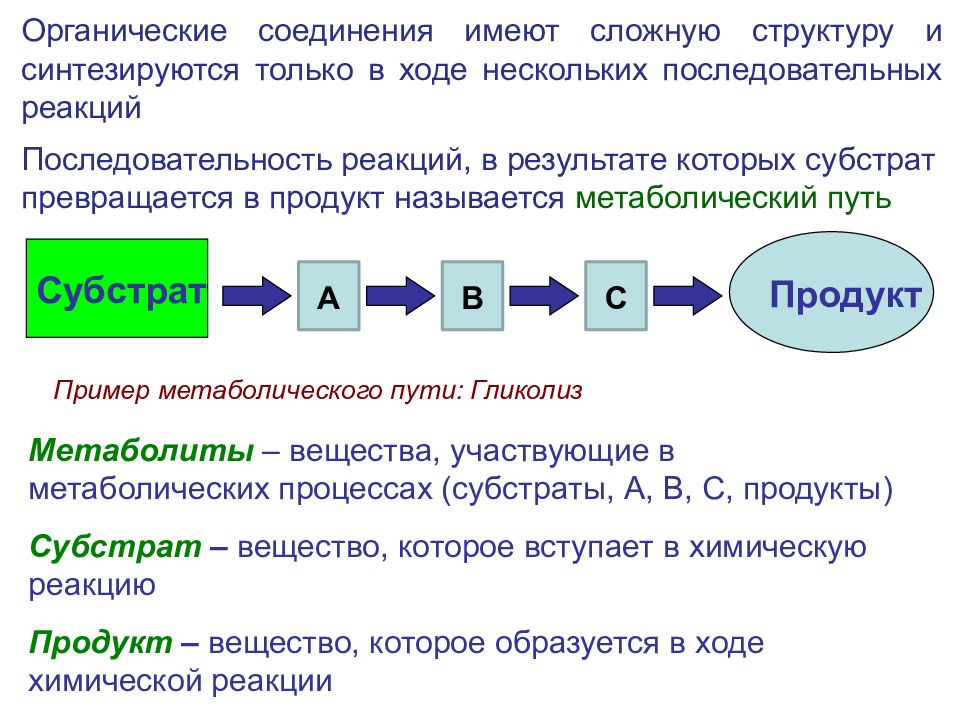
Метаболиты – вещества, участвующие в метаболических процессах (субстраты, А, В, С, продукты) Субстрат – вещество, которое вступает в химическую реакцию Продукт – вещество, которое образуется в ходе химической реакции Субстрат Продукт Последовательность реакций, в результате которых субстрат превращается в продукт называется метаболический путь А В С Органические соединения имеют сложную структуру и синтезируются только в ходе нескольких последовательных реакций Пример метаболического пути: Гликолиз
Слайд 9
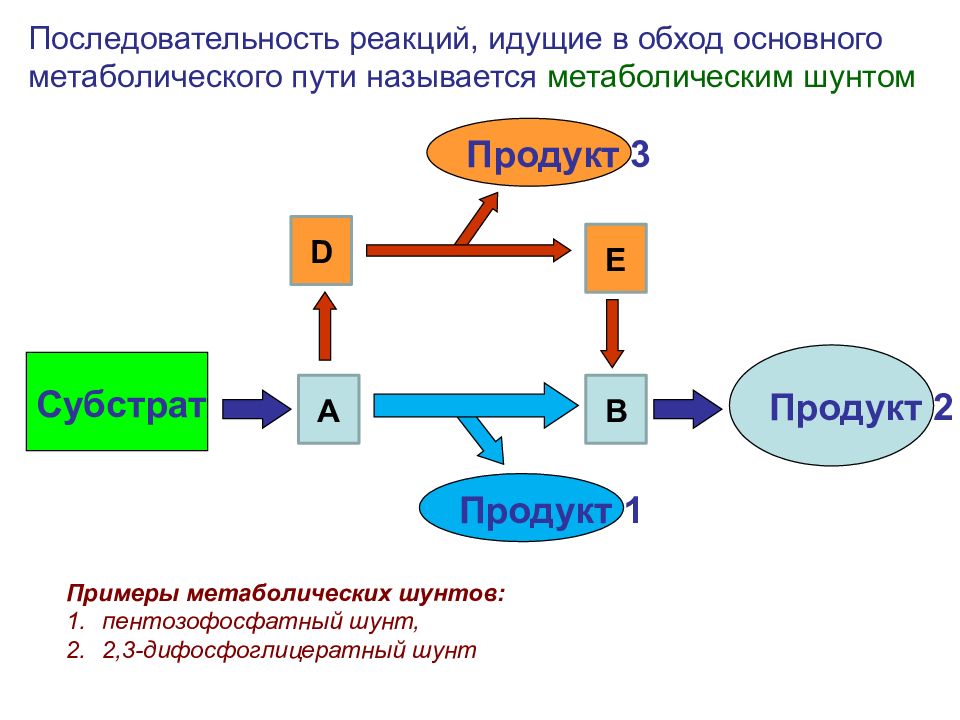
Субстрат Продукт 2 Последовательность реакций, идущие в обход основного метаболического пути называется метаболическим шунтом А В D E Продукт 3 Продукт 1 Примеры метаболических шунтов: пентозофосфатный шунт, 2,3-дифосфоглицератный шунт
Слайд 10
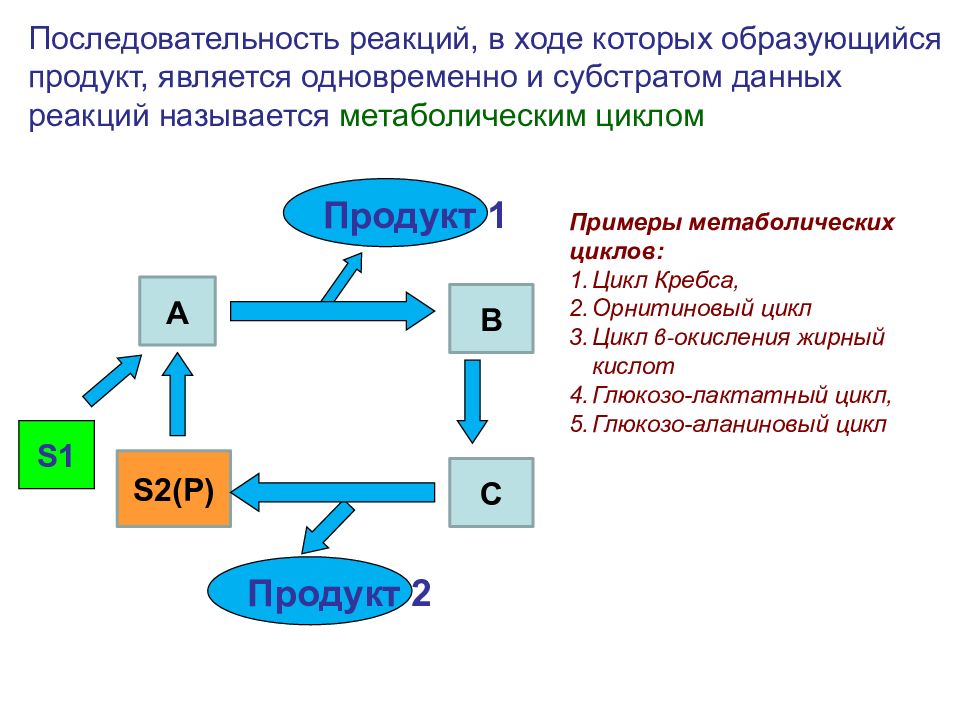
S1 Последовательность реакций, в ходе которых образующийся продукт, является одновременно и субстратом данных реакций называется метаболическим циклом S2(P) A C B Продукт 1 Продукт 2 Примеры метаболических циклов: Цикл Кребса, Орнитиновый цикл Цикл β - окисления жирный кислот Глюкозо-лактатный цикл, Глюкозо-аланиновый цикл
Слайд 11: Практически все реакции в живом организме протекают с участием природных биокатализаторов – ферментов (энзимов)
III. Ферменты Ферменты – биологические катализаторы белковой природы Биологическая роль Биологическая роль ферментов заключается в том, что они катализируют контролируемое протекание всех метаболических процессов в организме Физико-химические свойства Являясь веществами белкой природы, ферменты обладают всеми свойствами белков Определение и химическая природа К 2013 году было описано более 5000 разных ферментов
Слайд 12: Особенности действия ферментов
Ускоряют только термодинамически возможные реакции Не изменяют состояние равновесия реакций, а только ускоряют его достижение реакции ускоряют значительно, в 10 8 -10 14 раз В реакциях не расходуются Действуют в малых количествах Чувствительны к активаторам и ингибиторам. Активность ферментов регулируется специфическими и неспецифическими факторами Ферменты действуют только в мягких условиях (t = 36-37ºС, рН ~ 7,4, атмосферное давление) Обладают широким диапазоном действия, катализируют большинство реакций в организме Для ферментов характерна высокая специфичность субстратная специфичность : ▪ абсолютная (1 фермент - 1 субстрат), ▪ групповая (1 фермент – несколько похожих субстратов), ▪ стереоспецифичность (ферменты работают с субстратами L или D ). • каталитическая специфичность (ферменты катализируют реакции одного из типов химических реакций)
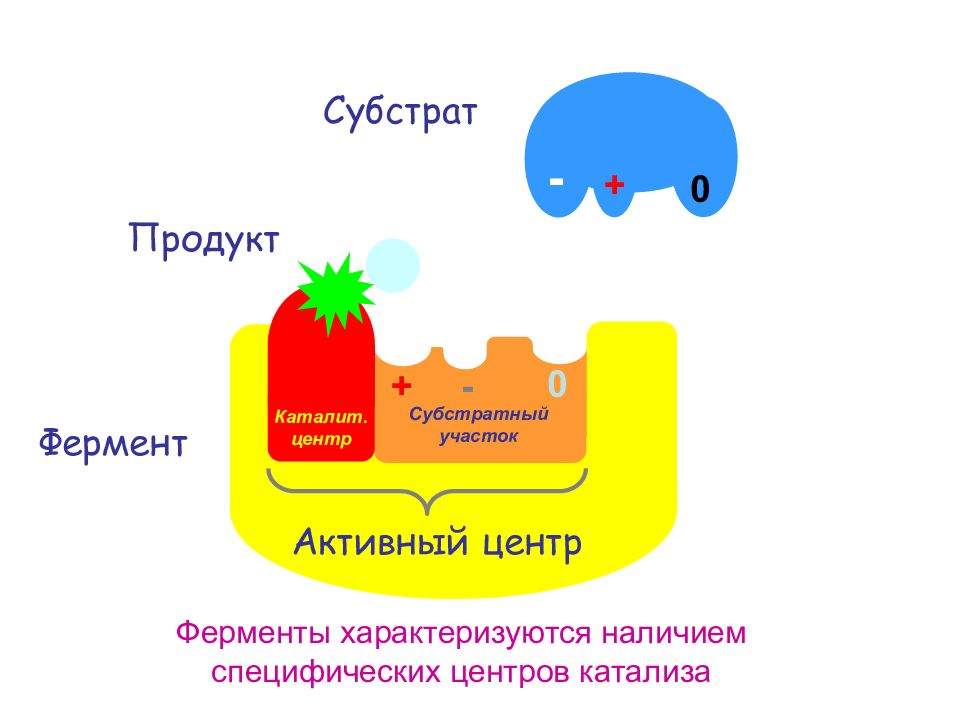
Слайд 13: 1. Активный центр – это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное участие в катализе
б). Каталитический центр Активный центр, как правило, находиться в нише (кармане) Содержит, не менее трех точек для связывания субстрата, благодаря чему молекула субстрата присоединяется к активному центру единственно возможным способом, что обеспечивает субстратную специфичность фермента 1. Активный центр а). Субстратный участок (контактная площадка) Особенность строения каталитического центра дает возможность ферменту катализировать реакцию с помощью определенного механизма катализа: кислотно-основного, электрофильного, нуклеофильного и т.д. Т.о. каталитический центр обеспечивает выбор пути химического превращения и каталитическую специфичность фермента Строение ферментов Ферменты – глобулярные белки, содержащие активный центр
Слайд 14
Фермент + - 0 Субстрат Ферменты характеризуются наличием специфических центров катализа Субстратный участок Каталит. центр Активный центр + 0 - Продукт
Слайд 15
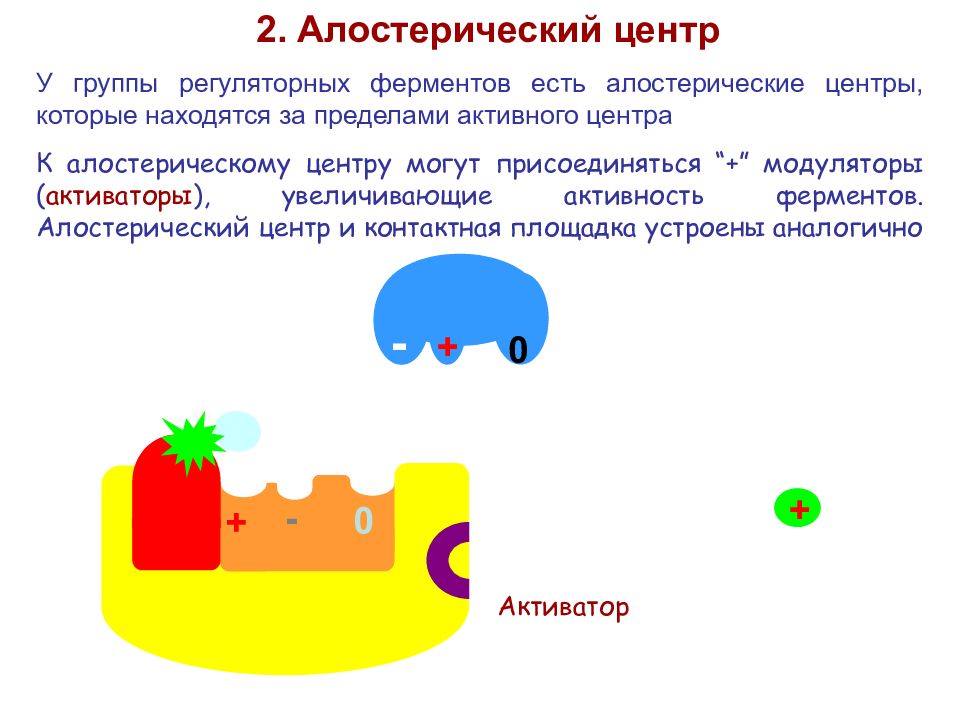
+ - 0 2. Алостерический центр У группы регуляторных ферментов есть алостерические центры, которые находятся за пределами активного центра К алостерическому центру могут присоединяться “+” модуляторы ( активаторы ), увеличивающие активность ферментов. Алостерический центр и контактная площадка устроены аналогично + - 0 + Активатор
Слайд 16
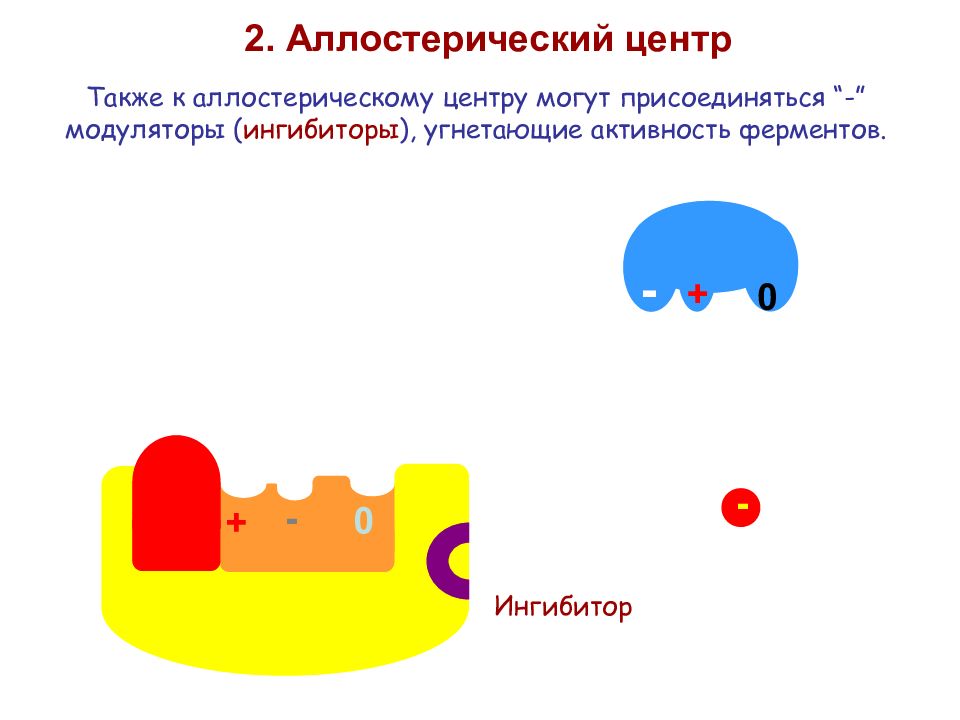
+ - 0 2. Аллостерический центр Также к аллостерическому центру могут присоединяться “-” модуляторы ( ингибиторы ), угнетающие активность ферментов. - 0 + Ингибитор -
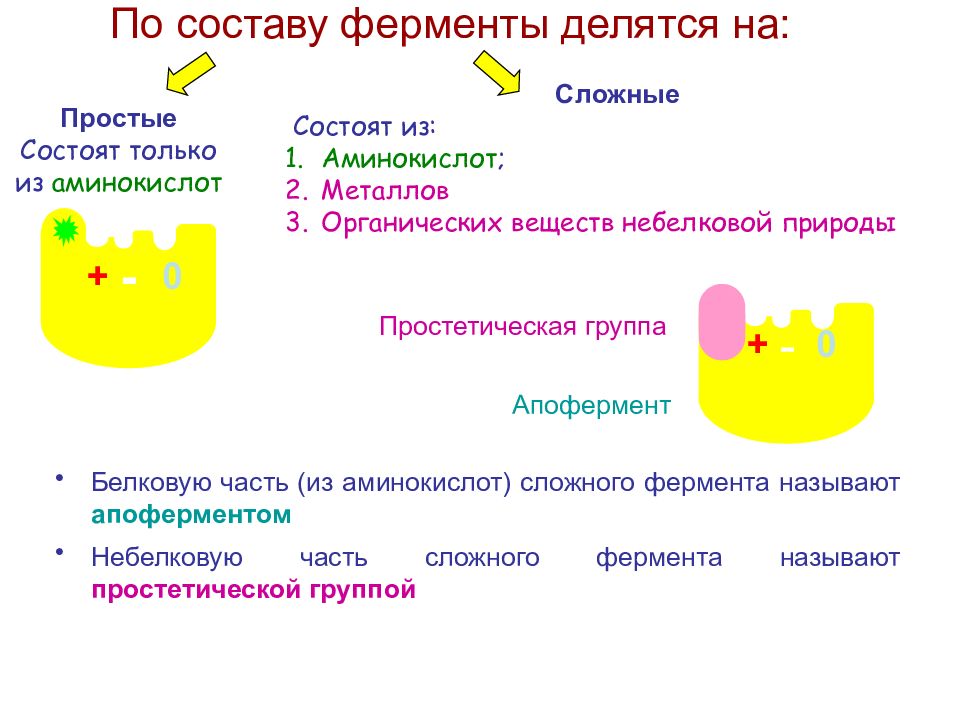
Слайд 17: По составу ферменты делятся на:
Простые Состоят только из аминокислот - Сложные Состоят из: Аминокислот ; Металлов Органических веществ небелковой природы 0 + Апофермент Простетическая группа + - 0 Белковую часть (из аминокислот) сложного фермента называют апоферментом Небелковую часть сложного фермента называют простетической группой
Слайд 18
Коферментами называют органические вещества небелковой природы, которые участвуют в катализе в составе каталитического участка активного центра. Каталитически активную форму сложного белка называют холоферментом Холофермент = Апофермент + Кофермент Простетическая группа прочно связана с апоферментом. В сложном ферменте простетическая группа может быть представлена: Металлами (кофактороры) органическими веществами небелковой природы (коферменты)
Слайд 19
В качестве коферментов функционируют: Витамины Активация Коферменты РР (никотиновая кислота) НАД +, НАДФ + В 1 (тиамин) В 2 (рибофлавин) Тиаминпирофосфат ФАД, ФМН В 6 (пиридоксаль) Пиридоксальфосфат В 12 Кобаламины Гемы; Нуклеотиды; коэнзим Q ; ФАФС; SAM ; Глутатион; Производные водорастворимых витаминов:
Слайд 20
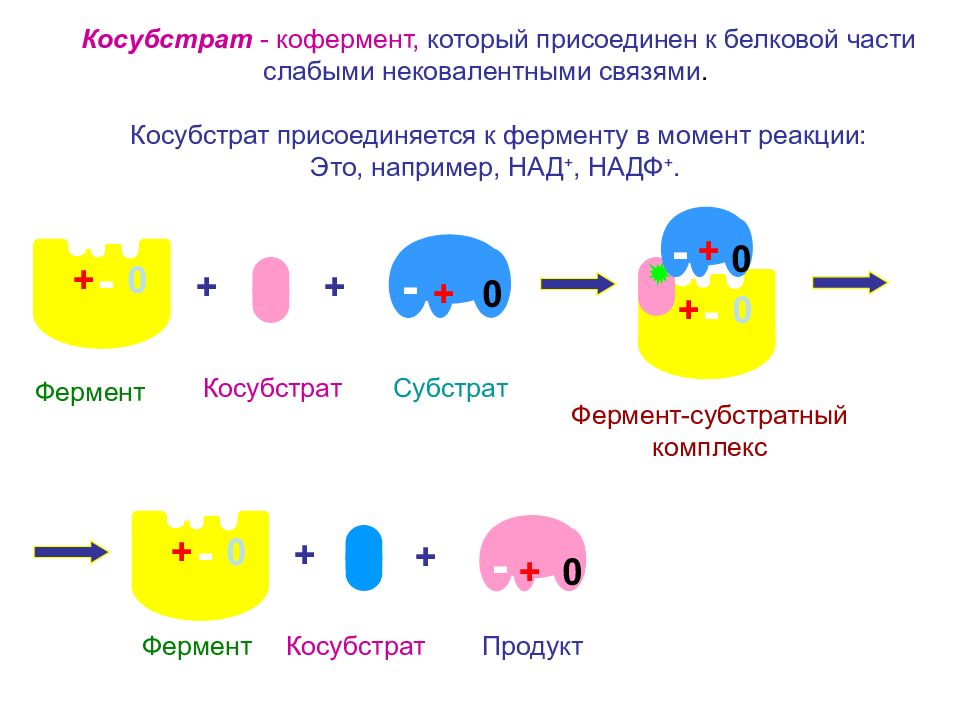
- 0 + + - 0 + + - 0 + + - 0 Косубстрат - кофермент, который присоединен к белковой части слабыми нековалентными связями. Косубстрат присоединяется к ферменту в момент реакции: Это, например, НАД +, НАДФ +. + - 0 + Продукт Фермент + Субстрат Фермент Косубстрат Фермент-субстратный комплекс Косубстрат - 0 +
Слайд 21
Кофакторы – это ионы металлов, необходимые для проявления каталитической активности многих ферментов В качестве кофакторов выступают ионы калия, магния, кальция, цинка, меди, железа и т.д. стабилизируют молекулы субстрата; стабилизируют активный центр фермента, стабилизируют третичную и четвертичную структуру фермента; обеспечивают связывание субстрата; обеспечивают катализ. Роль кофакторов разнообразна, они:
Слайд 22
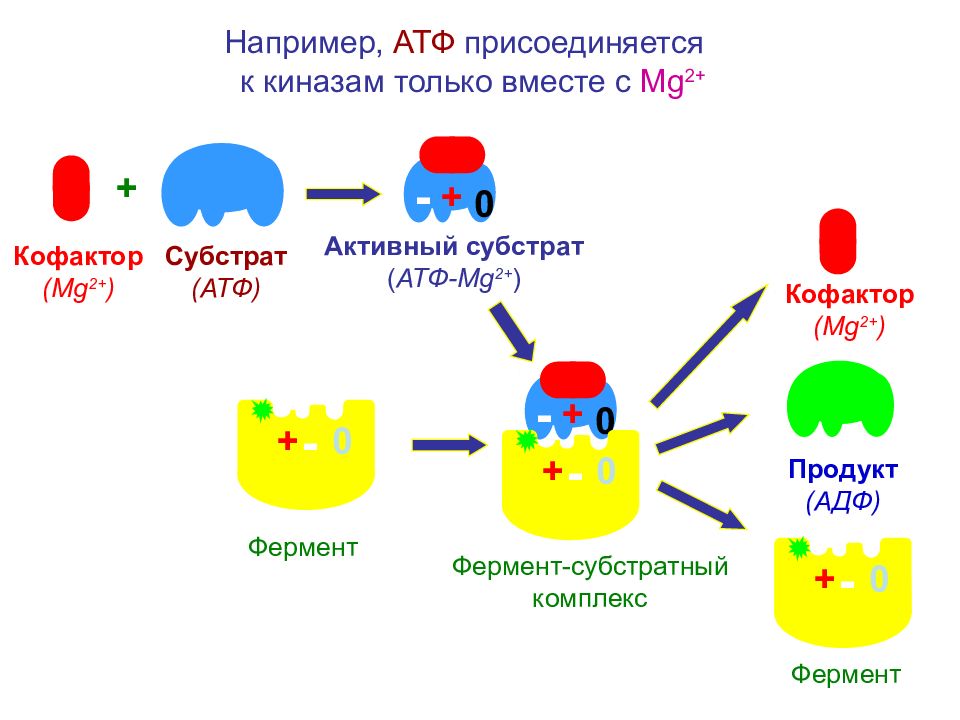
Например, АТФ присоединяется к киназам только вместе с Mg 2+ + Субстрат ( АТФ ) Кофактор ( Mg 2+ ) + - 0 Фермент Активный субстрат ( АТФ- Mg 2+ ) - 0 + + - 0 - 0 + Фермент-субстратный комплекс Продукт (АДФ) - 0 + Фермент Кофактор ( Mg 2+ )
Слайд 23
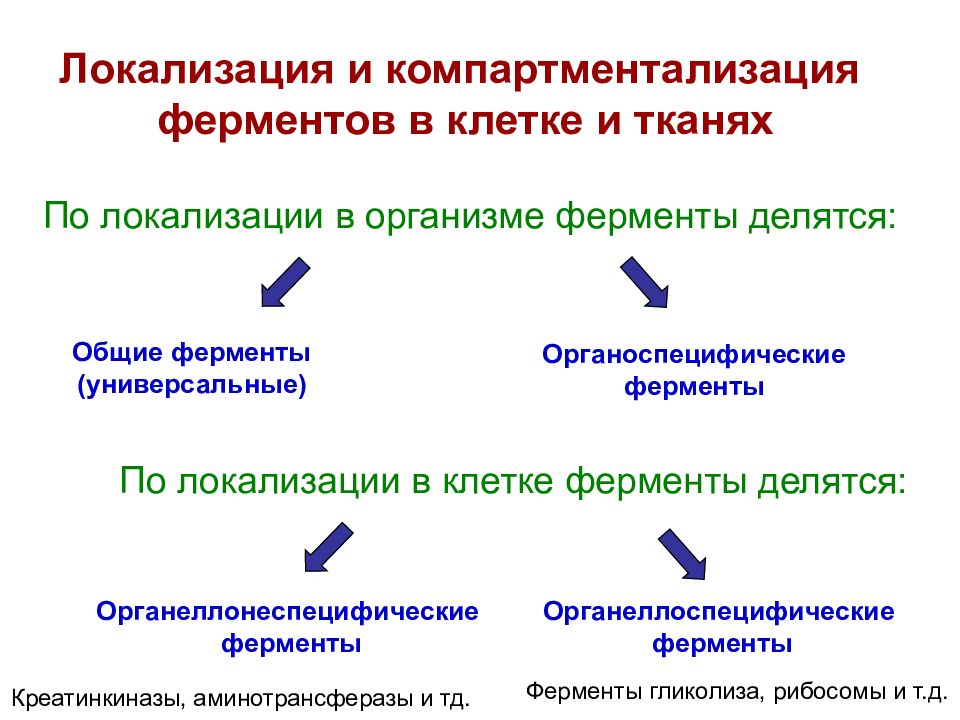
Локализация и компартментализация ферментов в клетке и тканях По локализации в организме ферменты делятся: Общие ферменты (универсальные) Органоспецифические ферменты Органеллоспецифические ферменты Органеллонеспецифические ферменты По локализации в клетке ферменты делятся: Креатинкиназы, аминотрансферазы и тд. Ферменты гликолиза, рибосомы и т.д.
Слайд 24
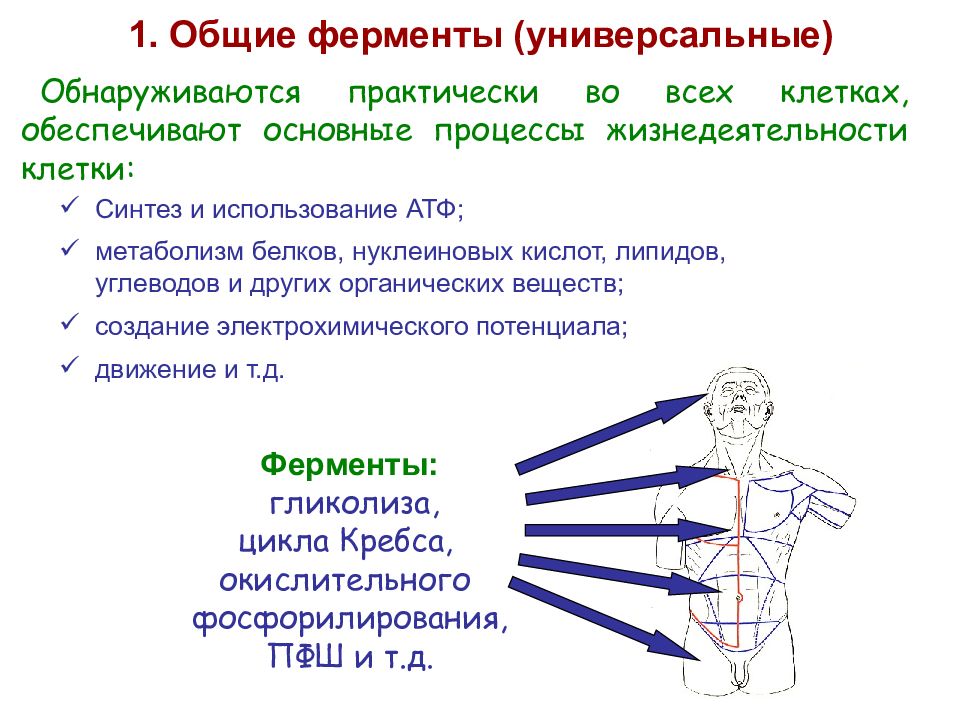
Обнаруживаются практически во всех клетках, обеспечивают основные процессы жизнедеятельности клетки: 1. Общие ферменты (универсальные) Ферменты: гликолиза, цикла Кребса, окислительного фосфорилирования, ПФШ и т.д. Синтез и использование АТФ; метаболизм белков, нуклеиновых кислот, липидов, углеводов и других органических веществ; создание электрохимического потенциала; движение и т.д.
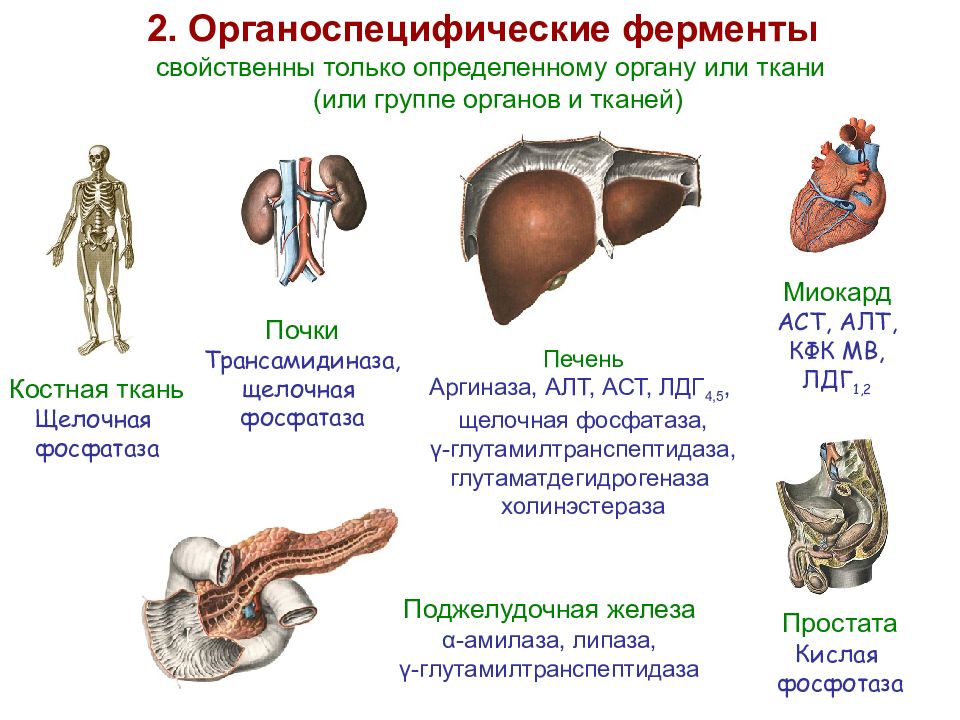
Слайд 25: 2. Органоспецифические ферменты
Костная ткань Щелочная фосфатаза Миокард АСТ, АЛТ, КФК МВ, ЛДГ 1,2 Почки Трансамидиназа, щелочная фосфатаза Печень Аргиназа, АЛТ, АСТ, ЛДГ 4,5, щелочная фосфатаза, γ -глутамилтранспептидаза, глутаматдегидрогеназа холинэстераза свойственны только определенному органу или ткани (или группе органов и тканей) Простата Кислая фосфотаза Поджелудочная железа α-амилаза, липаза, γ -глутамилтранспептидаза
Слайд 26
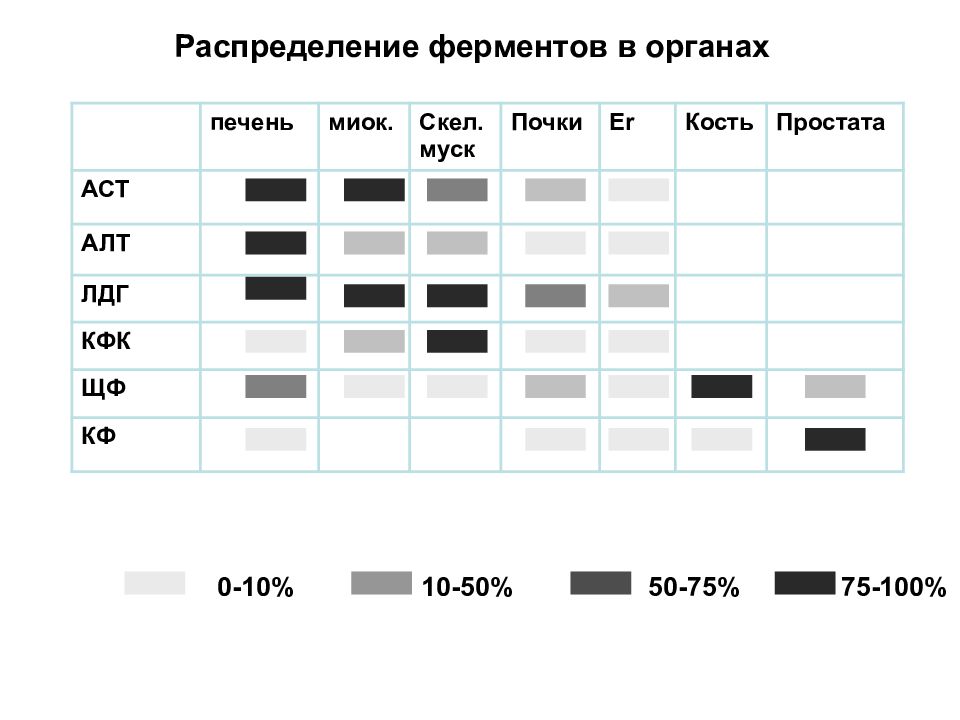
Распределение ферментов в органах печень миок. Скел. муск Почки Er Кость Простата АСТ АЛТ ЛДГ КФК ЩФ КФ 0-10% 10-50% 50-75% 75-100%
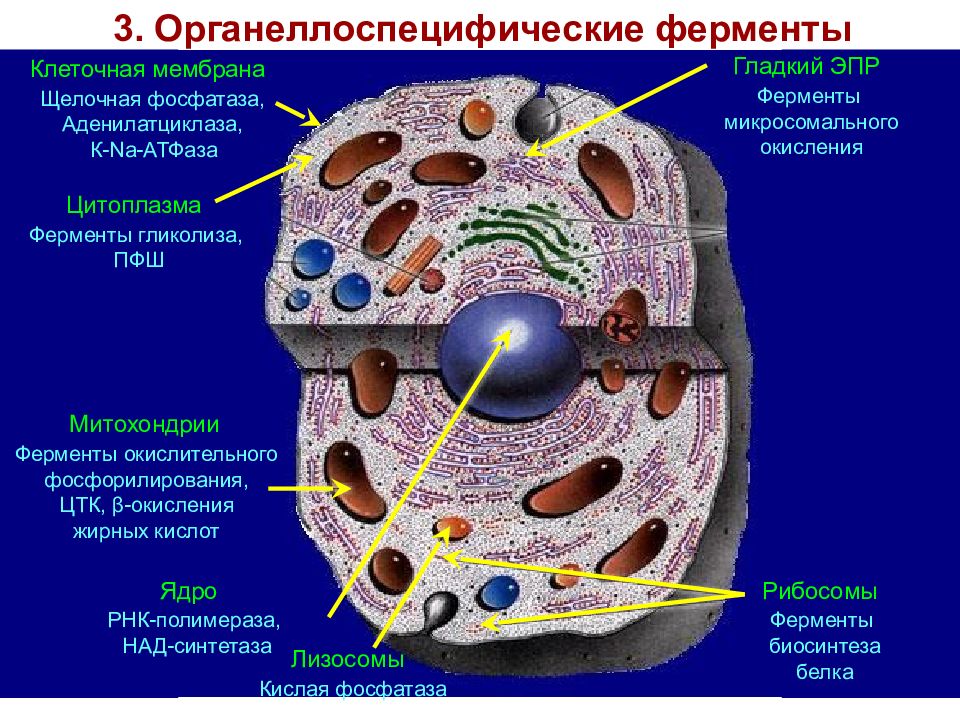
Слайд 27: 3. Органеллоспецифические ферменты
Клеточная мембрана Щелочная фосфатаза, Аденилатциклаза, К-Nа-АТФаза Цитоплазма Ферменты гликолиза, ПФШ Гладкий ЭПР Ферменты микросомального окисления Рибосомы Ферменты биосинтеза белка Лизосомы Кислая фосфатаза Митохондрии Ферменты окислительного фосфорилирования, ЦТК, β-окисления жирных кислот Ядро РНК-полимераза, НАД-синтетаза
Слайд 28
Изоферменты – это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие первичной структурой Изоферменты отличаются: сродством к субстрату (разные Км), максимальной скорости катализируемой реакции, электрофоретической подвижности, разной чувствительности к ингибиторам и активаторам, оптимуму рН термостабильности Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц (2, 4, 6 и т.д.): Изоферменты
Слайд 29
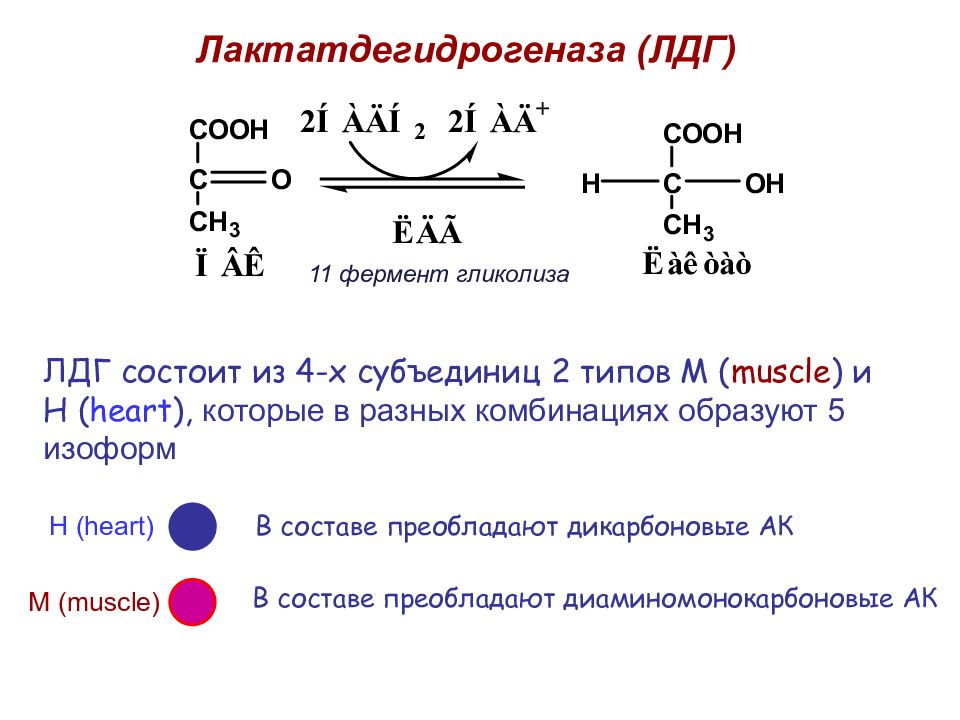
Лактатдегидрогеназа (ЛДГ) ЛДГ состоит из 4-х субъединиц 2 типов М ( muscle ) и Н ( heart ), которые в разных комбинациях образуют 5 изоформ М ( muscle ) Н ( heart ) В составе преобладают дикарбоновые АК В составе преобладают диаминомонокарбоновые АК 11 фермент гликолиза
Слайд 30
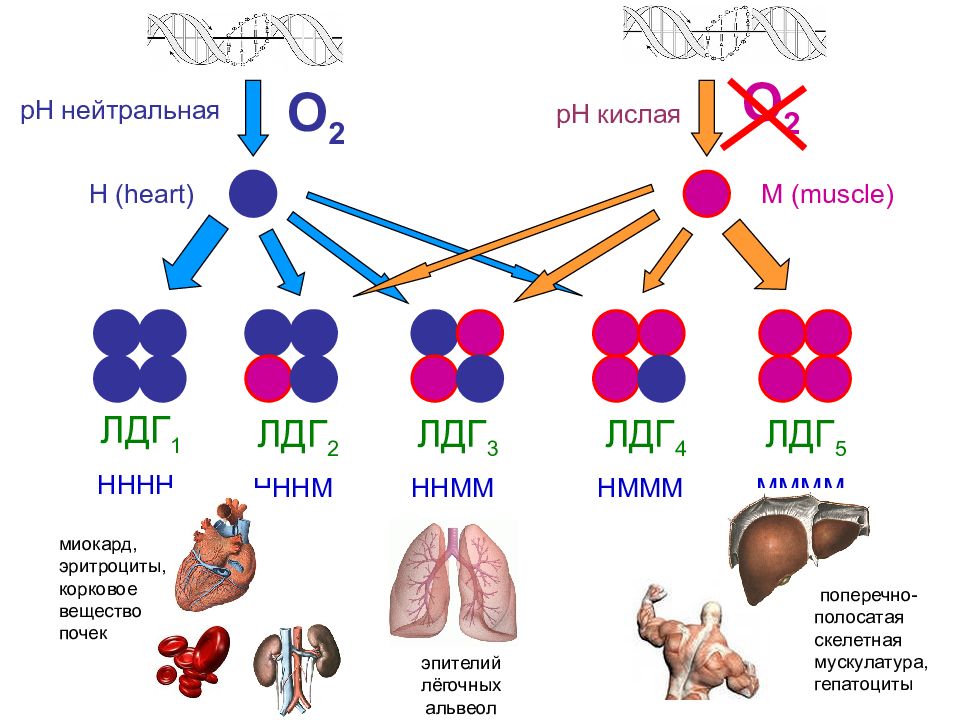
ЛДГ 1 НННН ЛДГ 2 НННМ ЛДГ 3 ННММ ЛДГ 4 НМММ ЛДГ 5 ММММ О 2 О 2 Н ( heart ) М ( muscle ) эпителий лёгочных альвеол миокард, эритроциты, корковое вещество почек поперечно-полосатая скелетная мускулатура, гепатоциты рН нейтральная рН кислая
Слайд 31
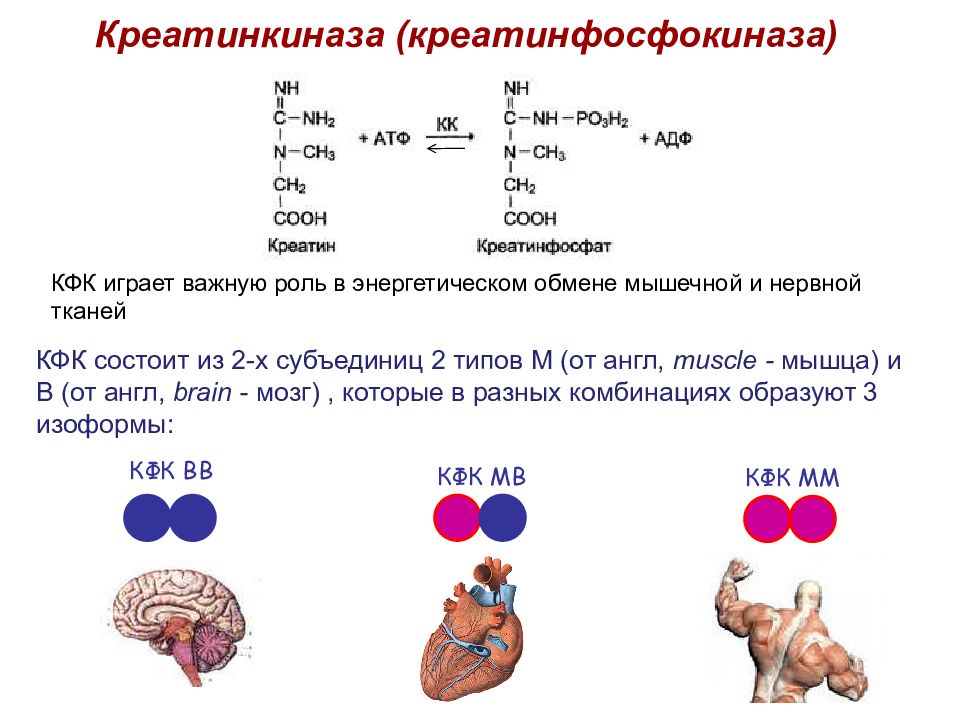
Креатинкиназа (креатинфосфокиназа) КФК состоит из 2-х субъединиц 2 типов М (от англ, muscle - мышца) и В (от англ, brain - мозг), которые в разных комбинациях образуют 3 изоформы : КФК ВВ КФК МВ КФК ММ КФК играет важную роль в энергетическом обмене мышечной и нервной тканей
Слайд 32
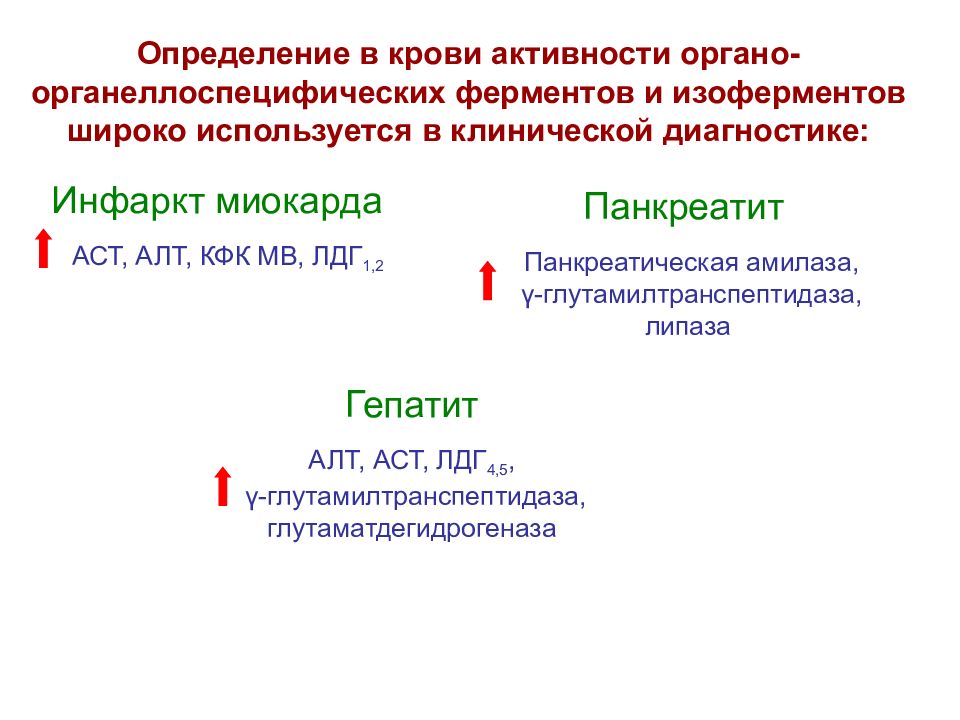
Определение в крови активности органо- органеллоспецифических ферментов и изоферментов широко используется в клинической диагностике: Инфаркт миокарда АСТ, АЛТ, КФК МВ, ЛДГ 1,2 Панкреатит Панкреатическая амилаза, γ -глутамилтранспептидаза, липаза Гепатит АЛТ, АСТ, ЛДГ 4,5, γ -глутамилтранспептидаза, глутаматдегидрогеназа
Слайд 33
Номенклатура – названия индивидуальных соединений, их групп, классов, а также правила составления этих названий Классификация – разделение чего-либо по выбранным признакам Номенклатура и классификация ферментов
Слайд 34
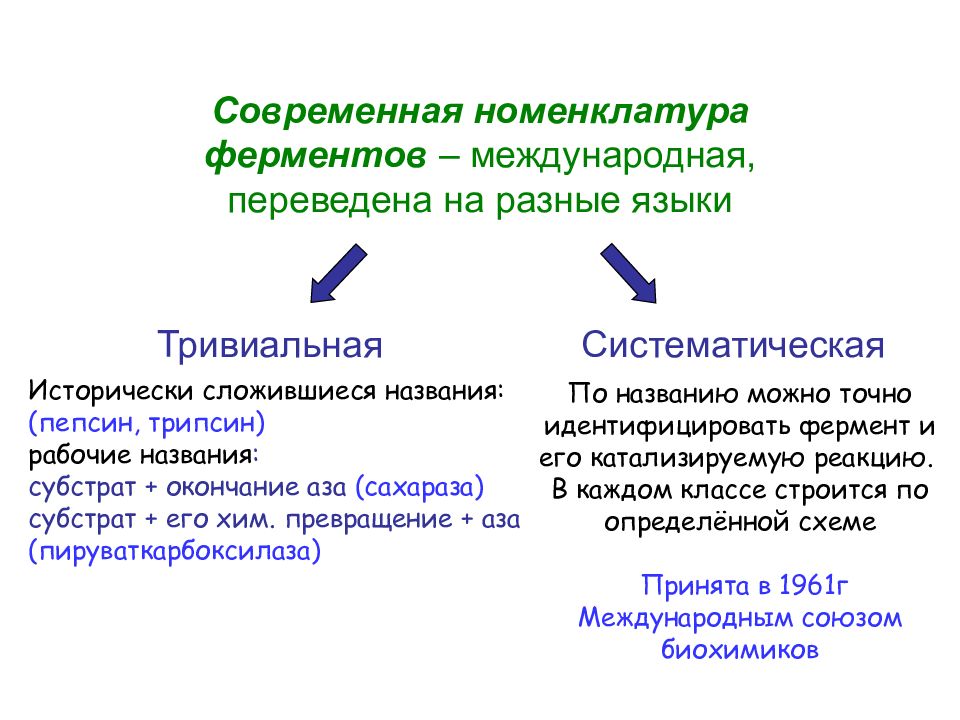
Современная номенклатура ферментов – международная, переведена на разные языки Исторически сложившиеся названия: (пепсин, трипсин) рабочие названия : субстрат + окончание аза (сахараза) субстрат + его хим. превращение + аза (пируваткарбоксилаза) Тривиальная Систематическая По названию можно точно идентифицировать фермент и его катализируемую реакцию. В каждом классе строится по определённой схеме Принята в 1961г Международным союзом биохимиков
Слайд 35
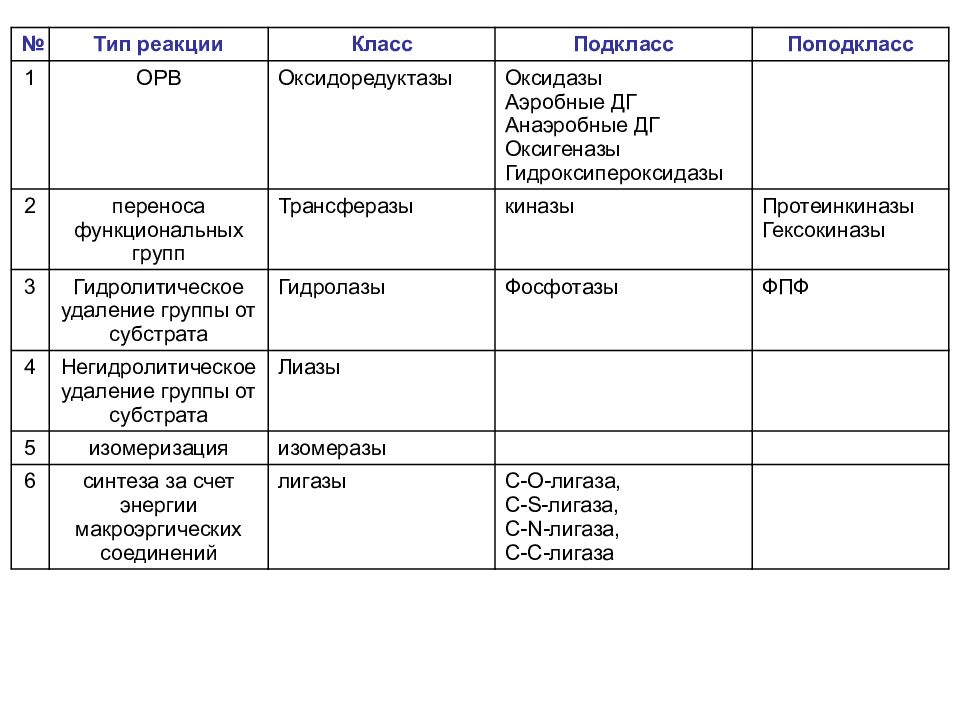
Классификация ферментов Классификация ферментов основана на типе катализируемой химической реакции (всего 6); На основании 6 типов химических реакций ферменты, которые их катализируют, подразделяют на 6 классов, в каждом из которых несколько подклассов и поподклассов (4-13); Каждый фермент имеет свой шифр КФ 1.1.1.1. Первая цифра обозначает класс, вторая - подкласс, третья - подподкласс, четвертая - порядковый номер фермента в его подподклассе (в порядке открытия).
Слайд 36
№ Тип реакции Класс Подкласс Поподкласс 1 ОРВ Оксидоредуктазы Оксидазы Аэробные ДГ Анаэробные ДГ Оксигеназы Гидроксипероксидазы 2 переноса функциональных групп Трансферазы киназы Протеинкиназы Гексокиназы 3 Гидролитическое удаление группы от субстрата Гидролазы Фосфотазы ФПФ 4 Негидролитическое удаление группы от субстрата Лиазы 5 изомеризация изомеразы 6 синтеза за счет энергии макроэргических соединений лигазы C-O-лигаза, C-S-лигаза, C-N-лигаза, C-C-лигаза
Слайд 37
Номенклатура ферментов В правилах названия ферментов нет единого подхода – в каждом классе свои правила Название фермента состоит из 2 частей: 1 часть – название субстрата (субстратов), 2 часть – тип катализируемой реакции. Окончание – АЗА; Дополнительная информация, если необходима, пишется в конце и заключается в скобки: L -малат + НАДФ + ↔ ПВК + СО 2 + НАДН 2 L -малат: НАДФ+ - оксидоредуктаза (декарбоксилирующая);
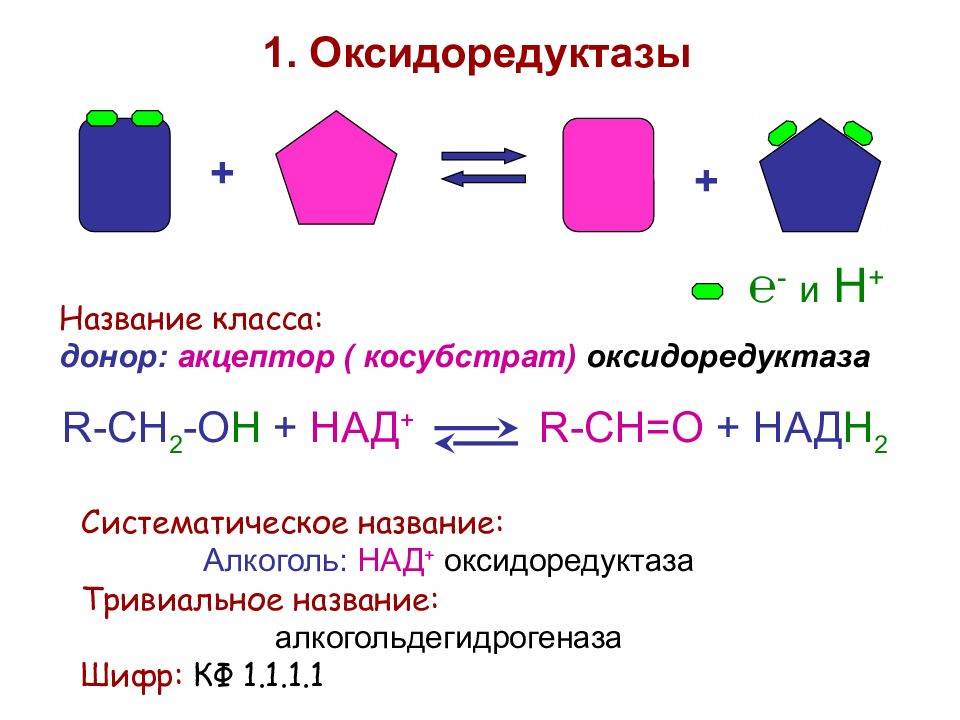
Слайд 38
+ + 1. Оксидоредуктазы Название класса: донор: акцептор ( косубстрат) оксидоредуктаза R - CH 2 - O H + НАД + R - CH =О + НАД Н 2 Систематическое название: Алкоголь: НАД + оксидоредуктаза Тривиальное название: алкогольдегидрогеназа Шифр: КФ 1.1.1.1 ℮ - и Н +
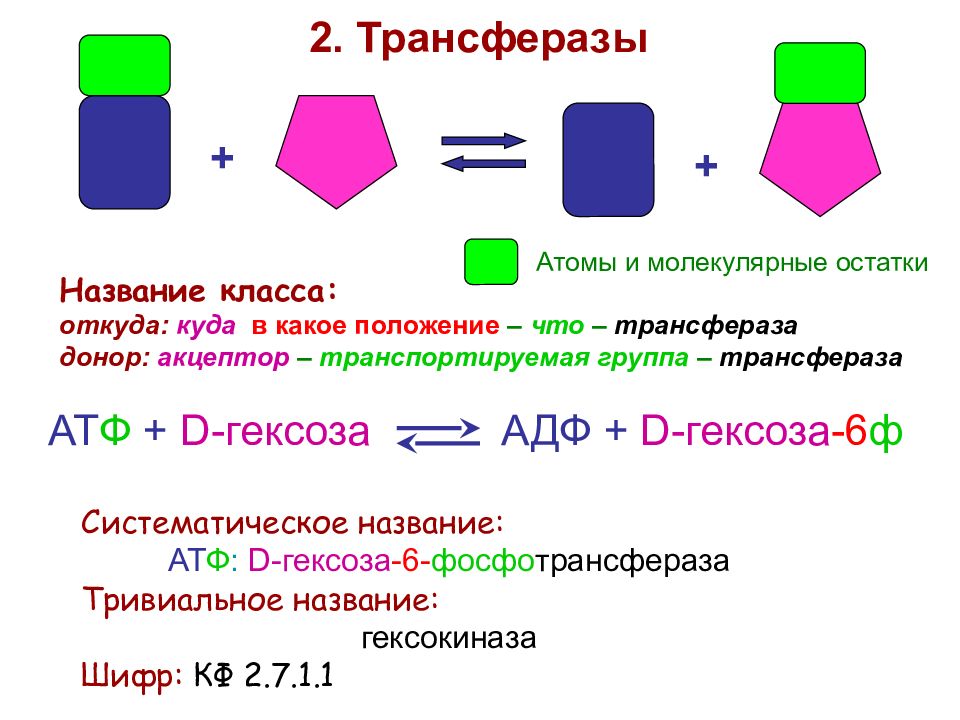
Слайд 39
+ + 2. Трансферазы Название класса: откуда: куда в какое положение – что – трансфераза донор: акцептор – транспортируемая группа – трансфераза АТ Ф + D -гексоза АДФ + D -гексоза -6 ф Систематическое название: АТ Ф : D -гексоза -6- фосфо трансфераза Тривиальное название: гексокиназа Шифр: КФ 2.7.1.1 Атомы и молекулярные остатки
Слайд 40
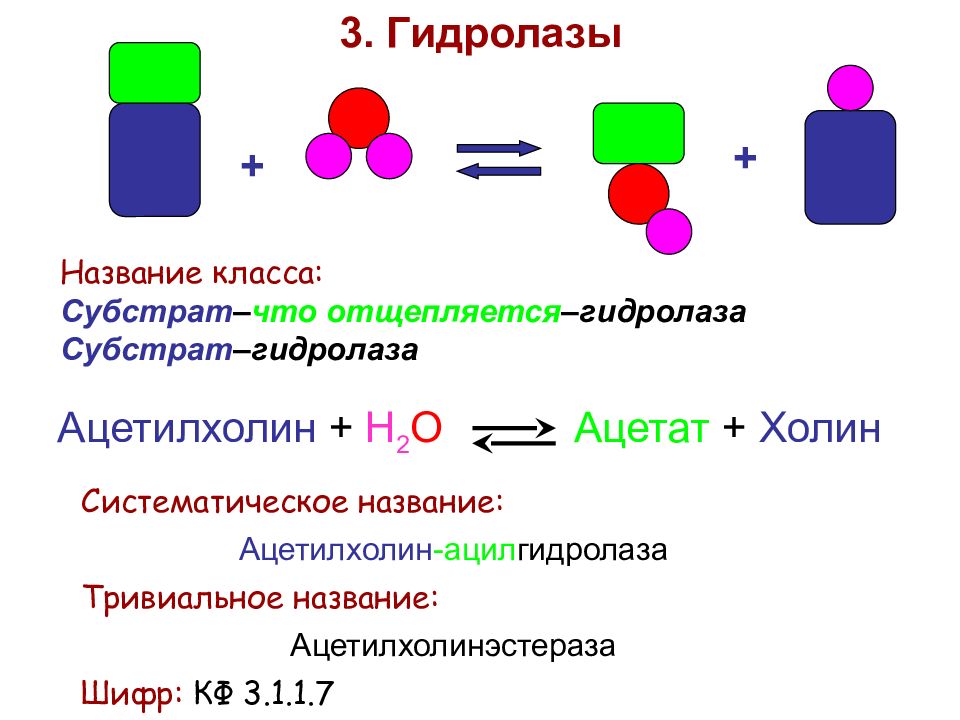
+ + 3. Гидролазы Название класса: Субстрат – что отщепляется –гидролаза Субстрат –гидролаза Ацетилхолин + Н 2 О Ацетат + Холин Систематическое название: Ацетилхолин -ацил гидролаза Тривиальное название: Ацетилхолинэстераза Шифр: КФ 3.1.1.7
Слайд 41
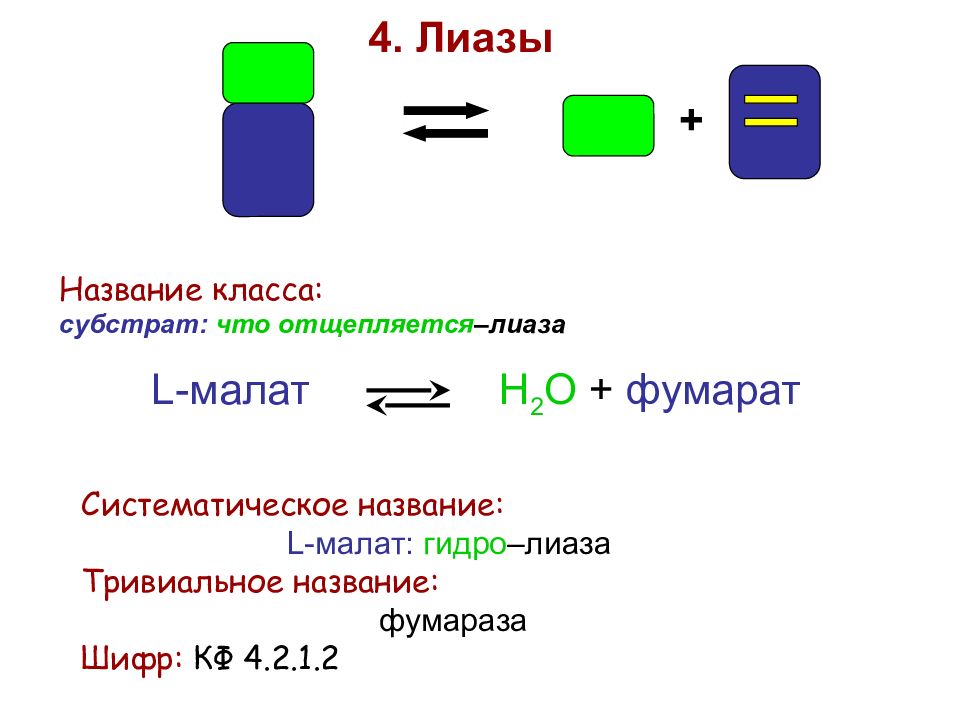
+ 4. Лиазы Название класса: субстрат: что отщепляется –лиаза L-малат Н 2 О + фумарат Систематическое название: L-малат: гидро –лиаза Тривиальное название: фумараза Шифр: КФ 4.2.1.2
Слайд 42
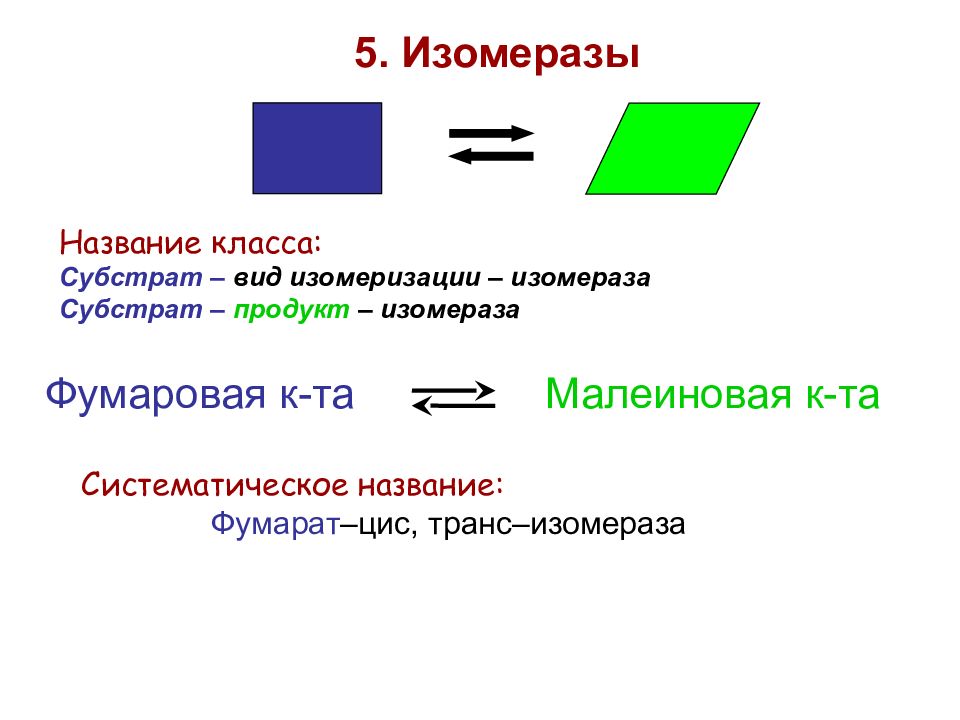
5. Изомеразы Название класса: Субстрат – вид изомеризации – изомераза Субстрат – продукт – изомераза Фумаровая к-та Малеиновая к-та Систематическое название: Фумарат –цис, транс–изомераза
Слайд 43
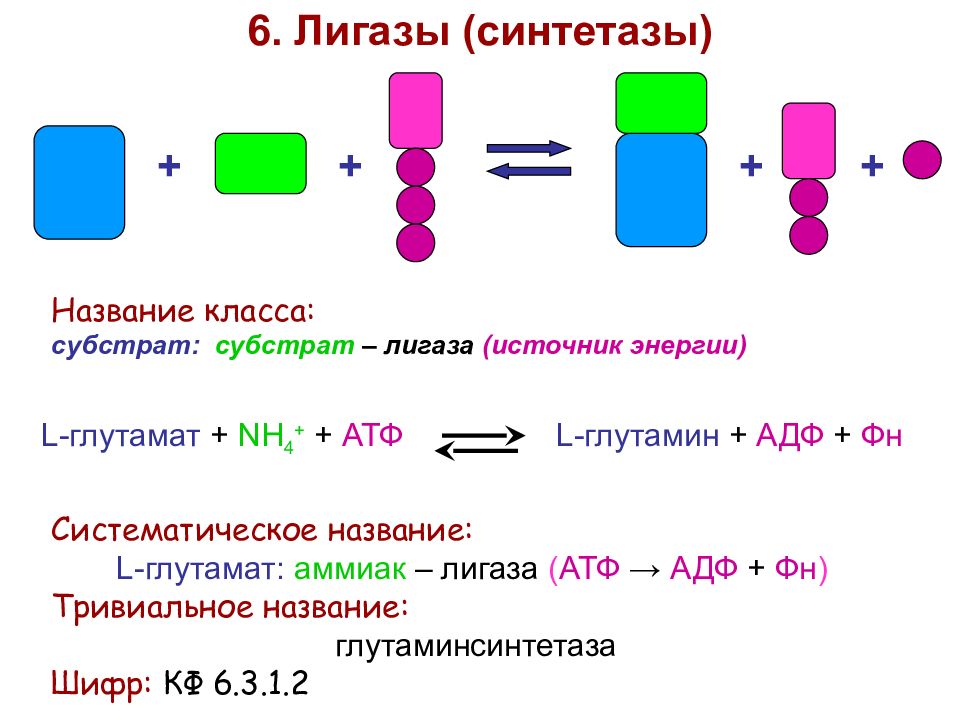
+ + + + 6. Лигазы (синтетазы) Название класса: субстрат: субстрат – лигаза (источник энергии) L-глутамат + NH 4 + + АТФ L-глутамин + АДФ + Фн Систематическое название: L-глутамат: аммиак – лигаза ( АТФ → АДФ + Фн ) Тривиальное название: глутаминсинтетаза Шифр: КФ 6.3.1.2