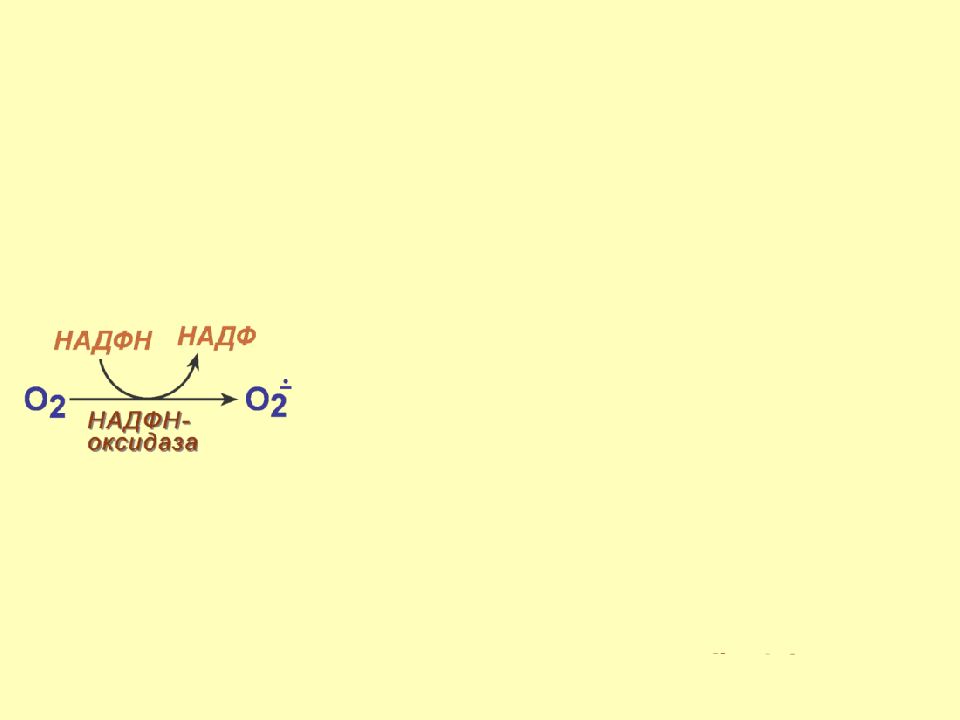Первый слайд презентации: Биологическое окисление
Тимин Олег Алексеевич Доцент кафедры биохимии и молекулярной и биологии ЛФ www.biokhimija.ru
Слайд 2: Окислительный стресс
Слайд 3: Цель
Изучить реакции образования свободных радикалов, их роль в клетке и способы сдерживания свободно-радикального окисления.
Слайд 4: План лекции
Что такое свободные радикалы? Активные формы кислорода. Реакции образования активных форм кислорода. Роль свободных радикалов. Механизмы повреждающего действия свободных радикалов. Антиоксиданты.
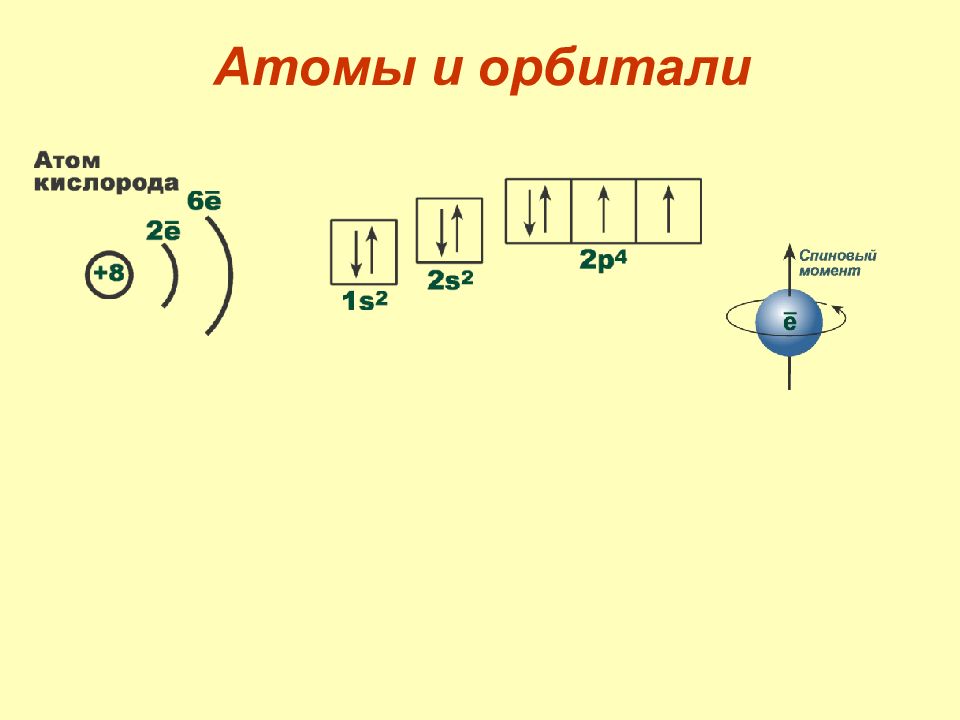
Слайд 7: Строение атома
1. Электроны в атомах находятся на орбиталях. 2. Заполненная внешняя орбиталь содержит 2 электрона с противоположными спинами. 3. Вещества, имеющее заполненный внешний слой, инертны в химических реакциях. 4. Присоединение или потеря электронов заполняют или опустошают внешний слой. 5. При наличии незаполненного внешнего слоя вещества стремятся его заполнить образованием ковалентных связей.
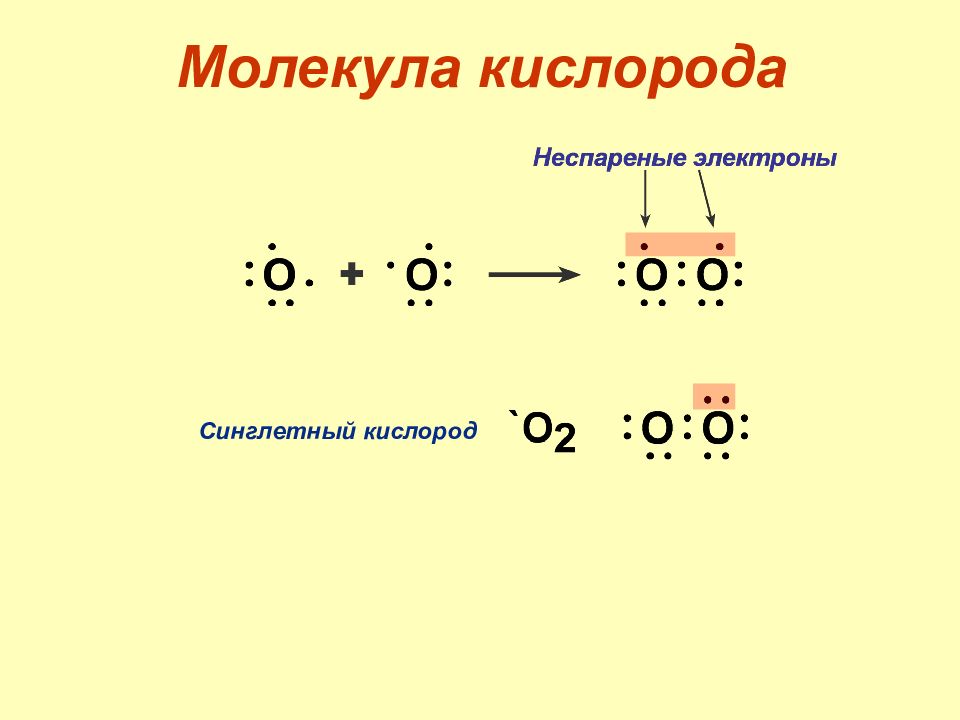
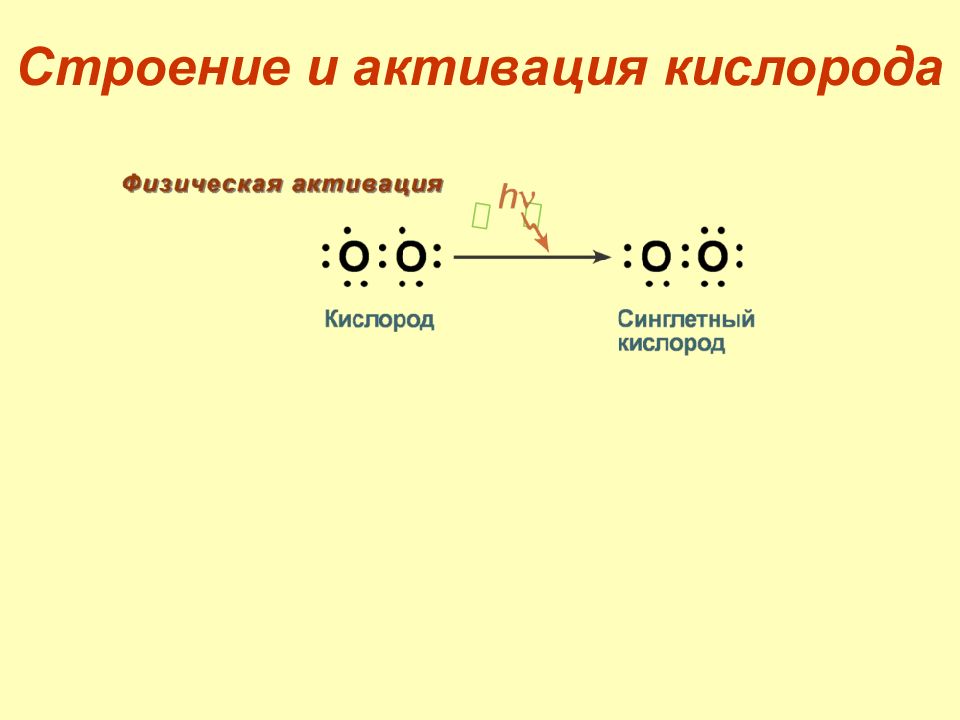
Слайд 9: Свободные радикалы
1. Свободные радикалы – частицы с неспаренными электронами на внешних атомных или молекулярных орбиталях. 2. Свободные радикалы быстро реагируют с другими соединениями, пытаясь отобрать недостающие электроны для получения стабильности. 3. Поэтому свободные радикалы очень нестабильны и существуют весьма непродолжительное время. 4. Являются промежуточными веществами во многих реакциях.
Слайд 10: Свободные радикалы
5. Все соединения, с которыми контактируют свободные радикалы, окисляются. 6. Аэробные организмы постоянно продуцируют свободные радикалы при клеточном дыхании, метаболизме и фагоцитозе. 7. Свободные радикалы способны создать хаос в биологических системах.
Слайд 12
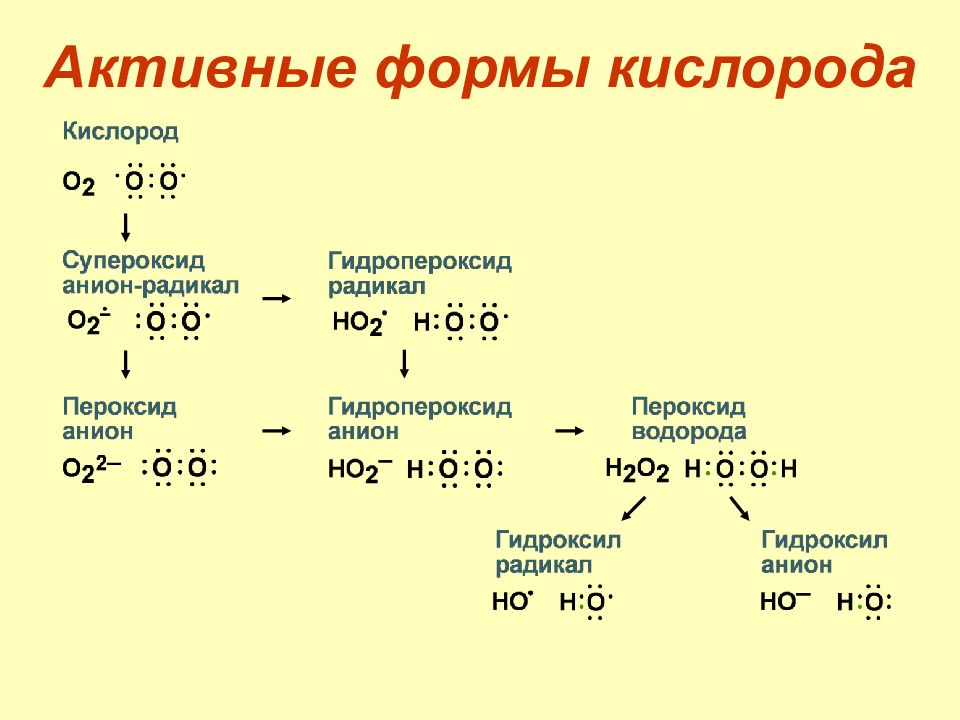
В течение окислительных реакций молекуляр-ный кислород восстанавливается до воды. 2. С уществуют «утечки» электронов из реакций с образованием продуктов неполного восстановления кислорода. 3. Продукты неполного восстановления кислорода носят название активные формы кислорода ( АФК ). 4. АФК содержат один или более неспаренных электронов на внешней орбитали – это свободные радикалы.
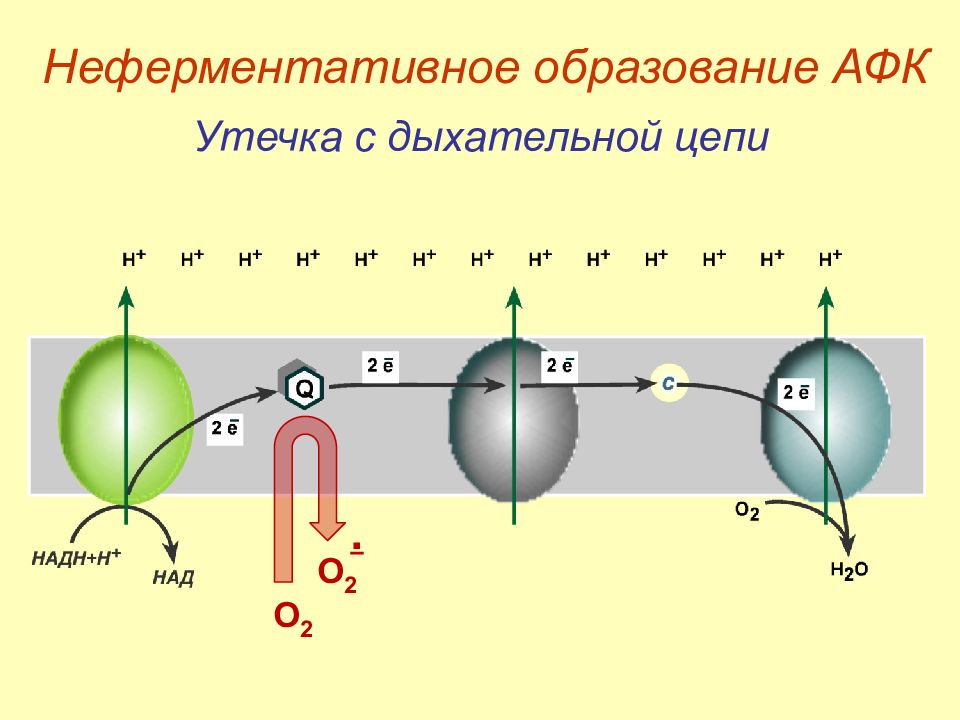
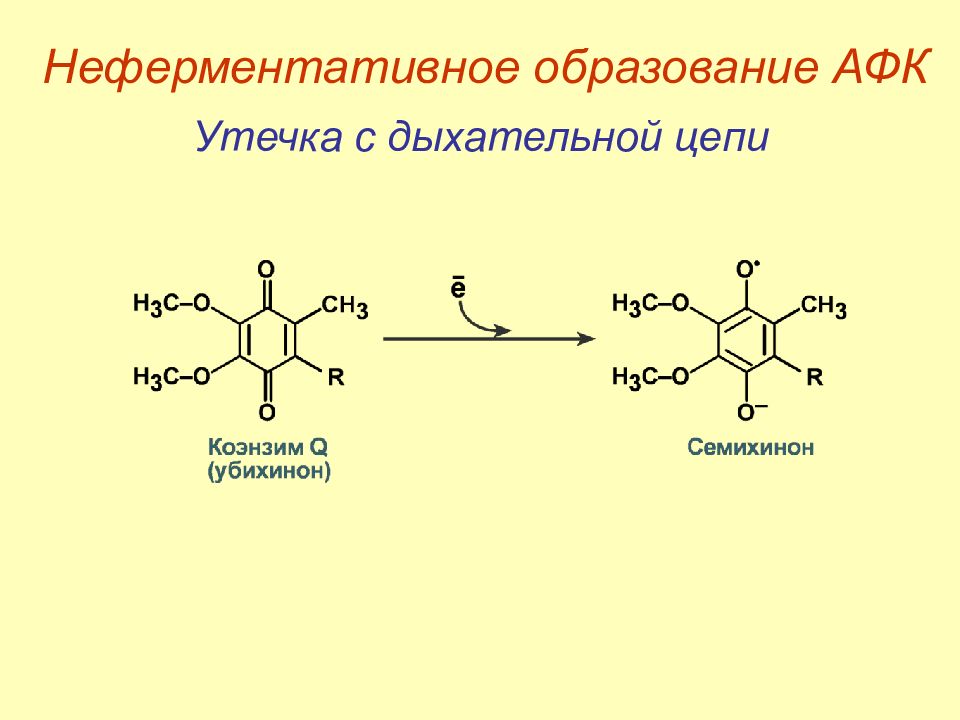
Слайд 19: Неферментативное образование АФК
Утечка с дыхательной цепи O 2 O 2 . Неферментативное образование АФК
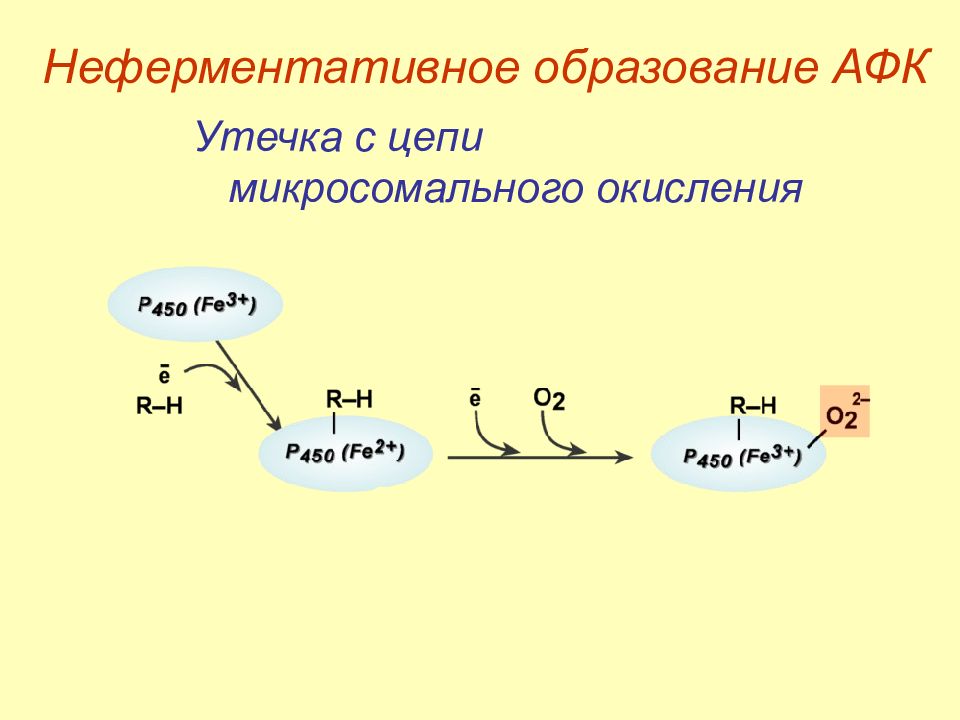
Слайд 21: Неферментативное образование АФК
Утечка с цепи микросомального окисления Неферментативное образование АФК
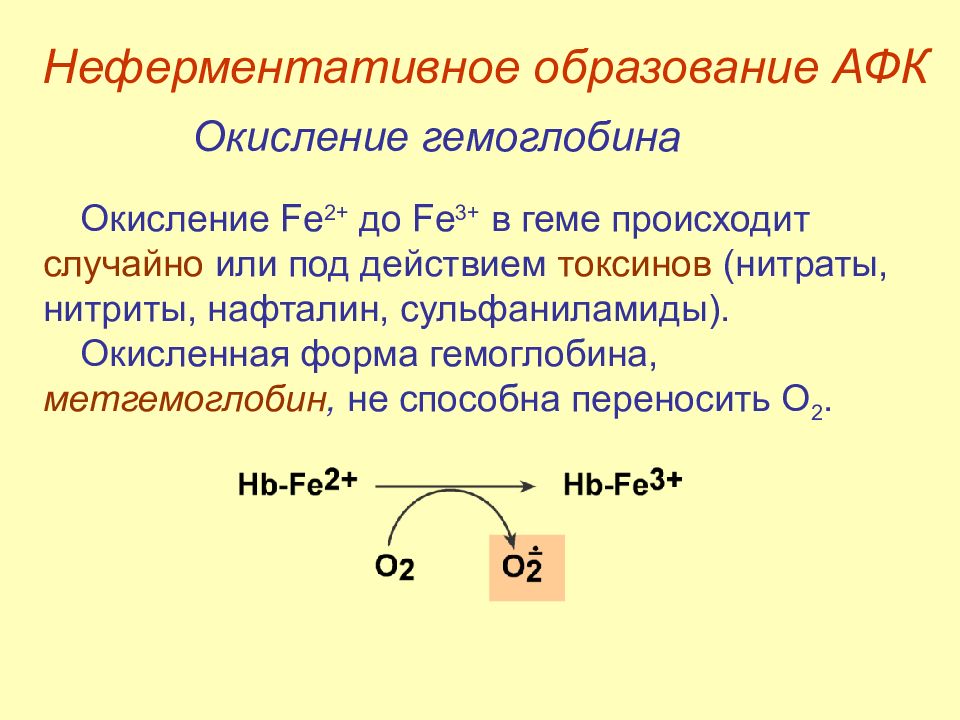
Слайд 22: Неферментативное образование АФК
Окисление гемоглобина Окисление Fe 2 + до Fe 3 + в геме происходит случайно или под действием токсинов (нитраты, нитриты, нафталин, сульфаниламиды). О кисленная форма гемоглобина, метгемоглобин, не способна переносить O 2. Неферментативное образование АФК
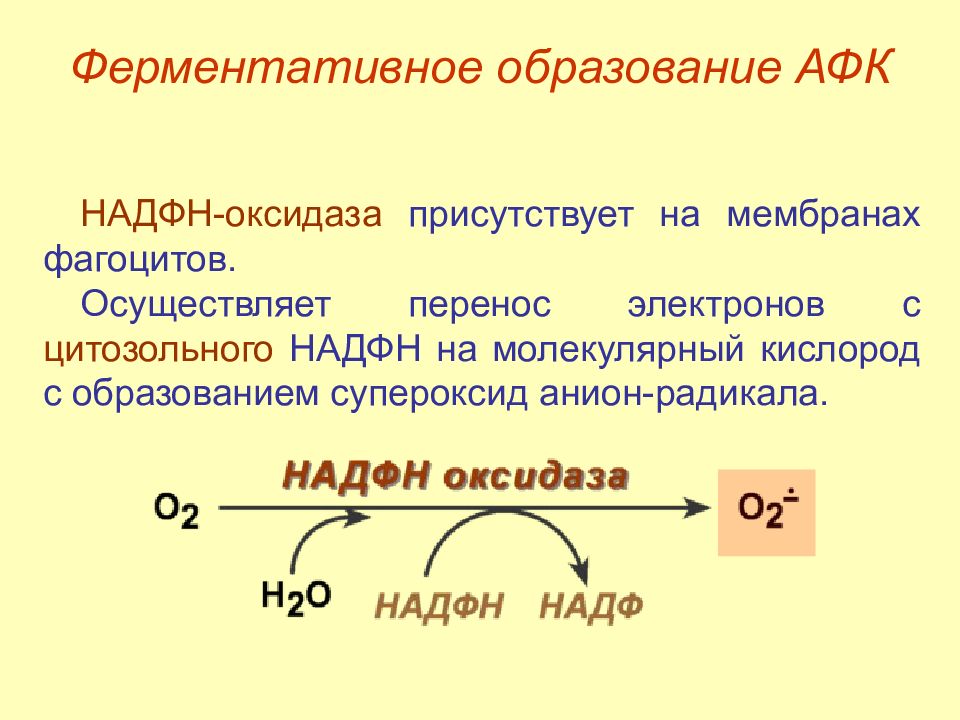
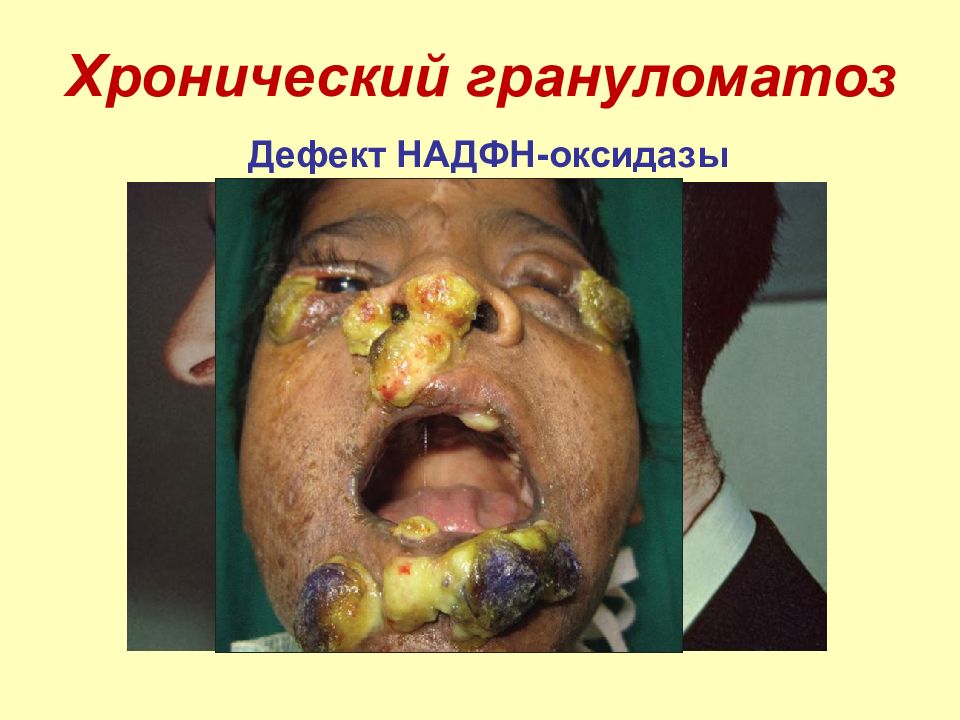
Слайд 23: Ферментативное образование АФК
НАДФН -оксидаза присутствует на мембранах фагоцитов. Осуществляет перенос электронов с цитозольного НАДФН на молекулярный кислород с образованием супероксид анион-радикала. Ферментативное образование АФК
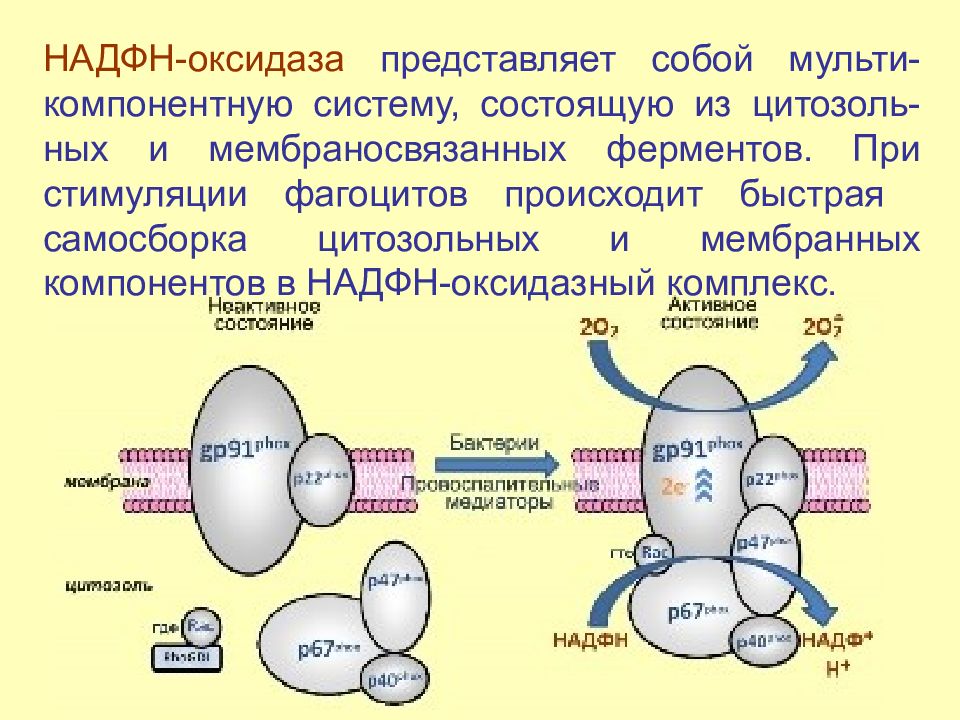
Слайд 24
НАДФН -оксидаза представляет собой мульти-компонентную систему, состоящую из цитозоль-ных и мембраносвязанных ферментов. При стимуляции фагоцитов происходит быстрая самосборка цитозольных и мембранных компонентов в НАДФН-оксидазный комплекс.
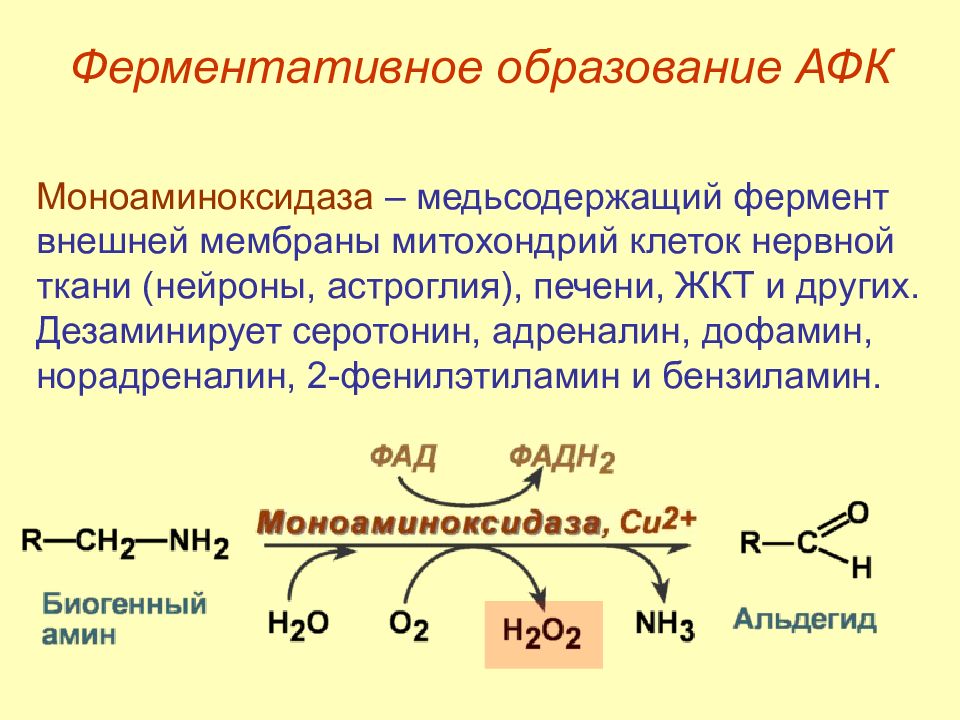
Слайд 25: Ферментативное образование АФК
Моноаминоксидаза – медьсодержащий фермент внешней мембраны митохондрий клеток нервной ткани (нейроны, астроглия ), печени, ЖКТ и других. Дезаминирует серотонин, адреналин, дофамин, норадреналин, 2- фенилэтиламин и бензиламин. Ферментативное образование АФК
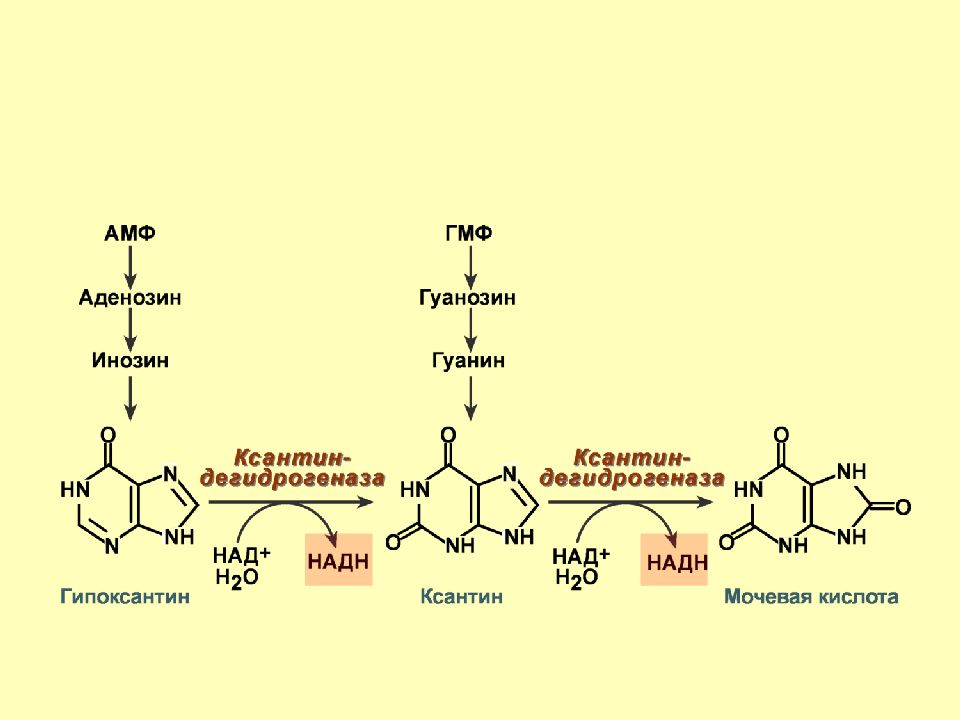
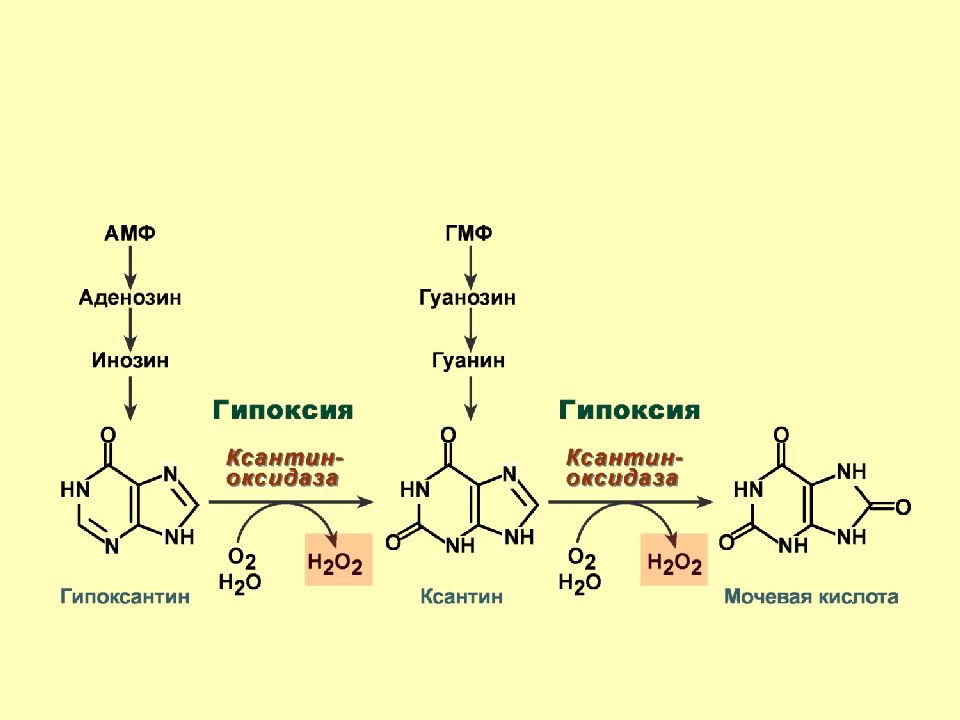
Слайд 26: Ферментативное образование АФК
К сантин оксидоредуктаза В обычных условиях к атализирует окисление ксантина с участием НАД – ксантиндегидрогеназа. П ри гипоксии клеток фермент необратимо превращается в оксидазную форму - ксантиноксидаза. Акцептором электронов в этой реакции выступает кислород. Ферментативное образование АФК
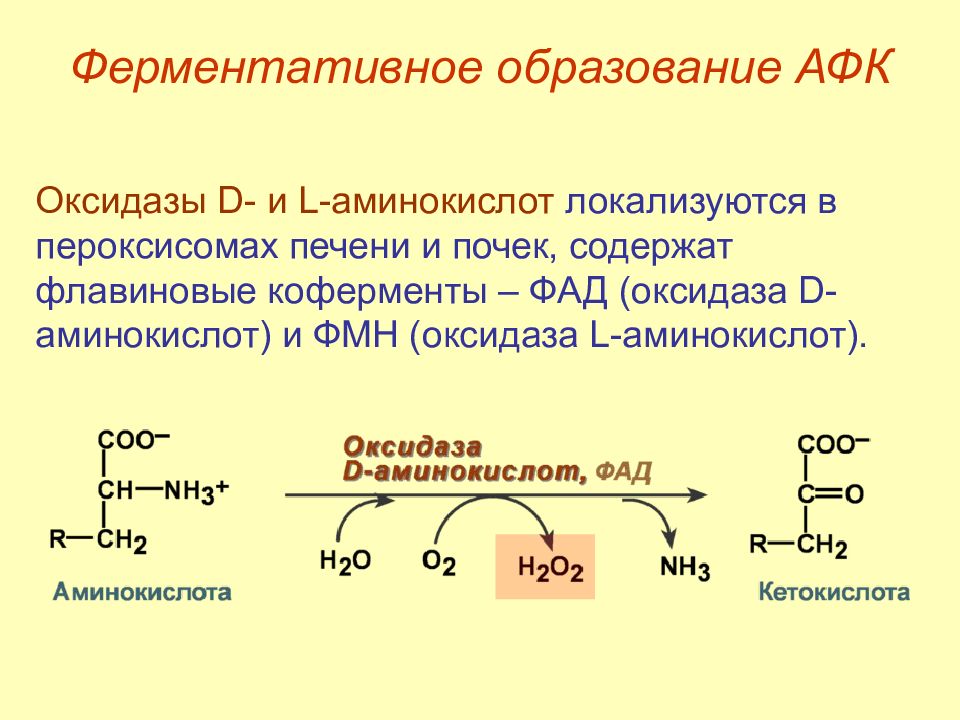
Слайд 29: Ферментативное образование АФК
Оксидазы D - и L -аминокислот локализуются в пероксисомах печени и почек, содержат флавиновые коферменты – ФАД (оксидаза D -аминокислот) и ФМН (оксидаза L -аминокислот). Ферментативное образование АФК
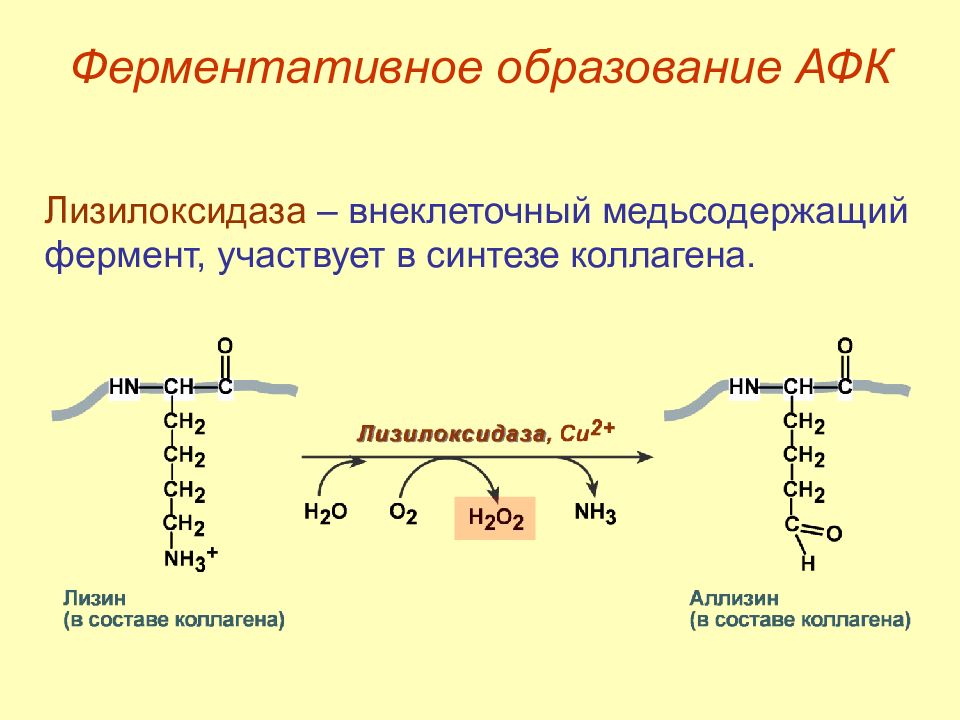
Слайд 30: Ферментативное образование АФК
Лизилоксидаза – внеклеточный медьсодержащий фермент, участвует в синтезе коллагена. Ферментативное образование АФК
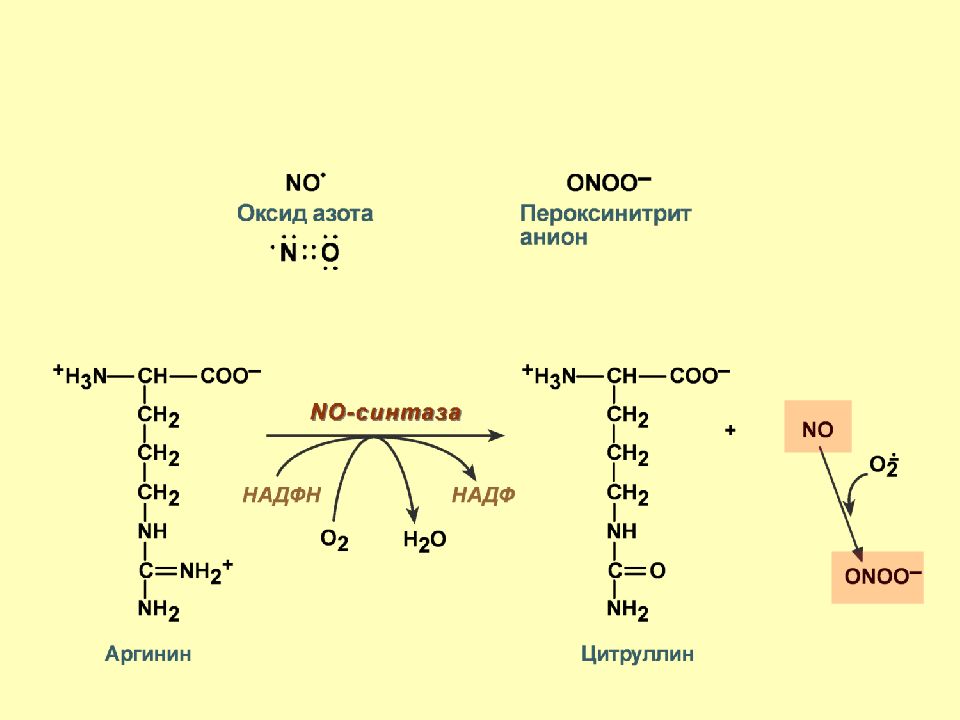
Слайд 31: Ферментативное образование активных форм азота
NO- синтаза – фермент, катализирующий окисление аргинина с образованием оксида азота ( NO ). Функции оксида азота: 1. Регуляция сосудистого тонуса. 2. Расслабление гладкой мускулатуры. 3. Торможение агрегации тромбоцитов. 4. Снижение адгезии нейтрофилов к эндотелию. 5. Нейромедиатор 6. Цитотоксический и бактерицидный эффект.
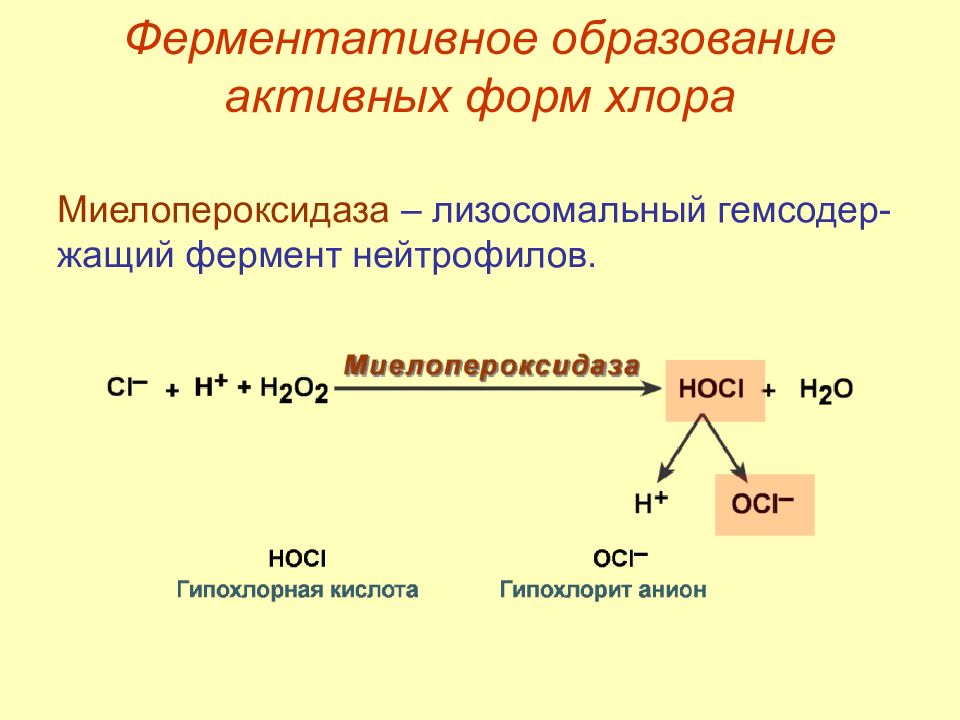
Слайд 33: Ферментативное образование активных форм хлора
Миелопероксидаза – лизосомальный гемсодер-жащий фермент нейтрофилов.
Слайд 35
Низкие уровни АФК бактерицидное действие, защита молока, участвуют в регуляции клеточных процессов ( АФК -зависимый сигналинг ). Высокие уровни АФК окислительный стресс, участвует в патогенезе атеросклероза, ИБС, ХОБЛ, б.Альгеймера, б.Паркинсона, опухолей, некроза.
Слайд 36: Фагоцитоз
Фагоцитоз – это активное поглощение и разрушение клетками твердых частиц, чуждых для организма (микроорганизмы, вирусы, иммунные комплексы антиген-антитело, простейшие, гельминты, твердые неорганические частицы, отмершие клетки). К фагоцитам относятся нейтрофилы, моноциты, эозинофилы, базофилы, тканевые макрофаги, купферовские клетки, остеокласты, клетки микроглии.
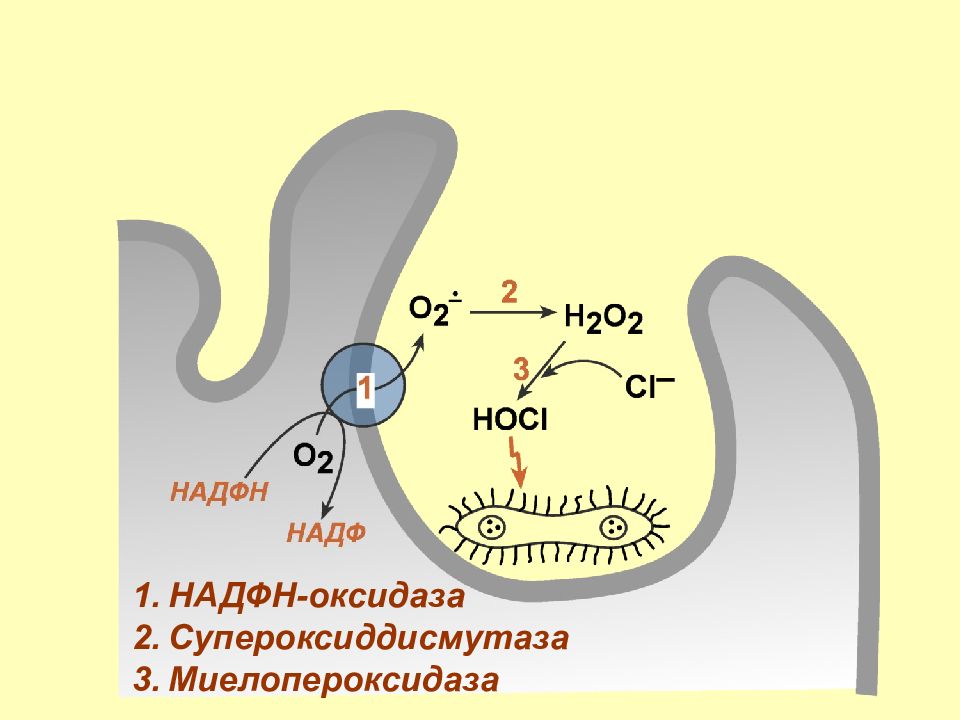
Слайд 37: Респираторный взрыв
Повышение потребление глюкозы и ее окисления по пентозофосфатному пути с образованием НАДФН. 2. Повышение потребления кислорода в 20-40 раз. 3. Активация НАДФН-оксидазы и генерация супероксид анион-радикала. 4. Активация миелопероксидазы и генерация гипохлорита.
Слайд 41: Защита молока
В систему антимикробной защиты молока входят лактоферрин, лизоцим, л актоглобулины, л актопероксидаза.
Слайд 42
Лактопероксидазная система способна подавлять широкий спектр бактерий, грибы, паразиты, вирусы. Обеспечивает уничтожение кишечных патогенов, защиту молочных желез и сохранение молока.
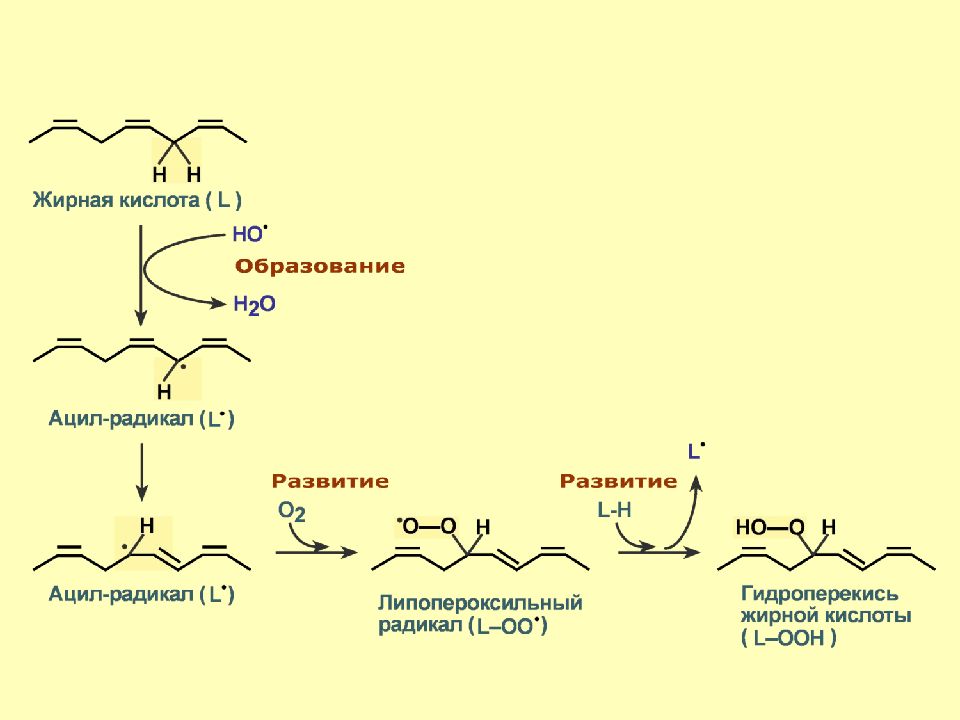
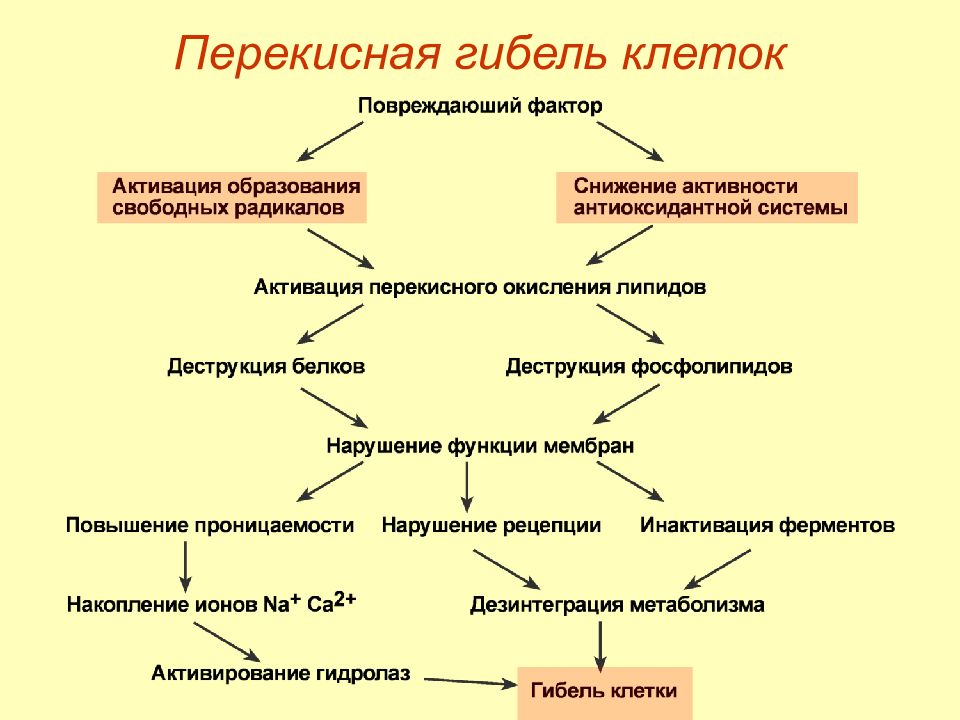
Слайд 43: Перекисное окисление липидов
Перекисное окисление липидов – это окислительная деградация липидов, происходящая под действием свободных радикалов с образованием липопероксильного радикала. Дальнейшее взаимодействие полученного радикала со структурами соседних молекул приводит к развитию линейной цепной реакции с появлением новых окисленных молекул.
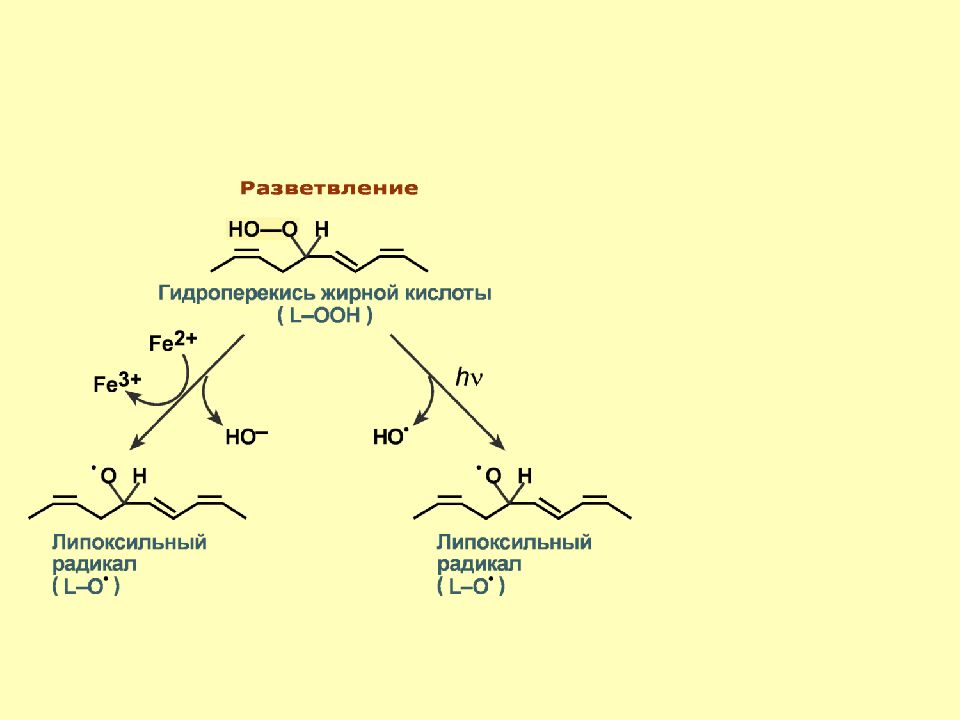
Слайд 44
Стадии ПОЛ: 1. Инициация – образование свободного радикала ( L •). 2. Развитие цепи – присоединение О 2 и образование липопероксирадикала LOO • или пероксид липида LOOH. 3. Разветвление цепи – LOOH + Fe 2 + → LO• + Fe 3 + + HO – 4. Обрыв цепи. 5. Разрушение структуры.
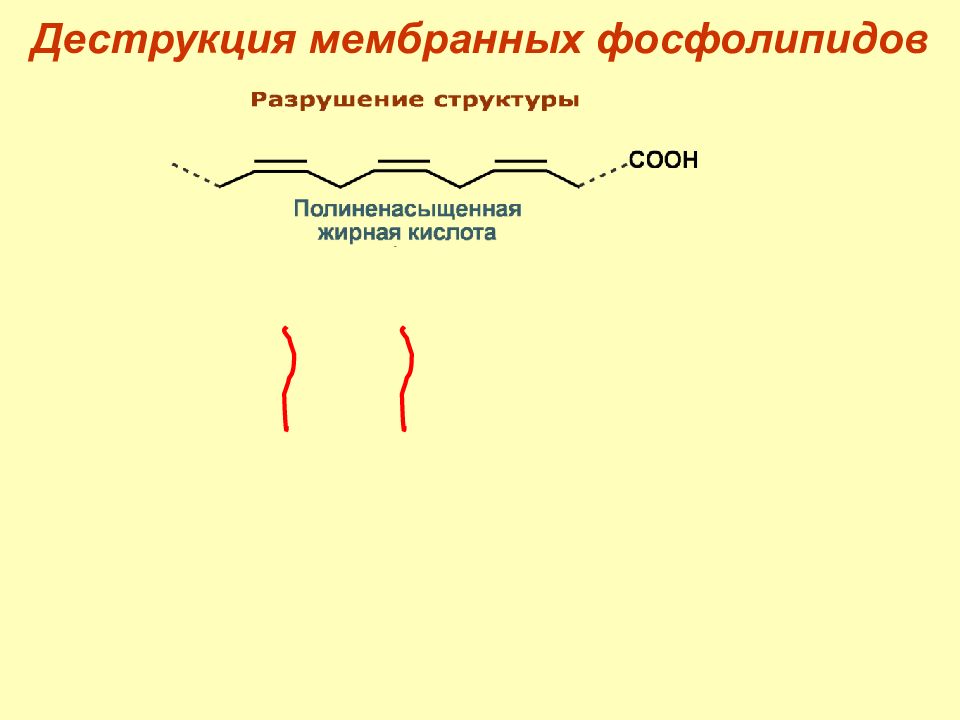
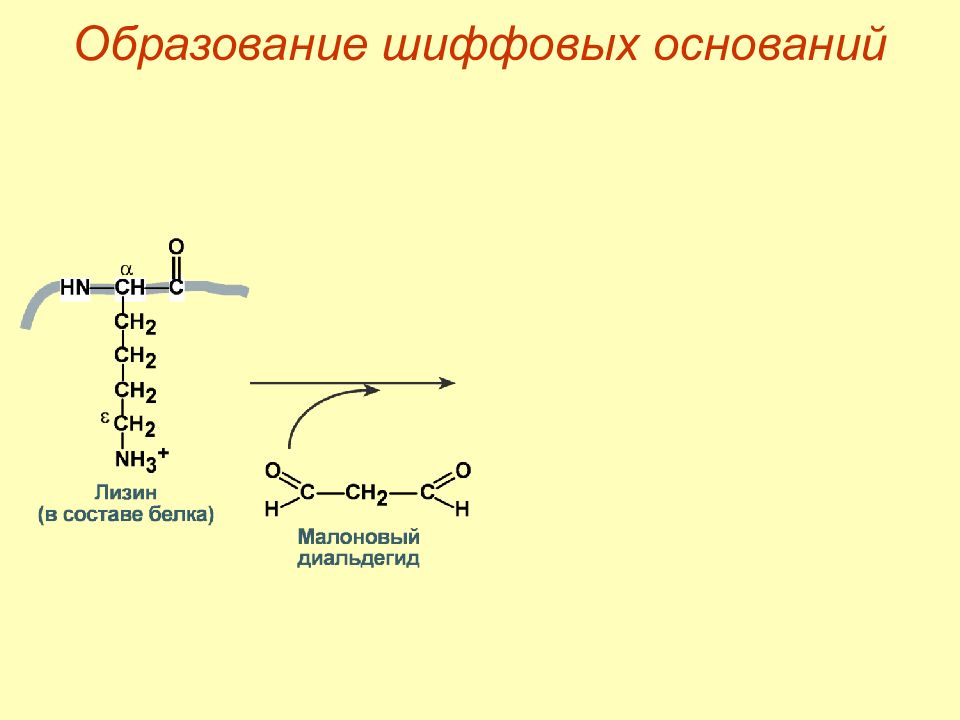
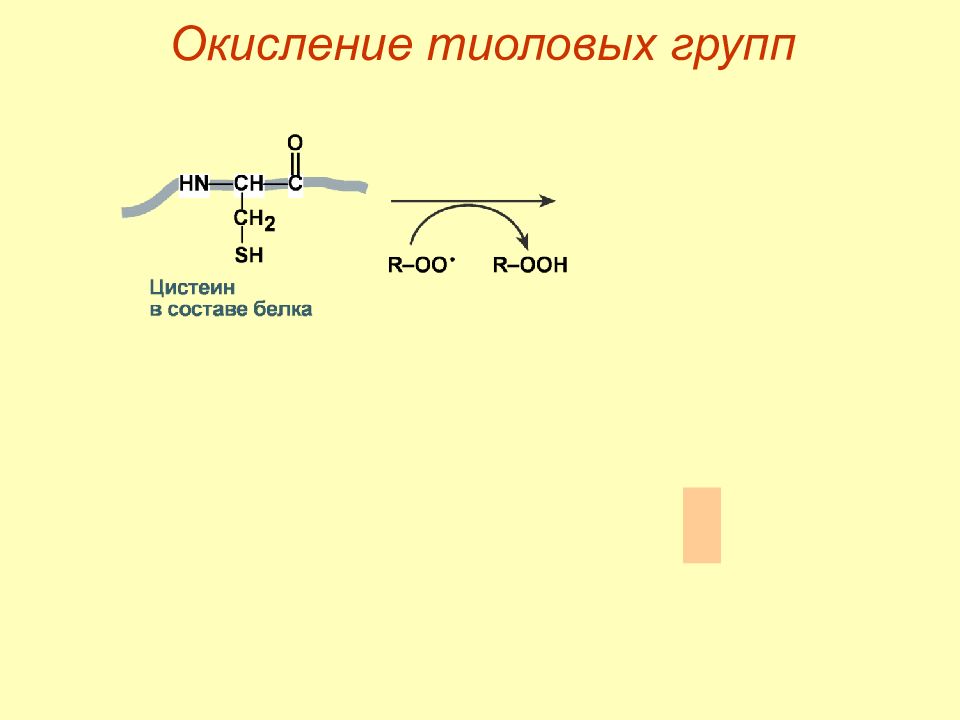
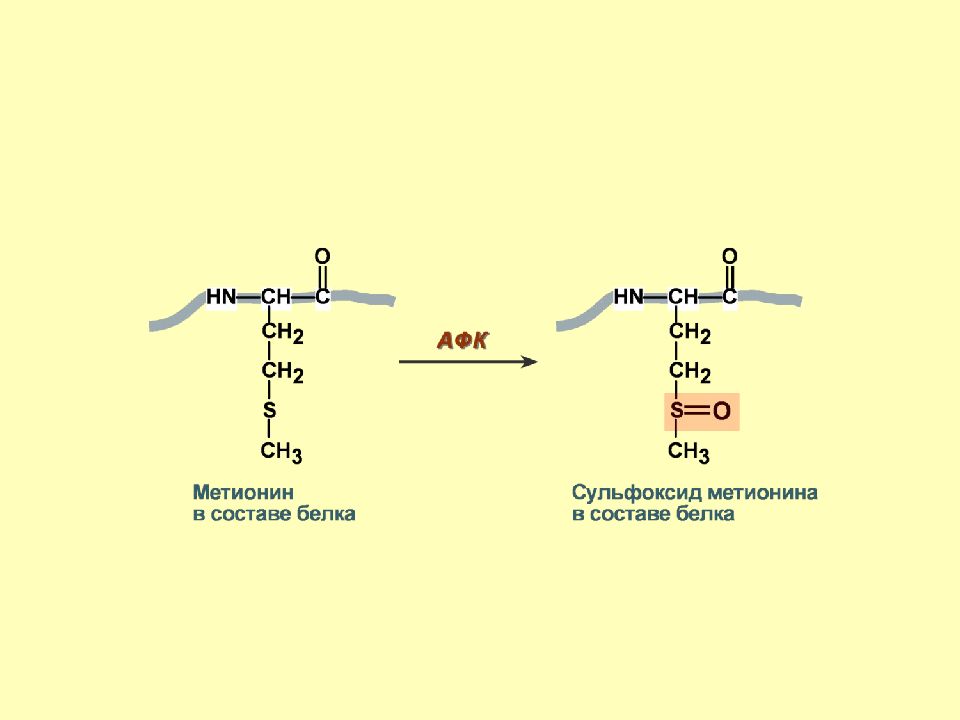
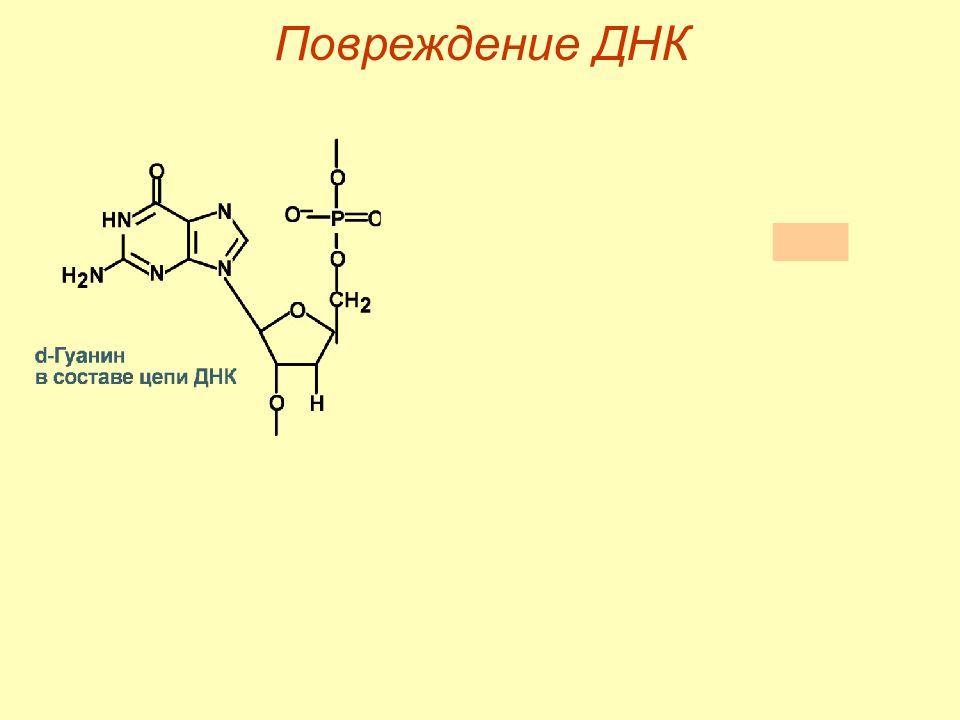
Слайд 48: Первичные механизмы
1. Деструкция жирных кислот фосфолипидов ( липоперекиси, эндоперекиси ). 2. Повреждение белков о бразование шиффовых оснований окисление тиоловых групп – инактивация тиоловых ферментов, транскрипционных факторов. 3. Повреждение ДНК – мутации, нарушение репарации.
Слайд 55: Вторичные механизмы
1. Повышение проницаемости мембран нарушение мембранных потенциалов, разобщение окислительного фосфори-лирования. 2. Повреждение лизосом – аутолиз клеток. 3. Повышение микровязкости мембран и нарушение активности мембранных рецепторов, мембраносвязанных ферментов, мембранного транспорта. 4. Канцерогенез.
Слайд 57: Образование АФК при ишемии
1. Конверсия ксантиндегидрогеназы в ксантиноксидазу, способную активно продуцировать АФК при окислении пуринов. 2. Выброс катехоламинов при болевом синдроме и их окисление в адренохром, что сопровождается образованием АФК. 3. Необратимое ингибирование активности антиоксидантных ферментов (СОД и GSH-пероксидазы) вследствие накопления АФК. 4. Активация нейтрофилов продуктами фосфолиполиза и протеолиза (при некрозе), что способствует началу « респираторного взрыва » и приводит к гиперпродукции свободных радикалов.
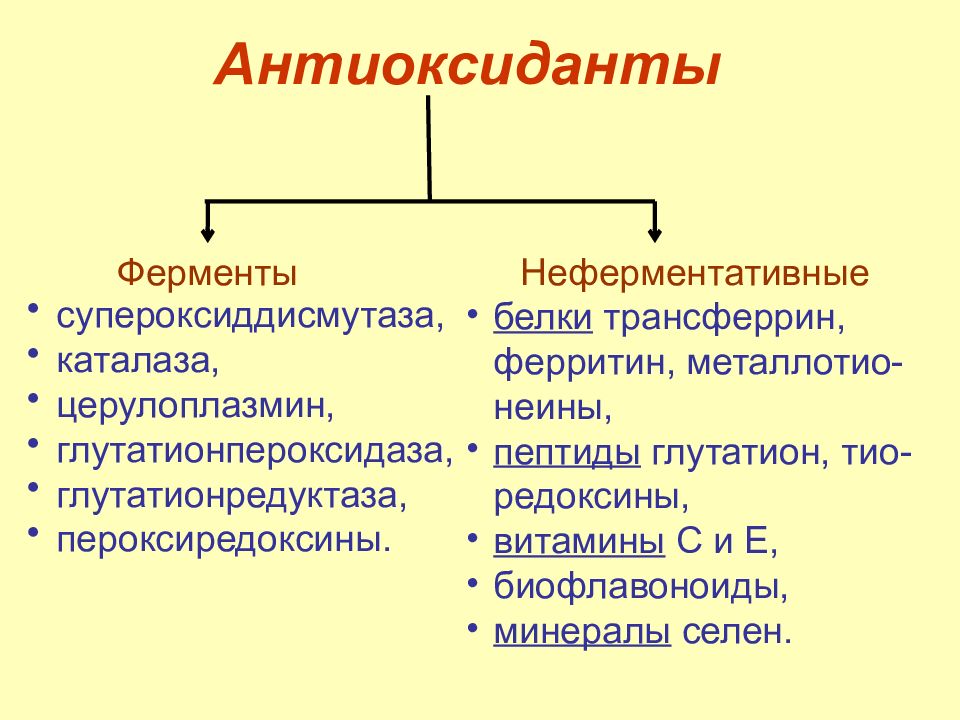
Слайд 59: А нтиоксиданты
Ферменты супероксиддисмутаза, каталаза, церулоплазмин, глутатионпероксидаза, глутатионредуктаза, пероксиредоксины. Неферментативные белки трансферрин, ферритин, металлотио-неины, пептиды глутатион, тио- редоксины, витамины C и E, биофлавоноиды, минералы селен.
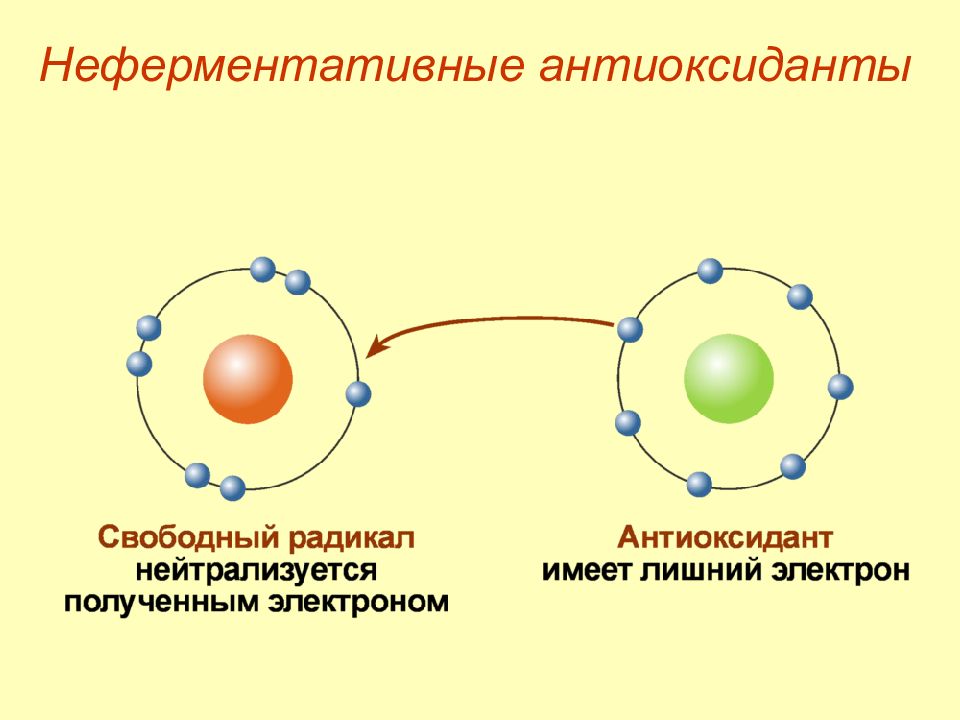
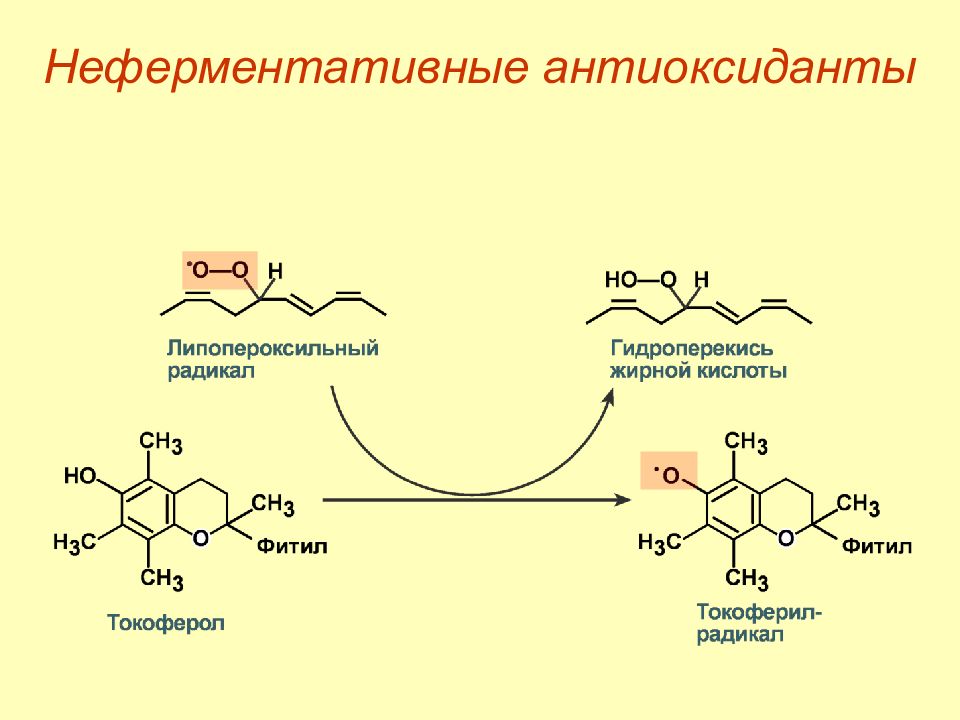
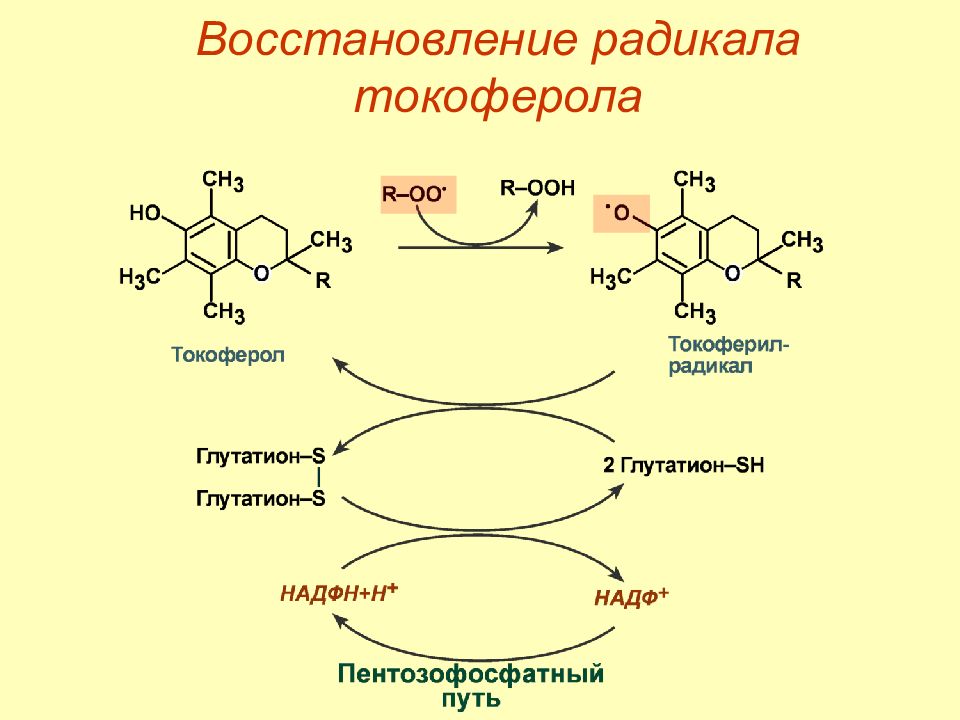
Слайд 60: Неферментативные антиоксиданты
Ф ерритин, трансферрин – проявляют анти- оксидантную активность благодаря способности связывать ( хелатировать ) ионы железа и предотвращать реакцию Фентона. Металлотионеины – богатые цистеином (до 30% от состава) небольшие белки, способные связывать ионы металлов переменной валентности (железо, цинк, медь, тяжелые металлы кадмий и ртуть). Неферментативные антиоксиданты
Слайд 61: Ферментативные антиоксиданты
Супероксиддисмутаза – фермент цитозоля и митохондрий, в реакции дисмутации образуются нерадикальные продукты из радикальных субстратов O 2 и пероксид водорода H 2 O 2. Изофермент цитозоля содержит Zn, Cu, изофермент митохондрий имеет Mn.
Слайд 62: Ферментативные антиоксиданты
Каталаза, гемсодержащий фермент, присутствует в пероксисомах всех клеток человека, обладает чрезвычайно высокой молекулярной активностью. В эритроцитах она находится в цитозоле и защищает гемоглобин от окисления. Ферментативные антиоксиданты
Слайд 63: Ферментативные антиоксиданты
Церулоплазмин – медьсодержащий фермент (гликопротеин) α 2 -глобулиновой фракции белков плазмы крови. В церулоплазмине содержится около 95% общего количества меди сыворотки крови. Проявляет феррооксидазную активность ( Fe 2 + Fe 3 + ), ускоряя связывание ионов железа с ферритином и трансферрином. Ферментативные антиоксиданты
Слайд 64: Ферментативные антиоксиданты
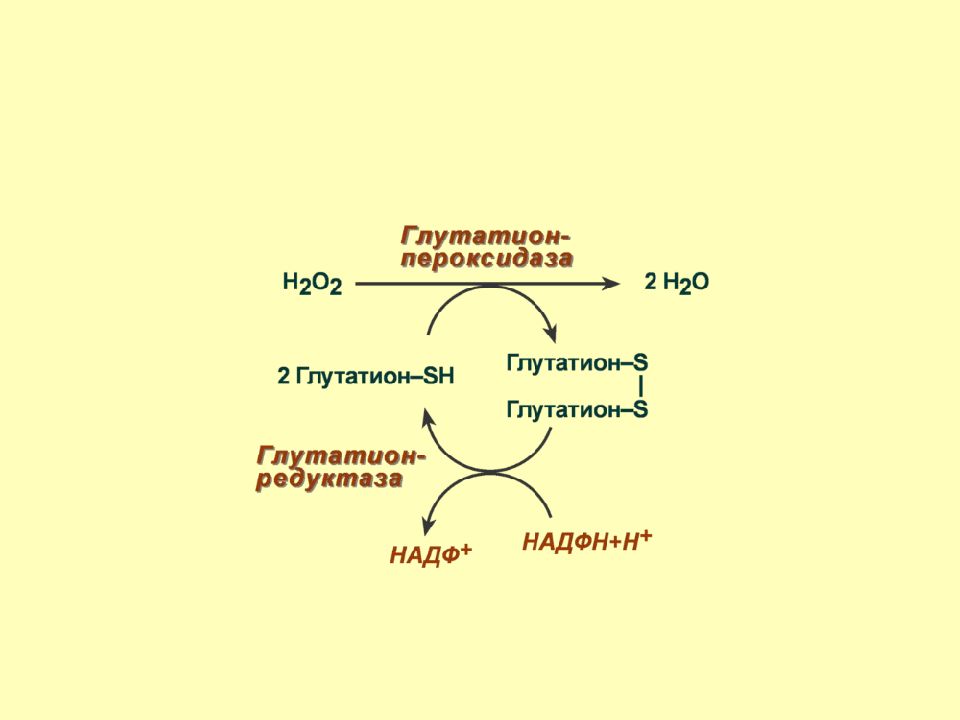
Глутатионпероксидаза является гемсодер-жащим ферментом цитоплазмы и митохондрий, обладает в 1000 раз большим сродством к перекиси водорода, чем каталаза. Особенностью глутатионпероксидазы является наличие в активном центре фермента селеноцистеина, т.е. такого цистеина, в котором сера заменена на селен. Ферментативные антиоксиданты
Слайд 70
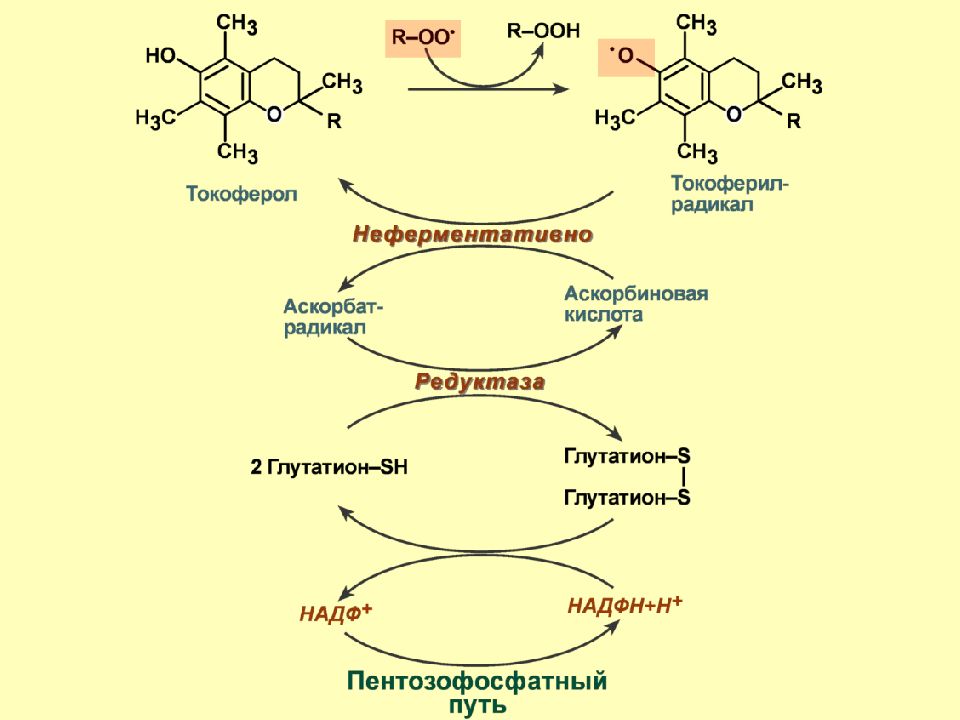
Также антиоксидантным эффектом обладают: растительные флавоноиды ( кверцетин, ресвератрол ), каротиноиды, мочевая кислота, гормоны (мелатонин, эстрадиол, эстриол ). Неферментативные антиоксиданты
Слайд 71
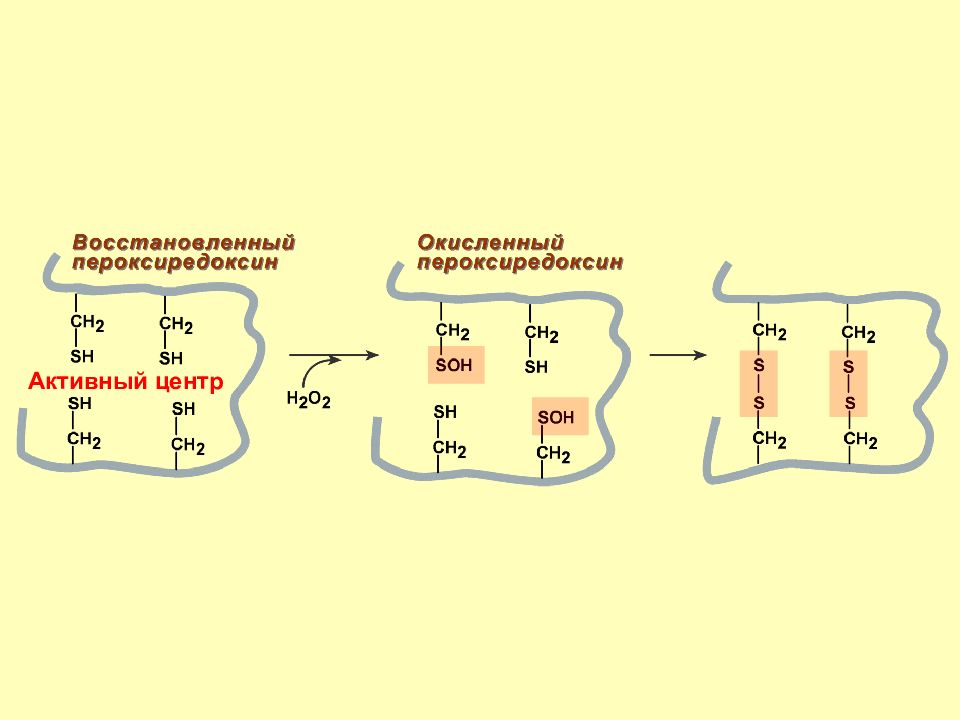
Пероксиредоксины – антиоксидантные ферменты, контролирующие уровень цитокин-индуцированных пероксидов, участвующих в передаче клеточных сигналов. В активном центре фермента находится SH -группа цистеина, которая окисляется до R- SOH состояния пероксидным субстратом (например, липидной гидроперекисью ). Ферментативные антиоксиданты
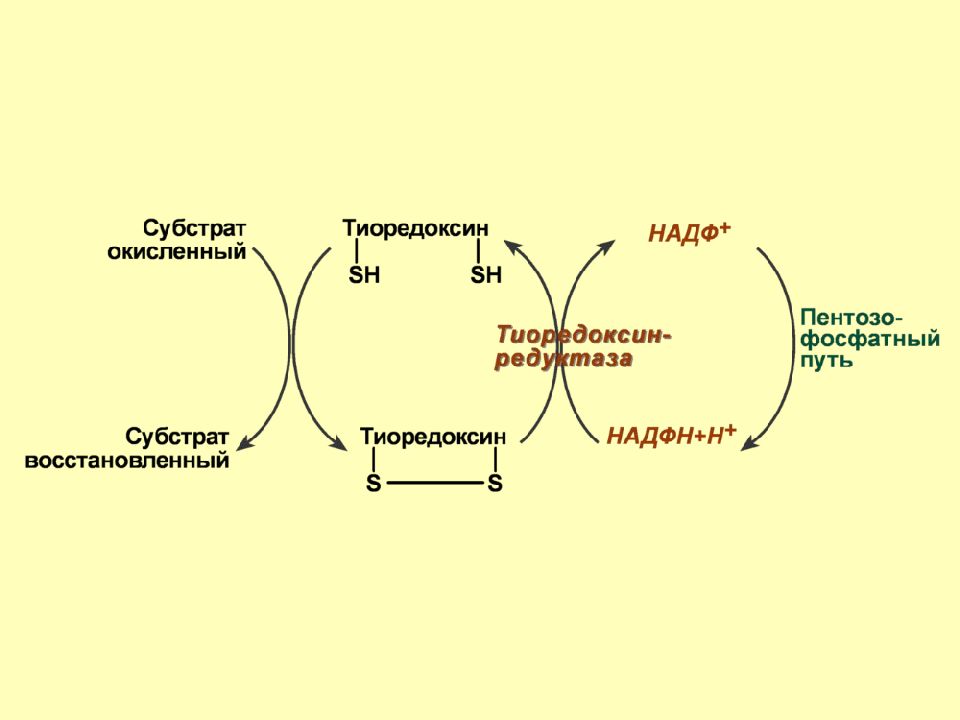
Слайд 73
Тиоредоксины – семейство небольших белков, содержащих в активном центре расположенные рядом остатки цистеина (- Cys - Gly -Pro- Cys -). С их помощью тиоредоксины восстанавливают дисульфидные связи в других белках. Неферментативные антиоксиданты
Слайд 74
Функции: регуляция активности некоторых ферментов ( пероксиредоксины, метионинсульфоксид-редуктаза ), тиоредоксин поставляет электроны, используемые в биохимических процессах (синтез дезоксирибонулеотидов, активация витамина К ), активирует apoptosis signal-regulating kinase 1 ( ASK-1 ), которая подавляет апоптоз и стимулирует клеточный рост.