Первый слайд презентации
№ 12. Реакции окисления и восстановления органических соединений
Слайд 2
Реакции окисления - восстановления реакции, в ходе которых происходит изменение степени окисления атома углерода, являющегося реакционным центром.
Слайд 3
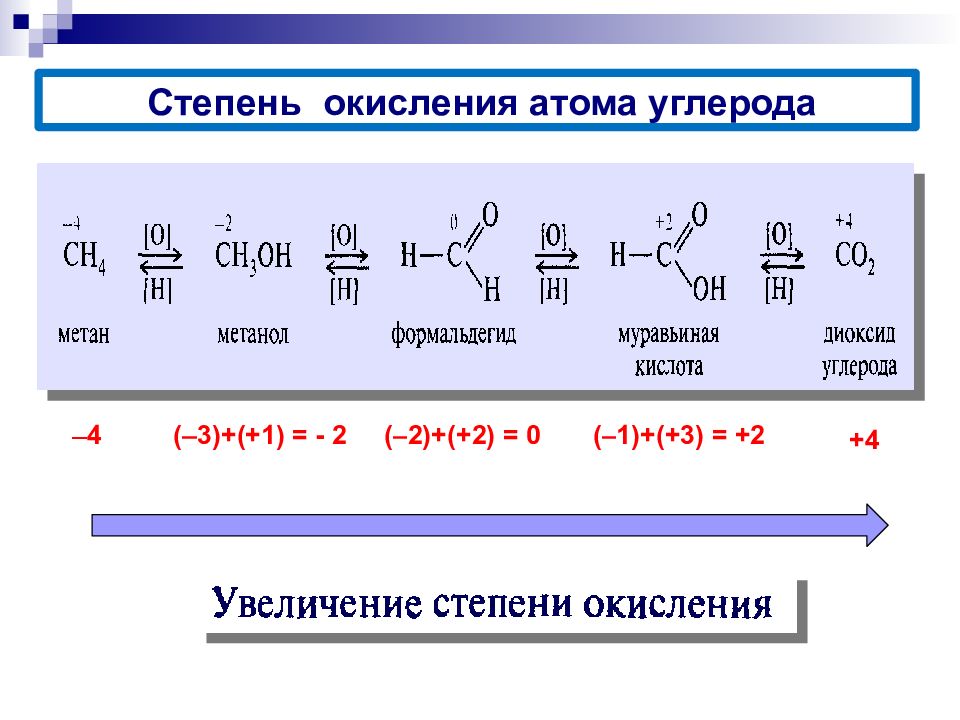
Степень окисления атома углерода в органическом веществе равна алгебраической сумме всех его связей с более ЭО элементом ( Cl, O, S,N), учитываемых со знаком «+», и связей с атомами Н, учитываемых со знаком «-». При этом связи с соседними атомами углерода не учитываются.
Слайд 4
4 ( 3)+(+1 ) = - 2 ( 2)+(+2 ) = 0 ( 1)+(+3 ) = +2 +4 Степень окисления атома углерода
Слайд 5: Окисление
Процесс удаления атомов Н с образованием кратной связи ; - замена связей С Н на связи с другими более ЭО элементами. (степень окисления С увеличивается) Окисление – процесс перехода электронов от субстрата к реагенту - окислителю, - «потеря электронов» атомом углерода.
Слайд 6: Восстановление
замена связей с ЭО элементами на новые связи С Н. (степень окисления С уменьшается). Восстановление – процесс перехода электронов от восстановителя к органическому субстрату. - « приобретение электронов» атомом углерода.
Слайд 8
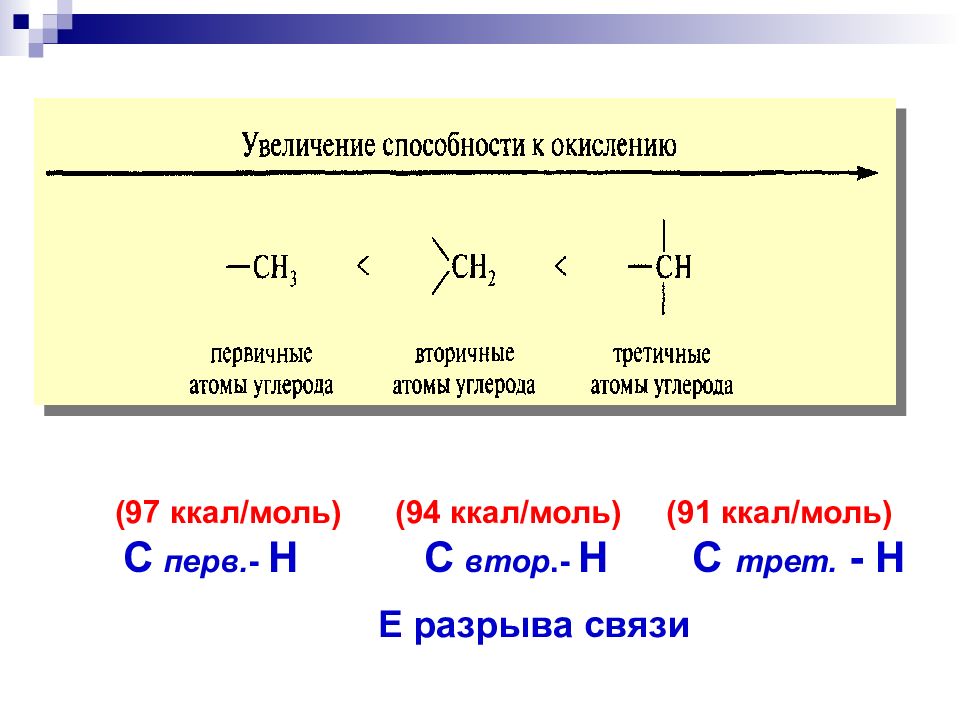
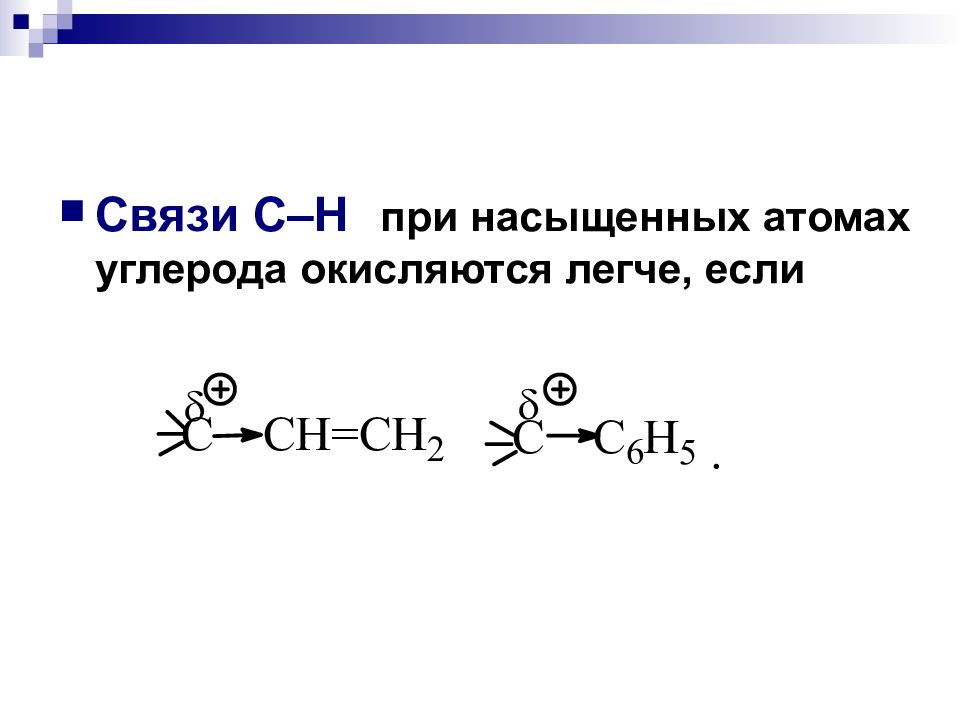
(97 ккал/моль) (94 ккал/моль) ( 91 ккал/моль ) С перв. - Н С втор.- Н С трет. - Н Е разрыва связи
Слайд 10
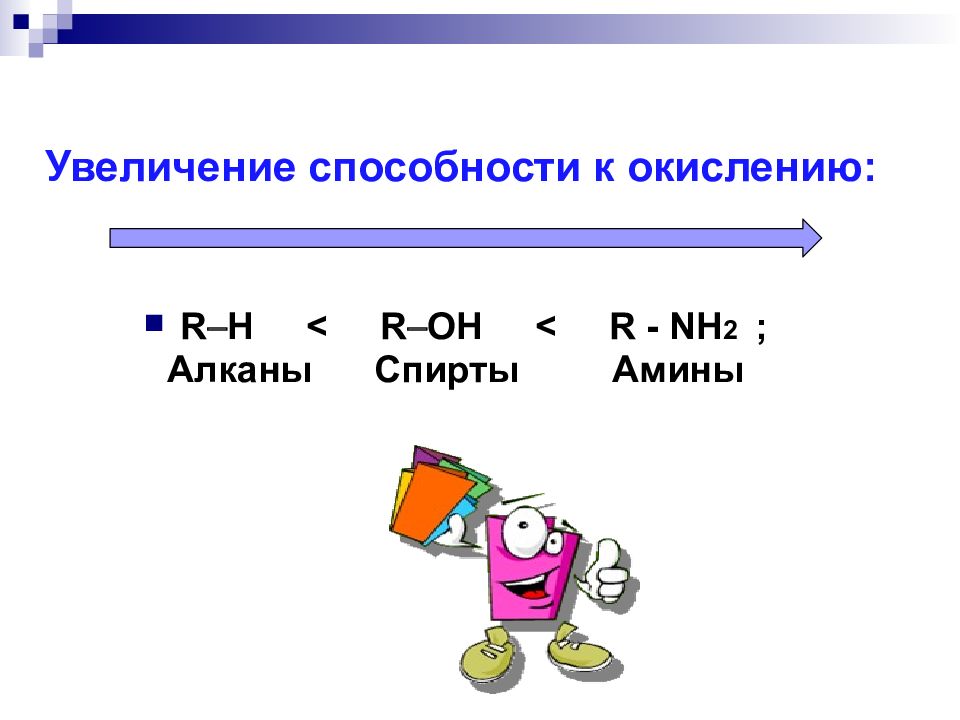
Увеличение способности к окислению: R H < R OH < R - NH 2 ; Алканы Спирты Амины
Слайд 11
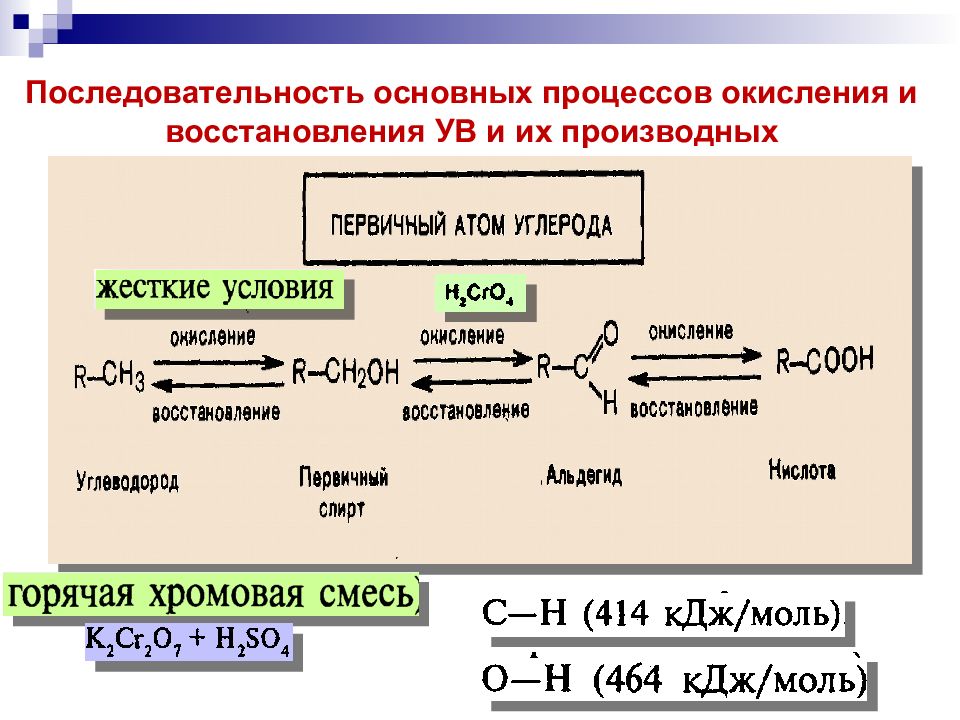
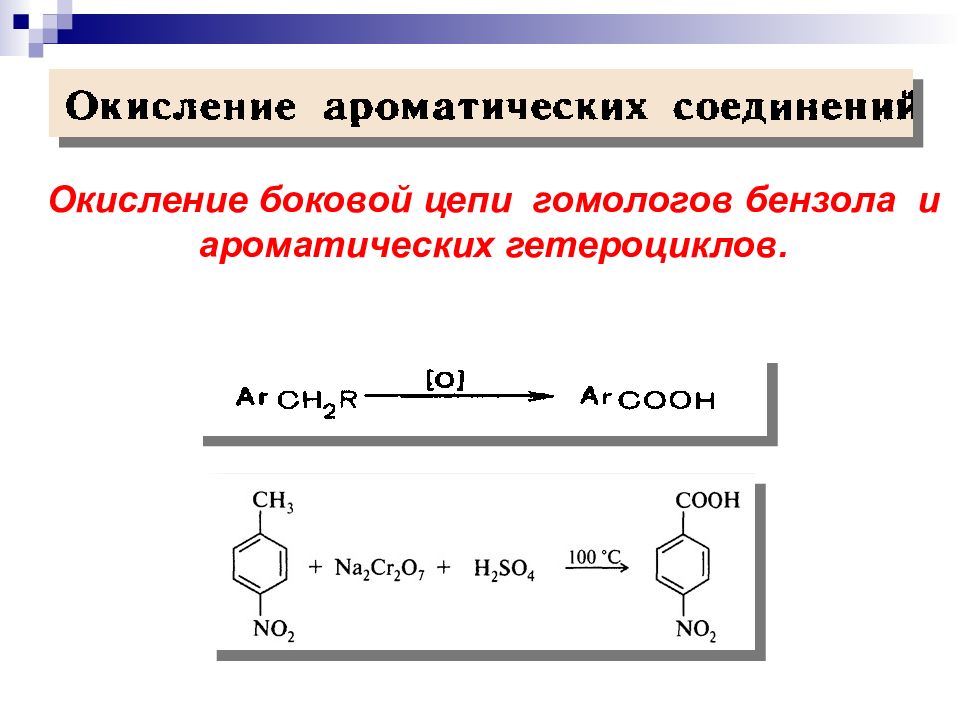
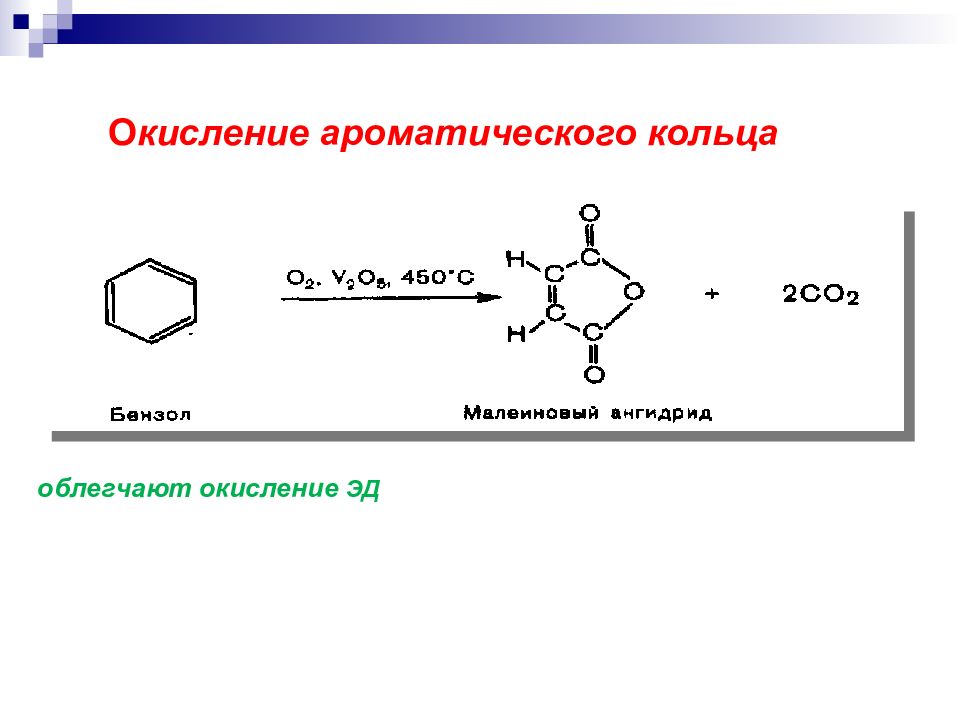
Горение алканов ( пламя): СН 4 + О 2 СО 2 + H 2 О + выделение тепла и света (полное окисление ). Окисление алканов сильными окислителями: RH + K 2 Cr 2 O 7 + H 2 SO 4, нагревание Смесь карбоновых кислот (неполное окисление ). Связи С С окисляются с большим трудом и всегда с разрушением соединения
Слайд 13
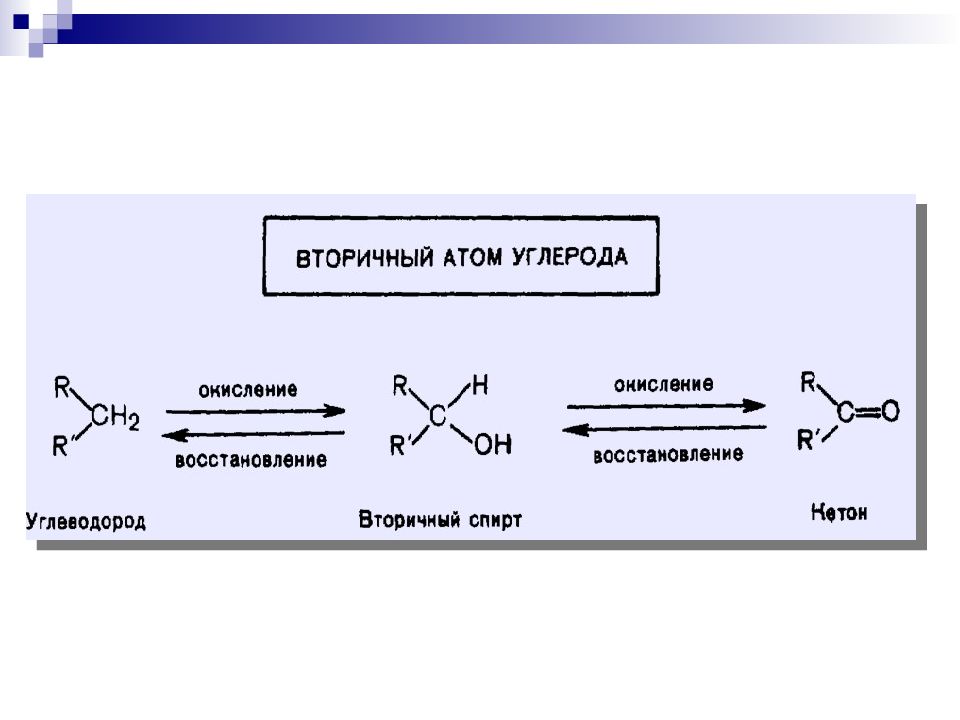
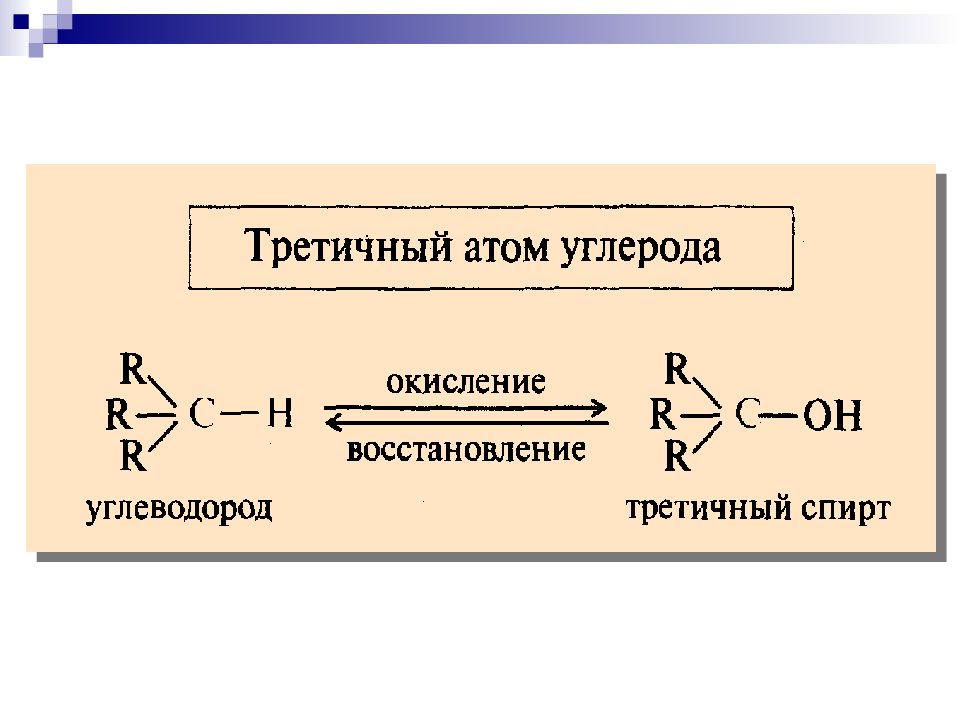
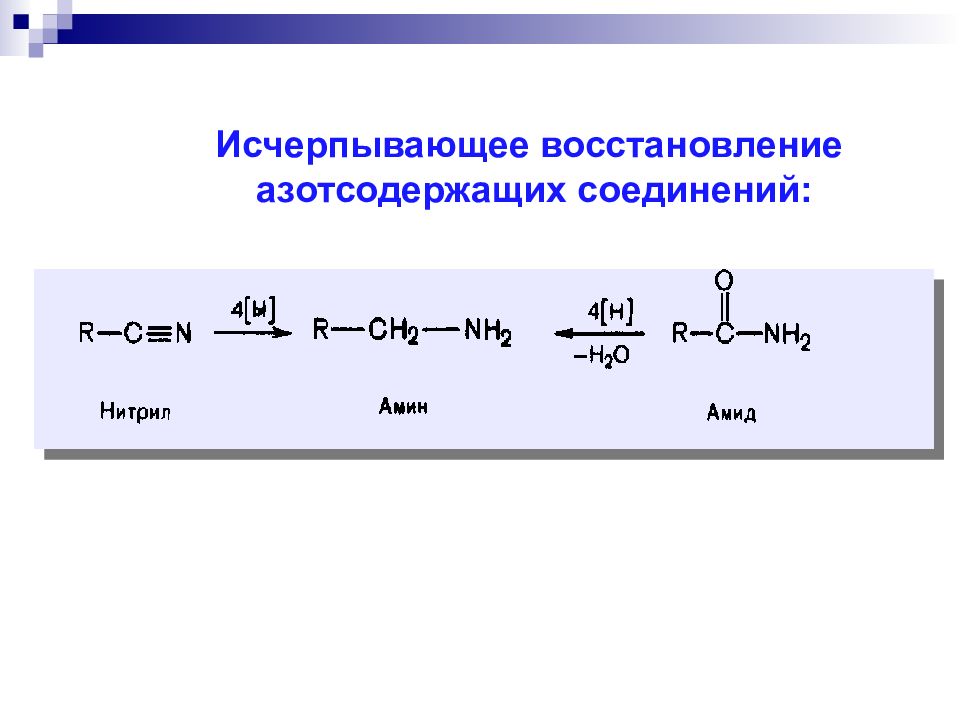
Последовательность основных процессов окисления и восстановления УВ и их производных
Слайд 18
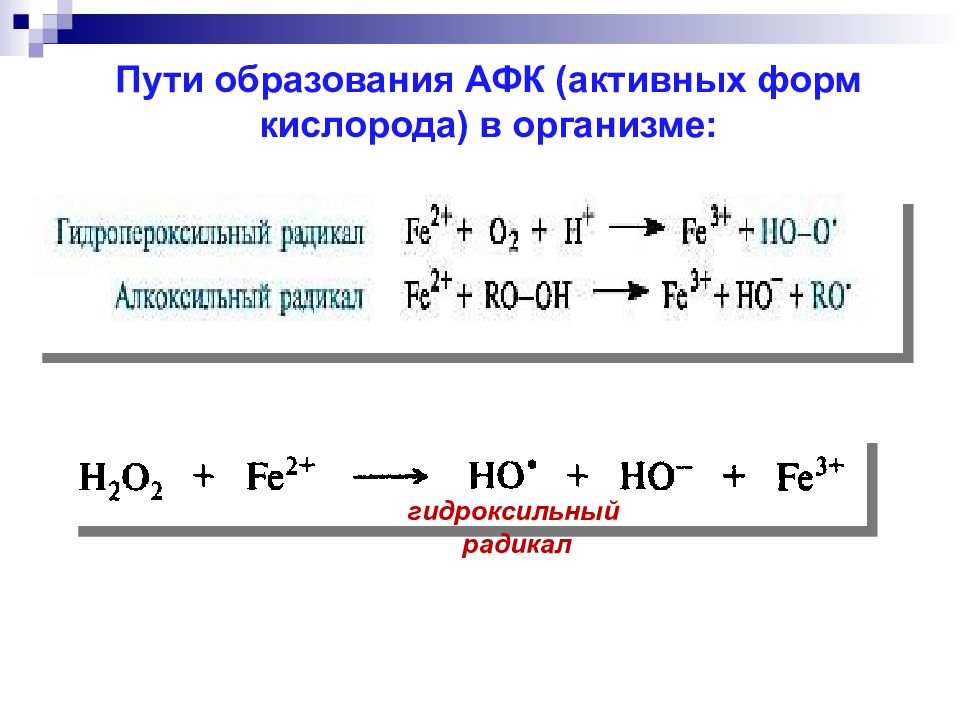
гидроксильный радикал Пути образования АФК ( активных форм кислорода) в организме:
Слайд 21
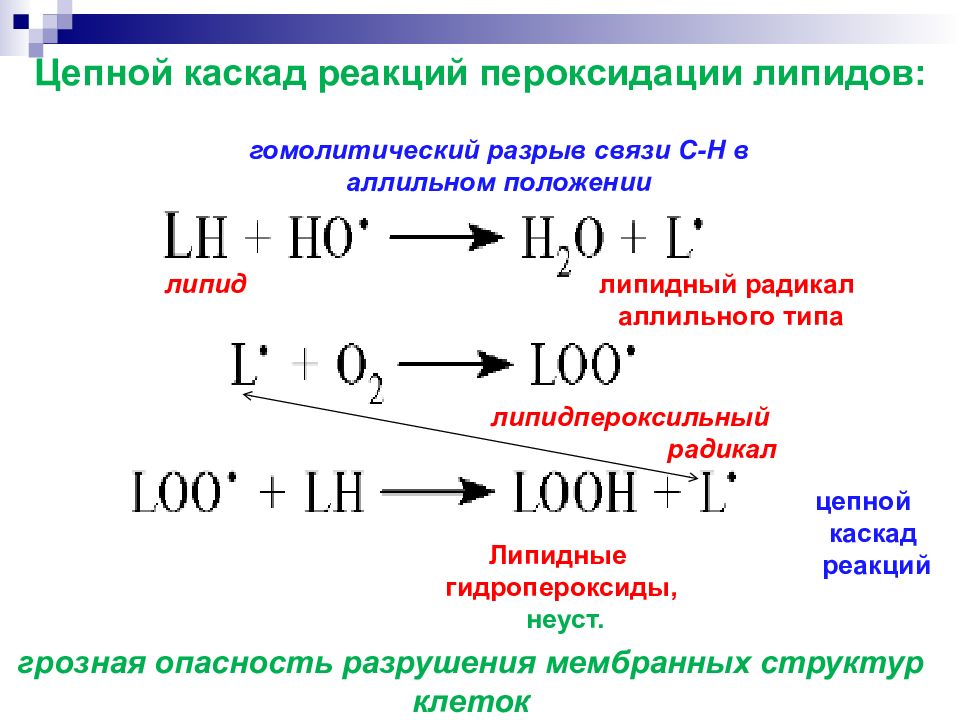
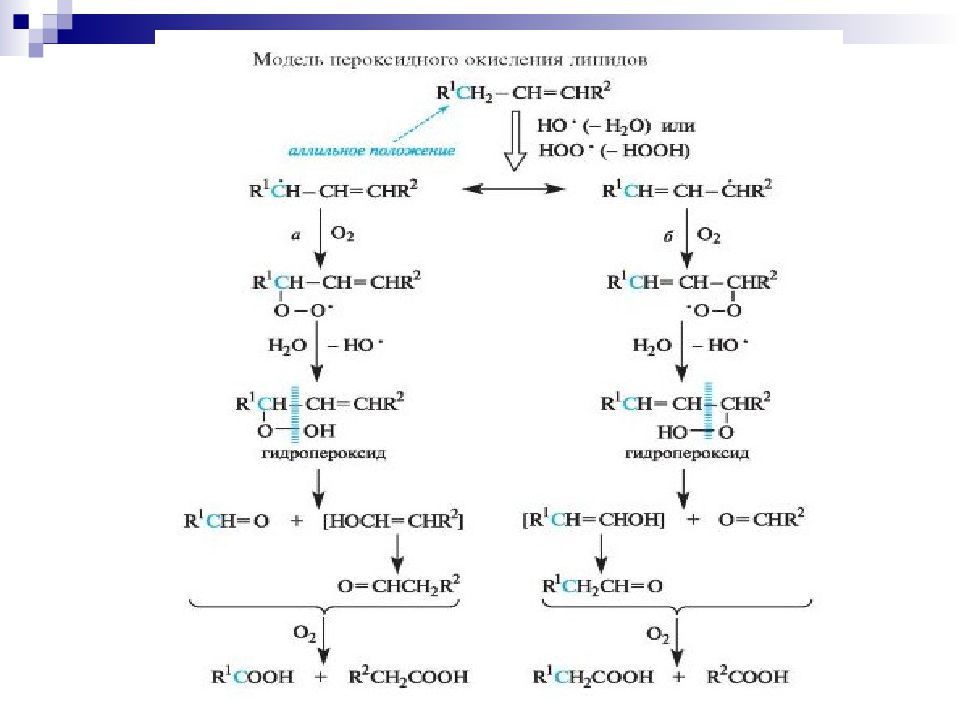
липидпероксильный радикал липид гомолитический разрыв связи С-Н в аллильном положении л ипидный радикал аллильного типа Цепной каскад реакций пероксидации липидов: Липидные гидропероксиды, неуст. цепной каскад реакций грозная опасность разрушения мембранных структур клеток
Слайд 22
Механизм эндогеной антиоксидантной защиты от избытка АФК: супероксиддисмутаза
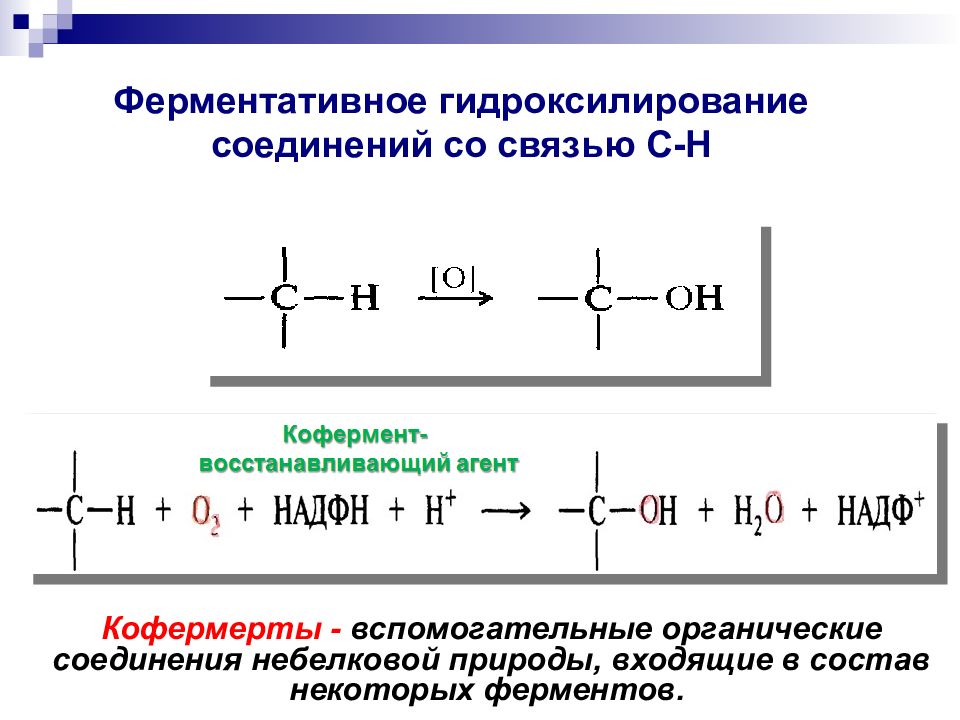
Кофермерты - вспомогательные органические соединения небелковой природы, входящие в состав некоторых ферментов.
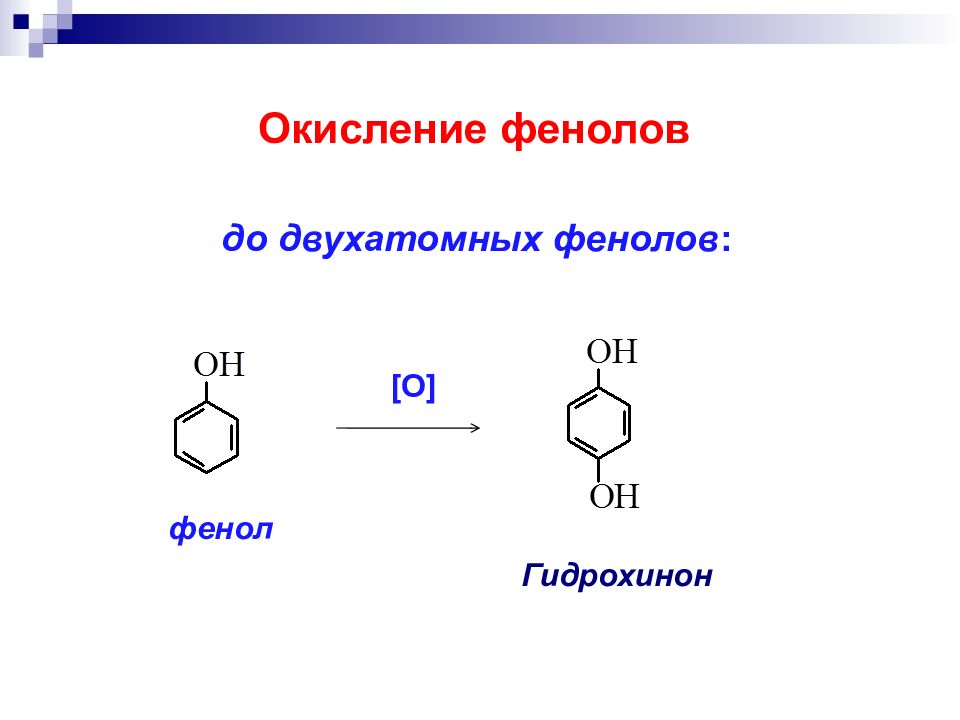
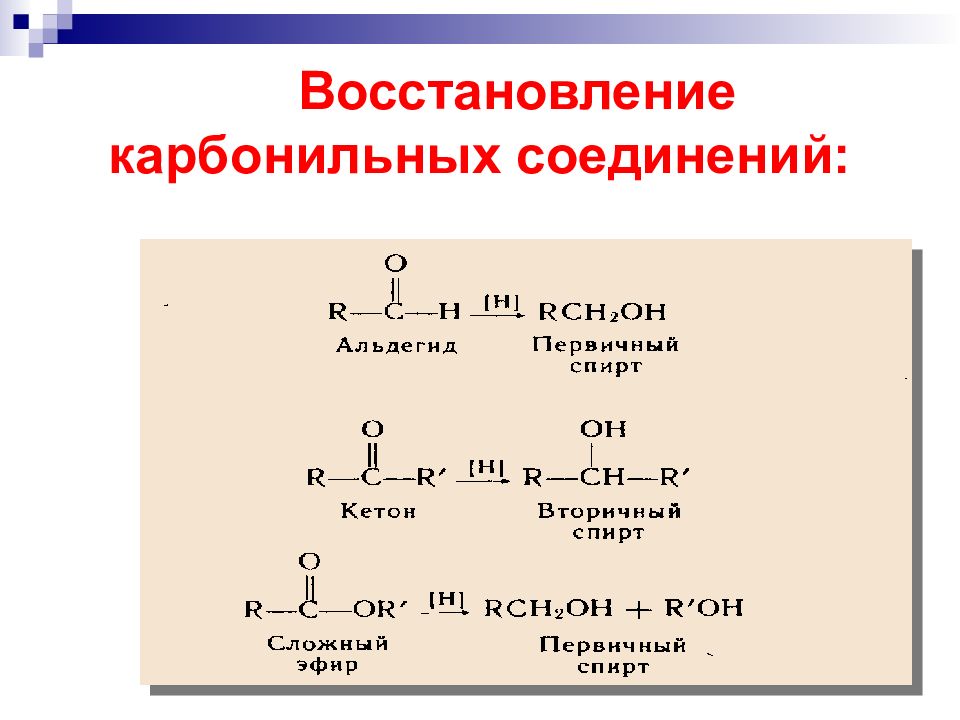
Слайд 25: Окисление спиртов ( получение альдегидов и кетонов ):
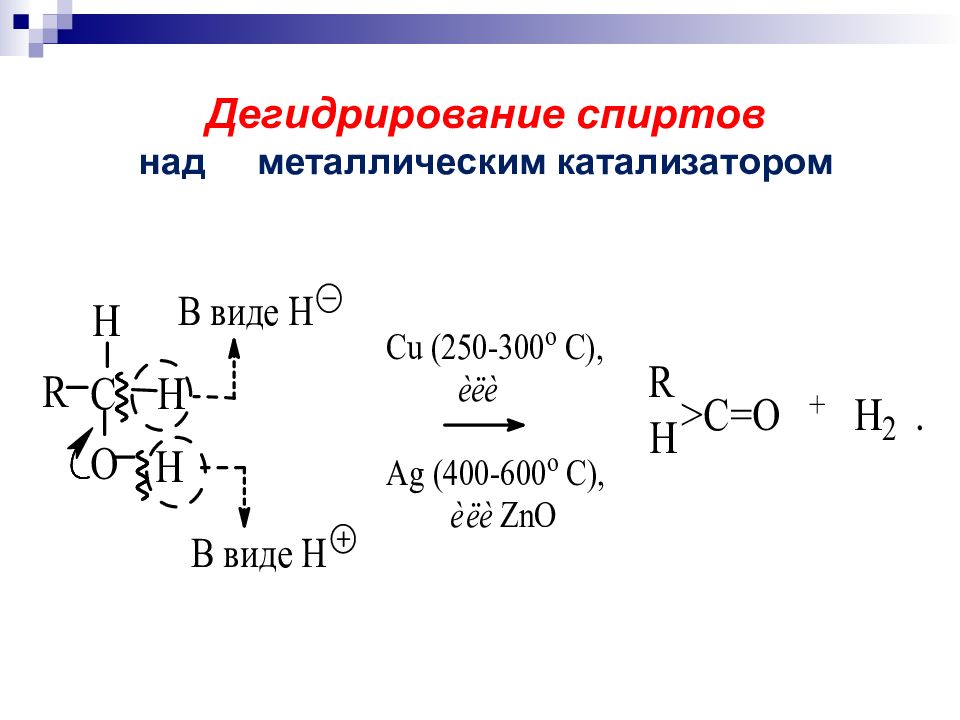
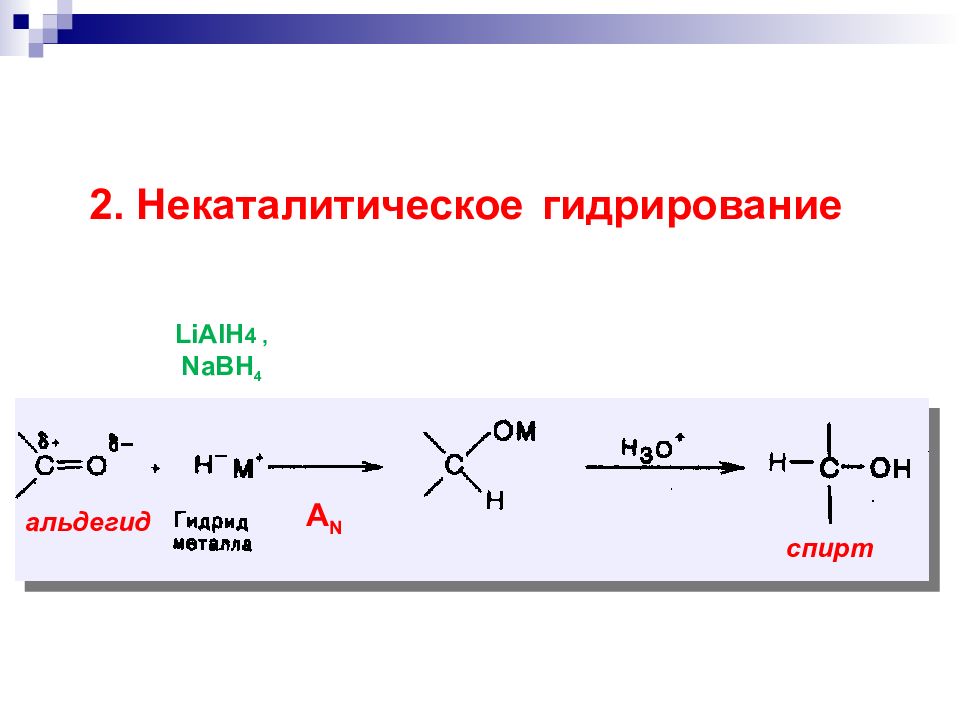
а) дегидрирование спиртов над металлическим катализатором R CH 2 OH + Cu R CH=O 200-300 С «восстановительный эквивалент» Потеря субстратом 2 х атомов Н эквивалентна потере или + H 2
Слайд 27
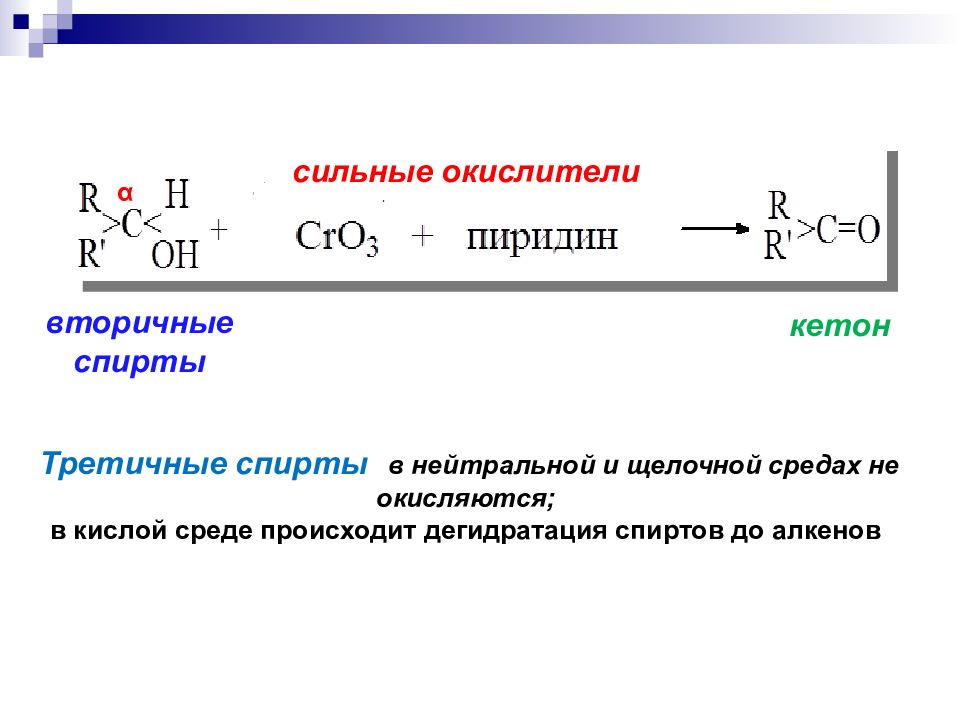
в мягких условиях двухромовая кислота С r(VI ) б) Окисление перв. спиртов первичные спирты α
Слайд 28
Третичные спирты в нейтральной и щелочной средах не окисляются; в кислой среде происходит дегидратация спиртов до алкенов вторичные спирты кетон сильные окислители α
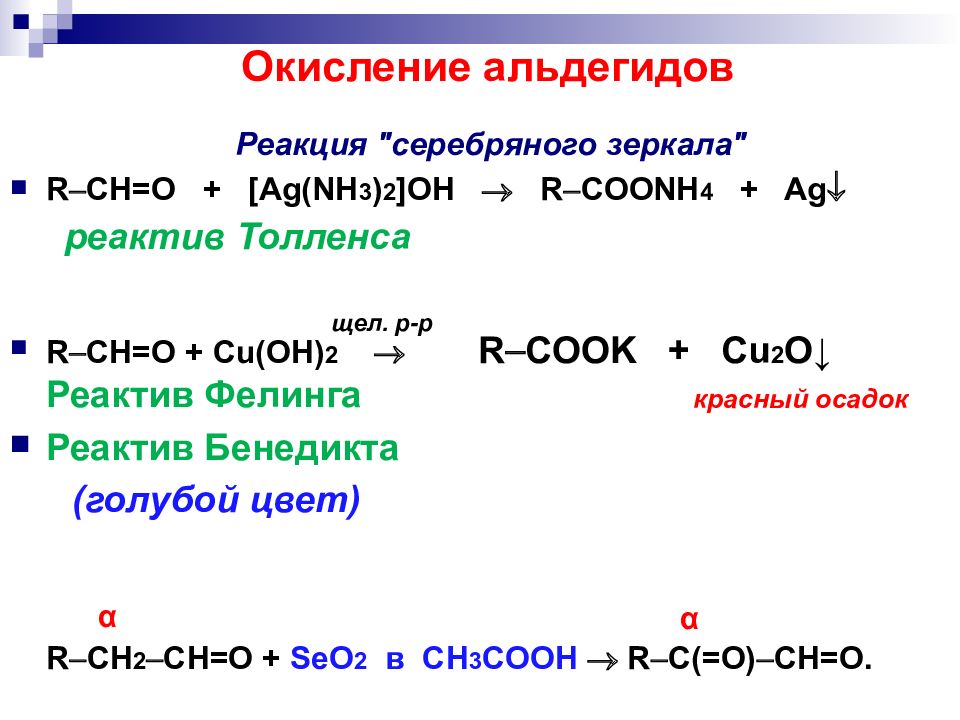
Слайд 29: Окисление альдегидов
R CH=O + [Ag(NH 3 ) 2 ]OH R COONH 4 + Ag реактив Толленса R CH=O + Cu(OH) 2 R COOK + Cu 2 O ↓ Реактив Фелинга Реактив Бенедикта (голубой цвет) R CH 2 CH=O + SeO 2 в CH 3 COOH R C(=O) CH=O. α α Реакция "серебряного зеркала" щел. р -р красный осадок
Слайд 30
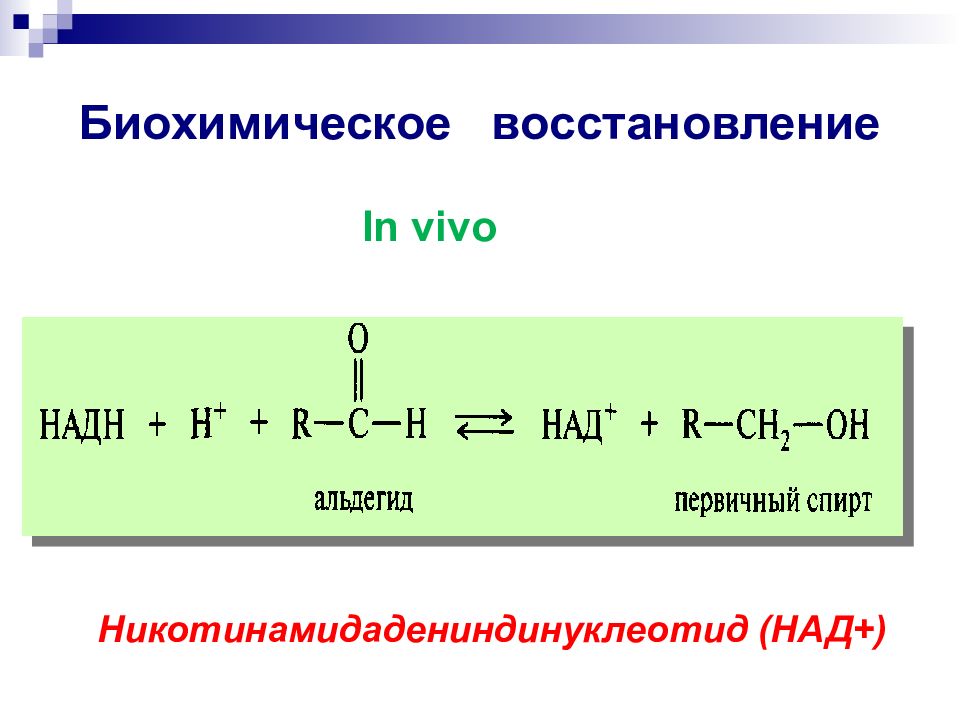
окисленная форма восстановленная форма 1). Кофермент НАД Биологическое дегидрирование:
Слайд 31
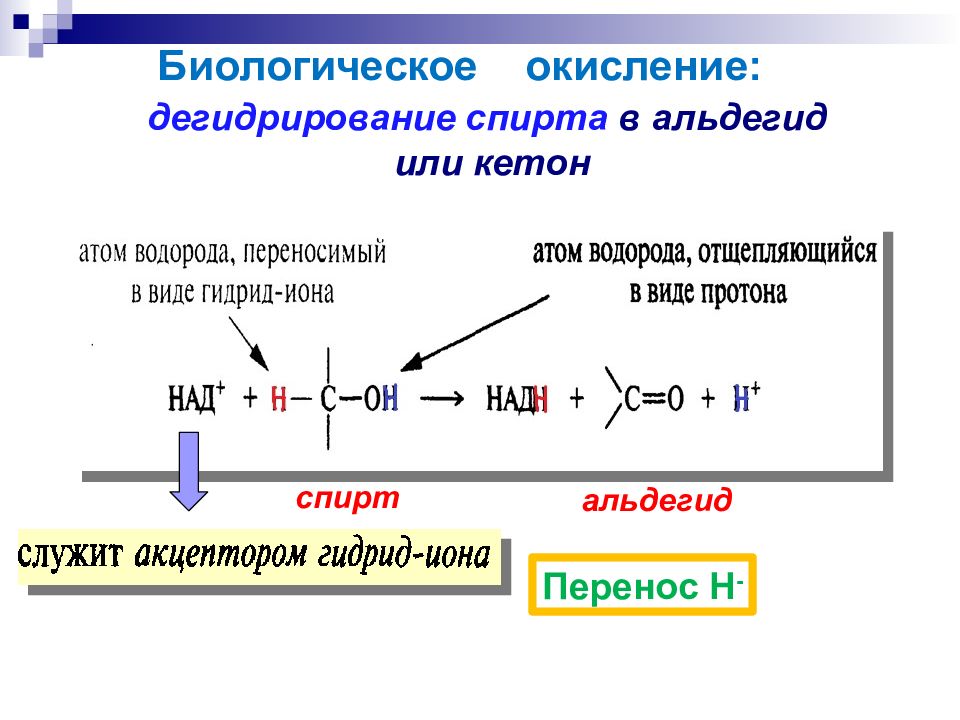
дегидрирование спирта в альдегид или кетон Перенос Н - спирт альдегид Биологическое окисление:
Слайд 32
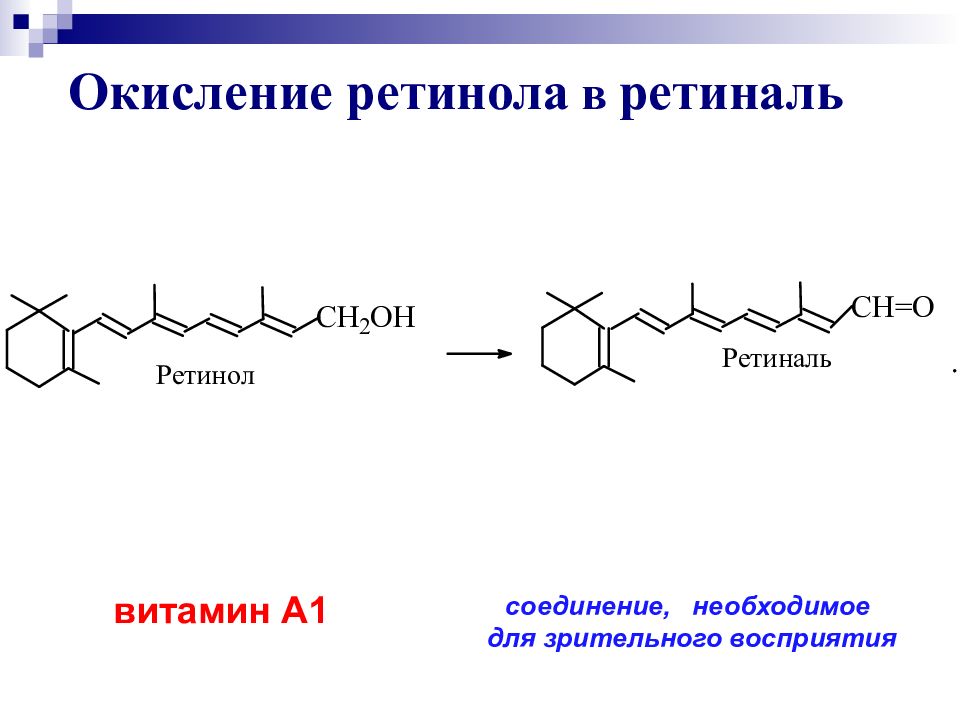
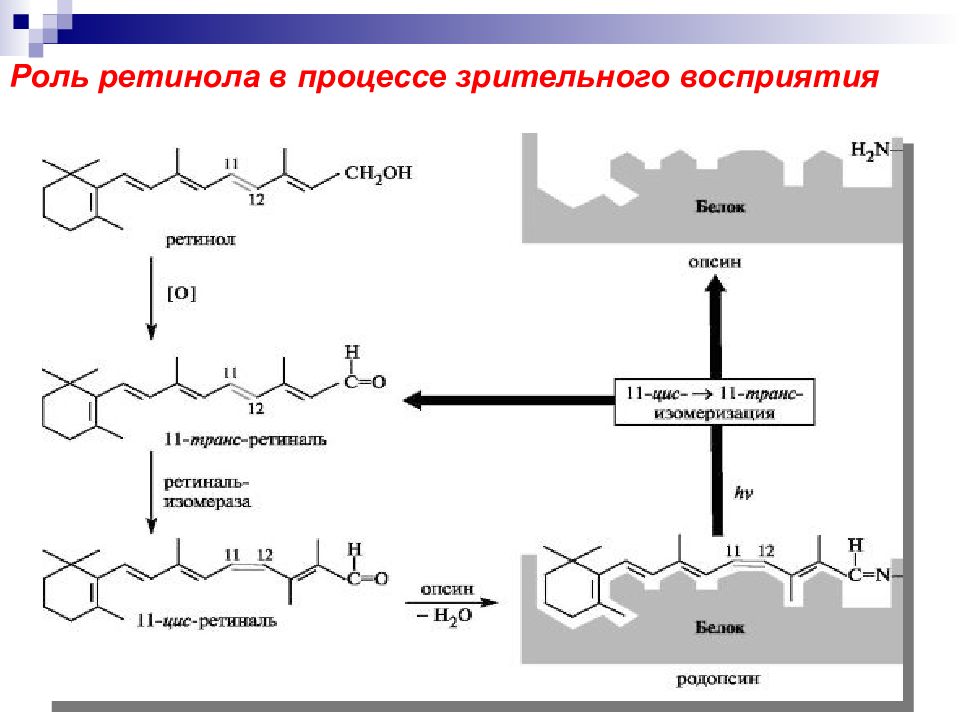
О кисление ретинола в ретиналь витамин А1 соединение, необходимое для зрительного восприятия
Слайд 34
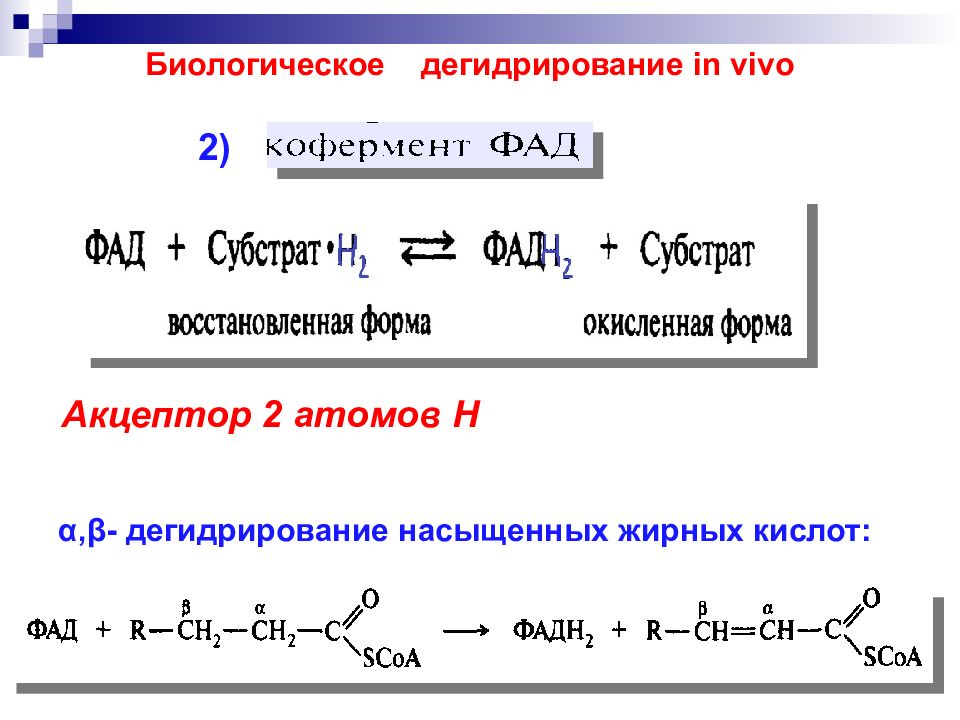
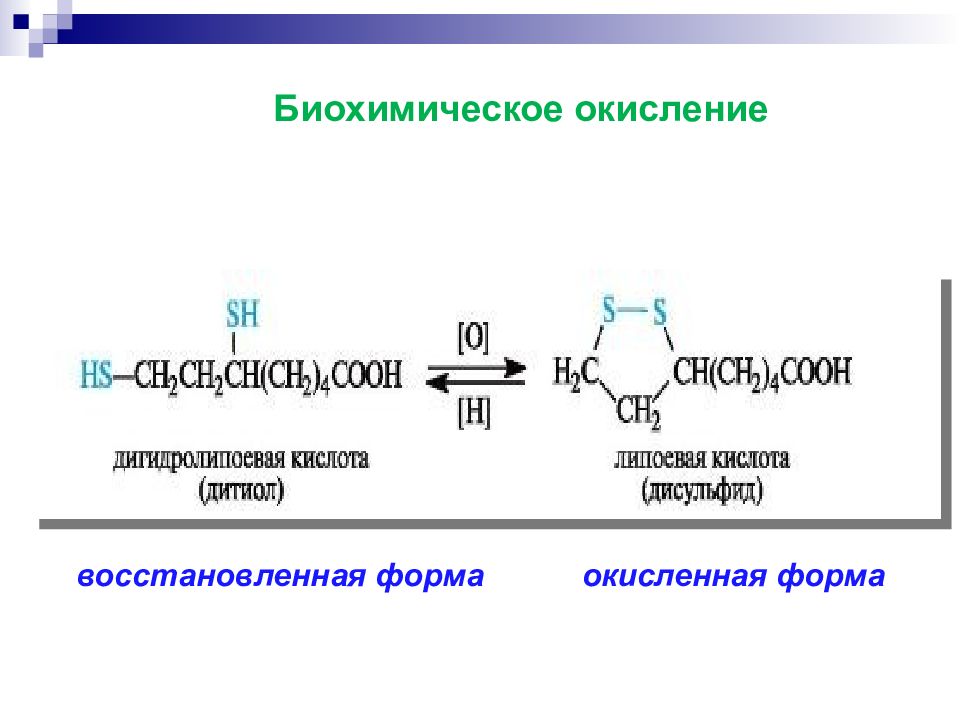
Акцептор 2 атомов Н 2) Биологическое дегидрирование in vivo α,β- дегидрирование насыщенных жирных кислот:
Слайд 35
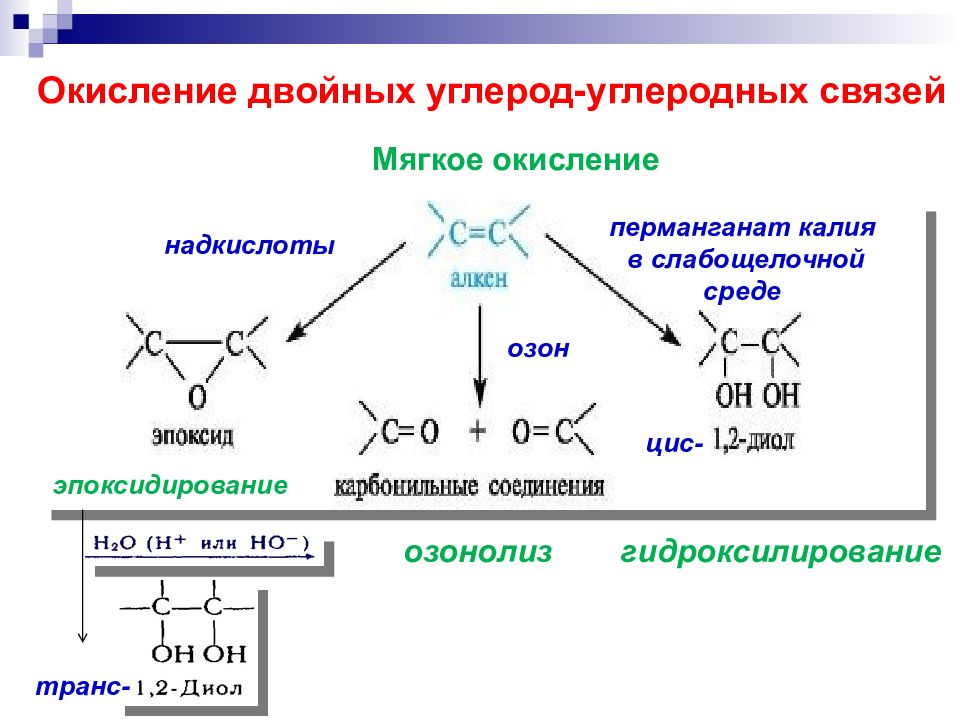
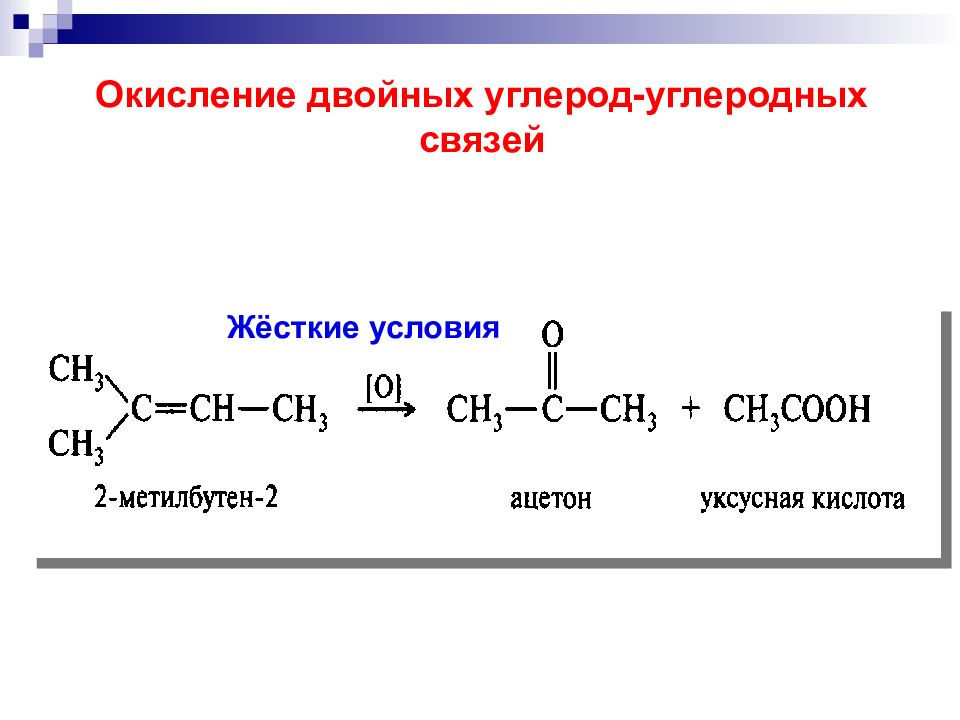
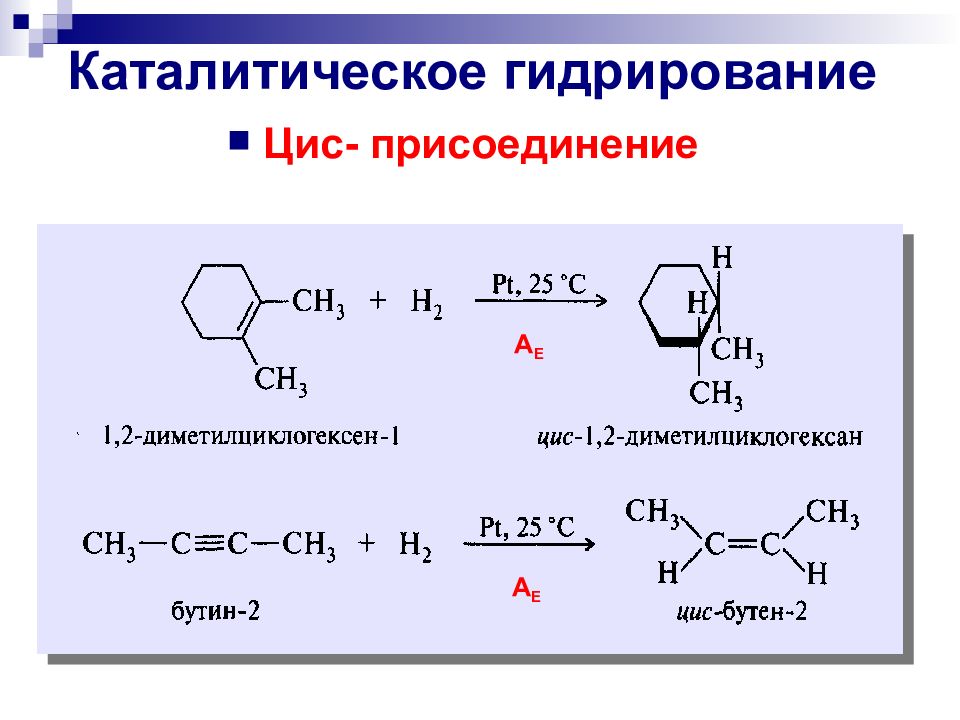
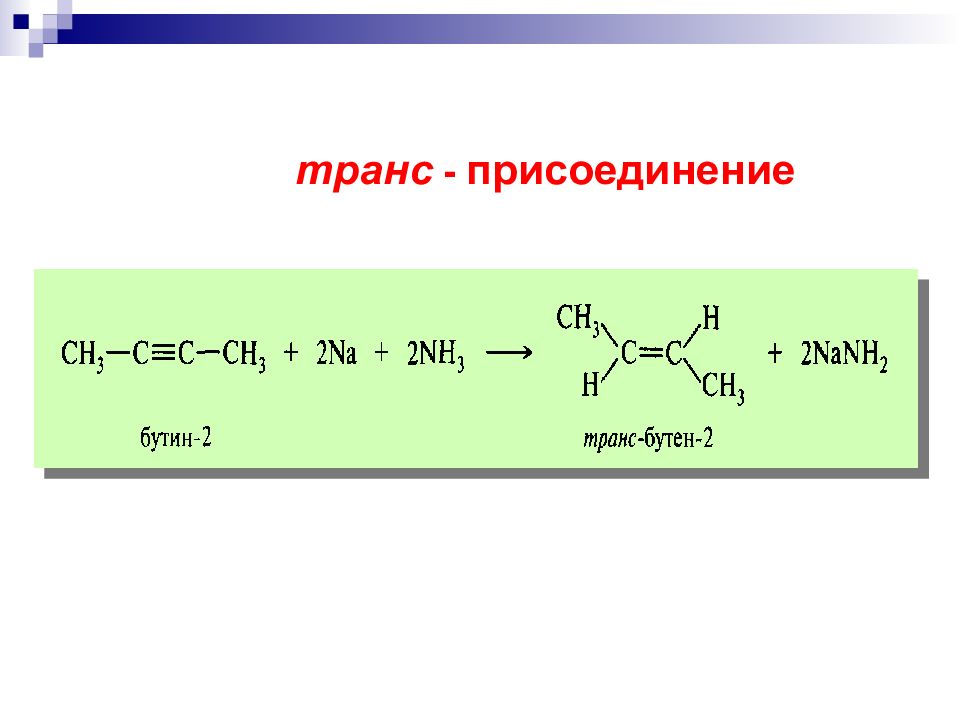
озонолиз гидроксилирование Окисление двойных углерод-углеродных связей Мягкое окисление перманганат калия в слабощелочной среде надкислоты озон эпоксидирование цис - транс-
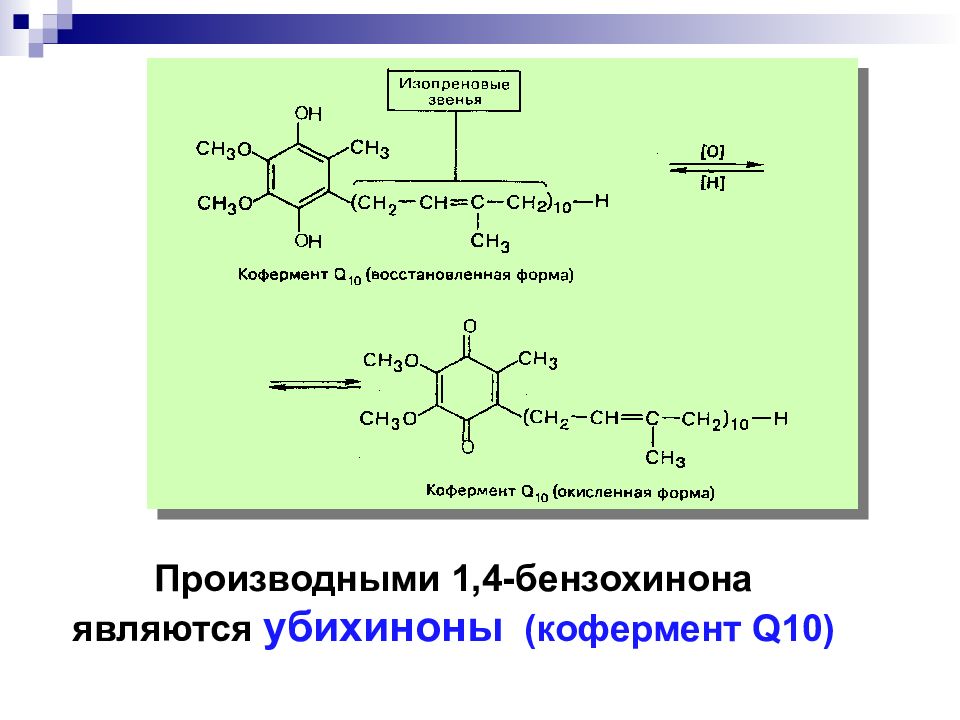
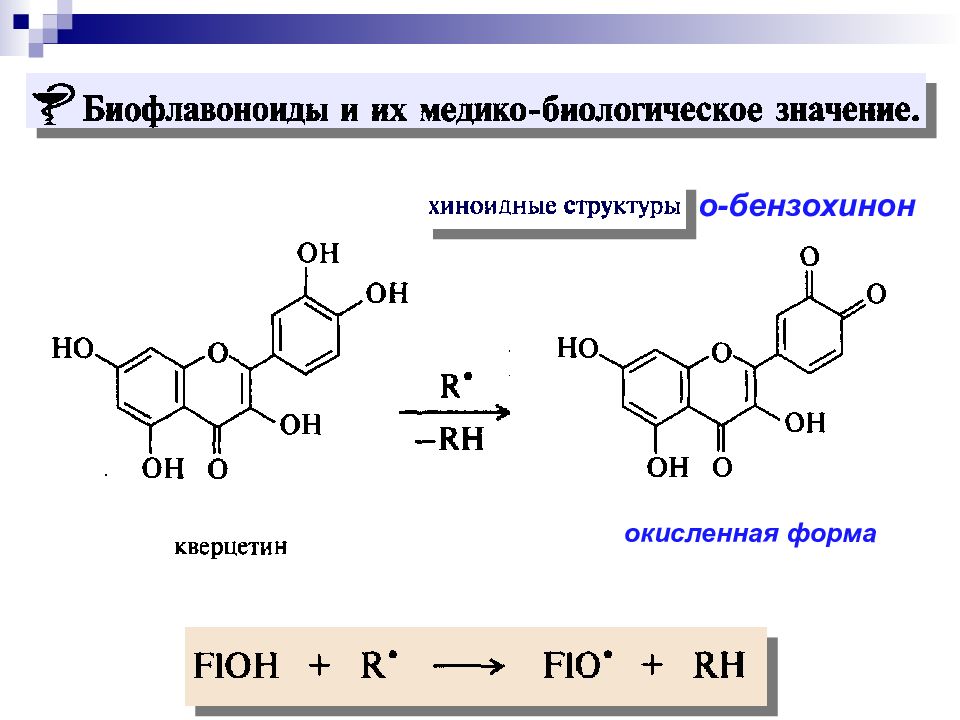
Слайд 39
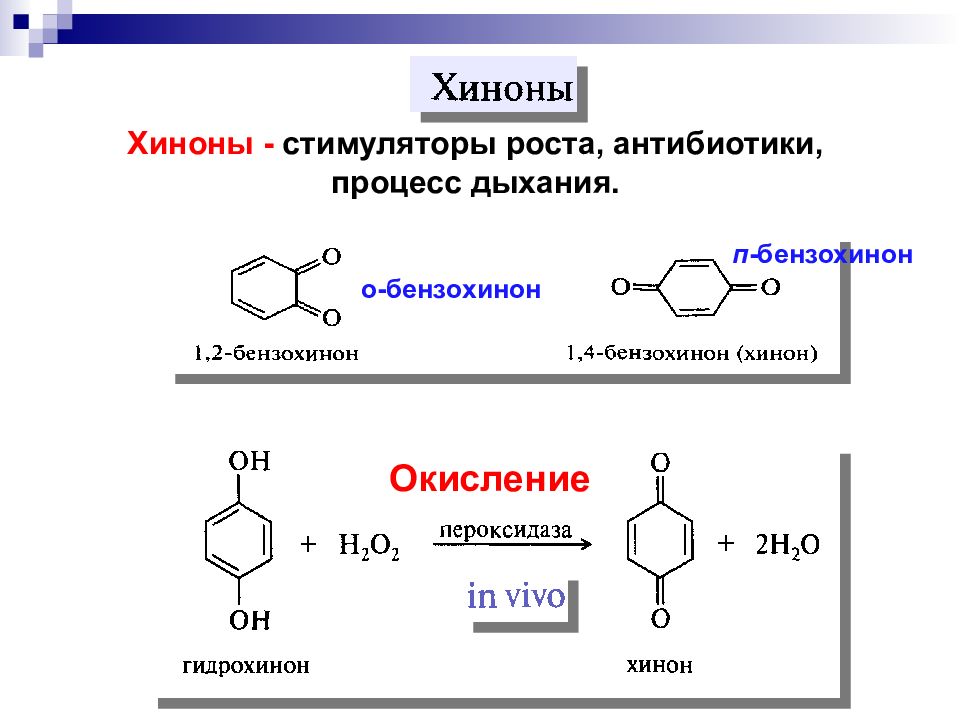
Хиноны - стимуляторы роста, антибиотики, процесс дыхания. о- бензохинон п - бензохинон Окисление
Слайд 41: Функции в организме:
*Обеспечивает выработку энергии на клеточном уровне *Положительно влияет на сердечно-сосудистую систему, головной мозг и периферическую нервную систему *Оказывает поддержку иммунной системе *Повышает регенеративные процессы слизистой оболочки десен и других быстрорастущих тканей * Обладает антиоксидантной активностью CoQ10
Слайд 42: Богатые источники CoQ10
говяжье сердце и другие внутренние органы, яичный желток, печень, треска, молочный жир, различные виды цельного зерна. В среднем человек должен потреблять приблизительно 5 мг CoQ10 в день
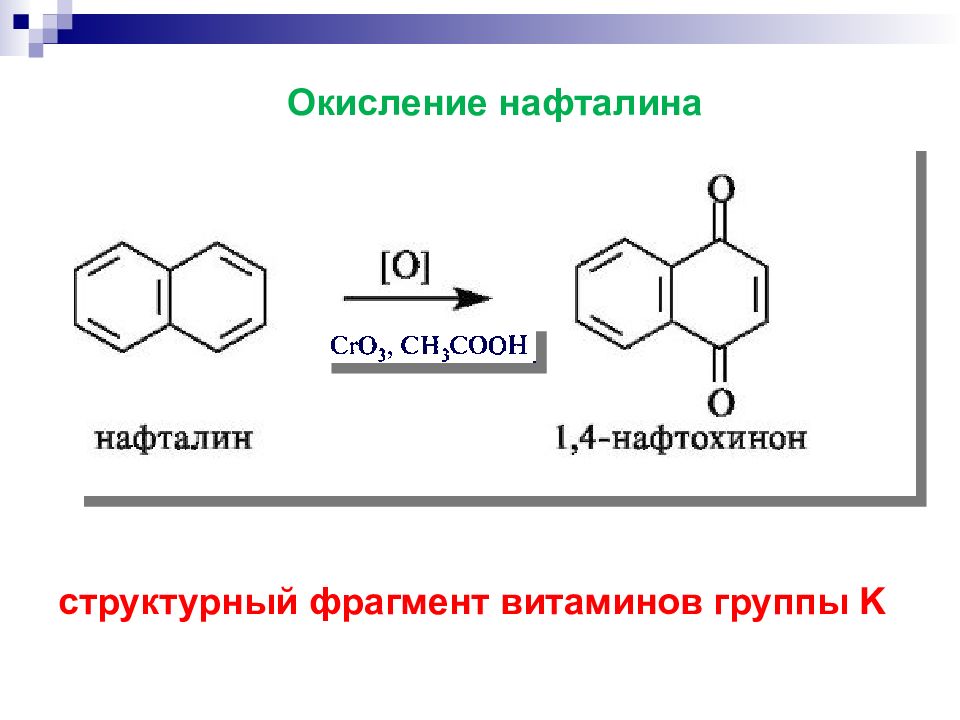
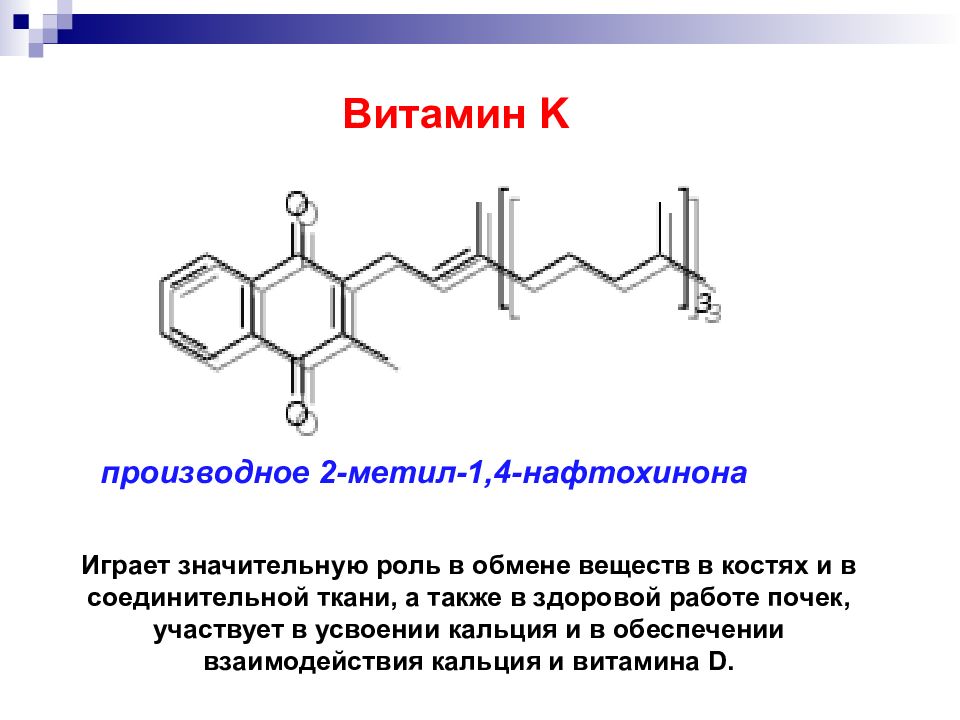
Слайд 45
производное 2-метил-1,4-нафтохинона Витамин K Играет значительную роль в обмене веществ в костях и в соединительной ткани, а также в здоровой работе почек, участвует в усвоении кальция и в обеспечении взаимодействия кальция и витамина D.
Слайд 46
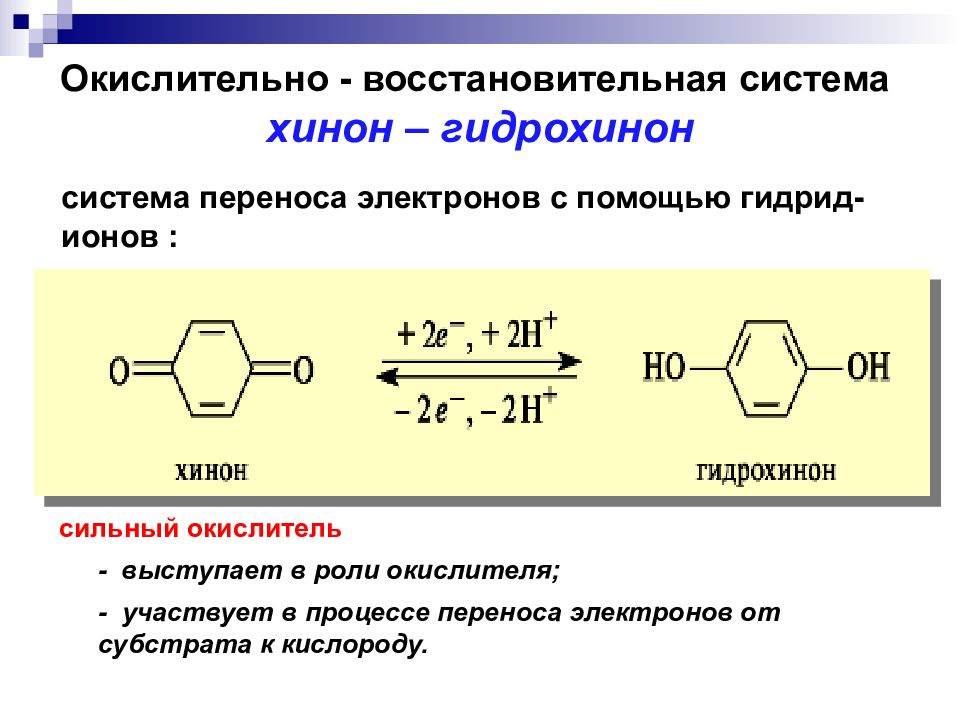
Окислительно - восстановительная система х инон – гидрохинон сильный окислитель - участвует в процессе переноса электронов от субстрата к кислороду. - выступает в роли окислителя; система переноса электронов с помощью гидрид-ионов :
Слайд 47
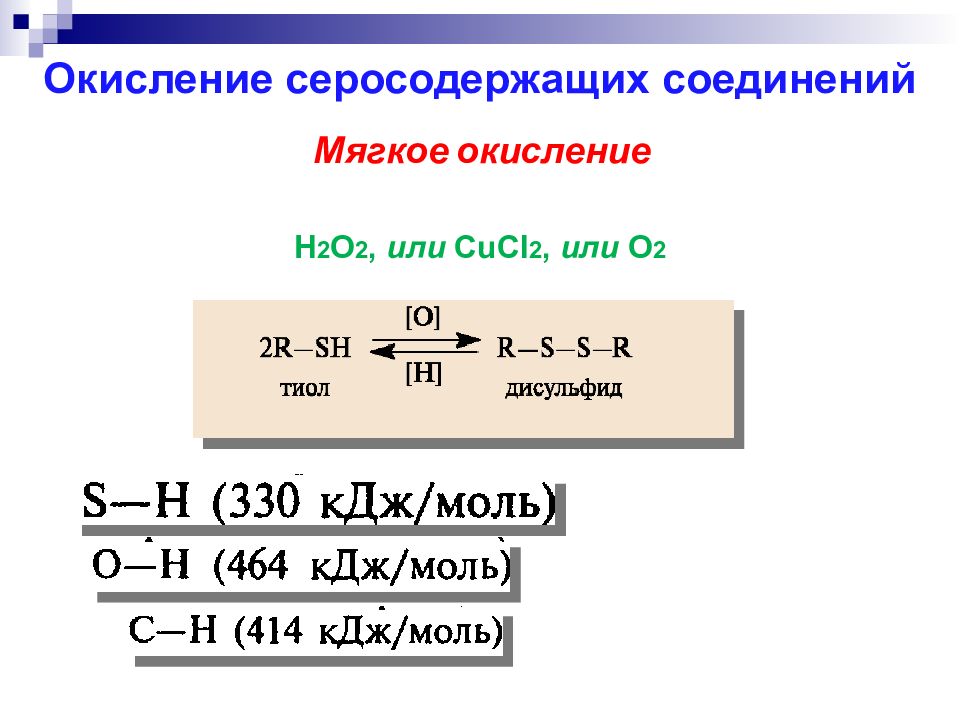
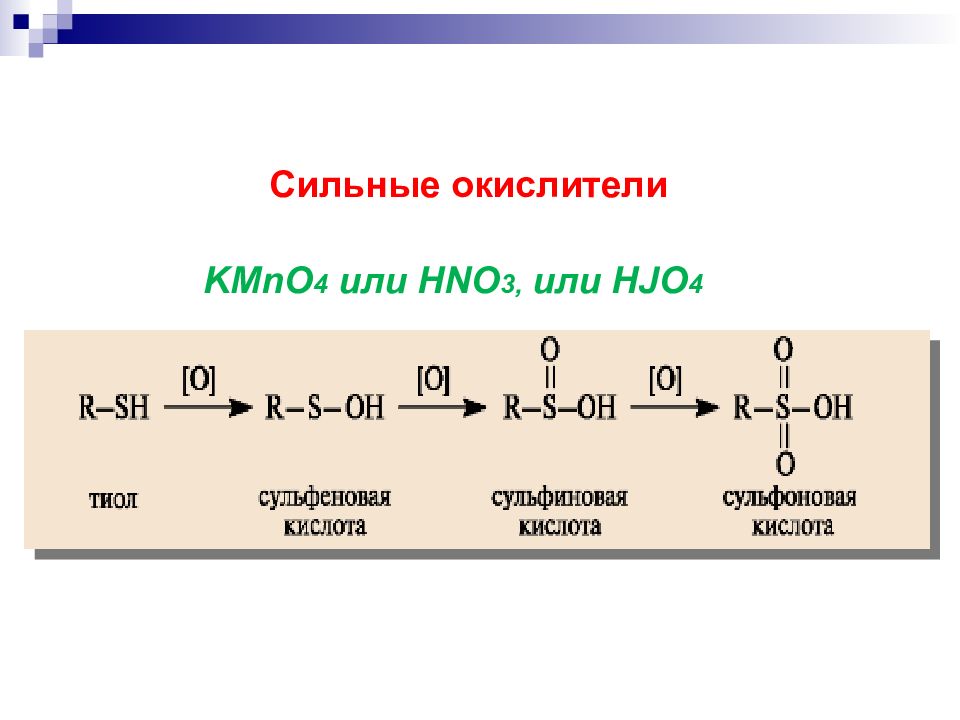
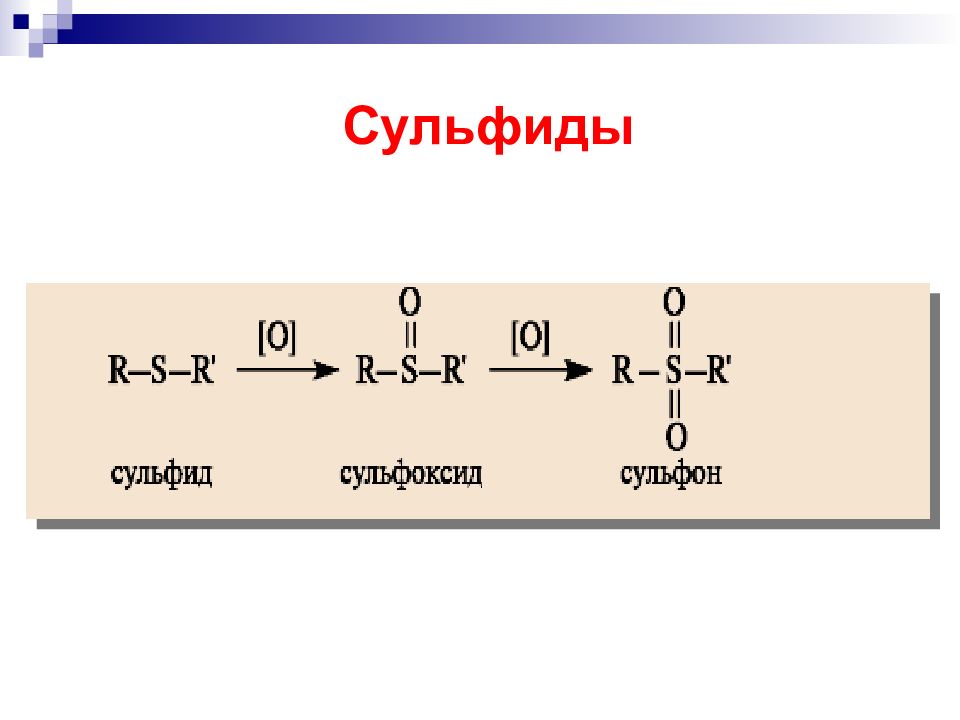
H 2 O 2, или CuCl 2, или O 2 Окисление серосодержащих соединений Мягкое окисление
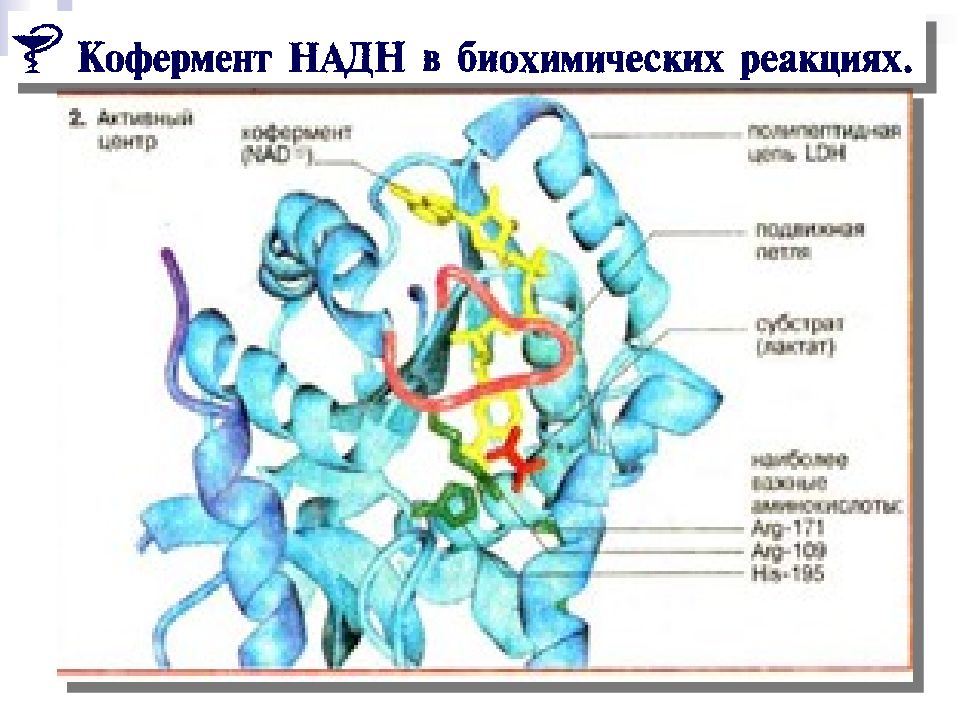
Слайд 58: Биохимическое восстановление
In vivo Никотинамидадениндинуклеотид (НАД +)
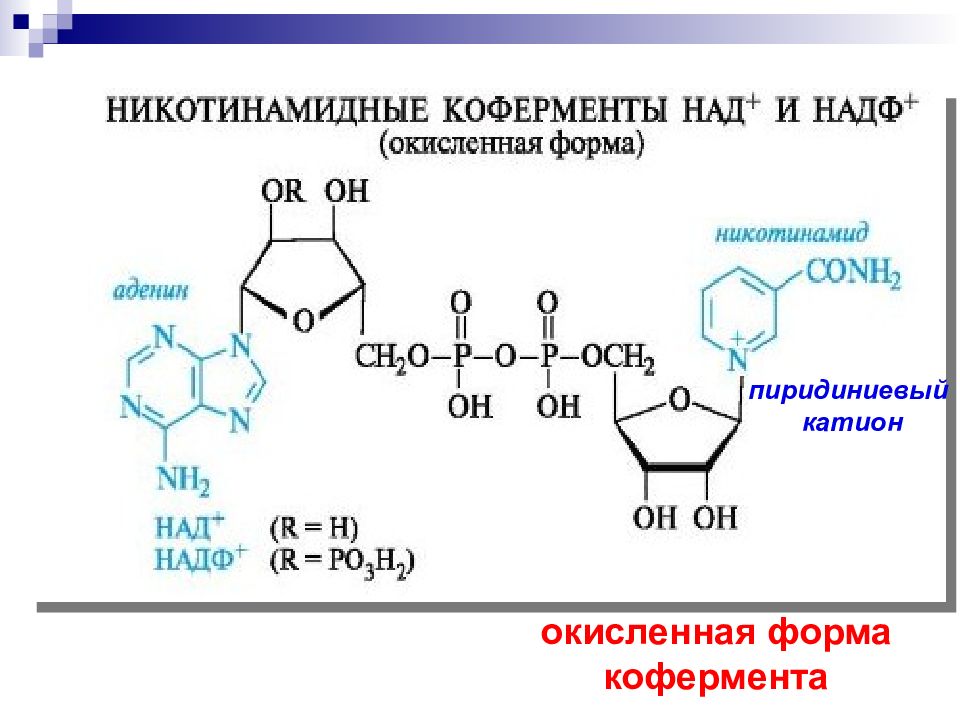
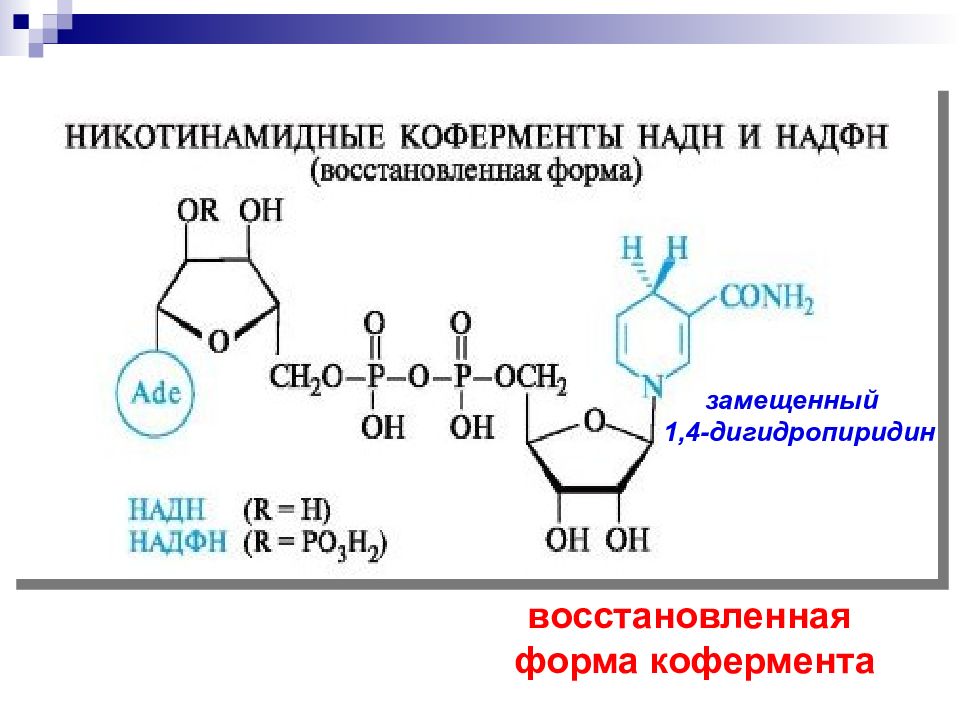
Слайд 59: Никотинамидадениндинуклеотид, НАД
кофермент, присутствующий во всех живых клетках; входит в состав ферментов группы дегидрогеназ Открыт в 1904 в дрожжевом соке английскими биохимиками А. Гарденом и У. Йонгом ; строение установлено в 1936г. О. Варбургом и Х. Эйлером.
Слайд 60: ОТТО ГЕНРИХ ВАРБУРГ
(1883–1970), немецкий биохимик и физиолог, удостоенный в 1931 Нобелевской премии по физиологии и медицине за открытие природы и механизма действия дыхательных ферментов.
Слайд 63
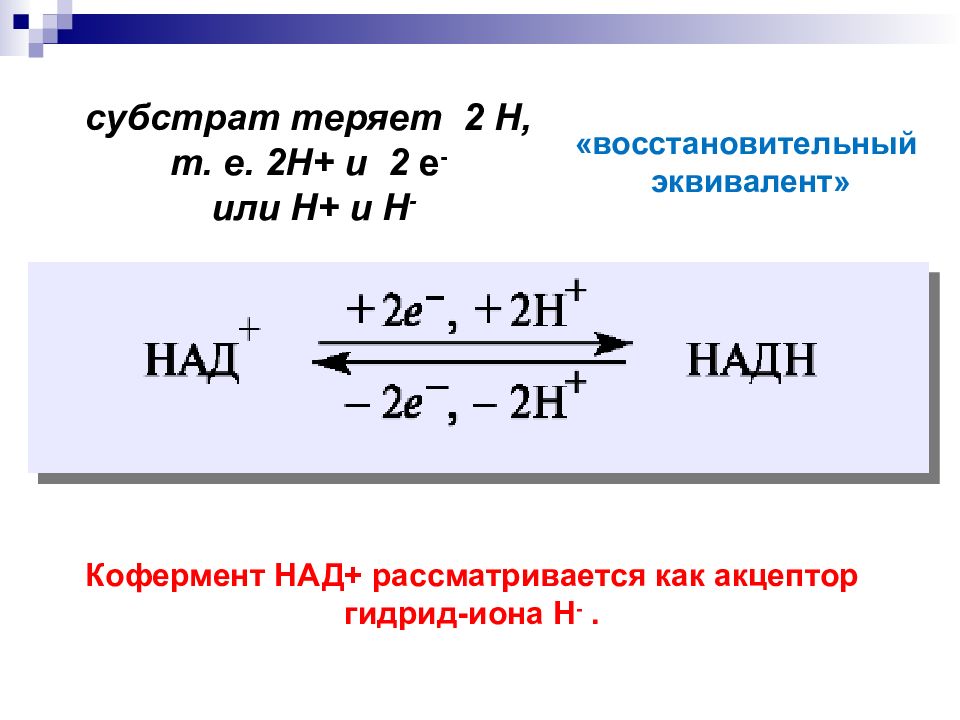
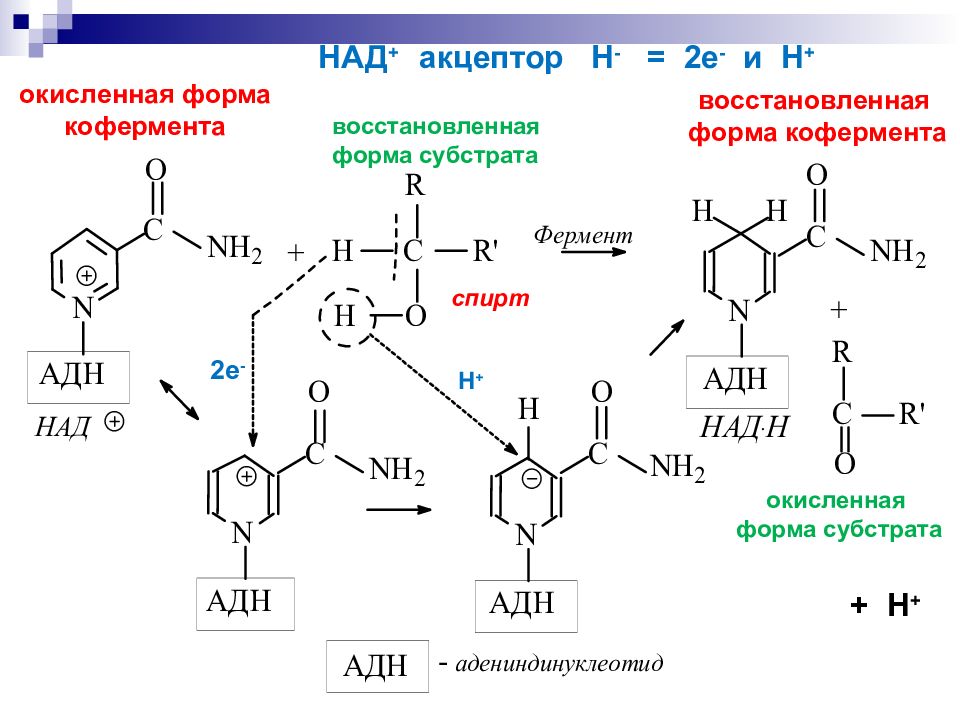
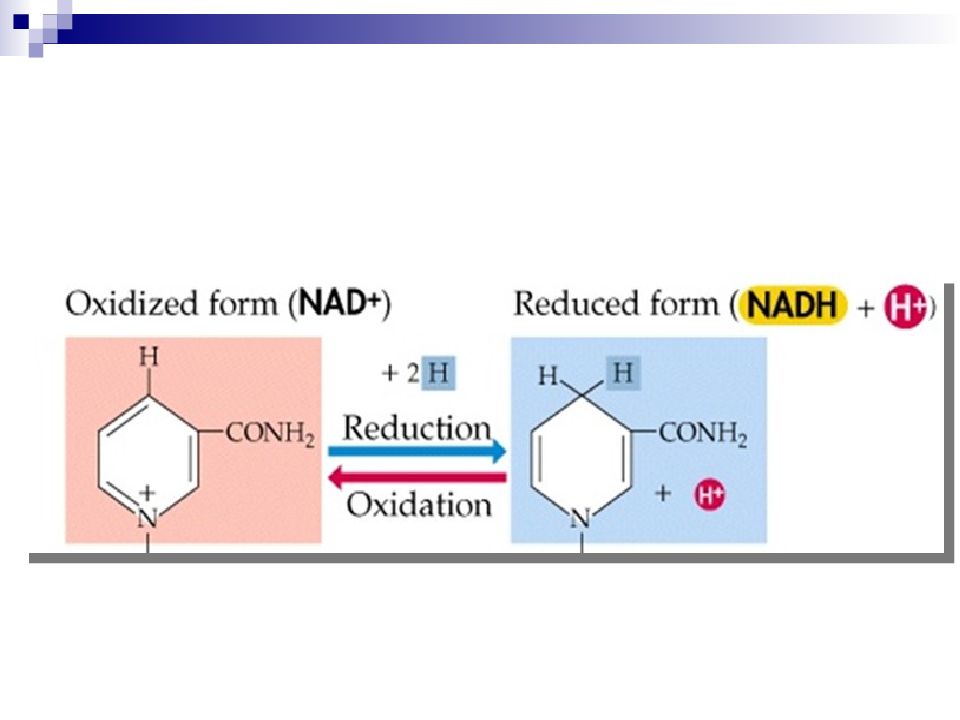
субстрат теряет 2 Н, т. е. 2Н+ и 2 е - или Н + и Н - Кофермент НАД+ рассматривается как акцептор гидрид-иона Н -. « восстановительный эквивалент»
Слайд 64
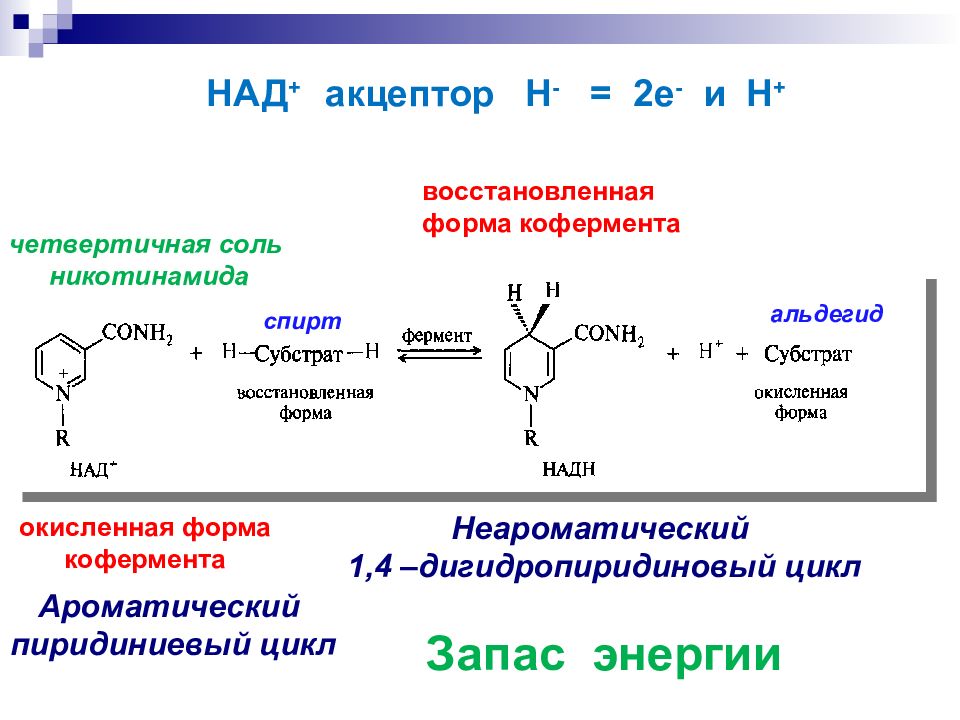
Ароматический пиридиниевый цикл Неароматический 1,4 – дигидропиридиновый цикл Запас энергии четвертичная соль никотинамида спирт альдегид окисленная форма кофермента восстановленная форма кофермента НАД + акцептор Н - = 2е - и Н +
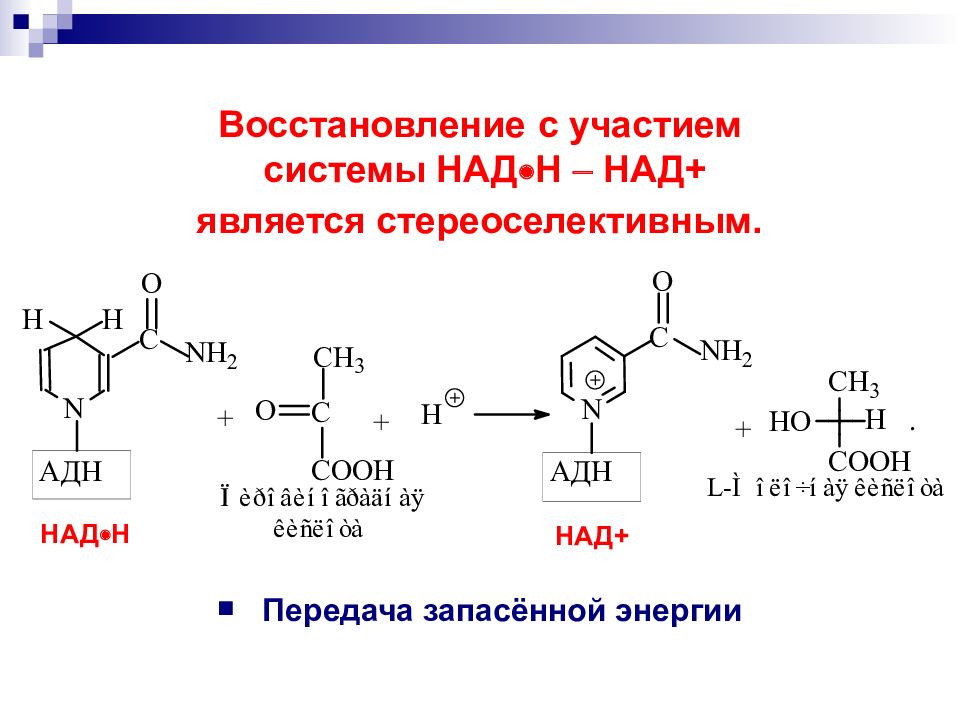
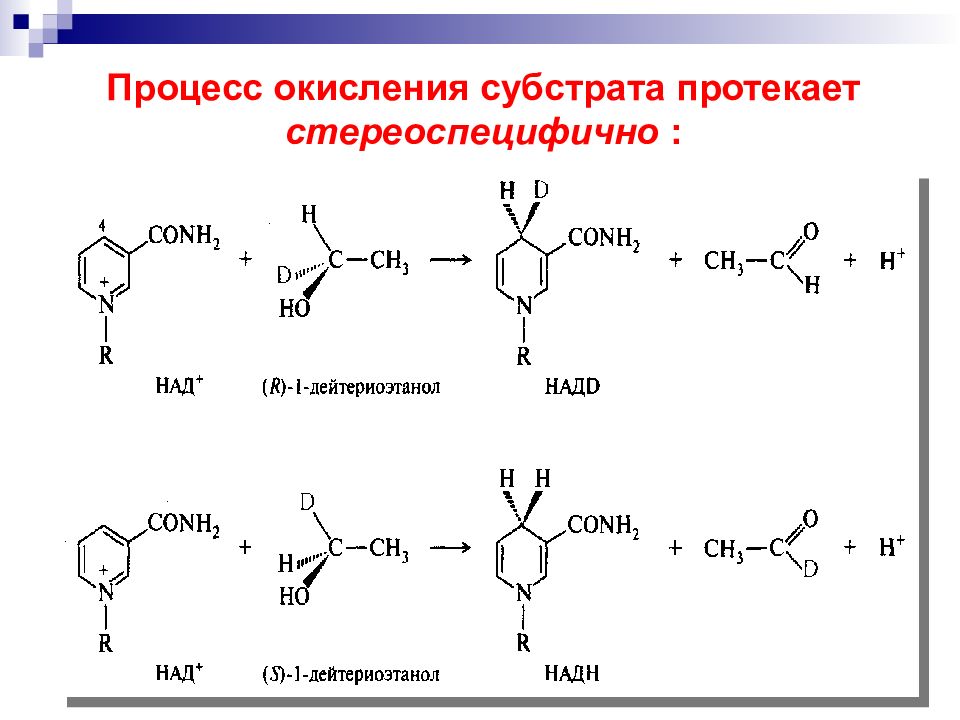
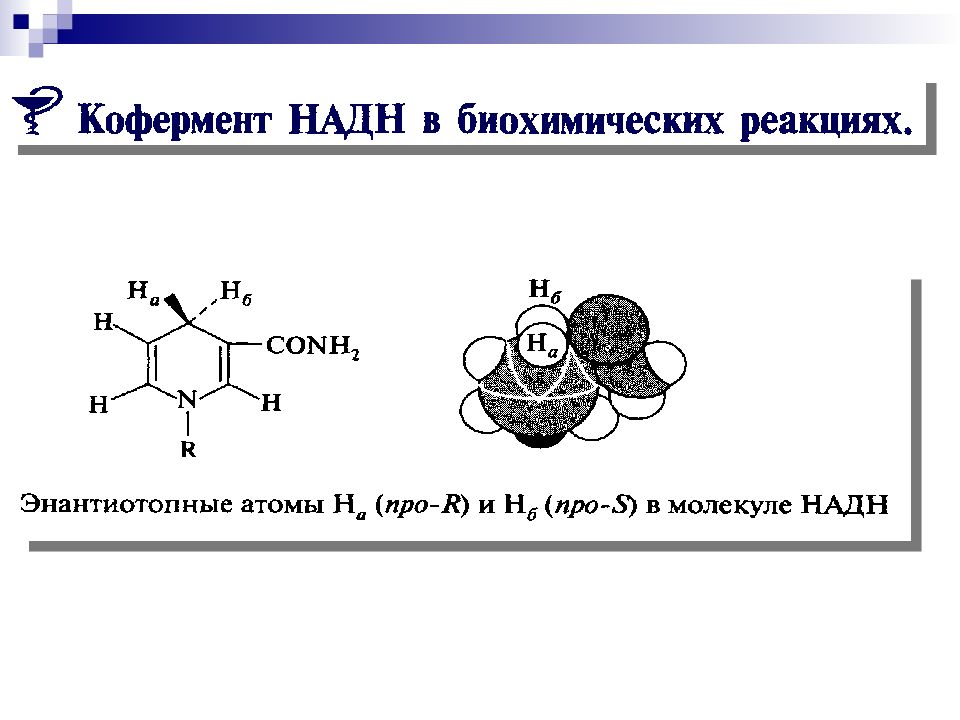
Слайд 66: Восстановление с участием системы НАД Н НАД + является стереоселективным
Передача запасённой энергии НАД Н НАД+
Слайд 67
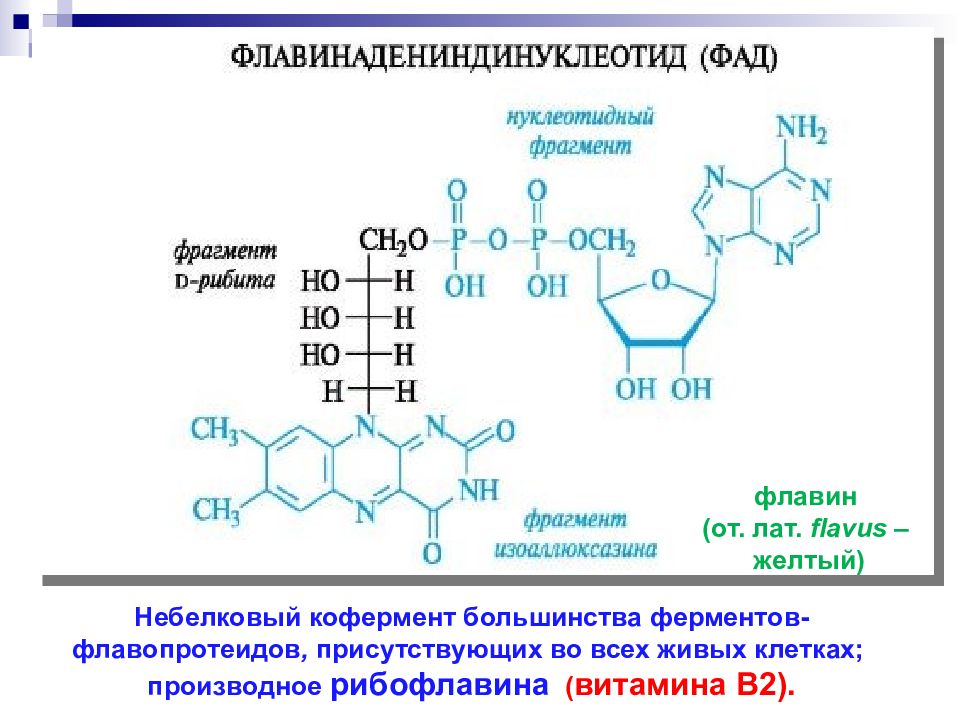
Небелковый кофермент большинства ферментов- флавопротеидов, присутствующих во всех живых клетках; производное рибофлавина ( витамина В2). флавин ( от. лат. flavus – желтый )
Слайд 68
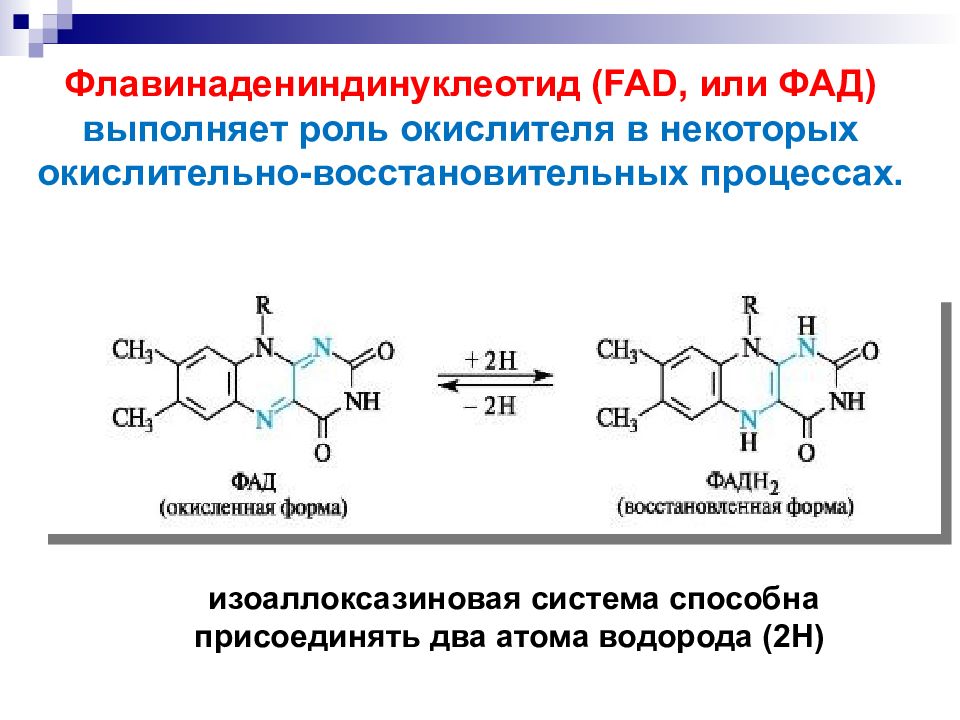
Флавинадениндинуклеотид (FAD, или ФАД) выполняет роль окислителя в некоторых окислительно -восстановительных процессах. изоаллоксазиновая система способна присоединять два атома водорода (2Н)
Слайд 70
Спасибо всем ! Скажи мне – и я забуду, Покажи мне – и я запомню, Вовлеки меня – и я научусь! Китайская мудрость
Слайд 72
восстановленная форма субстрата окисленная форма кофермента восстановленная форма кофермента окисленная форма субстрата 2е - Н + + Н + НАД + акцептор Н - = 2е - и Н + спирт