Первый слайд презентации
ФАРМАКОЛОГИЯ МЕСТНЫХ АНЕСТЕТИКОВ Акулов М.С. Кафедра анестезиологии и реаниматологи ВПКВ Нижегородской медицинской академии 2010
Слайд 5
Анализ структуры анестезий в 5 африканских странах (Сенегал, Чад, Центрально-Африканская республика, Нигер, Мозамбик) показал, что доля регионарных анестезий составляет 22,5% (от 15 до 69%) Частота осложнений – 1,5%, летальных – 0,2% ( Carpentier J. // Ann.Fr.Anesth.Reanim. – 2001 )
Слайд 6
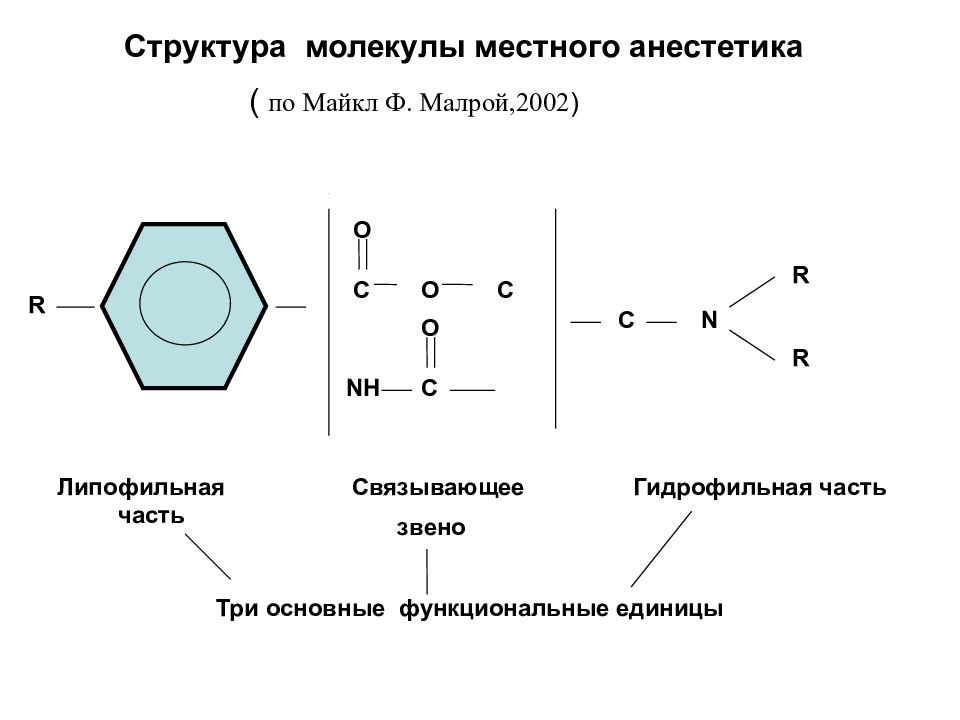
Структура молекулы местного анестетика ( по Майкл Ф. Малрой,2002 ) R C O O C NH C O C N R R Липофильная часть Связывающее звено Гидрофильная часть Три основные функциональные единицы
Слайд 7
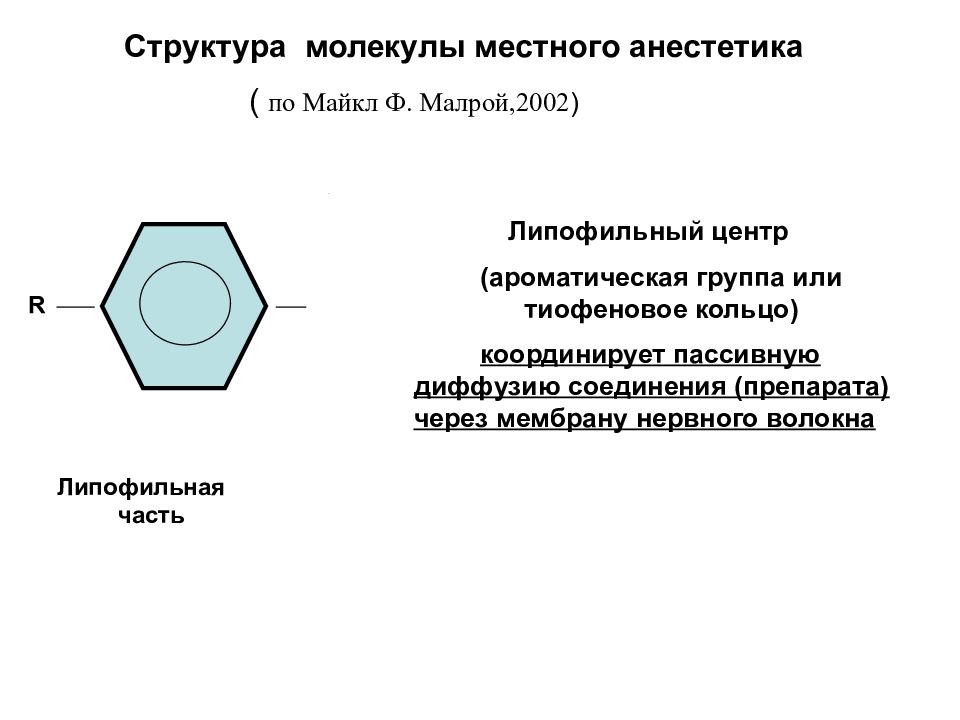
Структура молекулы местного анестетика ( по Майкл Ф. Малрой,2002 ) R Липофильная часть Липофильный центр (ароматическая группа или тиофеновое кольцо) координирует пассивную диффузию соединения (препарата) через мембрану нервного волокна
Слайд 8
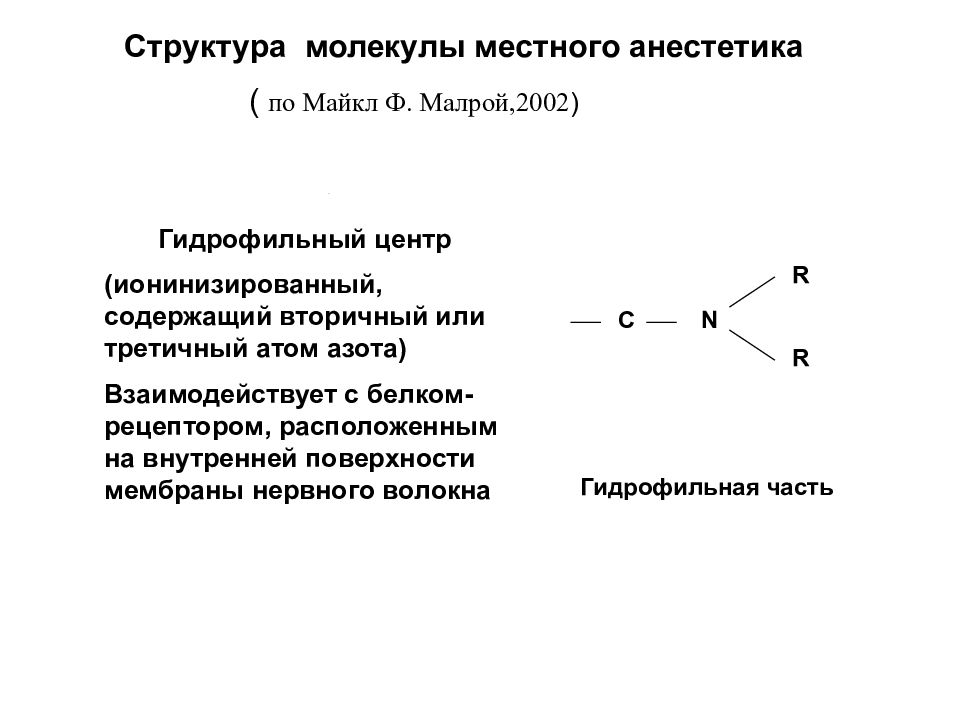
Структура молекулы местного анестетика ( по Майкл Ф. Малрой,2002 ) C N R R Гидрофильная часть Гидрофильный центр (ионинизированный, содержащий вторичный или третичный атом азота) Взаимодействует с белком-рецептором, расположенным на внутренней поверхности мембраны нервного волокна
Слайд 9
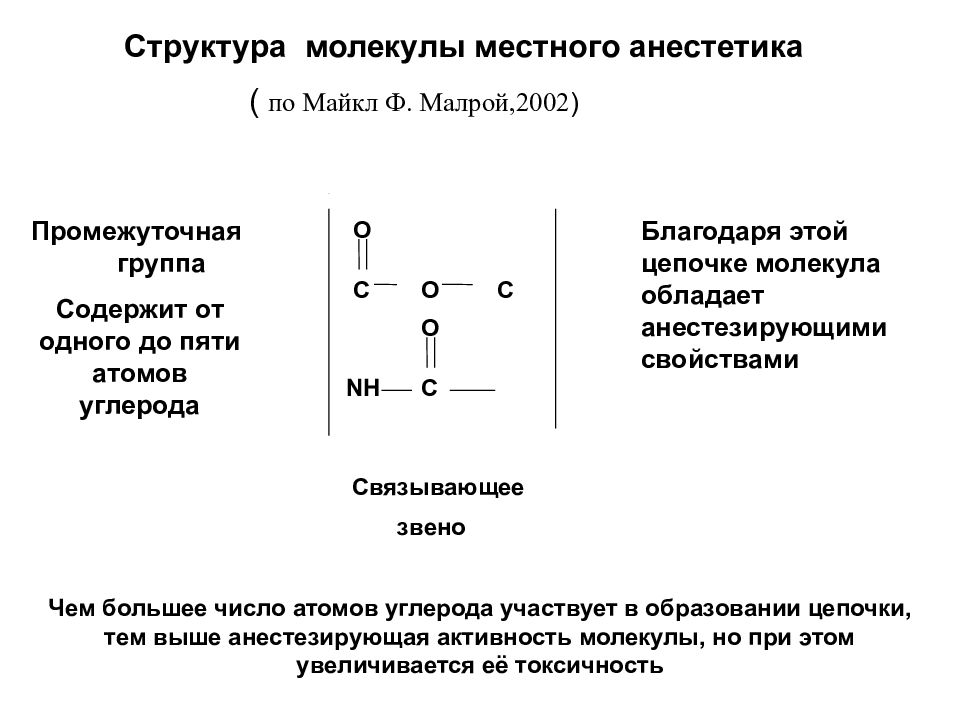
Структура молекулы местного анестетика ( по Майкл Ф. Малрой,2002 ) C O O C NH C O Связывающее звено Промежуточная группа Содержит от одного до пяти атомов углерода Благодаря этой цепочке молекула обладает анестезирующими свойствами Чем большее число атомов углерода участвует в образовании цепочки, тем выше анестезирующая активность молекулы, но при этом увеличивается её токсичность
Слайд 10
Эфирная или амидная часть между двумя частями соединения определяет интенсивность метаболизма и анестезирующее действие, а так же проявляющееся в специфической токсичности веществ. (-СОО- ) -эфирная группа гидролизируется холинэстеразой ( -NHCO-) – амидная группа подвергается метаболизму в печени, а малая часть эксретируется в неизменном виде Раствор МА содержит равновесную смесь ионизированной ( катионовой) соли и неионизированного основания. Совместное существование с липофильной и гидрофильными частями обеспечивает возможность проникновения как через гидрофильные, так и через липофильные мембраны, что является основным свойством, позволяющим проникать этим соединениям через оболочку нервной клетки и вызывать анестезию.
Слайд 11
Эфирная или амидная часть между двумя частями соединения определяет интенсивность метаболизма и анестезирующее действие, а так же проявляющееся в специфической токсичности веществ.
Слайд 12
Влияние на эффекты местных анестетиков рКа – константа диссоциации. pKa – отрицательный логарифм константы диссоциации кислоты которая отражает значение рН, при котором молекула ионизирована на 50%. Только неионизированные формы могут проникать через липидные мембраны. Растворы с более высокой рКа обычно действуют медленнее вследствие меньшей эффективности препарата в месте действия. Чем выше рКа, тем меньше присутствует неионизированной (основание) формы препарата. Чем меньше рКа, тем быстрее начало действия анестетика.
Слайд 14
Действие анестететиков: на наружное отверстие натриевого канала действие не оказывается. Вначале в тканях на поверхности нервного волокна существует равно-весие между ионизированной солью и слаборастворимым основанием. Неионизированное основание обладает большей способностью проникать через липидные слои эпиневрия и клеточной стенки. Основание может достигать натриевого канала путем прямой диффузии через внутреннюю аксолемму. Катионные формы молекул во время деполяризации могут проникать в канал со стороны его внутреннего отверстия и нарушать ток ионов натрия. Эта блокада зависит от концентрации препарата и она обратима. Оно заканчивается, когда кон-центрация препарата становится ниже необходимого минимального уровня. В + Н + ВН + В + Н + ВН + ВН + Аксоплазма
Слайд 15
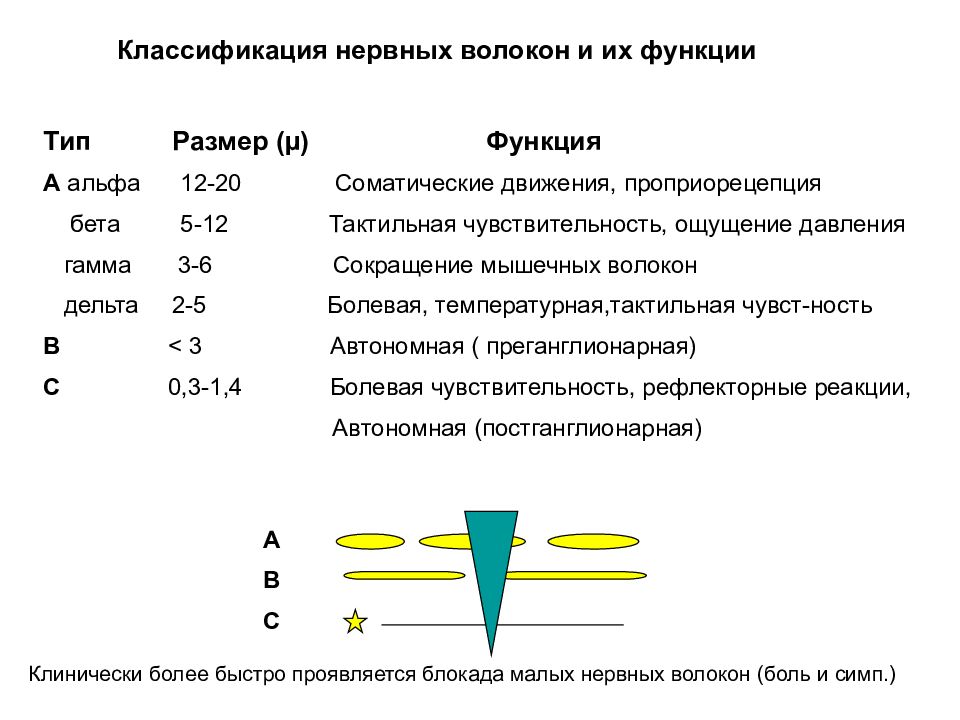
Классификация нервных волокон и их функции Тип Размер ( µ ) Функция А альфа 12-20 Соматические движения, проприорецепция бета 5-12 Тактильная чувствительность, ощущение давления гамма 3-6 Сокращение мышечных волокон дельта 2-5 Болевая, температурная,тактильная чувст-ность В < 3 Автономная ( преганглионарная) С 0,3-1,4 Болевая чувствительность, рефлекторные реакции, Автономная (постганглионарная) А В С Клинически более быстро проявляется блокада малых нервных волокон (боль и симп.)
Слайд 16
Свойства местных анестетиков Характеристика Коррелят Химическая связь Метаболизм Жирорастворимость Активность* Константа диссоциации Быстрота действия Связывание с белками Продолжительность действия Частично-зависимая блокада Сенсорно-моторная диссоциация Сосудорасширяющее действие Длительность, видимое действие Проницаемость тканей Быстрота действия Жирорастворимость - чем лучше растворимость в липидных структурах оболочки нервных клеток, тем быстрее начинает действовать препарат. * Единицей активности м.а. является минимальная концентрация (С m ) м.а., необходимая для блокады проведения импульса по нервному волокну с данным диаметром в течение «обоснован-ного» периода времени.
Слайд 17
Влияние на эффекты местных анестетиков рКа – константа диссоциации. Только неионизированные формы могут проникать через липидные мембраны, растворы с более высокой рКа обычно действуют медленнее вследствии меньшей эффективности препарата в месте действия. Связывание с белками – Натриевые каналы являются белковыми структурами. Продолжительность действия м.а. зависит от их афинности к этим белковым соединениям. Бо ‘ льшая способность к связыванию с белками удлиняет время «вымывания». Связывание с белками влияет так же на токсичность. Вазодилатация уменьшает время действия м.а.
Слайд 18
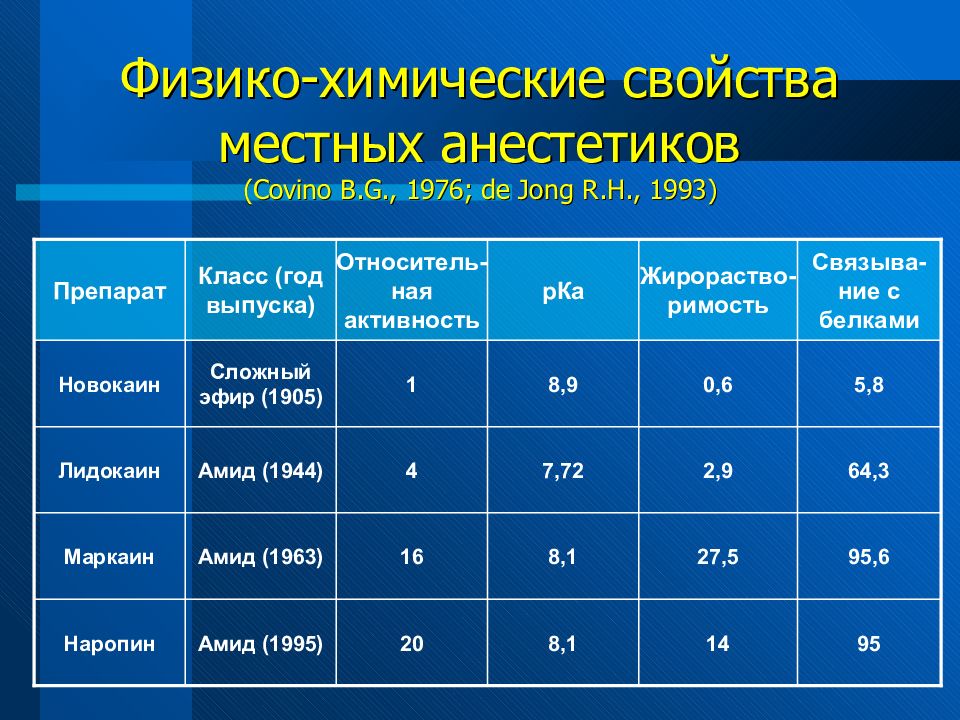
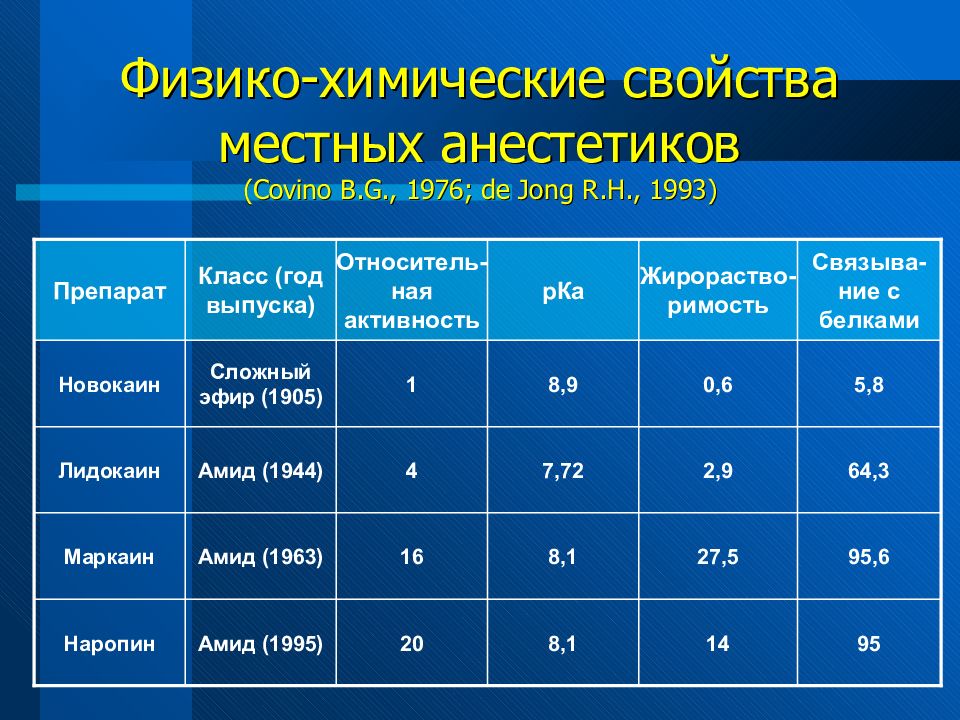
Физико- химические свойства местных анестетиков (эфирных) Свойства Новокаин Дикаин Активность 1 16 рКа 8,9 8,5 Жирорастворимость 0,6 80 Связывание с белками 5,8 75,6 Эфирные связи не стойкие и разрушаются холинэстеразой. Это влияет на длительность действия препарата.
Слайд 19
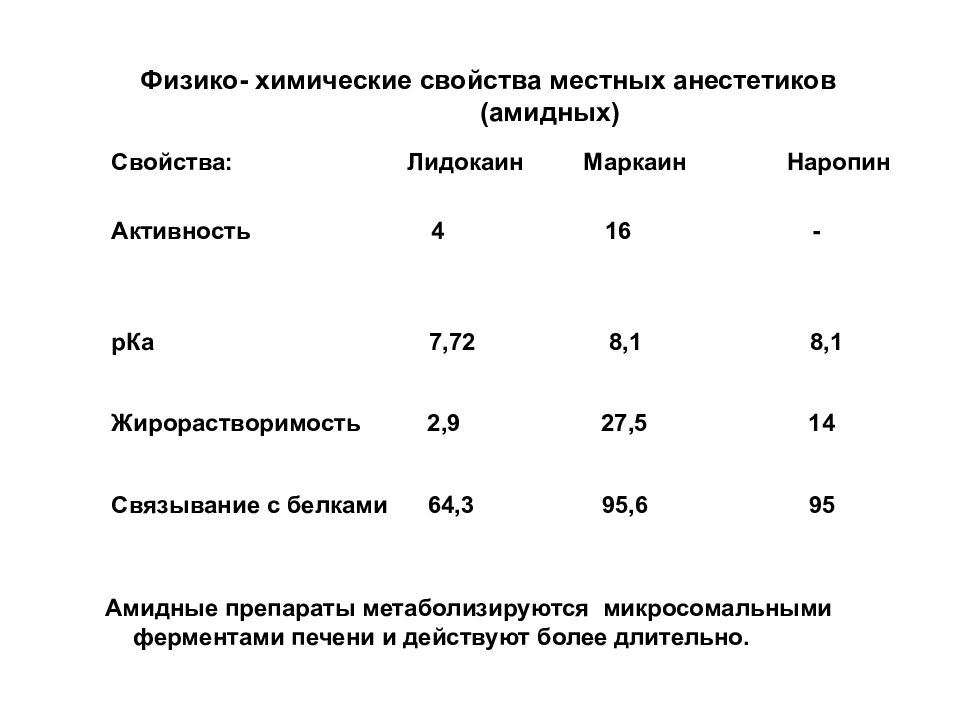
Физико- химические свойства местных анестетиков (амидных) Свойства: Лидокаин Маркаин Наропин Активность 4 16 - рКа 7,72 8,1 8,1 Жирорастворимость 2,9 27,5 14 Связывание с белками 64,3 95,6 95 Амидные препараты метаболизируются микросомальными ферментами печени и действуют более длительно.
Слайд 20
Р Е З Ю М Е Различия в скорости наступления, силе, длительности эффекта и токсичности местных анестетиков объясняются: Различной способностью к ионизации, что зависит от рКа препаратов Различной способностью к диффузии в нервное волокно, что зависит от растворимости в липидах Различной способностью фиксации на мембране, что зависит от связывания с белками Различной концентрацией применяемых местных анестетиков Рабинович С.А., Зорян Е.В., Сохов С.Т. и др., 2005
Слайд 21
Анестетики с эфирной связью Прокаин ( новокаин) Анестезин (бензокаин) Дикаин ( тетракаин) Новокаин - сложный эфир диэтиламиноэтанола (Д Т АЭ )и парааминобензойной кислоты ( ПАБК). Токсичность новокаина принята за 1 условную. единицу.
Слайд 23
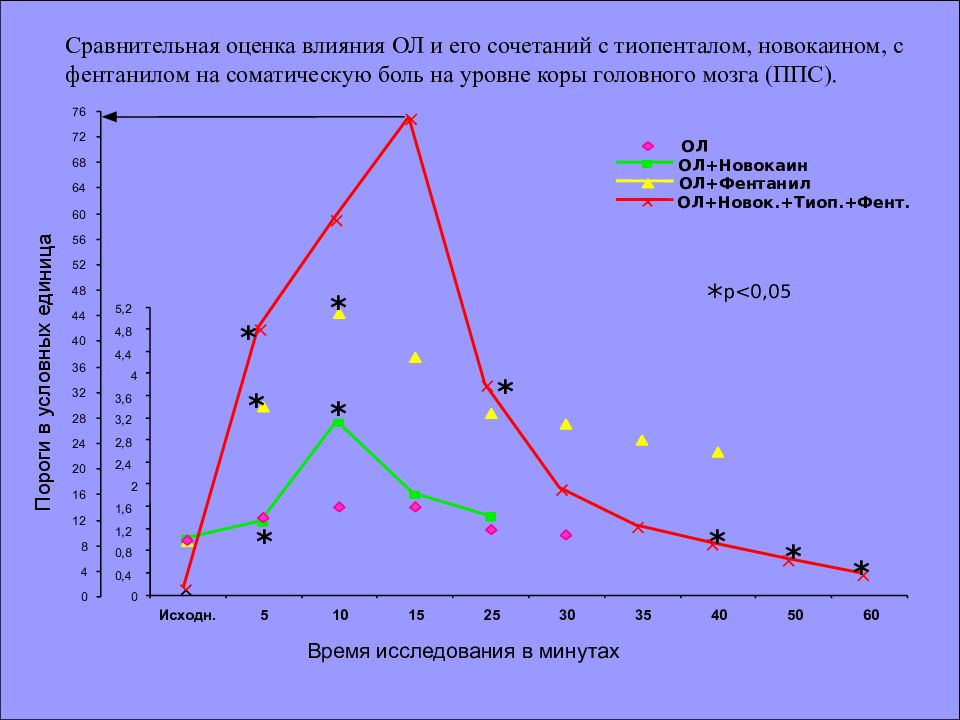
* * 0 0,4 0,8 1,2 1,6 2 2,4 2,8 3,2 3,6 4 4,4 4,8 5,2 Исходн. 5 10 15 25 30 35 40 50 60 0 4 8 12 16 20 24 28 32 36 40 44 48 52 56 60 64 68 72 76 * * * * * * * Сравнительная оценка влияния ОЛ и его сочетаний с тиопенталом, новокаином, с фентанилом на соматическую боль на уровне коры головного мозга (ППС). Пороги в условных единица Время исследования в минутах * р<0,05 ОЛ ОЛ+Новокаин ОЛ+Фентанил ОЛ+Новок.+Тиоп.+Фент.
Слайд 24
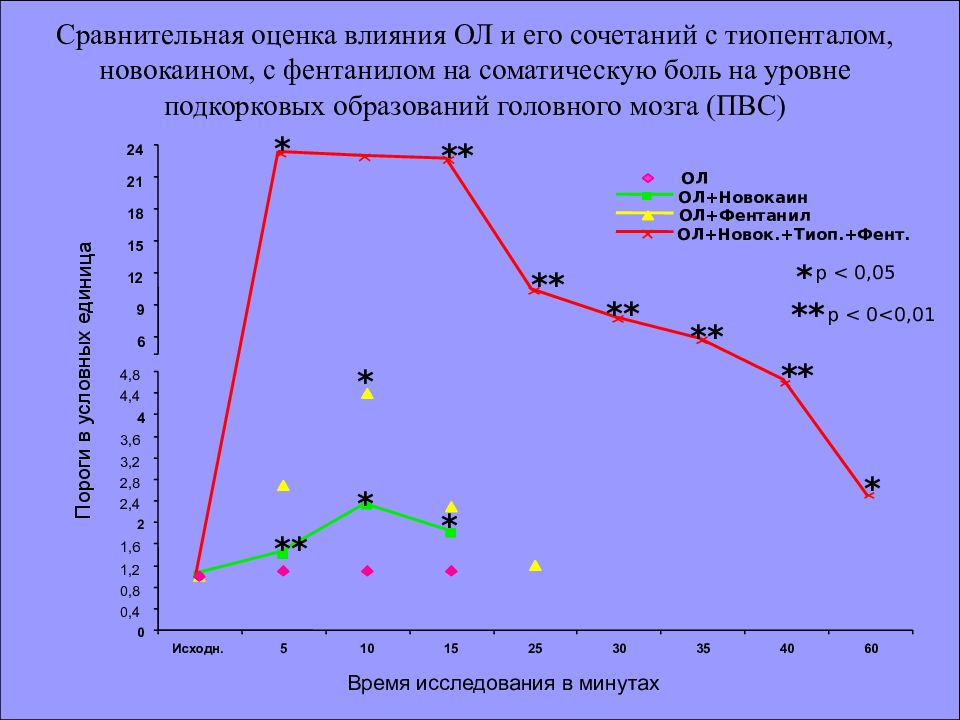
* ** * * 4,8 0 0,4 0,8 1,2 1,6 2 2,4 2,8 3,2 3,6 4 4,4 Исходн. 5 10 15 25 30 35 40 60 6 9 12 15 18 21 24 * ** ** ** ** ** * Пороги в условных единица ОЛ ОЛ+Новокаин ОЛ+Фентанил ОЛ+Новок.+Тиоп.+Фент. Сравнительная оценка влияния ОЛ и его сочетаний с тиопенталом, новокаином, с фентанилом на соматическую боль на уровне подкорковых образований головного мозга (ПВС) * p < 0,05 ** р < 0<0,01 Время исследования в минутах
Слайд 25
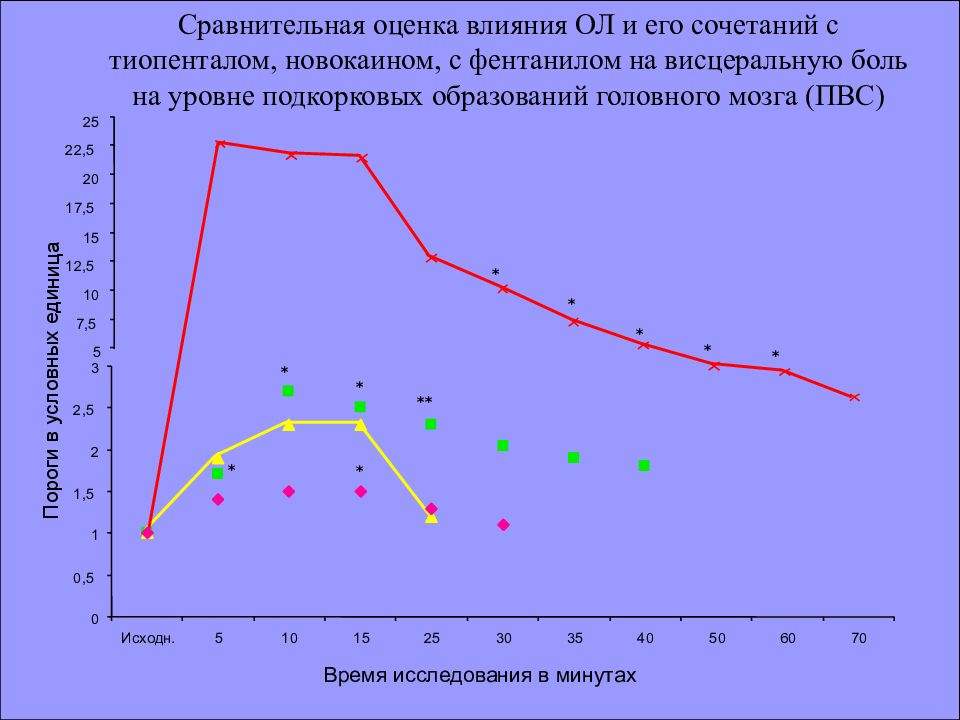
* 3 5 7,5 10 12,5 15 17,5 20 22,5 25 0 0,5 1 1,5 2 2,5 Исходн. 5 10 15 25 30 35 40 50 60 70 * * * * ** * * * * Сравнительная оценка влияния ОЛ и его сочетаний с тиопенталом, новокаином, с фентанилом на висцеральную боль на уровне подкорковых образований головного мозга (ПВС) Пороги в условных единица Время исследования в минутах
Слайд 26
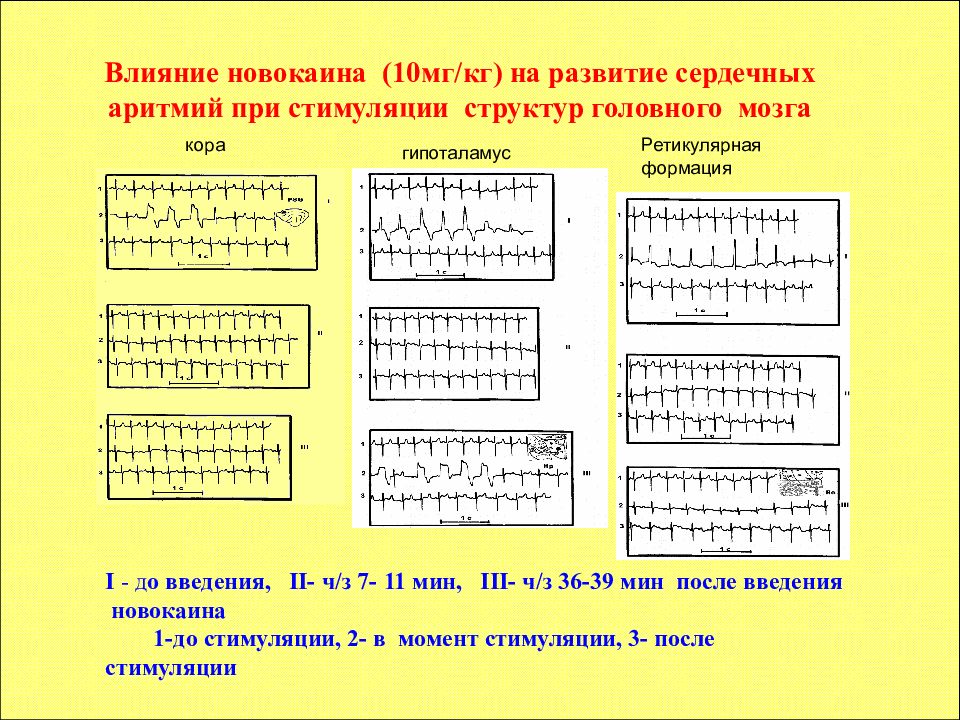
Влияние новокаина (10мг/кг) на развитие сердечных аритмий при стимуляции структур головного мозга I - д о введения, II- ч/з 7- 11 мин, III- ч/з 36-39 мин после введения новокаина 1-до стимуляции, 2- в момент стимуляции, 3- после стимуляции кора гипоталамус Ретикулярная формация
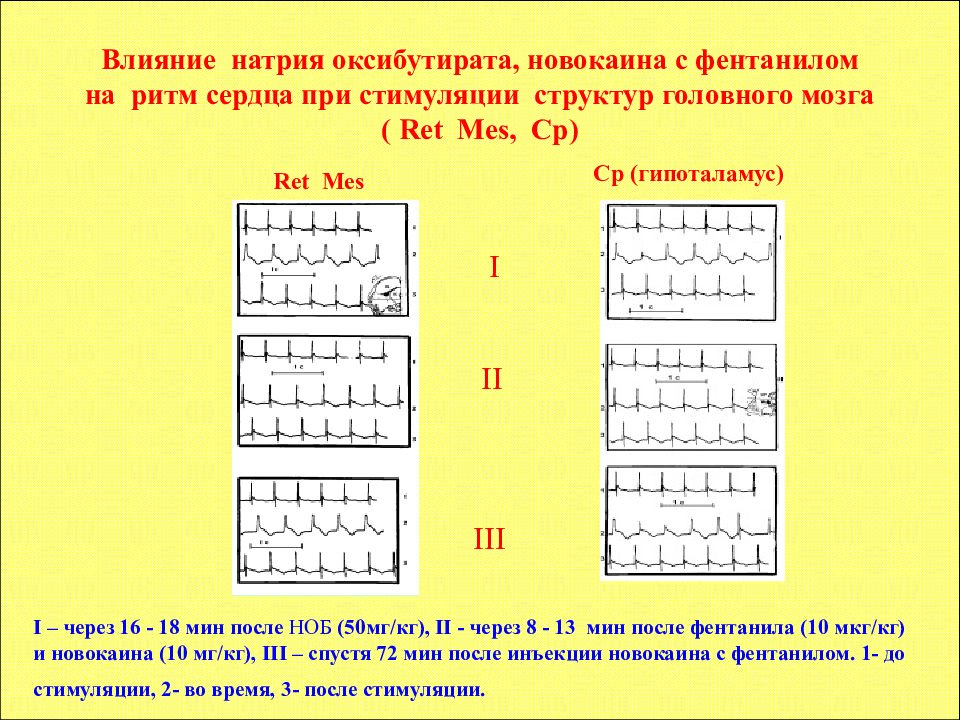
I – через 16 - 18 мин после НОБ (50мг/кг), II - через 8 - 13 мин после фентанила (10 мкг/кг) и новокаина (10 мг/кг), III – спустя 72 мин после инъекции новокаина с фентанилом. 1- до стимуляции, 2- во время, 3- после стимуляции. Ret Mes Cp (гипоталамус) II I III
Слайд 28
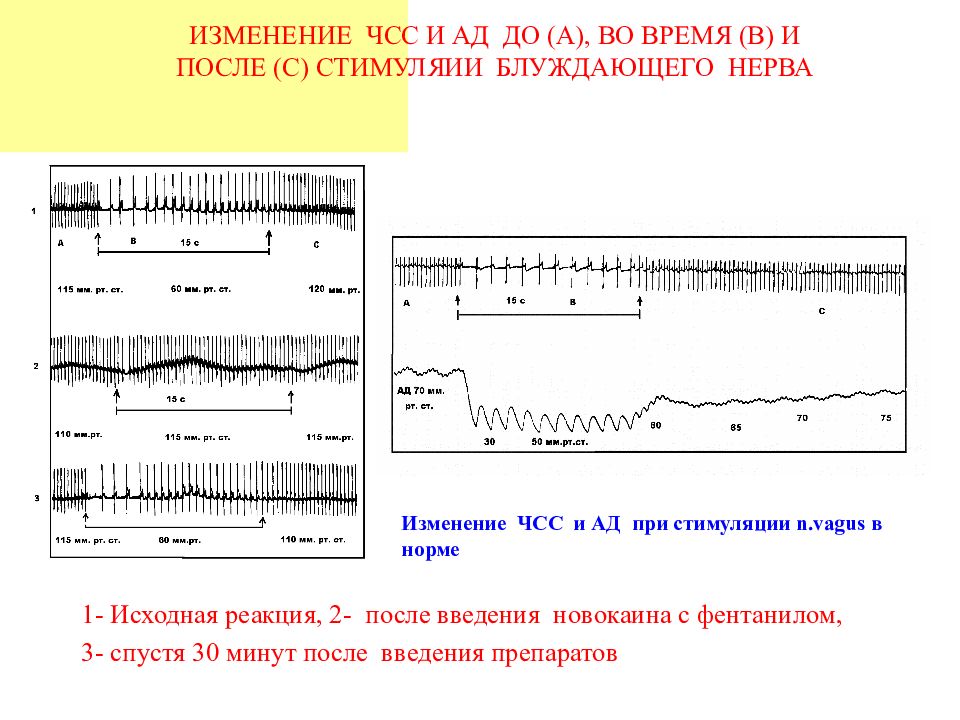
1- Исходная реакция, 2- после введения новокаина с фентанилом, 3- спустя 30 минут после введения препаратов ИЗМЕНЕНИЕ ЧСС И АД ДО (А), ВО ВРЕМЯ (В) И ПОСЛЕ (С) СТИМУЛЯИИ БЛУЖДАЮЩЕГО НЕРВА Изменение ЧСС и АД при стимуляции n.vagus в норме
Слайд 29
Изменение АД при стимуляции n. vagus у кошки I - до введения НОБ, 2 - ч/з 5 мин после введения НОБ (50 мг/кг) и тиопентала (10 мг/кг), 3 - после капельного вливания новокаина с фентанилом. А - до стимуляции, В - в момент, С- после раздражения нерва
Слайд 30
Изменение амплитуды вызванных потенциалов в ответ на стимуляцию седалищного нерва А - исходный фон, В - ч / з 6 минут после вливания тиопентала (10 мг / кг), С - ч / з 8 мин после введения новокаина с фентанилом, D - ч / з 58 мин после введения новокаина (15 мг / кг ) и фентанила (10 мкг / кг). O - локализация электродов
Слайд 31
Psg La Sa Sp Mec Lp Hp Ncm Cm Hi GC GC Влияние ЛО и новокаина на вызванные потенциалы ГМ при соматической стимуляции А- исх. фон, В- ч/з 20 мин после ЛО (50 мг/кг), С- ч/з 6 мин после новокаина, D- ч/з 37 мин после новокаина. Е- локализация электродов
Слайд 32: НОВОКАИН
Улучшает клеточное дыхание за счет ПАБК (участвует в синтезе лецитина, который способствует синтезу фолиевой кислоты) Не токсичен для печени! Улучшает функцию почек! Стабилизирует гемодинамику (ингибитор МАО) Стабилизирует клеточные мембраны Замедляет внутрижелудочковую проводимость Потенцирует действие средств для наркоза и анальгезии При внутривенном введении действует кратковременно 0,3% - после операции тошнота и рвота 0,2% - слабые аллергические реакции
Слайд 34
Предпосылки синтеза лидокаина В растениях обнаружен грамин (Ганс ван Улер,1933г) Начат синтез грамина как пестицида. Х.Эрдман и Г.В.Уолер получили изомер грамина в 1935г При дегустации изограмина Холгер Эрдман обнаружил эффект местного обезболивания, но вещество токсично С мая 1940 по 1942 г Лофгрен получил локастин, комбинацию новокаина и анилинов. В 1942 г Лофгрен создает два вещества LL30 и LL31,в которых две метиловые группы занимают ортоположение (противоположное) в бензольном кольце, молекула приобретает согнутую структуру из-за распределения электрического заряда. Это было в небольшой лаборатории в подвальном помещении без окон Стокгольмского политехнического института на улице Kungstensgatan, 45. ( Цитировано по П.Ю.Столяренко,2005)
Слайд 35: Синтезировал ксилокаин (лидокаин) в 1943г
Нильс Магнус Лофгрен (1913- 1967)
Слайд 36
Нильс Магнус Лофгрен ( Nils Magnus Lofgren) Родился 18 августа 1913 г в Гамблеби ( В 2008 г 95 лет ) В июле 1943 г защитил кандидатскую диссертацию В 1943 синтезировал LL30 ( ксилокаин ) ( В 30 летнем возрасте) 24 мая 1948г защитил докторскую диссертацию В 1952 г награжден золотой медалью Шведской химической Академии В 1956г стал доцентом на кафедре органической и биологической химии Стокгольмского политехнического института В 1956 г –золотая медаль Королевской Шведской Академии естественных наук В 1962 г профессор кафедры органической химии В1962 г стал почетным доктором стоматологии в Стокгольме. Умер в 1967 г ( Прожил 54 года, но сделал для медицины много). После смерти фирма « Astra » учредила стипендию «Стипендия Нильса Лофгрена» - за достижения в области фармацевтической химии. Вручается ежегодно молодым исследователям.
Слайд 37
Из истории создания лидокаина Бенг Люндквист ( Bengt Lundqvist) испытывает на себе LL30 вводя препарат в руки, ноги и тело. Сделал себе спинномозговую анестезию перед зеркалом. В своем отчете о результатах испытаний LL30, он отметил, что это лучший местный анестетик из всех. Этот человек был прирожденным экспериментатором, рискуя собственным здоровьем, он дал путевку в «жизнь» ксилокаину, который применяется до настоящего времени. 2. Патент на ксилокаин был выдан 15 июля 1943 г. Авторами его являются Лофгрен и Люндквист. 3. Фирма « Astra » получила права на производство и продажу ксилокаина 22 ноября 1943г.
Слайд 38
Бенгт Джозеф Люндквист ( Bengt Josef Lundqist) Родился 5 октября 1922 г в Стокгольме В 1941 г окончил Реальную гимназию Окончил политехнический институт Занимался фехтованием в составе сборной Швеции Был ст. лаборантом и получил ученую степень по химии В 1942-1943 гг испытывает LL30 и LL31 на себе В 1952 г падает с лестницы и получает сотрясение мозга Умер в 1953 г в возрасте 30 лет.
Слайд 39
Токсичность лидокаина Исследования по токсичности LL30 начал Леонард Голдберг в апреле 1943г ( стал доктором наук). Торстен Горд ( Torsten Gordh) проводит клиническую аробацию по применению высоких доз ксилокаина, вводя им по три грамма препарата и убеждается, что конвульсии и судороги успешно снимаются барбитуратами. Он сделал вывод, что максимальная разовая доза ксилокаина равняется одному грамму. Было установлено, что частицы металла шприца вызывают раздражение тканей у больного в месте введения. Инъекции препарата стеклянным шприцом не вызывает этих осложнений.
Слайд 40
Противоаритмические свойства лидокаина В 1960 г кардиологи США обнаруживают противоаритмический эффект лидокаина. Им лечили президента Д.Д.Эйзенхауэра. Установлено, что препаратом выбора при желудочковых экстрасистолах является лидокаин. Препарат нашел применение в кардиологии для лечения и профилактики желудочковых экстрасистолий, тахикардии, трепетании, фибрилляции желудочков, в том числе при ОИМ, при имплантации искусственного водителя ритма, при глюкозной интоксикации. Применяется 0,2 % раствор, вначале 50-100 мг болюсно в теч.3-4 мин, затем капельно со скоростью 1-4 мг/мин до 1,2-1,5 грамм в сутки. Максимальная суточная доза до 2000 мг.
Слайд 41: Кардиотоксичность местных анестетиков
Блокирование медленных кальциевых каналов и взаимодействие с другими катионными каналами местными анестетиками приводит к снижению сократительной способности миокарда и нарушением внутрисердечной проводимости с последующей кардиоваскулярной депрессии. На ССС в убывающем порядке влияют: Бупивакаин Ропивакаин Лидокаин Новокаин ( Четвериков В.В., Болотов В.В., и др. Вестн. интенсив.терапии,2005.-№5.-с.76-77).
Слайд 42
Показания к применению лидокаина Для анальгезии при хронических болях Как компонент внутривенного обезболивания при наркозе Внутривенно с целью снижения высокой температуры тела Как препарат для местной инфильтрационной анестезии Для проводниковой анестезии нервов и нервных сплетений Для эпидуральной анестезии Для спинномозговой анестезии ( продолжительностью до 60 мин) Для местной анестезии слизистых и кожных покровов в аэрозолях, мазях, кремах, желе и пластырях Как растворитель антибиотиков (0,25% - 0,5% р-р) В качестве противоаритмического средства
Слайд 43
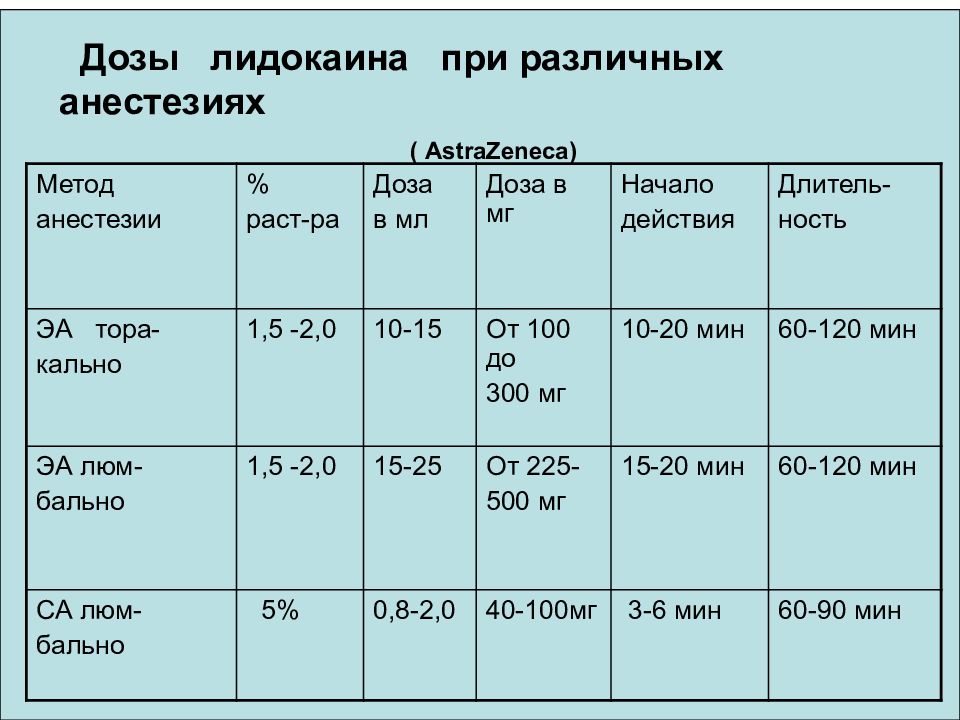
Дозы лидокаина при различных анестезиях ( AstraZeneca) Метод анестезии % раст-ра Доза в мл Доза в мг Начало действия Длитель- ность ЭА тора- кально 1,5 -2,0 10-15 От 100 до 300 мг 10-20 мин 60-120 мин ЭА люм- бально 1,5 -2,0 15-25 От 225- 500 мг 15-20 мин 60-120 мин СА люм- бально 5% 0,8-2,0 40-100мг 3-6 мин 60-90 мин
Слайд 44: Нейротоксичность лидокаина ?
В хроническом эксперименте на собаках в течение 14 дней вводили лидокаин, клофелин, просидол в дозах превышающих клинические. Зарегистрировали морфофункциональные изменения в нейронах спинного мозга и спинальных ганглиях. Такие же изменения развиваются при введении 0,85% раствора хлористого натрия. Преходящие неврологические осложнения развиваются через 12-36 часов после того, как закончилось действие СА и далее продолжаются в течение 2-3 дней. Проходят самостоятельно или эффективно лечатся НПВС. Волчков В.А. III съезд АИР северо-запада России.- Спб., 2005.-с. 47.
Слайд 45
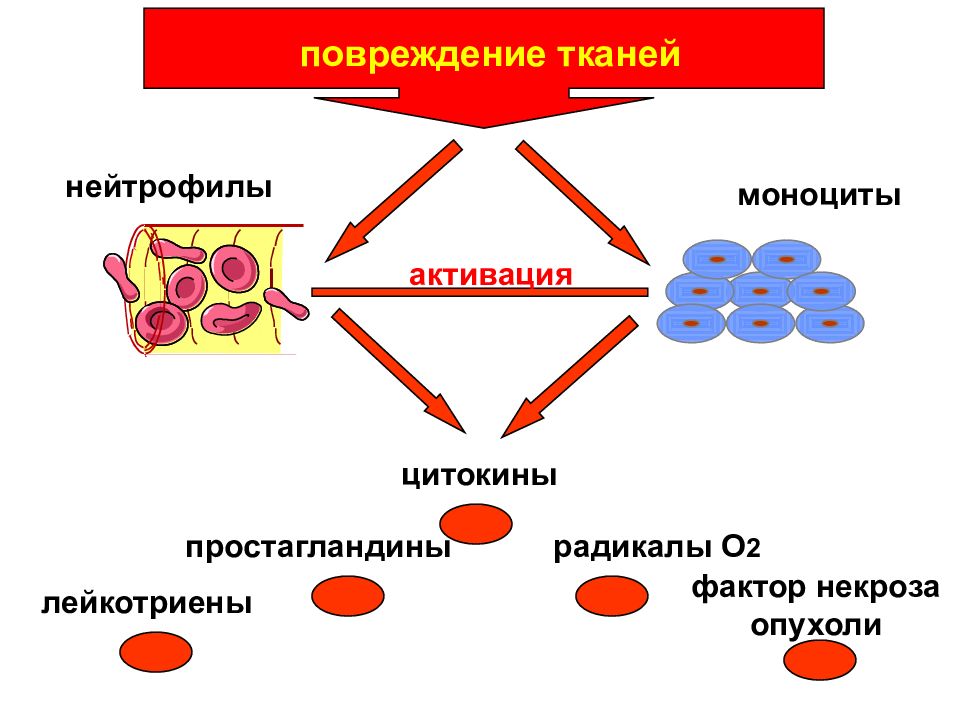
нейтрофилы моноциты активация простагландины радикалы О 2 лейкотриены цитокины повреждение тканей фактор некроза опухоли
Слайд 46
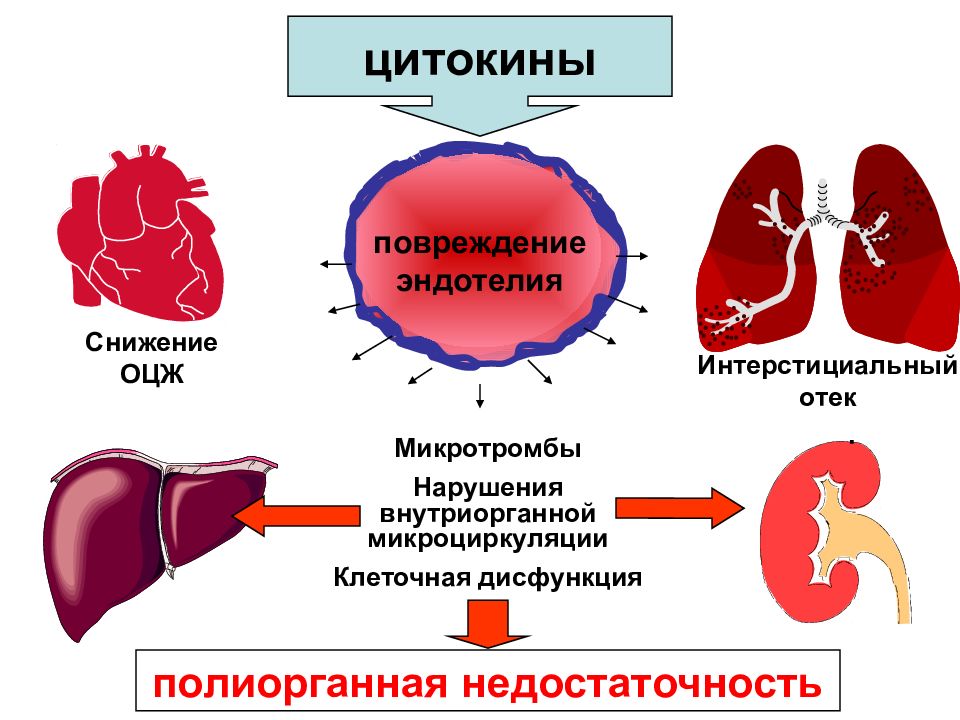
цитокины повреждение эндотелия полиорганная недостаточность Снижение ОЦЖ Интерстициальный отек Микротромбы Нарушения внутриорганной микроциркуляции Клеточная дисфункция
МА снижают аккумуляцию нейтрофилов в легких МА предупреждают повреждение эндотелия МА подавляют синтез свободных радикалов в легких МА уменьшают эктравазацию альбумина и отек интерстиция Активация и секвестрация нейтрофилов в легких играет ведущую роль в механизмах РДСВ
Слайд 48
Ишемические и реперфузионные повреждения миокарда во многом обусловлены воспалительной реакцией коронарных сосудов МА блокируют выработку свободных радикалов и метаболитов арахидоновой кислоты МА подавляют патологический автоматизм, обусловленный свободно-радикальным повреждением МА предотвращают адгезию активированных нейтрофилов на эндотелии
Слайд 49
Воспалительная реакция тканей играет важнейшую роль в механизмах послеоперационного пареза кишечника Тканевое повреждение – выброс гистамина, кининов, ПГ Активация сенсорных нейронов, активация абдоминальных рефлексов, экстравазация, отек стенки кишечника МА тормозят высвобождение гистамина из базофилов и тучных клеток МА угнетают активность сенсорных нейронов, уменьшают экстравазацию альбумина и жидкости Противовоспалительный эффект МА является стойким и сохраняется до 36 часов после прекращения их инфузии
Слайд 50
Снижают активацию и миграцию нейтрофилов, а также их адгезию к эндотелию Уменьшают оксидрадикальное повреждение легких Подавляют синтез лейкотриена В4, являющегося мощным стимулятором активности нейтрофилов Тормозят высвобождение гистамина из тучных клеток Оказывают антибактериальное действие Системный противовоспалительный эффект МА
Слайд 51
Взаимодействие с другими лекарственными средствами гипоксия и ацидоз увеличивают его токсичность циметидин и пропранолол увеличивают общий клиренс лидокаина за счет снижения печеночного кровотока замедляет атриовентрикулярную проводимость, увеличивает время внутрижелудочковой проводимости способен вытеснять верапамил и нифедипин с мест их связы-вания с белками усиливает действие миорелаксантов выпадает в осадок при смешивании с амфотерицином, метогекситоном, сульфадиазином, дофамином усиливает угнетающее действие этанола на дыхание может быть не совместим с ампициллином
Слайд 52
Побочные влияния лидокаина на деятельность жизненно важных органов больного ССС- синусовоя брадикардия нарушение проводимости сердца поперечная блокада сердца гипотензия коллапс Печень – снижение кровотока угнетение активн. микросомальных ферментов Почки - снижение кровотока из-за гипотонии Удлиняет действие миорелаксантов, снотворных и седа- тивных средств, а также бета- блокаторов.
Слайд 53
Противопоказания к использованию лидокаина AV блокада II-III ст и нарушения внутрижелудочковой проводимости Синдром Морганьи-Адамса-Стока выраженная брадикардия кардиогенный шок значительное снижение функции левого желудочка повышенная чувствительность к препарату гитотония связанная с дефицитом ОЦК
Слайд 54
Бупивакаин ( Маркаин) Синтезирован в 1963 Г В 1973 г « Astra » приобретает права на производство карбокаина (мепивакаина) и маркаина (бупивакаина)
Слайд 56: МАРКАИН
Выпускается Маркаин 0,25%- 20 мл во флаконах Маркаин 0,25%- 20 мл во флаконах с адреналином Маркаин 0,5% - 20 мл во флаконах Маркаин 0,5% - 20 мл во флаконах с адреналином Маркаин спинал 0,5%-4,0 мл в ампуле (8 мг/мл NaCl) Маркаин спинал Хеви 0,5%-4,0 мл в амп (80 мг/мл декстрозы)
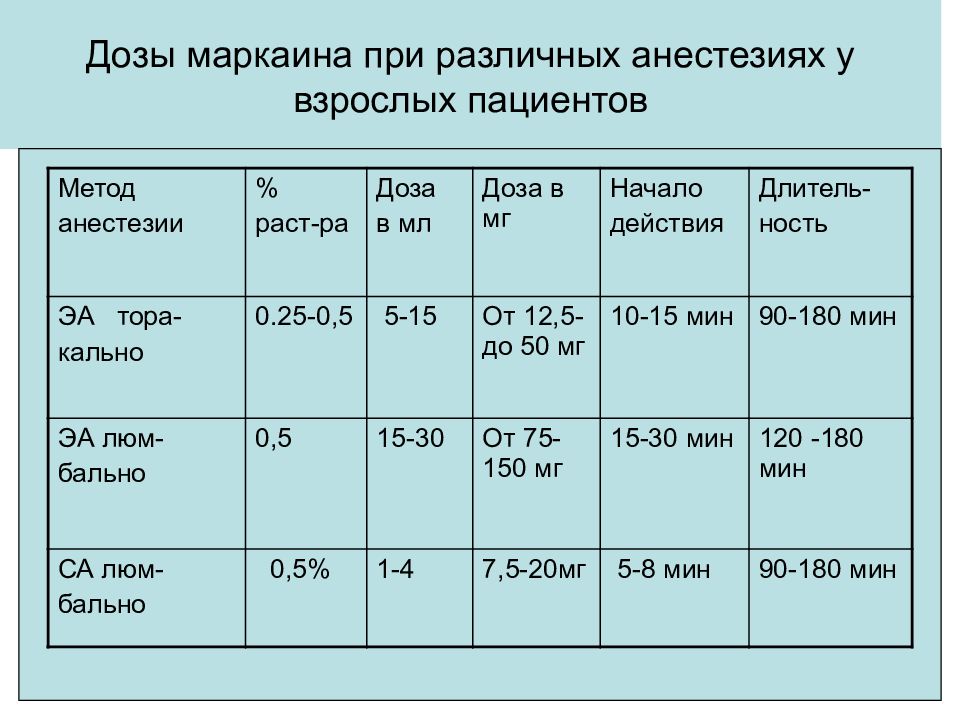
Метод анестезии % раст-ра Доза в мл Доза в мг Начало действия Длитель- ность ЭА тора- кально 0.25-0,5 5-15 От 12,5- до 50 мг 10-15 мин 90-180 мин ЭА люм- бально 0,5 15-30 От 75-150 мг 15-30 мин 120 -180 мин СА люм- бально 0,5% 1-4 7,5-20мг 5-8 мин 90-180 мин
Слайд 58
Кардиотоксичность маркаина концентрация бупивакаина в клетках миокарда возрастает при гипоксии угнетает синтез АТФ в митохондриях кардитоксичность связана с крайне медленной диссоциацией из N а- каналов период связывания бупивакаина с N а каналами проводящей системы сердца в 1000 раз длительнее по сравнению с лидокаином в несколько раз, по сравнению с лидокаином, вызывает выраженную депрессию сократительной способности миокарда способствует развитию фибрилляции желудочков в результате неравномерного «вымывания», так как в клетках развивается различная рефрактерность, что создает повторную циркуляцию возбуждения. _____________________________________________________________ Басов М.Б., Цыпин Л.Е и др.,(2005), Овечкин А.М., Осипов С.А., (2004)
Слайд 59
Синтезирован в 1995г 1996 г Начало клинического применения наропина (ропивакаина) фирма « AstraZeneca » Наропин- солнышко на темном фоне регионарной анестезии!
Слайд 60: Наропин
Обладает собственным вазоконстрикторным эффектом, поэтому длительность его действия не зависит от добавления к нему сосудосуживающих средств С-волокна блокирует быстрее, чем А- волокна (0,2-0,125%) При концентрации 0,5-0,75% блокирует НВ, как и маркаин Он менее токсичен чем маркаин, так как является чисто S – изомером (бутиловая группа заменена на пропиловую) Менее угнетает синтез АТФ в митохондриях, чем маркаин
Слайд 61
РОПИВОКАИН Высокие дозы препарата применяются для мест-ной анестезии при хирургических вмешательствах Низкие дозы наропина обеспечивают сенсор-ный блок с минимальным и не прогрессирую-щим моторным блоком На длительность и интенсивность блокады, вызванной препаратом, добавление адреналина не влияет! Может оказывать влияние на возбудимые клеточные мембраны в головном мозге и миокарде.
Слайд 62
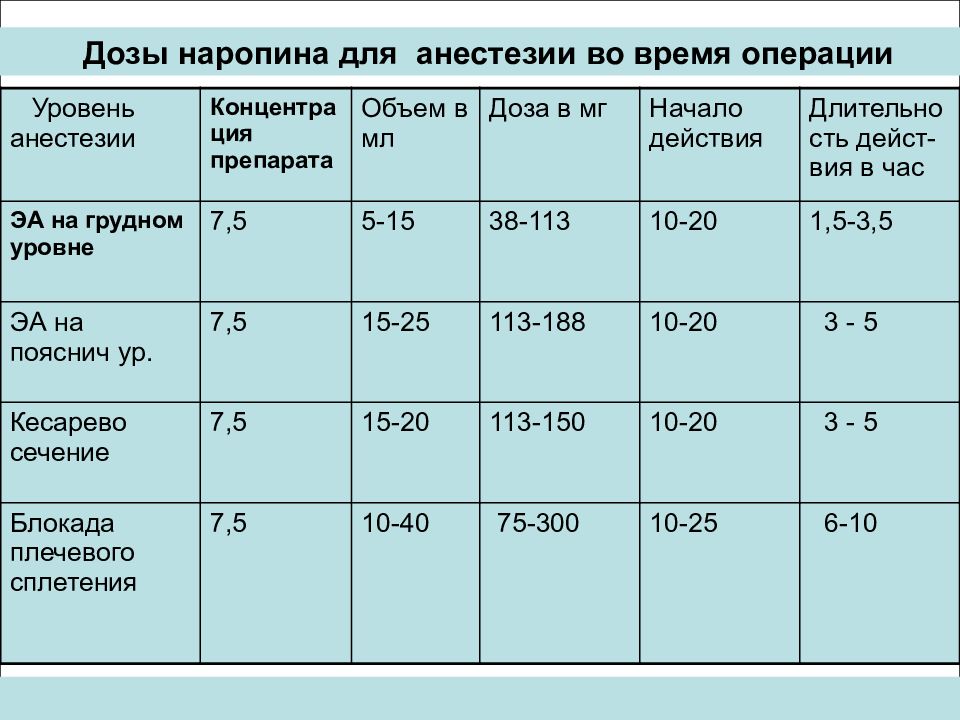
Дозы наропина для анестезии во время операции Уровень анестезии Концентрация препарата Объем в мл Доза в мг Начало действия Длительность дейст-вия в час ЭА на грудном уровне 7,5 5-15 38-113 10-20 1,5-3,5 ЭА на пояснич ур. 7,5 15-25 113-188 10-20 3 - 5 Кесарево сечение 7,5 15-20 113-150 10-20 3 - 5 Блокада плечевого сплетения 7,5 10-40 75-300 10-25 6-10
Слайд 63
НАРОПИН Н А Р О П И Н Введение наропина в течении 24 часов в дозе до 800 мг суммарно для послеопера-ционного обезболивания не опасно. Продленная эпидуральная инфузия наропина после операции со скоростью 28мг/ч в течение 72 ч хорошо переносится взрослым ____________________________________ Инструкция по применению наропина, 2006
Слайд 64
При обезболивании родов эпидурально через катетер: маркаин 0,0625- 0,126% раствор 10-15 мл наропин 0,1- 0,2 % 8-12 мл Путем эпидуральной инфузии: маркаин 0.0625-0,1% со скоростью10-12 мл/час наропин 0,2% 8 мл/час При неадекватности анестезии скорость инфузии увеличивается и вводится болюсно 4-6 мл анестетика. В.М.Женило, А.Д.Беляевский и др.,2004г Для послеоперационного обезболивания в абдоминальной хирургии 0,2% раствор капельно эпидурально со скоростью 4-10 мл по клинике. Нет парезов кишечника. А.М.Овечкин, 2001г
Слайд 65
ОПЕРАЦИИ НА СЕРДЦЕ В УСЛОВИЯХ ИК Т.В.Клыпа, Д.В.Вершута, О.В.Степанова,И.А.Козлов ( НИИ ТОиТ) – 2004. 27 больных в возрасте 21-82 лет. Ревасукляризация миокрда 3-4 артерии. Пункция и катетеризация пространства Th 3 – Th 4 на кануне оперативного вмешательства. Перед индукцией эпидурально 0,75%-4 мл наропина, в дальнейшем через 5-10 мин постоянная инфузия с фентанилом 150 ± 24 мкг. Сочетали так же с пропофолом. Высокоэффективно в 92,6% наблюдений. И.М.Губкин,А.А. Лаврентьев, С.А. Ковалев (2003) Воронеж. Для этих целей использовали эпидурально 0,125% раствор маркаина.
Слайд 66
Местные анестетики и воспаление (Марсель Дурью и др, 2004., Т.В.Клыпа и др., 2004) ЭА с использование МА уменьшает эндокринную и метаболическую реакцию при операциях на верхнем этаже брюшной полости, снижает риск послеоперационной непроходимости кишечника, сокращает продолжительность ИВЛ и пребывание больного в ПИТ Эффект этих полезных эффектов заключается в модуляции воспалительной реакции местными анестетиками, которые возникают при резорбции препарата из эпидурального пространства и проявля-ются на системном уровне. Местные анестетики уменьшают повреждение легких, вызываемые эндотоксинами или гипероксией Местные анестетики селективно ингибируют функции G- белка, который играет важную роль во многих воспалительных и гемостатических каскадах Антитромботические эффекты видимо также связаны вследствие ингибирования функции G- белка тромбоцитов