Первый слайд презентации: Гетерогенные равновесия
Равновесие, в котором находится система, состоящая более чем из одной фазы, называется гетерогенным равновесием. Джозайя Уиллард Гиббс (1839 - 1903) – Американский химик и физико-химик сформулировал основные принципы, лежащие в основе гетерогенных равновесий.
Слайд 2: Гетерогенные равновесия
Основные принципы, лежащие в основе гетерогенных равновесий : - система приходит в состояние термодинамического равновесия при установлении термического, механического и химического равновесий между фазами, входящими в состав данной системы dG = VdP - SdT + Σ μ i dn i, где объем V, энтропия S и число молей n i компонента i – экстенсивные (зависящие от количества вещества) переменные, а температура Т, давление Р и химический потенциал μ i – интенсивные (не зависящие от количества вещества) ; - при химическом равновесии μ i для любого компонента одинаков во всех фазах и перенос вещества через фазовые границы отсутствует.
Слайд 3: Гетерогенные равновесия
Правило фаз Гиббса: число степеней свободы ( F ) равновесной термодинамической системы, на которую из внешних факторов влияют только Т и Р, равно числу независимых компонентов системы ( K ) минус число фаз ( N ) плюс 2 F = K - N + 2 Число степеней свободы ( F ) – число независимых интенсивных переменных, которые можно варьировать не изменяя фазового состояния системы. ■ Как и для гомогенной системы константу равновесия процесса можно рассчитать по данным термодинамических функций: K т = е -∆G 0 /RT
Слайд 4: Равновесие в системе осадок-раствор
Упрощенная схема равновесия осадок A m B n - раствор: для соединений с кристаллической решеткой (ВaSO 4, CaSO 4 ) преобладает процесс (1), а для соединений с молекулярной решеткой (C 6 H 5 COOH, Hg 2 CI 2 ) – процесс (2).
Слайд 5: Равновесие в системе осадок-раствор
■ Соответствующие константы равновесия (произведения растворимости): K т s = a A m • a B n ; K c s = [A] m • [B] n ; K у s = С A m • С B n ; термодинамическое; реальное; условное; (концентрационное)
Слайд 6: Равновесие в системе осадок-раствор
Правило произведения растворимости : произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе малорастворимого электролита, есть величина постоянная для данного растворителя, температуры и давления. Связь между различными произведениями растворимости осадка AmBn ↓ выражается формулами: К c s K т s К у s = ———— = ————————— —. А m • B n f A m • f B n • А m • B n
Слайд 7: Равновесие в системе осадок-раствор
Растворимость (массовая, молярная, ионная и др. ) есть концентрация вещества (S) в его насыщенном растворе при определенной Ти Р. Растворимость складывается из концентраций всех форм нахождения данного вещества в растворе (сольватированные ионы А и В, ассоциаты, нейтральные молекулы А m B n ). Например, в насыщенном водном растворе Fe 2 O 3 • H 2 O могут существовать частицы Fe(H 2 O) 6 3+, Fe(H 2 O) 5 (OH) 2+, Fe(H 2 O) 4 (OH) 2 +, Fe(H 2 O) 3 (OH) 3, Fe 2 (OH) 2 (H 2 O) 8 4+ и др.
Слайд 8: Равновесие в системе осадок-раствор
При растворении в 1 л S моль осадка A m B n его ионы переходят в раствор в стехиометрических количествах: A m B n ↔ (ms) m • (ns) n Тогда: K т s = a A m • a B n = (ms) m • f A m • А m • (ns) n • f B n • B n Ионная растворимость (S): K т s K у s S = m+n √————————————— = m+n √—————. m m • n n • f A m • А m • f B n • B n m m • n n
Слайд 9: Равновесие в системе осадок-раствор
В присутствии избытка одноименного иона, например, А растворимость осадка A m B n определяется концентрацией иона В (nS = C В ): K у s = (C A ) m • (ns) n, отсюда K у s S = n √———— ; (C A ) m K у s S = m √———— если избыток B. (C B ) n
Слайд 10: Равновесие в системе осадок-раствор
Молекулярная растворимость (S 0 ) : обусловлена наличием в растворе нейтральных молекул A m B n A m B n(тв) ↔ A m B n(р-р) = S 0 Молекулярная растворимость для данных Т, Р и растворителя есть величина постоянная и не зависящая от концентрации одноименного иона. Расчет значений S 0 : - малорастворимые комплексы состава [АВ] [AB] β = ———; K s = [A] [B]; [AB] = S 0 = β • K s. [A] [B]
Слайд 11: Равновесие в системе осадок-раствор
Расчет значений S 0 : - малорастворимые кислоты типа НА [H] [A] K s K a = ———— = ———; [HA] = S 0 = K s / K a. [HA] [HA] Общая растворимость ( S Σ ) : - для электролита АВ в отсутствии побочных реакций и избытка одноименных ионов S Σ = √K s + S 0 ; - для малорастворимых сильных электролитов √K s >> S 0 ; - для малорастворимых слабых электролитов S 0 >> √K s.
Слайд 12: Равновесие в системе осадок-раствор
Растворимость рассчитывают с учетом всех форм нахождения.
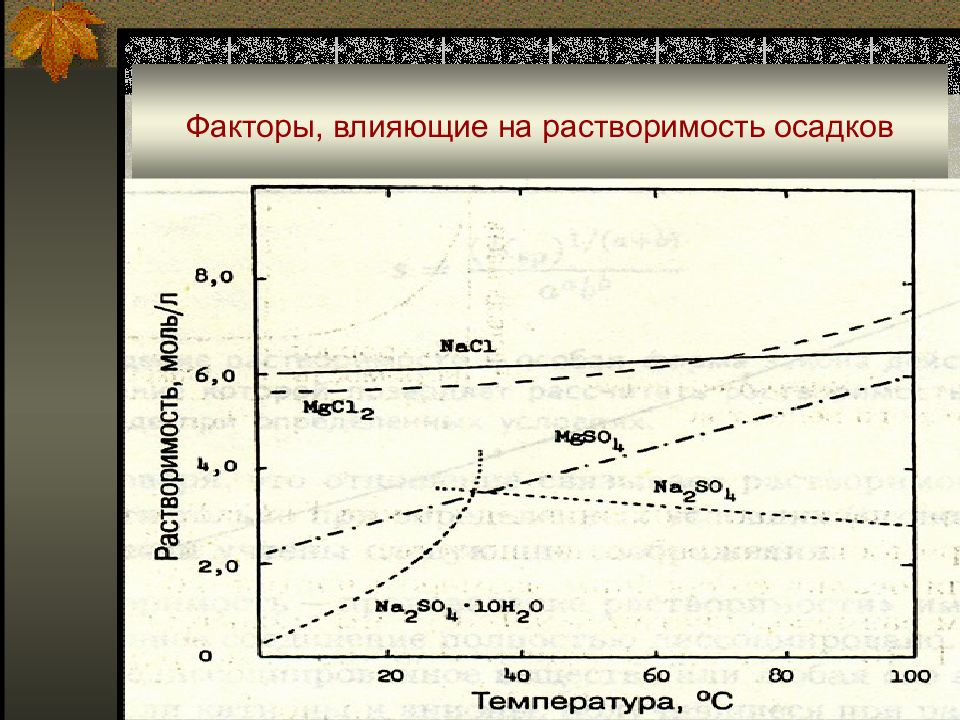
Слайд 14: Факторы, влияющие на растворимость осадков
Температура: при ∆ H < 0 ( экзотермические процессы ) величина К S 0 с ростом Т уменьшается ; при ∆ H > 0 ( эндотермические процессы ) величина К S 0 с ростом Т увеличивается ; в подавляющем большинстве случаев процессы растворения твердых веществ – эндотермические.
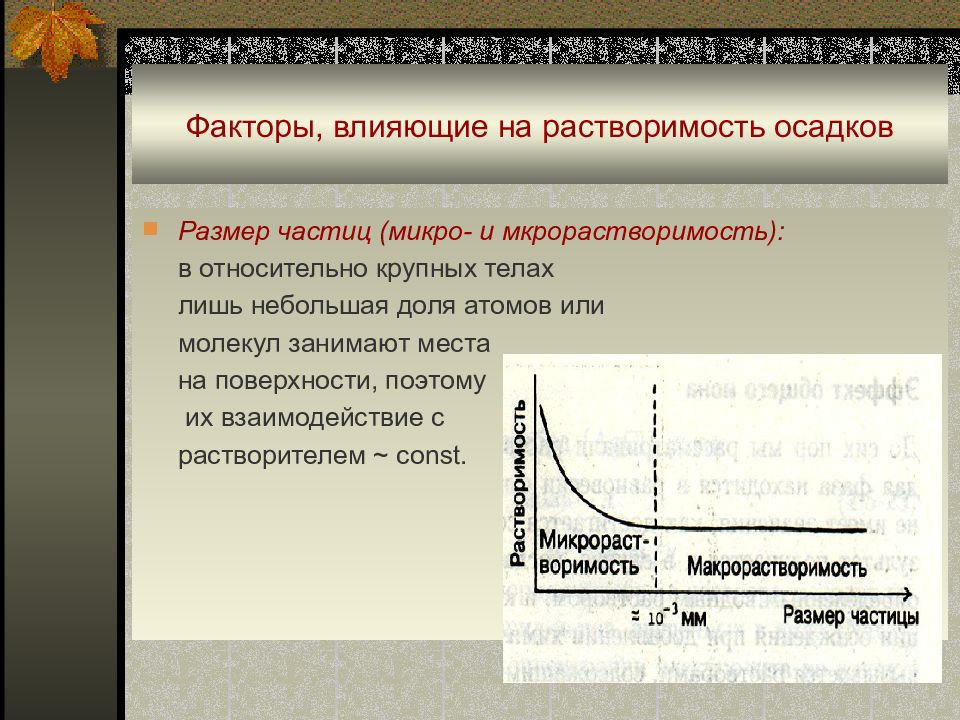
Слайд 16: Факторы, влияющие на растворимость осадков
Размер частиц (микро- и мкрорастворимость) : в относительно крупных телах лишь небольшая доля атомов или молекул занимают места на поверхности, поэтому их взаимодействие с растворителем ~ const.
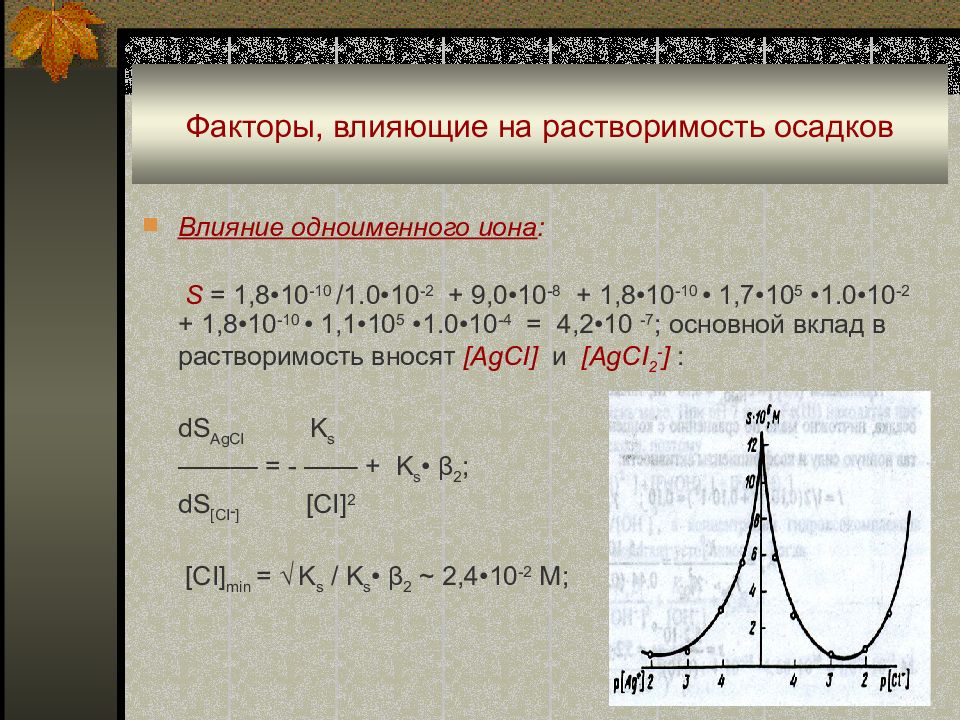
Слайд 17: Факторы, влияющие на растворимость осадков
Влияние одноименного иона. При большом избытке одноименного иона, вследствие «солевого эффекта» (обусловленного увеличением ионной силы) и образования растворимых комплексов может наблюдаться увеличение растворимости. Пример: AgCI ↓+ NaCI (0,01 M) ↔ AgCI + AgCI 2 - + AgCI 3 2- (β 1 = 5,0•10 2 ; β 2 = 1,7•10 5 ; β 3 = 1,1•10 5 ) S = [Ag + ] + [ AgCI] + [ AgCI 2 - ] + [AgCI 3 2- ] = K s / [CI - ] + S 0 (K s • β 1 ) + K s • β 2 • [CI - ] + K s • β 3 • [CI - ] 2.
Слайд 18: Факторы, влияющие на растворимость осадков
Влияние одноименного иона : S = 1,8 •10 -10 /1.0•10 -2 + 9,0 •10 -8 + 1,8 •10 -10 • 1,7•10 5 •1.0•10 -2 + 1,8 •10 -10 • 1,1•10 5 •1.0•10 -4 = 4,2•10 -7 ; основной вклад в растворимость вносят [ AgCI] и [ AgCI 2 - ] : dS AgCI K s ——— = - —— + K s • β 2 ; dS [CI - ] [CI] 2 [CI] min = √ K s / K s • β 2 ~ 2,4•10 -2 M;
Слайд 19: Факторы, влияющие на растворимость осадков
Влияние конкурирующих реакций: K т s S = m+n √————————————— m m • n n • f A m • А m • f B n • B n
Слайд 20: Факторы, влияющие на растворимость осадков
Протолитические конкурирующие реакции: K a,1 • K a,2 • K a,3 • • • K a,n B = ————————————————————————————. [H 3 O + ] n + K a,1 • [H 3 O + ] n-1 + K a,1 • K a,2 • [H 3 O + ] n-2 + K a,1 • K a,2 ••• K a,n
Слайд 21: Факторы, влияющие на растворимость осадков
Протолитические конкурирующие реакции: K т s S = m+n √————————————— m m • n n • f A m • А m • f B n • B n
Слайд 22: Факторы, влияющие на растворимость осадков
Конкурирующие реакции комплексообразования: 1 A = ———————————————. 1 + β 1 [L] + β 2 [L] 2 + …+ β n [L] n K т s S = m+n √————————————— m m • n n • f A m • А m • f B n • B n
Слайд 23: Факторы, влияющие на растворимость осадков
Конкурирующие реакции комплексообразования:
Обнаружение ионов (С А m • C B n > K S у ): HgCI 2 + 2KI ↔ HgI 2 ↓ + 2KCI HgI 2 ↓ + 2KI ↔ K 2 [ HgI 4 ] Отделение мешающего иона (C A ≤ 10 -6 M) : ПР т А m B n C A = m √ —————————— ≤ 10 -6 M; C B n • f B n • B n • f A m • A m обнаружению К + по реакции с NaHC 4 H 4 O 6 мешает NH 4 +, который маскируют в виде осадка с формальдегидом: 4NH 4 CI + 6CH 2 O + 2Na 2 CO 3 ↔ (CH 2 ) 6 N 4 ↓ + 8H 2 O + 2CO 2 + 4Na CI, после этого определяют К + KCI + NaHC 4 H 4 O 6 ↔ KHC 4 H 4 O 6 ↓ + Na CI
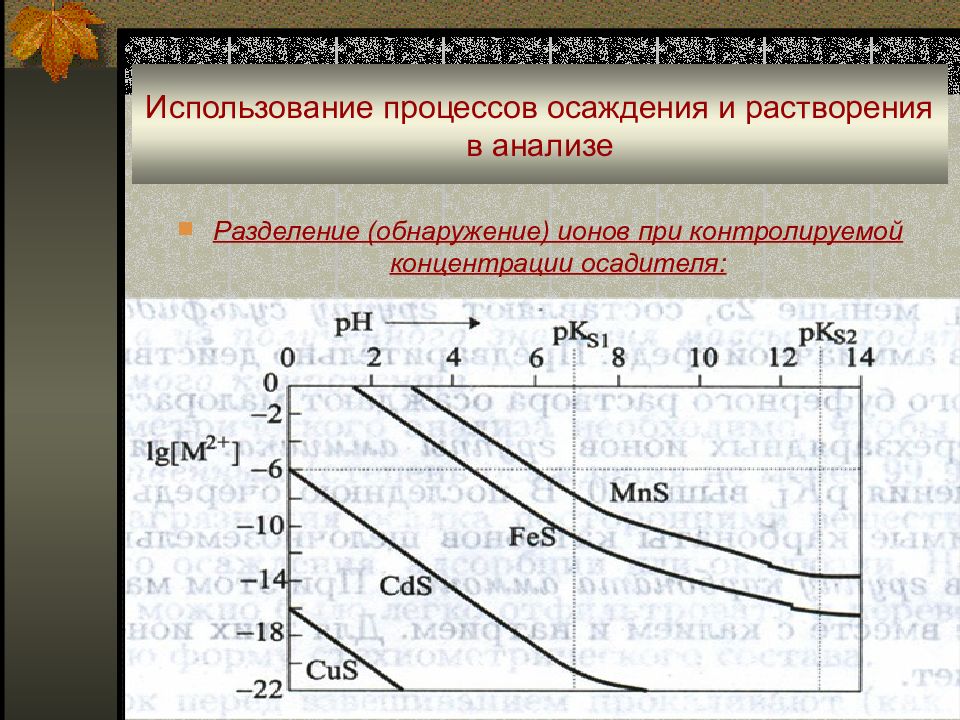
Слайд 25: Использование процессов осаждения и растворения в анализе
Разделение (обнаружение) ионов при контролируемой концентрации осадителя пример 1: разделить 0,1 M Fe 3+ и Mg 2+ с помощью OH - → ? ПР т Fe(OH) 3 = 4•10 -38 ; ПР т Mg(OH) 2 = 1,8•10 -11 ; приняв f i, I = 1, получаем 1•10 -6 • [OH - ] 3 = 4•10 -38 ; [OH - ] = 3,4 •10 -11 M; 0,1 • [OH - ] 2 = 1,8•10 -11 ; [OH - ] = 1,3 •10 -5 M; таким образом, если поддерживать [OH - ] в интервале 3,4 •10 -11 M - 1,3 •10 -5 M, получим Fe(OH) 3 ↓ в осадке, а Mg 2+ в растворе;
Слайд 26: Использование процессов осаждения и растворения в анализе
Разделение (обнаружение) ионов при контролируемой концентрации осадителя пример 2: найти условия количественного разделения 0,1 М Pb 2+ и TI + с помощью H 2 S; ПР т PbS = 7•10 -28 ; ПР т TI 2 S = 1,0•10 -22 ; приняв f i, I = 1, получаем 1•10 -6 • [S 2- ] = 7•10 -28 ; [ S 2- ] = 7,0 •10 -22 M; (0,1) 2 • [S 2- ] = 1 •10 -22 ; [ S 2- ] = 1,0 •10 -20 M; т.о., поддерживая [S 2- ] в интервале 7,0 •10 -22 - 1,0 •10 -20 M, получим осадок PbS↓ и TI + в растворе.
Слайд 27: Использование процессов осаждения и растворения в анализе
Разделение (обнаружение) ионов при контролируемой концентрации осадителя ( [S 2- ] в интервале 7,0 •10 -22 - 1,0 •10 -20 M): C S = [S 2- ] + [HS - ] + [H 2 S]; S 2- = [S 2- ] / C S ; растворимость H 2 S в воде составляет около 0,1 М, тогда 1 = 7,0 •10 -22 /0,1 = 7,0 •10 -21 ; 2 = 1,0 •10 -20 /0,1 = 1,0 •10 -19 ; [H 3 O + ] 2 • [S 2- ] [H 3 O + ] 2 •{ [S 2- ] } K a,1 • K a,2 = —————— = —————— { S 2- } [H 2 S] { C S 2- } для 1 [H 3 O + ] = √ K a,1 • K a,2 / 1 = √6,8•10 -23 / 7,0 •10 -21 ~ 0,1 M ; для 2 [H 3 O + ] = √ K a,1 • K a,2 / 2 = √6,8•10 -23 / 1,0 •10 -19 ~ 0,03 M.
Слайд 28: Использование процессов осаждения и растворения в анализе
Разделение (обнаружение) ионов при контролируемой концентрации осадителя:
Слайд 30: Использование процессов осаждения и растворения в анализе
■ Превращение одних малорастворимых соединений в другие: BaSO 4 → BaCO 3 ; ПР BaSO 4 = 1•10 -10 ; ПР BaCO 3 = 5,1•10 -9 ; [Ba 2+ ] • [CO 3 2- ] > ПР BaCO 3 ; отсюда [Ba 2+ ] > ПР BaCO 3 / [CO 3 2- ]; ПР BaSO 4 ПР BaCO 3 [CO 3 2- ] ПР BaCO 3 5,1•10 -9 ; ———— > ———— или ———— > ———— > ————. [SO 4 2- ] [CO 3 2- ] [SO 4 2- ] ПР BaSO 4 1•10 -10
Слайд 31: Использование процессов осаждения и растворения в анализе
■ Растворение осадков (протолитические конкурирующие реакции) : M(OH) n ↓ ↔ M n+ + nOH - nOH - + nH + ↔ nH 2 O M(OH) n ↓ + nH + ↔ nH 2 O + M n+ a M n+ ПР т M(OH) n K w • n √ 1•10 -6 K = ——— = ————; a n H + = —————— a n H + K n w n √ ПР т M(OH) n
Слайд 32: Использование процессов осаждения и растворения в анализе
Растворение осадков: при [H 3 O + ] = 1 M полностью растворяются M(OH) M(OH) 2 M(OH) 3 M(OH) 4 ПР 10 -20 10 -34 10 -48 10 -62 A m B n + nm H 3 O + ↔ mA n+ + nBH m + nm H 2 O K т s • ( [H 3 O + ] n + K a,1 • [H 3 O + ] n-1 + K a,1 • K a,2 ••• K a,n ) n S = m+n √————————————— —————————— m m • n n • f A m • А m • f B n •( K a,1 • K a,2 • K a,3 • • • K a,n ) n
Слайд 33: Использование процессов осаждения и растворения в анализе
Растворение осадков (конкурирующие реакции комплексообразования): AgBr ↓ ↔ Ag + + Br - Ag + + nNH 3 ↔ Ag[( NH 3 ) n ] + A m B n + nm L - ↔ mAL n + nB m- K т s • ( 1 + β 1 [L] + β 2 [L] 2 + …+ β n [L] n ) m S = m+n √————————————— ——————. m m • n n • f A m • B n • f B n