Первый слайд презентации: Титриметрия (основные понятия)
Титриметрия (фр. titre – качество, характеристика ; греч. metreo – измеряю) – совокупность методов количественного анализа, основанных на проведении стехиометрических химических реакций в растворе, реже в газовой фазе. Титриметрический анализ возник как метод нейтрализации. Название «титриметрический анализ» предложено французским физикохимиком Ж. Гей-Люссаком (1778 – 1850), внесшим большой вклад в развитие этого метода. В ХХ в. голландский химик-аналитик И.М. Кольтгоф (1894 – 1997) предложил ряд методов измерений рН растворов с использованием цветных кислотно-основных индикаторов.
Слайд 2: Титриметрия (основные понятия)
Монография И.М. Кольтгофа «Объемный анализ», впервые вышедшая в 1929 г., в дальнейшем многократно переиздавалась и на протяжении десятков лет служила замечательны учебником для многих поколений химиков во всем мире.
Слайд 3: Титриметрия (основные понятия)
Титрованием называют процесс последовательного контролируемого добавления раствора одного вещества ( титрант ) к раствору другого вещества ( титруемое вещество ). Массовые титриметрические анализы обычно проводят с помощью титраторов. В процессе титрования в качестве аналитического сигнала измеряют объем титранта, израсходованного для достижения конечной точки титрования (к.т.т.).
Слайд 7: Основы титриметрии
Согласно закону химических эквивалентов вещества А и В вступают в реакцию А + В ↔ С в эквивалентных количествах : n 1 = n 2 (n 1, n 2 - количество вещества компонента А и В соответственно). Поскольку количество вещества n = C•V (C – молярная концентрация эквивалента вещества, V – объем раствора, в котором растворено вещество), для двух стехиометрически реагирующих веществ справедливо соотношение : C 1 • V 1 = C 2 • V 2, где C 1, C 2 – молярная концентрация эквивалента вещества А и В соответственно, V 1, V 2 – объем раствора вещества А и В соответственно. Следовательно, можно найти неизвестную концентрацию одного из веществ (например, концентрацию C 2 ), если известны объем этого раствора V 2, а также объем V 1 и концентрация C 1 прореагировавшего с ним вещества.
Слайд 8: Основы титриметрии
Зная молярную массу эквивалента М 2, находят массу m 2 вещества В : m 2 = C 2 • М 2 • V 0 • 10 -3, где V 0 объем раствора, мл. Чтобы зафиксировать момент окончания реакции, который называют точкой эквивалентности (или точкой стехиометричности), раствор с известной концентрацией вещества (его называют титрантом Т ) постепенно, небольшими порциями добавляют к раствору определяемого вещества А. Этот процесс называют титрованием. После добавления каждой порции титранта в растворе устанавливается равновесие реакции титрования : aA + tT ↔ cC
Слайд 9: Основы титриметрии
Реакция титрования должна отвечать следующим требованиям : • строгая стехиометричность ; • экспрессность ; • протекать количественно ; • должен существовать способ фиксирования точки эквивалентности. Экспериментально момент окончания титрования устанавливают по изменению цвета индикатора или какого-либо физико-химического свойства раствора. Эта точка, называемая конечной точкой титрования, в общем случае не совпадает с теоретически рассчитанной точкой эквивалентности. В титриметрии используют реакции всех типов (таблица).
Слайд 11: Способы выражения концентраций в титриметрии
Наиболее распространено выражение концентрации растворов в массовых долях (%) растворенного вещества, количеством молей растворенного вещества в 1 л ( молярная концентрация ) и количеством молей эквивалентов растворенного вещества в 1 л раствора ( нормальная концентрация ). Эквивалентом называют реальную или условную частицу вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону. Эквивалент – безразмерная величина.
Слайд 12: Способы выражения концентраций в титриметрии
В титриметрическом анализе иногда используют единицу измерения массовой концентрации в г / мл. Это титр раствора Т. При проведении однотипных титриметрических определений удобен титр по определяемому веществу ; это число граммов определяемого вещества, реагирующего с 1 мл стандартного раствора. Например, запись T(HCI/CaCO 3 ) = 0,008 г / мл означает, что 1 мл раствора HCI реагирует с 0,008 г CaCO 3.
Слайд 13: Основы титриметрии
По способу выполнения процедуры титрования различают прямое, обратное титрование и титрование заместителя. При прямом титровании титрант добавляют непосредственно к раствору определяемого вещества. Такой способ выполним только при наличии всех требований, перечисленных выше. aA + bB cC + dD
Слайд 21: Основы титриметрии (обратное титрование)
Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются нежелательные побочные эффекты, можно использовать прием обратного титрования : добавить к раствору определяемого вещества заведомо избыток титранта, а затем найти количество непрореагировашего титранта титрованием его раствором другого реагента. Например, прямое титрование диоксида марганца щавелевой кислотой невозможно из-за малой скорости реакции : MnO 2 + H 2 C 2 O 4 + 2H 3 O + ↔ Mn 2+ + 2С O 2 + 4H 2 O 2MnO 4 - + 5 H 2 C 2 O 4 + 6H 3 O + ↔ 2Mn 2+ + 10 С O 2 ↑ + 14H 2 O
Слайд 25: Основы титриметрии (титрование заместителя)
Если реакция нестехиометрична или протекает медленно, можно использовать заместительное титрование (титрование заместителя).
Слайд 26: Основы титриметрии (титрование заместителя)
Если реакция нестехиометрична или протекает медленно, можно использовать заместительное титрование (титрование заместителя). aA + bB ↔ a 1 A 1 + … a* 1 A 1 + cC ↔ a 2 A 2 + … a * 2 A 2 + dD ↔ a 3 A 3 + … a * 3 A 3 + rR ↔ a 4 A 4 + …
Слайд 31: Стандартные растворы в титриметрии
Для титриметрического определения необходимо знать концентрацию титранта. Титрант известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением образца чистого химического вещества, масса которого точно измерена и известен стехиометрический состав, в определенном объеме растворителя. Вторичный стандартный раствор подлежит стандартизации по подходящему первичному стандартному раствору.
Слайд 32: Стандартные растворы в титриметрии
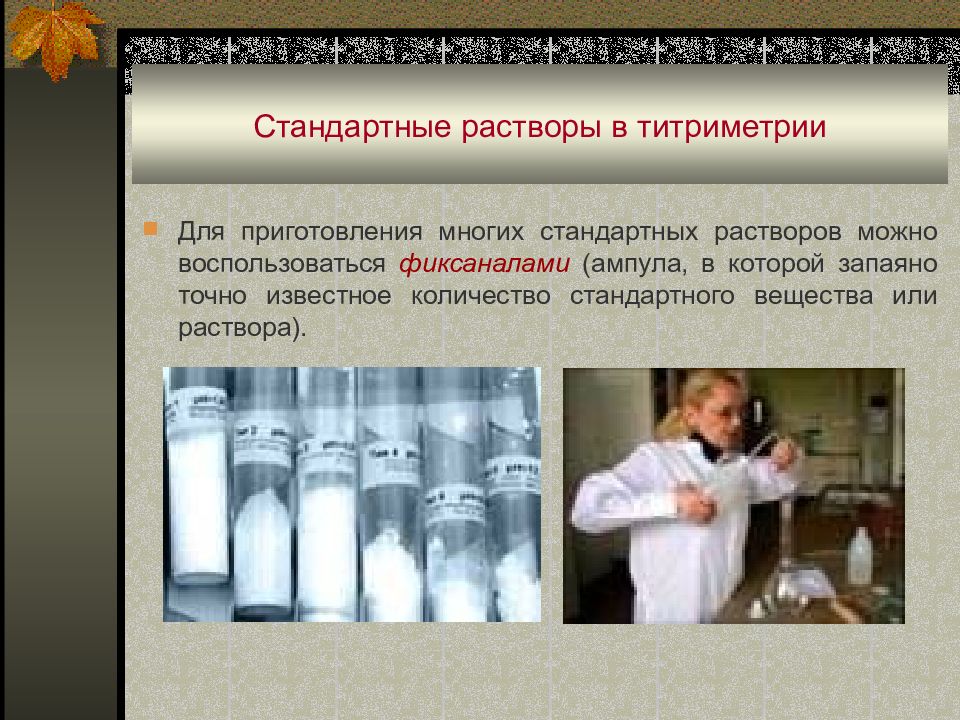
Для приготовления многих стандартных растворов можно воспользоваться фиксаналами (ампула, в которой запаяно точно известное количество стандартного вещества или раствора).
Слайд 34: Стандартные растворы в титриметрии
Стандартизацию вторичных стандартных растворов проводят способами отдельных навесок и пипетирования. Для титриметрического определения необходимо знать концентрацию титранта. В методе отдельных навесок каждую навеску первичного стандарта растворяют в определенном объеме и титруют раствором анализируемого вещества : В методе пипетирования титруют аликвотные порции анализируемого вещества раствором первичного стандарта.
Слайд 37: Кривые титрования
В процессе титрования изменяются равновесные концентрации определяемого вещества, титранта и продуктов реакции. При этом пропорционально концентрации этих веществ изменяются свойства раствора (рН, потенциал). График зависимости параметра системы, связанного с концентрацией определяемого вещества, титранта или продукта, от состава раствора в процессе титрования называют кривой титрования. Кривые титрования помогают выбрать индикатор, оценить возможность и погрешности титрования.
Слайд 38: Кривые титрования
Как правило, по оси абсцисс откладывают объем добавленного титранта ( V т ) или степень оттитрованности ( f, ) – отношение количества оттитрованного в данный момент вещества n Т к исходному количеству вещества n 0. Поскольку С Т V Т = n Т, n 0 = С 0 V 0 = С Т V т.э., получаем : При С 0 = С Т имеем V т – объем титранта, добавленный в i- момент времени, V 0 - исходный объем раствора определяемого вещества, V т.э – объем титранта в точке эквивалентности, С 0, С Т - молярные концентрации эквивалентов определяемого вещества и титранта соответственно.
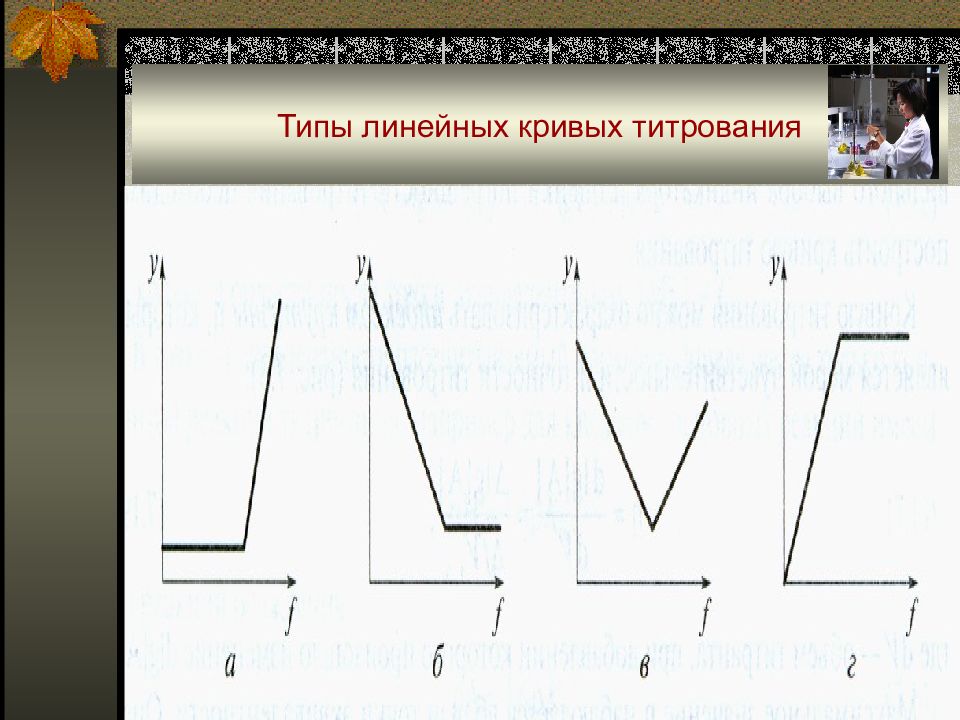
Слайд 39: Линейные кривые титрования
Откладывая на оси ординат свойство системы (аналитический сигнал у), прямо пропорциональное концентрации вещества, титранта, продукта реакции или их комбинации, получают линейные кривые титрования. Как правило, для реакции титрования А + Т ↔ C + D, y = k A [A] = k A •C 0 •(1 – f). Достоинством линейных кривых титрования является простота построения. Их получают экспериментально при фотометрическом, амперометрическом, кондуктометрическом, радиометрическом, потенциометрическом титровании.
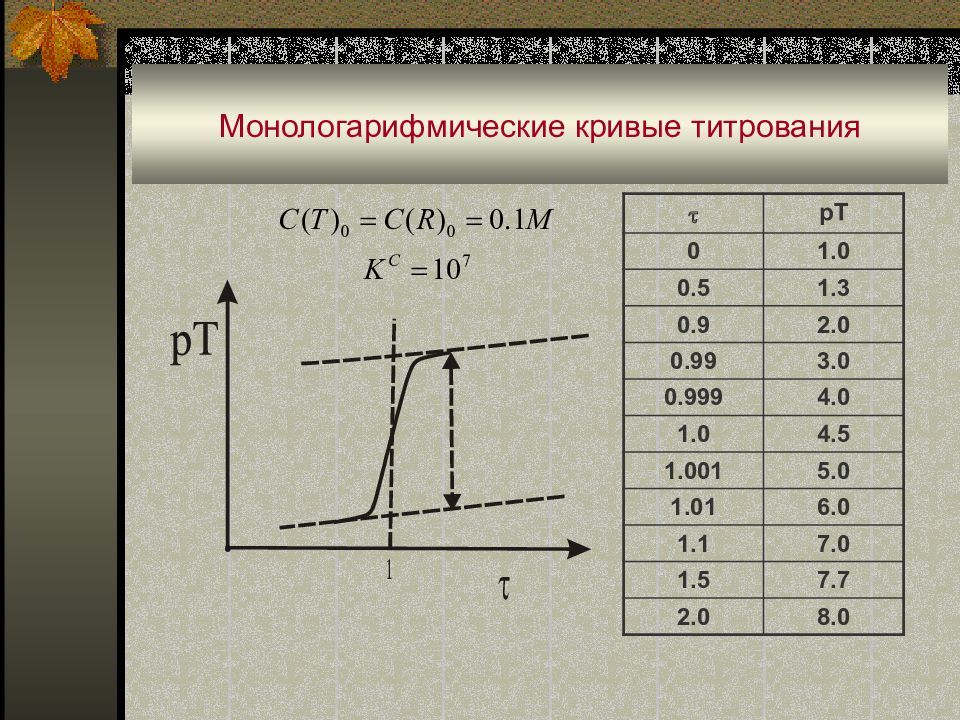
Слайд 41: Монологарифмические кривые титрования
В некоторых случаях продукты реакции титрования практически не влияют на равновесные концентрации определяемого вещества [ А ] или титранта [ Т ]. Например, при кислотно-основном, комплексометрическом, осадительном титровании (молекулы воды, комплексы или малорастворимые соединения) выводятся из реакции. В этих случаях при построении кривых титрования по оси ординат можно отложить логарифм концентрации [ А ] или [ Т ]. Такие кривые называют монологарифмическими. Монологарифмические кривые титрования удобны в работе, в частности, позволяют упростить расчетные формулы (при C 0 ≈ С Т пренебрегают изменением объема раствора при титровании).
Слайд 42: Монологарифмические кривые титрования
Процесс титрования можно условно разбить на три этапа : • титрование до т.э. ; • в т.э. ; • титрование после т.э. Для реакции Т ( титруемое вещество ) + R ( реагент, титрант ) при С(Т) 0 = С( R ) 0, получаем зависимость рТ = f( ). I этап. 0 1 ; [T] = C(T) 0 (1- ); pT= - lg C(T) 0 - lg (1- ).
Слайд 43: Монологарифмические кривые титрования
II этап : = 1 pT = - lg C(T) 0 + 1/2 lg K C × C 2 (T) 0
Слайд 44: Монологарифмические кривые титрования
III этап : >1 pT = - lg C(T) 0 + lg K C × C 2 (T) 0 + lg ( -1 )
Слайд 45: Монологарифмические кривые титрования
pT 0 1.0 0.5 1.3 0.9 2.0 0.99 3.0 0.999 4.0 1.0 4.5 1.001 5.0 1.01 6.0 1.1 7.0 1.5 7.7 2.0 8.0
Слайд 47: Монологарифмические кривые титрования
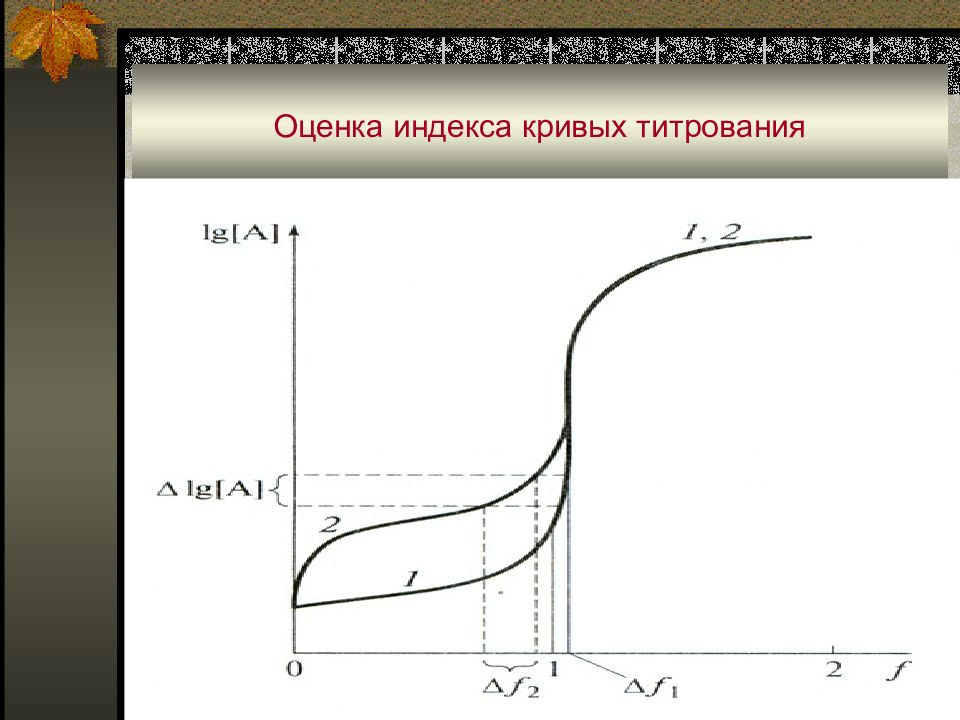
Область резкого изменения параметра на кривых титрования называют скачком титрования. Кривую титрования можно охарактеризовать индексом крутизны ŋ, который является мерой чувствительности и точности титрования : где dV – объем титранта, при добавлении которого произошло изменение d lg[A]. Очевидно, что чем больше значение ŋ, тем чувствительнее метод.
Слайд 49: Кислотно-основное титрование
В основе метода кислотно-основного титрования лежит протолитическая реакция : SH 2 + + S - ↔ 2SH, в частности в водных растворах : H 3 O + + OH - ↔ 2H 2 O. Кривые титрования строят в координатах рН – f ( ).
Слайд 50: Кривые кислотно-основного титрования
Этапы титрования Состав раствора Уравнение pH I 0 1 H 3 O + H 2 O pH= - lg C( H 3 O + ) 0 - lg (1- ) 0 1 0.5 1.3 0.9 2 0.99 3 0.999 4
Слайд 51: Кривые кислотно-основного титрования
Этапы титрования Состав раствора Уравнение pH II = 1 III, > 1 H 2 O H 2 O OH - pH = - lg C( H 3 O + ) 0 + ½ lg K C C 2 ( H 3 O + ) 0 = = ½ pK w pH= - lg C( H 3 O + ) 0 + lg K C C 2 ( H 3 O + ) 0 + lg ( -1 ) = = lg C( H 3 O + ) 0 + pK w + lg ( -1 ) 1 7 1,001 1,01 1,1 1,5 2,0 10 11 12 12,7 13
Слайд 52: Кривые кислотно-основного титрования
pH = lg C( H 3 O + ) 0 + pK w + lg ( -1 ) + lg C( H 3 O + ) 0 + lg (1 - ) = 2 lg C( H 3 O + ) 0 + pK w – 4 = 2 lg C( H 3 O + ) 0 + pK w – 4. pH 0 когда 2lg C( H 3 O + ) 0 + 14 > 4 или lg C( H 3 O + ) 0 > -5 C( H 3 O + ) 0 >10 -5 M
Слайд 53: Кривые кислотно-основного титрования
Крутизна ( ) кривой кислотно-основного титрования : 6 для диапазона (0,999 ÷ 1,001) = ———————— = 300 ; (1,001 – 0,999) × 10 7 для диапазона (0,99 ÷ 1,01) = ———————— = 3 5. (1,01 – 0,99) × 10
Слайд 54: Кривые кислотно-основного титрования
pH I = pKw + lg C(OH - ) O + lg (1 - ); pH II = ½ lg K W ; pH III = - lg C( OH - ) 0 – lg ( -1 ); pH= - lg C( OH - ) 0 + 2 – pK w - lg C( OH - ) 0 + 2 = - 2 lg C( OH - ) 0 = 1 0; pH 0 при C( OH - ) 0 >10 -5 M
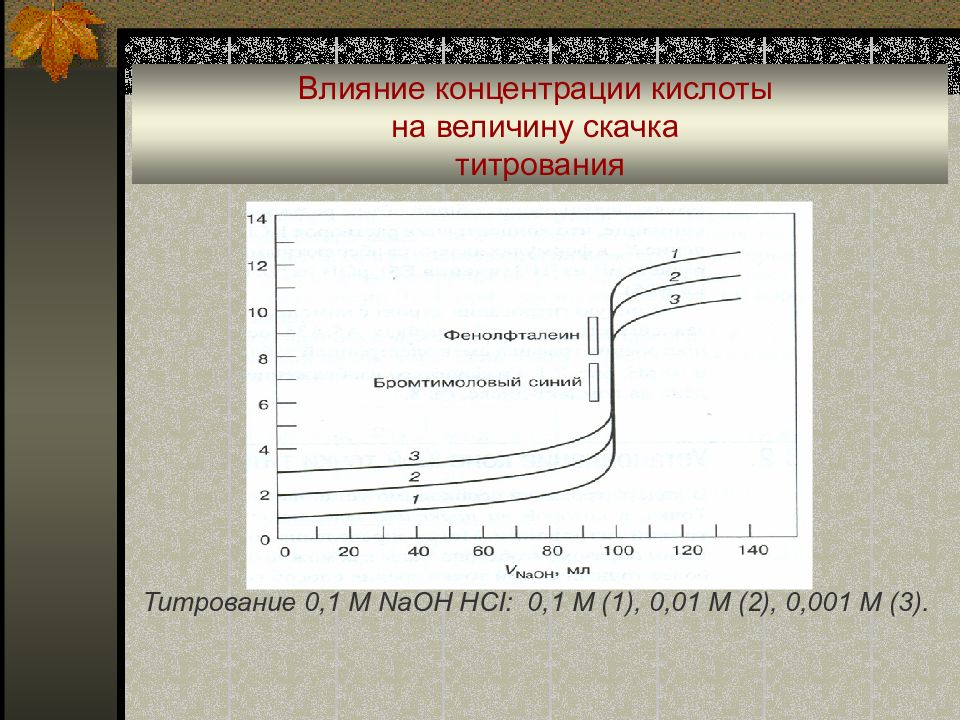
Титрование 0,1 М NaOH HCI: 0,1 M (1), 0,01 M (2), 0,001 M (3).
Слайд 56: Титрование слабых протолитов сильными протолитами
BH + OH - ↔ H 2 O + B (BH + Solv - ↔ HSolv + B) – алкалиметрия B + H 3 O + ↔ BH + H 2 O (B + H 2 Solv + ↔ BH + HSolv) – ацидиметрия
Слайд 57: Титрование слабых протолитов сильными протолитами (алкалиметрия)
Этапы титрования Состав раствора Уравнение I, = 0 BH [B] [H 3 O + ] [H 3 O + ] 2 K a(BH) = ————— = ——— [BH] [BH] [H 3 O + ] = √ K a(BH) [BH] pH = ½ pK a(BH) - ½ lg C(BH) 0
Слайд 58: Титрование слабых протолитов сильными протолитами
Этапы т - я Состав раствора Уравнение II, 0 1 BH, B [B] [H 3 O + ] K a(BH) = —————; [BH]
Слайд 59: Титрование слабых протолитов сильными протолитами
Этапы т - я Состав раствора Уравнение III, = 1 B, H 2 O B+H 2 O HB+OH -
Слайд 60: Титрование слабых протолитов сильными протолитами
Этапы т - я Состав раствора Уравнение III, = 1 B, H 2 O
Слайд 61: Титрование слабых протолитов сильными протолитами
Этапы т - я Состав раствора Уравнение IV, > 1 B, OH -
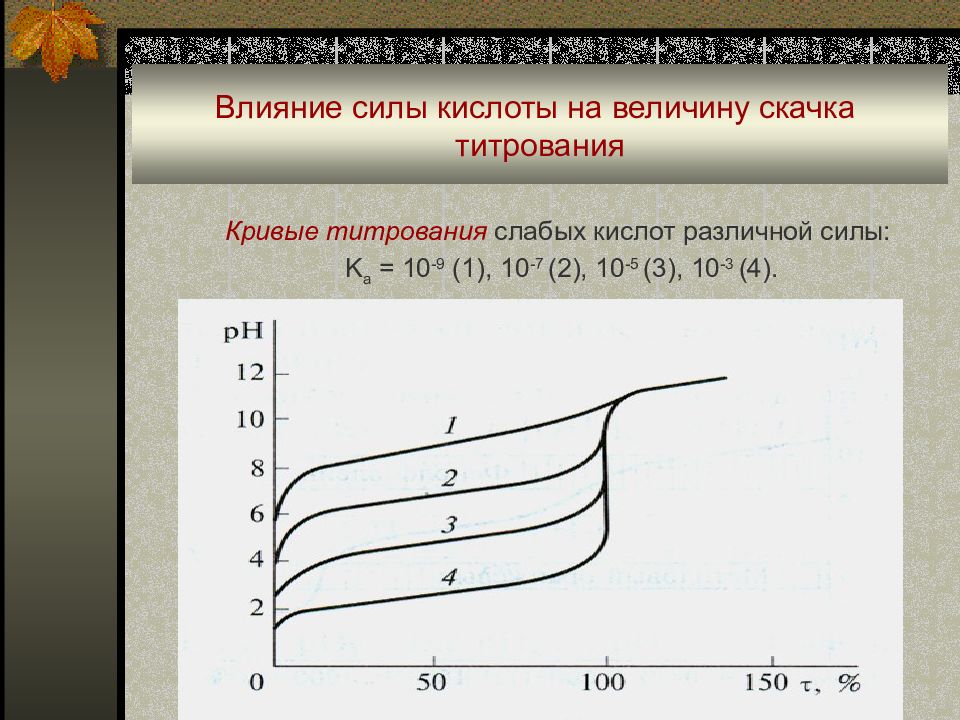
Слайд 64: Влияние силы кислоты на величину скачка титрования
Кривые титрования слабых кислот различной силы : K a = 10 -9 (1), 10 -7 (2), 10 -5 (3), 10 -3 (4).
Слайд 65: Титрование слабых протолитов сильными протолитами
Протолит pK a Протолит т CH 3 COOH NH 4 + HCN HBO 2 C 6 H 5 OH C 5 H 5 NH + 4,8 9,2 9,3 9,1 9,9 5,2 CH 3 COOH NH 3 CN - BO 2 - C 6 H 5 O - C 5 H 5 NH +
Слайд 66: Титрование смесей (многоосновных) протолитов ( B I H B II H B III H )
Этапы т - я Состав раствора Уравнение 1, τ = 0 2, 0< τ <1 3, τ = 1 4, 1< τ <2 5, τ = 2 B I H B II H B III H B I H B II H B III H B 1 B 1 B II H B III H B 1 B II H B III H B II B 1 B II B III H pH = ½ pK a (B I H) – ½ lgC(B I H) 0 τ pH = pK a (B I H) + lg 1 – τ pH = ½ pK a (B I H) + ½ pK a (B II H) τ - 1 pH = pK a (B II H) + lg 2 – τ pH = ½ pK a (B III H) + ½ pK a (B II H)
Слайд 67: Титрование смесей (многоосновных) протолитов ( B I H B II H B III H )
Этапы т - я Состав раствора Уравнение 6, 2< τ <3 7, τ = 3 8, τ > 3 B 1 B II B III B III H B 1 B II B III B 1 B II B III OH - τ - 2 pH = pK a (B III H) + lg 3 – τ pH = ½ pK w + ½ pK a (B III H) + ½ lg C (B III H) pH = pK w + lg C (OH - ) + lg ( τ – 3)
Слайд 68: Титрование смесей (многоосновных) протолитов ( B I H B II H B III H )
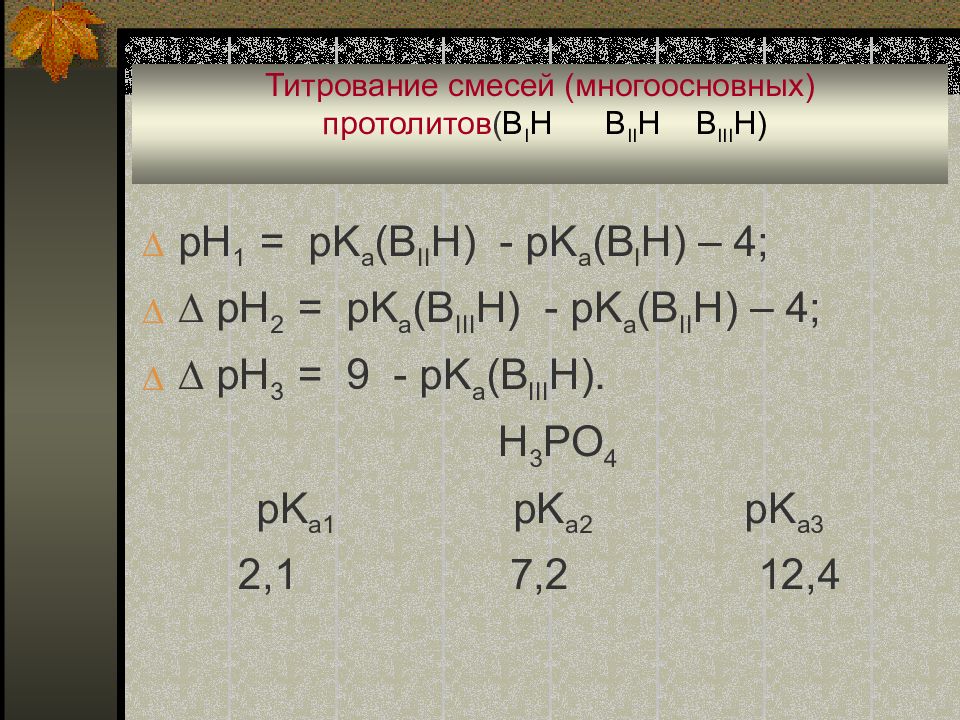
pH 1 = pK a (B II H) - pK a (B I H) – 4; pH 2 = pK a (B III H) - pK a (B II H) – 4; pH 3 = 9 - pK a (B III H). H 3 PO 4 pK a1 pK a2 pK a3 2,1 7,2 12,4
Слайд 69: Индикаторы
Для фиксирования конца титрования в титриметрии используют визуальные (титрование с индикатором цветным или флуоресцентным) и инструментальные (потенциометрическое, амперометрическое, фотометрическое титрование) методы. Цветные индикаторы в кислотно-основном титровании – это слабые органические кислоты и основания, молекулярные и ионные формы которых различаются по строению и окраске. Изменение окраски индикатора связано также с таутомерией органических молекул.
Слайд 70: Индикаторы
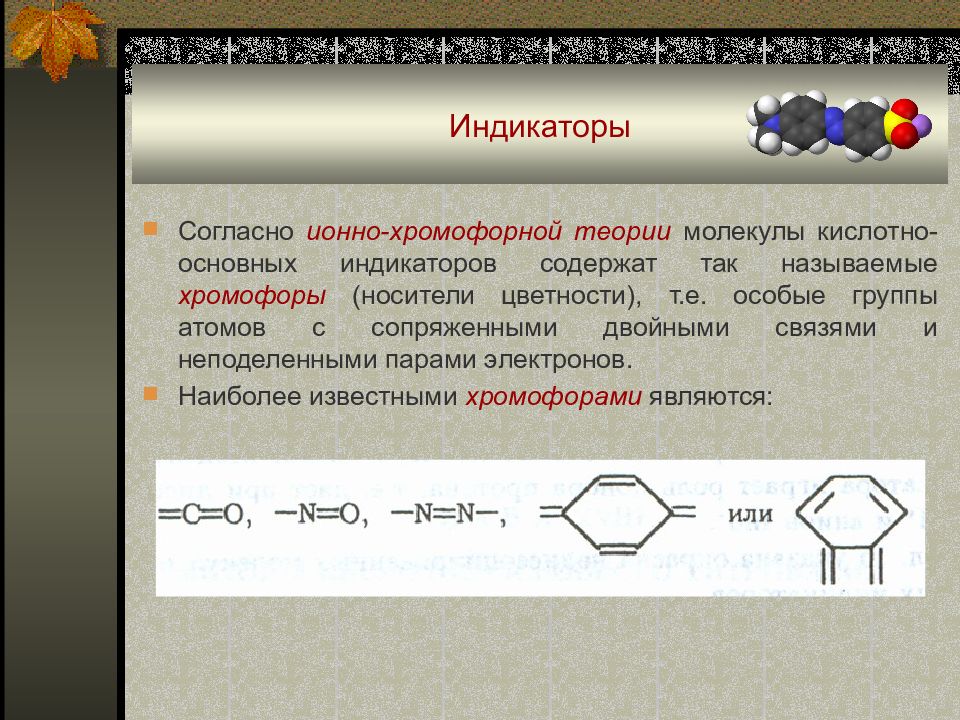
Согласно ионно-хромофорной теории молекулы кислотно-основных индикаторов содержат так называемые хромофоры (носители цветности), т.е. особые группы атомов с сопряженными двойными связями и неподеленными парами электронов. Наиболее известными хромофорами являются :
Слайд 71: Индикаторы
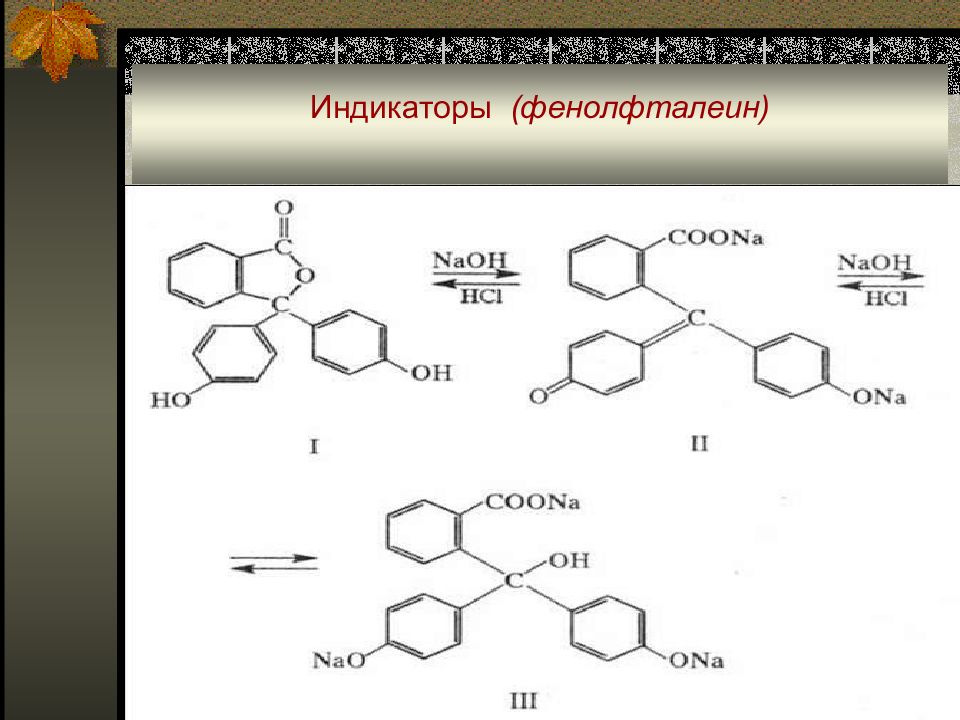
Помимо хромофорных групп в молекулах индикаторов могут присутствовать ауксохромные - электродонорные ( -F < -CH 3 < -CI < -Br < -OH < -OCH 3 < -NH 2 < -NHCH 3 < -N(CH 3 ) 2 < -NHC 6 H 5 ) и антиауксохромные – электроноакцепторные ( -NH 3 + < -SO 2 NH 2 < -COO - < -CN < -COOCH 3 < -COCH 3 < CHO < NO 2 ) группы, которые усиливают окраску реагентов. Типичный одноцветный индикатор – фенолфталеин. При pH < 8 его молекулы не содержат хромофорных групп, поэтому его растворы бесцветны. При повышении рН молекулы фенолфталеина диссоциируют и образующийся анион содержит хиноидную группировку, что проявляется в окрашивании раствора в малиновый цвет.
Слайд 73: Индикаторы ( метиловый оранжевый )
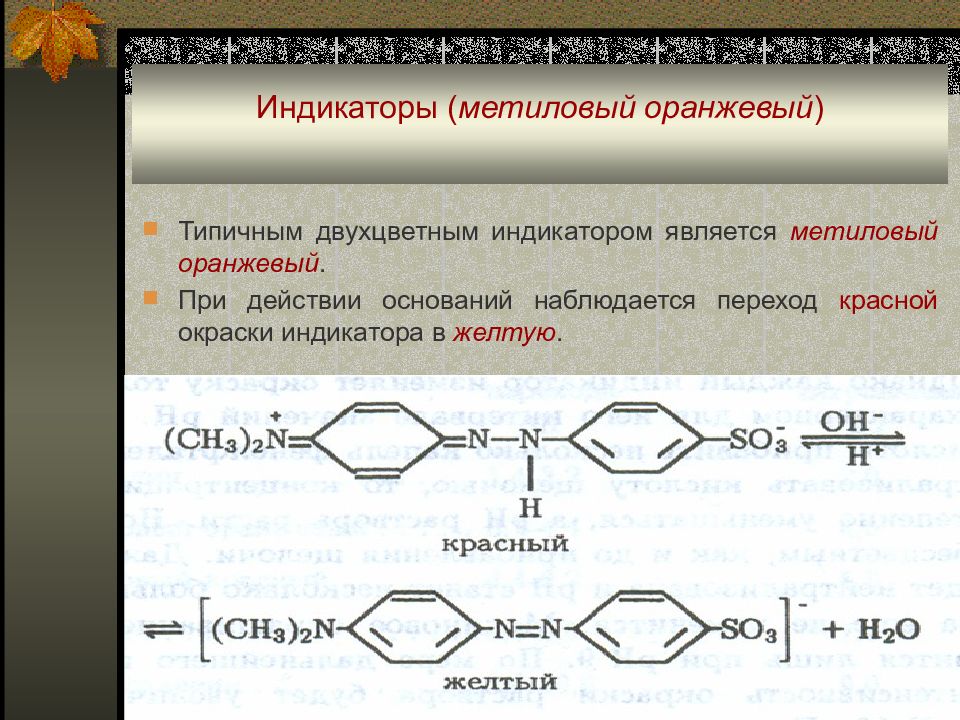
Типичным двухцветным индикатором является метиловый оранжевый. При действии оснований наблюдается переход красной окраски индикатора в желтую.
Слайд 75: Равновесия в растворах индикаторов
Равновесие в растворе индикатора HIn можно представить как кислотно-основную реакцию Из выражения для константы кислотности получаем Человеческий глаз воспринимает окраску одной из форм при определенной концентрации ее в растворе, например, форму In - при [In - ]/[HIn] ≥ 10 и форму HIn при In - ]/[HIn] ≤10.
Слайд 76: Равновесия в растворах индикаторов
Подставляя граничные значения отношений форм, получим интервал рН перехода окраски индикатора : Индикатор тем ценнее, чем меньше ∆ рН. Для одноцветных индикаторов при изменении рН нарастает или уменьшается концентрация окрашенной формы. Если окрашенная ионная форма In - получаем равновесие : ∆pH = pKa ± 1
Слайд 77: Кислотно-основные индикаторы
Середина области перехода окраски индикатора (при этом рН = рК а ) называется показателем индикатора (рТ). Выбирают индикатор так, чтобы область рН перехода его окраски входила в скачок титрования. При титровании возможны случайные и систематические погрешности. Случайные погрешности титрования связаны с измерением объема и массы навески. Они тем меньше, чем больше индекс крутизны кривой титрования Систематические погрешности титрования связаны с несовпадением точки эквивалентности и конечной точки титрования. s(V) = s(pH)/ ŋ
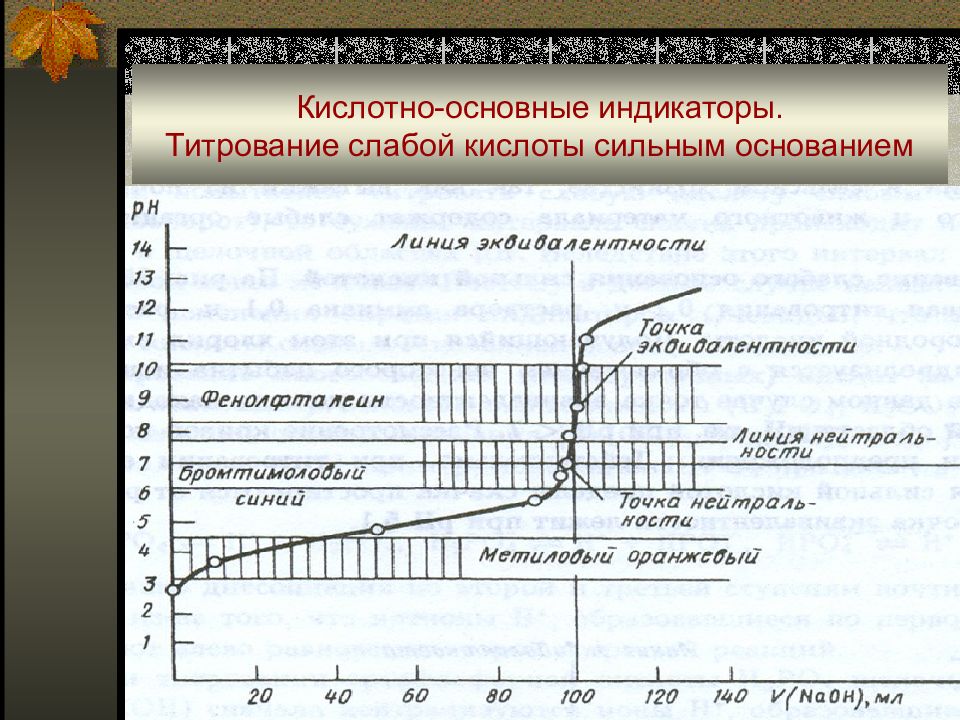
Слайд 78: Кислотно-основные индикаторы. Титрование слабой кислоты сильным основанием
Слайд 79: Погрешности кислотно-основного титрования
1. При недотитровывании сильных кислот (присутствует избыток ионов водорода) : C 0 - исходная концентрация титруемого раствора. Систематическая погрешность титрования вычисляется по формуле : C учетом изменения объема раствора : [H + ] = C 0 (1 – f)
Слайд 80: Погрешности кислотно-основного титрования
2. При недотитровывании сильных оснований в растворе присутствует избыток гидроксид - ионов Тогда С учетом изменения объема [OH - ] = C 0 (1 – f)
Слайд 81: Погрешности кислотно-основного титрования
3. При перетитровывании сильных кислот в растворе присутствует избыток сильного основания, и систематическую погрешность рассчитывается по формуле : 4. При перетитровывании сильного основания в растворе присутствует избыток сильной кислоты, и систематическую погрешность рассчитывается по формуле :
Слайд 82: Погрешности кислотно-основного титрования
При недотитровывании слабых кислот : При недотитровывании слабых оснований :
Слайд 83: Погрешности кислотно-основного титрования
Систематические погрешности : 1. протонная (водородная ошибка) pT < pH т.э. - алкалиметрия pT > pH т.э. - ацидиметрия N 1 V 1 10 -pT V 2 10 -pT V 2 ——— = 100 %; ———— = x %; x = ————×100 %. 1000 1000 N 1 V 1 pH = - lg [H 3 O + ] = pT; [H 3 O + ] = 10 -pT
Слайд 84: Погрешности кислотно-основного титрования
Систематические погрешности : 2. гидроксильная ошибка pT > pH т.э. - алкалиметрия pT < pH т.э. - ацидиметрия pOH = 14 – pH = 14 – (-lg[H 3 O + ]) = 14 – pT [OH - ] = 10 - (14 – pT) 10 -(14-pT ) V 2 x = ————— 100% N V 1
Слайд 85: Погрешности кислотно-основного титрования
Систематические погрешности : 3. кислотная ошибка [ B ][ H 3 O + ] [ BH ] [ H 3 O + ] BH + H 2 O ↔ B + H 3 O + ; K a = —————; —— = ——— = [ BH ] [ B ] K a 10 -pT ———— = 10 pKa – pT ; pK a – pT ≤ - 2; pT ≥ pK a + 2. 10 -pKa 4. щелочная ошибка [BH][OH - ] B + H 2 O ↔ BH + OH - ; K b = —————; [B]
Слайд 86: Погрешности кислотно-основного титрования
[B] [OH - ] 10 -(14 – pT) ——— = ——— = ————— = 10 pKb + pT - 14 [BH] K b 10 -pKb pK b + pT - 14 ≤ -2 при pT ≤ 12 - pK b Для снижения систематической погрешности рекомендуется использовать контрольный раствор (называемый также «холостым» или «свидетелем»). С этой целью заранее готовят раствор с такой же окраской, как в конечной точке титрования.
Слайд 87: Погрешности кислотно-основного титрования
Пример. Рассчитайте погрешность титрования 10,0 мл 0,1000М раствора соляной кислоты 0,1000М раствором гидроксида натрия с индикатором фенолфталеином (рТ = 9,0). Решение. Поскольку рТ > рН т.э., то раствор перетитрован. Следовательно погрешность титрования определяется избыточным количеством добавленного титранта. Используем уравнение 20,0 • 10 (14 – 9) ∆, % = ————————— × 100 = + 0,02 %. 10,0 • 1,000 • 10 -1
Слайд 88: Погрешности кислотно-основного титрования
Пример. Рассчитайте погрешность титрования 0,1000М раствора уксусной кислоты 0,1000М раствором гидроксида натрия в присутствии индикатора метилового оранжевого (рТ = 4). Решение. Титрование закончилось раньше точки эквивалентности (рН = 8.72). Следовательно в растворе осталась неоттитрованная уксусная кислота.
Слайд 89: Применение протолиметрии
Определение азота. Важным методом определения азота в белках и других азотсодержащих веществах является метод Кьельдаля. Для определения азота пробу сначала разлагают серной кислотой : Затем раствор охлаждают, добавляют концентрированный раствор щелочи и отгоняют аммиак, поглощая его точно измеренным объемом стандартного раствора кислоты, которая берется в избытке.
Слайд 90: Прибор для отгонки аммиака
1 – колба Кьельдаля ; 2 – ловушка ; 3 – холодильник ; 4 – аллонж ; 5 – приемник.
Слайд 91: Применение протолиметрии
Непрореагировавшее количество кислоты оттитровывают стандартным раствором щелочи : Содержание азота находят по разности между взятым количеством кислоты и израсходованным количеством щелочи.
Слайд 92: Определение карбонатной жесткости воды
Жесткость воды зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются : Жесткость воды принято выражать молярной концентрацией эквивалентов кальция и магния. Карбонатную жесткость определяют титрование определенного объема воды раствором HCI с метиловым оранжевым :
Слайд 94: Определение общей кислотности плодов и овощей
По общей кислотности судят о качестве свежих или переработанных плодов и овощей. Приблизительно 20 г анализируемого материала переносят в мерную колбу вместимостью 200 мл, ставят на водяную баню и выдерживают 15 мин при температуре 80 0 С. Аликвоту (20 мл) переносят в коническую колбу (если необходимо, предварительно фильтруют), добавляют 2 – 3 капли фенолфталеина и титруют раствором гидроксида натрия. Общую кислотность продукта (x) рассчитывают в процентах
Слайд 95: Определение карбонат-, гидрокарбонат- и гидроксид - ионов в смеси
При титровании смеси ионов CO 3 2- и HCO 3 - на кривой титрования имеется два скачка, поскольку K b (CO 3 2- )/ K b (HCO 3 - ) = 2 • 10 -4 : 2,2 • 10 -8 ≈ 10 4. Если титровать смесь объемом V см раствором HCI концентрацией С HCI в присутствии фенолфталеина до обесцвечивания последнего ( V 1 ), то ионы CO 3 2- будут оттитровываться до HCO 3 - : С HCI • V 1 C(CO 3 2- ) = —————. V см Если титровать смесь в присутствии метилового оранжевого, то будут оттитрованы все ионы CO 3 2- и HCO 3 - до H 2 CO 3.
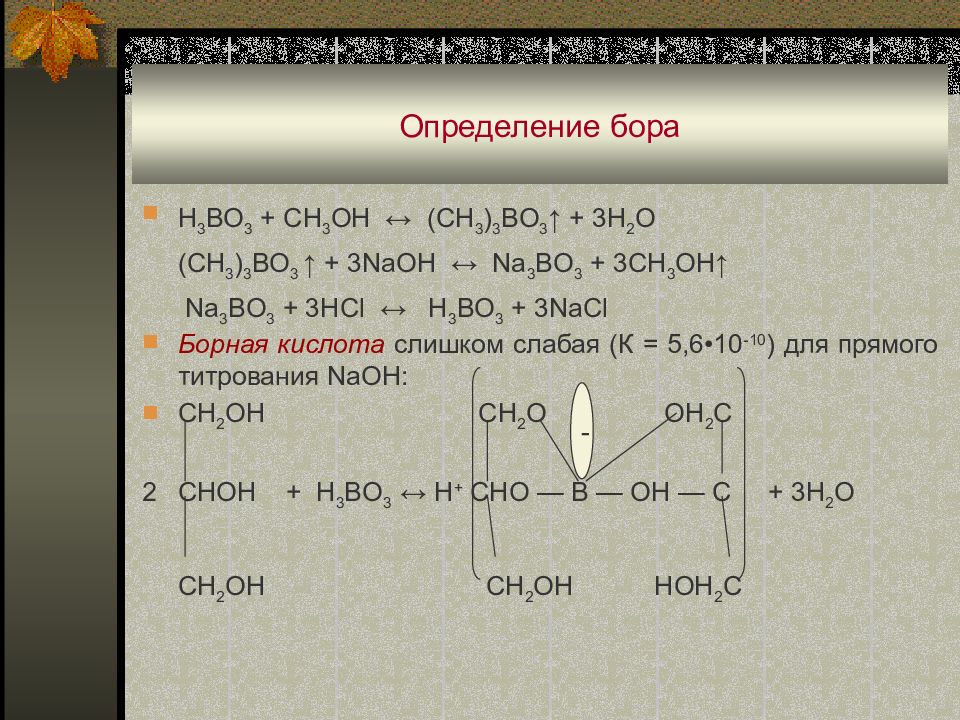
Слайд 96: Определение бора
H 3 BO 3 + CH 3 OH ↔ (CH 3 ) 3 BO 3 ↑ + 3H 2 O (CH 3 ) 3 BO 3 ↑ + 3NaOH ↔ Na 3 BO 3 + 3CH 3 OH↑ Na 3 BO 3 + 3HCl ↔ H 3 BO 3 + 3NaCl Борная кислота слишком слабая (К = 5,6 •10 -10 ) для прямого титрования NaOH: CH 2 OH CH 2 O OH 2 C 2 CHOH + H 3 BO 3 ↔ H + CHO — B — OH — C + 3H 2 O CH 2 OH CH 2 OH HOH 2 C -
Последний слайд презентации: Титриметрия (основные понятия): Определение бикарбоната в крови методом обратного титрования
Порядка 95 % диоксида углерода в крови человека находится в форме HCO 3 -, остальная часть – в виде растворенного СО 2. Концентрация HCO 3 - в крови во многих случаях является диагностическим показателем. К пробе крови добавляют избыток 0,01 М HCI для перевода HCO 3 - в летучий СО 2 и удаления газа, а затем оттитровывают непрореагировавшее количество HCI раствором NaOH. Уравнения реакций : HCO 3 - + H + ↔ H 2 O + СО 2 ↑ H + (избыток) + OH - ↔ H 2 O