Слайд 3: р-Элементы
р-элементы включают в себя все благородные газы, кроме гелия, все неметаллы, кроме водорода, все металлоиды, и даже несколько металлов, в том числе Al, Sn и РЬ O, Si и Al – наиболее распространенные элементы в земной коре C, N, O, P, S и Cl – среди элементов, составляющих большую часть живой материи C и S могут встречаться в свободном виде
Слайд 4: Общая характеристика p - элементов
Общая электронная формула: […] ns 2 ( n– 2) f 14 ( n– 1) d 10 np 1 6 Степени окисления (от – IV до + VII ). Отличие свойств последнего элемента группы (6 период) : стабилизаци я низ ше й степени окисления. Например, в 13 групп е таллий ( I ) ; в 14 групп е свин ец ( II ) ; в 15 групп е висмут ( III ) и т.д. Х арактерно образование кратных ( - и -) связей ; тип гибридизации атомных орбиталей преимущественно sp 3.
Слайд 5: р - элементы:
Для простых и сложных веществ: к атенаци я – образовани е структур типа –Э—Э—Э– … ( O 3, P 4, S 8, Na 2 Se 5, HN 3 … ) и –Э—О—Э—О—Э– … ( H 2 S 2 O 7, Na 2 B 4 O 7...). Н еметаллические свойства : склонность к образованию одноатомных анионов ( S 2–, Cl – и т.д.), к образованию только сложных катионов ( NH 4 +, NO + и т.д.), окислительные свойства. С увеличением порядкового номера элемента (сверху вниз по группе) усилива е тся металлич ность.
Слайд 6
Металлический характер элементов уменьшается слева направо в периодах в связи с увеличением энергии ионизации. Максимальная степень окисления увеличивается в периодах. Ионный характер галогенидов и оксидов уменьшается в каждом периоде. Кислотный характер оксидов возрастает в каждом периоде. Ионный характер оксидов и галогенидов увеличивается (сверху вниз по группе) и они становятся более основными.
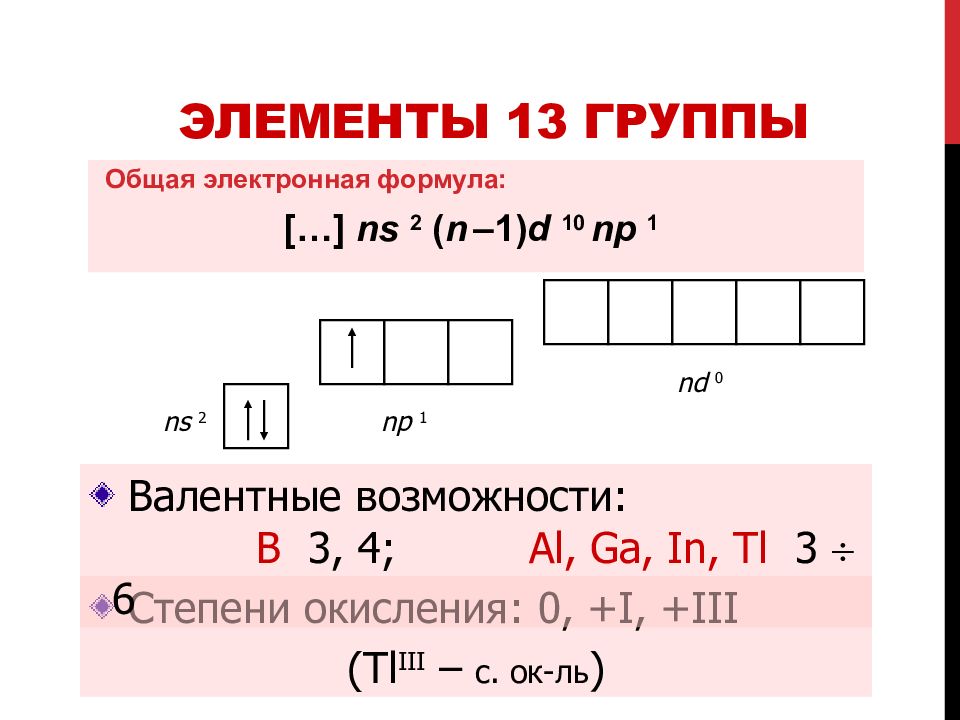
Слайд 8: Элементы 13 группы
Общая электронная формула: […] ns 2 ( n – 1) d 10 np 1 Степени окисления: 0, +I, +III (Tl III – с. ок-ль ) ns 2 np 1 nd 0 Валентные возможности: B 3, 4; Al, Ga, In, Tl 3 6
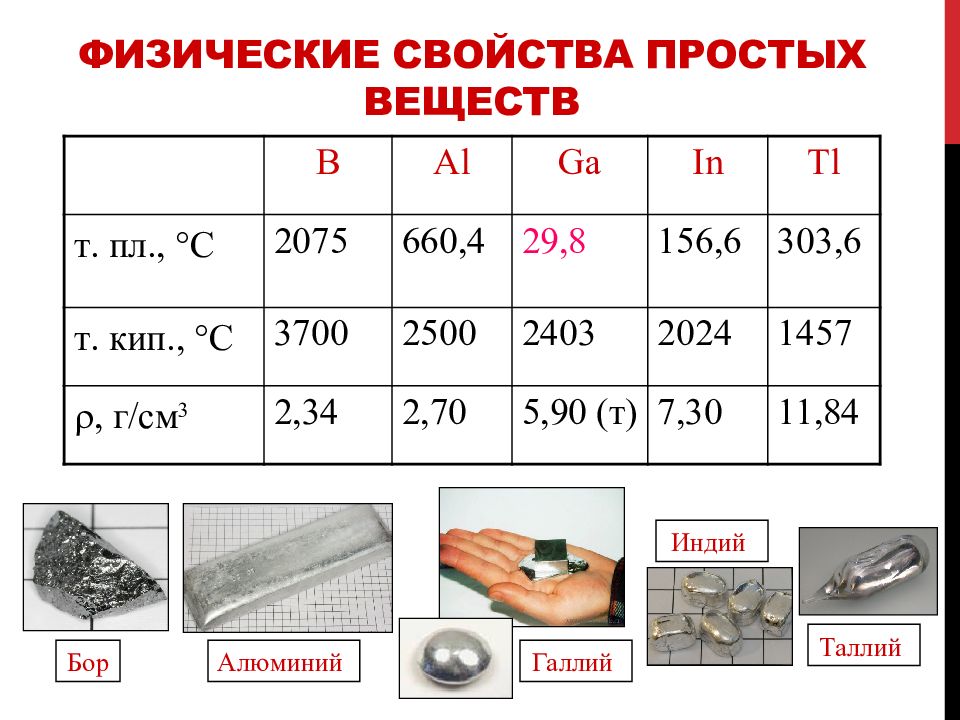
Слайд 9: Физические свойства простых веществ
B Al Ga In Tl т. пл., С 2075 660, 4 29, 8 156, 6 303,6 т. кип., С 3700 2500 2403 2024 1457 , г/см 3 2,34 2,70 5,90 (т) 7,30 11,84 Бор Алюминий Таллий Индий Галлий
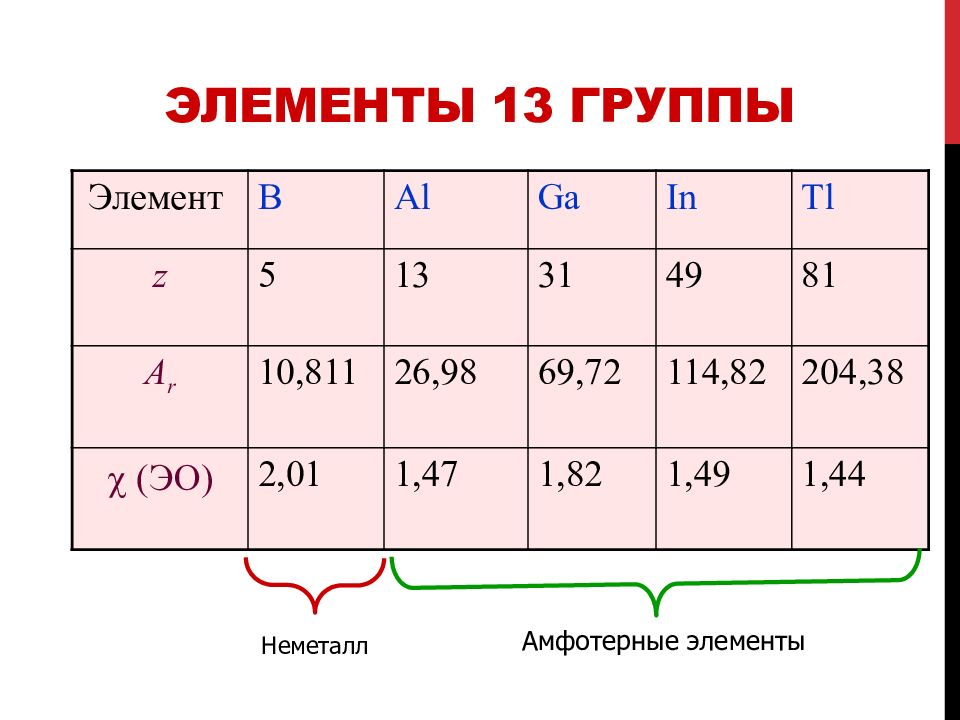
Слайд 10: Элементы 13 группы
Элемент B Al Ga In Tl z 5 13 31 49 81 A r 10,811 26,98 69,72 114,82 204,38 (ЭО) 2,01 1,47 1,82 1,49 1,44 Неметалл Амфотерные элементы
Слайд 11: Распространение в природе. Минералы
3. Al 7,57 % масс. 37. B 2·10 –3 %. масс. 38. Ga 65. Tl 68. In Al : б оксит AlO ( OH ) каолин Al 4 ( Si 4 O 10 )( OH ) 8 корунд Al 2 O 3 ( рубин и сапфир ) криолит Na 3 [ AlF 6 ] алунит ( K, Na ) Al 3 ( SO 4 ) 2 ( OH ) 6 полевые шпаты – ортоклаз K ( AlSi 3 O 8 ) нефелин K, Na ( AlSiO 4 ) Редкие рассеянные элементы Алунит Боксит Каолин Нефелин Криолит
Слайд 12
B: бура Na 2 B 4 O 7. 10 H 2 O кернит Na 2 B 4 O 7. 4 H 2 O борацит Mg 3 ( B 7 O 13 ) Cl сассолин B ( OH ) 3 Сапфиры и рубины Корунд Бура (тинкал) Кернит Сассолин
Слайд 14
Открыт в 1808 г. Два известных французских ученых Жозеф Гей-Люссак и Луи Тенар «отняли» воду у борной кислоты и на полученный оксид подействовали металлическим калием. Гей-Люссак и Тенар объявили об открытии нового элемента. Спустя несколько месяцев бор открыли вторично. Великий английский химик Хэмфри Дэви получил его при электролизе расплавленного борного ангидрида. Своим названием элемент обязан латинскому слову borax, что значит бура.
Слайд 16
Свойства бора 1. Единственный неметалл в 13 группе 2. Очень высокие т.пл. ( 2573 о С ) и т.кип. ( 3660 о С ) 3. d = 2.35 г/см 3 - черный, кристаллический бор d = 1.73 г/см 3 - коричневый, аморфный бор 4. Кристаллический бор очень твердый ( 9.5 по шкале Мооса ) 5. Кристаллический бор - полупроводник, Еg = 1.55 эВ 6. Бор имеет 2 стабильных изотопа 10В, 11В 10 5 В + 1 10 n = 4 2 He + 7 3 Li замедление нейтронов 7. Бор - восстановитель, Е 0 (Н 3 ВО 3 /В) = -0.87 В
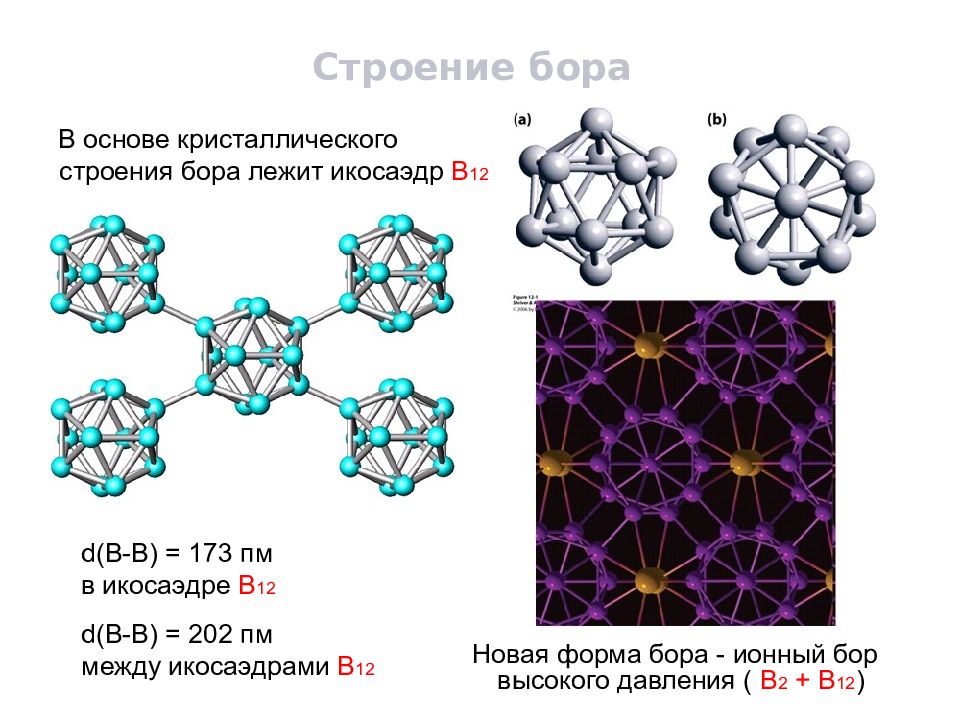
Слайд 17
Строение бора В основе кристаллического строения бора лежит икосаэдр В 12 d(B-B) = 173 пм в икосаэдре В 12 d(B-B) = 202 пм между икосаэдрами В 12 Новая форма бора - ионный бор высокого давления ( В 2 + В 12 )
Слайд 18
ПОЛУЧЕНИЕ Наиболее чистый бор получают пиролизом: B 2 H 6 = 2B + 3 H 2 Термическое разложение паров бромида бора на раскаленной (1000—1200°С) танталовой проволоке в присутствии водорода: 2BBr 3 + 3H 2 = 2B + 6HBr Метод металлотермии (чаще восстановление магнием или натрием): B 2 O 3 + 3Mg = 3MgO + 2B ΔG= −525 кДж KBF 4 + 3Na = 3NaF + KF + B ΔG= −377 кДж
Слайд 20
1808 году Хэмфри Дэви получил сплав алюминия с железом. Он писал: «Если бы мне посчастливилось получить металлическое вещество, которое я ищу, я бы предложил для него название — алюминий». Впервые алюминий был получен датчанином Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от латинского aluminis — квасцы.
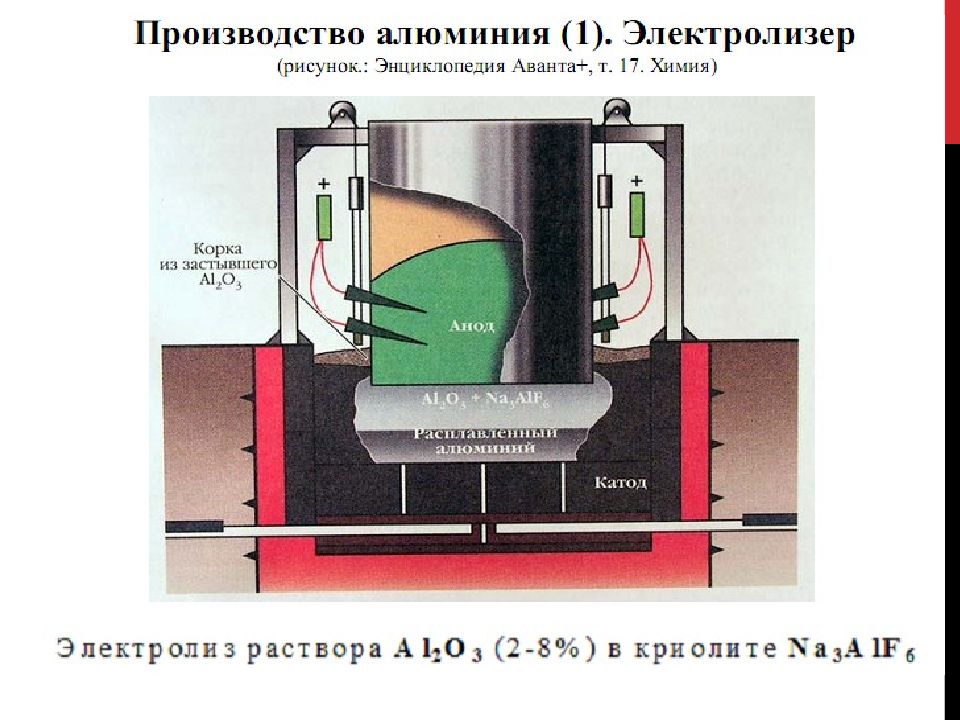
Слайд 23
Температуру ванны поддерживают в пределах 950—970°С за счет тепла, выделяющегося при прохождении постоянного тока через электролит.
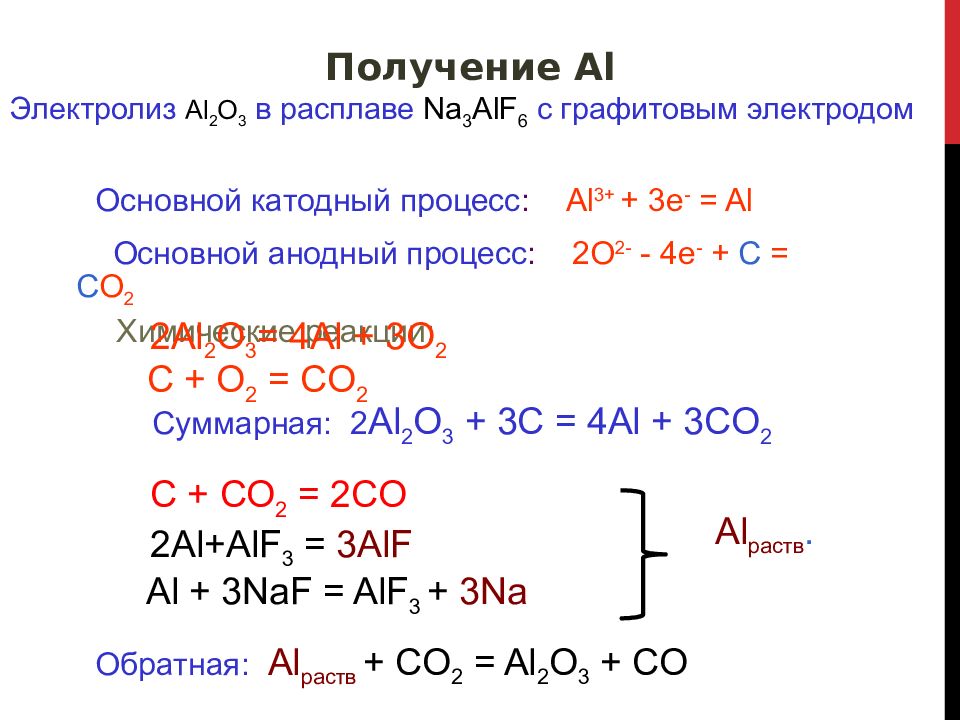
Слайд 24
Получение Al Электролиз Al 2 O 3 в расплаве Na 3 AlF 6 с графитовым электродом Основной катодный процесс : Al 3+ + 3e - = Al Основной анодный процесс : 2O 2- - 4e - + C = C O 2 Химические реакции : 2 Al 2 O 3 = 4 Al + 3 O 2 C + O 2 = CO 2 Суммарная: 2 Al 2 O 3 + 3 C = 4 Al + 3 CO 2 C + CO 2 = 2CO 2Al+AlF 3 = 3AlF Al раств. Al + 3NaF = AlF 3 + 3Na Обратная: Al раств + CO 2 = Al 2 O 3 + CO
Слайд 25
Производительность современных электролизных ванн составляет 500—1200 кг алюминия в сутки. Для получения 1 т алюминия расходуется: 1,95 т глинозема, 25 кг криолита, 25 кг фтористого алюминия, 0,5—0,6 т анодной массы, 14—16 МВт • ч электроэнергии.
Слайд 26: Галлий, индий, таллий
В 1875 году Лекок де Буабодран исследовал спектр цинковой обманки. В этом спектре и была обнаружена новая фиолетовая линия. После длительных опытов удалось получить новый элемент, но в очень небольшом количестве, что не позволило изучить его физические и химические свойства. Он назвал элемент в честь своей родины Франции, по её латинскому названию — Галлия ( Gallia ). Символ Франции — петух (по-французски — le coq ), так что в названии элемента его первооткрыватель неявно увековечил и свою фамилию. Кроме того на латыни «петух» — gallus.
Слайд 28
Индий был обнаружен Фердинандом Рейхом и Теодором Рихтером в 1863 году при спектроскопическом исследовании цинковой обманки. Спектроскопическая линия индия — цвета индиго. Отсюда и происхождение названия. Таллий был открыт спектральным методом в 1861 году английским ученым Уильямом Круксом. Название элемент получил по характерным зеленым линиям своего спектра и зеленой окраске пламени. От греч. θα λλος — молодая, зелёная ветвь.
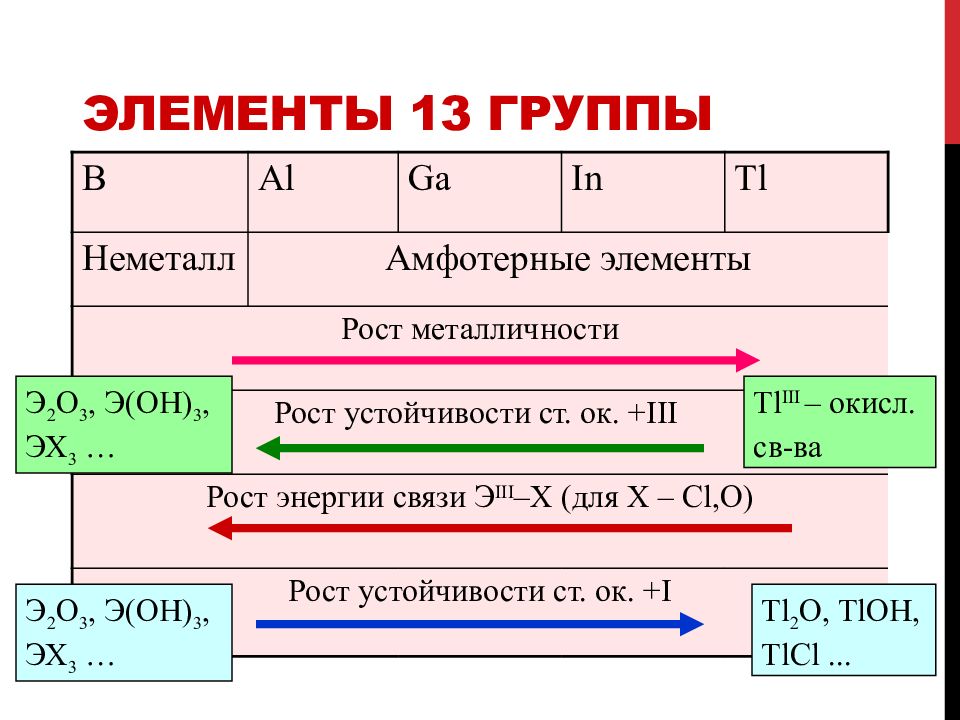
Слайд 29: Элементы 13 группы
B Al Ga In Tl Неметалл Амфотерные элементы Рост м еталличност и Рост у стойчивост и ст. ок. + III Рост э нерги и связи Э III – X (для X – Cl,O) Рост у стойчивост и ст. ок. + I Tl 2 O, TlOH, TlCl... Tl III – окисл. св - ва Э 2 O 3, Э( OH ) 3, ЭХ 3 … Э 2 O 3, Э( OH ) 3, ЭХ 3 …
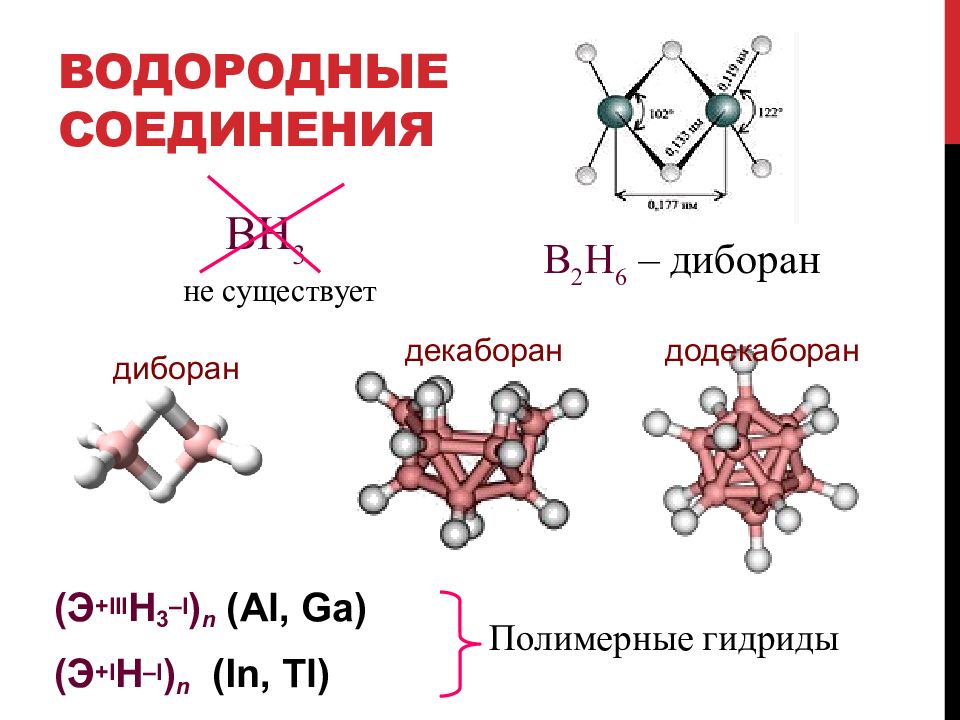
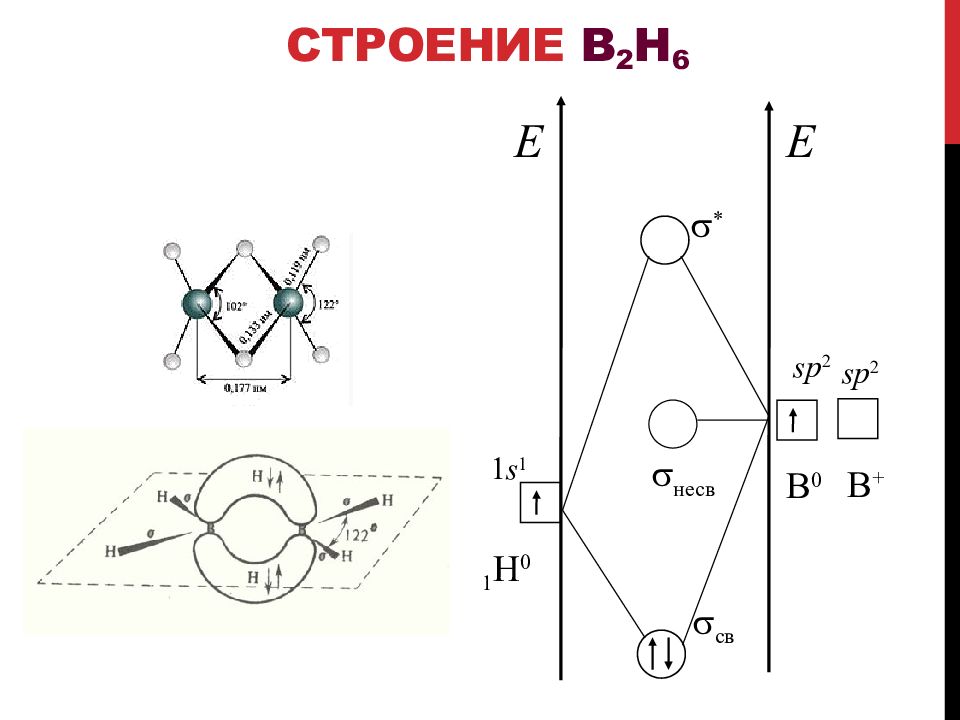
Слайд 30: Водородные соединения
(Э +III Н 3 – I ) n ( Al, Ga ) (Э +I Н – I ) n (In, Tl) BH 3 не существует B 2 H 6 – диборан Полимерные гидриды диборан декаборан додекаборан
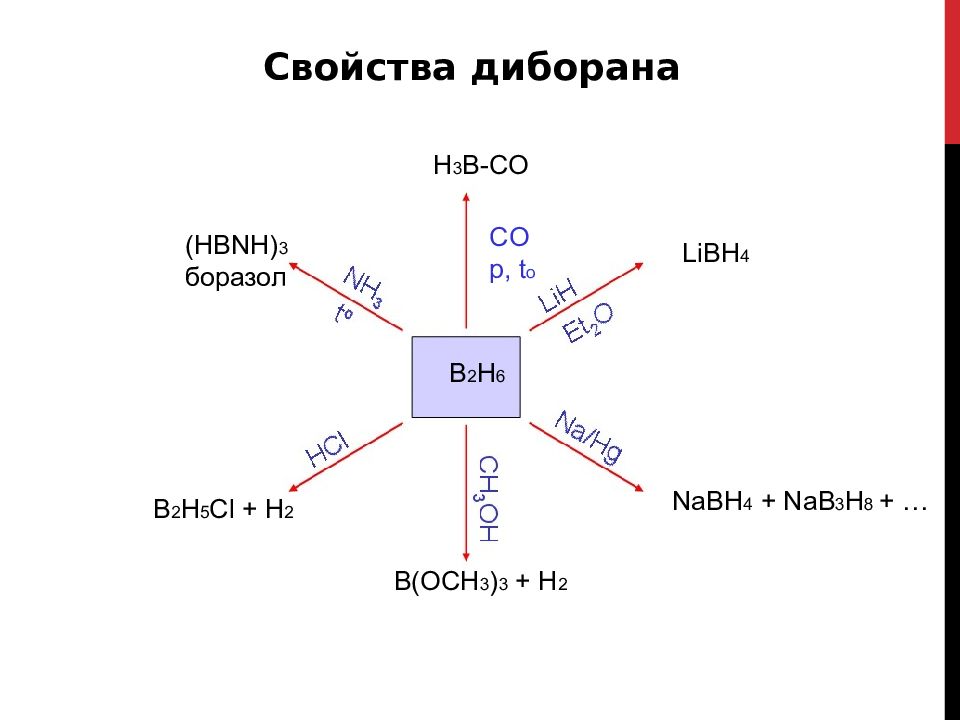
Слайд 31
Свойства диборана H 3 B-CO (HBNH) 3 боразол B 2 H 5 Cl + H 2 CO p, t o B 2 H 6 B(OCH 3 ) 3 + H 2 LiBH 4 NaBH 4 + NaB 3 H 8 + …
Слайд 33: Гидридные комплексы
Na [ BH 4 ] – тетрагидридоборат натрия Li[AlH 4 ] – тетрагидридоалюминат лития Восстановительные свойства [AlH 4 ] + 4H 2 O = [Al(OH) 4 ] + 4H 2 Li[AlH 4 ] + RCHO = RCH 2 OH + LiOH + Al(OH) 3 ЭН 3 + H – = [ Э H 4 ] B Al Ga In Tl Рост устойчивости комплексов
Слайд 34: Химические свойства простых веществ
B + 3HNO 3 = B(OH) 3 + 3NO 2 4 B + 4NaOH ( т ) + 3O 2 = 4NaBO 2 + 2H 2 O (сплавление) 2 Ga + 6H 3 O + + 6H 2 O = 2[Ga(H 2 O) 6 ] 3+ + 3H 2 2 Ga + 2OH + 6H 2 O = 2[Ga(OH) 4 ] + 3H 2
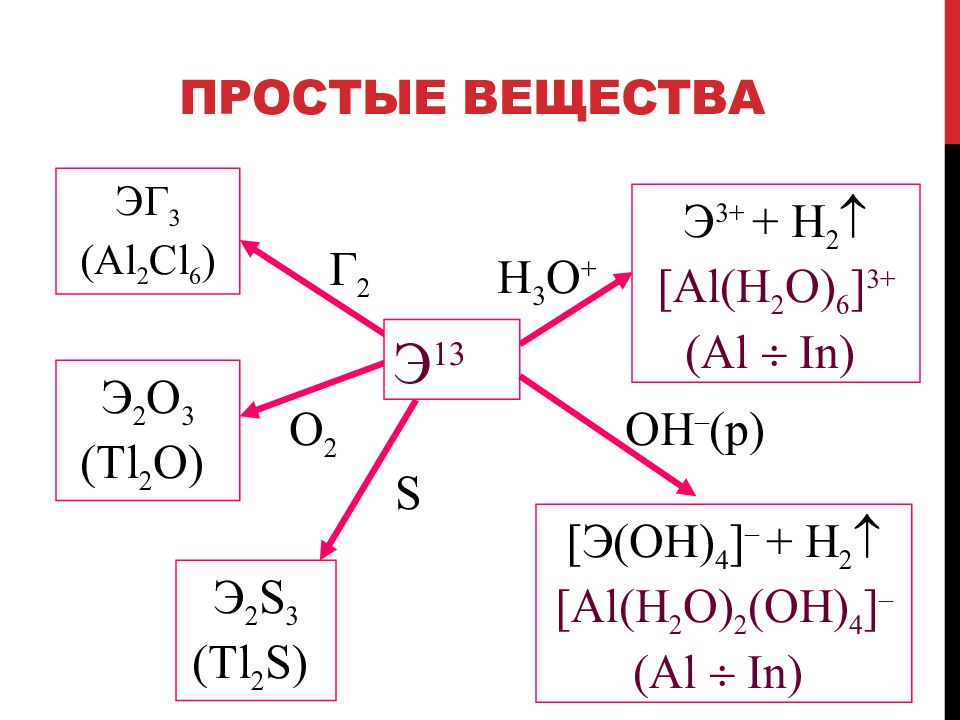
Слайд 35: Простые вещества
Г 2 ЭГ 3 ( Al 2 Cl 6 ) O 2 Э 2 О 3 ( Tl 2 O) Э 2 S 3 ( Tl 2 S) H 3 O + S Э 3+ + H 2 [Al ( H 2 O) 6 ] 3+ (Al In ) [ Э( OH ) 4 ] – + H 2 [Al ( H 2 O) 2 ( OH ) 4 ] – (Al In ) Э 13 OH – ( р )
Слайд 36: Кислородные соединения
Э 2 O 3 (т) + 2NaOH (т) = 2Na Э O 2 (т) + H 2 O (г) (Э = B Tl, сплавление) Э 2 O 3 (т) + 6 H 3 O + (р) = 2 Э 3+ (р) + 9 H 2 O (Э = Al Tl ) Э 2 О 3 B Al Ga In Tl амфотерные кислотный кислотность увеличивается Tl 2 O – основный оксид, TlOH – сильное основание Оксид алюминия
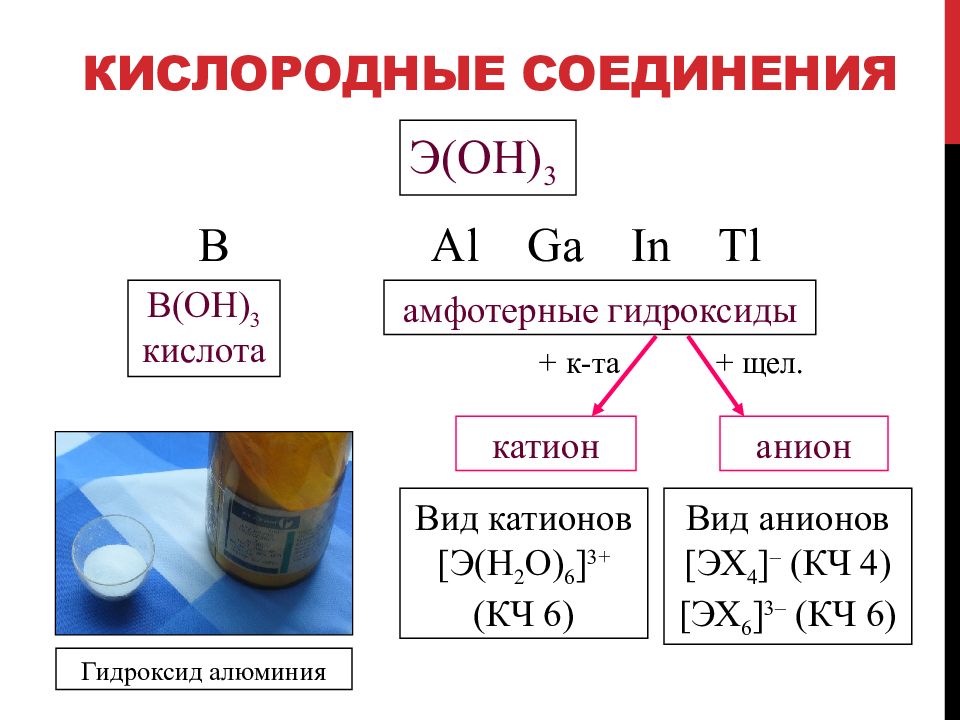
Слайд 37: Кислородные соединения
Э( OH ) 3 B Al Ga In Tl B(OH) 3 кислота амфотерные гидроксиды + к-та + щел. катион анион Вид катионов [ Э (H 2 O) 6 ] 3+ (КЧ 6) Вид анионов [ ЭХ 4 ] – (КЧ 4) [ ЭХ 6 ] 3 – (КЧ 6) Гидроксид алюминия
Слайд 38: Кислородные соединения бора
B 2 O 3 – кислотный оксид B 2 O 3 + 3H 2 O = 2B(OH) 3 Гидроксид бора B ( OH ) 3 (борная кислота) Растворение и гидратация: B(OH) 3 (т) + H 2 O = [B(H 2 O)(OH) 3 ] (р) Протолиз [B(H 2 O)(OH) 3 ] + H 2 O [B(OH) 4 ] + H 3 O +
Слайд 39: Строение B(OH) 3 и [B(H 2 O)(OH) 3 ]
t° t° t° B(OH) 3 (HBO 2 ) 3 (HBO 2 ) n B 2 O 3 –H 2 O –H 2 O –H 2 O B OH HO OH sp 2 - гибр. sp 3 - гибр. OH HO B OH : OH 2
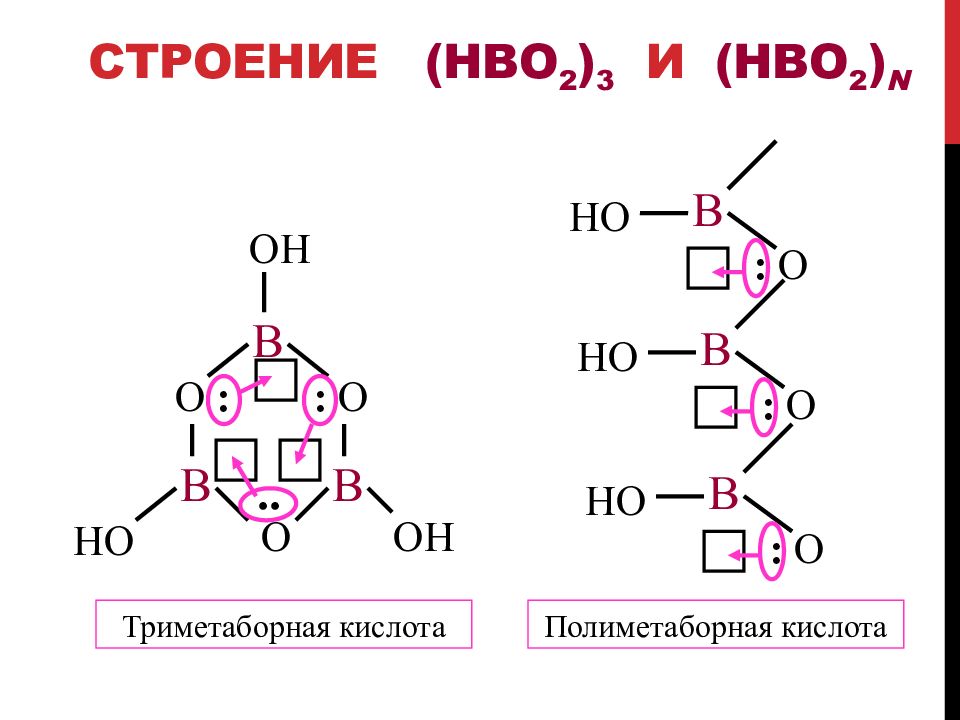
Слайд 40: Строение ( HBO 2 ) 3 и (HBO 2 ) n
B OH O : : O B OH B HO O .. B HO : O B HO : O B HO : O Триметаборная кислота Полиметаборная кислота
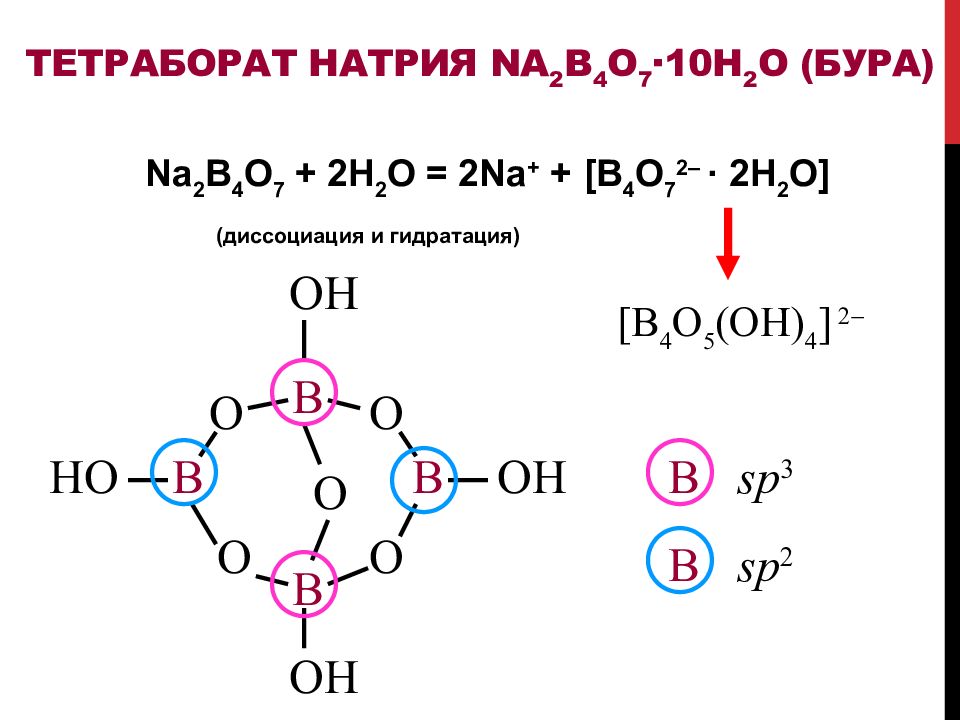
Слайд 41: Тетраборат натрия Na 2 B 4 O 7 · 10H 2 O ( бура )
Na 2 B 4 O 7 + 2H 2 O = 2 Na + + [ B 4 O 7 2– · 2H 2 O] (диссоциация и гидратация) [ B 4 O 5 ( OH ) 4 ] 2 B B B B O O O O O OH OH OH HO B sp 2 B sp 3
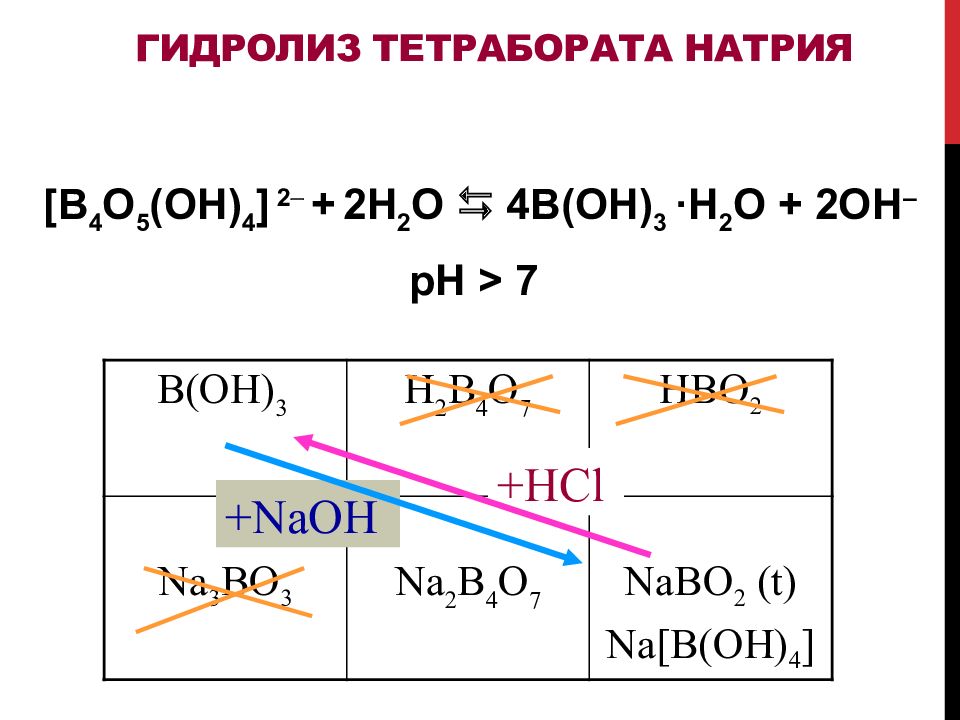
Слайд 42: Гидролиз тетрабората натрия
[ B 4 O 5 ( OH ) 4 ] 2 + 2H 2 O 4 B(OH) 3 ·H 2 O + 2OH – pH > 7 B(OH) 3 H 2 B 4 O 7 HBO 2 Na 3 BO 3 Na 2 B 4 O 7 NaBO 2 (t) Na[B(OH) 4 ] +HCl +NaOH
Слайд 43: Получение B ( OH ) 3
BCl 3 + 3H 2 O = B(OH) 3 + 3HCl (лаб.) Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O = = 4 B ( OH ) 3 + Na 2 SO 4 (лаб., пром.)
Слайд 44: Обнаружение соединений бора
Na 2 B 4 O 7 + 12C 2 H 5 OH + 2H 2 SO 4 = = 4B(OC 2 H 5 ) 3 + 7H 2 O + 2NaHSO 4 2B(OC 2 H 5 ) 3 + 18 O 2 = B 2 O 3 + 15H 2 O + 12CO 2 Получение и горение борноэтилового эфира.
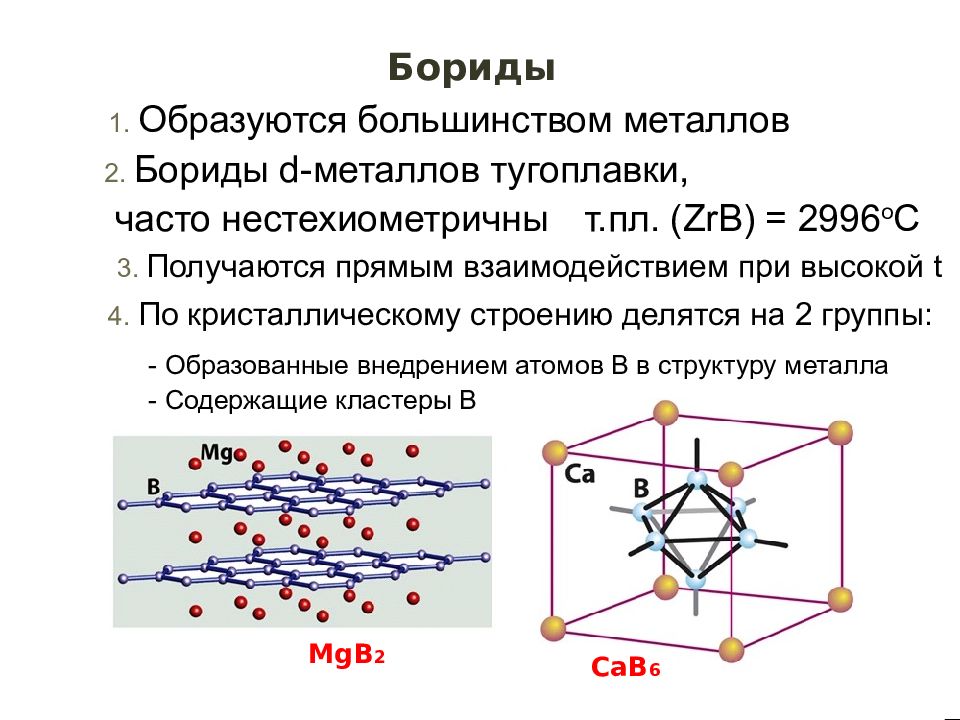
Слайд 45
Бориды 1. Образуются большинством металлов 2. Бориды d- металлов тугоплавки, часто нестехиометричны т.пл. ( ZrB ) = 2996 о С 3. Получаются прямым взаимодействием при высокой t 4. По кристаллическому строению делятся на 2 группы : - Образованные внедрением атомов B в структуру металла - Содержащие кластеры В MgB 2 CaB 6
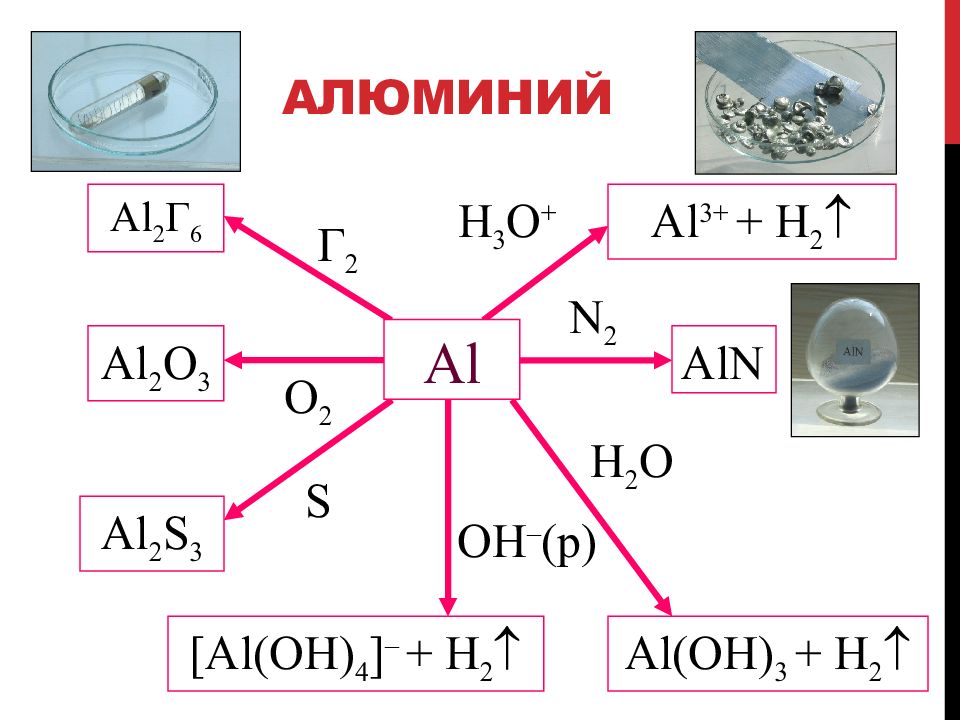
Слайд 46: Алюминий
Г 2 Al 2 Г 6 O 2 Al 2 О 3 Al 2 S 3 H 3 O + S Al 3+ + H 2 [Al ( OH ) 4 ] – + H 2 OH – ( р ) N 2 AlN H 2 O Al ( OH ) 3 + H 2 Al
Слайд 47: Окисление амальгамированного алюминия
Алюминиевая ложка, погруженная в раствор Hg ( NO 3 ) 2, покрывается амальгамой – сплавом Al и Hg. Алюминий теряет защитную оксидную плёнку и окисляется, превращаясь в белые хлопья Al(OH) 3. Термитная сварка Самолеты Изделия из алюминия в быту
Слайд 48
2Al + 6H 3 O + + 6H 2 O = 2[Al(H 2 O) 6 ] 3+ + 3H 2 2Al + 2OH + 6H 2 O = 2[Al(OH) 4 ] + 3H 2 2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 В щелочной среде восст. св-ва сильнее: 8 Al + 30 HNO 3 (оч. разб.) = = 8Al(NO 3 ) 3 + 3NH 4 NO 3 + 9H 2 O 8Al + 18H 2 O + 5KOH + 3KNO 3 = = 8K[Al(OH) 4 ] + 3NH 3
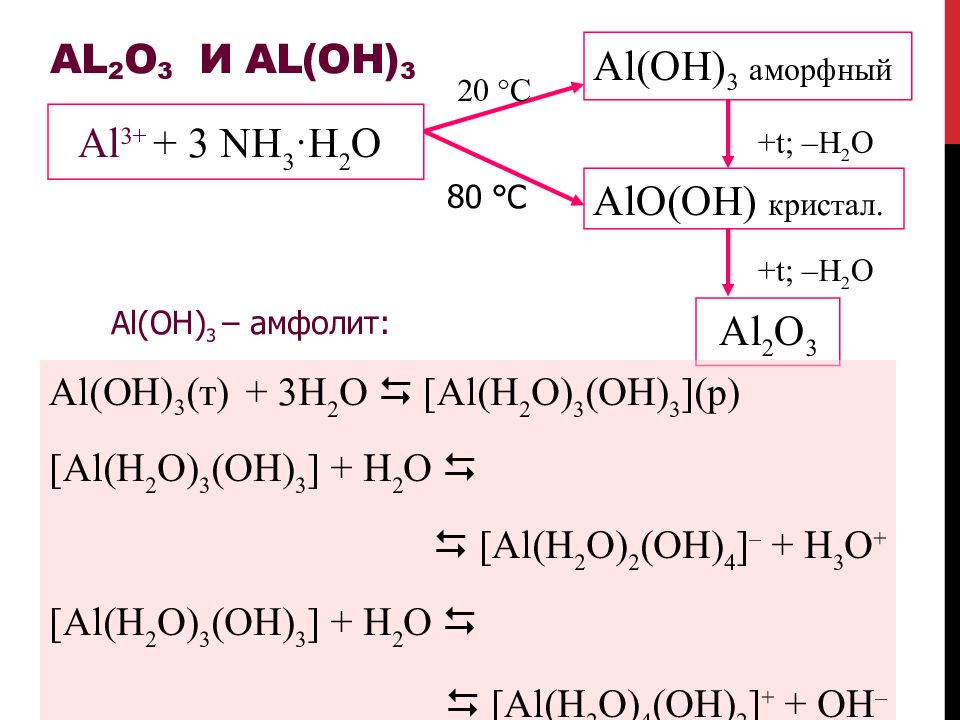
Слайд 49: Al 2 O 3 и Al(OH) 3
+ t; – H 2 O + t; – H 2 O Al 3+ + 3 NH 3 ·H 2 O Al 2 O 3 Al(OH) 3 – амфолит: Al(OH) 3 (т) + 3H 2 O [Al(H 2 O) 3 (OH) 3 ] (р) [Al(H 2 O) 3 (OH) 3 ] + H 2 O [Al(H 2 O) 2 (OH) 4 ] – + H 3 O + [Al(H 2 O) 3 (OH) 3 ] + H 2 O [Al(H 2 O) 4 (OH) 2 ] + + OH – 20 °C 80 °C Al(OH) 3 аморфный AlO(OH) кристал.
Слайд 50: Формы существования Al III в растворах
рН < 4 (изб. к - ты) : [Al(H 2 O) 6 ] 3+ sp 3 d 2 ( октаэдр ) рН > 4 (гидролиз) : [Al(H 2 O) 6 ] 3+ + H 2 O [Al(H 2 O) 5 OH ] 2+ + H 3 O + рН > 7: [Al(H 2 O) 2 (OH) 4 ] sp 3 d 2 ( искаж. октаэдр ) рН > 7 (изб. щелочи) : [Al(OH) 4 ] sp 3 ( тетраэдр )
Слайд 55
ХИМИЧЕСКИЕ СВОЙСТВА Ga, In, Tl Характерная степень окисления Ga и In +3, для Tl +1. От галлия к таллию увеличивается активность. С углеродом и азотом эти элементы не взаимодействуют. Галлий растворяется в смеси азотной и плавиковой кислот, легко растворяется в щелочах и даже в аммиаке: 2Ga + 2NaOH + 6H 2 O = 2Na[ Ga (OH) 4 ] + 3H 2 2Ga + 2NH 4 OH + 6H 2 O = 2NH 4 [ Ga (OH) 4 ] + 3H 2 Индий хорошо растворим и в кислотах и щелочах: 2 In + 6 HCl = 2 InCl 3 + 3 H 2
Слайд 56
Таллий в щелочах не растворяется, хорошо растворим в кислотах: Tl + 2HNO 3 = TlNO 3 + NO 2 + H 2 O Оксиды Ga 2 O 3, In 2 O 3, Tl 2 O получают термическим разложением гидроксидов. 2Ga(ОН) 3 = Ga 2 O 3 + 3Н 2 О Оксиды галлия и индия в воде не растворимы, Tl 2 O при взаимодействии с водой образует гидроксид TlOH - сильное основание Tl 2 O + Н 2 О = 2Tl ОН
Слайд 57
В чистом виде галлий применяется для изготовления высококачественных зеркал, в полупроводниковой промышленности. Оксид галлия при добавлении в стекло дает эффект высокого блеска. Индий применяется в полупроводниковой технике и для изготовления сплавов особого назначения. Таллий – в виде соединений в приборах ночного видения.
Слайд 59: Общая электронная формула: […] n s 2 ( n– 1) d 10 np 2
Валентные возможности: С : 2, 4; Si, Ge, Sn, Pb: 2 6 Степени окисления: –IV, 0, +II, +IV Устойчивые ст.ок.: С, Si, Ge, Sn: +IV ( Pb IV – сильн.окисл.). Уст. ст.ок.: Pb: +II ns 2 np 2 nd 0
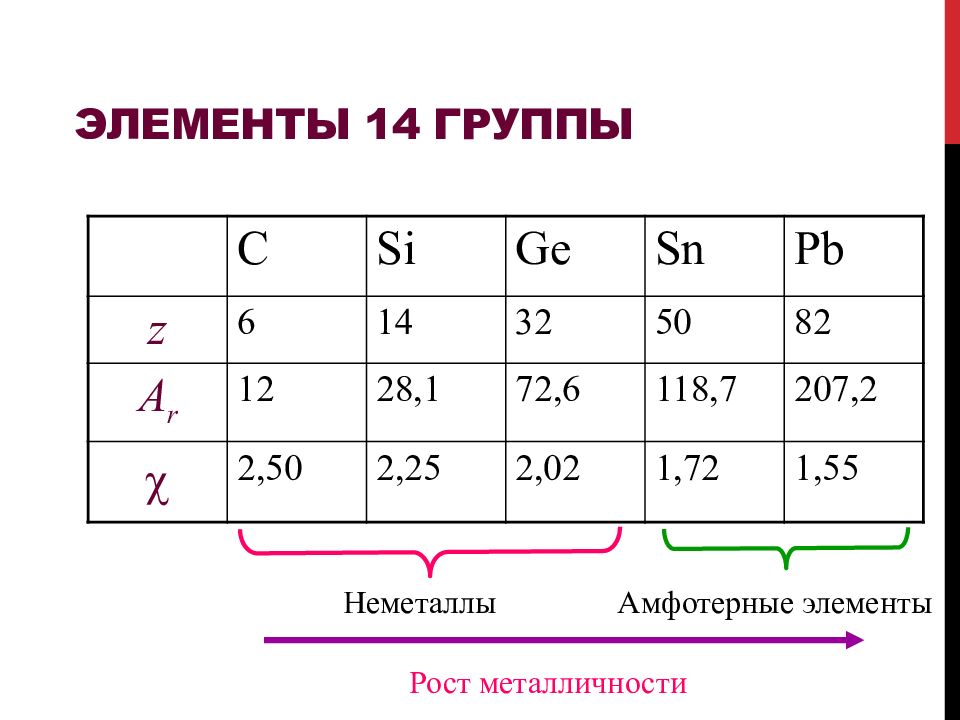
Слайд 60: Элементы 14 группы
C Si Ge Sn Pb z 6 14 32 50 82 A r 12 28, 1 72,6 118,7 207,2 2,50 2,25 2,02 1,72 1,55 Неметаллы Амфотерные элементы Рост металличности
Слайд 61: Распространение в природе и важнейшие минералы
2. Si 25,80% ( 27,72% в литосфере ) 13. C 0,087% ( 0,032% в литосфере ) 31. Sn 0,0035% 35. Pb 0,0018% 46. Ge 6 ·10 –4 % (РРЭ) Кремний : кварц, яшма, агат, опал, силикаты, алюмосиликаты Кварц Аметист Каолинит Агат Опал
Слайд 62: Углерод : графит, алмаз, каменный уголь, нефть, природный газ, орг. в- ва, карбонаты
Алмаз Графит Кальцит Газодобыча Каменный уголь
Слайд 63: Германий, олово и свинец
Касситерит SnO 2 Галенит PbS Германит ( Fe II Cu 6 I Ge 2 ) S 8 Аргиродит ( Ag 8 I Ge IV ) S 6
Слайд 64: КРЕМНИЙ
В 1825 году шведский химик Йенс Якоб Берцелиус действием металлического калия на фтористый кремний SiF 4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Слайд 65
Кремний в природе содержится во многих минералах в виде оксида SiO 2, из которого элементарный кремний можно получить восстановлением магнием или углеродом: SiO 2 + 2Mg = 2MgO + Si В чистом виде кремний тверд, хрупок, имеет алмазоподобную структуру.
Слайд 66: ГЕРМАНИЙ
Элемент был предсказан Д.И.Менделеевым (эка-кремний) и открыт в 1885 году немецким химиком Клеменсом Винклером при анализе минерала - аргиродита Ag 8 GeS 6. Германий выделяют в виде оксида GeO 2,который восстанавливают водородом при 600 о С до простого вещества: GeO 2 + 2H 2 = Ge + 2H 2 O
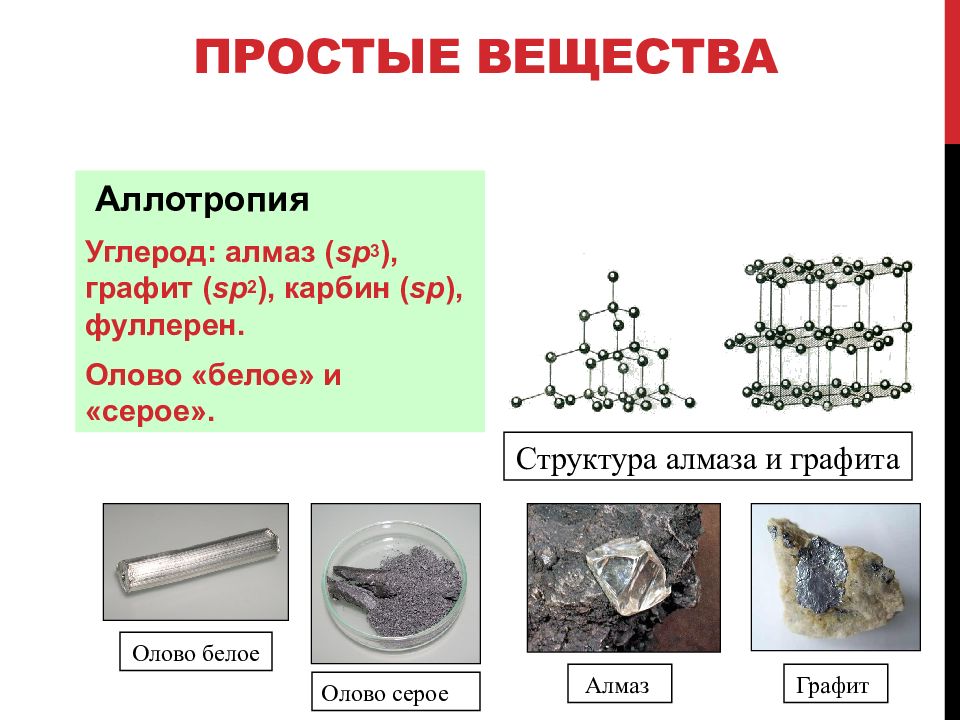
Слайд 67: Простые вещества
Аллотропия Углерод: алмаз ( sp 3 ), графит ( sp 2 ), карбин ( sp ), фуллерен. Олово «белое» и «серое». Структура алмаза и графита Олово белое Олово серое Алмаз Графит
Слайд 68: Графит
Т. пл. 3800 С, т. кип. 4000 С, плотность 2,27 г/см 3, электропроводен, устойчив. Типичный восст - ль (реагирует с водородом, кислородом, фтором, серой, металлами). Кристаллическая решетка слоистая ( sp 2 -гибридизация).
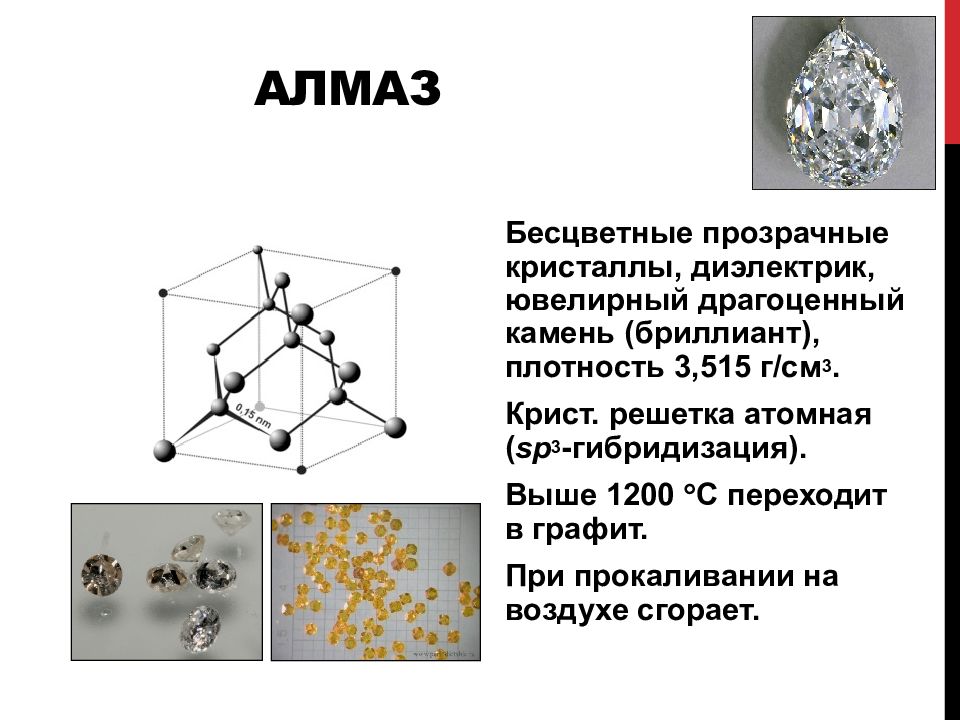
Слайд 69: Алмаз
Б есцв етные прозрачн ые кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см 3. К рист. решетк а атомн ая ( sp 3 -гибридизация). Выше 1200 С переходит в графит. При прокаливании на воздухе сгорает.
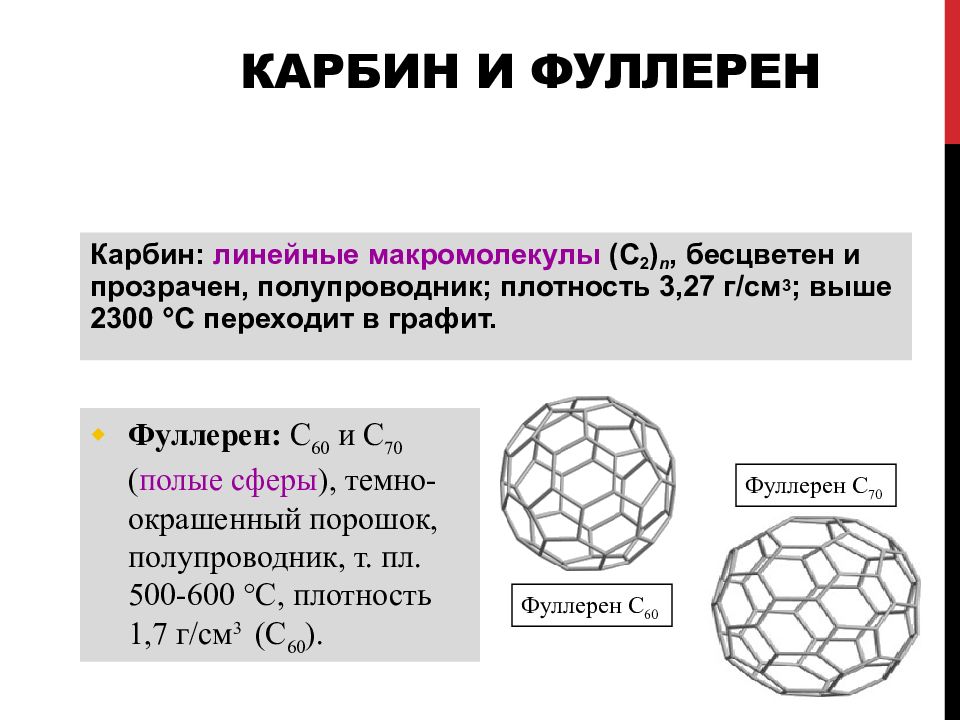
Слайд 70: Карбин и фуллерен
Карбин : линейны е макромолекул ы (С 2 ) n, бесцветен и прозрачен, полупроводник ; п лотность 3,27 г/см 3 ; выше 2300 С переходит в графит. Фуллерен : С 60 и С 70 ( полые сферы ), темно-окрашенный порошок, полупроводник, т. пл. 500-600 C, плотность 1,7 г/см 3 (С 60 ). Фуллерен С 60 Фуллерен С 70
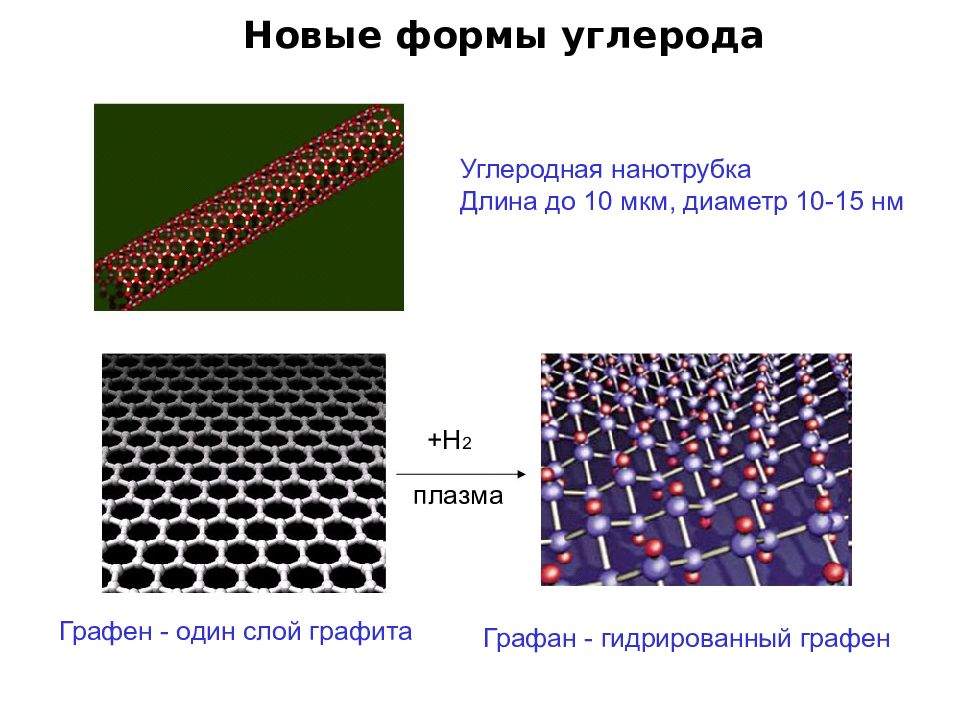
Слайд 71
Новые формы углерода Углеродная нанотрубка Длина до 10 мкм, диаметр 10-15 нм +Н 2 плазма Графен - один слой графита Графан - гидрированный графен
Слайд 72
Новые формы углерода Нобелевская премия по физике 2010 года Андрей Гейм Константин Новоселов « З а новаторские эксперименты с двумерны м материалом - графеном»
Слайд 73: Химические свойства
При комнатной температуре С, Si, Ge + H 2 O С, Si, Ge + H 3 O + Sn, Pb + H 2 O Sn + H 3 O + Sn 2+ + H 2 Pb + H 3 O + Pb 2+ + H 2 Кремний Свинец Олово Германий
Слайд 74: Химические свойства
С(т) + KOH Si + 4NaOH = Na 4 SiO 4 + 2H 2 Si + 8OH – –4 e – = SiO 4 4– + 4H 2 O 2H 2 O + 2 e – = H 2 + 2OH – Ge + 2KOH + 2H 2 O 2 = K 2 [Ge(OH) 6 ] Ge + 6OH – –4 e – = [Ge(OH) 6 ] 2– H 2 O 2 + 2 e – = 2OH – Sn + NaOH + 2H 2 O = Na[Sn(OH) 3 ] + H 2 Sn + 3OH – –2 e – = [Sn(OH) 3 ] – 2H 2 O + 2 e – = H 2 + 2OH –
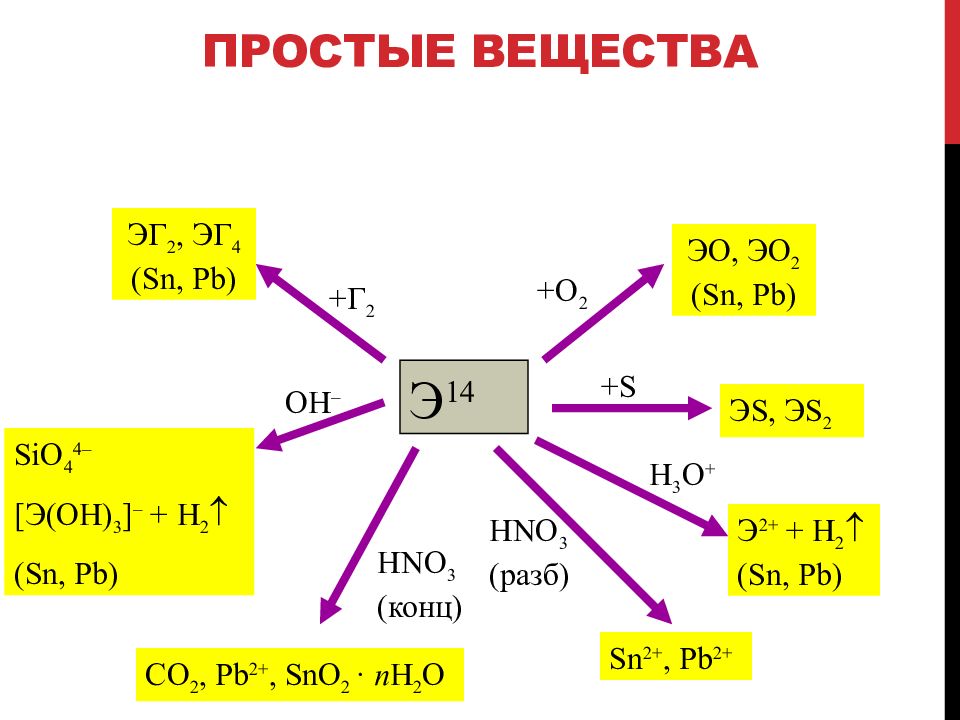
Слайд 75: Простые вещества
Э 14 + Г 2 ЭГ 2, ЭГ 4 ( Sn, Pb) +O 2 Э O, Э O 2 ( Sn, Pb) Э S, Э S 2 +S SiO 4 4 – [ Э (OH) 3 ] – + H 2 ( Sn, Р b) H 3 O + Э 2+ + H 2 ( Sn, Pb) HNO 3 (конц ) CO 2, Pb 2+, SnO 2 · n H 2 O OH – HNO 3 (разб ) Sn 2+, Pb 2+
Слайд 76: Шкала степеней окисления углерода
+IV +II 0 IV CO 2, CO 3 2 , H 2 CO 3, Na 2 CO 3, CS 2, CF 4, CCl 2 O CO, HCN, C 2 F 4 C (графит, алмаз, карбин, фуллерен) С H 4, Be 2 C, Al 4 C 3, SiC
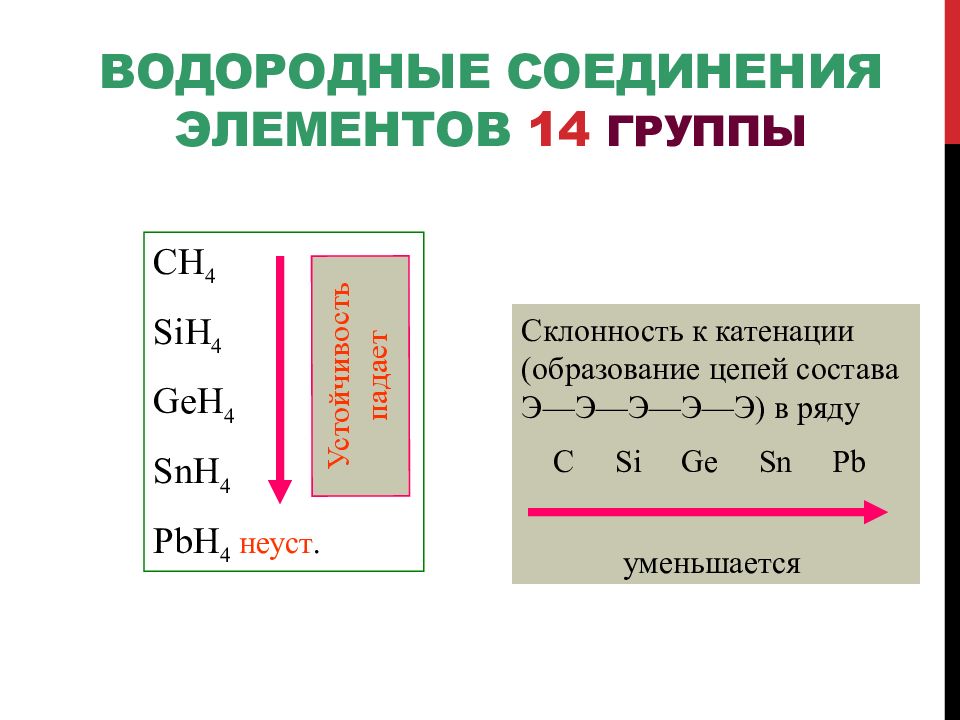
Слайд 77: Водородные соединения элементов 14 группы
С H 4 SiH 4 GeH 4 SnH 4 PbH 4 неуст. Устойчивость падает Склонность к катенации (образование цепей состава Э—Э—Э—Э—Э) в ряду C Si Ge Sn Pb уменьшается
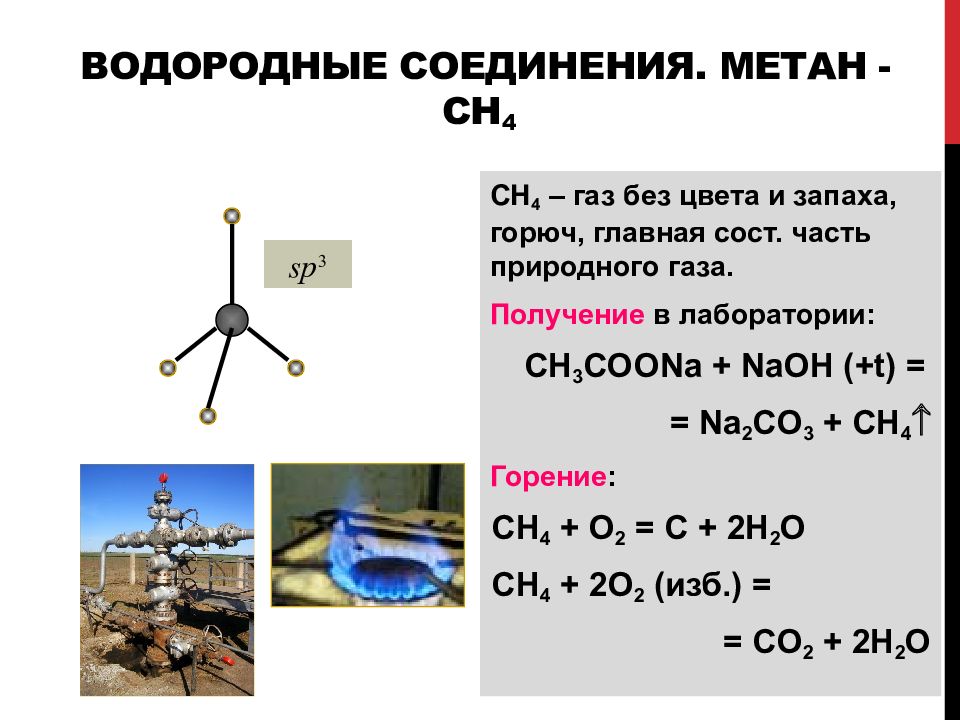
Слайд 78: Водородные соединения. Метан - CH 4
СН 4 – газ без цвета и запаха, горюч, гл авная сост. ч асть прир одного газа. Получение в лаборатории: CH 3 COONa + NaOH (+t) = = Na 2 CO 3 + CH 4 Горение : CH 4 + O 2 = С + 2 H 2 O CH 4 + 2O 2 ( изб.) = = С O 2 + 2 H 2 O sp 3
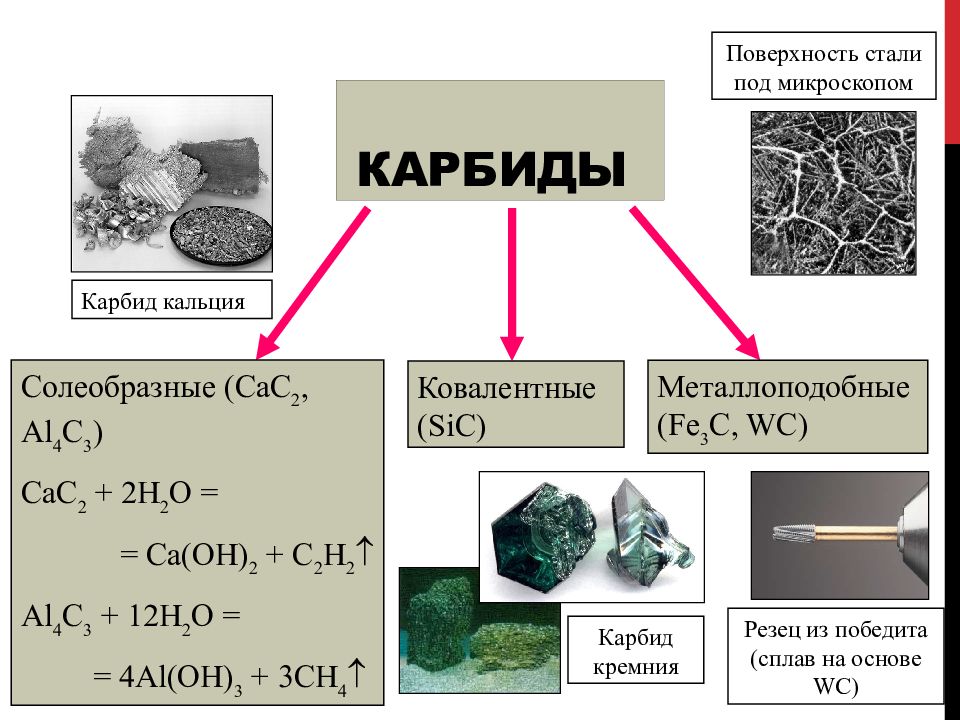
Слайд 79: Карбиды
Солеобразные (CaC 2, Al 4 C 3 ) CaC 2 + 2H 2 O = = Ca(OH) 2 + C 2 H 2 Al 4 C 3 + 12H 2 O = = 4Al(OH) 3 + 3CH 4 Ковалентные (SiC) Металлоподобные (Fe 3 C, WC) Карбид кальция Карбид кремния Поверхность стали под микроскопом Резец из победита (сплав на основе WC )
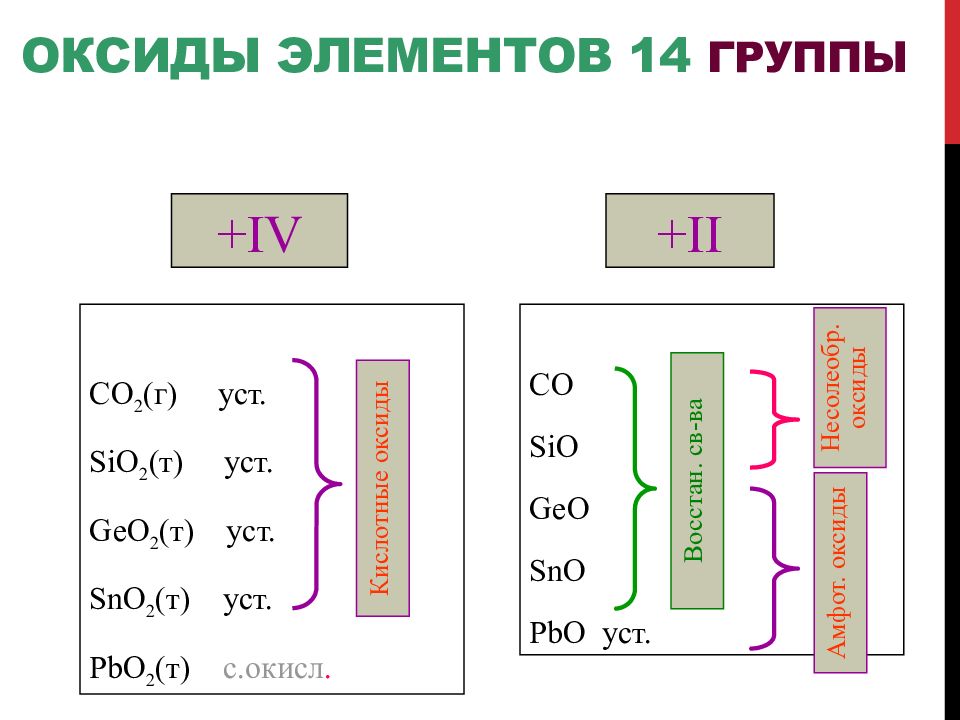
Слайд 80: Оксиды элементов 14 группы
+IV CO 2 ( г ) уст. SiO 2 ( т) уст. GeO 2 ( т ) уст. SnO 2 ( т ) уст. PbO 2 ( т ) с.окисл. Кислотные оксиды +II CO SiO GeO SnO PbO уст. Амфот. оксиды Несолеобр. оксиды Восстан. св-ва
Слайд 81: Монооксид углерода CO – несолеобразующий оксид
Бесцв етный газ, без запаха, легче возд уха, м алор астворим в воде, т.кип. –191,5 С, ядовит («угарный газ»). Восстановительные свойства (t) : 4CO + Fe 3 O 4 = 3Fe + 4CO 2 (пирометаллургия) E E св. св. * * 2 p 2 6 С 0 2 p 4 8 O 0
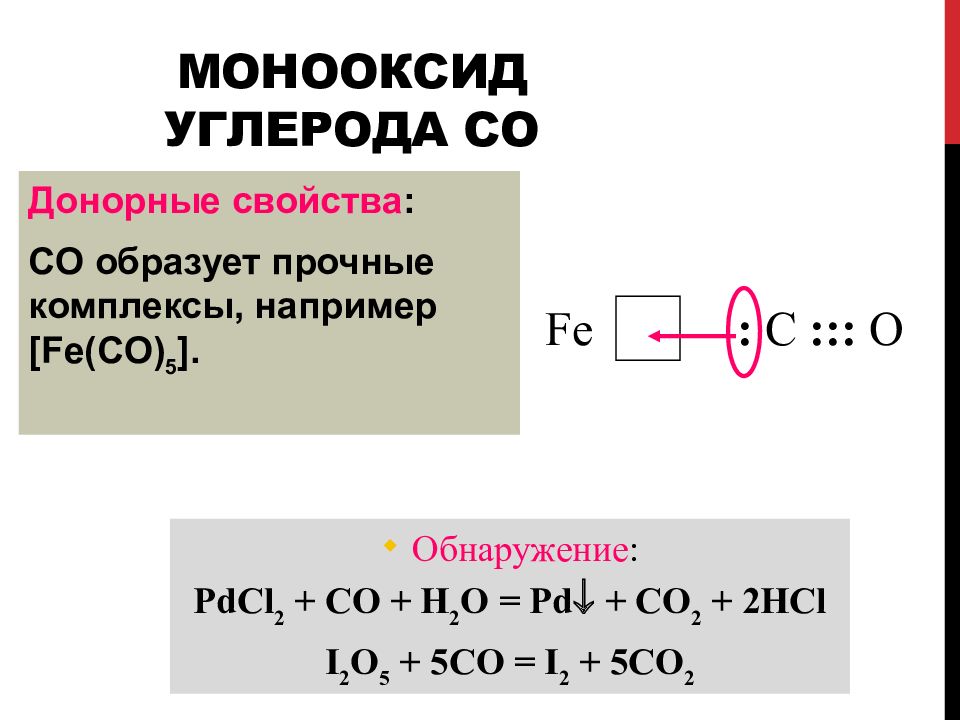
Слайд 82: Монооксид углерода CO
Донорные свойства : CO образует прочные комплексы, например [Fe(CO) 5 ]. Fe : C ::: O Обнаружение : PdCl 2 + CO + H 2 O = Pd + CO 2 + 2HCl I 2 O 5 + 5CO = I 2 + 5CO 2
Слайд 83: Диоксид углерода CO 2 ( кислотный оксид )
Бе с цвет ный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т - ре в 1 л воды – около 1,7 л CO 2 ). В тв. сост. («сухой лёд») – молекулярн ая крист. р еш етка; т. возг онки –78 С, т.пл. –57 С ( р = 5 атм). O O С , , «Сухой лед» sp - гибридизация
Слайд 84: М оногидрат CO 2. H 2 O и угольн ая кислот а H 2 CO 3
В водном растворе : CO 2 ( г ) + H 2 O CO 2. H 2 O H 2 CO 3 H 2 CO 3 – слаб ая двухосновн ая кислот а: H 2 CO 3 + H 2 O HCO 3 – + H 3 O + ; K K = 4,27 · 10 –7 HCO 3 – + H 2 O CO 3 2– + H 3 O + ; K K = 4,68 · 10 –11 Соли – карбонаты и гидрокарбонаты M 2 CO 3 и MHCO 3 подвергаются гидролизу (рН > 7). Термическое разложение гидрокарбонатов: 2 NaHCO 3 = Na 2 CO 3 + CO 2 + H 2 O
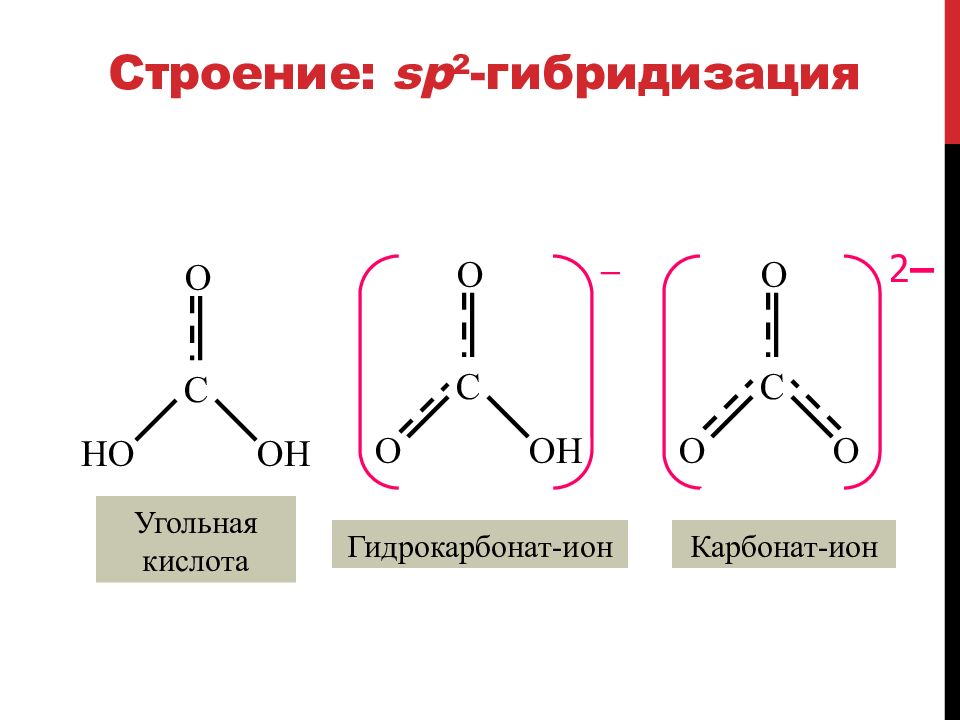
Слайд 85: Строение: sp 2 - гибридизация
C O HO OH Угольная кислота C O O OH – Гидрокарбонат-ион C O O O 2 – Карбонат-ион
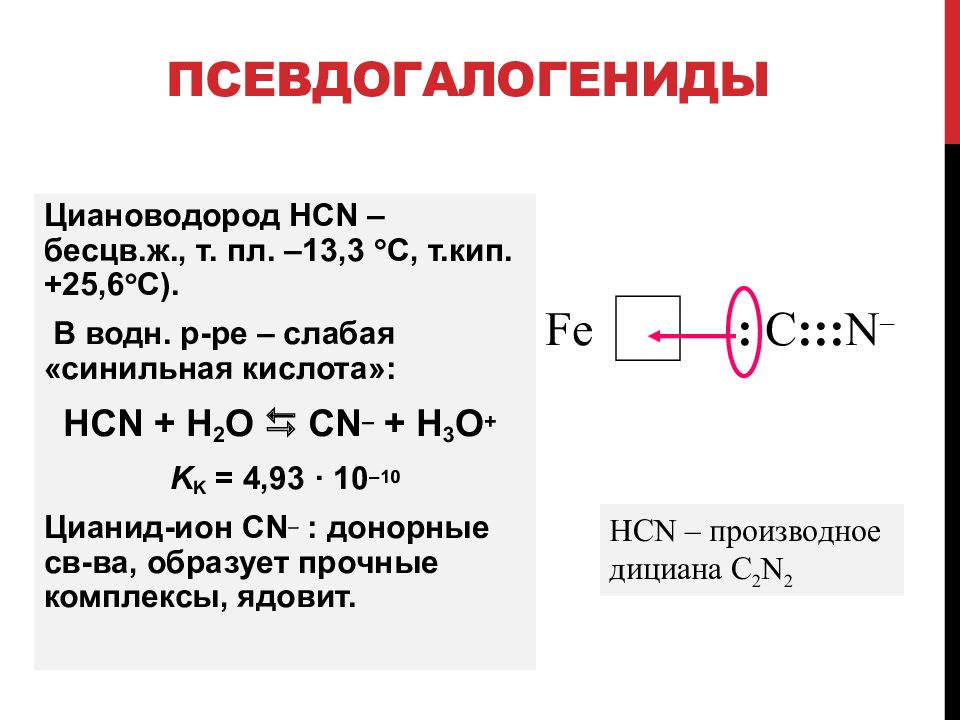
Слайд 87: Псевдогалогениды
Циановодород HCN – бесцв. ж., т. пл. –13,3 С, т.кип. +25,6 С). В водн. р - ре – слаб ая «синильная кислота»: HCN + H 2 O CN – + H 3 O + K K = 4,93 · 10 –10 Цианид-ион CN : донорны е св - ва, образует прочные комплексы, ядовит. Fe : C ::: N – HCN – производное дициана C 2 N 2
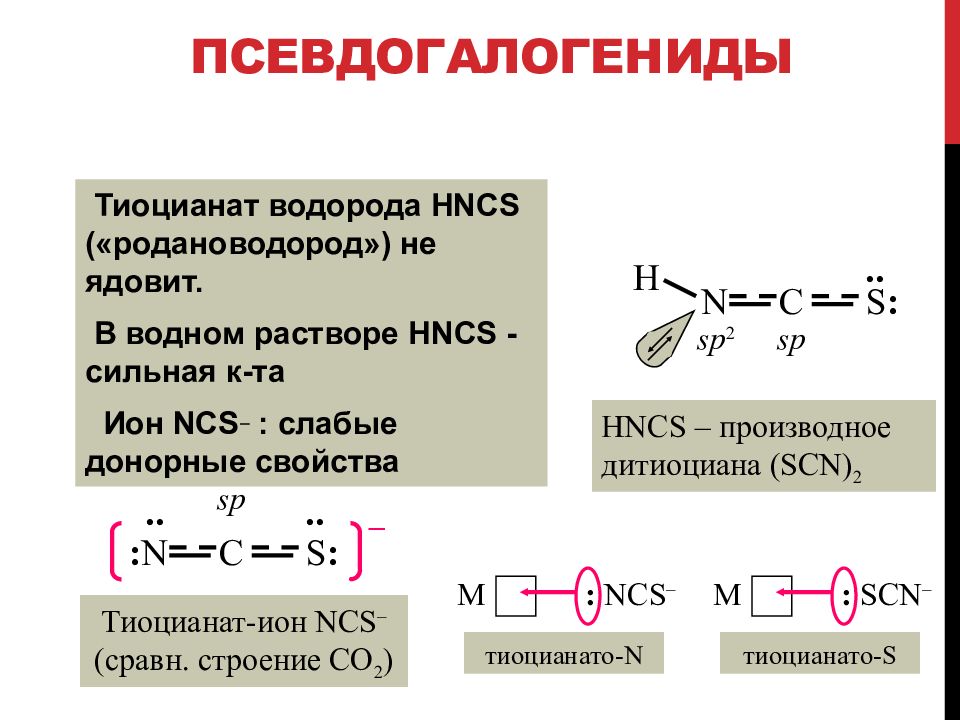
Слайд 89: Псевдогалогениды
Тиоцианат водорода HNCS («родановодород») не ядовит. В водном растворе HNCS - сильн ая к -та Ион NCS : слабые донорные свойства Тиоцианат-ион NCS – (сравн. строение CO 2 ) C : N S : – .. .. sp C N S : .. H sp 2 sp : SCN – M : NCS – M тиоцианато- N тиоцианато- S HNCS – производное дитиоциана (SCN) 2
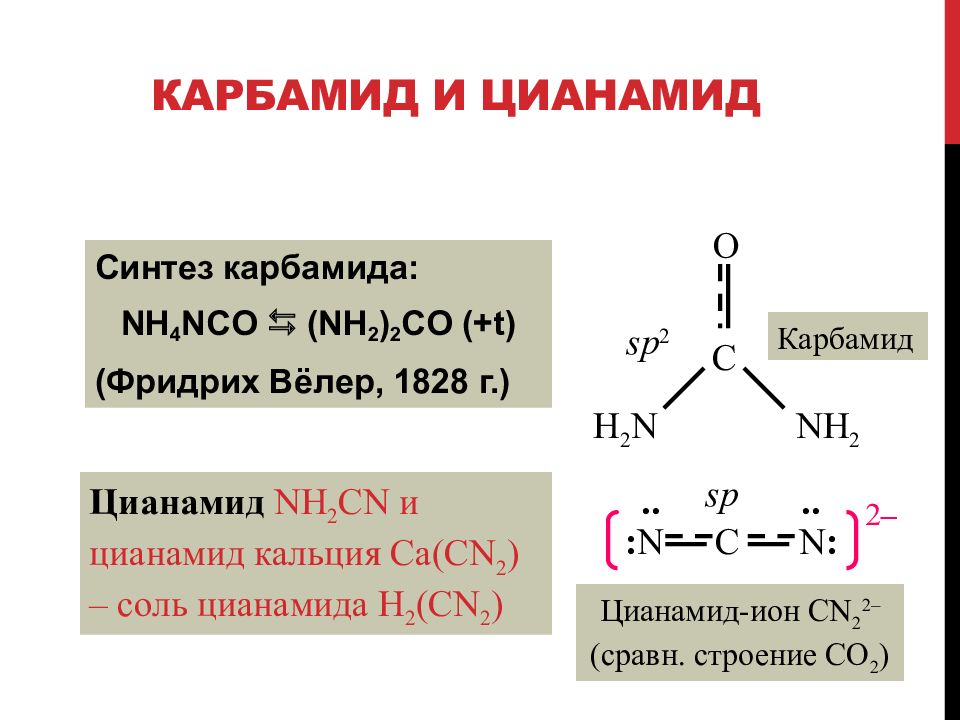
Слайд 91: Карбамид и цианамид
Синтез карбамида : NH 4 NCO (NH 2 ) 2 CO ( +t ) ( Фридрих Вёлер, 1828 г. ) Цианамид NH 2 CN и цианамид кальция Ca(CN 2 ) – соль цианамида H 2 ( CN 2 ) C O H 2 N NH 2 Карбамид sp 2 sp Цианамид-ион CN 2 2 – (сравн. строение CO 2 ) C : N N : 2 – .. ..
Слайд 93: Кремний
Химическое растворение 3Si + 4HNO 3 + 18HF = 3H 2 [SiF 6 ] + 4NO + 8H 2 O Si + 4NaOH = Na 4 SiO 4 + 2H 2 Получение кремния SiO 2 + 2Mg = 2MgO + Si SiCl 4 + 2H 2 = Si + 4HCl (кремний ос.ч.)
Слайд 94: Водородные соединения S i n H 2 n +2 ( силаны )
Моносилан SiH 4 : SiH 4 + 2O 2 = SiO 2 + 2H 2 O Получение силанов : SiO 2 + 4Mg( изб ) = Mg 2 Si + 2Mg O (силицид магния) Mg 2 Si + 4H 2 O = 2Mg(OH) 2 + SiH 4 Mg 2 Si + 4H 3 O + = 2Mg 2+ + 4H 2 O + SiH 4 Получение кремния и силана
Слайд 95: Кислородные соединения
Полиморф изм диоксида кремния: кварц тридимит кристобалит SiO 2(ж) (расплав) 573 С 1470 С 1728 С SiO 2 GeO 2 + H 2 O SiO 2 + 4NaOH( р ) = Na 4 SiO 4 + 2H 2 O ( ортосиликат натрия) GeO 2 + 2NaOH( т ) = Na 2 GeO 3 + H 2 O ( метагерманат натрия) SiO 2 GeO 2 + H 3 O +
Слайд 96: Травление стекла
SiO 2 + 4HF = SiF 4 + 2H 2 O SiO 2 + 6HF ( изб.) = H 2 [SiF 6 ] + 2H 2 O ( гексафторосиликат водорода)
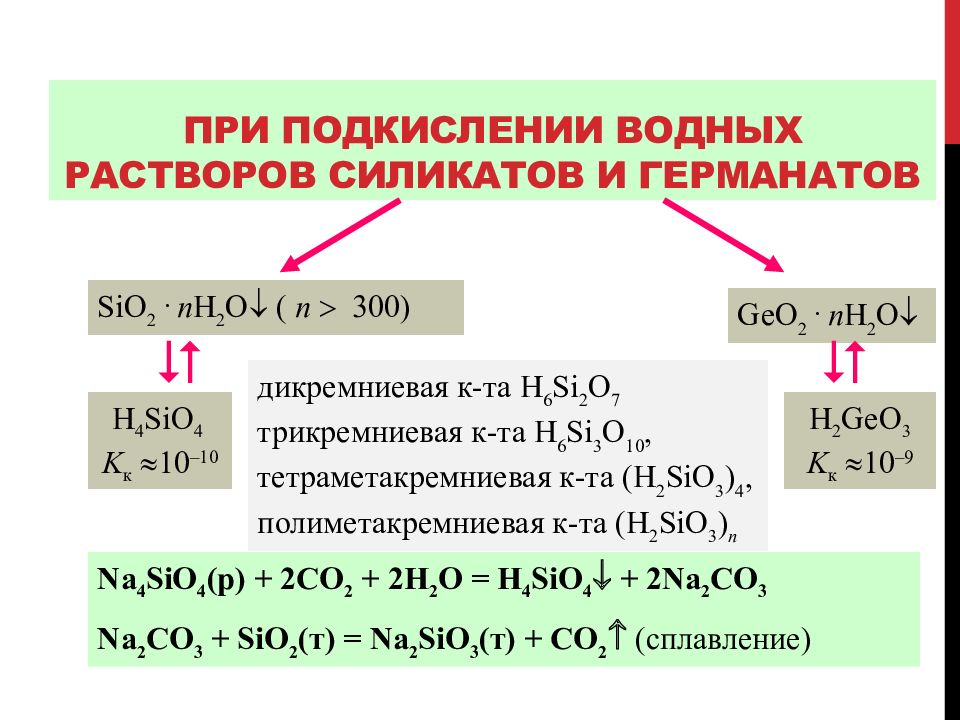
Слайд 97: При подкислении водных растворов силикатов и германатов
SiO 2. n H 2 O ( n 300 ) дикремниевая к-та H 6 Si 2 O 7 трикремниевая к-та H 6 Si 3 O 10, тетраметакремниевая к-та (H 2 SiO 3 ) 4, п олиметакремниевая к-та (H 2 SiO 3 ) n Ge O 2. n H 2 O H 4 SiO 4 K к 10 –10 H 2 GeO 3 K к 10 – 9 Na 4 SiO 4 (р) + 2CO 2 + 2H 2 O = H 4 SiO 4 + 2Na 2 CO 3 Na 2 CO 3 + SiO 2 ( т ) = Na 2 SiO 3 ( т ) + CO 2 (сплавление)
Слайд 100: S n, P b
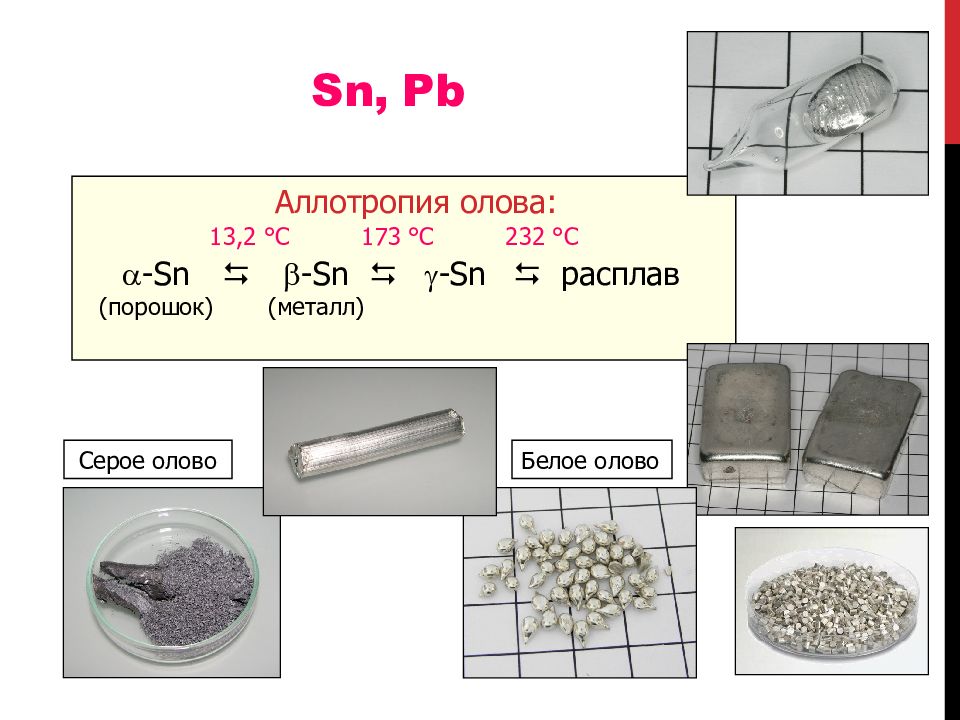
Аллотропия олова: - Sn (порошок) 13,2 °С - Sn (металл) - Sn 173 °С расплав 23 2 °С Серое олово Белое олово
Слайд 101: S n, P b
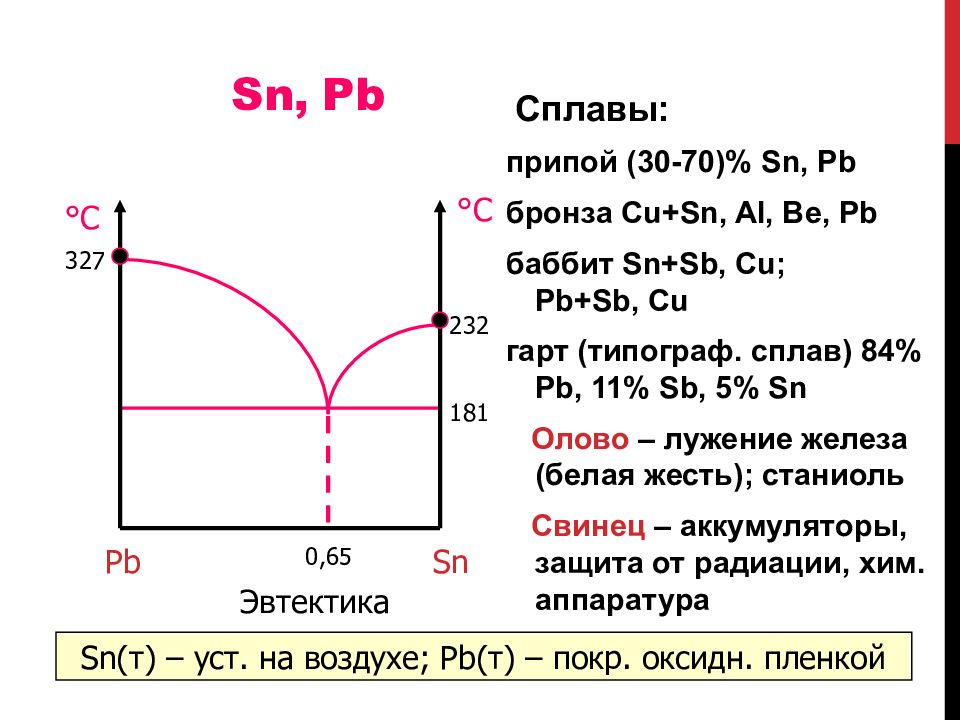
C плавы : припой (30-70)% Sn, Pb бронза Cu + Sn, Al, Be, Pb баббит Sn+Sb, Cu ; Pb+Sb, Cu гарт (типограф. сплав) 84% Pb, 11% Sb, 5% Sn Олово – лужение железа (белая жесть); станиоль Свинец – аккумуляторы, защита от радиации, хим. аппаратура 1 81 23 2 °С °С 327 Эвтектика Pb Sn 0,65 Sn( т ) – уст. на воздухе; Pb( т ) – покр. оксидн. пленкой
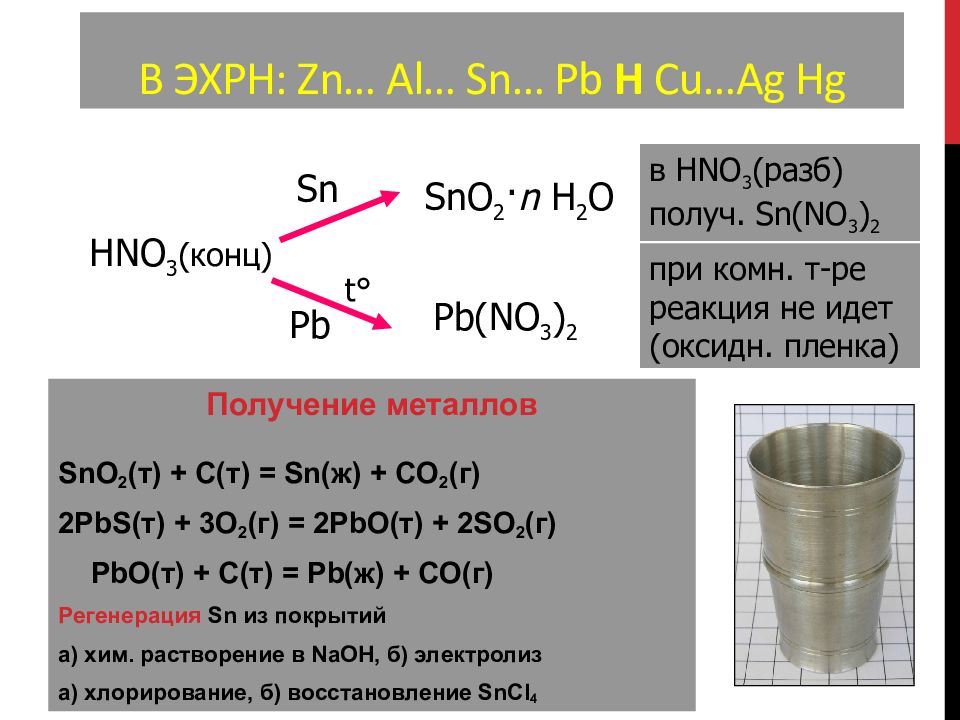
Слайд 102: В ЭХРН: Zn… Al… Sn… Pb H Cu…Ag Hg
Получение металлов SnO 2 ( т ) + C( т ) = Sn ( ж ) + CO 2 ( г ) 2PbS ( т ) + 3O 2 ( г ) = 2PbO ( т ) + 2SO 2 ( г ) PbO ( т ) + C( т ) = Pb ( ж ) + CO( г ) Регенерация Sn из покрытий а) хим. растворение в NaOH, б) электролиз а) хлорирование, б) восстановление SnCl 4 HNO 3 ( конц ) Sn SnO 2 · n H 2 O Pb t ° Pb(NO 3 ) 2 при комн. т-ре реакция не идет (оксидн. пленка) в HNO 3 ( разб) получ. Sn(NO 3 ) 2
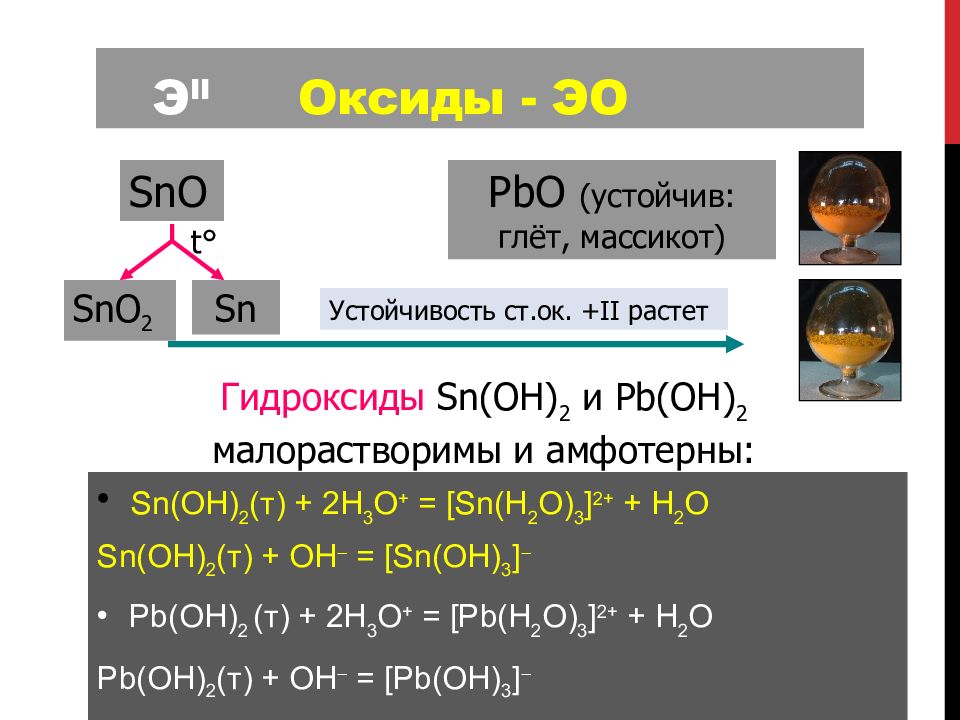
Слайд 103: Э II Оксиды - ЭО
SnO PbO (устойчив: глёт, массикот) t ° SnO 2 Sn Sn (OH) 2 ( т ) + 2H 3 O + = [ Sn (H 2 O) 3 ] 2+ + H 2 O Sn (OH) 2 ( т ) + OH = [ Sn (OH) 3 ] Pb (OH) 2 ( т ) + 2H 3 O + = [ Pb (H 2 O) 3 ] 2+ + H 2 O Pb (OH) 2 ( т ) + OH = [ Pb (OH) 3 ] Гидроксиды Sn(OH) 2 и Pb(OH) 2 малорастворимы и амфотерны : Устойчивость ст.ок. + II растет
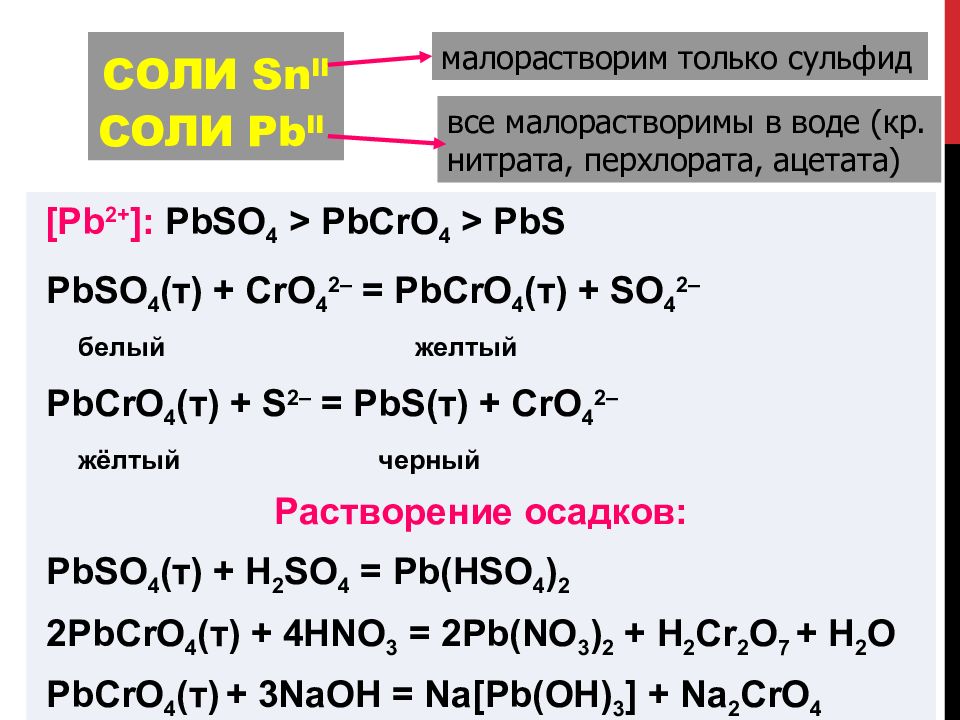
Слайд 104: Соли S n II Соли P b II
[Pb 2+ ]: PbSO 4 > PbCrO 4 > PbS PbSO 4 ( т ) + CrO 4 2– = PbCrO 4 ( т ) + SO 4 2– белый желтый PbCrO 4 ( т ) + S 2 – = PbS( т ) + CrO 4 2– жёлтый черный Растворение осадков: PbSO 4 ( т ) + H 2 SO 4 = Pb(HSO 4 ) 2 2 PbCrO 4 ( т ) + 4 HNO 3 = 2 Pb(NO 3 ) 2 + H 2 Cr 2 O 7 + H 2 O PbCrO 4 ( т ) + 3NaOH = Na[Pb(OH) 3 ] + Na 2 CrO 4 малорастворим только сульфид все малорастворимы в воде (кр. нитрата, перхлората, ацетата)
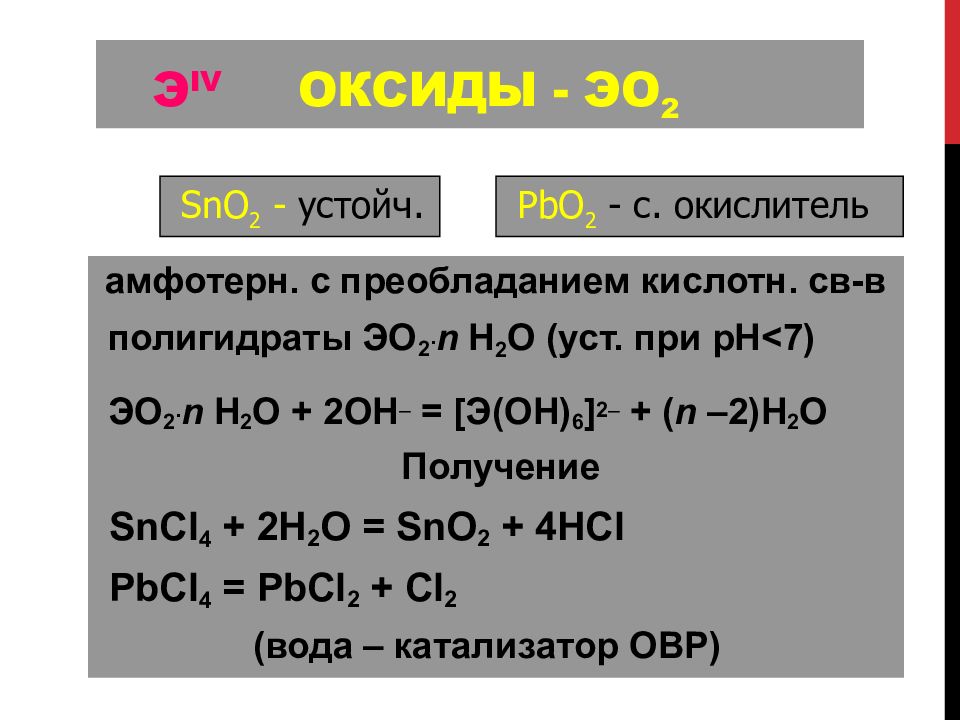
Слайд 105: Э IV Оксиды - ЭО 2
амфотерн. с преобладанием кислотн. св -в полигидраты Э O 2. n H 2 O (уст. при рН < 7) Э O 2. n H 2 O + 2OH = [ Э (OH) 6 ] 2 + ( n –2)H 2 O Получение SnCl 4 + 2H 2 O = SnO 2 + 4HCl PbCl 4 = PbCl 2 + Cl 2 (вода – катализатор ОВР) SnO 2 - устойч. PbO 2 - c. окислитель
Слайд 106: Окислительно -восстановительные свойства
Sn 2+ – мягкий восстановитель рН < 7 ( HCl ): [SnCl 3 ] – + 3Cl – –2 e – = [SnCl 6 ] 2– рН > 7: [Sn(OH) 3 ] + 3OH 2 e – = [Sn(OH) 6 ] 2 Sn 2+ – слабый окислитель (восстановители – Ti 3+, Cr 2+ ) рН < 7: ( HCl ): [SnCl 3 ] – + 2 e – = Sn ( т ) + 3Cl –
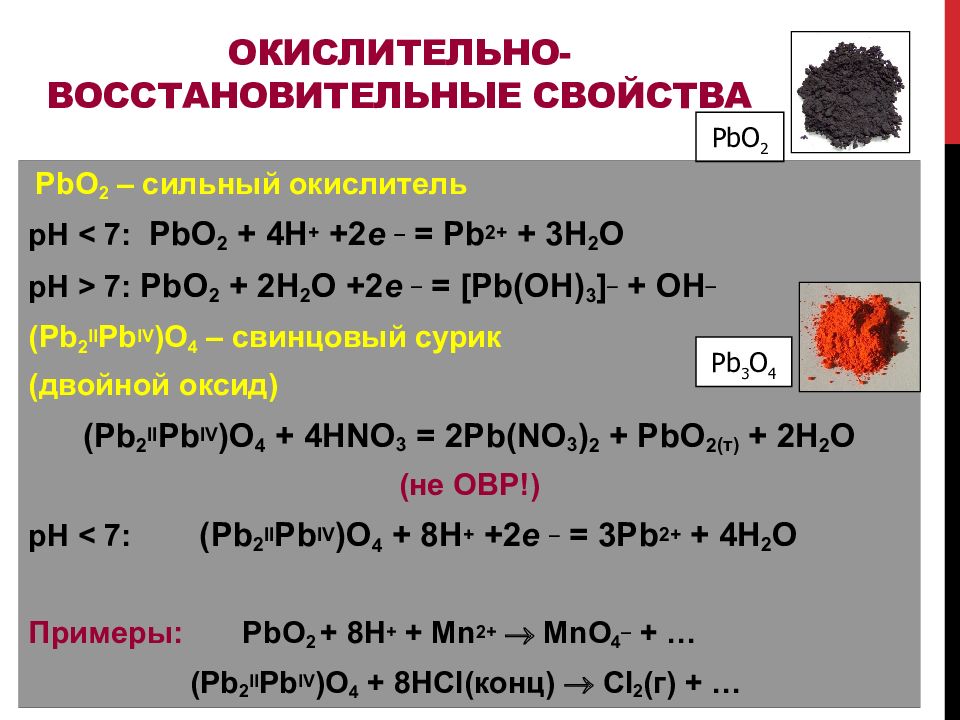
Слайд 107: Окислительно -восстановительные свойства
PbO 2 – сильный окислитель рН < 7 : PbO 2 + 4H + +2 e = Pb 2+ + 3H 2 O рН > 7 : PbO 2 + 2H 2 O +2 e = [ Pb (OH) 3 ] + OH (Pb 2 II Pb IV )O 4 – свинцовый сурик ( двойной оксид) (Pb 2 II Pb IV )O 4 + 4HNO 3 = 2Pb(NO 3 ) 2 + PbO 2 ( т ) + 2 H 2 O (не ОВР!) рН < 7 : (Pb 2 II Pb IV )O 4 + 8 H + +2 e = 3 Pb 2+ + 4 H 2 O Примеры: PbO 2 + 8 H + + Mn 2+ MnO 4 – + … (Pb 2 II Pb IV )O 4 + 8 HCl ( конц ) Cl 2 ( г ) + … PbO 2 Pb 3 O 4
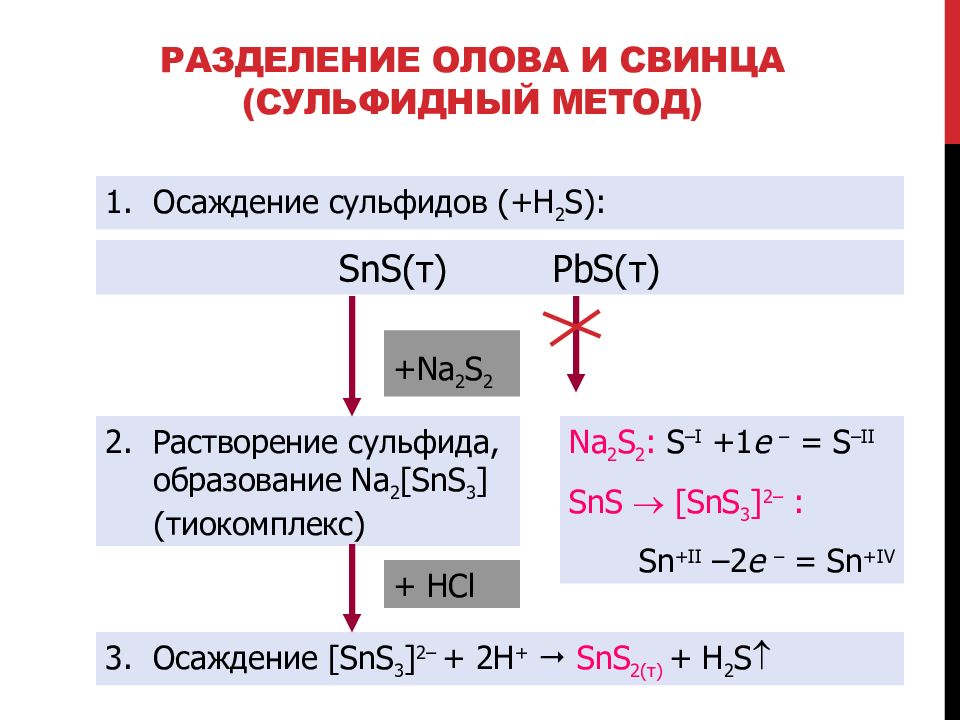
Слайд 108: Разделение олова и свинца (сульфидный метод)
Осаждение сульфидов (+ H 2 S) : SnS( т ) PbS( т ) 2. Растворение сульфида, образование Na 2 [SnS 3 ] (тиокомплекс) Na 2 S 2 : S –I +1 e – = S –II SnS [SnS 3 ] 2– : Sn +II –2 e – = Sn +IV 3. Осаждение [SnS 3 ] 2– + 2H + SnS 2 (т) + H 2 S + Na 2 S 2 + HCl
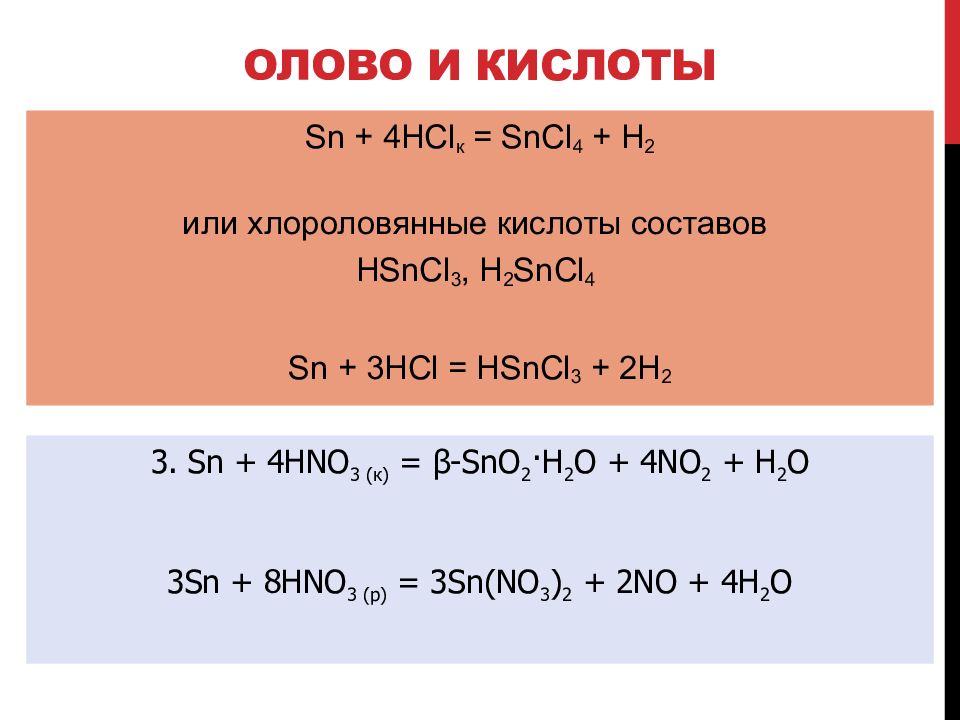
Слайд 109: Олово и кислоты
3. Sn + 4HNO 3 (к) = β -SnO 2 ·H 2 O + 4NO 2 + H 2 O 3Sn + 8HNO 3 (р) = 3Sn(NO 3 ) 2 + 2NO + 4H 2 O Sn + 4HCl к = SnCl 4 + H 2 и ли хлороловянные кислоты составов HSnCl 3, H 2 SnCl 4 Sn + 3HCl = HSnCl 3 + 2H 2
Последний слайд презентации: Химия р-элементов
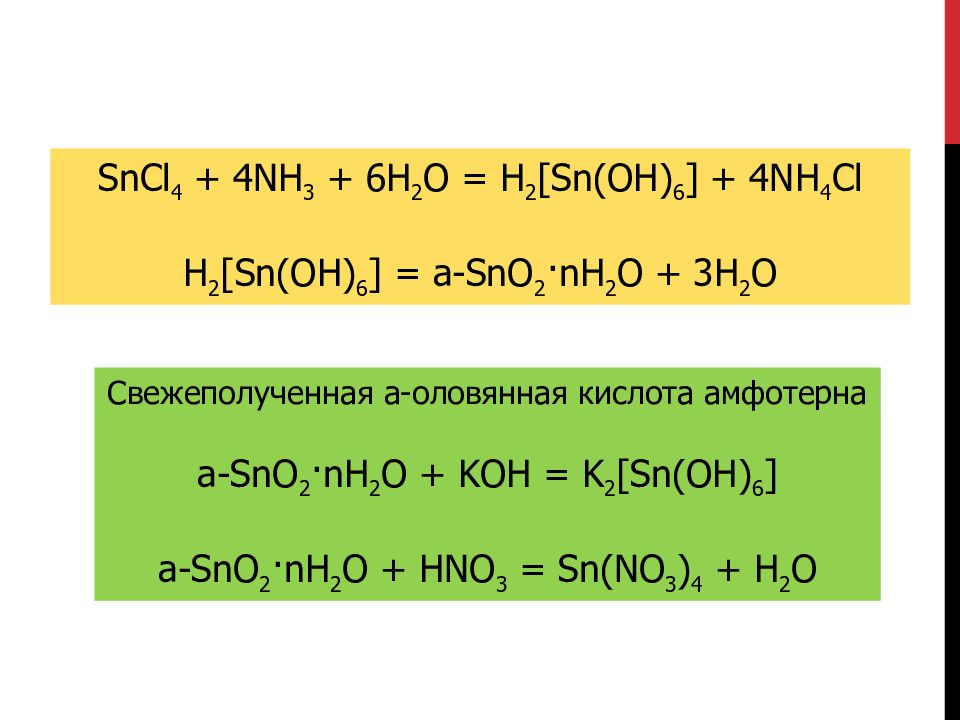
SnCl 4 + 4NH 3 + 6H 2 O = H 2 [ Sn (OH) 6 ] + 4NH 4 Cl H 2 [ Sn (OH) 6 ] = a -SnO 2 ·nH 2 O + 3H 2 O Свежеполученная a-оловянная кислота амфотерна a -SnO 2 ·nH 2 O + KOH = K 2 [Sn(OH) 6 ] a -SnO 2 ·nH 2 O + HNO 3 = Sn(NO 3 ) 4 + H 2 O

























![Химия р-элементов Строение B(OH) 3 и [B(H 2 O)(OH) 3 ]](https://s0.showslide.ru/s_slide/9d4328f58731f45ff5d4cede875c0085/925c4eb8-eaa2-4ec4-99dd-a75af36e27f6.jpeg)













![Химия р-элементов Общая электронная формула: […] n s 2 ( n– 1) d 10 np 2](https://s0.showslide.ru/s_slide/841b13618f91011be297f18d74ce594c/3228f855-dc50-4c25-a054-716760cff8e0.jpeg)