Первый слайд презентации: Глутаминовая кислота
Доклад подготовили студентки группы МЭ-12 Пустынская Алеся Стасенко Александра Москва 2021
Слайд 2: Глутаминовая кислота
Глутаминовая кислота — 2-аминопентандиовая или α-аминоглутаровая кислота. Название кислоты произошло от сырья, из которого она была впервые выделена – клейковина пшеницы. Глутаминовая кислота впервые была выделена из эндосперма пшеницы в 1866 г. Ритгаузеном была синтезирована в 1890 г. Вольфом. 2 Суточная потребность в глутаминовой кислоте выше, чем во всех других аминокислотах и составляет 16 грамм в сутки.
Слайд 3: Физико-химические свойства
Молекулярная масса: 147.13 г/моль Плотность: 1,538 Температура плавления 205 ºC альфа 32 º (с = 10,2 н. HCl) Растворимость в воде 7,5 г / л (20 ºC). Очень плохо растворяется в холодной воде. Белый кристаллический порошок кислого вкуса. Глутаминовая кислота растворяется в разбавленных кислотах, щелочах и горячей воде, трудно растворяется в холодной воде и концентрированной соляной кислоте, практически не растворима в этиловом спирте, эфире и ацетоне. Для L-изомера температура плавления 247-249°С. По химическим свойствам глутаминовая кислота-типичная алифатическая α-аминокислота. 3
Слайд 4: Биологическая роль
L-Глутаминовая кислота встречается во всех организмах в свободном виде (в плазме крови вместе с глутамином составляет около 1/3 всех свободных аминокислот) и в составе белков. Заменимая аминокислота. L-Глутаминовая кислота-предшественник в биосинтезе орнитина и проли-на, участвует в переаминировании при биосинтезе аминокислот, а также в транспорте ионов К+ в центр. нервной системе. Глутаминовая кислота стимулирует окислительно-восстановительные процессы в головном мозге. Глутамат и аспартат содержится в мозге в высоких концентрациях. Глутаминовая кислота нормализует обмен веществ, изменяя функциональное состояние нервной и эндокринной систем. Стимулирует передачу возбуждения в синапсах ЦНС, связывает и выводит аммиак. Находясь в центре азотистого обмена, глутаминовая кислота тесно связана с углеводным, энергетическим, жировым, минеральным и другими видами обмена веществ живого организма. Участвует в синтезе других аминокислот, АТФ, мочевины, способствует переносу и поддержанию необходимой концентрации K+ в мозге, повышает устойчивость организма к гипоксии, служит связующим звеном между обменом углеводов и нуклеиновых кислот, нормализует содержание показателей гликолиза в крови и тканях. 4
Слайд 6: Назначение
Глутаминовая кислота и глутамин применяются: В пищевой промышленности в качестве вкусовой приправы, придающей продуктам продуктам и концентратам «мясной» запах и вкус, а также как источник легко усвояемого азота; В качестве кормовой добавки сельскохозяйственных животных; В медицине (широко применяется, например, при лечении болезни Боткина, печеночной коме, циррозе печени, пневмонии у детей раннего возраста и др.). 6
Слайд 7: Применение в пищевой промышленности
Глутаминовая кислота (пищевая добавка E620) и её соли (глутамат натрия Е621, глутамат калия Е622, диглутамат кальция Е623, глутамат аммония Е624, глутамат магния Е625) используются как усилитель вкуса во многих пищевых продуктах. Еще с начала XX века на Востоке глутаминовая кислота используется как вкусовая добавка к пище и источника легко усвояемого азота. Широкая популярность глутаминовой кислоты как пищевой добавки связана с ее способностью улучшать вкус продуктов. Глутамат натрия усиливает вкус многих пищевых продуктов, а также способствует длительному сохранению вкусовых качеств консервированных продуктов. Это свойство позволяет его широко используют в консервной промышленности, особенно при консервировании овощей, рыбы, мясных продуктов. 7
Слайд 8: Применение как кормовой добавки сельскохозяйственных животных
Использование глутаминовой кислоты как кормовой добавки особенно эффективно на фоне малобелковой диеты и у растущих организмов, когда потребность в источниках азота возрастает. По видимому, под влиянием глутаминовой кислоты происходит более полное использование белковой пищи, чему способствует возрастание переваривающей силы желудочного сока. Под действием глутаминовой кислоты компенсируется дефицит азота и происходит нормализация питания. По эффекту обогащения пищи белковым азотом к глутаминовой кислоте близок ее амид – глутамин. Эффективность глутаминовой кислоты зависит от ее дозировки. Применение больших количеств глутаминовой кислоты оказывает токсическое действие на организм. Доза глутаминовой кислоты, вызывающая гибель половины подопытных животных (DL50) для мышей – 7-8 г/кг, для крыс – 14-18 г/кг. Напротив, в дозе 0,77 г/кг глутамат натрия оказывает положительное влияние на организм. Для достижения максимального прироста веса содержание глутаминовой кислоты в рационе должно быть 5,66%, и не менее 4%. 8
Слайд 9: Применение в медицине
Глутаминовую кислоту широко используют в медицине. Глутаминовая кислота способствует снижению содержания аммиака в крови и тканях при различных заболеваниях. Она стимулирует окислительные процессы при гипоксических состояниях, поэтому успешно применяют при сердечнососудистой и легочной недостаточности, недостаточности мозгового кровообращения и как профилактическое средство асфиксии плода при патологических родах. Также глутаминовую кислоту используют при болезни Боткина, печеночной коме, циррозе печени. В клинической практике применение этой кислоты вызывает улучшение состояния больных при инсулиновой гипокгликемии, судорогах, астенических состояниях. 9 В детской практике глутаминовую кислоту применяют при задержке психического развития, церебральных параличах, болезни Дауна, полиолимите. Важной особенностью глутаминовой кислоты является ее защитное действие при различных отравлениях печени и почек, усиление фармакологического действия одних и ослабление токсичности других лекарственных средств. Глутаминовая кислота оказывает влияние на состояние нервных процессов, в связи с этим она широко применяется при лечении эпилепсии, психозов, при истощении, депрессии, олигофрении, черепно-мозговых травм новорожденных, нарушениях мозгового кровообращения, туберкулезном менингите, параличах, а также при заболеваниях мышц. Глутаминовая кислота используется в сочетании с глицином для больных с прогрессирующей мышечной дистрофией, миопатией.
Слайд 10: Фармакокинетика
Абсорбция высокая. Хорошо проникает через гистогематические барьеры (в т.ч. через ГЭБ), клеточные оболочки и мембраны субклеточных образований. Накапливается в мышечной и нервной тканях, печени и почках. Выводится почками - 4-7% в неизмененном виде. 10
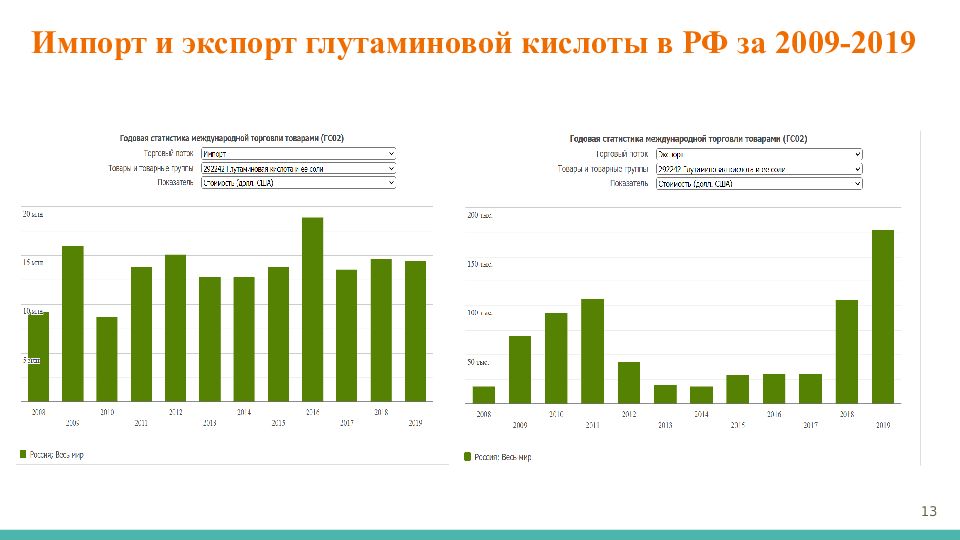
Слайд 11: Объём производства, выпуск в год
У нас глутаминовую кислоту производят: Марбиофарм, Квадрат-С, Фармстандарт, Арикон (глутамат натрия для пищевых производств). По состоянию на 2010 год мировой объем производства глутамата натрия составлял около 3 млн. тонн. Производственные мощности были распределены следующим образом: около 93% производственных мощностей было сосредоточено в Азии с материковым Китаем, на который приходится 80% этих мощностей. На Вьетнам приходится 11,3% от номинальной мощности в Азии, на Японию – 6,5%, Индонезия – 2,2%. Оставшиеся 8% мощностей сосредоточены в Бразилии и Европе (Франция). Согласно статистике, доля производства глутамата натрия в Китае с 2002 по 2008 год возросла с 44% до 78%. Уровень концентрации увеличился на 34%. Однако уже в 2009 году объем производства здесь снизился. В то время как еще в 2002 году количество производителей в Китае составляло общей сложности 140, в 2009 году этот показатель сократился до 17 крупнейших производителей. Фактически на сегодняшний день 75% производства глютаминовой кислоты в Китае обеспечивают 10 крупнейших производителей, мощность которых составляет более 60 тыс. тонн. Мировой рынок глутамата натрия, как основного усилителя вкуса, ежегодно растет на порядка 3-4%. Крупнейшим игроком на мировом рынке выступает компания Ajinomoto, с долей на рынке порядка 30%. Компания представлена в 14 странах мира, 6 из которых находятся в Азиатско-Тихоокеанском регионе. В мировых масштабах российский рынок усилителей вкуса сложно назвать крупным и развитым, т.к. при мировом уровне потребления более 3 млн. тонн, в российской промышленности используется лишь порядка 10 тыс. тонн., или 0,3% в общем объеме. 11
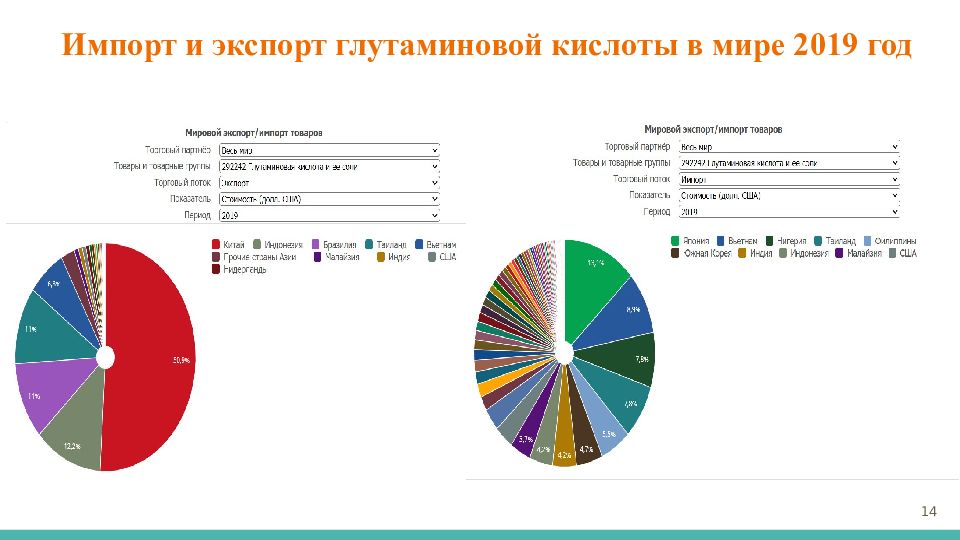
Слайд 12: Объём производства
Объём мирового экспорт товаров группы «Глутаминовая кислота и ее соли» в 2019 году превысил 1,36 млрд долларов (согласно отчётности 68 стран). Годом ранее этот показатель составил 1,08 млрд долларов (по данным 69 стран). Какие страны экспортировали «Глутаминовая кислота и ее соли» в 2019 году? Основными экспортёрами товаров этой группы в 2019 году были Китай - 50% мирового экспорт (693 млн долларов) Индонезия - 12,1% (165 млн) Бразилия - 10,9% (149 млн) Таиланд - 10,9% (149 млн) Вьетнам - 6,82% 12
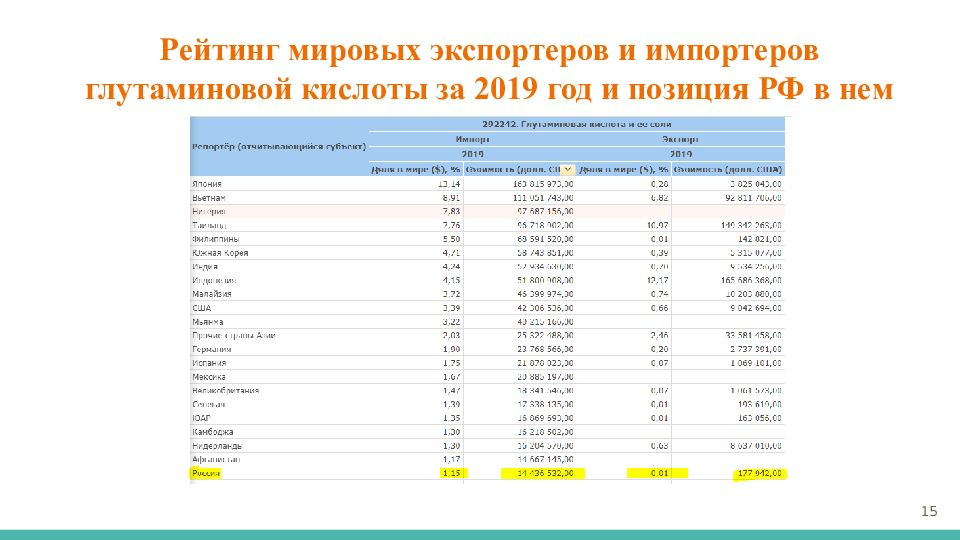
Слайд 15: Рейтинг мировых экспортеров и импортеров глутаминовой кислоты за 2019 год и позиция РФ в нем
15
Слайд 16: Стоимость на рынке
Глутаминовая кислота продаётся в форме таблеток в аптеках по цене от ~27 рубля за 10 таблеток 250 мг. Как добавка для спортивного питания глутаминовая кислота продается в форме порошка от 120 рублей за 100 грамм. Цена на глутамат натрия оптом: около 100 рублей за килограмм. Рыночная стоимость L-глутамата составляет 1000 долларов США за тонну (данные за 2004 год), а объем рынка достигает 1,5 млрд долларов США. Основные производства расположены в странах азиатского региона. 16
Слайд 17: Химический и микробиологический способы получения Х
Получение глутаминовой кислоты химическим методом из сепарационного щелока Основные процессы получения глутаминовой кислоты из щелока включают: сгущение щелока до 65° Брикс, его гидролиз и очистку гидролизата от примесей; выделение и очистку глутаминовой кислоты; превращение глутаминовой кислоты в глутамат натрия и упаковку готового продукта. Применяется кислотный (НС1 или Н2SО4) гидролиз щелока, щелочной (NаОН) или комбинированный щелочной и кислотный. В настоящее время отбросный щелок от сепарации не используется, а выкачивается на поля орошения. В 1965 г. способом известковой сепарации должно быть обессахарено около 650 тыс. тонн мелассы. При переработке такого количества мелассы в отбросном щелоке будет содержаться (в тыс. т): глутаминовой кислоты 13, бетаина 19 и поташа 60. Для извлечения этих ценных продуктов из щелока предлагается схема, которая является комбинацией схем (особенно в части гидролиза), применяемых на заводах США в Сен-Джауси и Джонстауне. 17
Слайд 18
На сахаро-баритовом заводе Джонстаун мононатриевый глютамат получают из щелоков после баритовой и известковой сепарации с применением сернокислотного гидролиза. Сконцентрированные до плотности 65% щелоки помещают в 4 резервуара-хранилища емкостью по 7500 тонн, из которых щелок подается в сборник 1, а из него на вакуум-фильтр 2 с намывным слоем. К фильтрату в сборник 3 добавляют Н2SО4 до рН 3,2 и выпавший осадок сернокислого калия отделяют на центрифуге 4. Сернокислый калий высушивают в ротационной сушилке и используют в качестве удобрения, а фугат снова фильтруют на вакуум-фильтре 5 с намывным слоем и выпаривают в аппарате 6 до содержания сухих веществ 70%. При выпаривании выпадает соль К2SО4, которую отделяют на центрифуге 7, а фугат подают в холодильник 8 и затем в кристаллизатор 9, где в течение 5 суток выкристаллизовывается сырая глютаминовая кислота. Отделенная от маточного раствора на фильтрпрессе 10 глютаминовая кислота поступает в сборник //, откуда подается в центрифугу 12. Там кристаллы кислоты осторожно промывают водой и выгружают в сборник 13. Затем разбавляют водой и перекачивают в сборник 14. Фильтрат, полученный на фильтр-прессе 10, нейтрализуют аммиаком и выкачивают в резервуар для хранения, откуда он используется на корм скоту. В сборник 14 к сырой глютаминовой кислоте добавляют кизельгур, активированный уголь и едкий натр для образования хорошо растворимой в воде мононатриевой соли; полученную суспензию фильтруют через фильтрпресс 15. Фильтрат охлаждают в холодильнике 16 и подают в сборник 17, где из мононатриевого глутамата путем добавления соляной кислоты до рН 3,2 вновь выделяют и отделяют на центрифуге 18 глютаминовую кислоту, которую собирают в сборнике 19. После вторичной очистки раствора кизельгуром и активированным углем в мешалке 20, фильтрации через фильтрпресс 21, кристаллизации в кристаллизаторе 22, отделения на центрифуге 23, сушки в сушильных аппаратах 24 и сортировки на ситах 25 получают чистый кристаллический глутамат натрия. 18
Слайд 19
Представляет определенный интерес способ получения мононатриевого глутамата на заводе Сен-Джауси (США) с применением щелочного гидролиза (КаОН) по следующей технологической схеме. Поступающий в железнодорожных или автомобильных цистернах сгущенный щелок сливают в приемные резервуары /, из которых его подают в сборник на весах 2, а затем на вакуум-фильтр 3 с намывным слоем из вспомогательного фильтрующего материала (суспензию которого готовят в сборнике 4} для удаления взвешенных частиц, которые направляют в канализацию 5. Полученный фильтрат тщательно перемешивают в стальном гидролизаторе 6 с 50%-ным раствором едкого натра, который готовят в сборнике 7. Из сборника 8 в гидролизатор поступает пар. По окончании гидролиза жидкость охлаждают в теплообменнике 9, а затем в сборнике 10 подкисляют соляной кислотой, которую подают из сборника //. Поддержание необходимого рН раствора обеспечивается автоматическим рН-метром. Нейтрализованный раствор сгущают в однокорпусном выпарном аппарате 12; все части этого аппарата, cоприкасающиеcя с жидкостью и соковым паром, вплоть до конденсатора смешения, гуммируют, а поверхность нагрева и циркуляционный насос изготовляют из нержавеющей стали. В результате сгущения раствора из него выкристаллизовывается смесь хлористых натрия и калия, содержащая 30% К2О. Смесь этих солей отделяют на центрифуге 13 и направляют в сборник 14, откуда их после растворения направляют для получения неорганических побочных продуктов. После удаления неорганических солей к фугату в сборнике 15 добавляют соляную кислоту точно до рН 3,2, соответствующих изоэлектрической точке глютаминовой кислоты, что обеспечивается соответствующим автоматическим рН-метром. 19
Слайд 20
Кислый раствор охлаждают в холодильнике 16, после чего направляют его в кристаллизаторы 17, в которых в течение 5—8 суток выкристаллизовывается сырая глютаминовая кислота. Отделение кристаллов проводят на центрифуге 19 после предварительного сгущения кристаллической массы в отстойнике Дорра 18. Декантат из отстойника направляют в сборник 20, а из сборника вместе с фугатом от центрифуг, собираемым в сборнике 21, фильтруют через фильтр 22. Взвешенный на весах 23 фильтрат направляют в сборник 24, откуда он поступает на извлечение бетаина и других побочных продуктов.Кристаллы сырой глутаминовой кислоты из центрифуги выгружают в сборник 25; затем в сборнике 26 разбавляют их водой и перекачивают в сборник 27. Для очистки сырой глютаминовой кислоты и перевода ее в хорошо растворяющуюся в воде мононатриевую соль к ней добавляют едкий натр, 50%-ный раствор которого подают из сборника 28, и активированный уголь со вспомогательным материалом для фильтрации, суспензию которых приготавливают в сборнике 29. Полученную смесь фильтруют через фильтр 30 и фильтрат под названием стандартного сиропа направляют в сборник 31. Сироп сгущают в вакуум-аппарате 32 и полученную массу направляют в кристаллизаторы системы Лафейля 33; поддержание установленной температуры в кристаллизаторах обеспечивается регулятором температуры 34. Кристаллы мононатриевого глутамата отделяют на центрифуге 35, высушивают в сушилке 36, просеивают через сито 37 и направляют в бункера 38, откуда готовый продукт поступает на расфасовку и упаковку 39. Фугат из центрифуги поступает в сборник 40, откуда его возвращают в основной процесс. Выход глутаминовой кислоты из сепарационного щелока принимают в среднем равным 2% к весу мелассы, а выход глутамата натрия примерно на 25% выше глутаминовой кислоты. Производство глутаминовой кислоты из мелассы В Италии фирмой Эрколи в 1956 г. освоено в промышленном масштабе производство глутаминовой кислоты, бетаина и поташа непосредственно из свекловичной мелассы по способу Сольвенте. В основе этого способа лежит обработка мелассы смесью метанола и бензола и высаливание в результате этого солей калия, затем последующая обработка частично обессахаренного и полностыо освобожденного от метанолбензола фильтрата ионитами. Из катионитового регенерата извлекают бетаин, а из анионитового — глутаминовую кислоту. Регенерацию катионита проводят серной или соляной кислотой, а регенерацию анионита — каустической содой. Способ Сольвенте интересен тем, что дает высокий выход продукции: сахара-песка 35% к весу патоки; пищевого сиропа 15%; глутаминовои кислоты 4%; бетаина до 6% и поташа 15% к весу мелассы. Группа японских специалистов института прикладной микробиологии Токийского университета во главе с проф. Т. Асаи нашла микроорганизм Micrococus glutamicus — глутаминовый микрококк, синтезирующий глутаминовую кислоту. В среде с аммонийной солью и глюкозой этот микрококк образует до 3 г глутаминовои кислоты на 1 л. 20
Слайд 21
Биохимический способ получения глутаминовой кислоты Японской фирмой Kyowa Hatsuko разработан и осуществлен в промышленных условиях синтез глутамата натрия биохимическим методом сбраживания на крахмалистых и глюкозных средах. По лицензии этой фирмы американской фирмой Мегс построен и пущен в 1958 г. крупный завод. Технологическая схема производства глутамата натрия из мелассы биосинтезом, разработанная японской фирмой Nichon Tensaito. Свекловичная меласса подвергается разбавлению 1 водой до содержания сахара примерно 5%, затем стерилизуется паром 2 и охлаждается. В процессе подготовки к раствору мелассы добавляют мочевину, фосфорные и магниевые соли. Подготовленный раствор мелассы направляется на ферментацию 3 с применением глутаминового микрококка, синтезирующего из сахарозы глютаминовую кислоту. Ферментация ведется при продувании стерильным воздухом в течение 60 часов. Накопившаяся в процессе ферментации глютаминовая кислота (примерно 9,5% к раствору) отделяется от бражки фильтрацией 4 с добавлением кизельгура. Выделение глутаминовой кислоты из фильтрата и дальнейшее получение товарного глютамата натрия производится в аппаратах 5— 21 обычным методом. Оттек от центрифугирования 8 может быть использован для корма скоту или для выработки кормовых дрожжей. Общая продолжительность всего процесса до 9 суток. Метод дает высокий выход глутаминовой кислоты — 12% и более к весу мелассы, против 1,2— 2,0% при других методах. В результате снижения расхода химикатов, энергии и вспомогательных материалов себестоимость глютамата натрия, полученного биохимическим методом сбраживания, на 40—50% ниже по сравнению с полученным химическим методом. 21
Слайд 22
Получение глютаминовой кислоты из мелассы с применением ионообменных смол. Производство глютамата натрия химическим методом связано с необходимостью применения сложной аппаратуры с антикоррозийным покрытием для защиты от агрессивных промежуточных продуктов и значительными затратами химикатов и энергии. Более совершенен в этом отношении способ извлечения глютаминовой кислоты по схеме французской фирмы Degremont с применением ионообменных смол, вырабатываемых другой французской фирмой Prosimafti. По этой схеме предусматриваются процессы деминерализации мелассы с одновременной очисткой и выделением из элюата ионообменников глютаминовой кислоты. Меласса поступает в аппарат / для разбавления и охлаждения; разбавленная примерно в 7 раз и охлажденная меласса направляется на катионообменник 2 для отделения солей калия и натрия, а также бетаина, после чего меласса поступает на анионообменник 3, на смоле которого задерживаются глютаминовая и пиролидонкарбоновая кислоты. Деминерализованная меласса в виде сахарного раствора с доброкачественностью 92% и выше направляется на сахарный завод для выделения сахара. После насыщения смол солями катионообменники и анионообменники переключают на процесс регенерации. Регенерация смол в катионообменнике проводится разбавленной серной кислотой с последующей промывкой умягченной водой. Элюат от регенерации катионообменных смол может поступать на выделение бетаина. 22
Слайд 23
Регенерация смол в анионообменнике проводится раствором соды с последующей промывкой смол до нейтральной реакции умягченной водой. Элюат от регенерации смол из анионообменника направляется в сборник 4, а затем на сгущение в трехкорпусный выпарной аппарат 5. Сгущенный элюат обрабатывается раствором каустической соды в реакторе 6, фильтруется 7 и направляется в реактор 8 для обработки соляной кислотой. Образовавшиеся кристаллы отделяют на фильтре и затем растворяют в реакторе 9. Полученный раствор фильтруется через нутч-фильтр 10, куда для осветления вводится активированный уголь, и поступает в кристаллизаторы 11. Выкристаллизовавшаяся глютаминовая кислота отделяется на фильтре 12, сушится в этажерочной электрической сушилке 13 и упаковывается (14). Особенность описанной схемы — комплексная переработка мелассы на сахар, глютаминовую кислоту, бетаин и другие продукты при незначительном расходе химикатов и других вспомогательных средств. Производство полностью автоматизировано. По данным фирмы на 1 т глютамата натрия расходуется: соляной кислоты (32%-ной) в/п............. 6,0 едкого натра (50%-кого) в/п.............. 2,0 пара в т........................ 16,2 воды в м3........................ 230,0 электроэнергии в кет-ч................. 200,0 Также к способам получения глутаминовой кислоты относятся: • гидролиз различных белков; • синтез химический из α-кетоглутаровой кислоты; • ферментативный из α-кетоглутаровой кислоты; 23
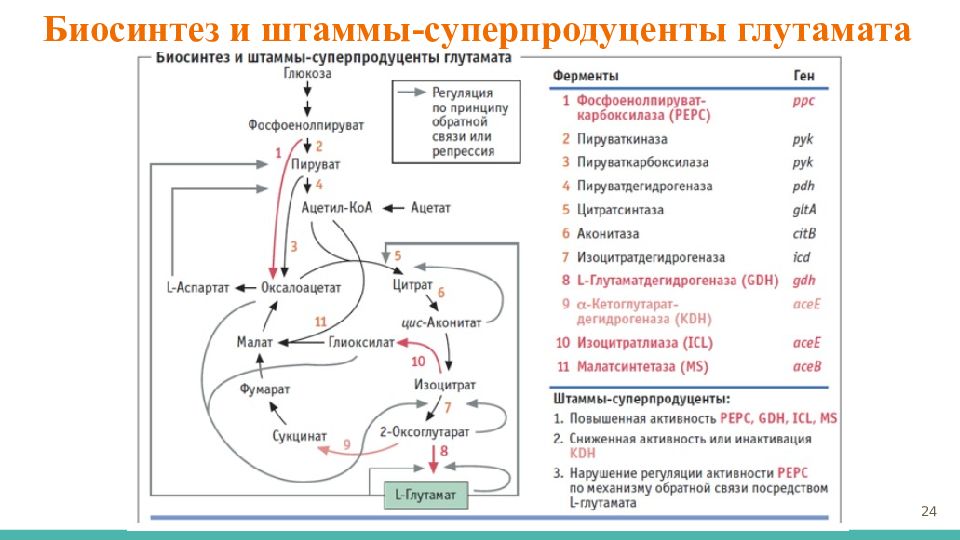
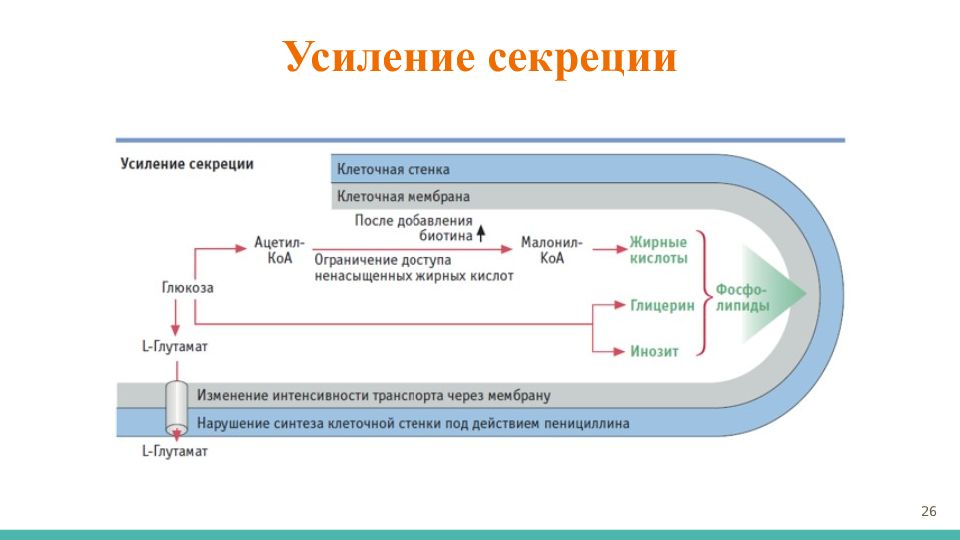
Слайд 25: Штаммы-продуценты глутаминовой кислоты
К настоящему времени установлено, что способностью продуцировать глутаминовую кислоту обладают некоторые виды дрожжей и бактерий. Однако практически только бактерии могут синтезировать глутаминовую кислоту с выходом не менее 40% относительно исходного сахара или другого сырья. Поэтому промышленное значение имеют пока только бактерии, относящиеся к родам Micrococcus, Brevibacterium, Microbacterium, Corynebacterium. Это, главным образом, палочковидные, грамположительные бактерии, не образующие спор. Специфической для них является обязательная потребность в биотине либо в биотине и тиамине. Продукцию глутаминовой кислоты Corynebacterium glutamicum можно вызвать тремя основными способами: 1) поддержанием низкой (субоптимальной) концентрации биотина в ферментационной среде; 2) при оптимальной или превышающей её концентрации биотина продукция вызывается внесением в ферментационную среду поверхностно активных веществ, содержащих некоторые жирные кислоты (пальмитиновую или стеариновую), а также внесением самих жирных кислот (далее ЖК); 3) внесением в ферментационную среду антибиотиков, действующих на синтез клеточной стенки (пенициллин) 25 Микроскопия Corynebacterium glutamicum Corynebacterium glutamicum MB 001
Слайд 27: Условия хранения и получения посевного материала
К способам хранения продуцентов, можно отнести: Хранение на косом агаре при низкой температуре (1-5 ℃) в течение 1-2 месяцев. Для увеличения сроков хранения вплоть до 12 месяцев, ватные пробки пробирок можно залить парафином или обернуть пробирки медицинской пленкой. Засев в жидкую питательную среду или пересев на свежую агаризованную, осуществляется микробиологической петлей в стерильных условиях. Хранение штаммов в лиофильно высушенном состоянии (обезвоживание под вакуумом после замораживания при температуре -40- -60℃ и ниже).Для высева вскрывают ампулы,содержимое петлей переносят на агаризованную среду и помещают в термостат или в ампулу вносят 0,2-0,3 мл стерильной дистиллированной воды, растворяют материал и высевают содержимое. Хранение в глицероле (содержание при низких и сверхнизких температурах в растворах глицерола, который служит криопротектором). Применяется реже, так как необходимы предварительные эксперименты по определению степени выживаемости штамма-продуцента. Чаще всего применяется при хранении суспензий различных спор. После разморозки культуры, засев на питательные среды производится или микробиологической петлей или автоматической пипеткой со стерильным носиком. 27
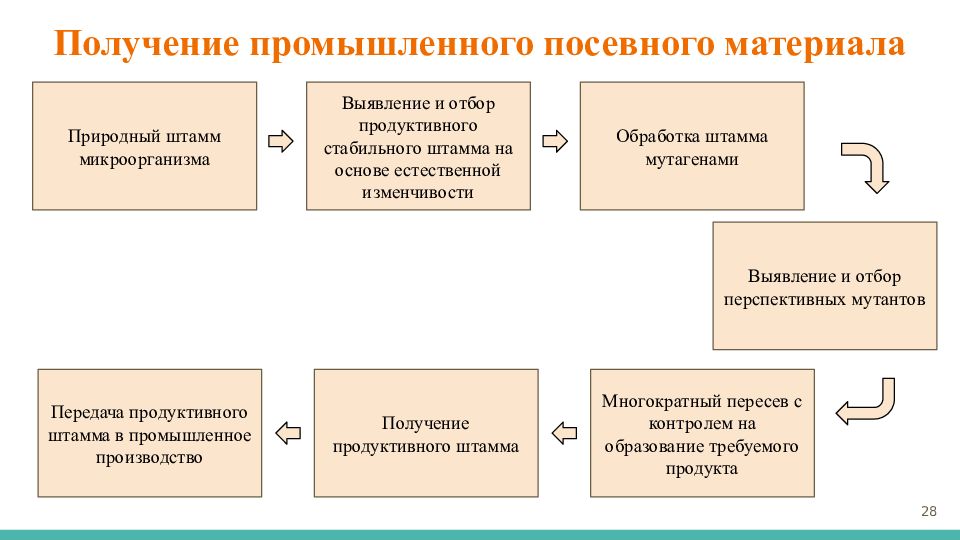
Слайд 28: Получение промышленного посевного материала
28 Природный штамм микроорганизма Выявление и отбор продуктивного стабильного штамма на основе естественной изменчивости Передача продуктивного штамма в промышленное производство Получение продуктивного штамма Многократный пересев с контролем на образование требуемого продукта Обработка штамма мутагенами Выявление и отбор перспективных мутантов
Слайд 29
Производственная культура микроорганизма-продуцента хранится в лаборатории предприятия в виде стока-посева в пробирке на жидкой или твердой питательной среде, предназначенной для среднесрочного хранения. В процессе хранения клетки микроорганизмов минимизируют свой метаболизм, поэтому передача их в производственный процесс проводится постепенно. Перед засевом в аппарат культура подращивается в термостате на специальной среде ( ночная культура). Цель этой стадии- “оживление культуры”, перевод из “спящего” состояния в активное-”инокулят”. 29
Слайд 30: Сырьевая база, питательная среда
Состав питательной среды для главной ферментации и для получения посевного материала в значительной степени зависит от используемого продуцента, от его физиологических особенностей. Основным источником углерода в среде чаще всего являются глюкоза, сахароза, гидролизаты крахмала, свекловичная меласса, гидрол. Количество усваиваемого сахара в пересчете на сахарозу должно быть в пределах от 8,5 до 25%. Пределы использования мелассы определяются уровнем в ней биотина. Концентрация биотина, по данным большинства исследователей, не должна превышать 2–5 мкг на 1 л питательной среды, иначе вместо глутаминовой кислоты будут интенсивно накапливаться аланин, молочная, янтарная, аспарагиновая кислоты, резко возрастет прирост биомассы продуцента, но снизится выход глутаминовой кислоты. Помимо мелассы биотин в среду может быть внесен и с кукурузным экстрактом. Ингибирующее влияние биотина удается снизить при включении в состав питательных сред различных добавок в виде некоторых спиртов, ПАВ, антибиотиков (пенициллинов, тетрациклинов). Добавки в среду ПАВ в количестве 0,01–0,2% или калиевой соли бензилпенициллина повышают биосинтетическую способность продуцента на 15–45% и выход глутаминовой кислоты достигает 50г/л. В качестве источника азота в питательных средах чаще всего используют мочевину в количестве до 1,5–2,0% в зависимости от особенностей используемого штамма, но вводится она дробно, по мере потребления ее из среды, и так, чтобы содержание ее в культуралыюй жидкости не превышало 0,8% и рН среды было в пределах от 6,8 до 7,8.Недостаток азота в среде приводит к снижению синтеза глутаминовой кислоты и к накоплению в среде повышенных количеств α-кетоглутаровой кислоты. Для нормального роста культуры и образования ею глутаминовой кислоты необходимо вводить в среду соли калия в виде КН 2 РО 4 до 0,1-0,2%; MgSO4*7H2O- до 0,03-0,3% MnSO4*4H20 до 0,001%, а также мел для поддержания рН среды на оптимальном уровне – около 7–7,2. Длительность культивирования зависит от содержания сухих веществ в среде, способа введения компонентов среды (единовременно или дробно), степени аэрации среды и, конечно, от физиологических особенностей продуцента. 30
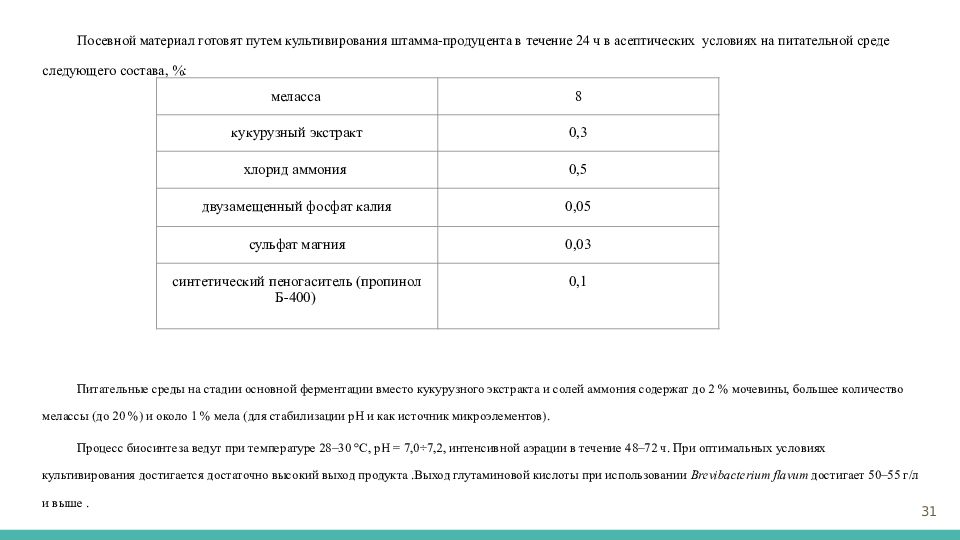
Слайд 31
Посевной материал готовят путем культивирования штамма-продуцента в течение 24 ч в асептических условиях на питательной среде следующего состава, %: Питательные среды на стадии основной ферментации вместо кукурузного экстракта и солей аммония содержат до 2 % мочевины, большее количество мелассы (до 20 %) и около 1 % мела (для стабилизации рН и как источник микроэлементов). Процесс биосинтеза ведут при температуре 28–30 °С, рН = 7,0÷7,2, интенсивной аэрации в течение 48–72 ч. При оптимальных условиях культивирования достигается достаточно высокий выход продукта.Выход глутаминовой кислоты при использовании Brevibacterium flavum достигает 50–55 г/л и выше. 31 меласса 8 кукурузный экстракт 0,3 хлорид аммония 0,5 двузамещенный фосфат калия 0,05 сульфат магния 0,03 синтетический пеногаситель (пропинол Б-400) 0,1
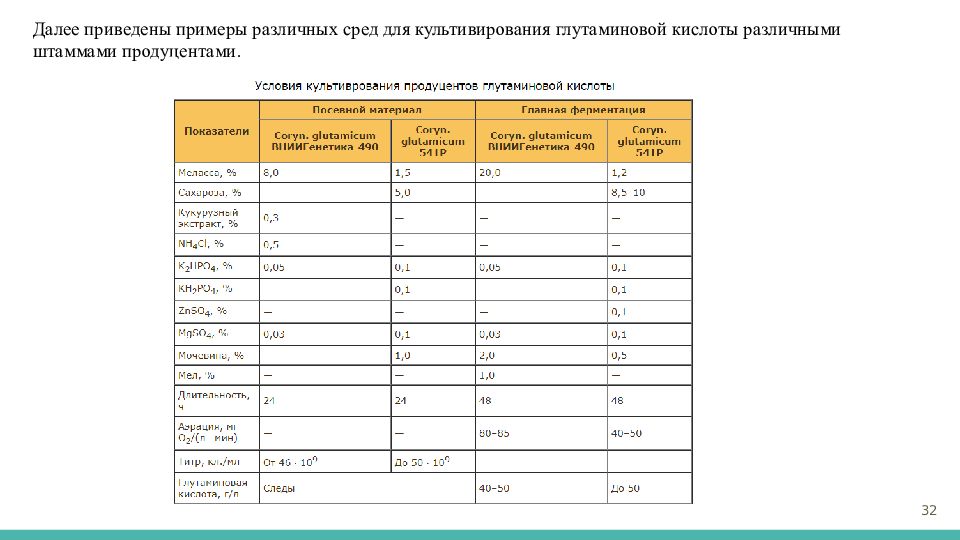
Слайд 32
Далее приведены примеры различных сред для культивирования глутаминовой кислоты различными штаммами продуцентами. 32
Слайд 33
Подготовку ферментаторов (инокуляторов) к работе начинают с промывки использованного оборудования горячей и холодной водой с последующей обработкой аппаратов и коммуникаций острым паром. Стерилизацию питательных сред осуществляют традиционным способом, так же как и подготовку технологического воздуха. Растворяемые компоненты среды нагревают до определенной температуры, затем выдерживают при этой температуре с последующим охлаждением до температуры ферментации. Питательная среда для выращивания продуцентов глутаминовой кислоты готовится и стерилизуется в две стадии с учетом свойств компонентов, входящих в ее состав. Стадия подготовки и стерилизация среды состоят из смешивания компонентов питательной среды в определенной пропорции с помощью специальных дозаторов в реакторе, растворения солей при перемешивании, нагрева до температуры стерилизации, выдержки при этой температуре в течение 1 часа и охлаждения до температуры, при которой проводится культивирование продуцента глутаминовой кислоты. Термолабильные компоненты среды, например мелассу, содержащую сахарозу стерилизуют отдельно. В реактор, снабженный мешалкой, подают мелассу и нагревают ее при постоянном перемешивании до температуры 80°С, с периодическим добавлением к раствору определенного количества воды. Собственно стерилизацию осуществляют путем быстрого разогрева полученного раствора глухим паром до 120–122°С в специальном аппарате и выдерживают при этой температуре определенное время, необходимое для полной гибели всей микрофлоры. Охлажденный раствор сжатым стерильным воздухом передают в предварительно подготовленный ферментатор. Температура стерилизации мелассы выше, а длительность значительно меньше, чем те же параметры при стерилизации остальных компонентов среды. Пеногаситель, используемый на стадиях культивирования продуцента в посевном аппарате и основном ферментере, особенно в том случае, когда им является масло или жир, стерилизуется отдельно. Режимы стерилизации (температура и длительность) при обработке пеногасителя более жесткие, чем это принято для стерилизации любых питательных сред. 33
Слайд 34
При стерилизации аппаратуры режимы стерилизации зависят главным образом от материала, из которого изготовлено оборудование и его отдельные узлы. Наибольшая эффективность стерилизации аппаратуры и коммуникаций наблюдается при применении острого пара, имеющего температуру 135–140°С. Но отдельные блоки аппаратов, в том числе датчики измерительных приборов, не выдерживают таких условий стерилизации, и потому в этих случаях могут применяться «холодные» способы стерилизации. Для такой обработки могут быть использованы бактерицидные газы (этилен) и растворы химических реагентов (формалина, смеси цитилпиридинового бромида и этанолмеркурихлорида в соотношении 2:1, различные производные фенола и их смеси, аммонийные соли первичных и вторичных алкилсульфатов, хлорсодержащие соединения, 3-пропиоллактон и т.д.). Степень стерильности среды, оборудования и коммуникаций может быть проверена. Простерилизованную среду или смывы, произведенные стерильной водой с внутренних поверхностей аппаратов и трубопроводов, высевают на агаризованные или жидкие питательные среды и инкубируют в термостате сутки. Если среды остаются стерильными, то стерилизация проведена качественно. Такой анализ проводится при пуске завода, в случае появления инфекции и периодически в профилактических целях. Посевной материал на каждой из стадии его получения (от пробирок до посевного аппарата) выращивают в строго асептических условиях по 24 ч. Состав питательных сред незначительно меняется при переходе от одного штамма к другому и практически остается постоянным на каждой из промежуточных стадий получения посевного материала. Только при выращивании продуцента в посевном аппарате в питательную среду вносят до 0,1% стерильного синтетического пеногаситсля. Накопление биомассы до 6–8 г. АСВ на 1 л среды производят в аэробных условиях сначала в инокуляторах объемом 2 м 3, потом в посевных аппаратах объемом 5 м. Полученный посевной материал в количестве 5–6% (от объема среды производственных аппаратов) стерильно передают в основные ферментаторы на 50 м 3. Коэффициент заполнения аппарата 0,7. 34
Слайд 36
Выращивание продуцента в ферментере Процесс биосинтеза осуществляют в строго асептических условиях в ферментаторах объемом 50 м 3 с коэффициентом заполнения аппарата 0,7 в течение 48–52 ч и интенсивной аэрации [80–85 мг Ог/(л-мин)], что соответствует расходу 1 объема воздуха на 1 объем среды в 1 мин. Температуру культивирования на всех стадиях поддерживают постоянной на уровне 28–30°С. В конце процесса биосинтеза готовая культуральная жидкость содержит до 45 г./л глутаминовой кислоты. Выход глутаминовой кислоты по отношению к потребленным сахарам составляет 45–50%. Поскольку производство глутаминовой кислоты направлено на получение высокоочищенных препаратов, последующая технологическая схема предусматривает производство продуктов, подготовленных непосредственно к применению в качестве пищевых добавок и в виде лекарственных форм. 36 Промышленный ферментер BIORUS®
Слайд 37
Предварительная обработка культуральной жидкости Осуществляется путем прогрева её глухим паром до температуры 35–85 °С в течение 30 мин и добавления к ней определенного количества негашеной извести (или известкового молока) (1%) с последующим осаждением избытка ионов кальция фосфорной кислотой до рН 5,5–7,0. Образующийся при этом осадок способствует лучшему отделению клеток продуцента и других балластных примесей. Отделение биомассы от культуральной жидкости Проводят центрифугированием или фильтрованием под давлением с помощью фильтр пресса. При получении глутаминовой кислоты культуральную жидкость нагревают до 60–65 ° С с целью докоагуляции клеток и направляют на рамный фильтр-пресс, где фильтруют. Осадок промывают и обезвоживают продувкой воздухом в течение нескольких часов. Нативный раствор и промывные воды объединяют, при необходимости корректируют рН до 5,5–6,0 концентрированной соляной кислотой и передают на дальнейшую переработку 37
Слайд 38
Осветление фильтрата Состоит в очистке его от пигментных примесей, окрашивающих нативный раствор в темный цвет. Для этого обрабатывают фильтрат активированным углем или подвергают его ионообменной сорбции на анионите ИА-1P. Нативный раствор глутаминовой кислоты, подкисленный 33 %-й соляной кислотой до рН 4,5–5,5 с содержанием сухих веществ около 9 % поступает на осветление в колонну с сорбентом ИА-1Р. Цикл работы одной колонны с сорбентом ИА-1Р включает следующие операции: • Процесс сорбции пигментов на регенерированном сорбенте. Нативный раствор глутаминовой кислоты подают сверху вниз со скоростью 0,5–1,0 ч-1. Осветлённую жидкость сливают в ВВУ для последующего упаривания или в промежуточный сборник. • Вытеснение осветленного раствора и промывка сорбента водой. Раствор из межгранульного пространства вытесняют обессоленной водой или конденсатом пара с ВВУ в количестве 1,5 объёма/1 объём сорбента со скоростью 0,5 ч-1. Раствор глутаминовой кислоты подают сверху вниз. • Регенерация сорбента. Регенерация проводится сверху вниз 0,5 н раствором гидроксида натрия и 1,2 н раствором аммиака в количестве 2 объёма/1 объём сорбента со скоростью 1 ч-1. 38
Слайд 39
Сильноокрашенный промывной раствор сливают в канализацию, слабоокрашенный используют в дальнейшем повторно, собирая в отдельную ёмкость для хранения. От щёлочи смолу отмывают водопроводной водой из расчёта 3 объёма воды/1 объём сорбента со скоростью 1 ч -1. Щелочной раствор с концентрацией гидроксид-ионов больше 1 моль/л собирают для повторного использования, остальные промывные воды сливают в канализацию. Затем снизу вверх пропускают 1 %-й раствор соляной кислоты из расчёта 1–1,5 объёма/1 объём сорбента со скоростью 1 ч -1. Стоки направляют в канализацию. Смолу снова промывают водой сверху вниз из расчета 2 объёма воды/1 объём смолы со скоростью 1 ч -1 до величины рН 2,0–2,5. Смола выдерживает 300 циклов. Элюат направляют на вакуум-выпаривание. Концентрирование осветленного раствора глутаминовой кислоты Проводят путем его вакуум-выпаривания при температуре 40–60 °С, при этом из исходного раствора глутаминовой кислоты отгоняют от 50 до 80% воды. Режимы вакуум-выпаривания растворов глутаминовой кислоты 39 Аминокислота Температура,°С Р, атм Содержание, % СВ Примечание Содержание аминокислоты в упаренном растворе, % Глутаминовая кислота 60–70 0,70–0,75 43–45 Препарат пищевого назначения 15–17
Слайд 40
40 Вакуумный выпариватель с тепловым насосом AQUADEST-K Кристаллизатор SCR SHINI
Слайд 41
Осаждение кристаллов глутаминовой кислоты в изоэлектрической точке Эта стадия осуществляется путем подкисления полученного на предыдущем этапе концентрата соляной кислотой до рН 3,2 (изоэлектрическая точка глутаминовой кислоты) и охлаждения раствора до 4–15°С в кристаллизаторе. Однократное проведение операции обеспечивает кристаллизацию 77% глутаминовой кислоты; при повторном ее проведении выход возрастает до 87%. Чистота получаемых кристаллов достигает 88%. В результате последующей перекристаллизации чистоту получаемых кристаллов можно увеличить до 99,6%, что удовлетворяет требованиям фармакопеи. Отделение кристаллов глутаминовой кислоты от маточника Это достигается центрифугированием с последующей декантацией и возвратом маточника на стадию вакуум-выпаривания. Суспензию кристаллов глутаминовой кислоты помещают в фильтрующую центрифугу и центрифугируют при 5000–6000 об/мин в течение 0,5–1,0 ч. Кристаллы распределяются по периферии ротора толщиной 1–5 см. Кристаллы промывают холодной водой (10°С) в течение 15–20 мин. Объём воды составляет 10–15 % от объёма исходной суспензии Полученные кристаллы с содержанием основного вещества не ниже 96 % (в случае глутаминовой кислоты) промывают обессоленной водой и направляют на сушку. 41 Центрифуга EquipNet.Inc
Слайд 42
Сушка кристаллов глутаминовой кислоты Проводится в вакууме или в токе нагретого воздуха при 60-70°С. 42 Барабан вакуумной сушки BIORUS GV150
Слайд 43
В производстве глутаминовой кислоты маточные растворы перерабатываются в продукт ГМЖ (глутаминовый маточник с жомом), в состав которого входит свекловичный жом или высушенная биомасса продуцента, или пшеничные отруби. Маточный раствор (вместе с промывными водами) представляет собой жидкость коричневого цвета, содержащую 35–37 % СВ, из которых 75 % приходится на органические вещества. Содержание глутаминовой кислоты составляет 5–8 %, других аминокислот 4–5 %, сахаров 3–15 %, азотистых веществ 8–12 % от суммы органических веществ. В производстве ГМЖ маточный раствор упаривают в ВВУ до 45–50 % СВ и собирают в сборник. В смеситель загружают свекловичный жом и приливают упаренный маточник до соотношения 1:1 по массе. С целью получения однородной массы смесь перемешивают в течение 2 ч. Затем высушивают в распылительной сушилке горячим воздухом с температурой на входе 120–125 °С и на выходе 65–70 °С до остаточной влажности 10–12 %. Выход ГМЖ составляет 7,5–9,0 кг/кг глутаминовой кислоты. В производстве глутаминовой кислоты предусматривается производство ещё одного кормового препарата – ОБГК (осажденная биомасса глутаминовой кислоты), который на 30 % состоит из органических веществ и на 70 % из ортофосфата кальция. Производство ОБГК включает следующие операции: • Осадок биомассы снимают с фильтр-пресса, продувают горячим воздухом и подсушивают до 20–40 % СВ, затем сбрасывают в бункер, подают транспортёром на гранулятор и далее на ленточную сушилку. Сушат биомассу так же, как и ГМЖ. • Сухие гранулы ОБГК, содержащие 6–8 % влаги пневмотранспортом подают на фасовку по 15 – 20 кг в бумажные крафт-мешки с полиэтиленовым вкладышем. Полиэтиленовый вкладыш заклеивают, мешки зашивают на мешкозашивочной машине. Выход ОБГК – до 2 кг/кг моногидрата глутамата натрия. 43
Слайд 44
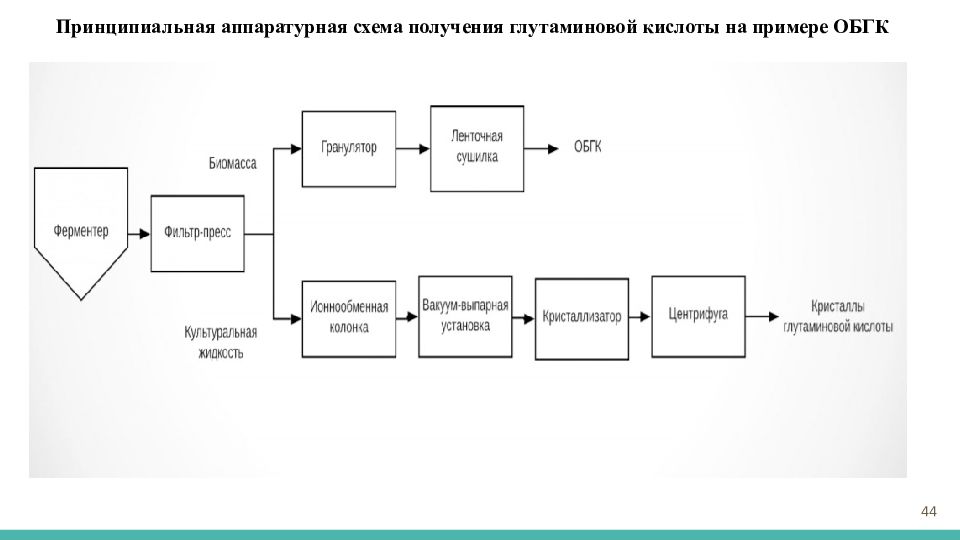
Принципиальная аппаратурная схема получения глутаминовой кислоты на примере ОБГК 44
Слайд 45
Обычно глутаминовую кислоту выпускают в виде натриевой соли – глутамата натрия. Для получения глутамата натрия влажные кристаллы с содержанием 98–99% глутаминовой кислоты по сухой массе растворяют и нейтрализуют 45–50%-ным раствором NaOH до рН 6,8. Расход гидроксида натрия составляет 90 % от требуемого по стехиометрии для получения моногидрата глутамата натрия. Для лучшего растворения смесь нагревают до 60–80 °С глухим паром. Далее происходит фильтрация горячего раствора на нутч-фильтре через слой активированного угля для очистки от взвешенных частиц и пигментов. Уголь берут в количестве 1,5 % от массы раствора. Затем его промывают водой, взятой в количестве 5 % от массы исходного раствора. Промывные воды объединяют с фильтратом, а уголь повторно используют в производстве глутаминовой кислоты на стадии перекристаллизации. Фильтрат подщелачивают 40 %-ым раствором гидроксида натрия до рН 6,8–7,0 и направляют на вакуум-выпарную установку (ВВУ). Упаривание раствора глутамата натрия проводят на ВВУ в тех же условиях, что и в производстве глутаминовой кислоты до содержания 57–60 СВ % (63–66 % в расчете на моногидрат). Конденсат собирают и используют в производстве. Упаренный раствор заливают в аппарат-кристаллизатор и кристаллизуют до содержания глутамата натрия в маточном растворе 40 г/л. Суспензию кристаллов направляют на центрифугирование. Центрифугирование осуществляют так же как и в производстве глутаминовой кислоты при 5000–6000 об/мин в течение 0,5–1,0 ч. Полученные кристаллы имеют влажность около 6 %. Их направляют на сушку в вакуум-сушильном шкафу. Маточный раствор используют для приготовления суспензии глутаминовой кислоты на стадии нейтрализации. Такую операцию проводят не более 5 циклов подряд, а далее маточный раствор возвращают на стадию производства подкисленного фильтрата культуральной жидкости. 45
Слайд 47: Контроль производства
На биосинтез глутаминовой кислоты существенное влияние оказывают степень аэрации среды, перемешивание, рН среды, длительность и температура ферментации, возраст и доза посевного материала. Поэтому на всех стадиях процесса все параметры культивирования строго регламентируются и контролируются (температура, рН, изменение основных компонентов среды, накопление глутаминовой кислоты, аэрация, перемешивание и т.д.). Уровень рН среды. Это очень ответственный параметр процесса. Как известно, продуцентами являются бактериальные штаммы, и потому в большинстве случаев оптимум рН для культивирования лежит в области, близкой к нейтральной или слабощелочной. Для штаммов, используемых в нашей стране, наилучшие результаты по биосинтезу глутаминовой кислоты получаются, если рН среды поддерживается около 7–7,2. Для всех известных продуцентов глутаминовой кислоты рН, обеспечивающей максимальное накопление глутаминовой кислоты и рост культуры, лежит в пределах от 6 до 8,5. Аэрирование Снабжение растущей культуры кислородом является ответственным и важным фактором, влияющим на рост микроорганизма и образование им продукта. Кислород, используемый бактериальной клеткой, должен быть растворен в питательной среде. Для увеличения растворимости кислорода осуществляют барботирование среды воздухом с одновременным ее перемешиванием. Оптическая плотность Контроль за ходом процесса биосинтеза осуществляют на разных этапах его проведения по оптической плотности раствора культуральной жидкости (по содержанию клеток продуцента), по содержанию субстрата в смеси или по сигналам датчиков рН и растворенного кислорода в ферментационной среде. К концу процесса биосинтеза содержание глутаминовой кислоты в культуральной жидкости достигает не менее 45 г./л, концентрация оставшегося субстрата не более 0,5–1,0%. 47
Слайд 48: Товарная форма. Условия и сроки хранения
Глутаминовая кислота продаётся в аптеках в форме таблеток. Условия хранения: в сухом, защищенном от света месте при температуре не выше 25 °С. Сроки хранения - 3-4 года. В форме порошка срок годности чаще всего 1-3 года. Условия хранения аналогичные: хранение в сухом прохладном месте, защищенном от света, в плотно закрытой упаковке при температуре не выше 25°С и относительной влажности воздуха не более 75%, в оригинальной упаковке. 48
Последний слайд презентации: Глутаминовая кислота: Список литературы
Промышленная биотехнология : электронный курс лекций для студентов специальности 1-48 02 01 «Биотехнология» / Н. С. Ручай, О. В. Остроух. – Минск : БГТУ. - 2013. – С. 23-27 Фармацевтическая биотехнология: Производство биологически активных веществ: учеб. пособие : в 2 ч. - Ч.2./ Ю.М. Краснопольский, Н.Ф. Клещев. - Харьков: НТУ “ХПИ”. - 2019. - С.25-27 Нижегородова Т. А., Гусева Е. В., Меньшутина Н. В., Будран Ж., Горжен Ж. -л, Гедон Э., Делонэ C., Фурнье Ф. Математическое моделирование производства L-глутаминовой кислоты // Известия ВУЗов. Химия и химическая технология. - 2007. - №10. - С. 93-97 Нижегородова Т. А. Исследование процессов микробиологического синтеза в условиях теплового шока (на примере получения Lглутаминовой кислоты):дис....К.т.н.:05.17.08 Процессы и аппараты химической технологии, защищена в 2007. - Московский Государственный Университет Прикладной Биотехнологии (МГУ ПБ).- Российская Федерация. -2007. - 92 с. Тринеева О. В. Теоретические и методологические подходы к стандартизации и оценке качества лекарственного растительного сырья и масляных экстрактов на его основе:дис....Д.ф.н.:14.04.02 – Фармацевтическая химия, фармакогнозия, защищена в 2016. - Воронежский государственный университет. - Российская Федерация. -2016. - 441с. Глутаминовая кислота и ее соли | Импорт и Экспорт | 2019 [Электронный ресурс]: база данных. / TrendEconomy. – База данных – Болгария, 2021. -. – режим доступа к базе данных.: https://trendeconomy.ru/abou t Краткий обзор рынка глутамата натрия [Электронный ресурс]: база данных. / Исследовательская компания «Abercade». – База данных – Млсква, 1999-2021. -. – режим доступа к базе данных.: http://www.abercade.ru/ Сыровая А.О., Шаповал Л.Г., Макаров В.А., Петюнина В.Н., Грабовецкая Е.Р., Андреева С.В., Наконечная С.А., Бачинский Р.О., Лукьянова Л.В., Козуб С.Н., Левашова О.Л. Аминокислоты глазами химиков, фармацевтов, биологов: в 2-х т. Том 1 / − Х. «Щедра садиба плюс», 2014 – С.27-83 Гусятинер М. М. Создание продуцентов аминокислот на основе бактерий Corynebacterium glutamicum и Escherichia coli; исследование механизмов продукции:дис...Д.б.н.: 03.02.07 – Генетика, защищена в 2017. - Закрытое акционерное общество «Научно-исследовательский институт Аджиномото-Генетика». -Российская Федерация. -2017. - 231с. Музыченко Л.А. Принципы синтеза математических моделей микроорганизмов. //Микробиологическая промышленность. 1974. - № 2. - С. 3-6. Uy D, Delaunay S, Germain P, Engasser JM, Goergen JL. Instability of glutamate production by Corynebacterium glutamicum 2262 in continuous culture using the temperature-triggered process/ J Biotechnol. - 2003. - V. 104. - P.173–184. Van der Rest ME, Lange C, Molenaar D. A heat shock following electro-poration induces highly efficient transformation of Corynebacterium glutamicum with xenogeneic plasmid DNA / Appl Microbiol Biotechnol. - 1999- V.52. - P.541–545 49