Первый слайд презентации: ИДЕАЛ ГАЗ
Орындаған: Тажаддинов О. Какімсеит А. Тексерген: аға-оқытушы Әлімтаева А.А. ИДЕАЛ ГАЗ Алматы 2015
Слайд 2: Жоспар
1.Идеал газ 2. Менделеев- Клапейрон теңдеуі 3. Бойль–Мариотт заңы 4. Гей-Люссак заңы 5. Идеалды газдар қоспасы 6. Идеал газ күйінің теңдеуі 7. Изотермалық процесс 8. Изобаралық процесс 9. Изохоралық процесс
Слайд 3: ИДЕАЛ ГАЗ
Идеал газ – бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі. Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен – Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль–Мариотт заңы және Гей-Люссак заңымен сипатталады
Слайд 4: Менделеев- Клапейрон теңдеуі
1834 жылы француз ғалымы Клапейрон Бойль- Мариот және Гей-Люссак заңдарын біріктіре отырып, ( р,Т, V) параметрлерінің үшеуі де өзгергенде жүретін процестерді сипаттайтын теңдеуді алды. Бұл теңдеу Клапейрон теңдеуі деп аталады.
Слайд 5: Бойль–Мариотт заңы
Бойль-Мариотт заңы ( кейде Бойль заңы ) – газ туралы негізгі заңдылықтардың бірі. Тұрақты температурадағы газдың көлемі мен қысымының арасындағы байланысты анықтайтын заң. Бұл заңды ағылшын ғалымы Роберт Бойль (1662 жылы ) ашқан pV = const Бойль-Мариотт заңының көмегімен реал газдың қысымы мен көлемі арасындағы байланыс жуықтап қана анықталады. Үлкен қысымдағы және жоғары температурадағы газ қасиеттерінде бұл заңнан күрт ауытқушылық байқалады. Өйткені, мұндай жағдайдағы зат молекулаларының көлемі мен оның бір-бірімен әсерлесуін еске алуға тура келеді. Бойль-Мариотт заңы идеал газдар үшін дәл орындалады.
Слайд 6: Идеалды газдар қоспасы
Жылулықты қолданатын машиналардың жұмыстық денесі ретінде, әртүрлі газдардың қоспасын қолданады. Олар үшін, R қос болуы қажет. Әрбір құрамды бөлікке кіретін қоспалар, қоспаның толық көлемімен толады, бірақ, онда олар өзінің парциалды қысымында болады : Дальтон заңы бойынша P= і Газды қоспаның т массасы үшін, дұрысында дәл осындай түріндегі теңдеу түрі : PV = RT
Слайд 8: Изотермалық процесс
1667ж. Бойль (ағылшын) Мариотт(француз) Бойль-Мариотт заңы берілген газдың, берілген массасы үшін тұрақты температурадағы қысым мен көлемнің көбейтіндісі тұрақты шама
Слайд 9: Изобаралық процесс
1802ж. Гей-Люссак (француз) Гей-Люссак заңы газдың берілген массасының тұрақты қысымында көлемі температураға тура пророрционал (түзу сызықты байланыста)
Слайд 10: Изохоралық процесс
1787 ж. Шарль(фр) Шарль заңы газдың берілген массасы үшін тұрақты көлемде қысымның температураға қатынасты тұрақты шама
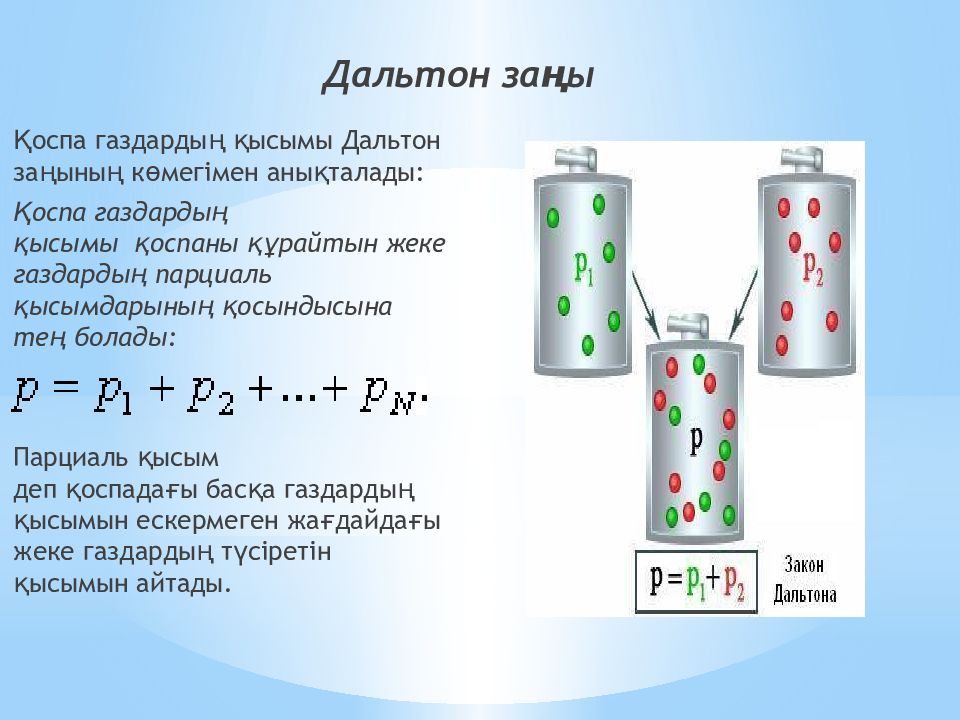
Слайд 11: Дальтон заңы
Қоспа газдардың қысымы Дальтон заңының көмегімен анықталады: Қоспа газдардың қысымы қоспаны құрайтын жеке газдардың парциаль қысымдарының қосындысына тең болады: Парциаль қысым деп қоспадағы басқа газдардың қысымын ескермеген жағдайдағы жеке газдардың түсіретін қысымын айтады.