Первый слайд презентации: Идеал газ. МКТ-ның негізгі теңдеуі. Менделеев – Клайперон теңдеуі. Изопроцесстер
Физика пәнінің мұғалімі: Оңғарбай Ж http://www.zhangozy.wordpress.com
Слайд 2: Термодинамикалық параметрлер
Термодинамикалық параметрлер деп макродененің күйін сипаттайтын физикалық шамаларды айтады. Оған қысым, көлем, температура жатады. Термодинамикалық процесс дегеніміз қандай да бір термопараметрдің өзгеру құбылысы немесе жүйенің бір күйден екінші күйге өтуі. Барлық макроденелер микроденелерден (атомдар мен молекулалардан) тұрады. www.zhangozy.wordpress.com
Слайд 3: Идеал газ
дегеніміз молекулалары шексіз аз көлем алатын серпімді шариктер болып табылатын және өзара әрекеттесуі тек олардың бір бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана білінетін газ болып табылады. Есептеулерді жеңілдету үшін МКТ нақты газдардың қарапайым физикалық моделі – идеал газ моделі енгізілді. www.zhangozy.wordpress.com
- теңдеуі молекулалық-кинетикалық теорияның негізгі теңдеуі деп аталады. Оны бұлай атау себебі: Ол макро және микродүниелерді байланыстырып тұр; Тәжірибе арқылы алынған барлық газ заңдарын теориялық жолмен алуға мүмкіндік береді; Ол микроәлемде өтіп жатқан процестер жайлы ақпарат береді. Негізгі теңдеуді былай да жазуға болады: www.zhangozy.wordpress.com
Слайд 5: Менделеев-Клапейрон теңдеуі
Термодинамикалық параметрлерді байланыстыратын теңдеу газ күйінің теңдеуі немесе Менделеев –Клаперйрон теңдеуі деп аталады. Универсал газ тұрақтысы дегеніміз заттың 1 молінің температурасы 1К-ге арттыру үшін оған қанша жылу мөлшерін беру қажет екенін көрсететін физикалық шама: www.zhangozy.wordpress.com
Слайд 6: Изопроцестер -газ заңдары
Т ермодинамикалық жүйеде бір макроскопи я лық параметрі тұрақты, ал қалған екеуі тұрақты бол ма са, онда оны : изопроцестер де п аталады. www.zhangozy.wordpress.com
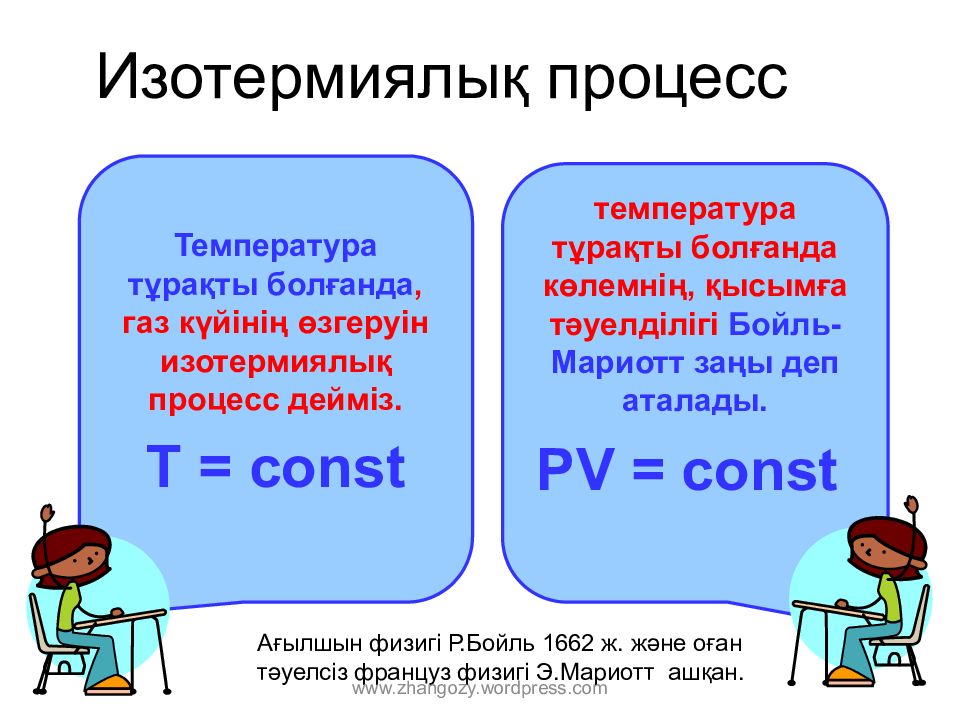
Слайд 7: Изотерми ялық процесс
Т емператур а тұрақты болғанда, газ күйінің өзгеруін изотерми ялық процесс дейміз. T = const температура тұрақты болғанда көлемнің, қысымға тәуелділігі Бойль - Мариотт заңы деп аталады. PV = const Ағылшын физигі Р.Бойль 1662 ж. және оған тәуелсіз француз физигі Э.Мариотт ашқан. www.zhangozy.wordpress.com
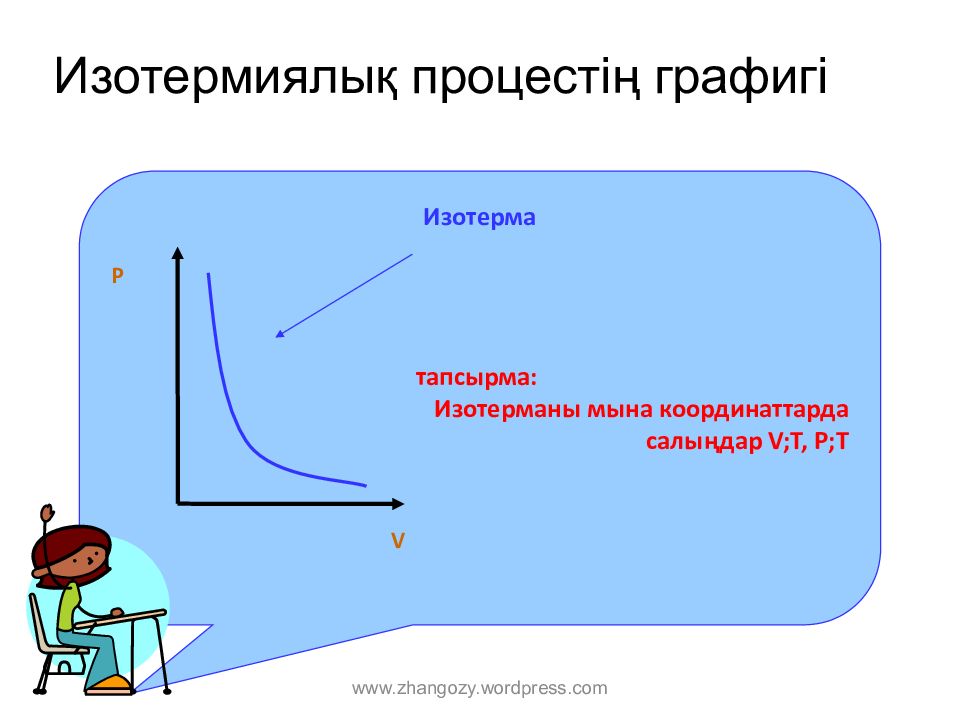
Слайд 8: И зотерми ялық процес тің графигі
Изотерма тапсырма : Изотерманы мына координат тарда салыңдар V;T, P;T V P www.zhangozy.wordpress.com
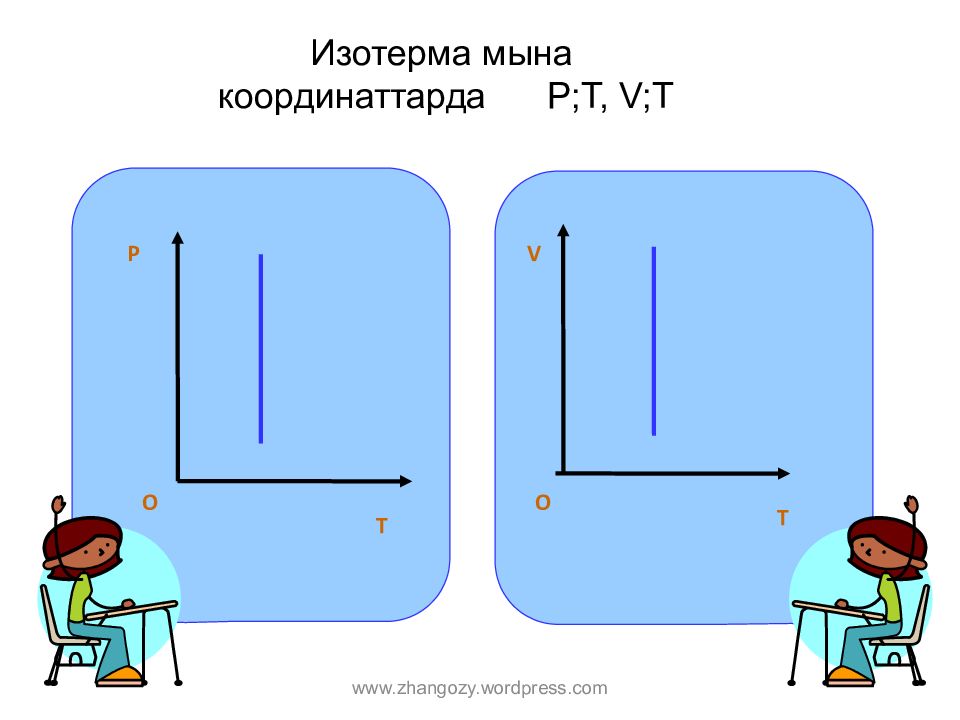
Слайд 9: Изотерма мына координат тарда P;T, V;T
P T O T V O www.zhangozy.wordpress.com
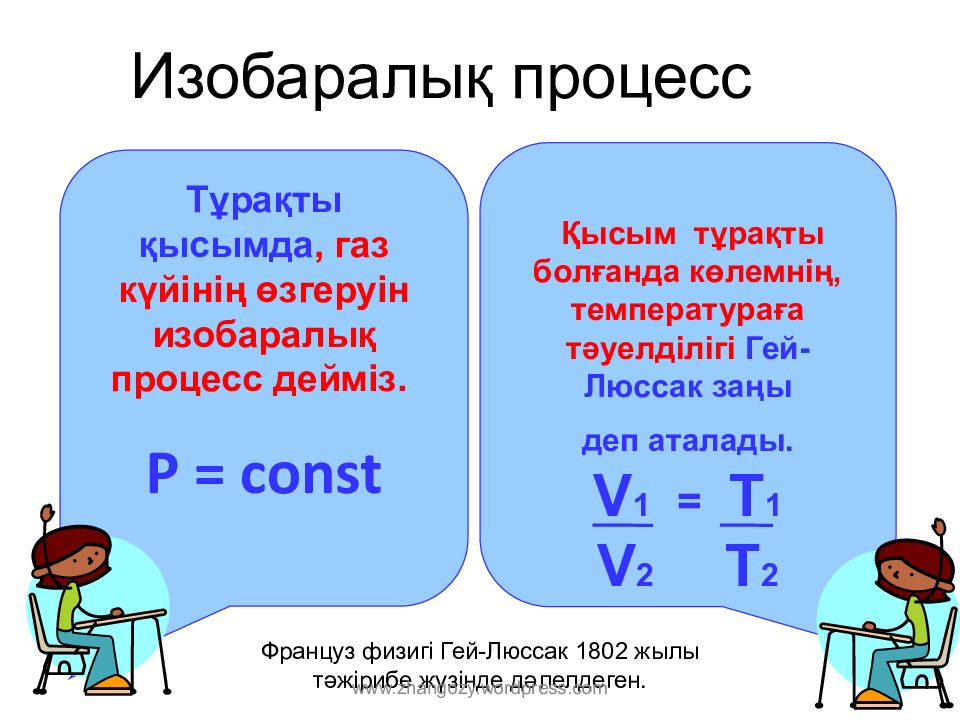
Слайд 10: Изобар алық процесс
Тұрақты қысымда, газ күйінің өзгеруін изо баралық процесс дейміз. Р = const Қысым тұрақты болғанда көлемнің, температураға тәуелділігі Гей-Люссак заңы деп аталады. V 1 = T 1 V 2 T 2 Француз физигі Гей-Люссак 1802 жылы тәжірибе жүзінде дәлелдеген. www.zhangozy.wordpress.com
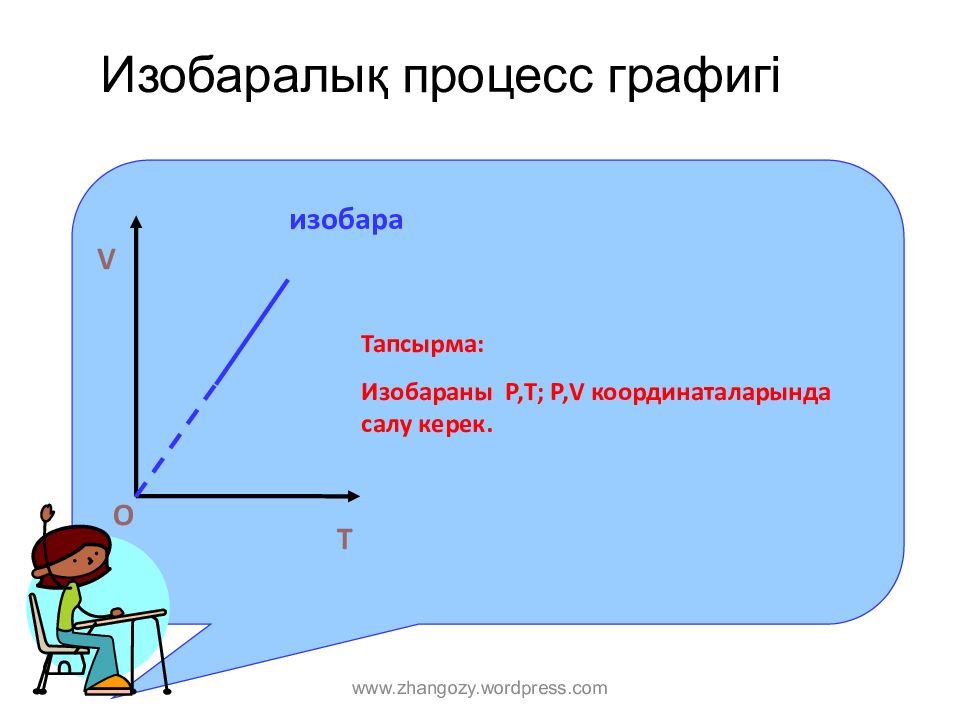
Слайд 11: Изобаралық процесс графигі
T V O изобара Тапсырма : И зобар аны Р,Т; Р,V координаталарында салу керек. www.zhangozy.wordpress.com
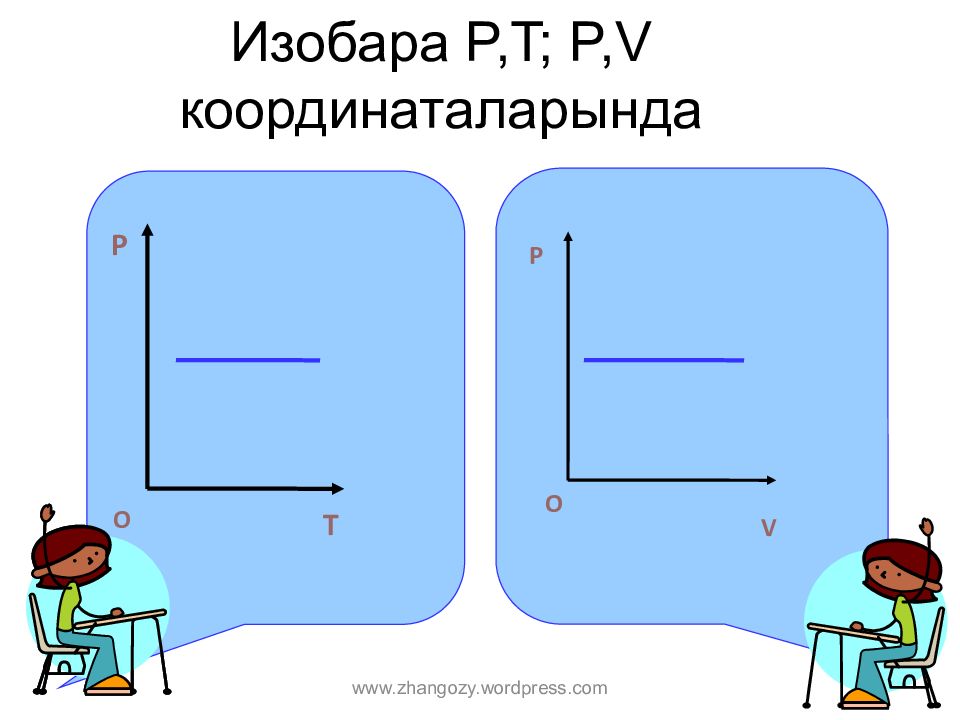
Слайд 12: Изобара P,T; P,V координата ларында
P T O P O V www.zhangozy.wordpress.com
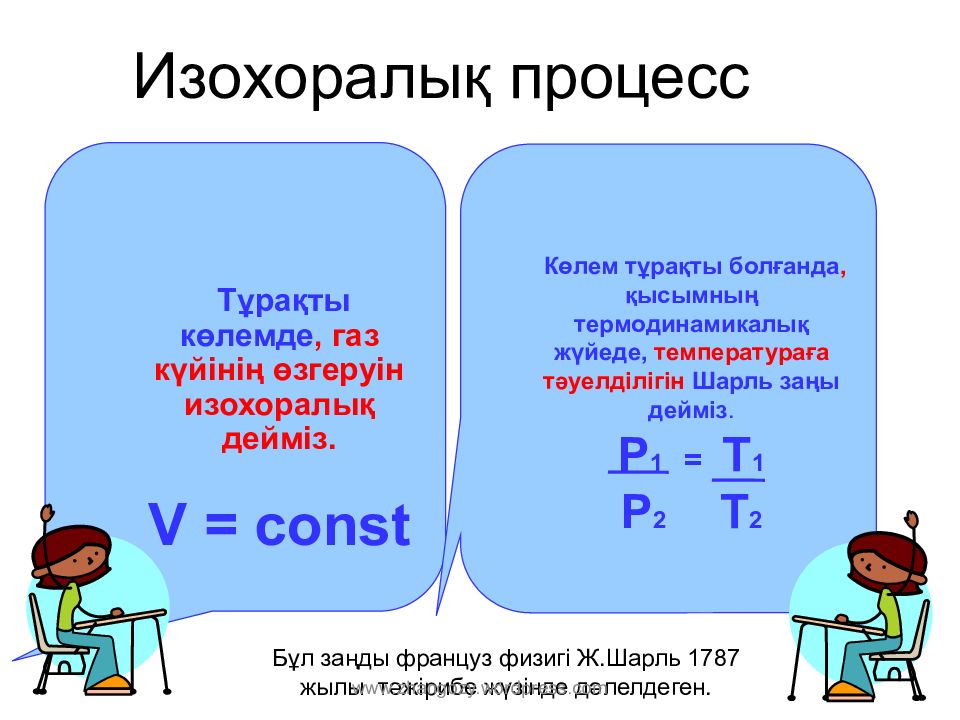
Слайд 13: Изохор алық процесс
Тұрақты көлемде, газ күйінің өзгеруін изохор алық дейміз. V = const К өлем тұрақты болғанда, қысымның термодинамикалық жүйеде, те мператураға тәуелділігін Шарл ь заңы дейміз. P 1 = T 1 P 2 T 2 Бұл заңды француз физигі Ж.Шарль 1787 жылы тәжірибе жүзінде дәлелдеген. www.zhangozy.wordpress.com
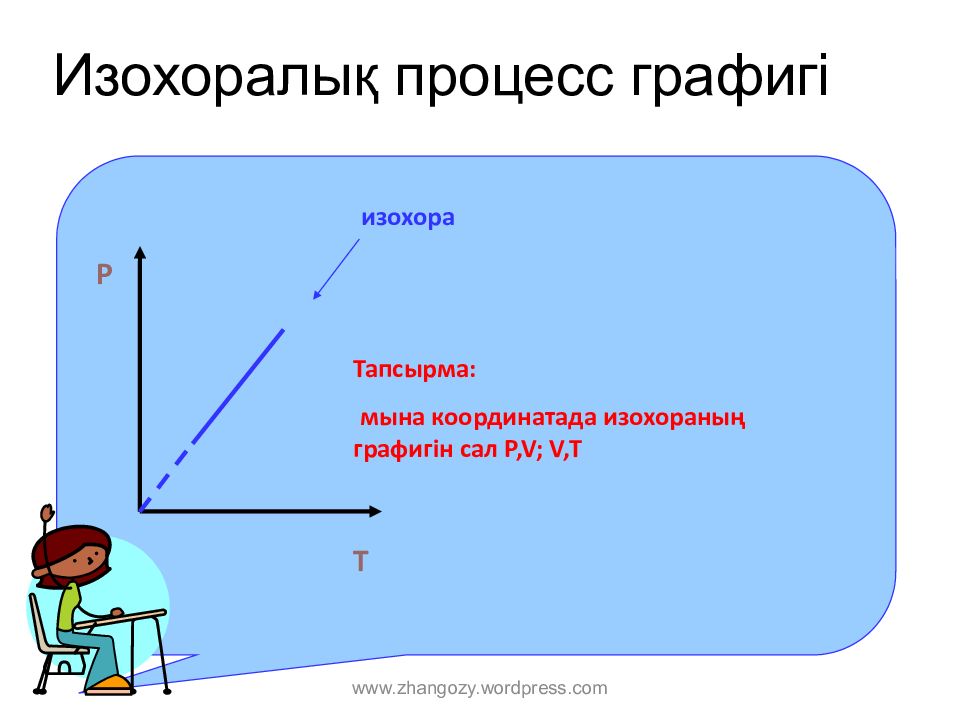
Слайд 14: И зохор алық процесс графигі
P O T изохора Тапсырма : мына координатада изохораның графигін сал P,V; V,T www.zhangozy.wordpress.com
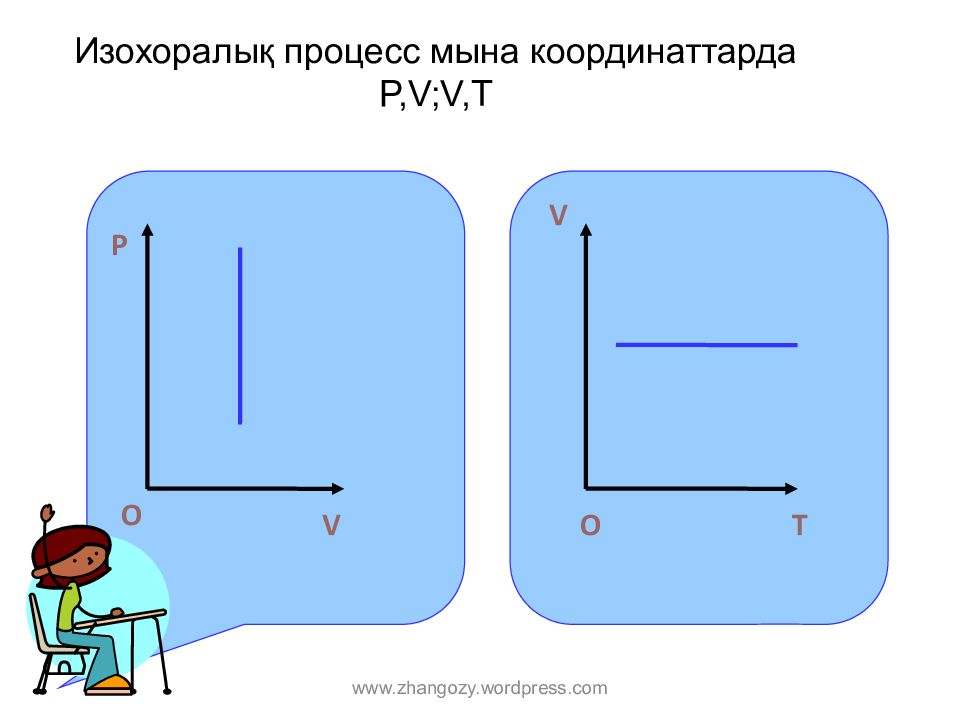
Слайд 15: Изохор алық процесс мына координат тарда P,V;V,T
О T V O O P V O www.zhangozy.wordpress.com
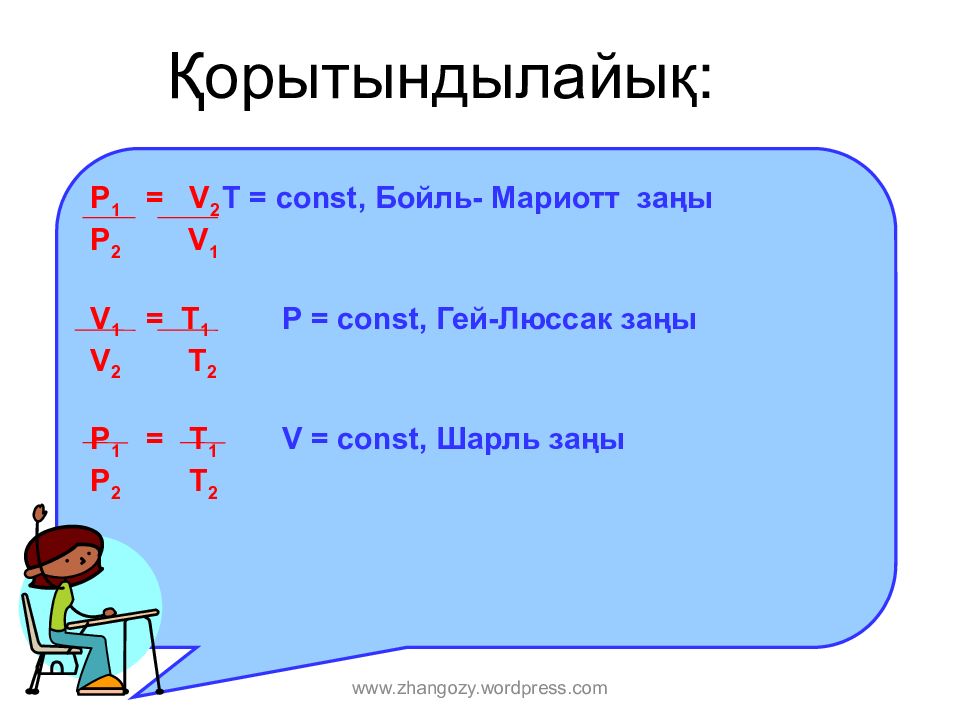
Слайд 16: Қорытындылайық:
P 1 = V 2 T = const, Бойл ь - Мариотт заңы P 2 V 1 V 1 = T 1 Р = const, Гей-Люссак заңы V 2 T 2 P 1 = T 1 V = const, Шарл ь заңы P 2 T 2 www.zhangozy.wordpress.com
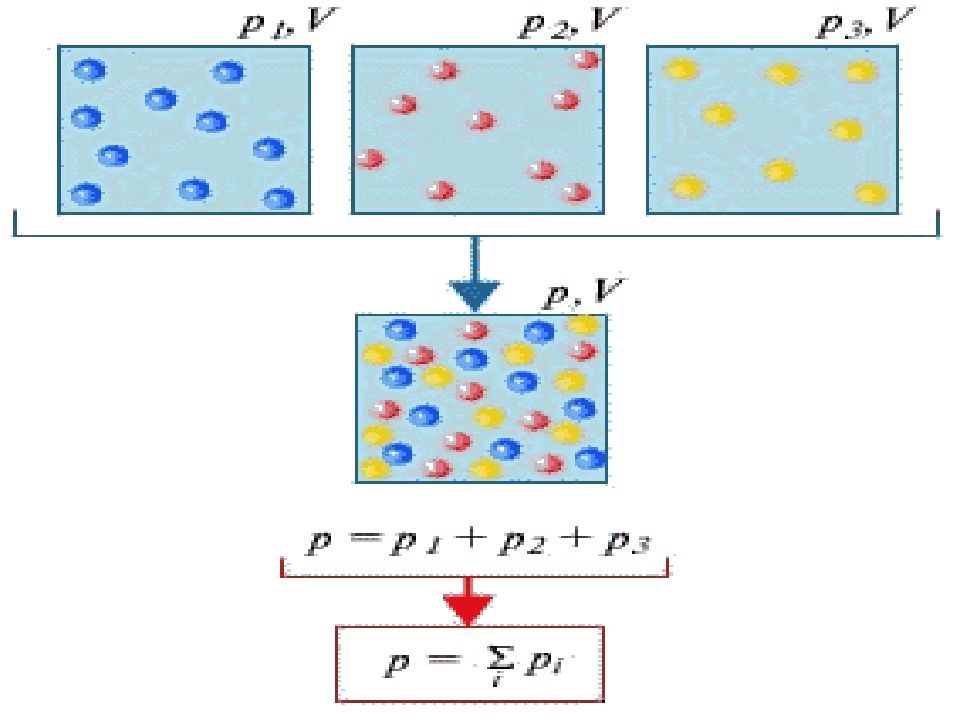
Слайд 17: Дальтон заңы
Үлестік (парциал) қысым деп газ қоспасының әрбір газы осы көлемді жалғыз өзі алатын кездегі қысымды айтады. Дальтон газ қоспасының қысымы осы қоспаға кіретін барлық газдардың үлестік қысымдарының қосындысына тең болатынын тағайындады: www.zhangozy.wordpress.com