Слайд 2
Особая роль глюкозы как универсального энергетического субстрата для всех клеток организма заключается в том, что при ее катаболизме АТФ может синтезироваться как в аэробных, так и анаэробных условиях. Существует 3 метаболических пути, в которых может окисляться глюкоза. Аэробный гликолиз Анаэробный гликолиз Аэробный распад глюкозы до СО 2 и Н 2 О
Слайд 3
Аэробный гликолиз – превращение глюкозы в 2 молекулы пирувата, которое происходит в аэробных условиях и сопровождается синтезом 8 молекул АТФ. Анаэробный гликолиз – образование из глюкозы 2 молекул лактата без участия кислорода и митохондриальной ЦПЭ. Энергетический выход процесса составляет 2 молекулы АТФ. Аэробный распад глюкозы до СО 2 и Н 2 О включает аэробный гликолиз и последующее окисление 2 молекул пирувата в общем пути катаболизма. При аэробном распаде глюкозы синтезируются 38 молекул АТФ.
Слайд 4
Аэробный и анаэробный гликолиз имеет не только энергетическое, но и анаболическое значение, так как промежуточные метаболиты и конечные продукты этих процессов могут использоваться для синтеза многих соединений. В жировой ткани и печени гликолиз обеспечивает образование субстратов, необходимых для синтеза жиров. В печени из лактата синтезируется глюкоза, а из пирувата – аминокислоты. В эритроцитах при анаэробном гликолизе образуется 2,3-бисфосфоглицерат – аллостерический регулятор сродства гемоглобина к кислороду.
Слайд 5
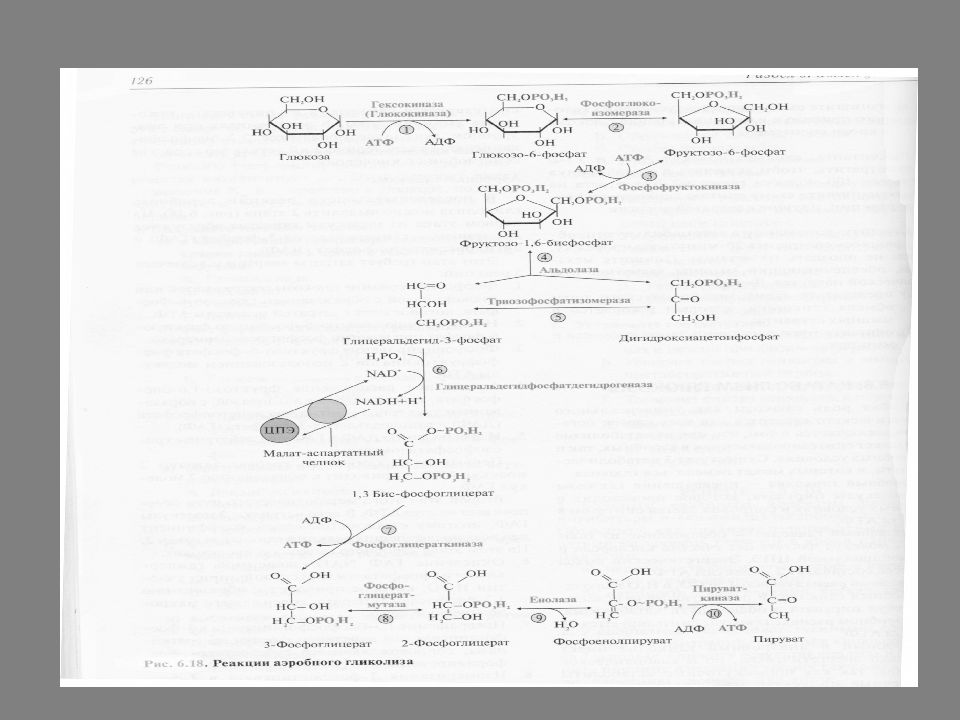
АЭРОБНЫЙ ГЛИКОЛИЗ В последовательности реакций аэробного гликолиза можно выделить 2 этапа. На первом этапе из молекулы глюкозы образуются две триозы – глицеральдегид-3-фосфат (ГАФ) и дигидроксиацетонфосфат (ДАФ). Первый этап гликолиза требует затраты 2 молекул АТФ и приводит к образованию 2 молекул ГАФ. Включает 5 реакций.
Слайд 6
фосфорилирование глюкозы гексокиназой или глюкокиназой с образованием глюкозо -6- фосфата, которое идет с затратой молекулы АТФ 2. изомеризация глюкозо -6- фосфата во фруктозо-6- фосфат при участии фосфофглюкоизомеразы 3. фосфорилирование фруктозо-6-фосфат фосфофруктокиназой с использованием молекулы АТФ и с образованием фруктозо-1,6-бисфосфата 4. альдольное расщепление фруктозо-1,6-бисфосфата, катализируемое альдолазой, с образованием двух триоз - глицеральдегид-3-фосфата (ГАФ) и дигидроксиацетонфосфата (ДАФ) 5. изомеризацию ДАФ и ГАФ под действием триозофосфатизомеразы
Слайд 7
Второй этап этого метаболического пути обеспечивает синтез АТФ. В него вступают 2 молекулы глицеральдегид-3-фосфат ( ГАФ), поэтому стехиометрический коэффициент для всех последующих реакций гликолиза равен 2.
Слайд 8
6. окисление ГАФ NAD + -зависимой глицеральдегидфосфат-дегидрогеназой при участии Н 3 РО 4, которое приводит к образованию 1,3-бисфосфоглицерата, содержащего макроэргическую связь 7. превращение 1,3-бисфосфоглицерата в 3-фосфоглицерат под действием фосфоглицераткиназы, сопровождающееся субстратным фосфорилированием АДФ. 8. изомеризация 3-фосфоглицерата в 2-фосфоглицерат, катализируемая фосфоглицеромутазой 9. дегидратация 2-фосфоглицерата ферментом енолазой с образованием фосфоенолпирувата, содержащего макроэргическую связь 10. образование пирувата из фосфоенолпирувата под действием пируваткиназы, сопряженное с субстратным фосфорилированием АДФ.
Слайд 10
В аэробном гликолизе есть 3 необратимые реакции, которые катализируют ферменты гексокиназа ( глюкокиназа ), фосфофруктокиназа, пируваткиназа. Единственная ОВР аэробного гликолиза – дегидрирование глицеральдегид-3-фосфат (ГАФ) – идет под действием NAD + -зависимой глицеральдегидфосфатдегидрогеназы. Акцептором 2 е и Н + в этой реакции является NAD +, который восстанавливается в NAD Н.
Слайд 11
Выход АТФ при аэробном гликолизе При аэробном гликолизе образуются 10 молекул АТФ, причем 6 из них – в результате окислительного фосфорилирования, 4 АТФ – при субстратном. 2 АТФ используются на первом этапе гликолиза в реакциях фосфорилирования глюкозы и фруктозо-6-фосфата. Следовательно суммарный энергетический выход АТФ при аэробном гликолизе составляет (6+4) - 2 = 8 АТФ.
Слайд 12
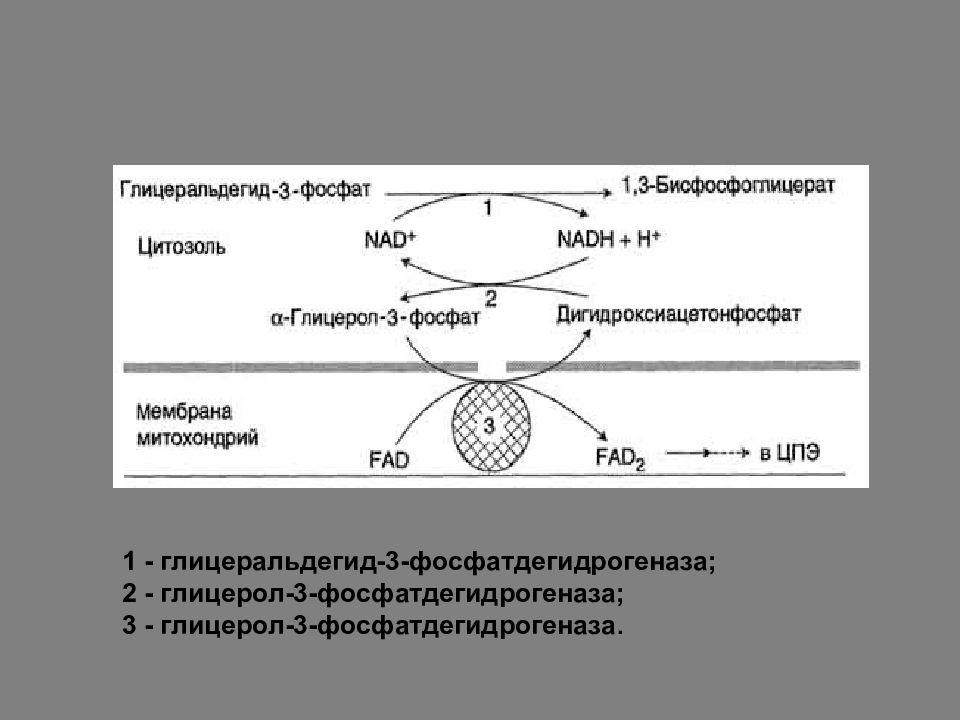
Все реакции гликолиза идут в цитоплазме клеток, но мембрана митохондрий непроницаема для NAD Н, поэтому транспорт водорода через митохондриальную мембрану осуществляется с помощью особых челночных механизмов.
Слайд 13
Малат-аспартатная челночная система Челночная система, в которой участвуют малат, цитозольная и митохондриальная малатдегидрогеназы, является более универсальной. В цитоплазме NADH восстанавливает оксалоацетат в малат, который при участии переносчика проходит в митохондрии, где окисляется в оксалоацетат NAD-зависимой малатдегидрогеназой.
Слайд 14
Восстановленный в ходе этой реакции NAD отдаёт водород в митохондриальную ЦПЭ. Однако образованный из малата оксалоацетат выйти самостоятельно из митохондрий в цитозоль не может, так как мембрана митохондрий для него непроницаема. Поэтому оксалоацетат превращается в аспартат, который и транспортируется в цитозоль, где снова превращается в оксалоацетат. Превращения оксалоацетата в аспартат и обратно связаны с присоединением и отщеплением аминогруппы. В результате происходит регенерация цитоплазматического NAD + из NADH.
Слайд 15
1,2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на ЦПЭ; 3,4 - транслоказы, обеспечивающие транспорт α-кетоглутарата, аспартата и глутамата и через мембрану митохондрий.
Слайд 16
Транспорт водорода в митохондрии с помощью малат-аспартатной системы позволяет получить 3 молекулы АТФ путем окислительного фосфорилирования
Слайд 17
Глицерофосфатная челночная система В этом случае образующийся в ОВР гликолиза NADH является донором водорода для восстановления ДАФ в г лицерол-3-фосфат цитоплазматической глицерол-3-фосфатдегидрогеназой. Глицерол-3-фосфат поступает в митохондрии и окисляется глицерол-3-фосфатдегидрогеназой (FAD-зависимым ферментом). Транспорт водорода в ЦПЭ с помощью этого механизма позволяет синтезировать 2 АТФ путем окислительного фосфорилирования.
Слайд 18
1 - глицеральдегид-3-фосфатдегидрогеназа; 2 - глицерол-3-фосфатдегидрогеназа; 3 - глицерол-3-фосфатдегидрогеназа.
Слайд 19
Аэробный распад глюкозы включает реакции аэробного гликолиза, заканчивающиеся образованием 2 молекул пирувата, которые далее превращаются в СО 2 и Н 2 О в общем пути катаболизма (ОПК) и митохондриальной ЦПЭ. Эти реакции идут в цитоплазме и митохондриях. Аэробный распад глюкозы – это основной путь катаболизма глюкозы в тканях. Для мозга глюкоза – основной энергетический субстрат.
Слайд 20
Анаэробный гликолиз позволяет синтезировать АТФ при недостатке кислорода в тканях, например, в мышцах в первые минуты мышечных сокращений и в эритроцитах. Первые 10 реакций анаэробного и аэробного гликолиза одинаковы, но в отличие от аэробного гликолиза, в анаэробном гликолизе при снижении поступления кислорода в митохондрии NADH, образующийся в результате дегидрирования ГАФ, не может использоваться в ЦПЭ. Он окисляется в цитоплазме в реакции, которую катализирует лактатдегидрогеназа (ЛДГ). Акцептором водорода в этой реакции является пируват, который превращается в лактат.
Слайд 22
Следовательно, последняя реакция анаэробного гликолиза, катализируемая ЛДГ, обеспечивает регенерацию NAD +, который необходим для работы глицеральдегидфосфатдегидрогеназы. АТФ при анаэробном распаде глюкозы образуется только в двух реакциях субстратного фосфорилирования.
Слайд 23
Образующийся в мышцах и эритроцитах лактат поступает в кровь и транспортируется в печень, где может превращаться в глюкозу или окисляться в пируват, который далее включается в ОПК. Лактат всегда присутствует в крови, но его концентрация может повышаться при снижении поступления кислорода в клетки.
Слайд 24
ЗНАЧЕНИЕ КАТАБОЛИЗМА ГЛЮКОЗЫ Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ. Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания)
Слайд 25
ЗНАЧЕНИЕ КАТАБОЛИЗМА ГЛЮКОЗЫ Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
Слайд 26
Кроме энергетической функции, процесс катаболизма глюкозы может выполнять и анаболические функции. Метаболиты гликолиза используются для синтеза новых соединений. Так, фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата - структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серии, глицин, цистеин. В печени и жировой ткани ацетил-КоА, образующийся из пирувата, используется как субстрат при биосинтезе жирных кислот, холестерина, а дигидроксиацетонфосфат как субстрат для синтеза глицерол-3-фосфата.
Слайд 28
Поскольку основное значение гликолиза состоит в синтезе АТФ, его скорость должна коррелировать с затратами энергии в организме. Большинство реакций гликолиза обратимы, за исключением трёх, катализируемых гексокиназой (или глюкокиназой), фосфофруктокиназой и пируваткиназой. Регуляторные факторы, изменяющие скорость гликолиза, а значит и образование АТФ, направлены на необратимые реакции. Показателем потребления АТФ является накопление АДФ и АМФ. Последний образуется в реакции, катализируемой аденилаткиназой: 2 АДФ ↔ АМФ + АТФ Даже небольшой расход АТФ ведёт к заметному увеличению АМФ.
Слайд 29
Отношение уровня АТФ к АДФ и АМФ характеризует энергетический статус клетки, а его составляющие служат аллостерическими регуляторами скорости как общего пути катаболизма, так и гликолиза.
Слайд 30
Существенное значение для регуляции гликолиза имеет изменение активности фосфофруктокиназы, так как этот фермент катализирует наиболее медленную реакцию процесса. Фосфофруктокиназа активируется АМФ, но ингибируется АТФ. АМФ, связываясь с аллостерическим центром фосфофруктокиназы, увеличивает сродство фермента к фруктозо-6-фосфату и повышает скорость его фосфорилирования. АТФ может взаимодействовать как с аллостерическим, так и с активным центром фермента, в последнем случае как субстрат.
Слайд 31
При физиологических значениях АТФ активный центр фосфофруктокиназы всегда насыщен субстратами (в том числе АТФ). Повышение уровня АТФ относительно АДФ снижает скорость реакции, поскольку АТФ в этих условиях действует как ингибитор: связывается с аллостерическим центром фермента, вызывает конформационные изменения и уменьшает сродство к его субстратам.
Слайд 32
Изменение активности фосфофруктокиназы способствует регуляции скорости фосфорилирования глюкозы гексокиназой. Снижение активности фосфофруктокиназы при высоком уровне АТФ ведёт к накоплению как фруктозо-6-фосфата, так и глюкозо-6-фосфата, а последний ингибирует гексокиназу. Следует напомнить, что гексокиназа во многих тканях (за исключением печени и β-клеток поджелудочной железы) ингибируется глюкозо-6-фосфатом.
Слайд 33
При высоком уровне АТФ снижается скорость цикла лимонной кислоты и дыхательной цепи. В этих условиях процесс гликолиза также замедляется. Аллостерическая регуляция ферментов ОПК и дыхательной цепи также связана с изменением концентрации таких ключевых продуктов, как NADH, АТФ и некоторых метаболитов.
Слайд 34
Так, NADH, накапливаясь в том случае, если не успевает окислиться в дыхательной цепи, ингибирует некоторые аллостерические ферменты цитратного цикла. Физиологическая роль гликолиза в печени и жировой ткани несколько иная, чем в других тканях. В печени и жировой ткани гликолиз в период пищеварения функционирует в основном как источник субстратов для синтеза жиров.
Слайд 35
В гликолитическом пути может протекать дополнительная реакция, катализируемая бисфосфоглицератмутазой, превращающей 1,3-бисфосфоглицерат в 2,3-бисфосфоглицерат (2,3-БФГ), который может при участии 2,3-бисфосфоглицерат-фосфатазы превращаться в 3-фосфоглицерат - метаболит гликолиза.
Слайд 36
В большинстве тканей 2,3-БФГ образуется в небольших количествах. В эритроцитах этот метаболит образуется в значительных количествах и выполняет роль аллостерического регулятора функции гемоглобина. 2,3-БФГ, связываясь с гемоглобином, понижает его сродство к кислороду, способствует диссоциации кислорода и переходу его в ткани. Образование 2,3-БФГ предполагает потерю энергии макроэргической связи в 1,3-бисфосфоглицерате, которая не переносится на АТФ, а рассеивается в форме теплоты, что означает снижение энергетического эффекта гликолиза.
Слайд 38
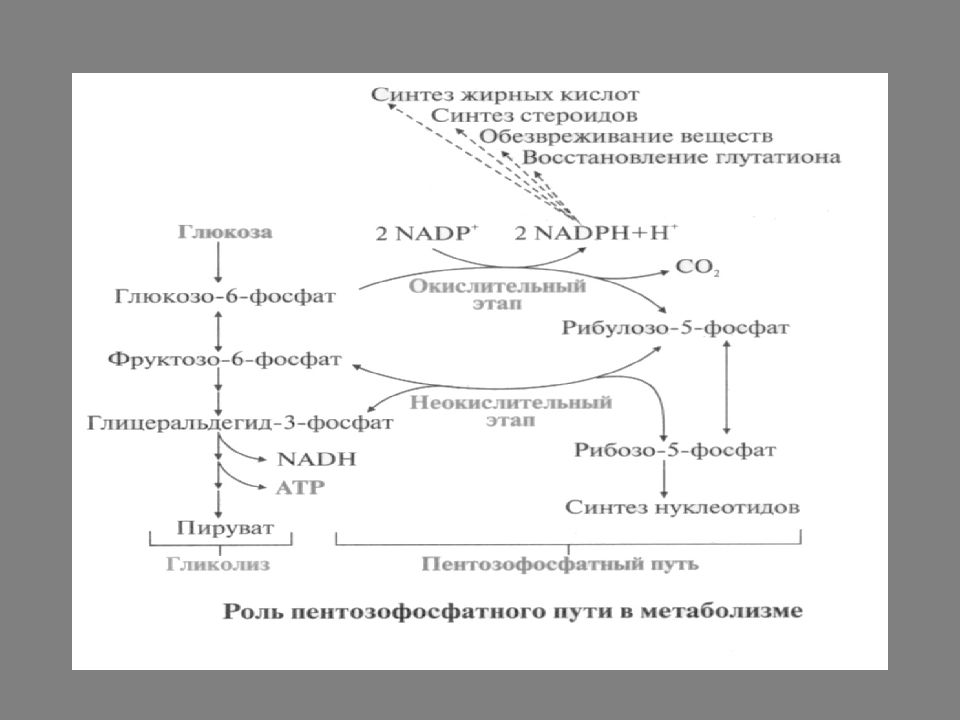
Глюкозо-6-фосфат может включаться в реакции пентозофосфатного пути. В этом процессе образуется рибозо-5-фосфат, необходимый для синтеза нуклеотидов, и восстанавливается кофермент NADP +. NADP Н является донором водорода в реакциях восстановления при синтезе жирных кислот, холестерола, стероидных гормонов, инактивации чужеродных веществ и обезвреживании активных форм кислорода.
Слайд 39
Реакции этого метаболического пути идут в большинстве тканей, но наиболее активно в печени, жировой ткани, эритроцитах. Все реакции этого метаболического пути идут в цитоплазме клеток и их можно разделить на два этапа: окислительный неокислительный
Слайд 41
превращение глюкозо-6-фосфата в 6-фосфоглюконолактон, катализируется NADP + - зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием NADPН. 2. превращение 6-фосфоглюконолактона в 6-фосфоглюконат под действием фермента глюконолактонгидратазы. 3. окислительное декарбоксилирование 6-фосфоглюконата с образованием пентозы рибулозо-5-фосфата и NADPН. Реакцию катализирует NADP + -зависимая 6-фосфоглюконат дегидрогеназа.
Слайд 42
Неокислительный этап пентозофосфатного пути включает серию обратимых реакций, в результате которых рибулозо-5-фосфат превращается в рибозо-5-фосфат.
Слайд 43
Промежуточные метаболиты гликолиза фруктозо-6-фосфат и глицеральдегид-3-фосфат, включаясь в реакции неокислительного пути, могут служить субстратами для синтеза рибозо-5-фосфата. С другой стороны, вследствие тог, что реакции пентозофосфатного пути обратимы, молекулы рибозо-5-фосфата, образующиеся при катаболизме нуклеотидов, могут превращаться в глицеральдегид-3-фосфат и фруктозо-6-фосфат, дальнейший катаболизм которых происходит в гликолизе и ОПК.
Слайд 44
Если в реакции пентозофосфатного пути вступают 6 молекул глюкозо-6-фосфата, то на окислительном этапе образуются 6 молекул рибулозо-5-фосфата и 6 молекул СО 2. Дальнейшее превращение 6 молекул рибулозо-5-фосфата на неокислительном этапе заканчивается образованием 5 молекул фруктозо-6-фосфата, которые под действием фосфоглюкоизомеразы могут превращаться в 5 молекул глюкозо-6-фосфата. Оба этапа этого метаболического пути образуют циклический процесс, суммарное уравнение которого можно представить так: 6 Глюкозо-6-фосфат + 12 NADP+ + 2 Н 2 О → 5 Глюкозо-6-фосфат + 12 NADPH +Н + + 6 СO 2.