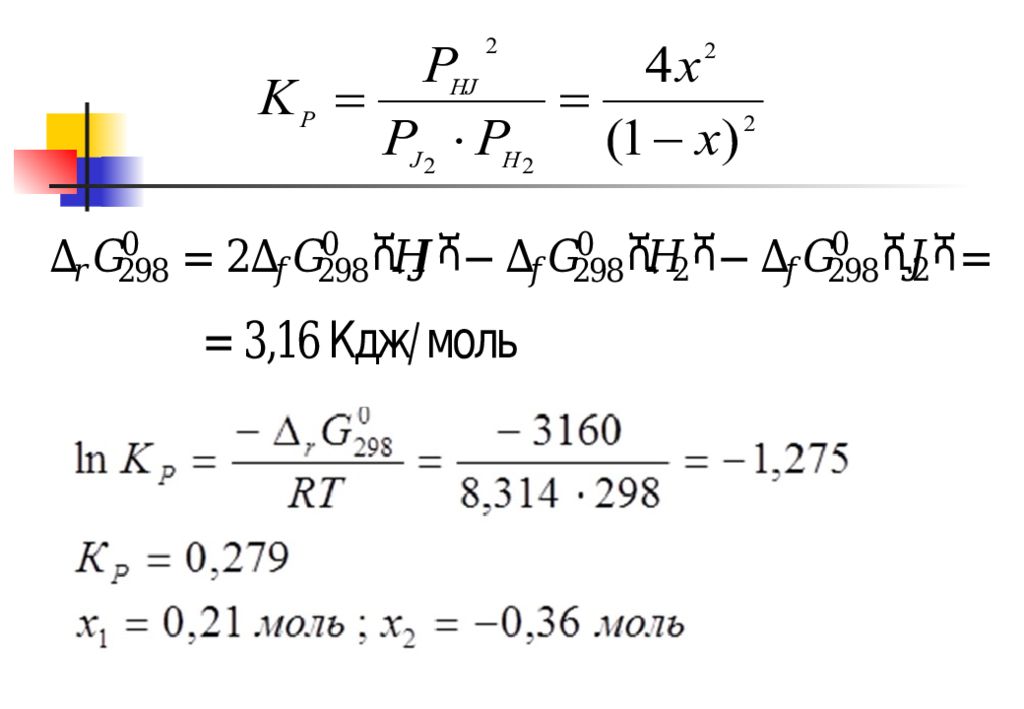Первый слайд презентации: Химическое равновесие
Термодинамика химического равновесия
Термодинамически равновесный процесс предполагает бесконечно медленное изменение всех свойств системы и не оставляет изменений в окружающей среде. При химическом равновесии прямая и обратная реакции протекают с определенными конечными скоростями и сопровождаются изменениями как внутри системы, так и в окружающей среде.
Слайд 3
В момент равенства скоростей прямой и обратной реакций суммарная скорость процесса в целом близка к нулю, то есть он протекает бесконечно медленно, и для его описания правомерно применять законы термодинамического равновесия. Самопроизвольный процесс сопровождается убылью свободной энергии, поэтому условием химического равновесия является её минимум:
Слайд 5
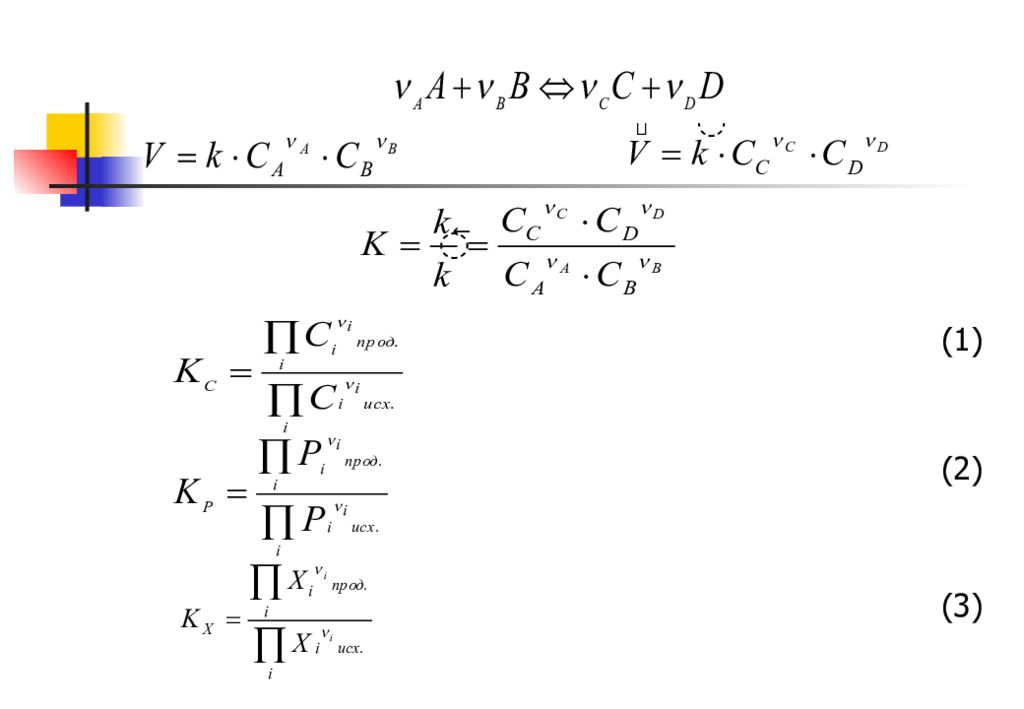
Константа равновесия химической реакции не зависит от абсолютных величин С i, Р i или х i, а только от их соотношения. В идеальных системах является истинной термодинамической константой при Т= const. (4) (5)
Слайд 6
(6) (7) В отличие от К Р и К С константа К Х зависит не только от температуры, но и от общего давления газовой смеси.
Слайд 7
Общее давление газовой смеси не влияет на смещение равновесия и выход продукта в обратимых реакциях, протекающих без изменения числа молей газообразных веществ. В случае реакции, сопровождающейся увеличением объема реакционной газовой смеси ( ∆ n >0 ), возрастание давления приводит к смещению равновесия в сторону обратной реакции и уменьшению выхода продукта. Для реакций, протекающих с уменьшением объема реакционной смеси ( ∆ n <0 ), возрастание давления приведет к сдвигу равновесия в сторону образования продуктов реакции.
при (P, Т ) = const : (8) (9) (10) (11)
Слайд 9
(12) Уравнение изотермы для неравновесного состояния системы: (13) – стандартная энергия Гиббса реакции при температуре Т; Р i – неравновесные парциальные давления реагирующих газов Уравнение изотермы для равновесного состояния : (14)
Слайд 10
(15) (16) (17) Уравнения изотермы химической реакции (13)-(15) или (16), (17) позволяют рассчитать константу равновесия по известной величине ТДП (или наоборот), установить направление самопроизвольного протекания процесса, определить состав реакционной смеси в равновесном и неравновесном состоянии.
Слайд 11: Зависимость константы равновесия от температуры. Уравнения изобары и изохоры химической реакции
(14) (18) (19)
Слайд 13: Интегрирование уравнения изобары (изохоры)
При интегрировании уравнения изобары необходимо знать температурную зависимость энтальпии. Если расчеты равновесий проводятся на небольшом температурном интервале, можно принять.
Слайд 16: Уравнения изобары и изохоры как количественная интерпретация принципа Ле Шателье – Брауна
Эндотермическая реакция Экзотермическая реакция С повышением температуры величина К Р увеличивается, равновесие смещается в сторону прямой реакции, выход продукта возрастает. С повышением температуры величина К Р уменьшается, равновесие смещается в сторону обратной реакции, выход продукта снижается.