Первый слайд презентации
НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ В СЛОЖНЫХ ХИМИЧЕСКИХ ПРОЦЕССАХ ЧАСТЬ 2: КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ Автор: Брусницына Л.А., доцент, к.х.н.
Слайд 2
ЛИТЕРАТУРА Физическая химия. Кн. 2, Электрохимия. Химическая кинетика и катализ : Учеб. Пособие для вузов: В 2-х кн. / Ред. К.С. Краснов. 3-е изд., испр. М. : Высшая школа, 2001. 319 с. : ил. Рек. М-вом образования РФ. Стромберг, А.Г. Физическая химия: учебник для хим. спец. вузов / А.Г. Стромберг, Д.П. Семченко; [под ред. А.Г. Стромберга]. 6-е изд., М. Высшая школа, 2006. 527 с.: ил. Рек. М-вом образования РФ. Библиогр. : с. 511-515. (а также ранние издания). Еремин, В.В. Задачи по физической химии: учеб. Пособие для вузов / В.В. Еремин, С.И. Каргов, И.А. Успенская, Н.Е. Кузьменко, В.В. Лунин. М.: Экзамен, 2005. 320 с.: ил. Краткий справочник физико-химических величин. Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой СПб.: «Иван Федоров», 2003. 240 с. ил.
Слайд 3
РАЗДЕЛ 3. КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ПРОСТЫХ РЕАКЦИЙ Основные понятия химической кинетики Химическая кинетика – это наука, изучающая протекание химической реакции или физико – химических процессов во времени, это раздел физической химии, в котором изучается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды, излучения и других факторов. Химическая кинетика позволяет рассчитать время заданной степени превращения вещества и найти наиболее эффективные факторы воздействия на скорость химической реакции.
Слайд 4
3.1. Классификация химических реакций С точки зрения кинетики существует несколько принципов классификации химических реакций: по агрегатному состоянию участников реакции все реакции делятся на гомогенные и гетерогенные. Гомогенными называются реакции, когда все реактанты находятся в одной фазе. Они бывают: а) газофазные б) жидкофазные в) твердофазные Гетерогенными называются реакции, когда участники реакции находятся в разных фазах; реакция протекает на границе раздела фаз
Слайд 5
2) по специфике элементарного акта а) каталитические б) некаталитические в) фотохимические г) электрохимические д ) цепные 3) по числу стадий а) простые (1 стадия) б) сложные 4) по обратимости реакций а) обратимые (двусторонние) б) необратимые
Слайд 6
Реакция считается необратимой, если: а) в результате реакции образуется газ HCOOH → H 2 O + CO 2 ↑ б) образуется труднорастворимое соединение AgNO 3 + KJ → AgJ ↓ + KNO 3 в) образуется малодиссоциируемое соединение HNO 3 + NaOH → NaNO 3 + H 2 O г) выделяется большое количество тепла 3Fe 3 O 4 + 8Al → 4Al 2 O 3 + 9Fe + ∆H↑
Слайд 7
3.2. Элементарные химические реакции Скорость химических реакций зависит от пути прохождения реакции. Этот путь может быть представлен в виде суммы элементарных химических реакций. Элементарная реакция – это односторонний процесс превращения одних компонентов в другие. Она является совокупностью однотипных элементарных актов химического превращения. Большинство химических реакций не являются элементарными; они включают в себя несколько элементарных стадий – сложные реакции. Механизм реакции – это совокупность элементарных стадий. Реактант – участник химической реакции. d ρ n k – бесконечно малое изменение числа молей компонента k в элементарной реакции ( ρ ) Если d ρ n k > 0 – продукт реакции d ρ n k < 0 – исходное вещество d ρ n k = 0 – индифферентное вещество
Слайд 8
3.3. Скорость химической реакции Скорость химической реакции – это число однотипных элементарных актов химического превращения, совершающихся в единицу времени в единице объема или на единице поверхности. Рассмотрим реакцию: t = 0 → t ≠ 0 → n A n B n C n D исходные числа молей текущие числа молей ( кси) ξ – глубина протекания реакций ξ = ξ d ξ
Слайд 9
Под скоростью химической реакции понимается производная по времени от глубины протекания реакции. W p W p x – плотность глубины реакции, x = V – объем реакционной системы x = = плотность скорости реакции W p ( V ) =
Слайд 10
тогда W p ( V ) = или W p ( V ) = Скорость химической реакции можно определить по изменению концентрации одного из компонентов реакции W ( V ) = Основной постулат Бекетова – Гульдберга – Вааги: Скорость химической реакции пропорциональна концентрации исходных веществ в степенях, равных их стехиометрическим коэффициентам где k – константа скорости реакции, если k определяется природой реакции, T и присутствием катализаторов; k называют удельной скоростью реакции. Этот постулат справедлив для простых одностадийных реакций.
Слайд 11
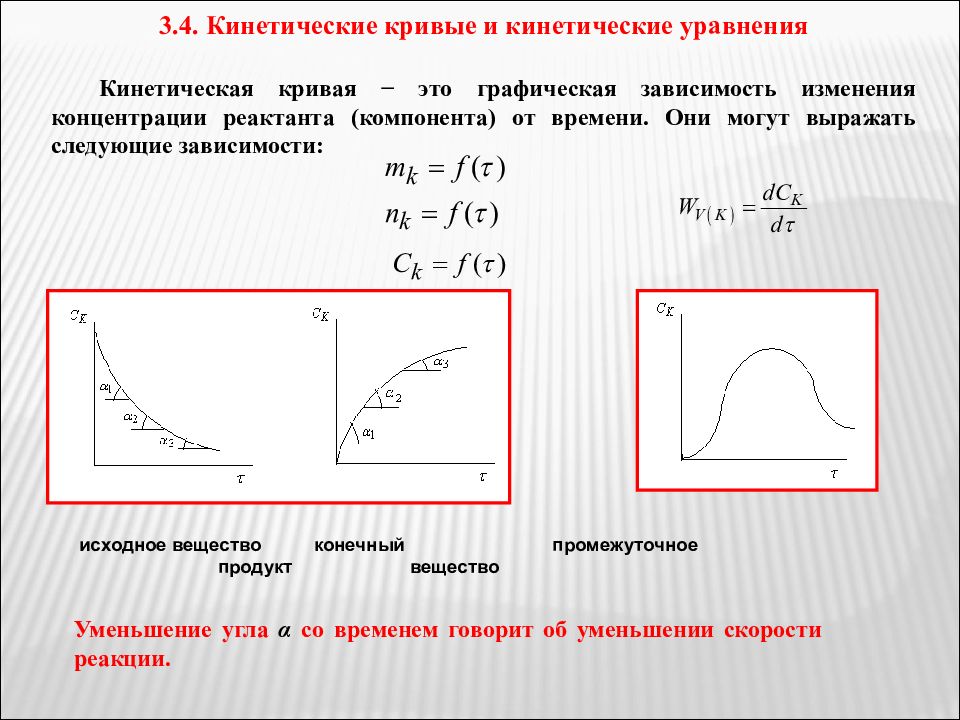
3.4. Кинетические кривые и кинетические уравнения Кинетическая кривая − это графическая зависимость изменения концентрации реактанта (компонента) от времени. Они могут выражать следующие зависимости: исходное вещество конечный промежуточное продукт вещество Уменьшение угла α со временем говорит об уменьшении скорости реакции.
Слайд 12
Кинетические уравнения – это уравнения, связывающие скорость процесса с давлением, температурой и составом.
Слайд 13
3.5. Молекулярность и порядок реакции Понятие молекулярность применяется только к одностадийным простым реакциям. Молекулярность – это количество частиц, одновременным соударением которых осуществляется акт химического превращения. Молекулярность выражается целым числом- 1, 2, 3 ≠ 0 Для простых одномолекулярных реакций степень концентрации совпадет со стехиометрическим коэффициентом. По числу участвующих в реакции молекул (или в элементарном акте) все реакции делятся на: 1) Мономолекулярные С А - текущая концентрация
Слайд 14
2) Бимолекулярные Если С А = С В, 3) Тримолекулярные Как показывает опыт, трёхмолекулярные и четырехмолекулярные реакции встречаются редко.
Слайд 15
Порядок реакции Различают порядок реакции в целом и порядок реакции по компонентам (ПР) ПР по компоненту - это степень, в которой концентрация реагирующего вещества входит в кинетическое уравнение скорости химической реакции Скорость химической реакции зависит от концентрации реактантов. Рассмотрим тримолекулярную реакция Пусть С А >> С В и С С, тогда изменение концентрации А можно пренебречь тогда можно записать кинетическое уравнение следующим образом Это реакция 2 порядка Это реакция третьего порядка Суммарный порядок реакции находиться сложением порядков реакции по компонентам Пусть С А и С В >> С С, тогда - это тримолекулярная реакция протекает согласно реакции I порядка.
Слайд 16
Порядок реакции находиться только экспериментальным путем и зависит от условий проведения процесса. Сложные реакции протекают так, что одно из стадий может протекать медленнее других. Эта стадия называется лимитирующей. Она определяет скорость всего процесса. Для сложных многостадийных реакций постулат Бекетова – Гульдберга – Вааги можно записать где n k – порядок реакции по К – компоненту
Слайд 17
3.6. Элементарный акт химического превращения Теория переходного состояния или активированного комплекса Элементарные акты химических превращений осуществляются при столкновении молекул, обладающих избыточной энергией по сравнению со средней. При соударении частиц изменяется их потенциальная энергия. Всякий элементарный химический акт протекает через переходное состояние или активированный комплекс, когда в реагирующей системе исчезают отдельные связи и возникают новые, характерные для продуктов реакции. Рассмотрим реакцию: После сближения на достаточно близкое расстояние возникают связи между разнородными молекулами. Связи внутри исходных молекул ослабевают и в дальнейшем разрываются, а новые связи упрочняются, т.е. происходит перегруппировка атомов. Время жизни активированного комплекса (АВС) * очень мало.
Слайд 18
Изменение энергии реагирующих веществ в ходе экзотермической реакции. Точка С соответствует энергетическому барьеру, который должны преодолевать молекулы. Е 1 – энергия активации, которую нужно сообщить молекулам, чтобы произошел элементарный химический акт.
Слайд 19
Е – потенциальная энергия исходных веществ R − расстояние между атомами Когда в системе реакции нет, то потенциальная энергия Е находится как ∑ ( Е АВ + Е D ). По мере сближения молекулы вступают в контакт, обменивают или отщепляют атомы, и за счёт этого энергия становится max ( Е max ). По мере выделения продуктов реакции энергия падает до величины, соответствующей сильно удалённым друг от друга молекулам продуктов реакции. Е max в точке С соответствует переходному состоянию, в ней образуется активированный комплекс (АВС) *. Энергетически более выгодно, когда реагирующие молекулы находятся на одной линии, он более вероятен. В ходе реакции энергия вначале возрастает, а после этого, т.е. достижения max значения, уменьшается.
Слайд 20
3.7. Интегральные и дифференциальные уравнения реакций с целочисленными порядками реакций При выводе уравнений рассматривают простые варианты реакций со следующими ограничениями: реакция гомогенная и протекает в закрытой системе в статических условиях ( V, T – const ); процесс односторонний, необратимый; частные порядки реакций n i и общий порядок реакции n = ∑ n i равны 0 или целому положительному числу. 3.7.1. Реакции нулевого порядка C корость химической реакции не зависит от концентрации реактантов.
Слайд 21
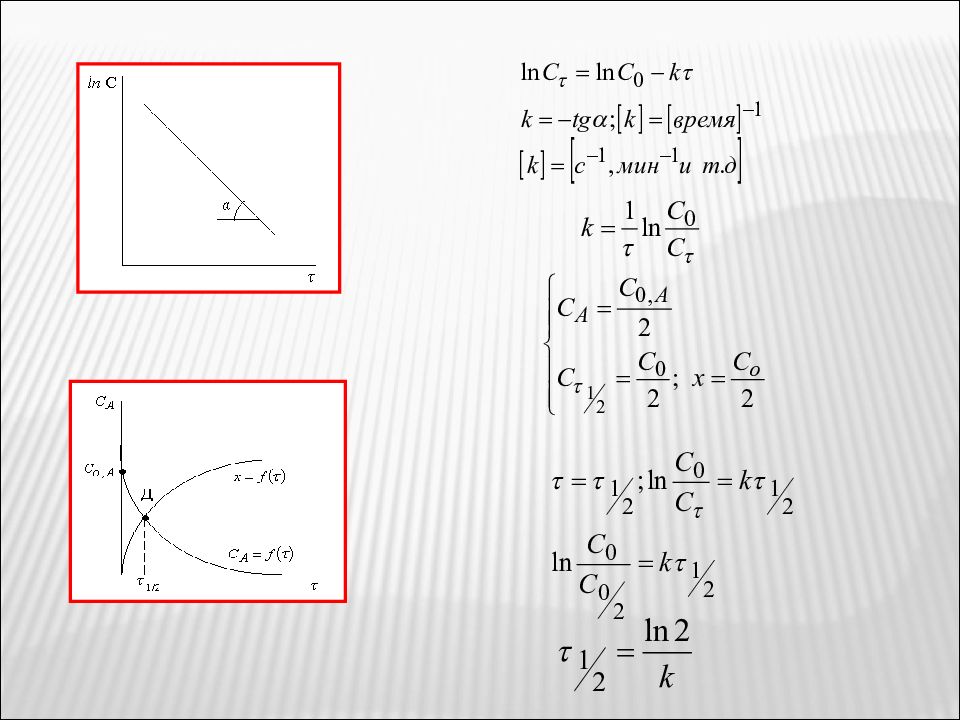
Для таких процессов n ∑ = 0, тогда дифференциальное кинетическое уравнение можно записать k 0 – константа скорости химической реакции «0» - порядка. Проинтегрируем это выражение и разделим переменные (С 0 – С) = Х – количество вещества, претерпевшего превращение.
Слайд 22
Степень превращения вещества α Другая форма кинетического уравнения «0» порядка имеет вид Для нахождения k 0 строят график в координатах С = f (τ) τ 1/2 − время полупревращения, когда С = С 0 / 2; х = С 0 / 2; С = С 0 – х; α = 0,5
Слайд 23
Примеры реакций нулевого порядка: 1. Фотохимические реакции. Лимитирующий фактор – количество поглощенной световой энергии. При постоянной температуре W ≠ f ( C 0 ) 2. Каталитические реакции. Скорость химической реакции не зависит от исходной концентрации реактантов, а определяется концентрацией катализатора W ≠ f ( C 0 ); W = f ( kt ).
Слайд 24
3.7.2. Односторонние (необратимые) реакции I порядка К реакциям первого порядка относятся реакции, в которых скорость реакции пропорциональна концентрации реагирующих частиц. Это могут быть мономолекулярные реакции, бимолекулярные реакции при значительном избытке одного из реактантов или даже многостадийные реакции, когда скорость реакции зависит, главным образом, от концентрации лишь одного компонента. Рассмотрим мономолекулярную реакцию: +
Слайд 25
Дифференциальные уравнения скорости реакции I порядка: Это кинетические уравнения реакции I порядка, записанные в интегральной форме. При кинетических исследованиях прямая задача - это определение зависимости с = f ( τ ), обратная задача- определение к.
Слайд 28
3.7.3. Односторонние реакции II порядка Рассмотрим реакцию, в которой участвуют два исходных вещества А 1 и А 2. Введем обозначения: Примем, что продукт реакции B ;
Слайд 30
В этом случае плотность глубины реакции х будет равна 2) Рассмотрим другой случай, когда С А1,0 =С А2,0 – эквивалентные концентрации исходных веществ.
Слайд 31
Плотность глубины реакции II порядка: Время полупревращения, когда 3) Пусть − Рассматривается как реакция I порядка
Слайд 32
3.7.4. Односторонние реакции n го порядка Сложные реакции могут протекать по n му порядку при
Слайд 33
Уравнение может быть использовано для реакций n го порядка при любом значении n, кроме реакций 1 порядка. Зная значение А и время полупревращения можно найти значение k n, n. .
Слайд 34
3.7.5. Методы определения порядка реакции Порядок реакции является эмпирической величиной и не может быть рассчитан теоретически, если не известен механизм реакции. Для его определения разработаны различные методы 1. Метод подстановки. Заключается в том, что экспериментальные данные зависимости с τ = f (τ ) подставляют в кинетические уравнения разных порядков и находят какое из них дает постоянное значение константы скорости реакции. 2. Графический метод. Зависимость концентрации от времени для реакции различного порядка может быть выражена прямой линией, если выбрать соответствующую систему координат. Для реакций I порядка прямая получается в системе координат ln c = f (τ ), II порядка (1/с)= f (τ ), III порядка (1/с 2 )= f (τ ).
Слайд 36
б) Интегральный метод 3.Метод определения по Раковскому (по периоду полупревращения) Для реакций I порядка II порядка III порядка
Слайд 37
Для определения n берутся различные начальные концентрации веществ, определяют время полупревращения, определяют зависимость и делают вывод о n. Из уравнения для реакций n го порядка Порядок реакции может быть 1,2,3, а также дробным. Если n = 0, то график пойдет параллельно оси абсцисс. Определив n и зная ln А можно рассчитать значения k
Слайд 38
4. Метод изолирования Оствальда Для реакции Пусть нужно найти n 1 – частный порядок реакции по 1 компоненту. Задаем условия Тогда скорость реакции Тогда скорость реакции Концентрации компонентов А 2 и А 3 оставляем постоянными, варьируем только С А1,0, находим n 1. Далее оставляем постоянными С А1,0 и С А3,0 и варьируем С А2,0 → n 2 и т.д.
Слайд 39
3.8. Зависимость скорости химической реакции от температуры. Уравнение Аррениуса Скорость химической реакции зависит не только от концентрации реагентов, но и от температуры. По правилу Вант-Гоффа увеличение температуры на 10 о приводит к увеличению скорости реакции в 2-4 раза. - температурный коэффициент скорости химической реакции Более строгая зависимость k от T выражается уравнением Аррениуса: где A и B – const ; A – предэкспоненциальный множитель, B = - энергия активации химической реакции Другая запись уравнения Аррениуса:
Слайд 40
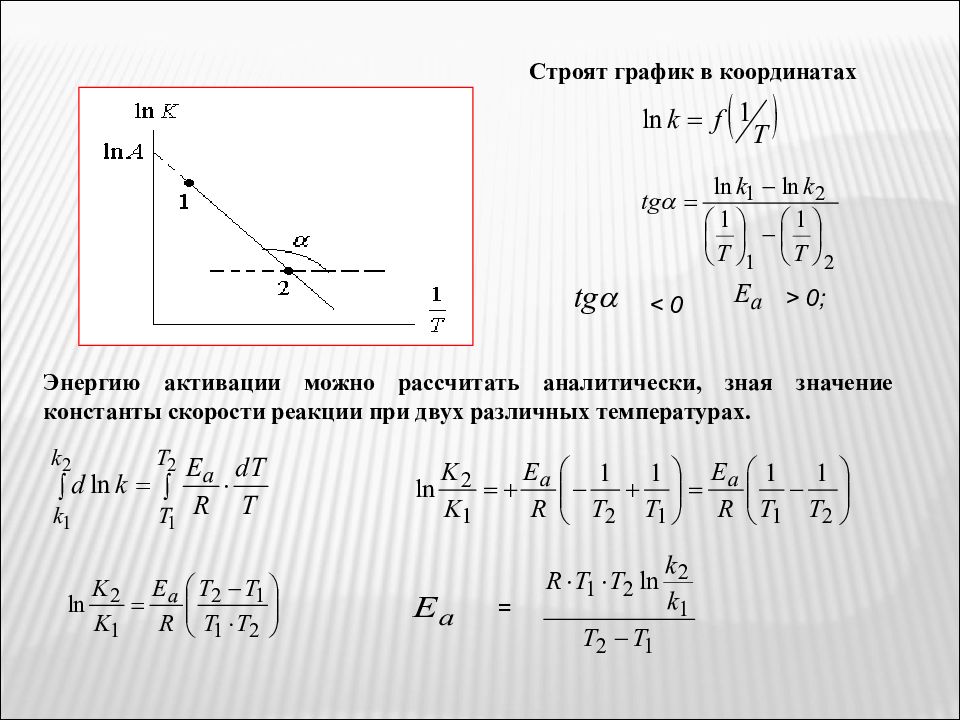
Энергия активации зависит от природы реакции. Пользуясь этим уравнением можно определить энергию активации, если известны k при различных температурах. Энергия активации обычно > 0 и равна 50-500 Дж/моль, реже меньше нуля. Для газофазных реакций A = 10 12 -10 16 C -1. - величина потенциального барьера. находят часто графическим решением уравнения Аррениуса: Строят график в координатах
Слайд 41
Строят график в координатах > 0; < 0 Энергию активации можно рассчитать аналитически, зная значение константы скорости реакции при двух различных температурах. =
Слайд 42
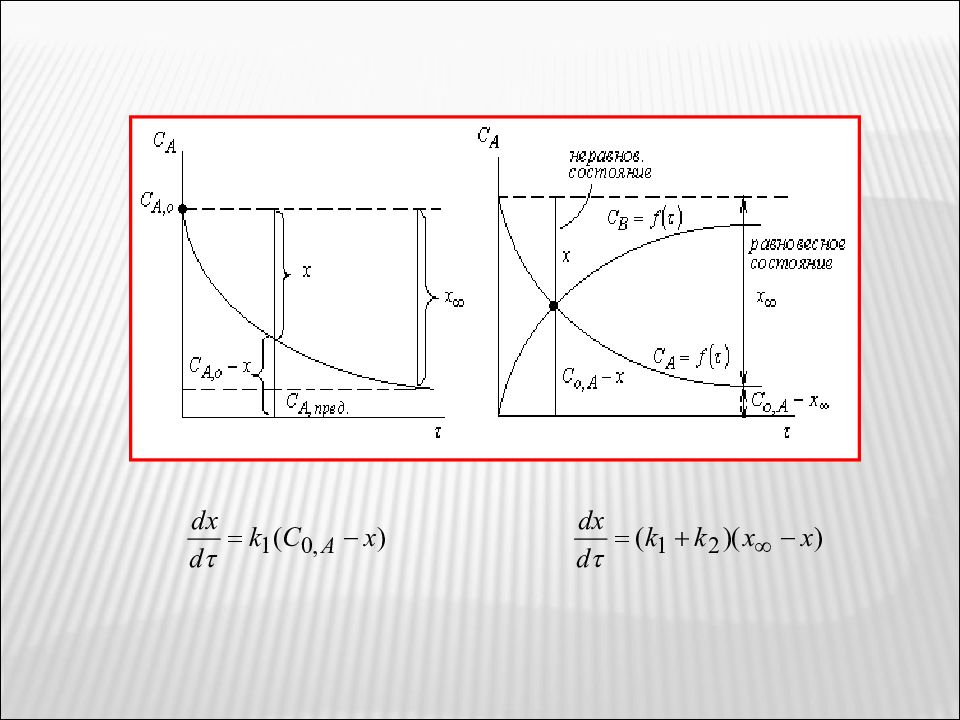
РАЗДЕЛ 4. КИНЕТИКА СЛОЖНЫХ ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ РЕАКЦИЙ. КАТАЛИТИЧЕСКИЕ РЕАКЦИИ Под сложными реакциями понимают реакции, протекающие в несколько стадий, 2 х – сторонние, параллельные, последовательные. При описании сложных реакции учитывается условие материального баланса и принцип независимого протекания реакции; каждая реакция протекает независимо от другой и скорость каждой реакции пропорциональна концентрации реагирующих веществ. Условно сложную реакцию разбивают на несколько элементарных стадий. 4.1 Обратимые (двусторонние) реакции первого порядка Обратимые реакции могут быть I и II порядка - равновесные концентрации
Слайд 44
const = - ln L Уравнение позволяет найти сумму ( k 1 + k 2 ), но не дает возможности найти k 1 и k 2. Найти значение k 1 и k 2 можно, исходя из равновесия прямой и обратной реакции, когда Константа равновесия реакции
Слайд 47
4.2. Параллельные односторонние реакции Реакции называются параллельными, если в каждой реакции в качестве исходного принимает участие одно и тоже вещество. Эти реакции могут быть I и II порядка. Рассмотрим параллельную реакцию I порядка, характерную для органического синтеза. Каждая реакция дает свой продукт. 0 0 0
Слайд 49
3.3. Односторонние последовательные реакции Реакции считаются последовательными, если вещество, образующееся в одной реакции, является исходным для другой. Реакции часто встречаются на практике и могут быть моно-, би- или тримолекулярными, односторонними или обратимыми. Рассмотрим последовательную одностороннюю реакцию первого порядка 0 0 В – промежуточное вещество
Слайд 50
К любому времени система дифференциальных кинетических уравнений Для первой стадии реакции : Для второй стадии реакции: y = ( x - y ) =
Слайд 51
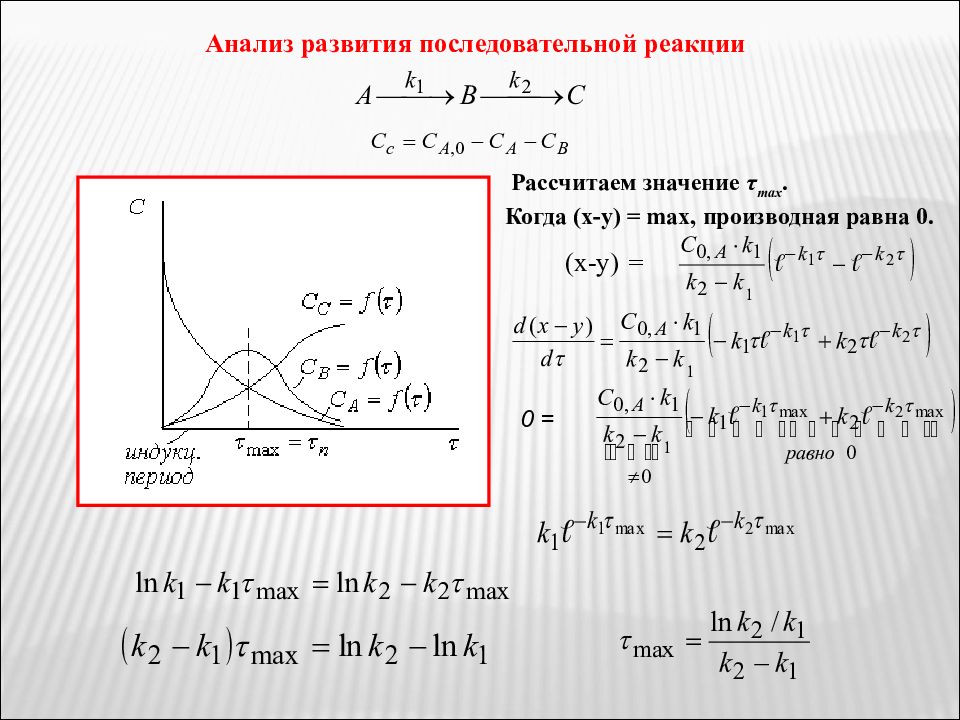
Анализ развития последовательной реакции Рассчитаем значение τ max. Когда ( x - y ) = max, производная равна 0. ( x - y ) = 0 =
Слайд 53
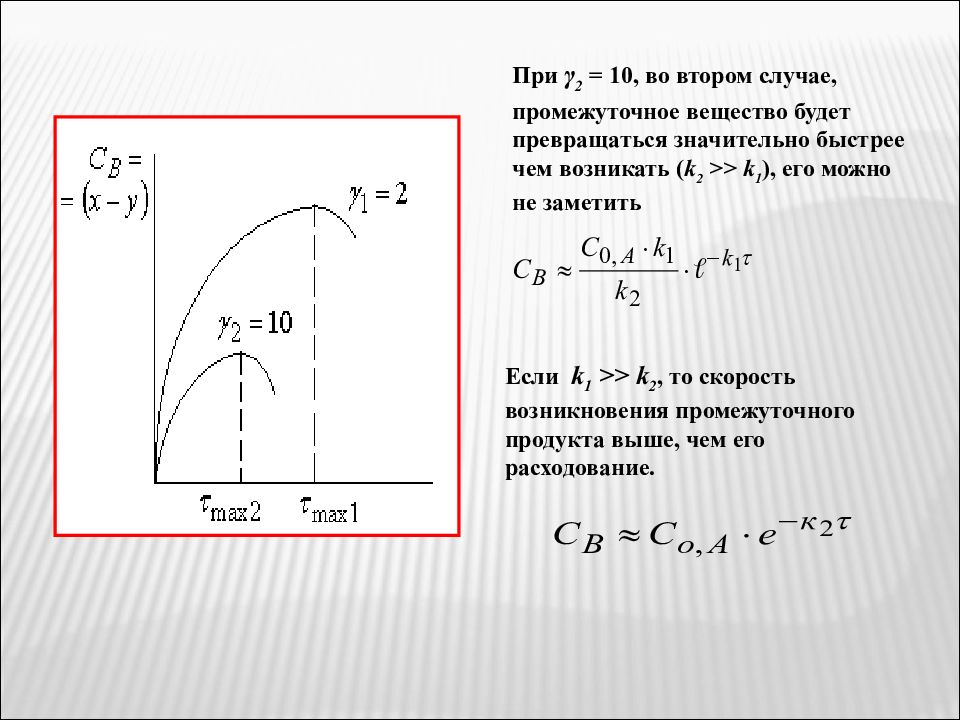
При γ 2 = 10, во втором случае, промежуточное вещество будет превращаться значительно быстрее чем возникать ( k 2 >> k 1 ), его можно не заметить Если k 1 >> k 2, то скорость возникновения промежуточного продукта выше, чем его расходование.
Слайд 54
4.4. Основные понятия кинетики гетерогенных реакций Гетерогенными называются процессы, происходящие на границе раздела соприкасающихся фаз. К ним относятся такие процессы как горение топлива, окисление металлов кислородом воздуха, реакции на поверхности катализаторов, кристаллизация чистых жидкостей. Скорость гетерогенных процессов зависит от размеров и состояния поверхности раздела фаз, а так же от скорости их относительного движения. Гетерогенные процессы многостадийны. Гетерогенные процессы могут протекать на границе между разными фазами:твердая-твердая, твердая - жидкая, твердая - газообразная, жидкая - жидкая, жидкая - газообразная. Пусть твердое вещество A ( T ) реагирует на поверхности с веществом B ( P ) в растворе с образованием продукта реакции AB ( P ) в растворе: К таким реакциям относится реакция: Эта реакция протекает на границе фаз − раствор.
Слайд 55
Можно выделить 3 основные стадии процесса: 1) доставка вещества из раствора к поверхности твердого тела; 2) собственно химическая реакция на поверхности твердого тела; 3) отвод продуктов реакции от поверхности вглубь раствора. Каждая из этих стадий может быть лимитирующей, иметь наименьшую константу скорости и оказывать наибольшее сопротивление процессу. Если определяющей стадией является химическая (стадия) реакция на границе раздела фаз, то гетерогенный процесс описывается законами химической кинетики и протекает в кинетической области. Если, как это чаще бывает, медленнее осуществляется подвод и отвод соответствующих веществ, то гетерогенный процесс протекает в диффузионной области и описывается законами диффузии. Температура сильнее влияет на скорость химической реакции, чем на диффузию. При повышении температуры гетерогенная химическая реакция может перейти из кинетической области в диффузионную.
Слайд 56
Доставка вещества к границе между фазами осуществляется за счет конвекции и диффузии. Конвекцией называется перемещение всей среды в целом. Она происходит из-за разности плотности раствора в объеме раствора и вблизи поверхности слоя. Конвекцию создают путем перемешивания твердого тела в растворе или раствора вблизи поверхностного слоя. Диффузией называется перемещение молекул вещества в неподвижной среде под влиянием градиента концентраций. Количественные закономерности диффузии описываются двумя законами Фика. Согласно I закону Фика скорость диффузии при S = 1 м 2 = где D – коэффициент диффузии
Слайд 57
Коэффициент диффузии D возрастает с увеличением температуры, т.к коэффициент вязкости растворителя уменьшается. По уравнению Эйнштейна По закону Стокса для сферических частиц B =6 πη r, где η – коэффициент вязкости, r – радиус частиц. По II закону Фика (устанавливается зависимость изменения концентрации в объеме от времени): При стационарной диффузии, когда концентрация не зависит от времени, а изменяется только с расстоянием линейно: = 0 = 0 → = const = где c и c 0 – значения концентраций на расстоянии x = δ и x = 0
Слайд 58
Исходя из этого, скорость стационарной диффузии будет равна: – коэффициент массопереноса; c 0 – концентрация в поверхностном слое. Для гетерогенной реакции, которая имеет I порядок и протекает стационарно, предположим, что скорость химической реакции равна скорости диффузии. − это диффузионное сопротивление − это химическое сопротивление
Слайд 59
Скорость реакции определяется β, характеризующей диффузию. Процесс протекает в диффузионной области. Суммарный процесс определяется химической стадией и протекает в кинетической области. Влияние температуры на константу скорости гетерогенной реакции γ – температурный коэффициент
Слайд 60
4.5. Интегральное кинетическое уравнение для расчета константы гетерогенной реакции Если гетерогенная химическая реакция протекает в кинетической области, то если считать, что эта реакция первого порядка ( n k = 1). При протекании гетерогенной реакции в диффузионной области можно записать, что ( dn k ~ dm k ) Согласно первому закону Фика скорость диффузии или изменение числа молей компонента во времени будет рассчитываться по уравнению: Поделим обе части уравнения на объем реакционной системы – V, тогда:
Слайд 61
Удельная скорость диффузии равна коэффициенту диффузии При произвольных значениях площади поверхности раздела фаз и объема реакционной смеси С учетом стехиометрического коэффициента k - компонента уравнение примет следующий вид: В стационарных условиях при равновесии k
Слайд 62
k определяется, исходя из экспериментального значения константы - k эксп Определение k эксп проводят графическим путем, построив график в координатах определяется соотношением площади поверхности раздела фаз и объема реакционной смеси.
Слайд 63
4.6. Катализ. Специфичность, селективность катализа Каталитическими называются реакции, протекающие с участием катализаторов − веществ, не входящих в стехиометрическое уравнение и остающихся после реакции неизменными. Катализаторы вступают в промежуточное химическое взаимодействие с участками реакции, а после реакции выделяются. Катализаторы сильно влияют на скорость реакции: положительный катализ – увеличивают скорость реакции; отрицательный катализ – понижают скорость реакции. Вещества, в присутствии которых скорость реакции уменьшается, называются ингибиторами. Если катализатором является один из продуктов реакции, то реакция называется автокаталитической. Реакция восстановления окси железа катализируется железом. Каталитические реакции широко распространены в природе и промышленности. Различают: 1) гомогенный катализ 2) гетерогенный катализ
Слайд 64
При гомогенном катализе все вещества находятся в общей фазе, включая катализатор. Реакция окисления SO 2 в присутствии окси азота NO : При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах, а каталитическая реакция протекает на поверхности раздела фаз: 6.1. Свойства катализаторов Свойства катализаторов: ( kt) 1) катализатор не влияет на положение термодинамического равновесия, т.е на величину константы равновесия 2) катализаторы обладают избирательностью (или селективностью действия). Каждый катализатор может ускорять лишь некоторые реакции. Ni – катализатор реакции гидрирования V 2 O 5 – катализатор реакции окисления
Слайд 65
Для каталитического действия обычно достаточно малое количество катализатора. Влияние kt на скорость процесса характеризуется удельной каталитической активностью, за меру которой принимается скорость реакции в присутствии kt, отнесенная к единице количества kt (гомогенный катализ) или к единице поверхности kt (гетерогенный катализ). Механизм действия kt очень сложный. В присутствии kt : снижается величина E акт ; увеличивается скорость реакции; kt может вызвать цепные реакции; делает более вероятным протекание некоторых реакций. Рассмотрим влияние катализатора на кинетику химических реакций на примере гомогенно-каталитической бимолекулярной односторонней реакции
Слайд 66
Константа равновесия образования активного комплекса равна − концентрация активированного комплекса; − концентрация исходных веществ; − концентрация катализатора, не вошедшего в активированный комплекс. Скорость реакции в присутствии катализатора Концентрация свободного катализатора − общая или исходная концентрация катализатора
Слайд 67
Уравнение показывает, что скорость гомогенно-каталитической бимолекулярной реакции пропорциональна концентрации катализатора .
Слайд 68
Анализ уравнения: 1) при малых значениях можно принять, что сумма Общий порядок реакции по исходным веществам – второй, а по веществам A или B – первый. 2) если значение велико, то и скорость реакции При этом реакция протекает по нулевому порядку (по исходным веществам). 3) при средних значениях порядок реакции по исходным веществам будет дробный. Если каталитическая реакция
Слайд 69
4.6.2.Каталитическая активность и избирательность Мерой каталитической активности A является изменение скорости химической реакции в результате введения kt : - доля объема системы, занимаемой kt и недоступная для реагирующих веществ. A может быть (+) и (-) в соответствии с положительным и отрицательным катализом. Часто очень мала, то им можно пренебречь, поэтому Если реакция протекает вблизи равновесия и является двусторонней, то за меру каталитической активности принимают скорость протекания реакции в прямом направлении. Удельная каталитическая активность относится к единице количества kt ( a ). В гомогенном катализе относится к числу молей в единице объема: В гетерогенном катализе
Последний слайд презентации: НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ В СЛОЖНЫХ ХИМИЧЕСКИХ ПРОЦЕССАХ ЧАСТЬ 2: КИНЕТИКА
Избирательностью kt называют его способность ускорять один из возможных путей реакции, если она может протекать по разным направлениям с образованием различных продуктов. Свойство избирательности или селективности имеет большое практическое значение. Путем подбора соответствующих kt можно увеличить выход нужного продукта. Например: при термическом разложении в газовой фазе диэтилового эфира без kt идет реакция В присутствии паров реакция идет быстрее в другом направлении В присутствии kt может протекать и реакция, которая шла без kt, но скорость ее обычно ниже. Иногда для уменьшения скорости некаталитической реакции понижают температуру.