Первый слайд презентации
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Лекция 4 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Слайд 2: Содержание
Основные понятия Закон действующих масс Влияние температуры на константу химического равновесия Влияние различных факторов на состояние химического равновесия. Принцип Ле Шателье Влияние концентраций (парциальных давлений) компонентов системы Влияние давления Влияние температуры Влияние катализатора Выбор оптимального технологического режима. Кажущееся равновесие ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 3
Необратимые и обратимые реакции Необратимые реакции – реакции, проходящие только в одном направлении до конца, т.е. до полного превращения одного или всех исходных веществ в продукты реакции 2 KClO 3 = 2 KCl + 3 O 2 Обратимые реакции – реакции, идущие в противоположных направлениях, не проходят до конца, исходные вещества полностью не расходуются H 2 + I 2 2 HI ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 4: Химическое равновесие - состояние системы, характеризующееся равными скоростями прямой и обратной реакций
Система H 2 + I 2 2 HI при Т = const С HI = 0 H 2 , I 2 , HI - равновесные концентрации, моль/л ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА 0 υ υ пр = υ обр τ τ равн Модуль I. Лекция 4. Химическое равновесие
Слайд 5: Закон действующих масс
В закрытой системе в состоянии равновесия при постоянных температуре и давлении отношение произведений концентраций продуктов реакции и исходных веществ в степенях, равных стехиометрическим коэффициентам, является постоянной величиной В закрытой системе для обратимой реакции (T, p = const) aA + bB cC + dD Для реакции с участием газообразных веществ p A, p B, p C, p D – равновесные парциальные давления ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 6: Константы равновесий в гомогенных и гетерогенных системах
Гомогенная система N 2(г) + 3 H 2(г) 2 NH 3(г) Гетерогенная система MgCO 3(к) MgO (к) + CO 2(г) концентрации твердых веществ считают неизменными и в выражение константы равновесия не включают ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 7: Константа равновесия - мера глубины прохождения реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Отсутствие взаимодействия Равновесие смещено в сторону прямой реакции Равновесие смещено в сторону обратной реакции Модуль I. Лекция 4. Химическое равновесие Константа равновесия зависит от природы веществ, образующих систему и от температуры, но не зависит от концентрации веществ
Слайд 8: Расчет равновесных концентраций реагентов по известным исходным концентрациям
CO (г) + H 2 O (г) CO 2(г) + H 2(г) К С = 1 при Т=1023 К, Исходные концентрации веществ В начальный момент времени Обозначаем х (моль/л) увеличение концентрации CO 2 в ходе реакции увеличение концентрации Н 2 уменьшение концентрации СО = х уменьшение концентрации Н 2 О ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 9: Определение возможного направления реакции при известном значении константы равновесия
2 SO 2(г) + O 2(г) 2 SO 3(г) При Т = 950 К значение К С = 83,88 Исходные концентрации Определить направление возможной реакции при данном составе системы В исходной газовой смеси В состоянии равновесия В ходе достижения равновесия при данном составе системы возможна прямая реакция ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 10: Влияние температуры на константу химического равновесия
зависимость lnK = f(T) близка к линейной При увеличении температуры для экзотермических реакций для эндотермических реакций К К ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Слайд 11: Расчет Н 0 и ∆ S 0 реакции 4 NO (г) 2 N 2 O (г) + O 2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие Расчет Н 0 и ∆ S 0 реакции 4 NO (г) 2 N 2 O (г) + O 2(г) Н 0 < 0 реакция экзотермическая ΔS 0 < 0 в ходе реакции система переходит в более упорядоченное состояние 205,0 220,0 210,6 0 81,6 90,4 O 2 (г) N 2 O (г) NO (г) Вещество
Слайд 12: Расчет и K 298 реакции 4 NO (г) 2 N 2 O (г) + O 2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие Расчет и K 298 реакции 4 NO (г) 2 N 2 O (г) + O 2(г) Стандартная энергия Гиббса реакции – при Т = 298 К возможна самопроизвольная прямая реакция Константа равновесия K 298 ≈ 10 24
Слайд 13: Расчет и K 1500 реакции 4 NO (г) 2 N 2 O (г) + O 2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие Расчет и K 1500 реакции 4 NO (г) 2 N 2 O (г) + O 2(г) Энергия Гиббса реакции при температуре 1500 К >> 0 – при Т = 1500 К возможна самопроизвольная обратная реакция Константа равновесия при температуре 1500 К K 1500 = 10 -3
Слайд 14: График зависимости для реакции 4 NO (г) 2 N 2 O (г) + O 2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие График зависимости для реакции 4 NO (г) 2 N 2 O (г) + O 2(г) Температура, при которой (К = 1) Т, К 0 2000 200 100 -100 -200 1000 1500 500 кДж
Слайд 15: Температурная зависимость константы равновесия реакции 4 NO (г) 2 N 2 O (г) + O 2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие Температурная зависимость константы равновесия реакции 4 NO (г) 2 N 2 O (г) + O 2(г) 298 К К >> 1 в системе преобладают продукты реакции 1500 К К << 1 в системе преобладают исходные вещества, реакция практически не идет 1000 К равновероятны оба направления реакции При повышении температуры равновесие смещается в сторону обратной (эндотермической) реакции Т, K 298 1000 1500 , кДж/моль -138,8 0 98,5 К 10 24 0 10 -3
Слайд 16: Влияние различных факторов на состояние химического равновесия. Принцип Ле Шателье
Если на систему, находящуюся в равновесии, оказать внешнее воздействие, равновесие сместится в направлении, ослабляющем это воздействие ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА смещение равновесия в сторону прямой реакции означает увеличение равновесных концентраций продуктов реакции смещение равновесия в сторону обратной реакции означает увеличение равновесных концентраций исходных веществ Модуль I. Лекция 4. Химическое равновесие
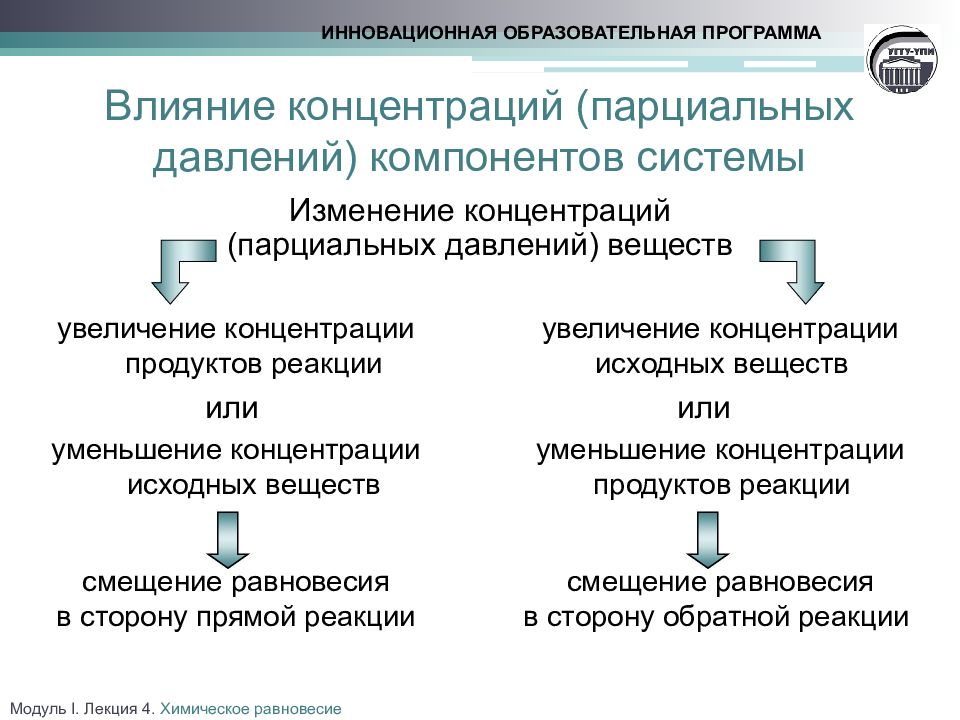
Слайд 17
Изменение концентраций (парциальных давлений) веществ ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Влияние концентраций (парциальных давлений) компонентов системы увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ смещение равновесия в сторону прямой реакции увеличение концентрации исходных веществ или уменьшение концентрации продуктов реакции смещение равновесия в сторону обратной реакции Модуль I. Лекция 4. Химическое равновесие
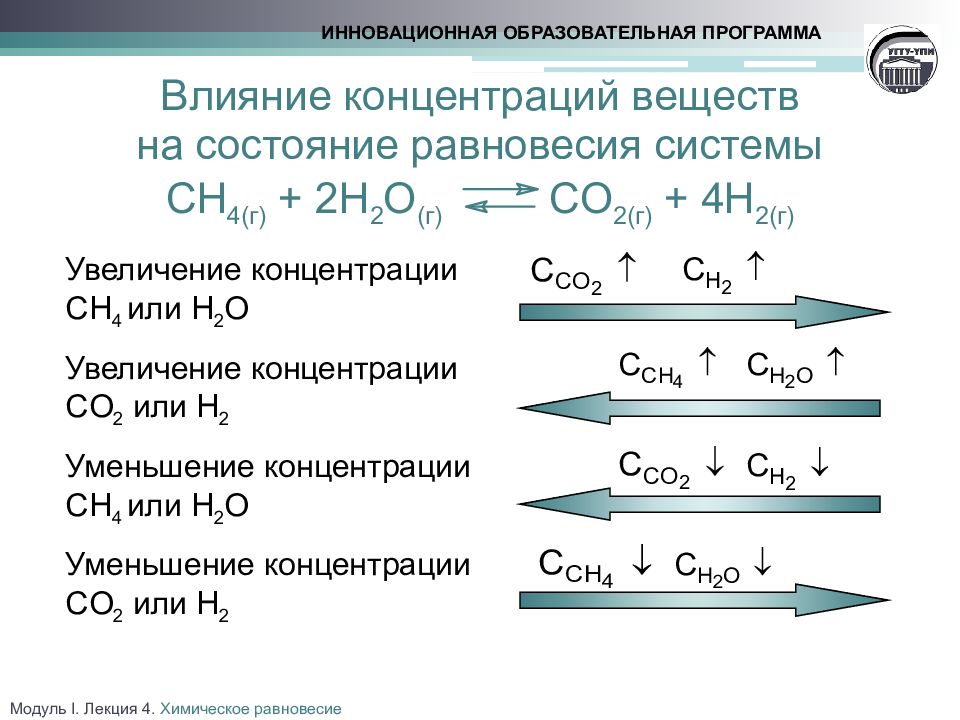
Слайд 18
Влияние концентраций веществ на состояние равновесия системы CH 4(г) + 2 H 2 O (г) CO 2(г) + 4 H 2(г) ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Увеличение концентрации CH 4 или H 2 O Увеличение концентрации CO 2 или H 2 Уменьшение концентрации CH 4 или H 2 O Уменьшение концентрации CO 2 или H 2 Модуль I. Лекция 4. Химическое равновесие
Слайд 19: Влияние общего давления в системе
Давление оказывает влияние на равновесие реакций, сопровождающихся изменением количеств газообразных веществ ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА увеличение общего давления смещение равновесия в сторону уменьшения количества газообразных веществ понижение общего давления смещение равновесия в сторону увеличения количества газообразных веществ Модуль I. Лекция 4. Химическое равновесие CH 4(г) + 2H 2 O (г) CO 2(г ) + 4H 2(г) 3 моль 5 моль
Слайд 20: Влияние температуры на состояние равновесия
Нагревание смещение равновесия в сторону эндотермических реакций ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Охлаждение смещение равновесия в сторону экзотермических реакций CH 4(г) + 2 H 2 O (г) CO 2(г) + 4 H 2(г), H>0 прямая реакция эндотермическая обратная реакция экзотермическая нагревание охлаждение Модуль I. Лекция 4. Химическое равновесие
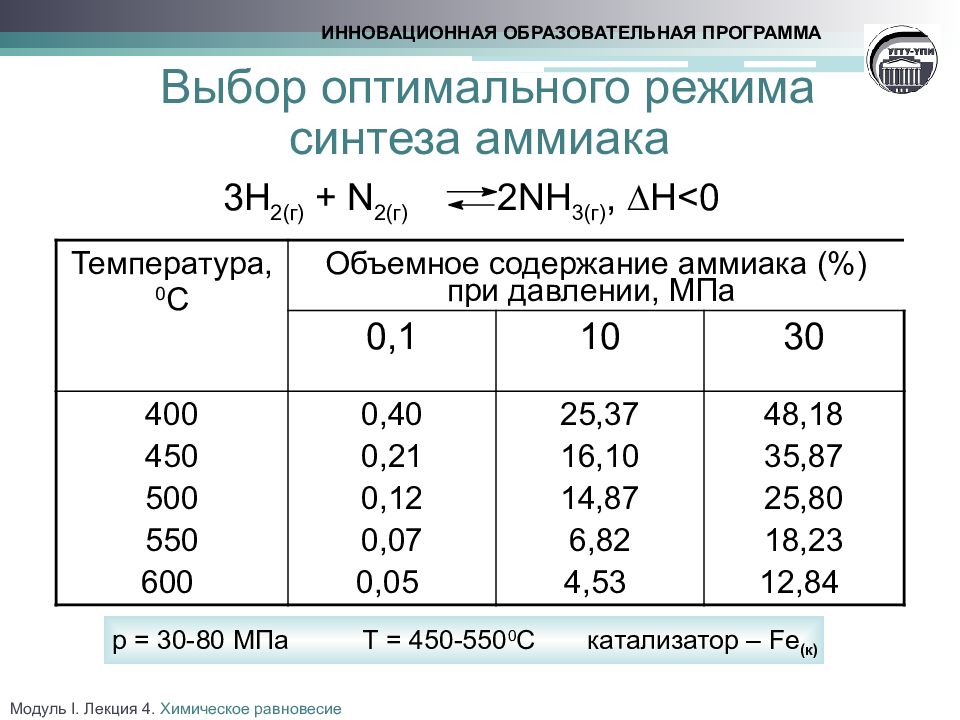
Слайд 21: Выбор оптимального режима синтеза аммиака
3Н 2(г) + N 2(г) 2NH 3(г), H<0 Температура, 0 С Объемное содержание аммиака (%) при давлении, МПа 0,1 10 30 400 450 500 550 600 0,40 0,21 0,12 0,07 0,05 25,37 16,10 14,87 6,82 4,53 48,18 35,87 25,80 18,23 12,84 ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие р = 30-80 МПа Т = 450-550 0 С катализатор – Fe ( к)
Слайд 22: Заключение
Все самопроизвольные реакции можно разделить на необратимые (идущие в одном направлении) и обратимые (идущие в противоположных направлениях) В ходе обратимых реакций наступает состояние химического равновесия, характеризующееся равными скоростями прямой и обратной реакций Количественной характеристикой химического равновесия является константа равновесия (К С или К Р ), величина которой зависит от природы реагирующих веществ и от температуры Константа равновесия экзотермических реакций уменьшается с повышением температуры; эндотермических - увеличивается. Химическое равновесие при изменении внешних условий (р, Т, С) может смещаться. Согласно принципу Ле Шателье при внешнем воздействии на систему равновесие смещается в направлении, ослабляющем это воздействие ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие
Последний слайд презентации: ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Лекция 4 ХИМИЧЕСКОЕ РАВНОВЕСИЕ: Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001 Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк., 1994 Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия, 2000 Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007 Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004 Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000 ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 4. Химическое равновесие