Первый слайд презентации: Комбинаторная химия
Курс лекций для студентов химического факультета КНУ имени Шевченко Рябухин С. В.
Слайд 2
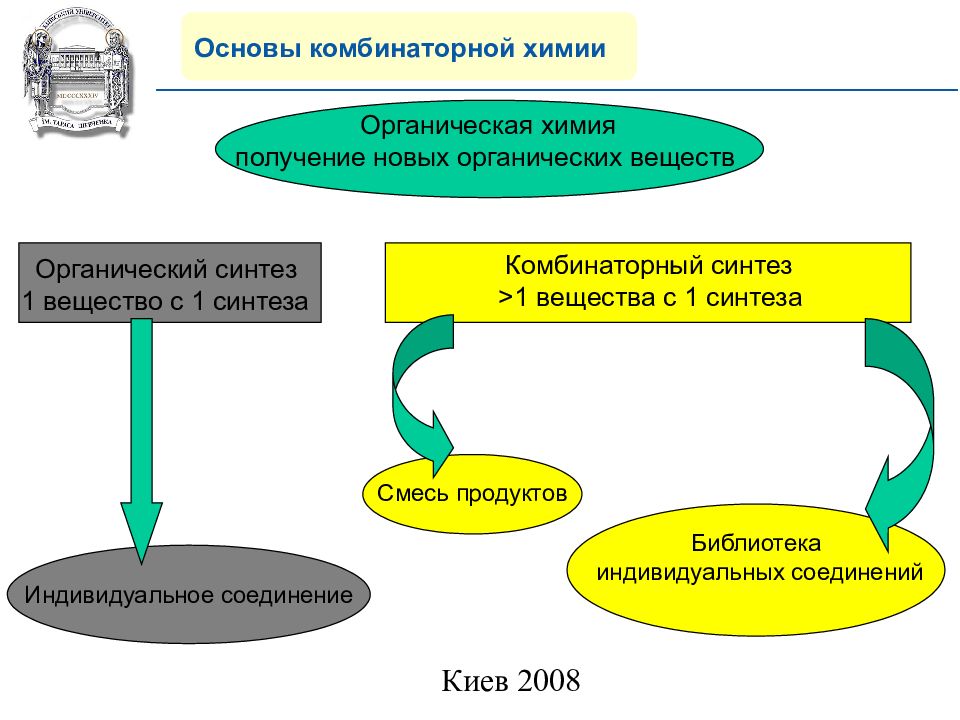
Основы комбинаторной химии Органическая химия получение новых органических веществ Комбинаторный синтез >1 вещества с 1 синтеза Смесь продуктов Библиотека индивидуальных соединений Органический синтез 1 вещество с 1 синтеза Индивидуальное соединение
Слайд 3
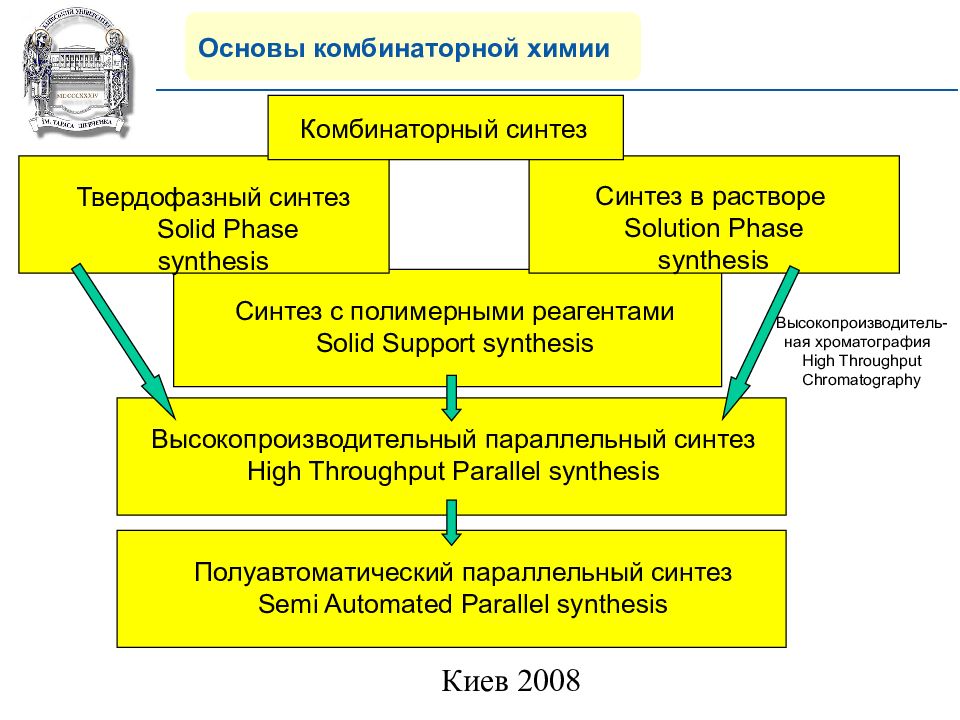
Синтез c полимерными реагентами Solid Support synthesis Основы комбинаторной химии Твердофазный синтез Solid Phase synthesis Синтез в растворе Solution Phase synthesis Комбинаторный синтез Высокопроизводительный параллельный синтез High Throughput Parallel synthesis Полуавтоматический параллельный синтез Semi Automated Parallel synthesis Высокопроизводитель-ная хроматография High Throughput Chromatography
Слайд 4
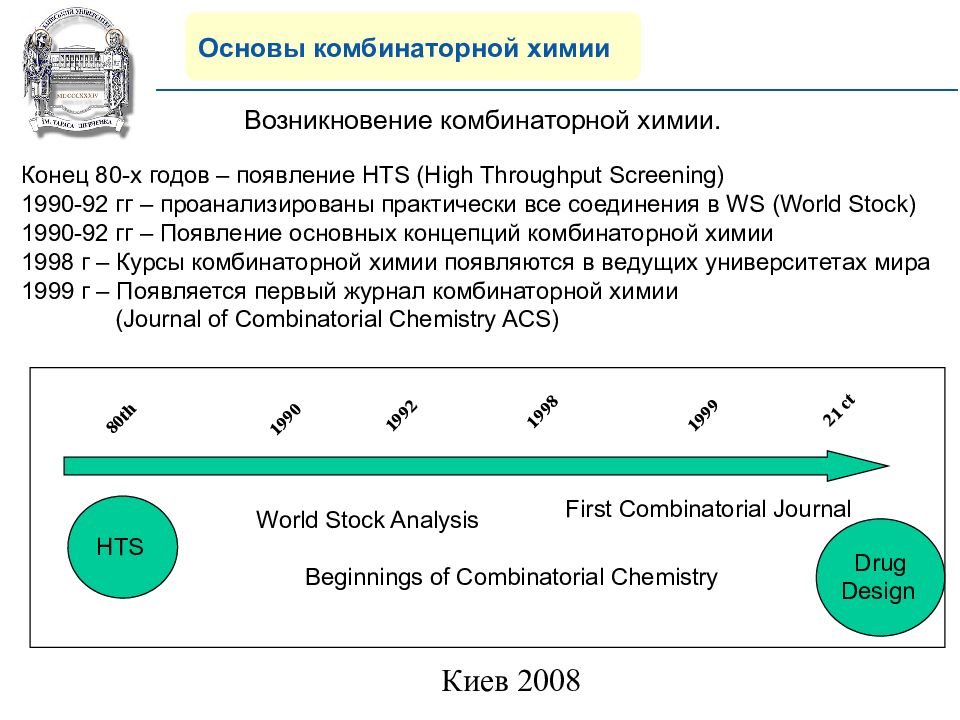
Основы комбинаторной химии 80th 19 90 19 92 19 98 19 99 21 ct Возникновение комбинаторной химии. Конец 80-х годов – появление HTS (High Throughput Screening) 1990-92 гг – проанализированы практически все соединения в WS ( World Stock) 1990-92 гг – Появление основных концепций комбинаторной химии 1998 г – Курсы комбинаторной химии появляются в ведущих университетах мира 1999 г – Появляется первый журнал комбинаторной химии ( Journal of Combinatorial Chemistry ACS) HTS World Stock Analysis Beginnings of Combinatorial Chemistry First Combinatorial Journal Drug Design
Слайд 5: COMPANY PROFILE
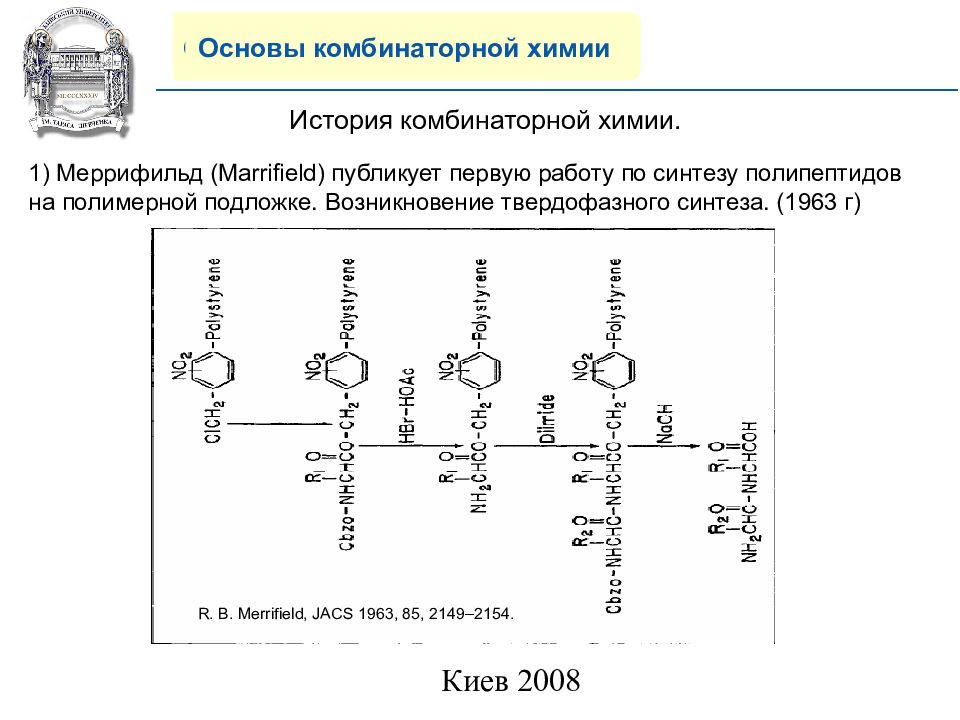
Основы комбинаторной химии История комбинаторной химии. 1) Меррифильд ( Marrifield) публикует первую работу по синтезу полипептидов на полимерной подложке. Возникновение твердофазного синтеза. (1963 г) R. B. Merrifield, JACS 1963, 85, 2149–2154.
Слайд 6: COMPANY PROFILE
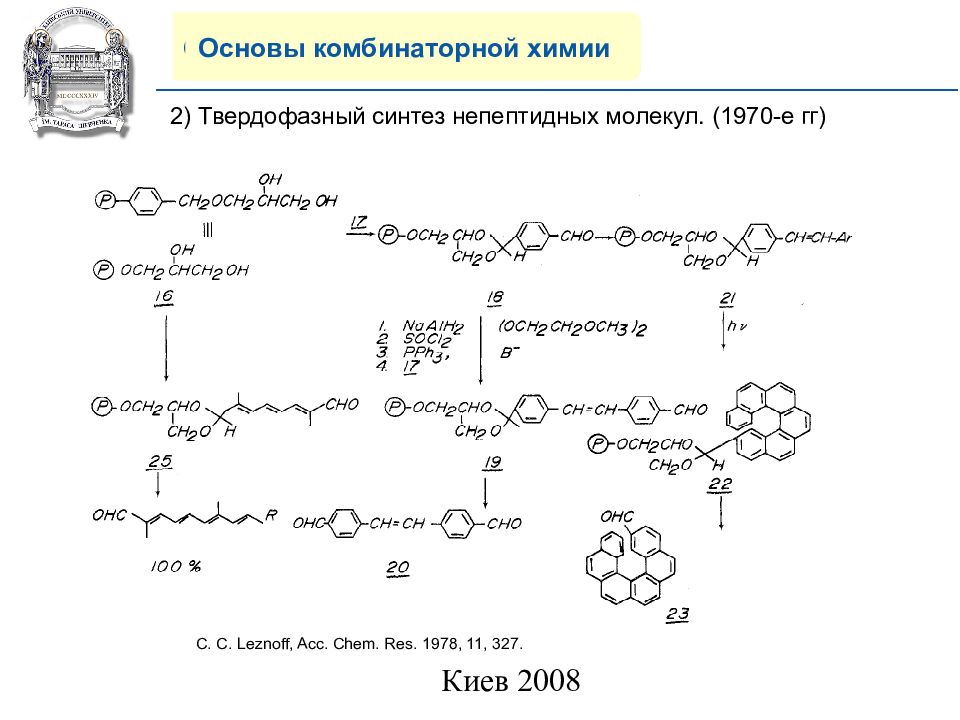
Основы комбинаторной химии 2) Твердофазн ый синтез непептидных молекул. (1970-е гг) C. C. Leznoff, Acc. Chem. Res. 1978, 11, 327.
Слайд 7: COMPANY PROFILE
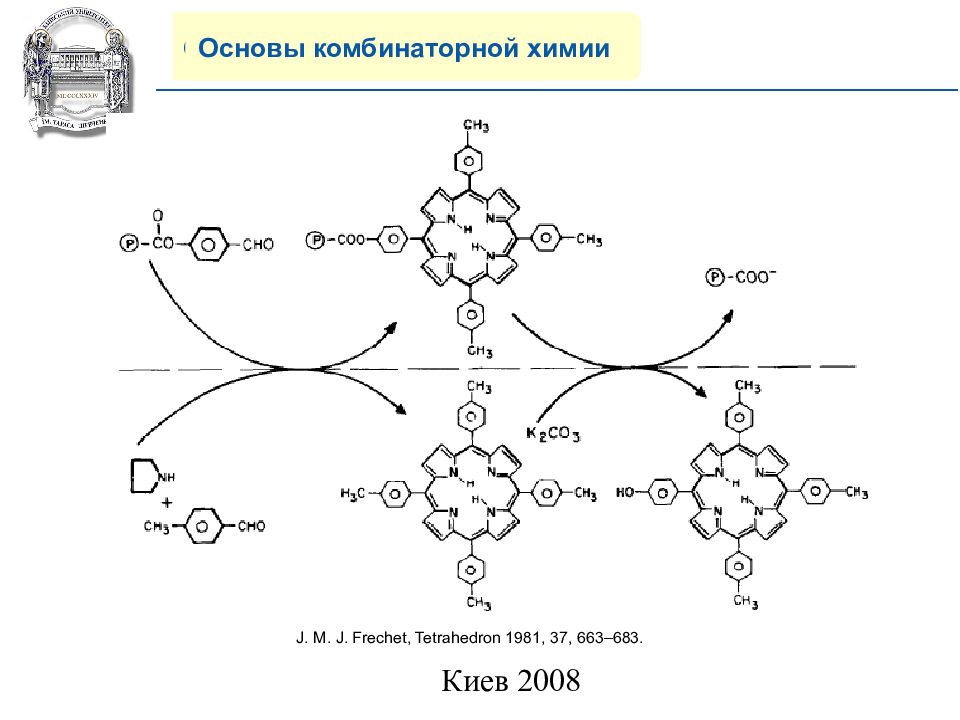
Основы комбинаторной химии J. M. J. Frechet, Tetrahedron 1981, 37, 663–683.
Слайд 8: COMPANY PROFILE
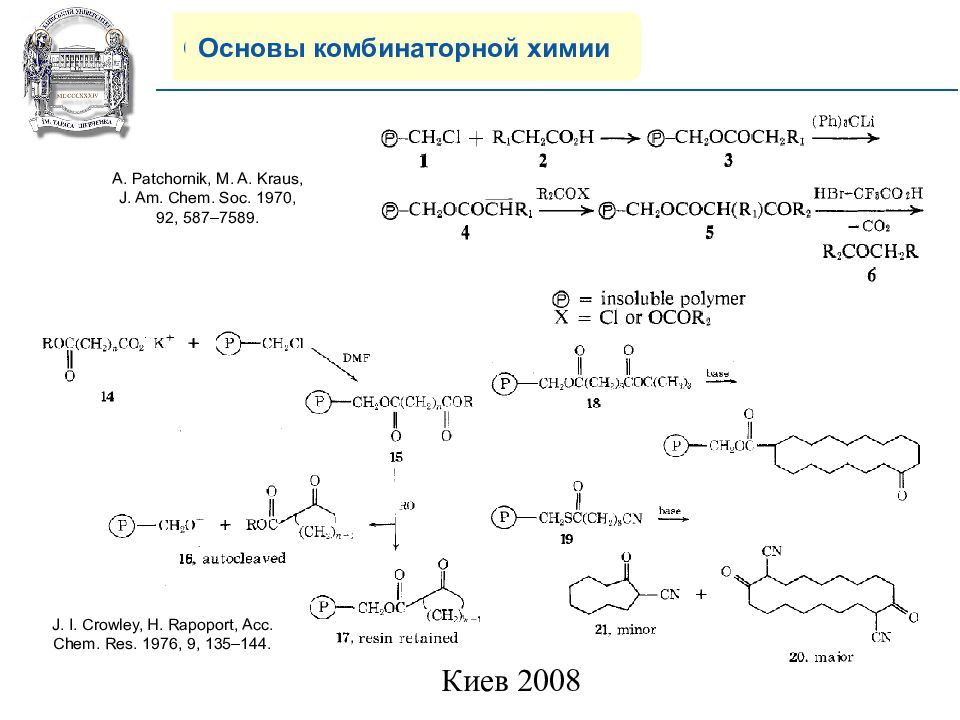
Основы комбинаторной химии J. I. Crowley, H. Rapoport, Acc. Chem. Res. 1976, 9, 135–144. A. Patchornik, M. A. Kraus, J. Am. Chem. Soc. 1970, 92, 587–7589.
Слайд 9: COMPANY PROFILE
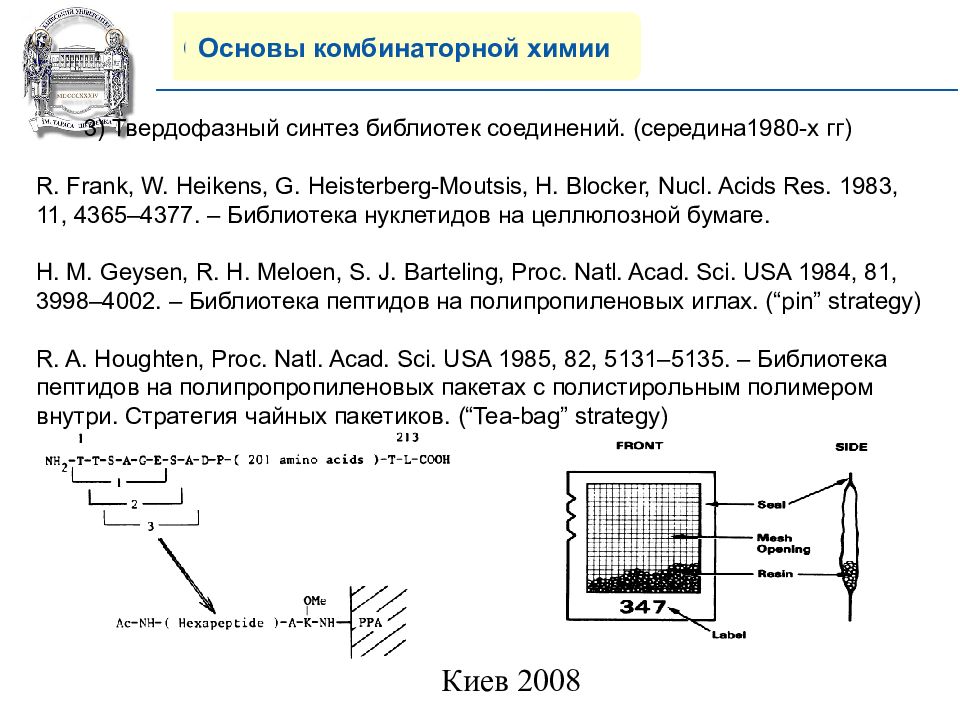
Основы комбинаторной химии 3) Твердофазн ый синтез библиотек соединений. (середина1980-х гг) R. Frank, W. Heikens, G. Heisterberg-Moutsis, H. Blocker, Nucl. Acids Res. 1983, 11, 4365–4377. – Библиотека нуклетидов на целлюлозной бумаге. H. M. Geysen, R. H. Meloen, S. J. Barteling, Proc. Natl. Acad. Sci. USA 1984, 81, 3998–4002. – Библиотека пептидов на полипропиленовых иглах. (“pin” strategy) R. A. Houghten, Proc. Natl. Acad. Sci. USA 1985, 82, 5131–5135. – Библиотека пептидов на полипропропиленовых пакетах с полистирольным полимером внутри. Стратегия чайных пакетиков. ( “Tea-bag” strategy)
Слайд 10: COMPANY PROFILE
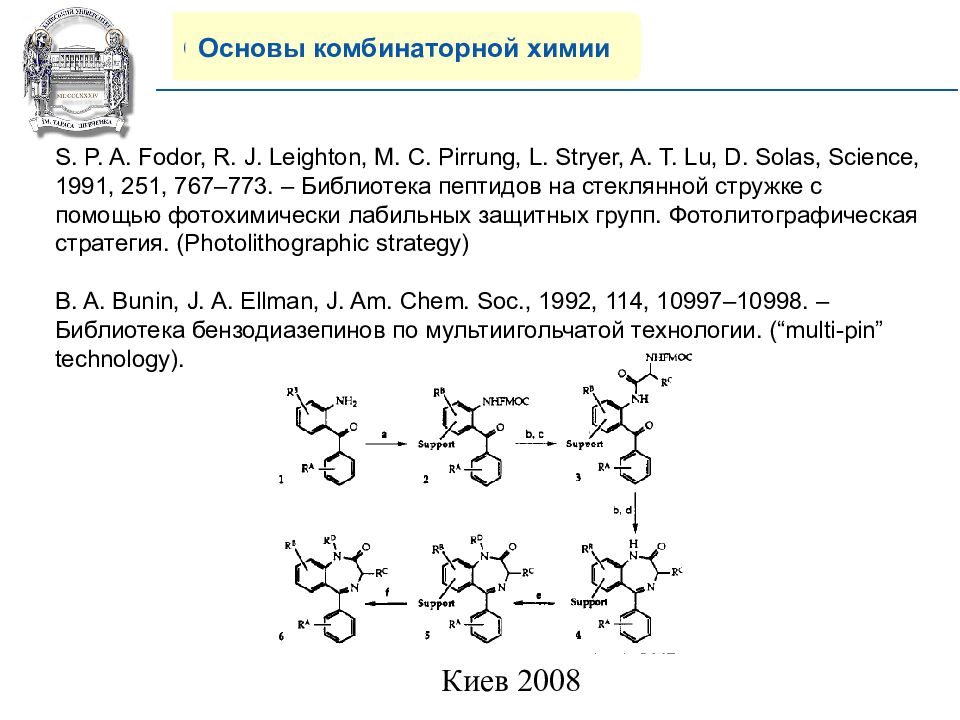
Основы комбинаторной химии S. P. A. Fodor, R. J. Leighton, M. C. Pirrung, L. Stryer, A. T. Lu, D. Solas, Science, 1991, 251, 767–773. – Библиотека пептидов на стеклянной стружке с помощью фотохимически лабильных защитных групп. Фотолитографическая стратегия. ( Photolithographic strategy) B. A. Bunin, J. A. Ellman, J. Am. Chem. Soc., 1992, 114, 10997–10998. – Библиотека бензодиазепинов по мультиигольчатой технологии. ( “multi-pin” technology).
Слайд 11: COMPANY PROFILE
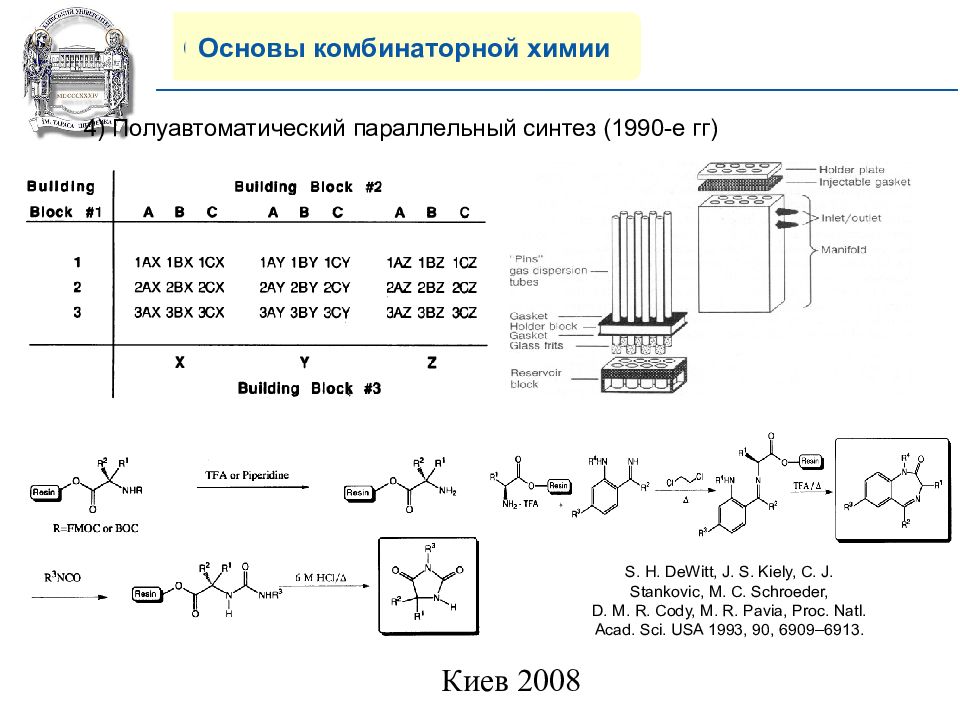
Основы комбинаторной химии 4 ) Полуавтоматический параллельный синтез (1990-е гг) S. H. DeWitt, J. S. Kiely, C. J. Stankovic, M. C. Schroeder, D. M. R. Cody, M. R. Pavia, Proc. Natl. Acad. Sci. USA 1993, 90, 6909–6913.
Слайд 12: COMPANY PROFILE
Основы комбинаторной химии 5) Разделительная стратегия (“Split” strategy, or “split & pool”). (1991 г) A. Furka, F. Sebestyen, M. Asgedom, G. Dibo, Int. J. Peptide Prot. Res. 1991, 37, 487–493. K. S. Lam, S. E. Salmon, E. M., Hersh, V. J. Hruby, W. M. Kazmierski, R. J. Knapp, Nature, 1991, 354, 82–84. R. A. Houghten, C. Pinilla, S. E., Blondelle, J. R., Appel, C. T. Dooley, J. H. Cuervo, Nature 1991, 354, 84–86.
Слайд 13: COMPANY PROFILE
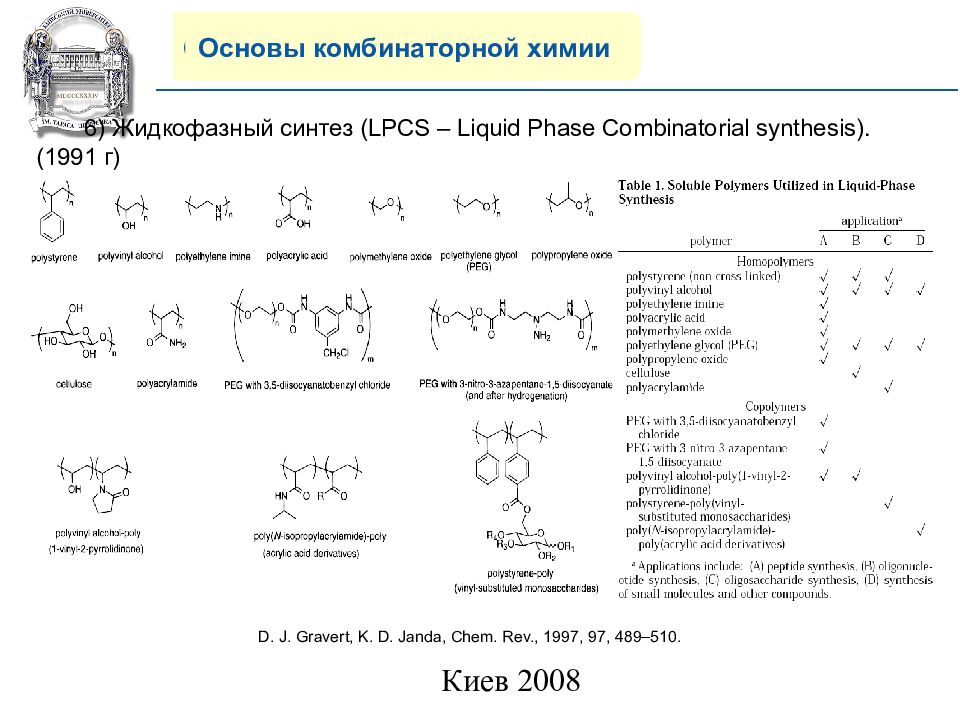
Основы комбинаторной химии 6) Жидкофазный синтез (LPCS – Liquid Phase Combinatorial synthesis). (1991 г) D. J. Gravert, K. D. Janda, Chem. Rev., 1997, 97, 489–510.
Слайд 14: COMPANY PROFILE
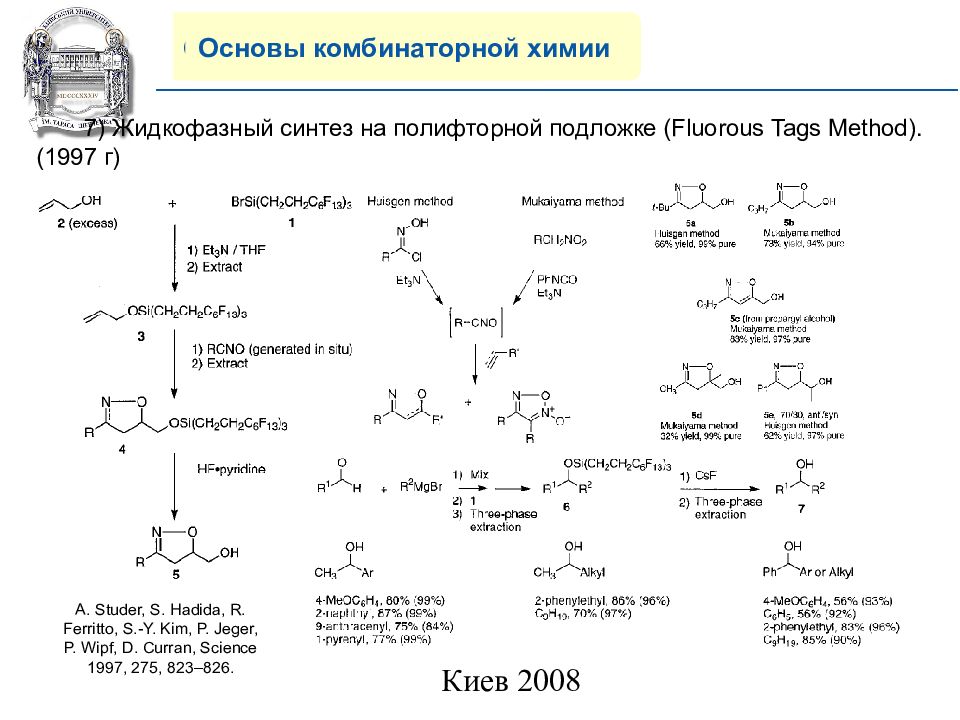
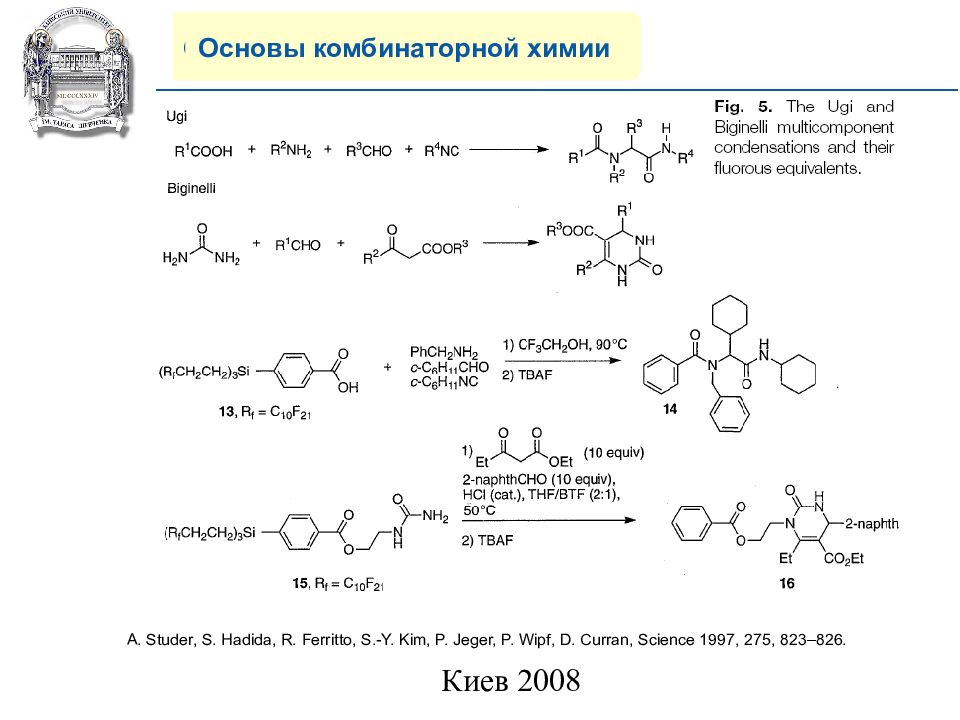
Основы комбинаторной химии 7) Жидкофазный синтез на полифторной подложке (Fluorous Tags Method). (199 7 г) A. Studer, S. Hadida, R. Ferritto, S.-Y. Kim, P. Jeger, P. Wipf, D. Curran, Science 1997, 275, 823–826.
Слайд 15: COMPANY PROFILE
Основы комбинаторной химии A. Studer, S. Hadida, R. Ferritto, S.-Y. Kim, P. Jeger, P. Wipf, D. Curran, Science 1997, 275, 823–826.
Слайд 16: COMPANY PROFILE
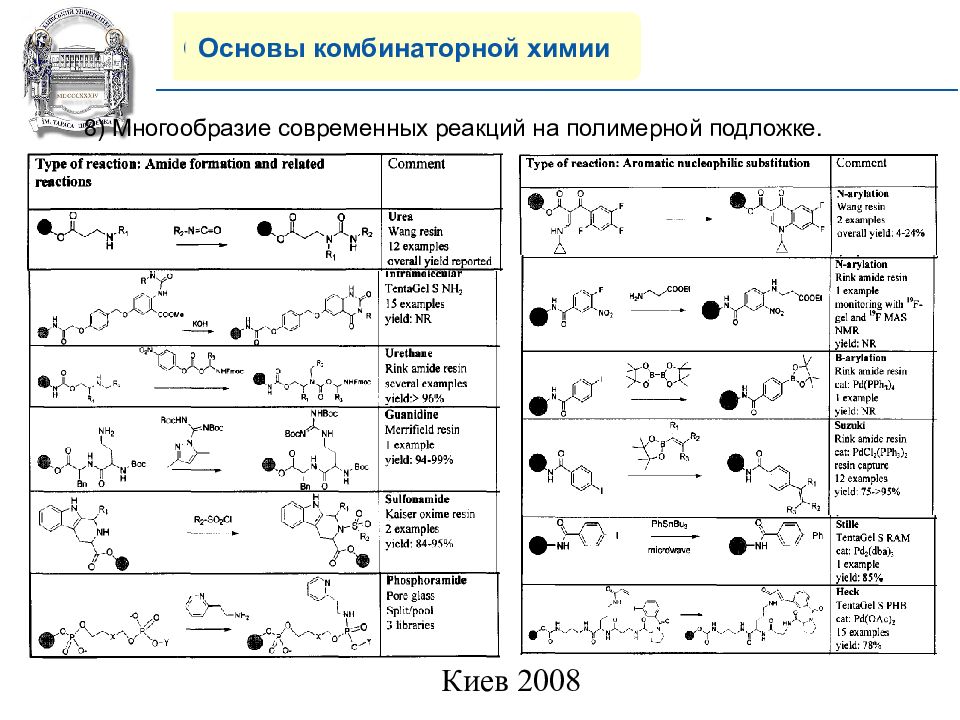
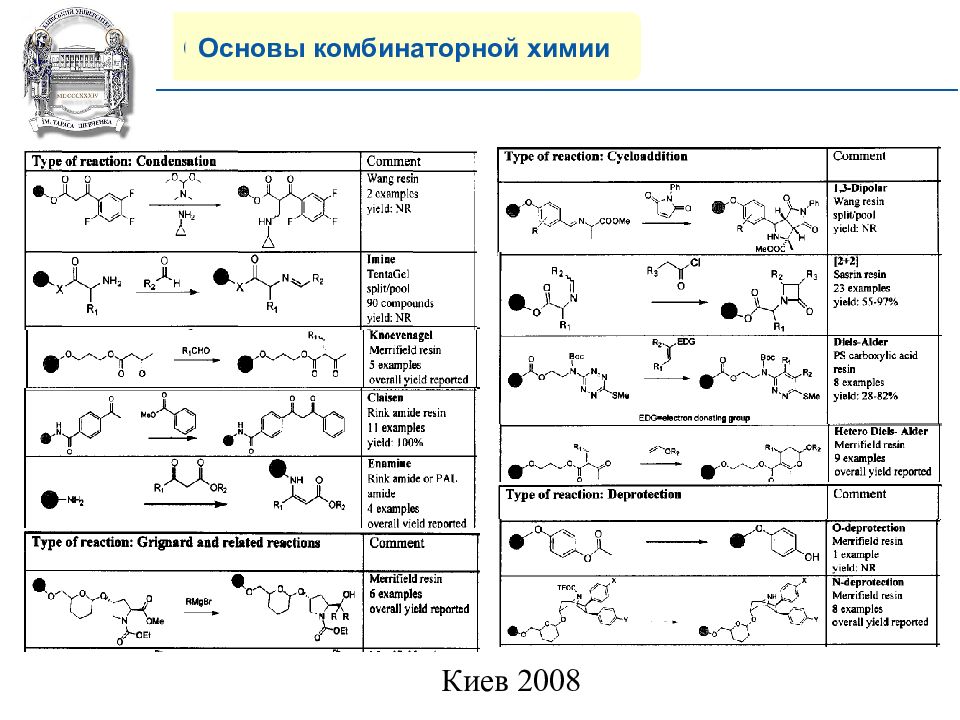
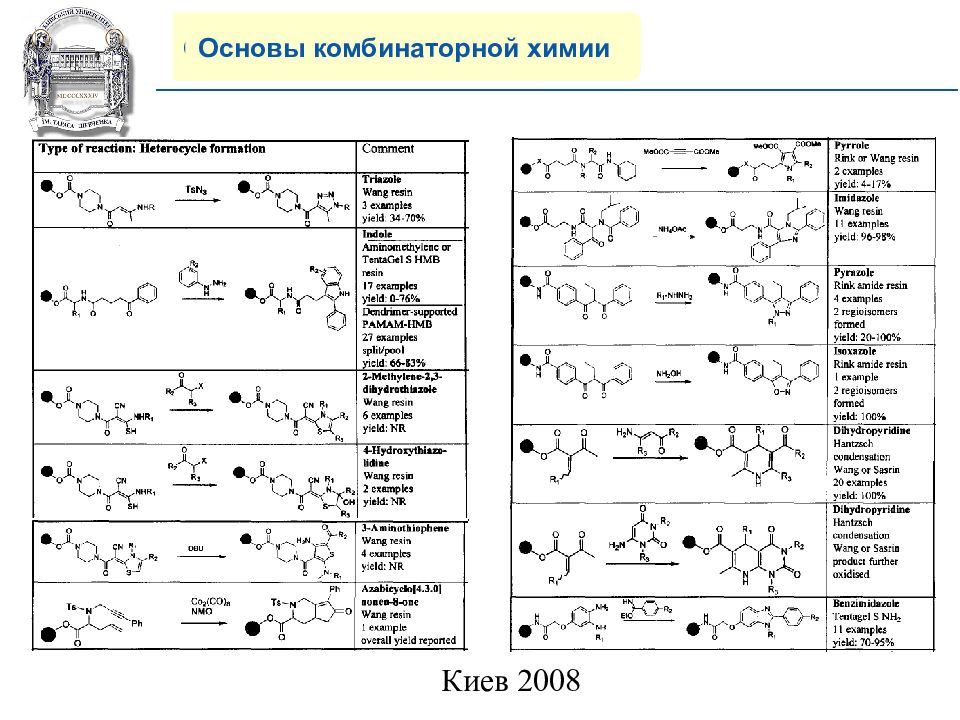
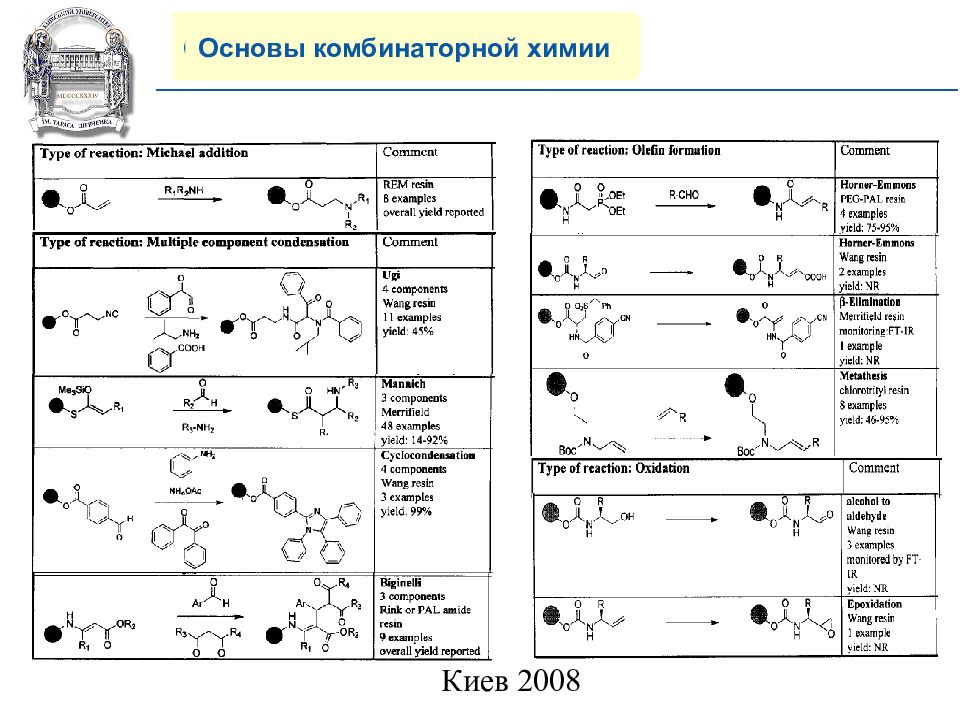
Основы комбинаторной химии 8) Многообразие современных реакций на полимерной подложке.
Слайд 20: COMPANY PROFILE
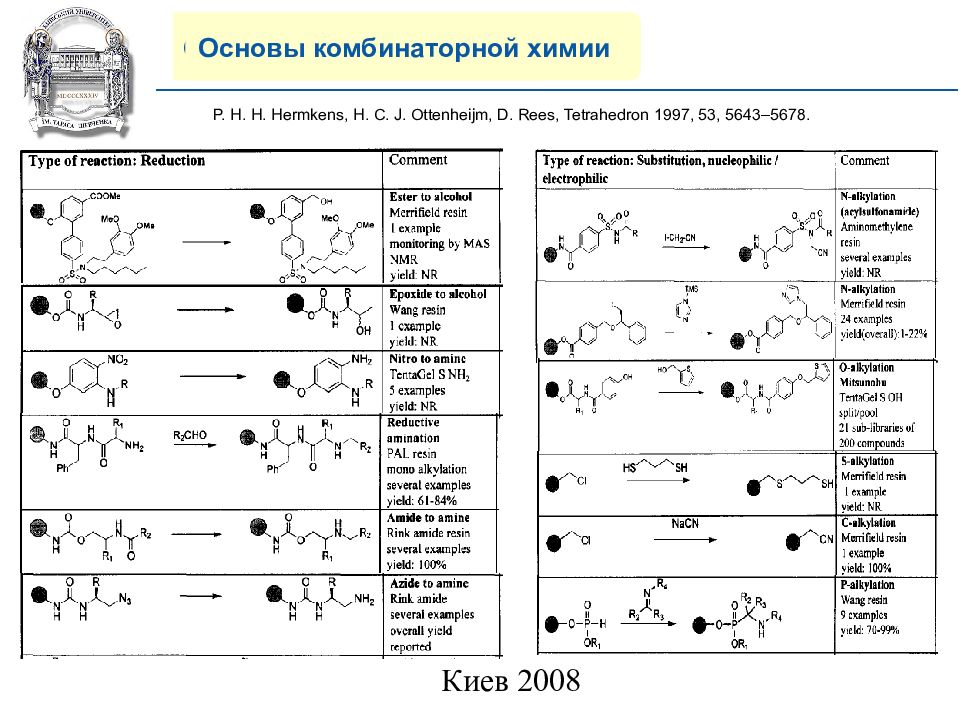
Основы комбинаторной химии P. H. H. Hermkens, H. C. J. Ottenheijm, D. Rees, Tetrahedron 1997, 53, 5643–5678.
Слайд 21: COMPANY PROFILE
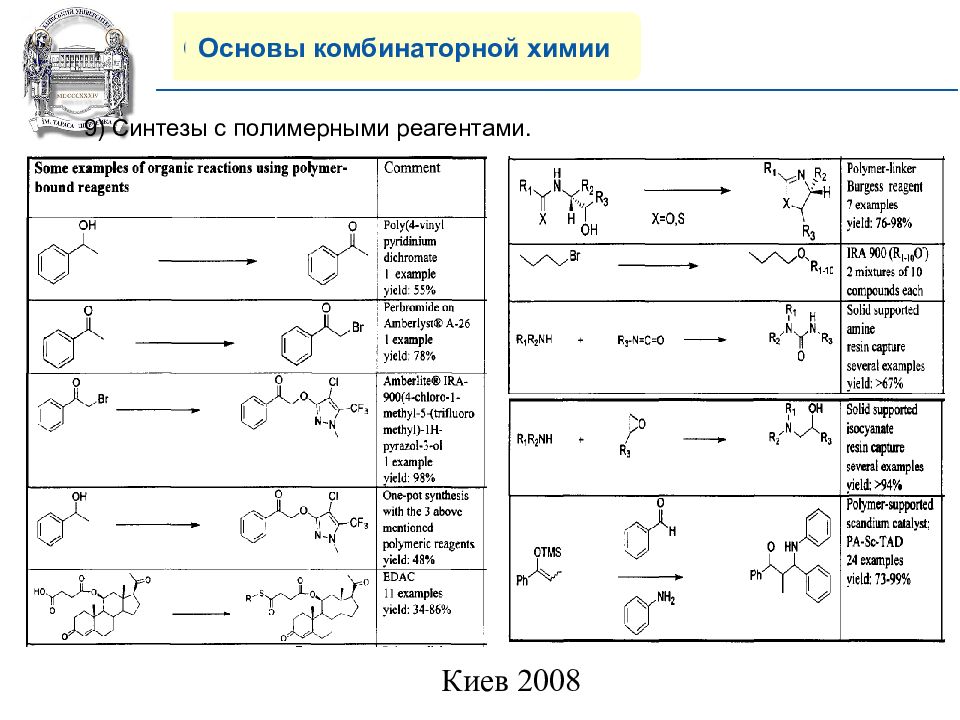
Основы комбинаторной химии 9) Синтезы с полимерными реагентами.
Слайд 22: COMPANY PROFILE
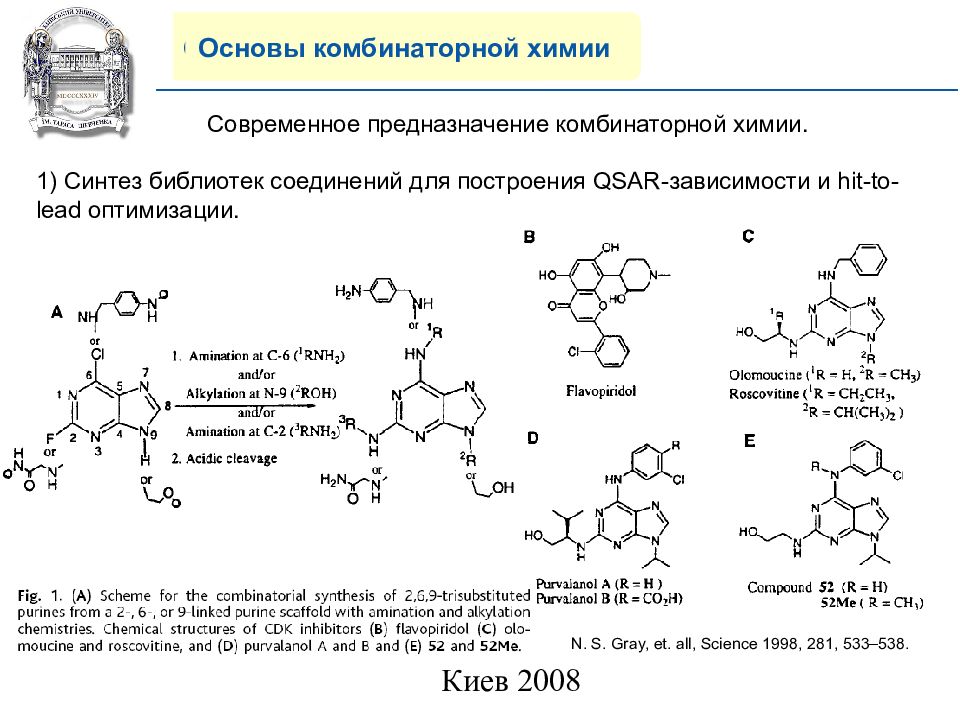
Основы комбинаторной химии Современное предназначение комбинаторной химии. 1) Синтез библиотек соединений для построения QSAR- зависимости и hit-to-lead оптимизации. N. S. Gray, et. all, Science 1998, 281, 533–538.
Слайд 23: COMPANY PROFILE
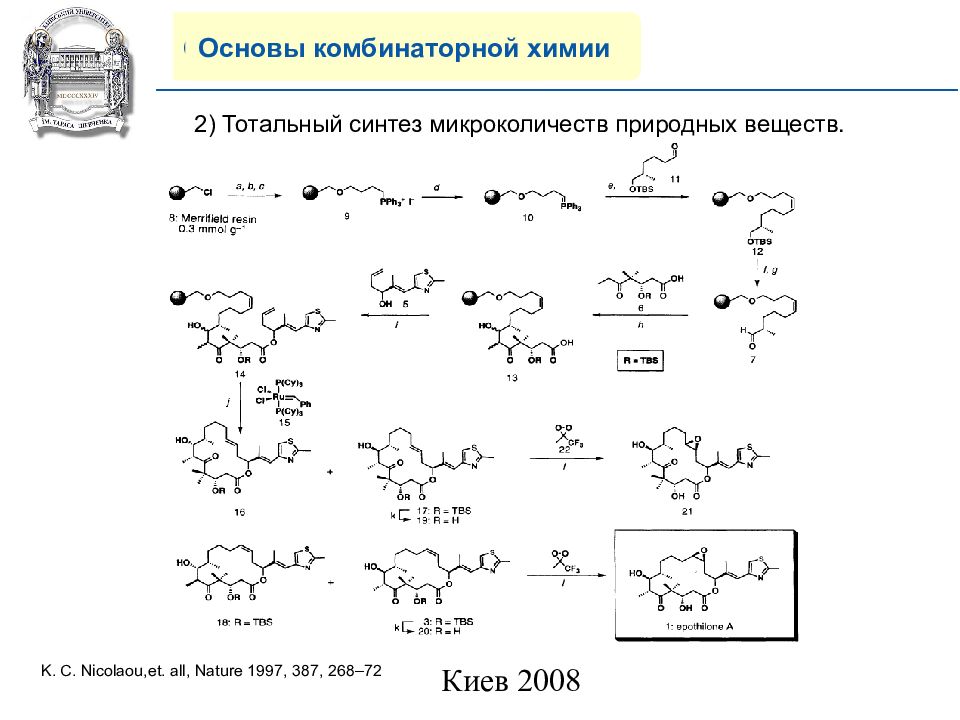
Основы комбинаторной химии 2 ) Тотальный синтез микроколичеств природных веществ. K. C. Nicolaou, et. all, Nature 1997, 387, 268–72
Слайд 24: COMPANY PROFILE
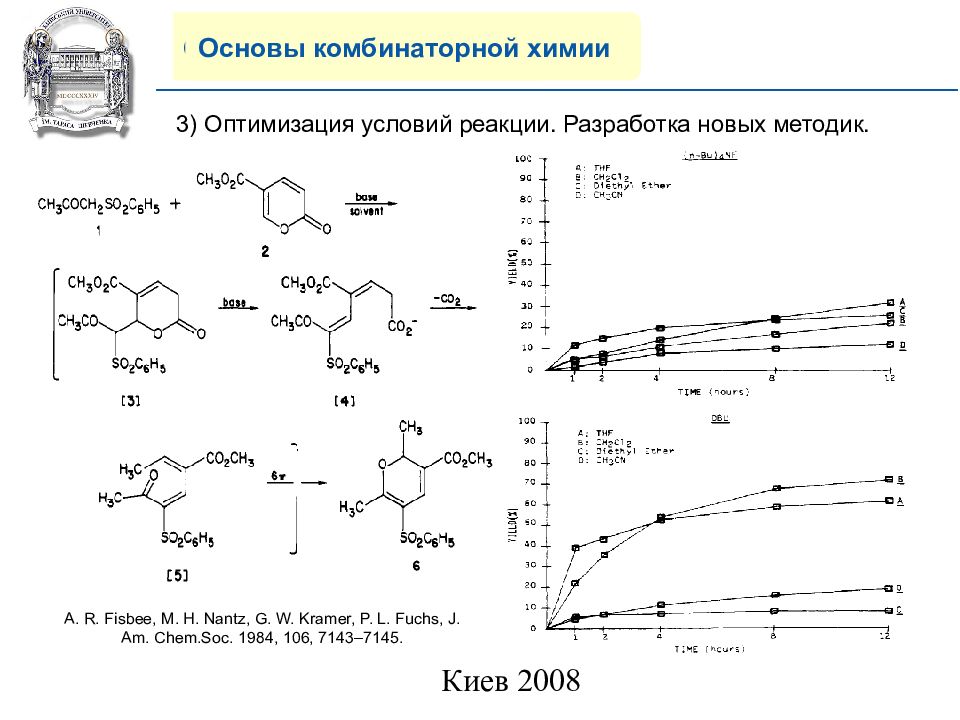
Основы комбинаторной химии 3 ) Оптимизация условий реакции. Разработка новых методик. A. R. Fisbee, M. H. Nantz, G. W. Kramer, P. L. Fuchs, J. Am. Chem.Soc. 1984, 106, 7143–7145.
Слайд 25: COMPANY PROFILE
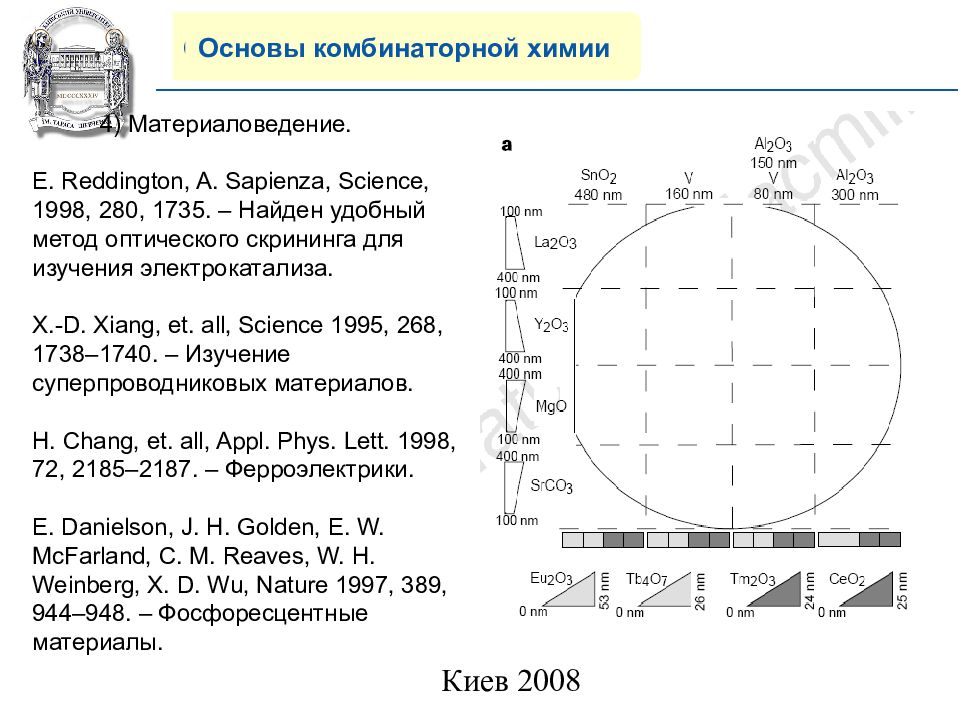
Основы комбинаторной химии 4) Материаловедение. E. Reddington, A. Sapienza, Science, 1998, 280, 1735. – Найден удобный метод оптического скрининга для изучения электрокатализа. X.-D. Xiang, et. all, Science 1995, 268, 1738–1740. – Изучение суперпроводниковых материалов. H. Chang, et. all, Appl. Phys. Lett. 1998, 72, 2185–2187. – Ферроэлектрики. E. Danielson, J. H. Golden, E. W. McFarland, C. M. Reaves, W. H. Weinberg, X. D. Wu, Nature 1997, 389, 944–948. – Фосфоресцентные материалы.
Слайд 26: COMPANY PROFILE
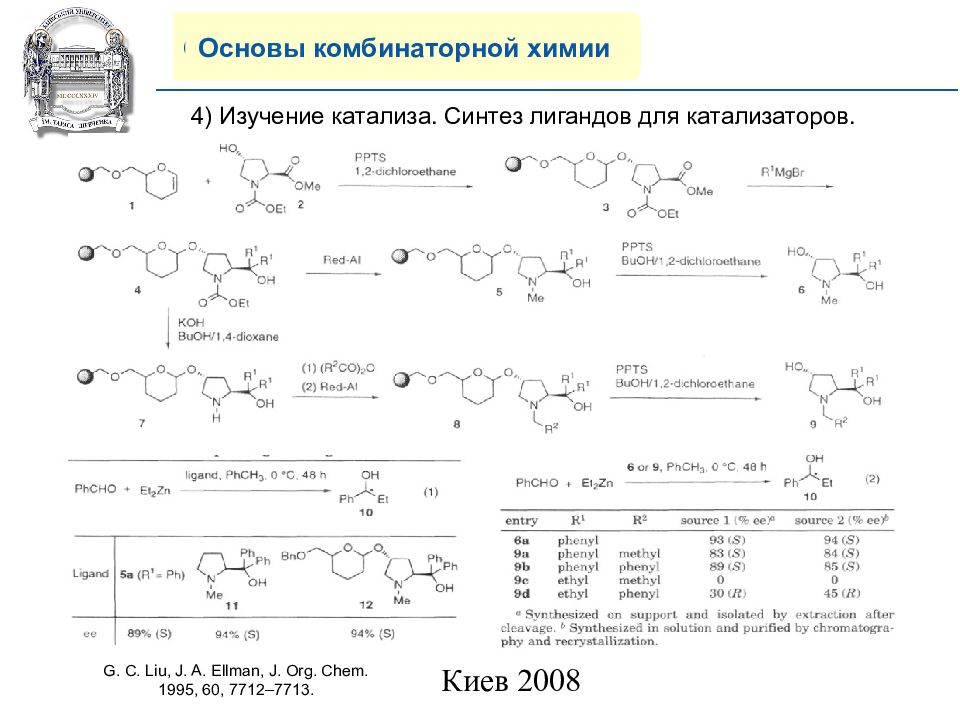
Основы комбинаторной химии 4) Изучение катализа. Синтез лигандов для катализаторов. G. C. Liu, J. A. Ellman, J. Org. Chem. 1995, 60, 7712–7713.
Слайд 27: COMPANY PROFILE
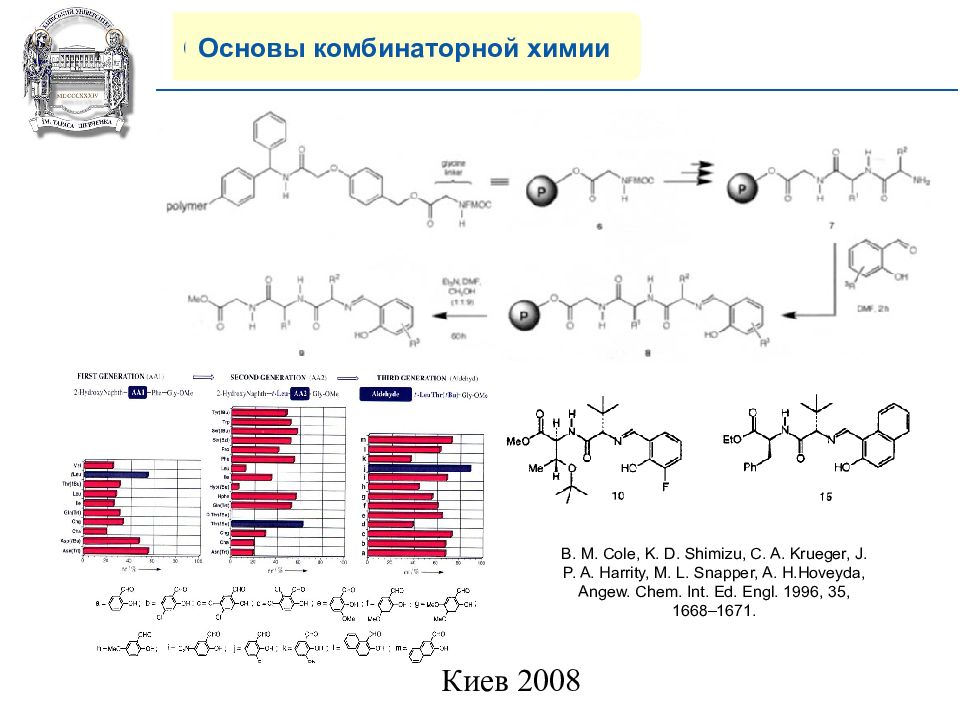
Основы комбинаторной химии B. M. Cole, K. D. Shimizu, C. A. Krueger, J. P. A. Harrity, M. L. Snapper, A. H.Hoveyda, Angew. Chem. Int. Ed. Engl. 1996, 35, 1668–1671.
Слайд 28: COMPANY PROFILE
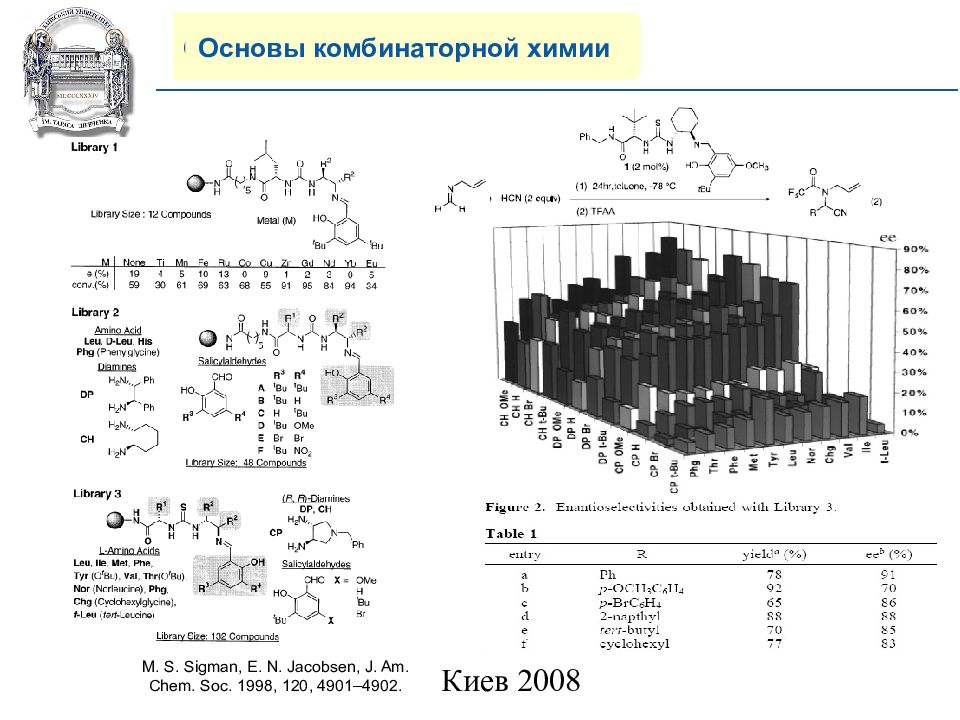
Основы комбинаторной химии M. S. Sigman, E. N. Jacobsen, J. Am. Chem. Soc. 1998, 120, 4901–4902.
Слайд 29
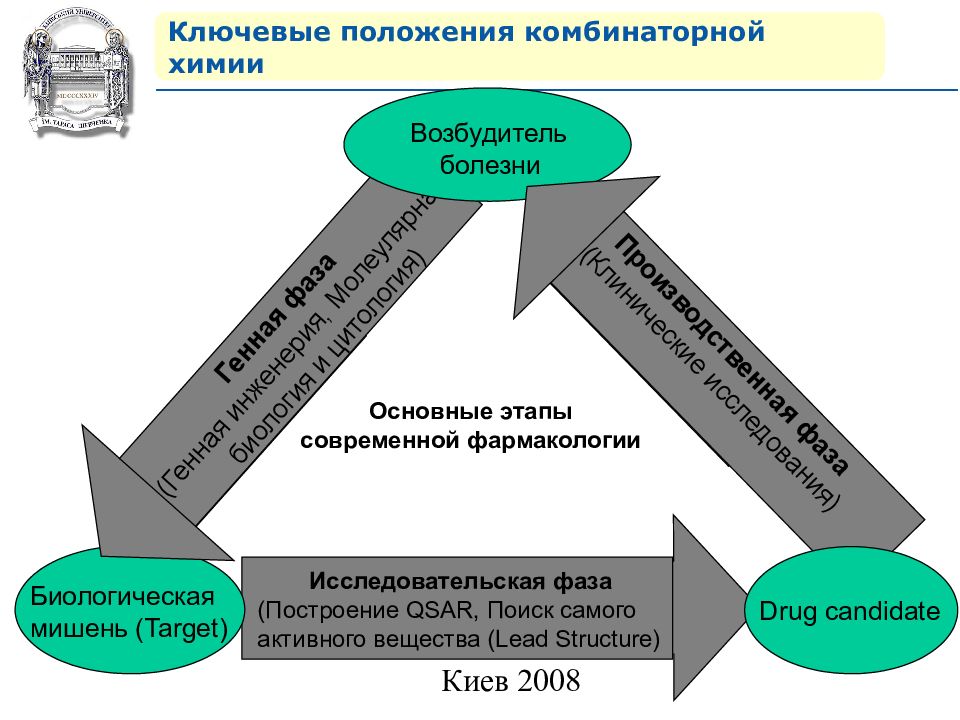
Исследовательская фаза (Построение QSAR, Поиск самого активного вещества ( Lead Structure ) Биологическая мишень ( Target) Генная фаза (Генная инженерия, Молеулярная биология и цитология) Возбудитель болезни Производственная фаза (Клинические исследования) Основные этапы современной фармакологии Ключевые положения комбинаторной химии Drug candidate
Слайд 30
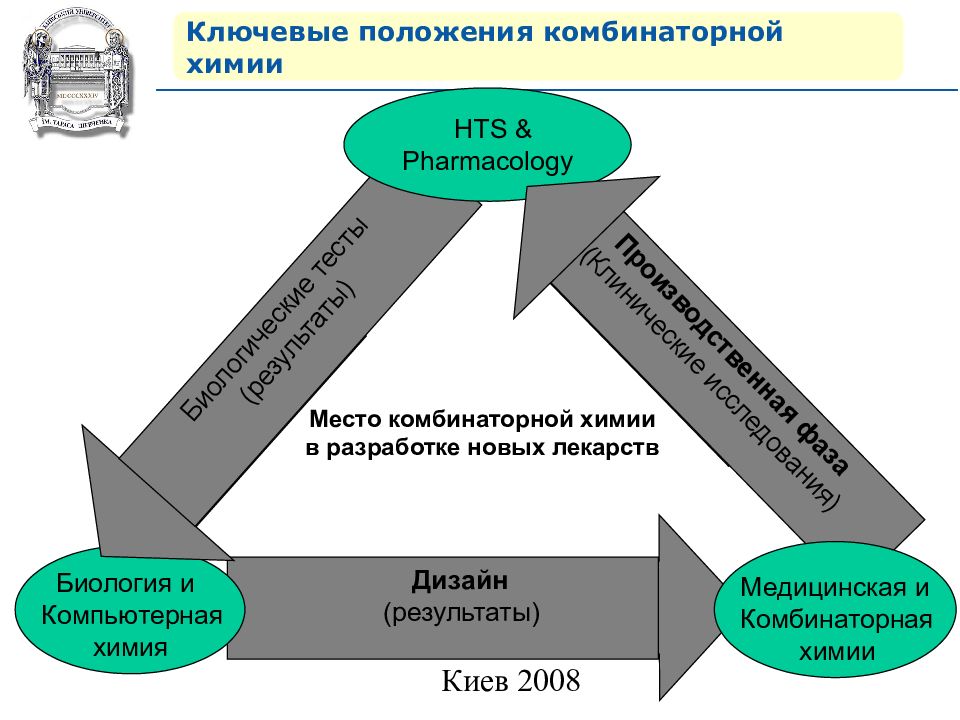
Дизайн (результаты) Ключевые положения комбинаторной химии Биология и Компьютерная химия Биологические тесты (результаты) HTS & Pharmacology Производственная фаза (Клинические исследования) Место комбинаторной химии в разработке новых лекарств Медицинская и Комбинаторная химии
Слайд 31
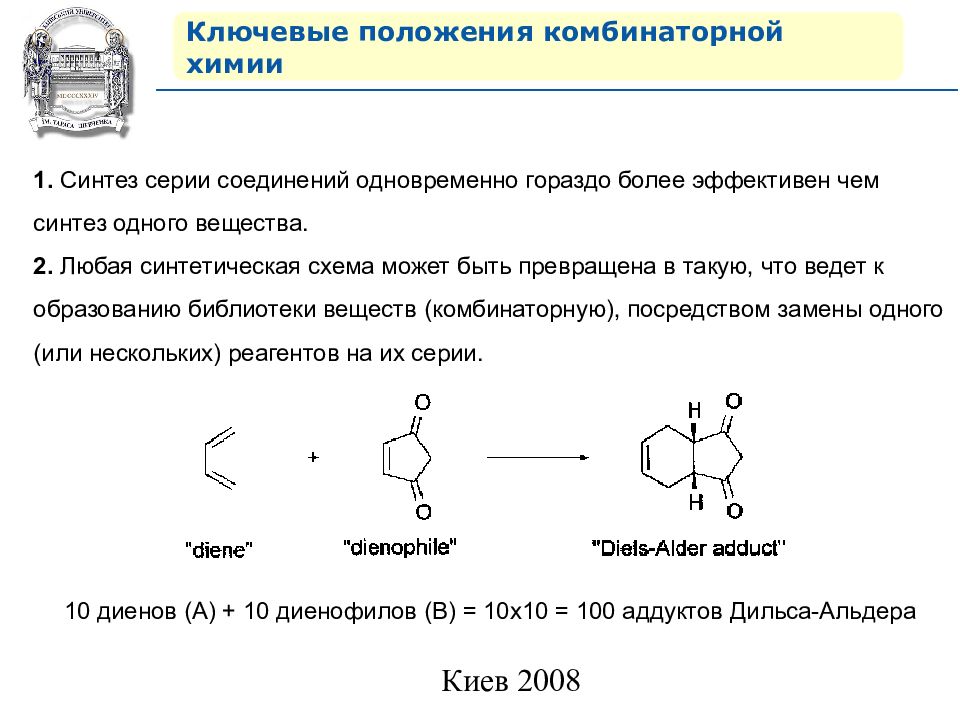
Ключевые положения комбинаторной химии 1. Синтез серии соединений одновременно гораздо более эффективен чем синтез одного вещества. 2. Любая синтетическая схема может быть превращена в такую, что ведет к образованию библиотеки веществ (комбинаторную), посредством замены одного (или нескольких) реагентов на их серии. 10 диенов (А) + 10 диенофилов (В) = 10х10 = 100 аддуктов Дильса-Альдера
Слайд 32
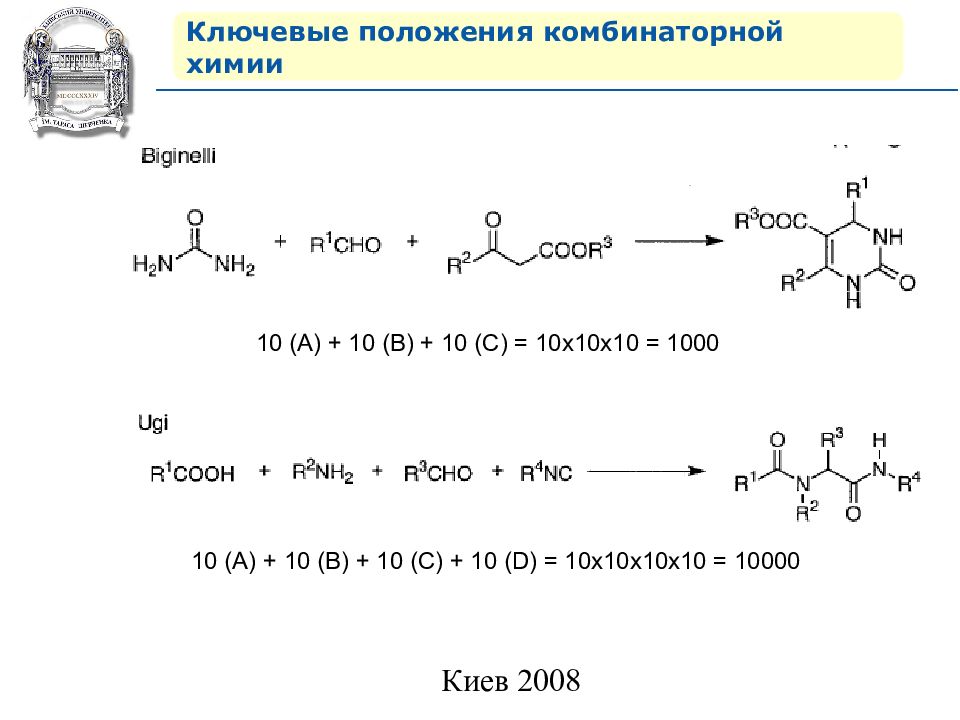
Ключевые положения комбинаторной химии 10 (А) + 10 (В) + 10 ( С ) = 10х10х10 = 1000 10 (А) + 10 (В) + 10 ( С ) + 10 (D) = 10х10х10 x10 = 1000 0
Слайд 33
Ключевые положения комбинаторной химии 3. Качественный дизайн продуктов синтеза критичен. Большой набор соединений не компенсирует плохого дизайна. 4. Производительность “ классической ” органической химии может быть значительно увеличена заменяя последовательную обработку синтезов параллельной. 5. Лабораторная автоматизация, робототехника и мультизадачное химическое оборудование являются неотъемлемой частью комбинаторной химии. 6. Разумный синтетический путь обязан гарантировать желательный результат. 7. Эффективная электронная система контроля синтезов – необходимая часть комбинаторной химии.
Слайд 34
Ключевые положения комбинаторной химии 8. Анализ структуры и контроль качества настолько же важны для комбинаторной химии, как и для любой другой, однако время в данном случае становится критичным. 9. Поскольку цель комбинаторной химии состоит в том, чтобы облегчить открытие новых соединений с полезными свойствами, комбинаторные синтезы должны быть воспроизводимыми и масштабируемыми. 10. Комбинаторная химия - увеличивающий производительность инструмент для химиков, занятых в фармацевтических и агрохимических исследованиях, изучении катализа, материаловедении, то есть в любой области химии, где получение и тестирование новых соединений - существенный элемент открытия.
Слайд 35
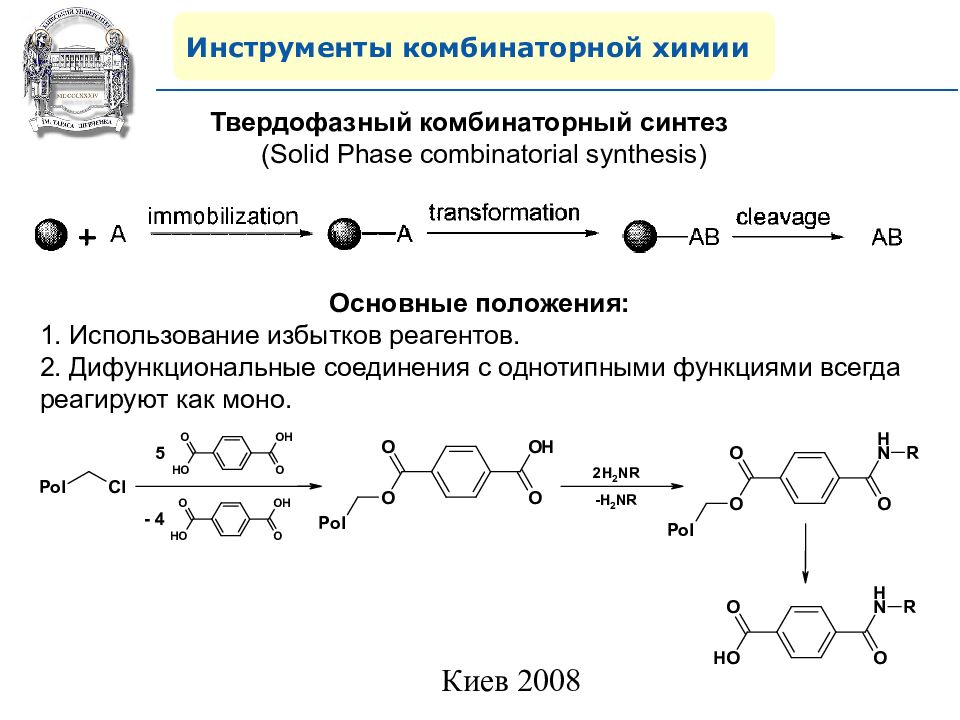
Инструменты комбинаторной химии Твердофазный комбинаторный синтез ( Solid Phase combinatorial synthesis) Основные положения: 1. Использование избытков реагентов. 2. Дифункциональные соединения с однотипными функциями всегда реагируют как моно.
Слайд 36
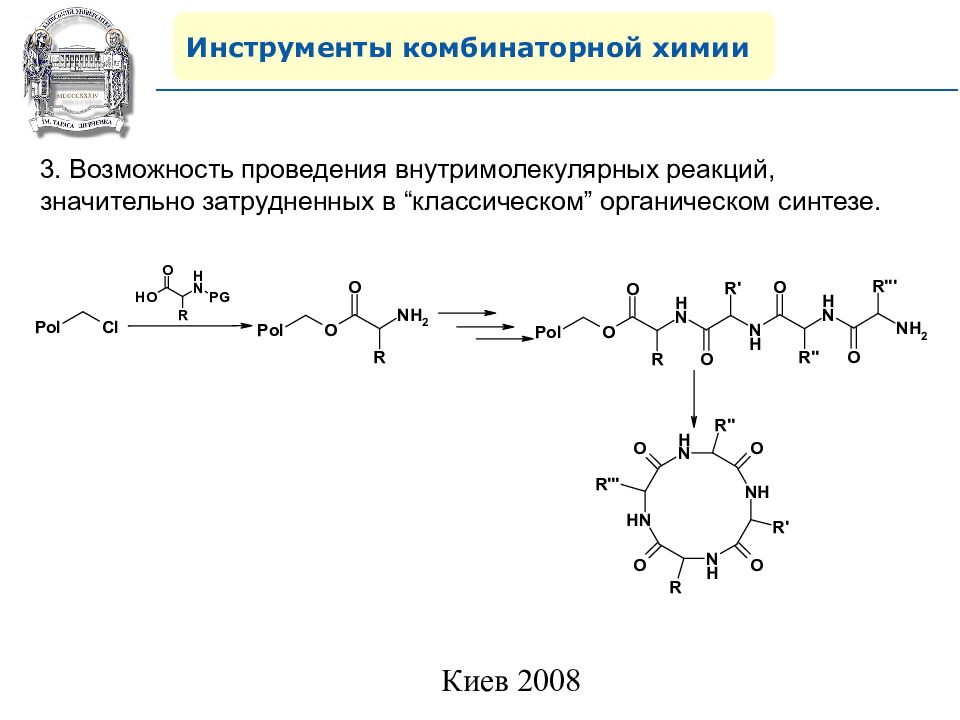
Инструменты комбинаторной химии 3. Возможность проведения внутримолекулярных реакций, значительно затрудненных в “ классическом ” органическом синтезе.
Слайд 37
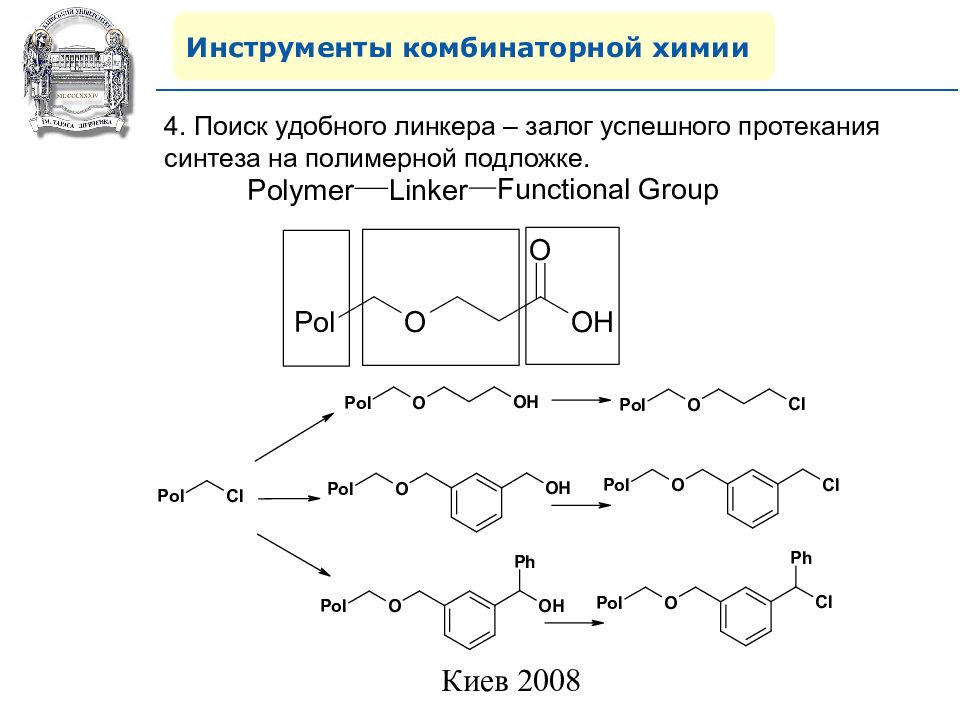
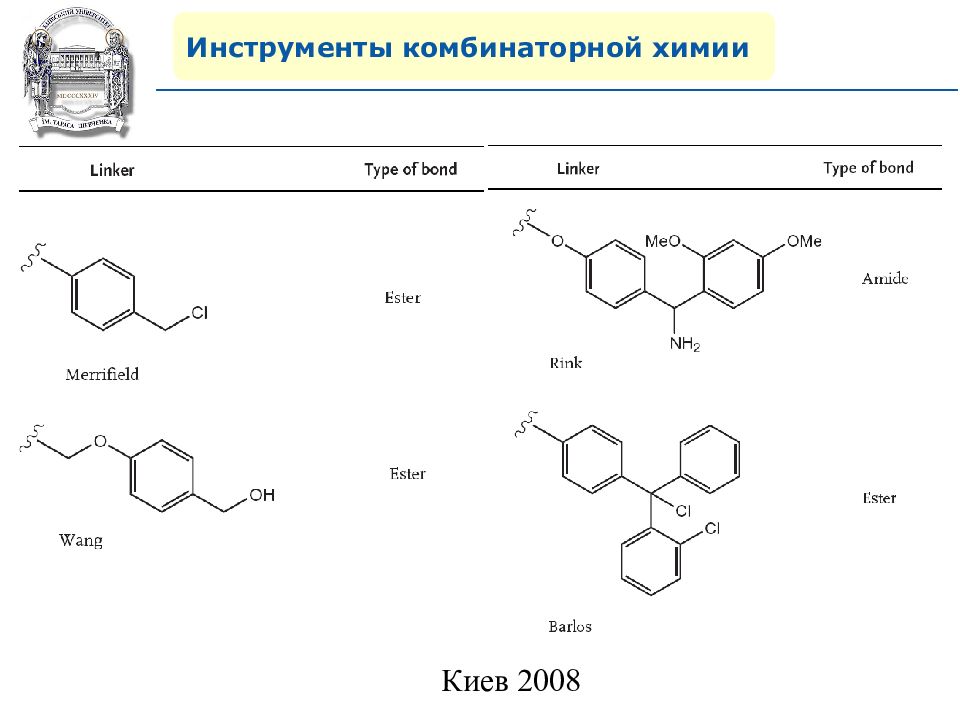
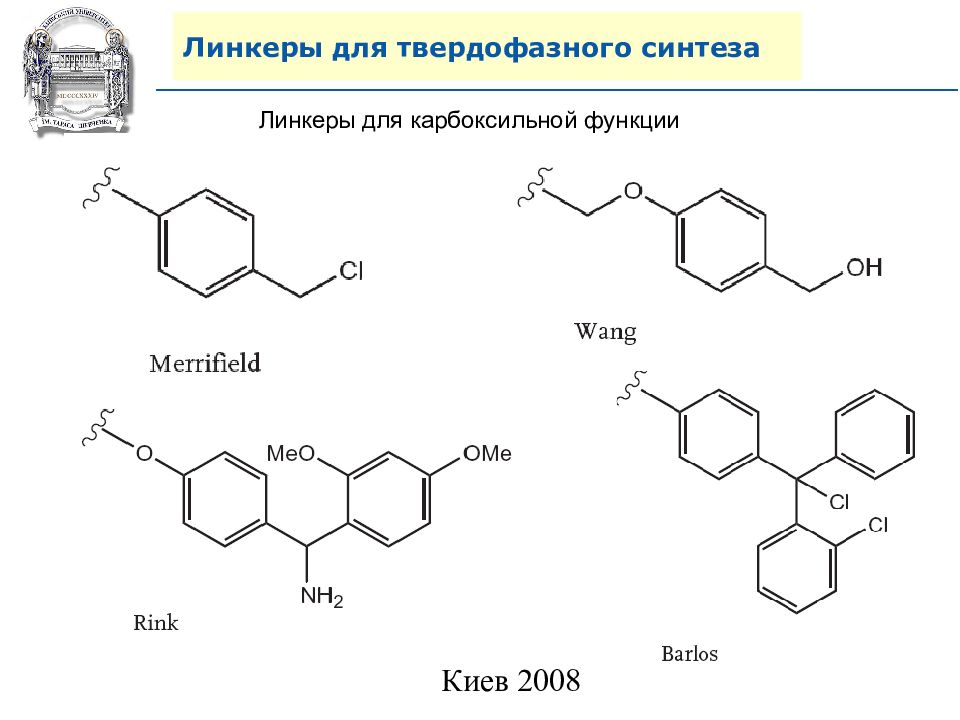
Инструменты комбинаторной химии 4. Поиск удобного линкера – залог успешного протекания синтеза на полимерной подложке.
Слайд 39
Инструменты комбинаторной химии 5. Набор растворителей пригодный для твердофазного синтеза ограничен, и зависит от типа полимера. 6. Диапазон температур комфортный для проведения твердофазных реакций 20 º С - 90 º С 7. В твердофазном синтезе эффективна только одна твердая фаза. 8. Анализ веществ на полимерной подложке сильно затруднен. Пригодные растворители Не пригодные растворители Диметилформамид Диэтиловый эфир Дихлорметан Этилацетат Хлороформ Спирты Тетрагидрофуран Ацетонитрил Толуол Ацетон Бензол Вода Диоксан ДМСО
Слайд 40
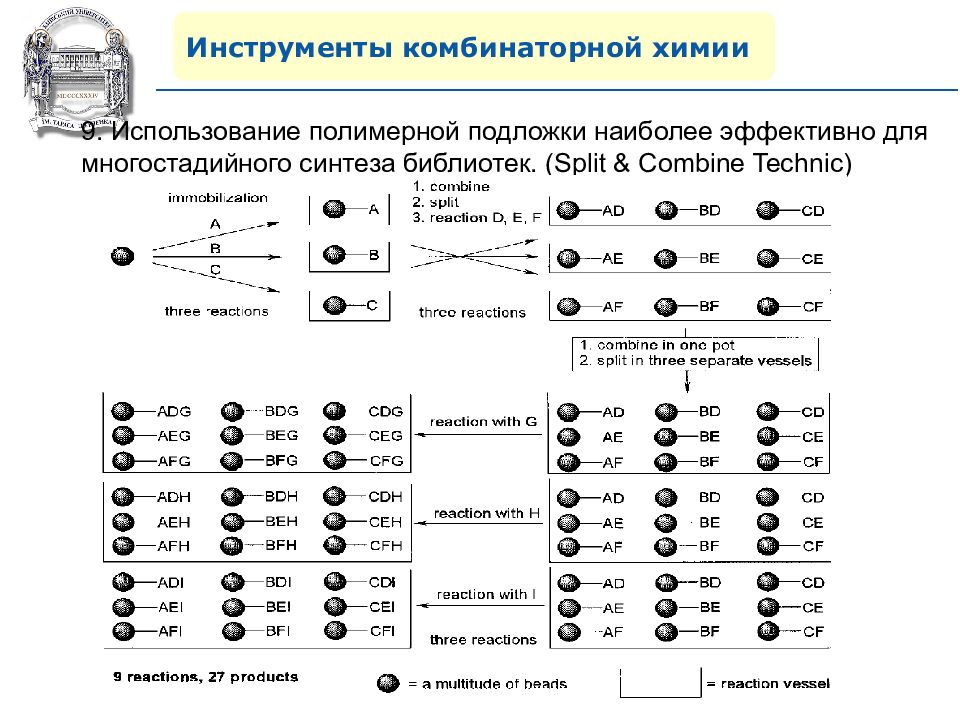
Инструменты комбинаторной химии 9. Использование полимерной подложки наиболее эффективно для многостадийного синтеза библиотек. ( Split & Combine Technic)
Слайд 41
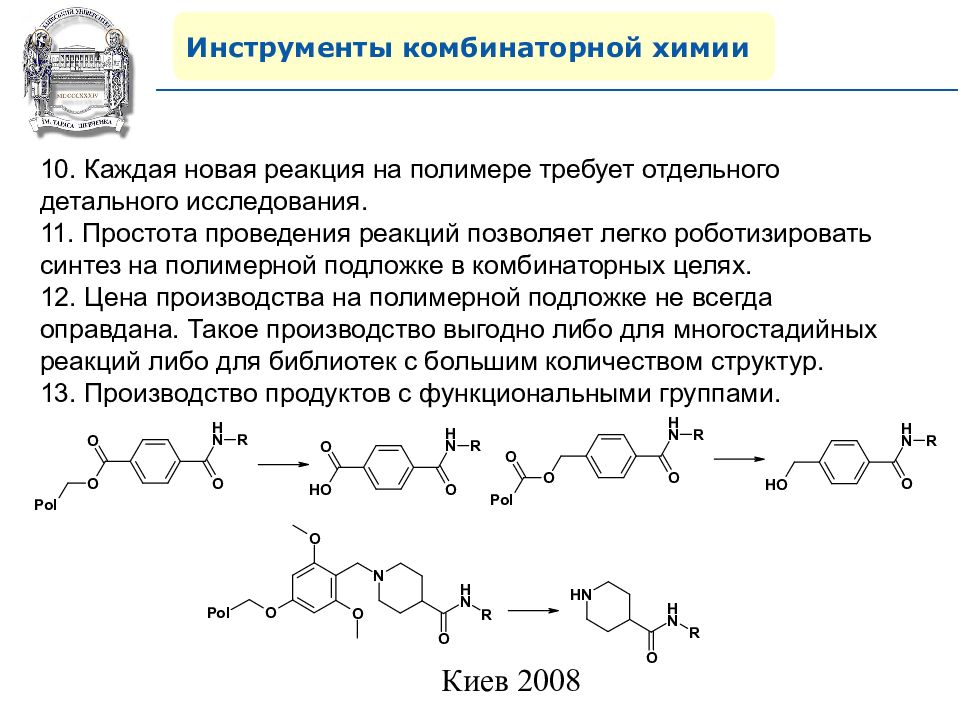
Инструменты комбинаторной химии 10. Каждая новая реакция на полимере требует отдельного детального исследования. 11. Простота проведения реакций позволяет легко роботизировать синтез на полимерной подложке в комбинаторных целях. 12. Цена производства на полимерной подложке не всегда оправдана. Такое производство выгодно либо для многостадийных реакций либо для библиотек с большим количеством структур. 13. Производство продуктов с функциональными группами.
Слайд 42
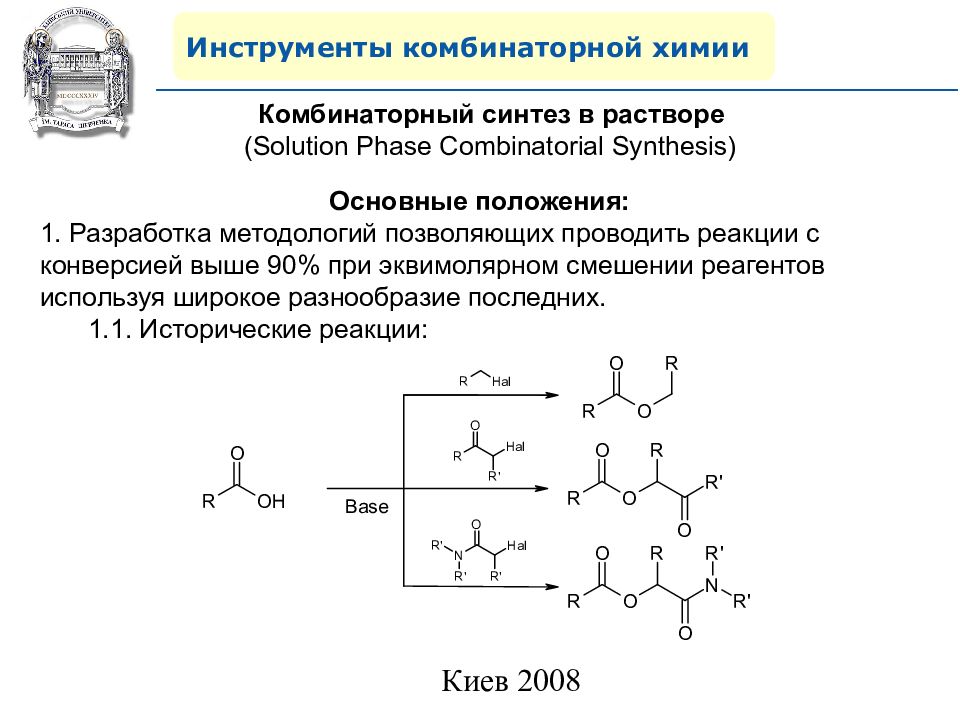
Инструменты комбинаторной химии Комбинаторный синтез в растворе ( Solution Phase Combinatorial Synthesis) Основные положения: 1. Разработка методологий позволяющих проводить реакции с конверсией выше 90% при эквимолярном смешении реагентов используя широкое разнообразие последних. 1.1. Исторические реакции:
Слайд 43
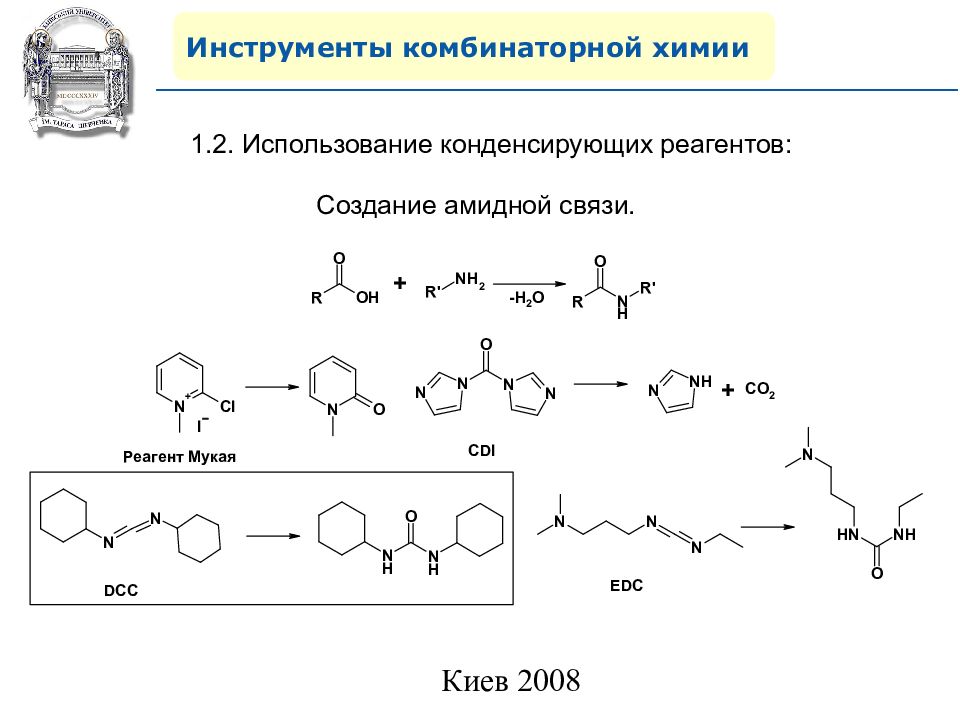
Инструменты комбинаторной химии 1.2. Использование конденсирующих реагентов: Создание амидной связи.
Слайд 44
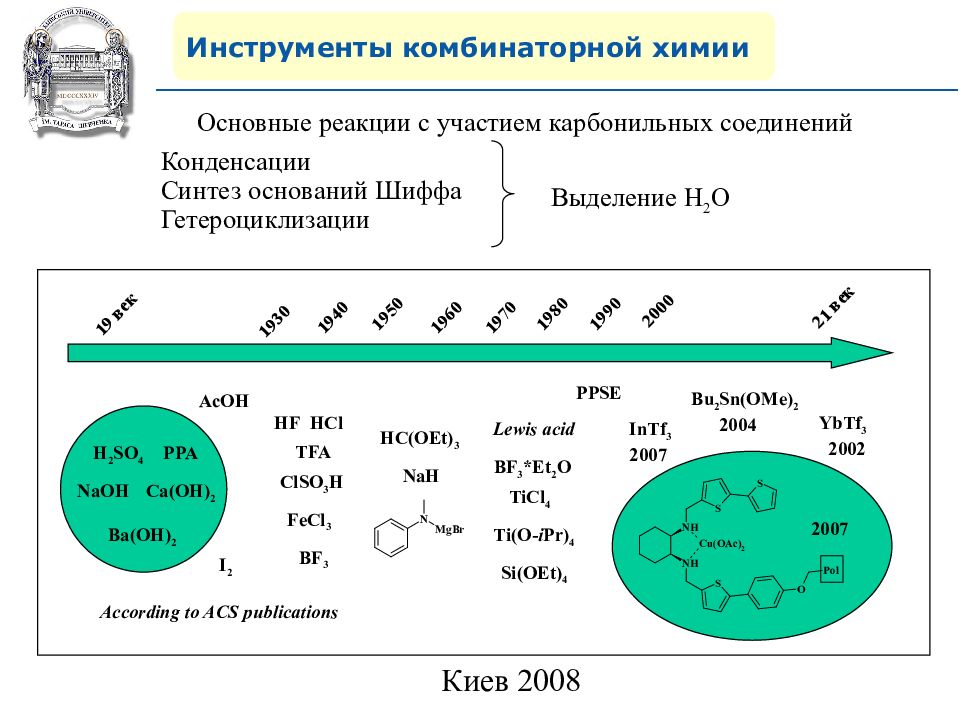
Инструменты комбинаторной химии 19 век 1930 1940 1950 1960 1970 1980 1990 2000 21 век Ca(OH) 2 H 2 SO 4 PPA NaOH HCl Ba(OH) 2 FeCl 3 HF TFA AcOH ClSO 3 H BF 3 I 2 NaH Lewis acid BF 3 *Et 2 O TiCl 4 Ti(O- i Pr) 4 Si(OEt) 4 HC(OEt) 3 Bu 2 Sn(OMe) 2 2004 InTf 3 2007 YbTf 3 2002 2007 According to ACS publications PPSE Основные реакции с участием карбонильных соединений Конденсации Синтез оснований Шиффа Гетероциклизации Выделение H 2 O
Слайд 45: Инструменты комбинаторной химии
устойчивость к действию воздуха и устойчивость во времени при хранении и использовании легкая доступность широкие границы применения возможность использования в смеси с органическими растворителя-ми и другими реагентами высокая активность при нормальных условиях и возможность использования при повышенной температуре простая и удобная синтетическая процедура применения высокая хемоселективность и степень конверсии удобная процедура очистки целевых продуктов от избытка реагента и продуктов его модификации Современные критерии поиска новых конденсирующих реагентов для комбинаторного синтеза
Слайд 46: Инструменты комбинаторной химии
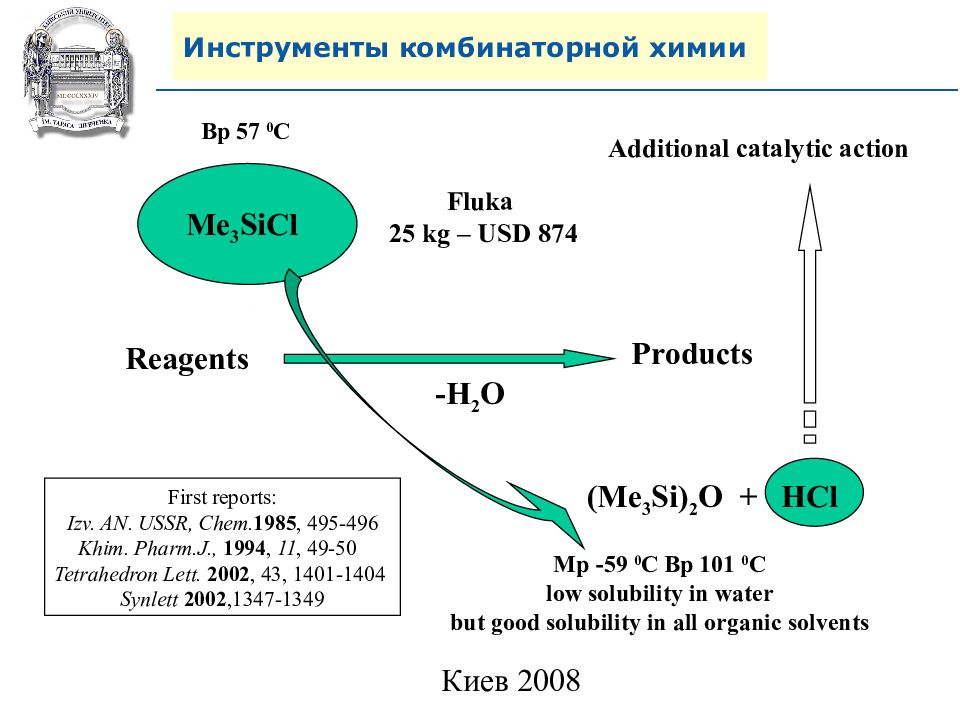
Reagents Products -H 2 O Me 3 SiCl (Me 3 Si) 2 O + HCl Mp -59 0 C Bp 101 0 C low solubility in water but good solubility in all organic solvents Bp 57 0 C Fluka 25 kg – USD 874 First reports: Izv. АN. USSR, Chem. 1985, 495-496 Khim. Pharm.J., 1994, 11, 49-50 Tetrahedron Lett. 2002, 43, 1401-1404 Synlett 2002, 1347-1349 Additional catalytic action
Слайд 47
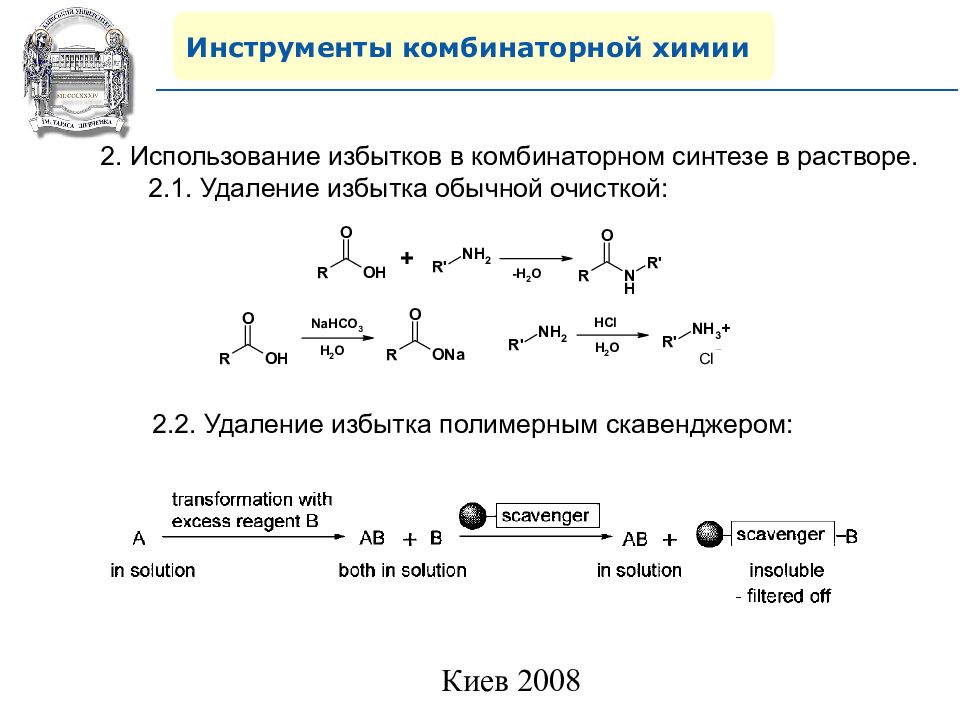
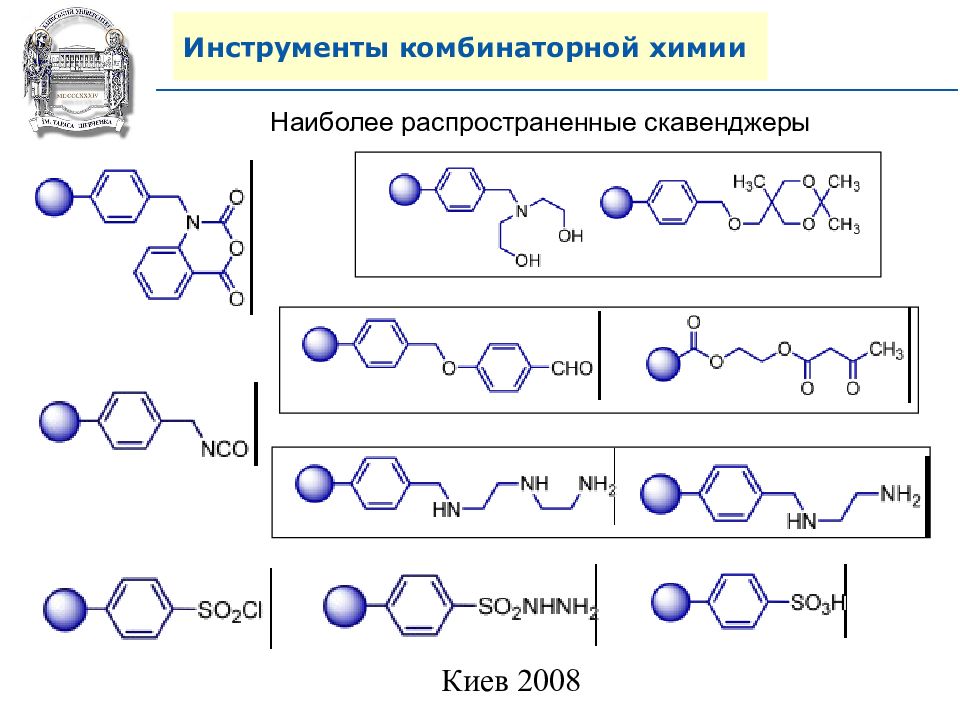
Инструменты комбинаторной химии 2. Использование избытков в комбинаторном синтезе в растворе. 2.1. Удаление избытка обычной очисткой: 2.2. Удаление избытка полимерным скавенджером:
Слайд 49: Инструменты комбинаторной химии
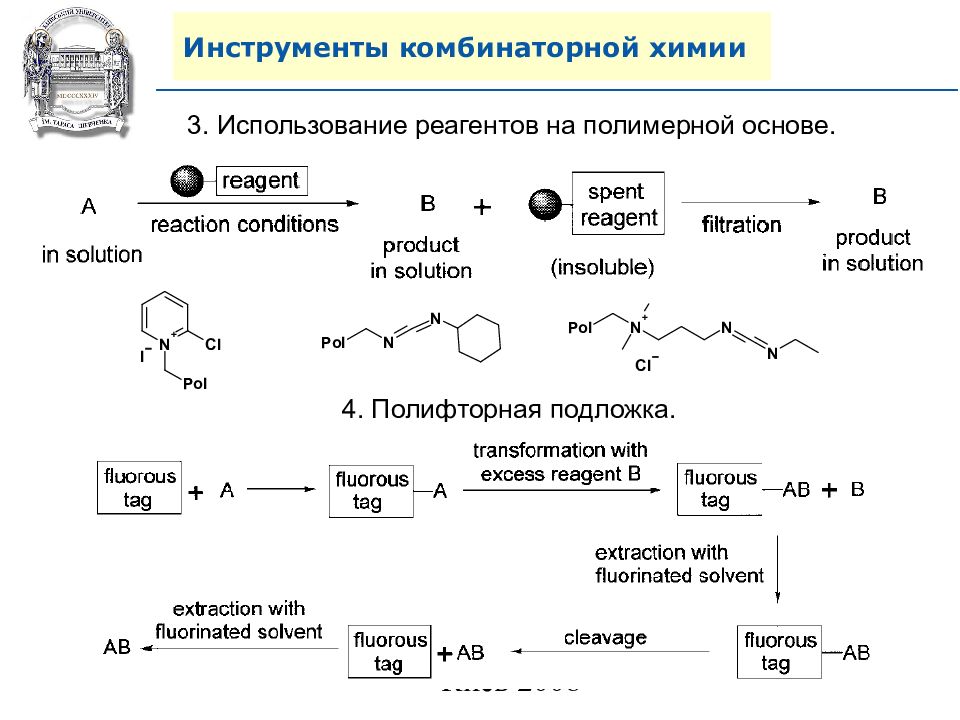
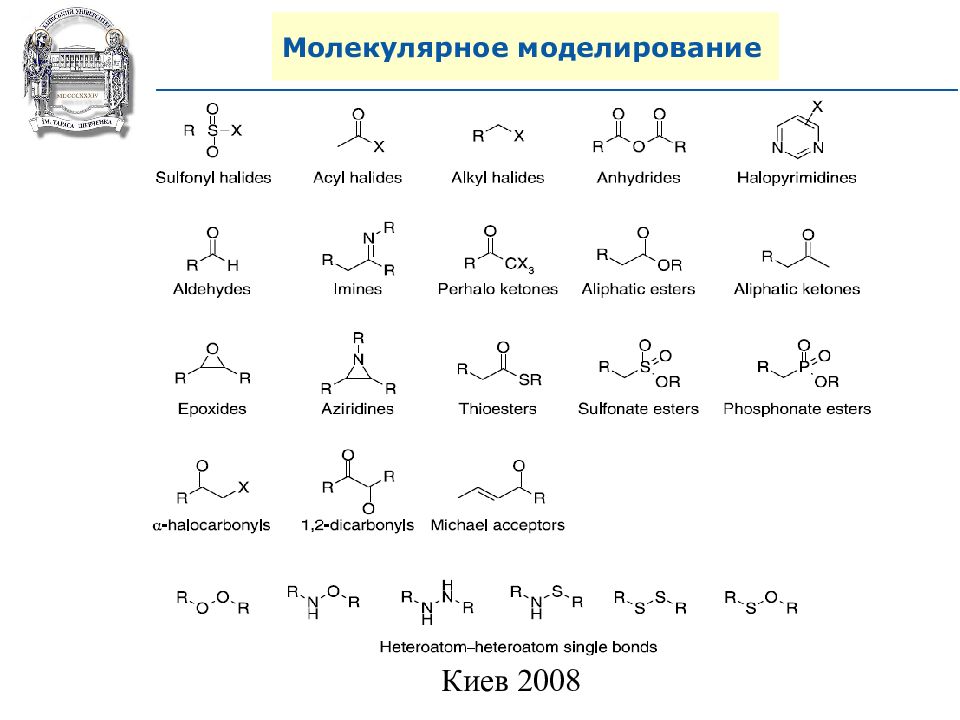
3. Использование реагентов на полимерной основе. 4. Полифторная подложка.
Слайд 50: Полимеры для твердофазного синтеза
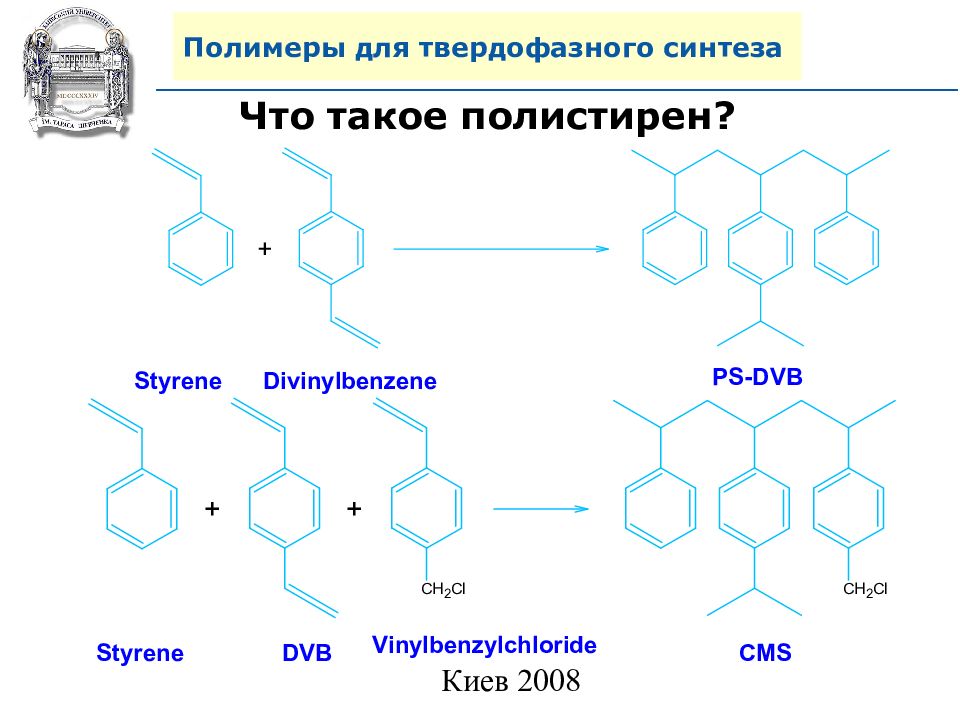
Что такое полистирен ? Styrene Divinylbenzene PS-DVB Styrene DVB Vinylbenzylchloride CMS
Слайд 51: Полимеры для твердофазного синтеза
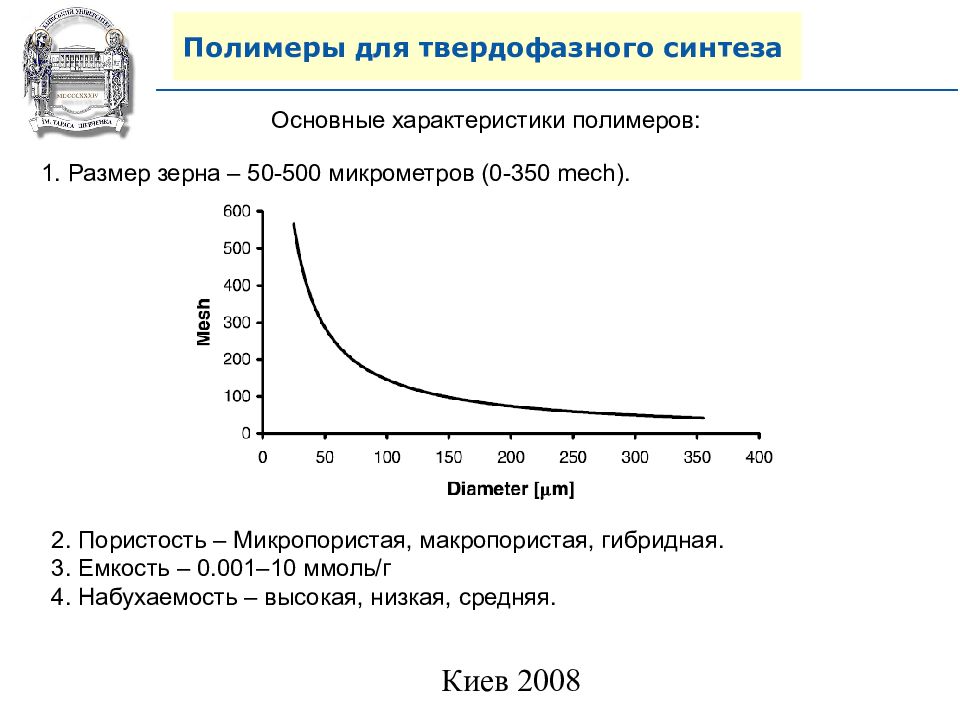
Основные характеристики полимеров: 1. Размер зерна – 50-500 микрометров (0-350 mech). 2. Пористость – Микропористая, макропористая, гибридная. 3. Емкость – 0.001–10 ммоль/г 4. Набухаемость – высокая, низкая, средняя.
Слайд 52: Полимеры для твердофазного синтеза
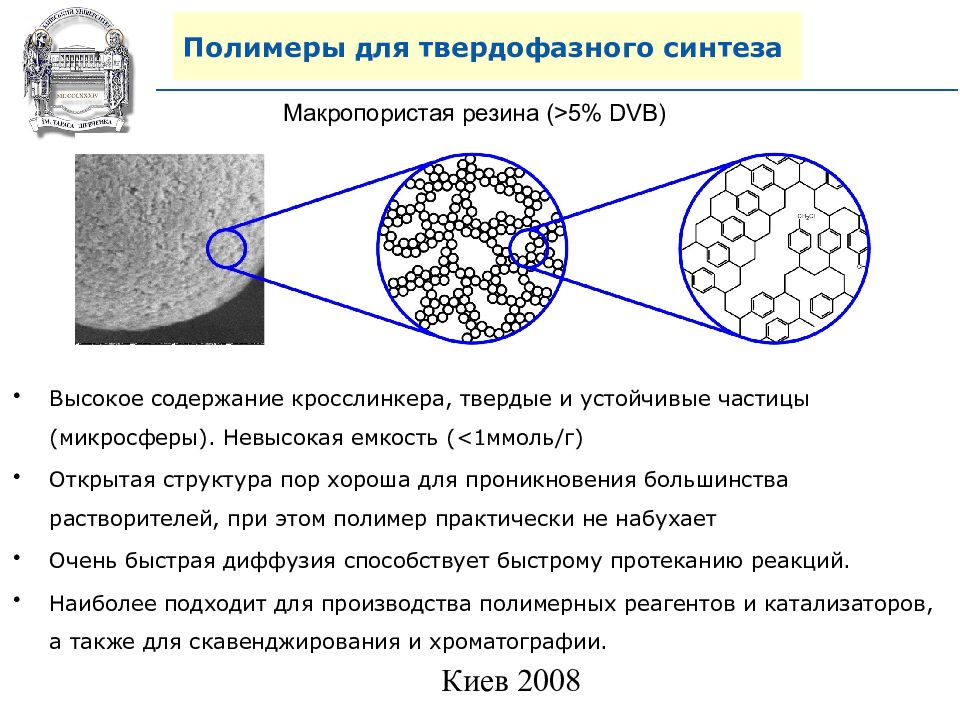
Макропористая резина (>5% DVB) Высокое содержание кросслинкера, твердые и устойчивые частицы ( микросферы ). Невысокая емкость ( <1 ммоль/г) Открытая структура пор хороша для проникновения большинства растворителей, при этом полимер практически не набухает Очень быстрая диффузия способствует быстрому протеканию реакций. Наиболее подходит для производства полимерных реагентов и катализаторов, а также для скавенджирования и хроматографии.
Слайд 53: Полимеры для твердофазного синтеза
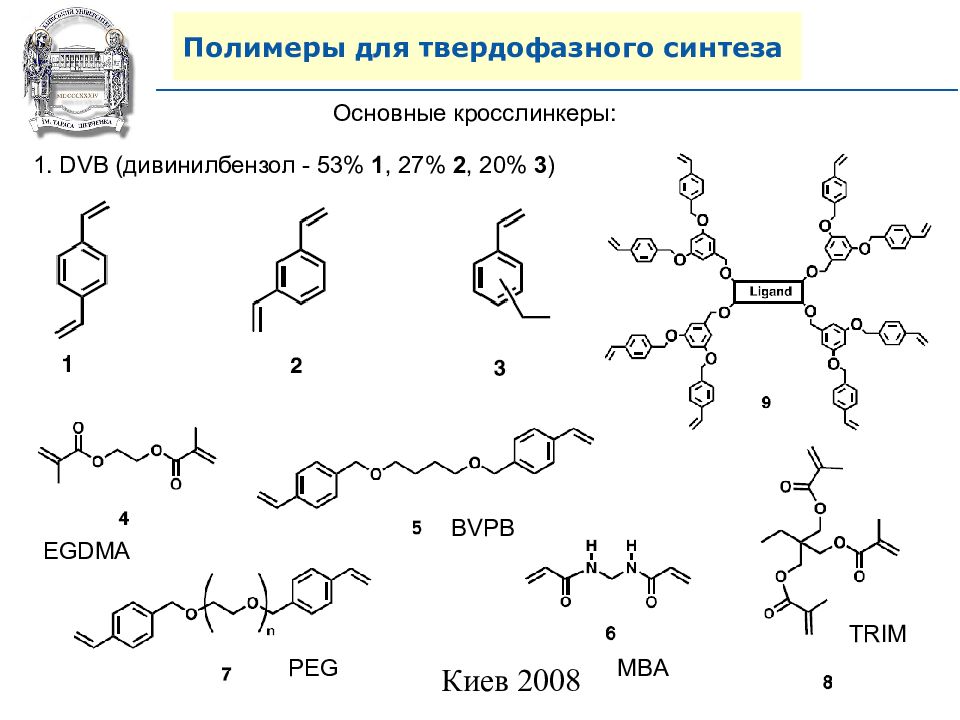
Основные кросслинкеры: 1. DVB (дивинилбензол - 53% 1, 27% 2, 20% 3 ) EGDMA PEG MBA BVPB TRIM
Слайд 54: Полимеры для твердофазного синтеза
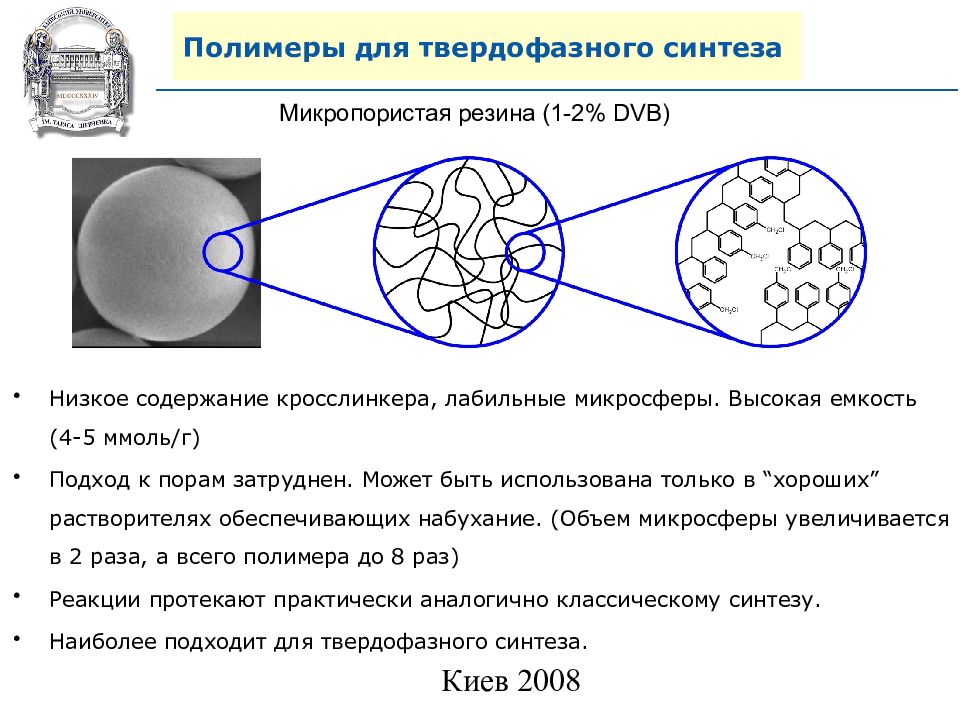
Микропористая резина ( 1-2 % DVB) Низкое содержание кросслинкера, лабильные микросферы. Высокая емкость (4-5 ммоль/г) Подход к порам затруднен. Может быть использована только в “ хороших ” растворителях обеспечивающих набухание. (Объем микросферы увеличивается в 2 раза, а всего полимера до 8 раз) Реакции протекают практически аналогично классическому синтезу. Наиболее подходит для твердофазного синтеза.
Слайд 55: Полимеры для твердофазного синтеза
Физические свойства a) Обработка ТГФ, фильтрование и осушка на воздухе. b) давление 100 атм. c) Перемешивание на магнитной мешалке (24 ч, 300 об/мин, 20 C, DMF) d) Механическое перемешивание (7 дн, 60 об/мин, 20 C, DMF)
Слайд 56: Полимеры для твердофазного синтеза
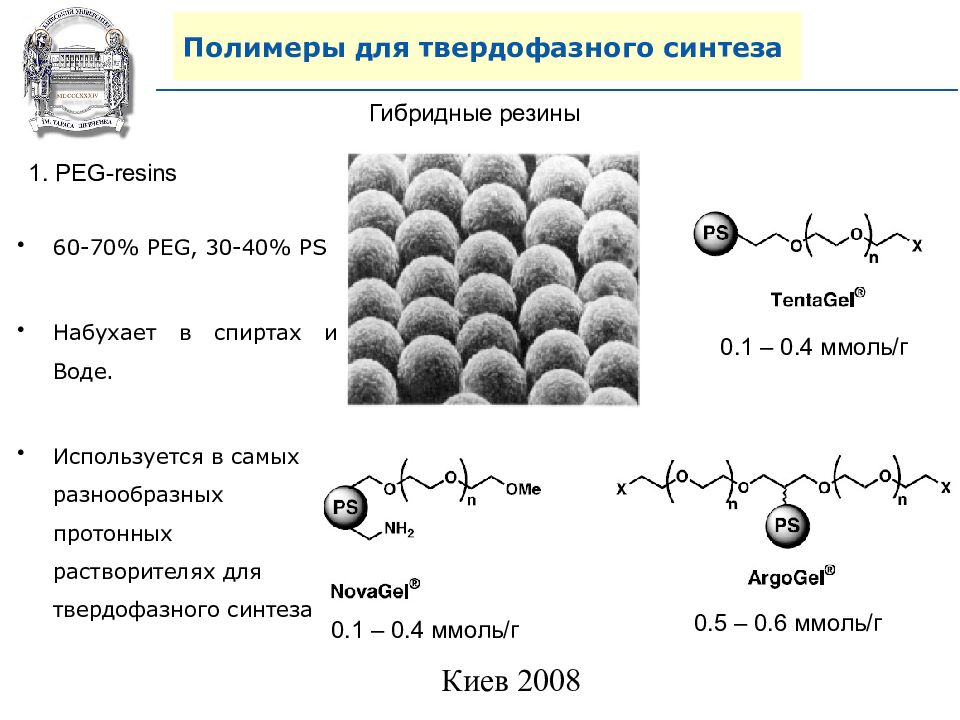
Гибридные резины 1. PEG-resins 0.1 – 0.4 ммоль/г 0.1 – 0.4 ммоль/г 0.5 – 0.6 ммоль/г 60-70% PEG, 30-40% PS Набухает в спиртах и Воде. Используется в самых разнообразных протонных растворителях для твердофазного синтеза
Слайд 57: Полимеры для твердофазного синтеза
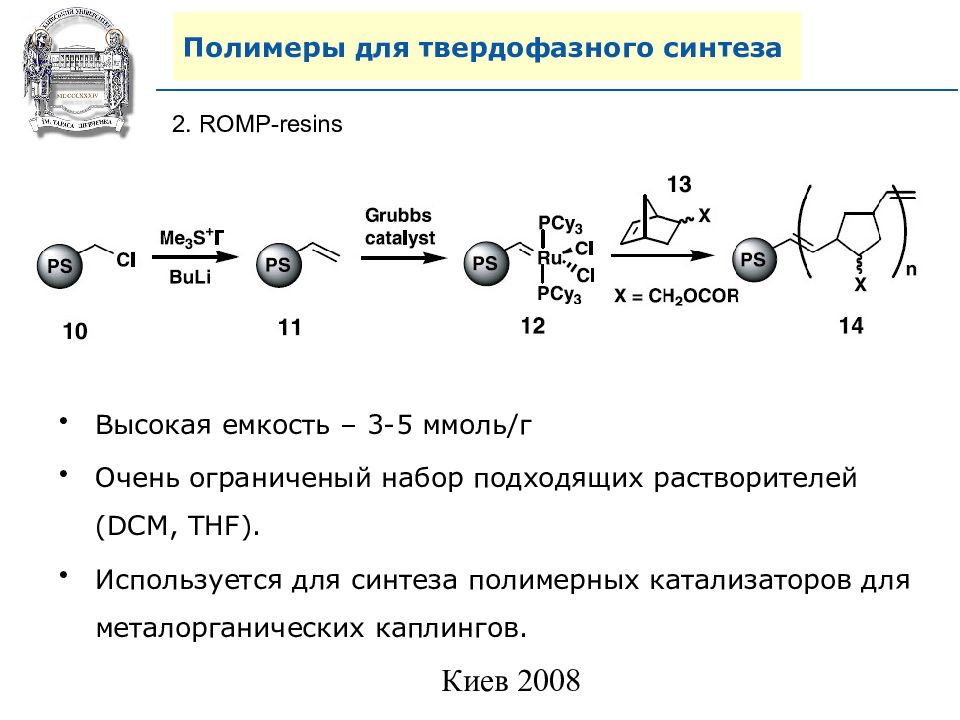
2. ROMP-resins Высокая емкость – 3-5 ммоль/г Очень ограниченый набор подходящих растворителей ( DCM, THF). Используется для синтеза полимерных катализаторов для металорганических каплингов.
Слайд 58: Полимеры для твердофазного синтеза
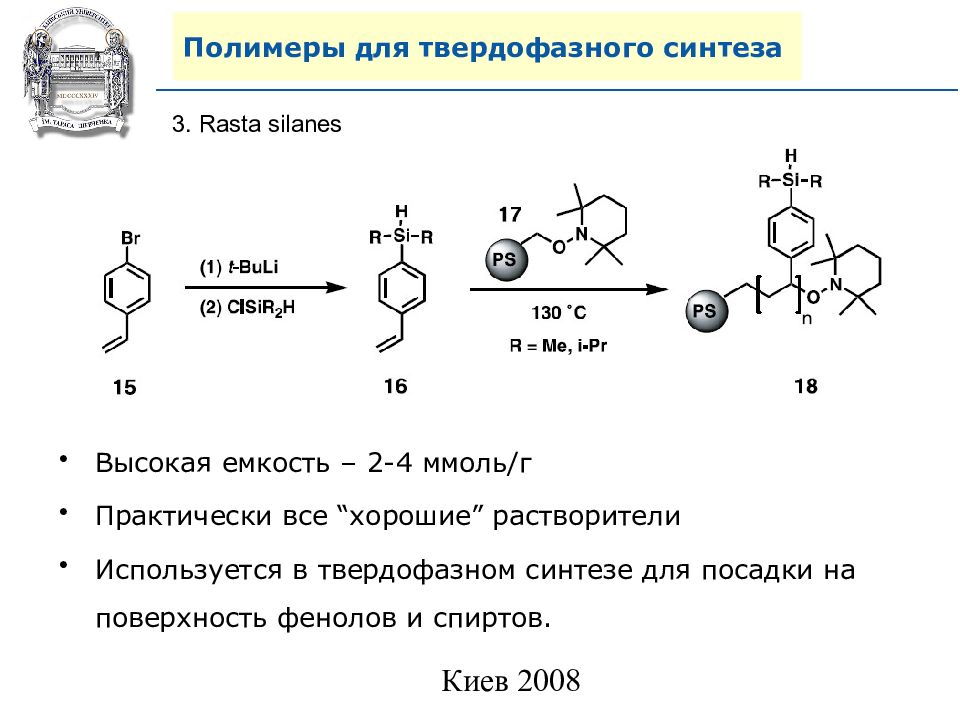
3. Rasta silanes Высокая емкость – 2 - 4 ммоль/г Практически все “ хорошие ” растворители Используется в твердофазном синтезе для посадки на поверхность фенолов и спиртов.
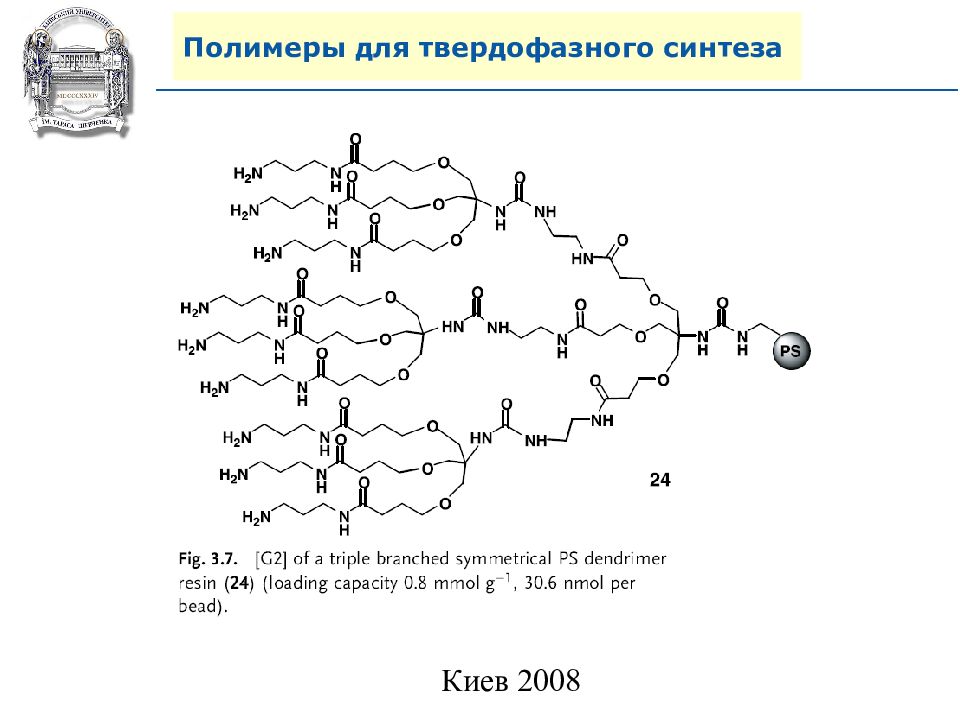
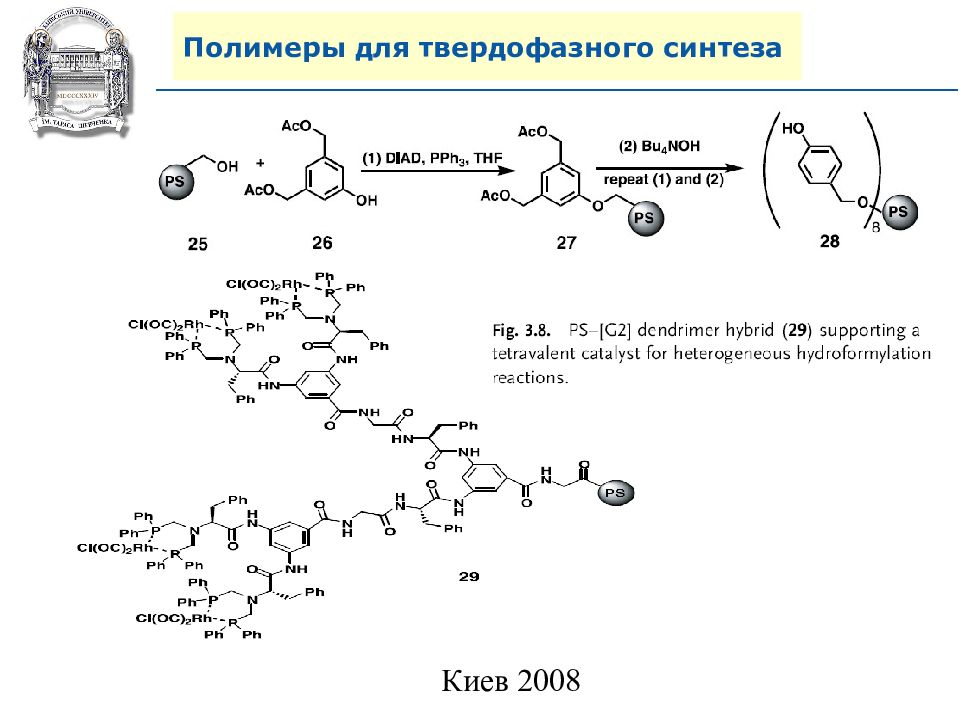
Слайд 62: Полимеры для твердофазного синтеза
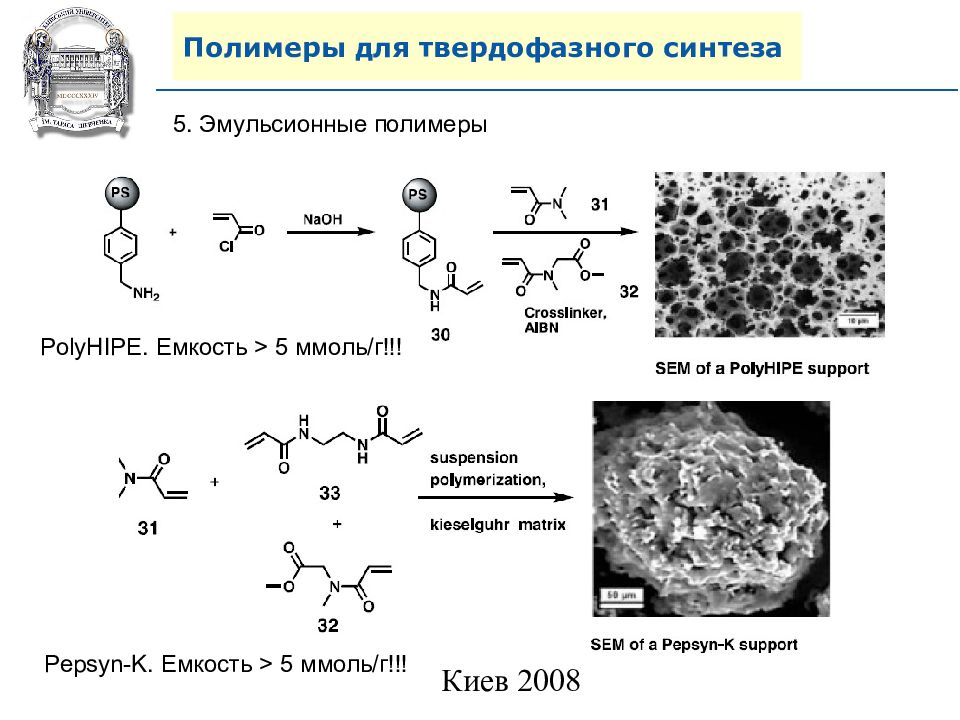
5. Эмульсионные полимеры PolyHIPE. Емкость > 5 ммоль/г!!! Pepsyn-K. Емкость > 5 ммоль/г!!!
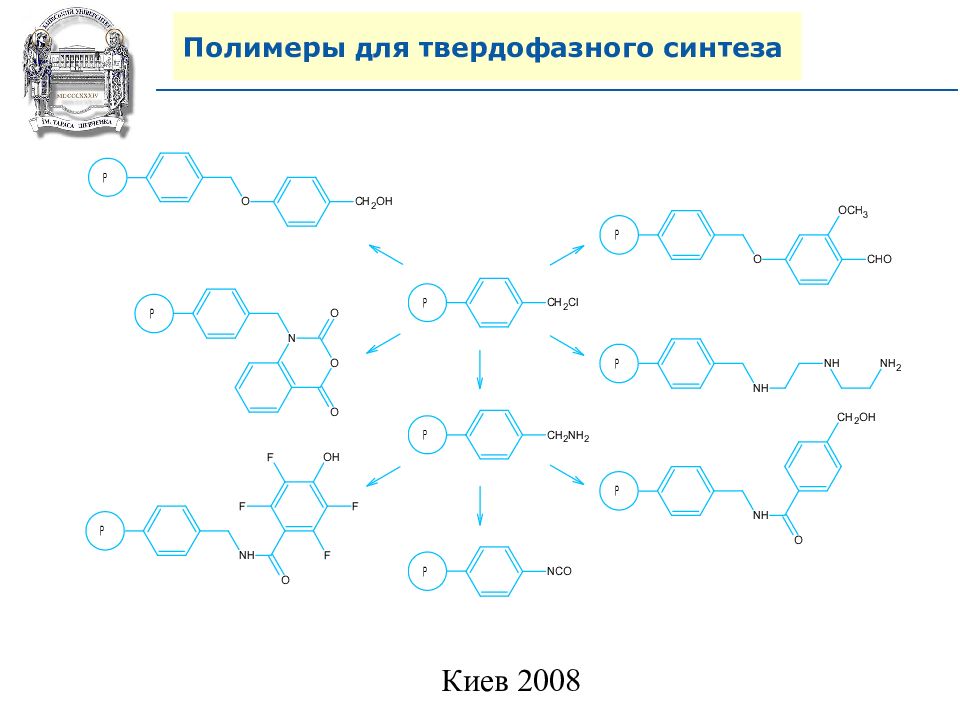
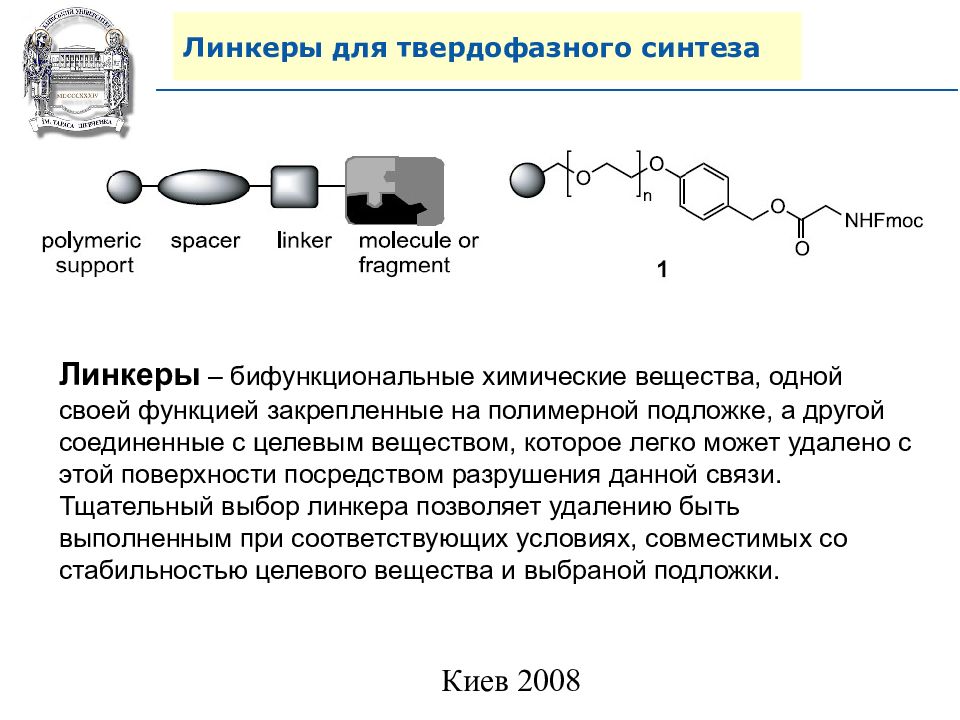
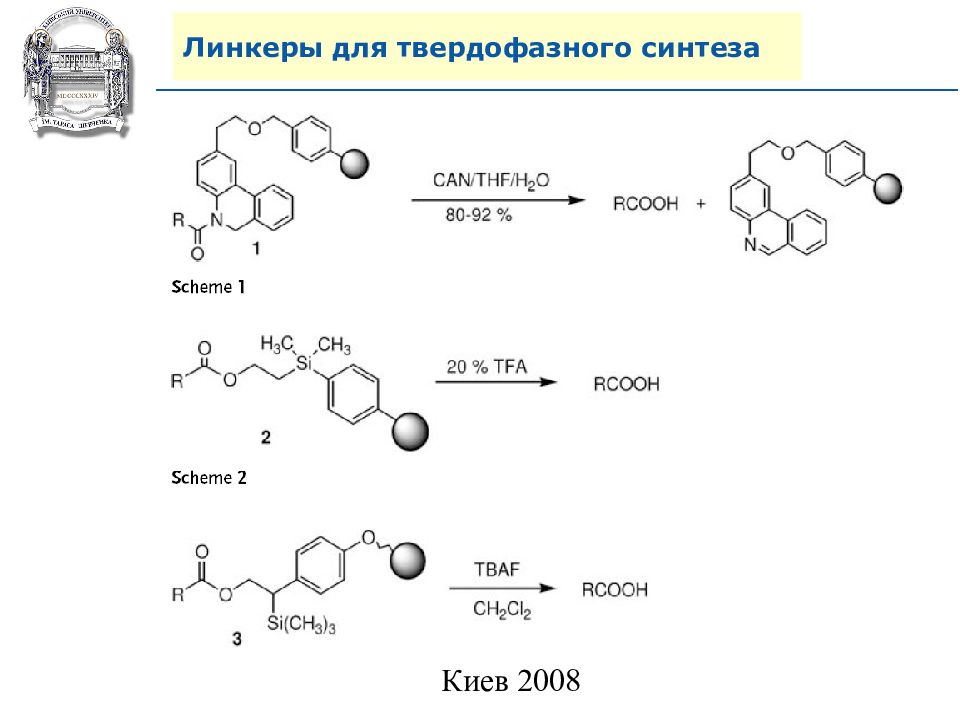
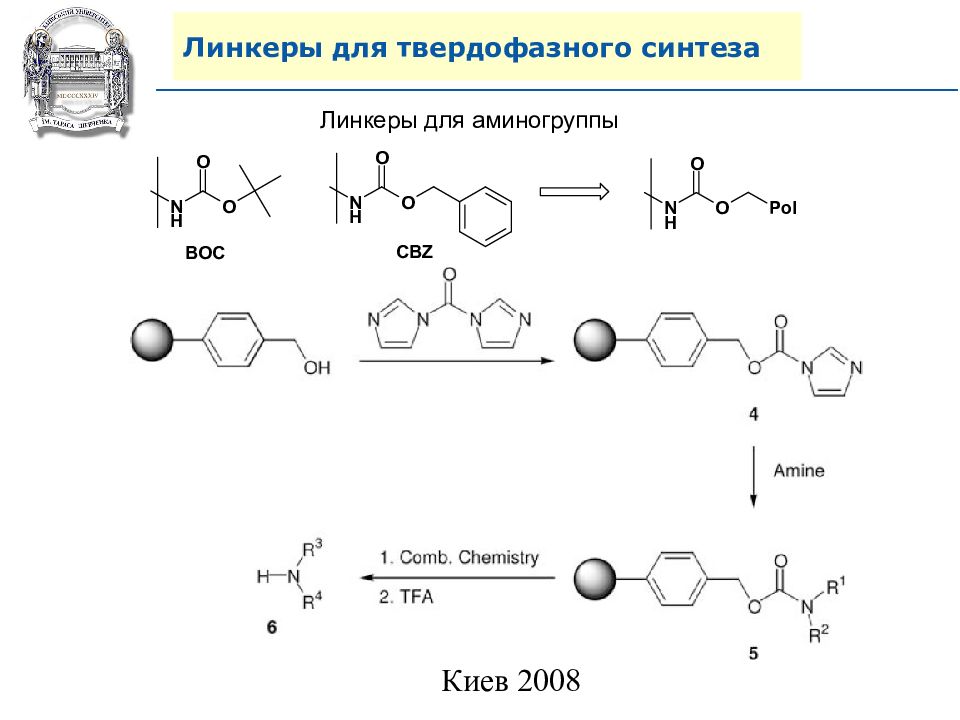
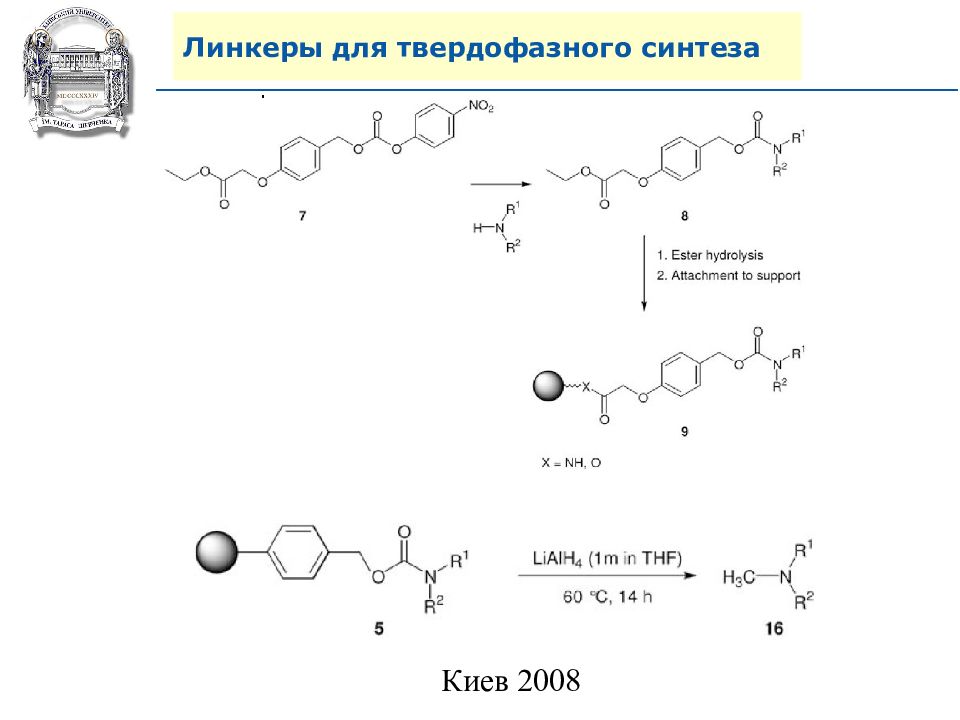
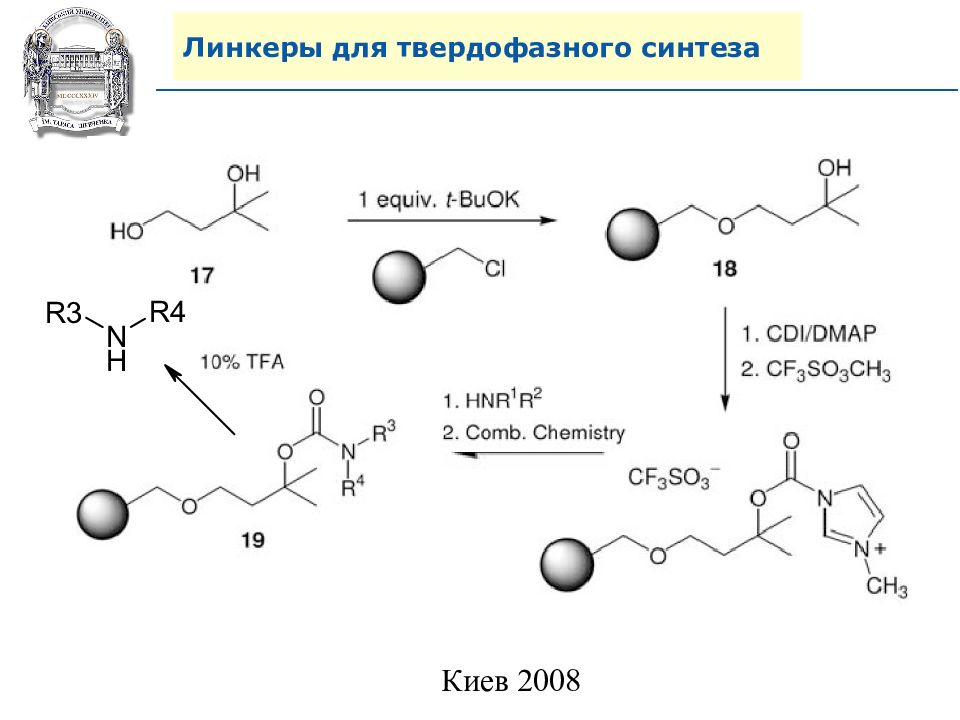
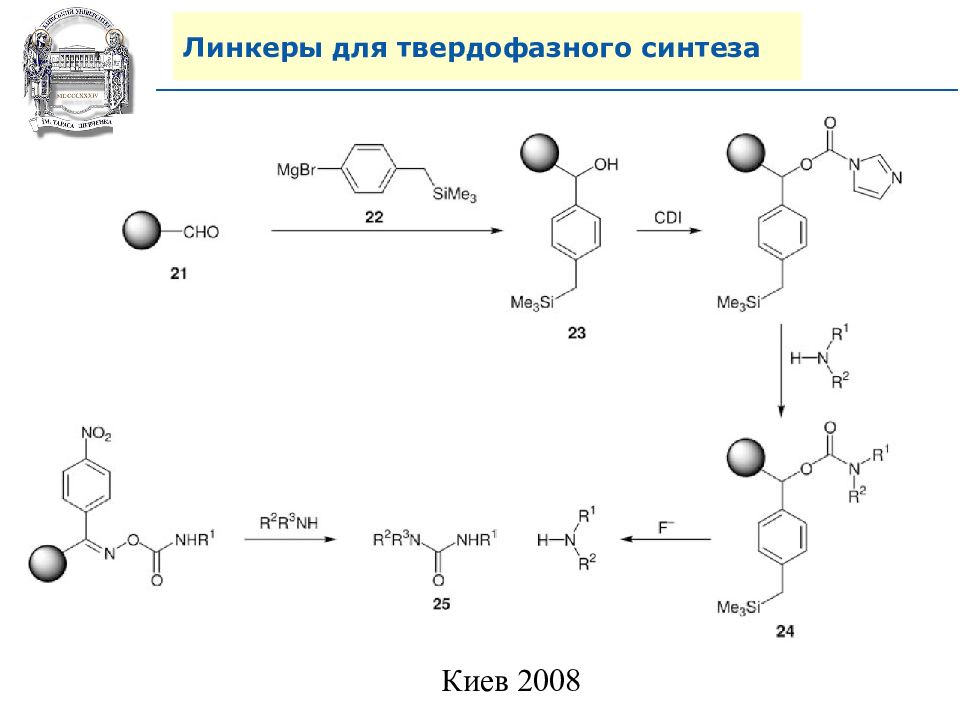
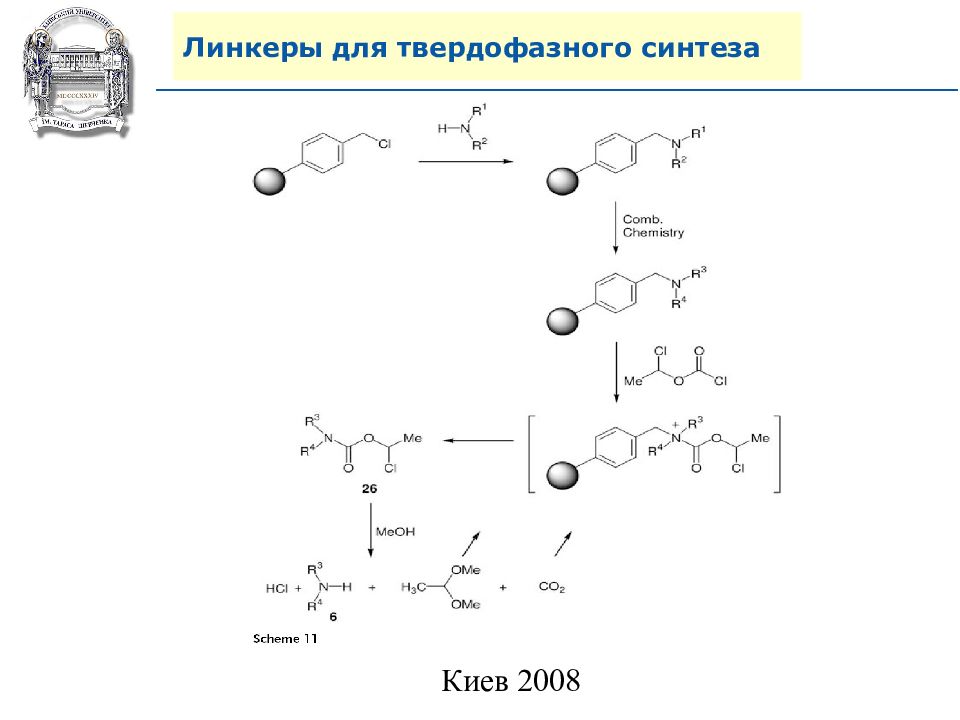
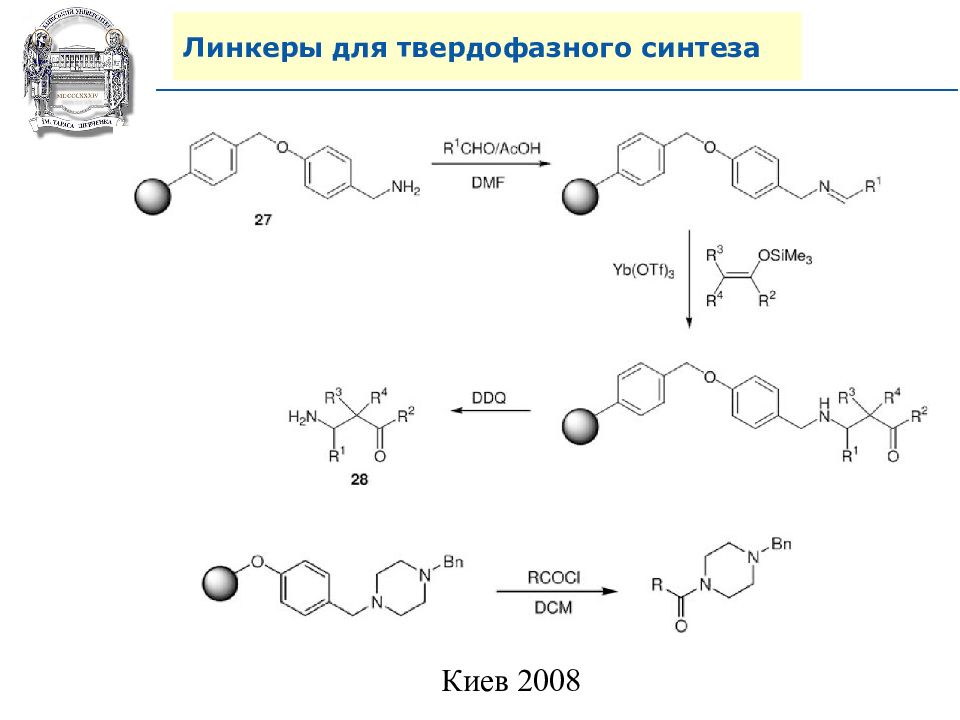
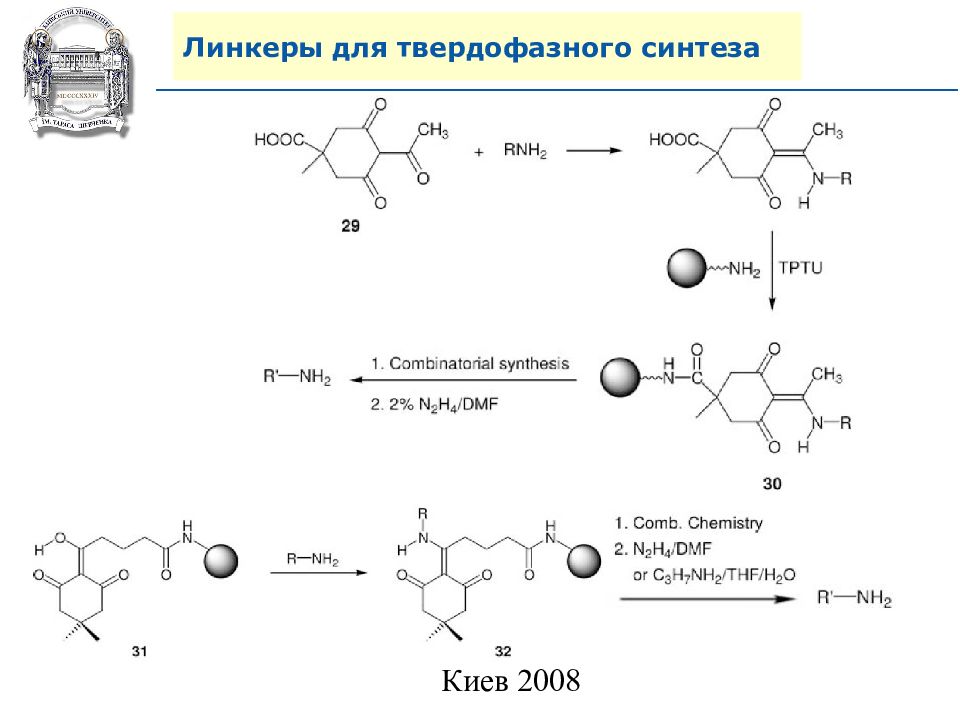
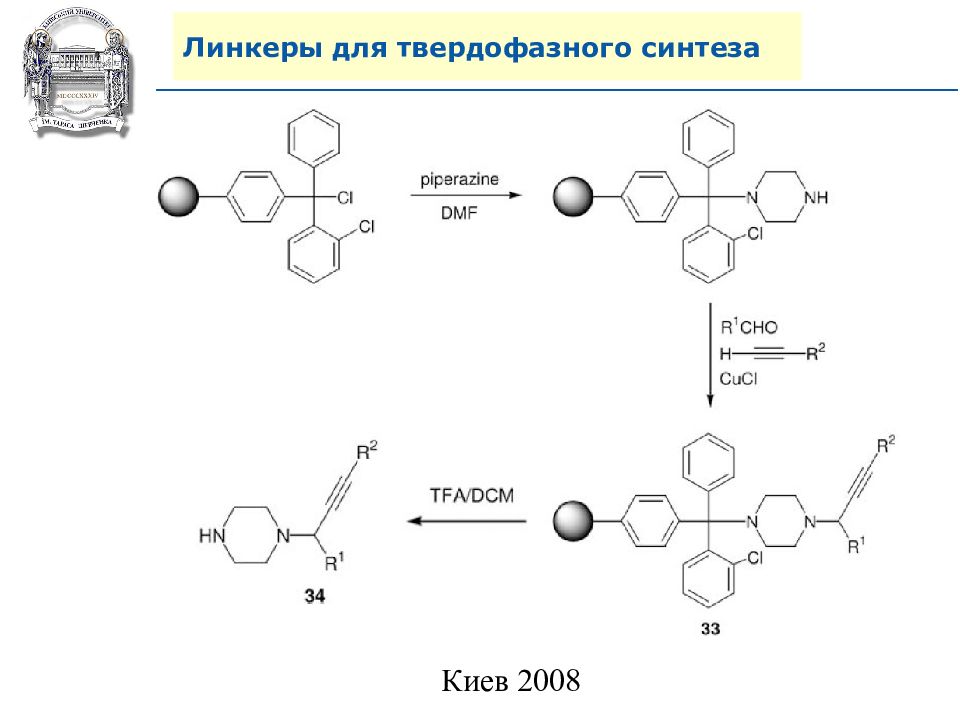
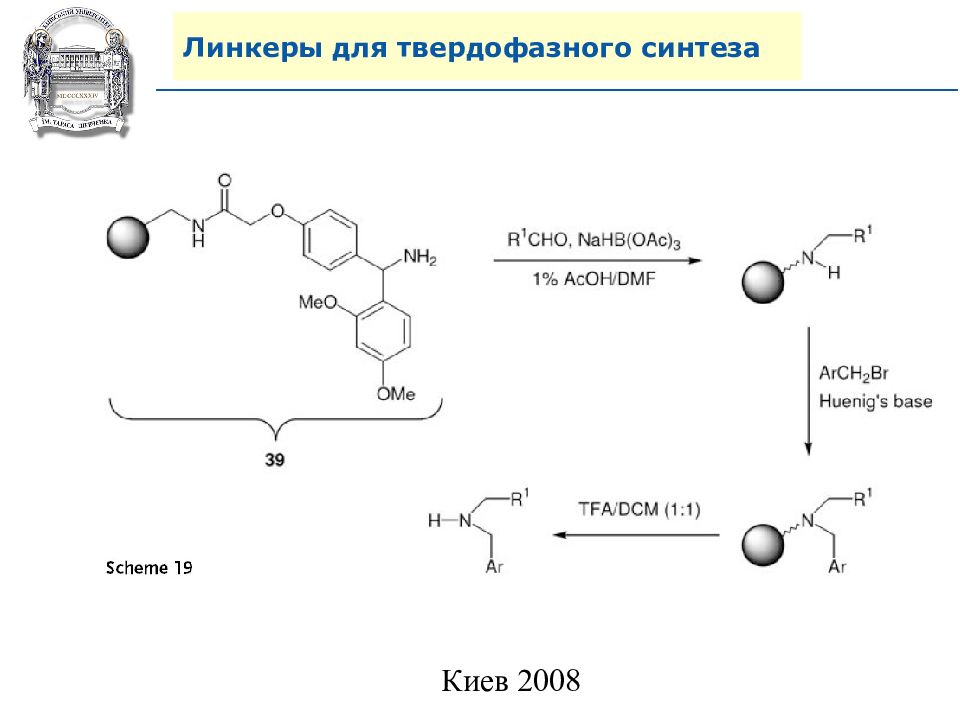
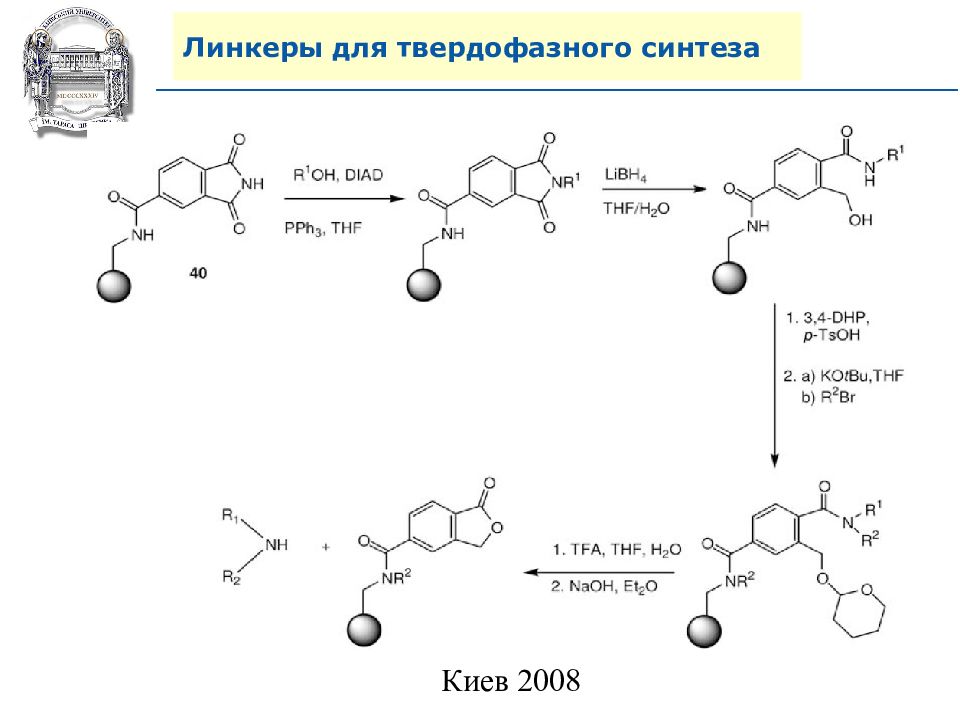
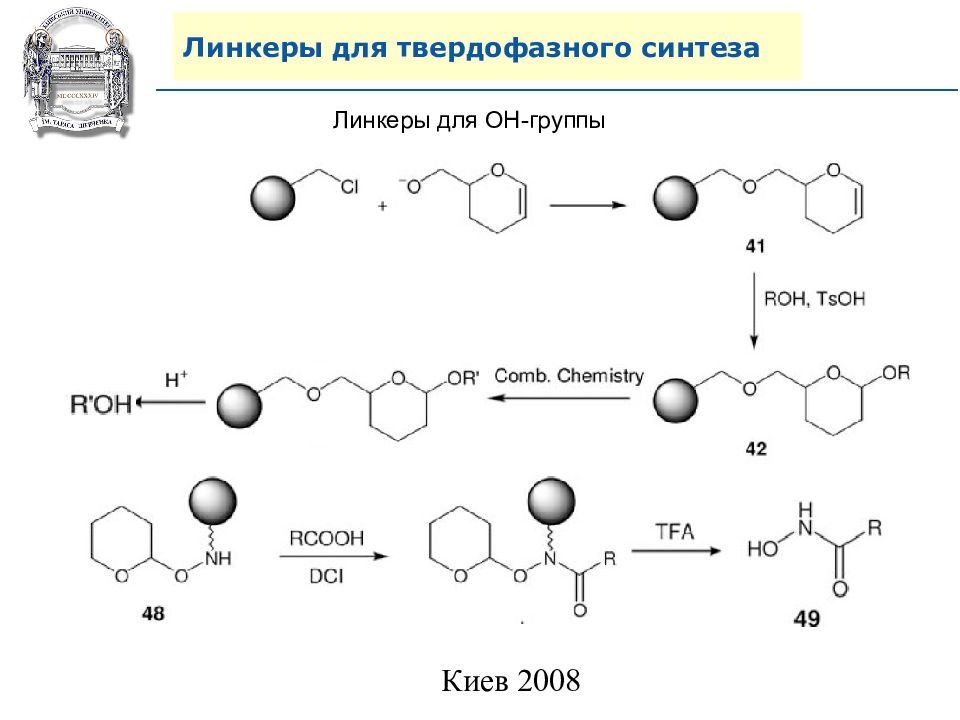
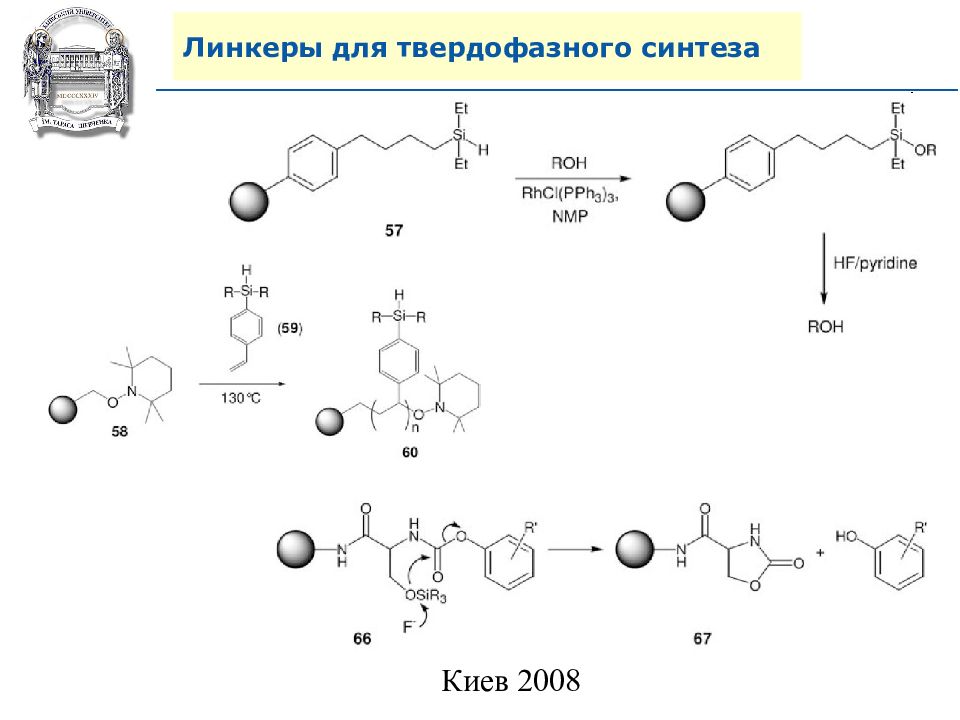
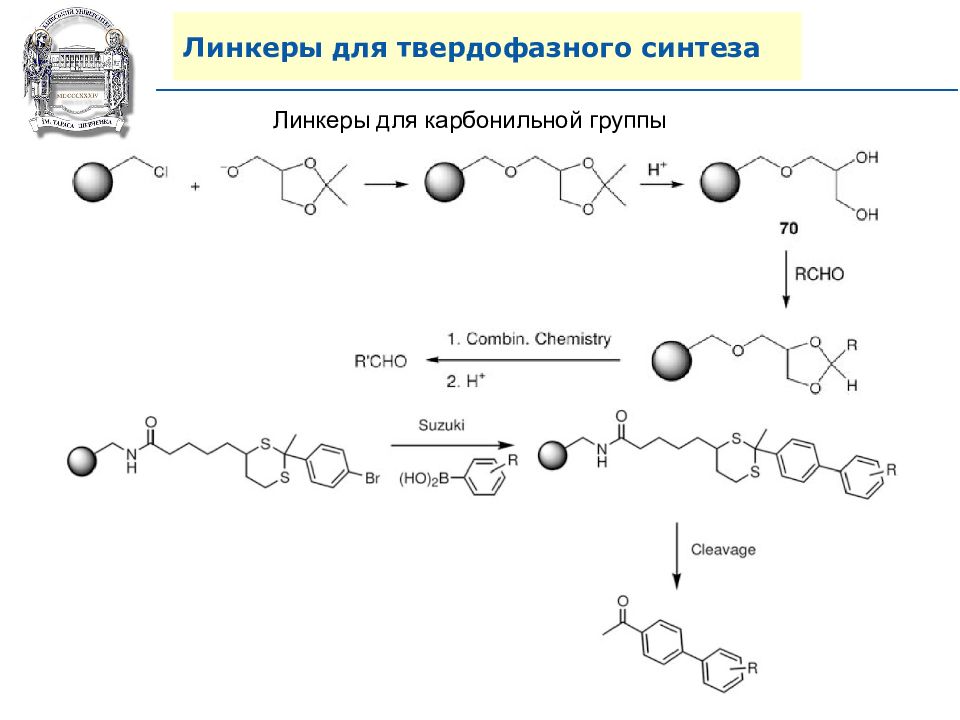
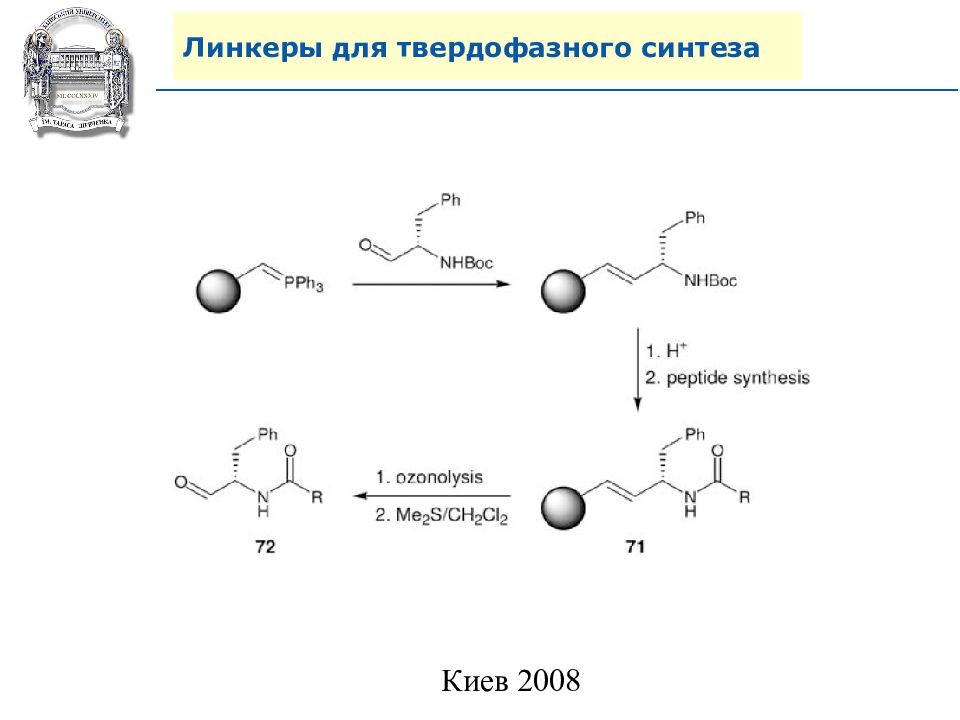
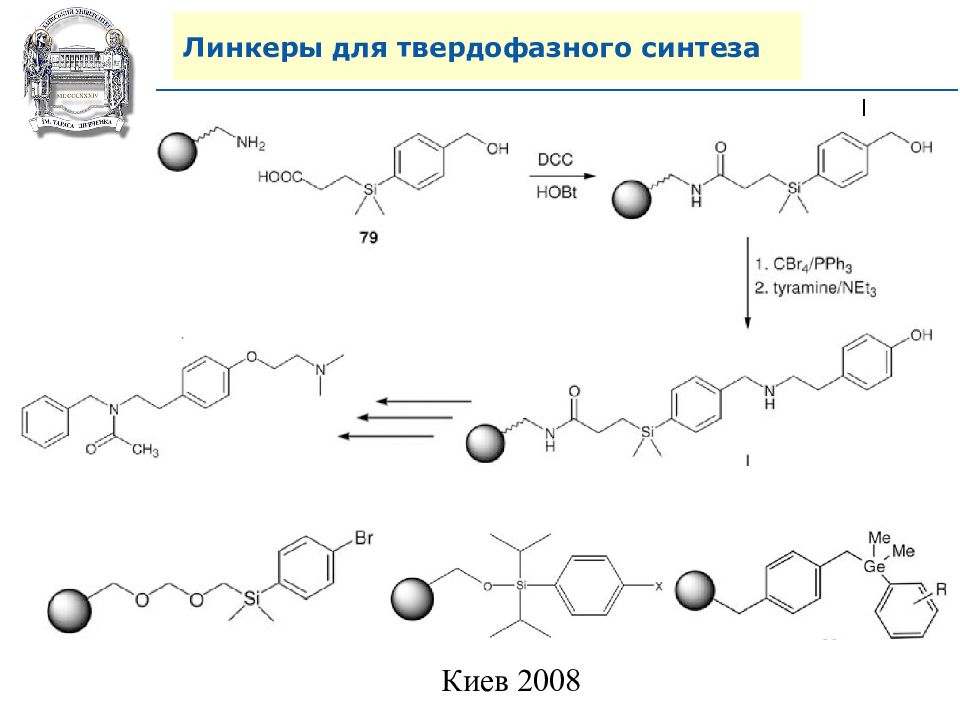
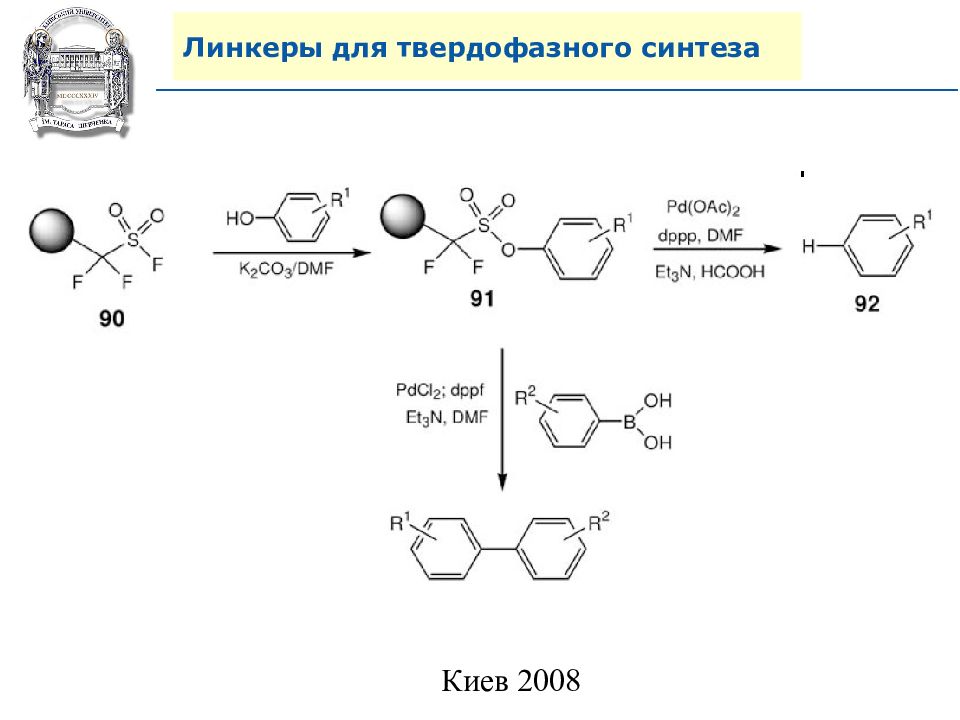
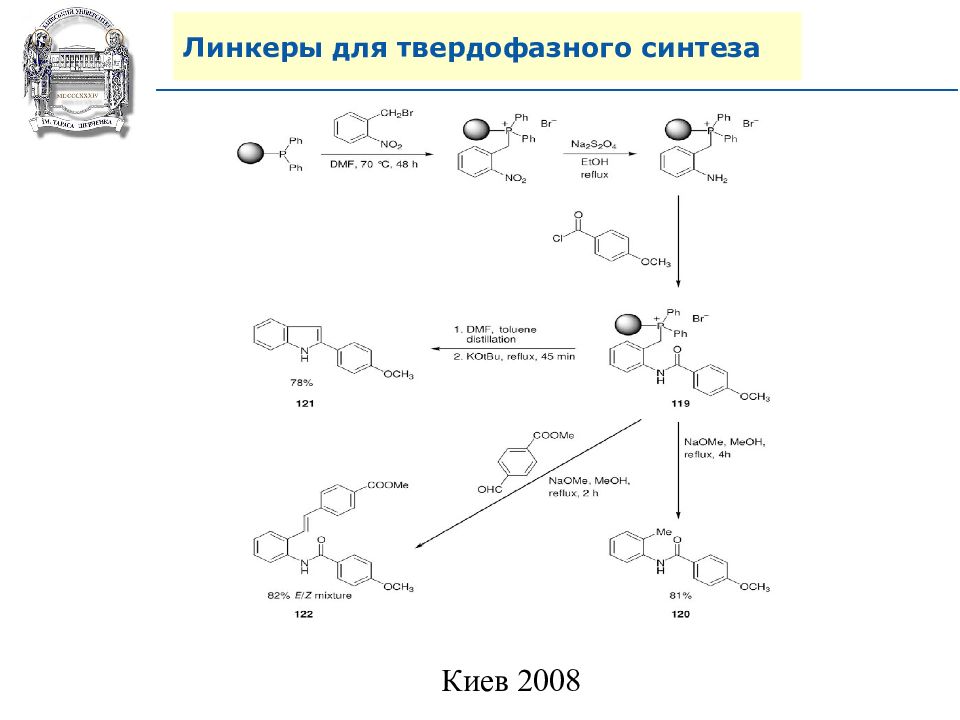
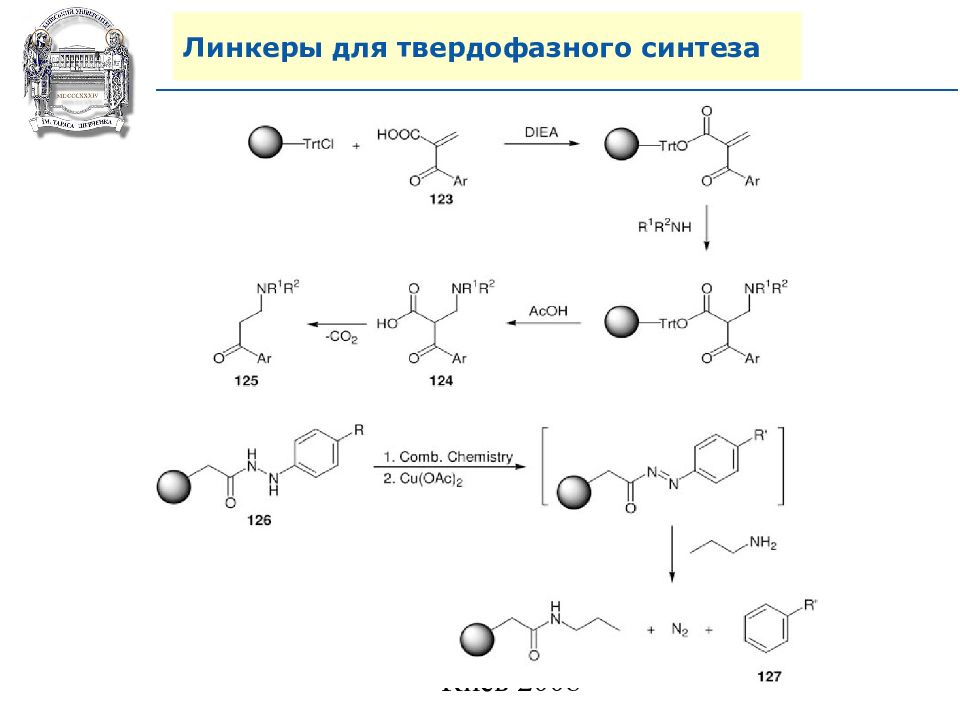
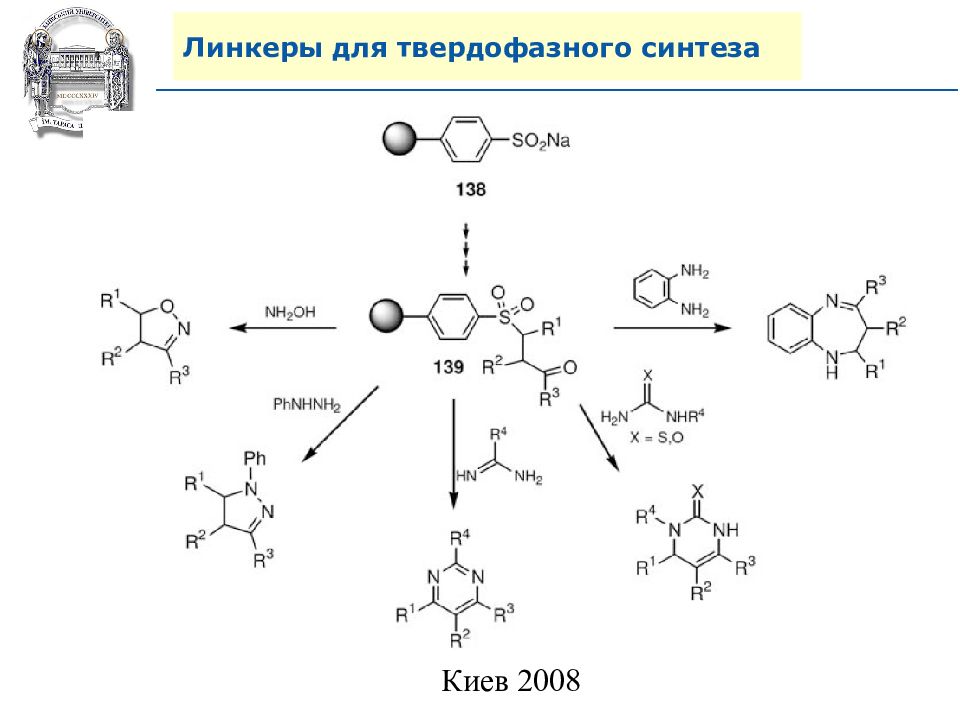
Слайд 64: Линкеры для твердофазного синтеза
Линкеры – бифункциональные химические вещества, одной своей функцией закрепленные на полимерной подложке, а другой соединенные с целевым веществом, которое легко может удалено с этой поверхности посредством разрушения данной связи. Тщательный выбор линкера позволяет удалению быть выполненным при соответствующих условиях, совместимых со стабильностью целевого вещества и выбраной подложки.
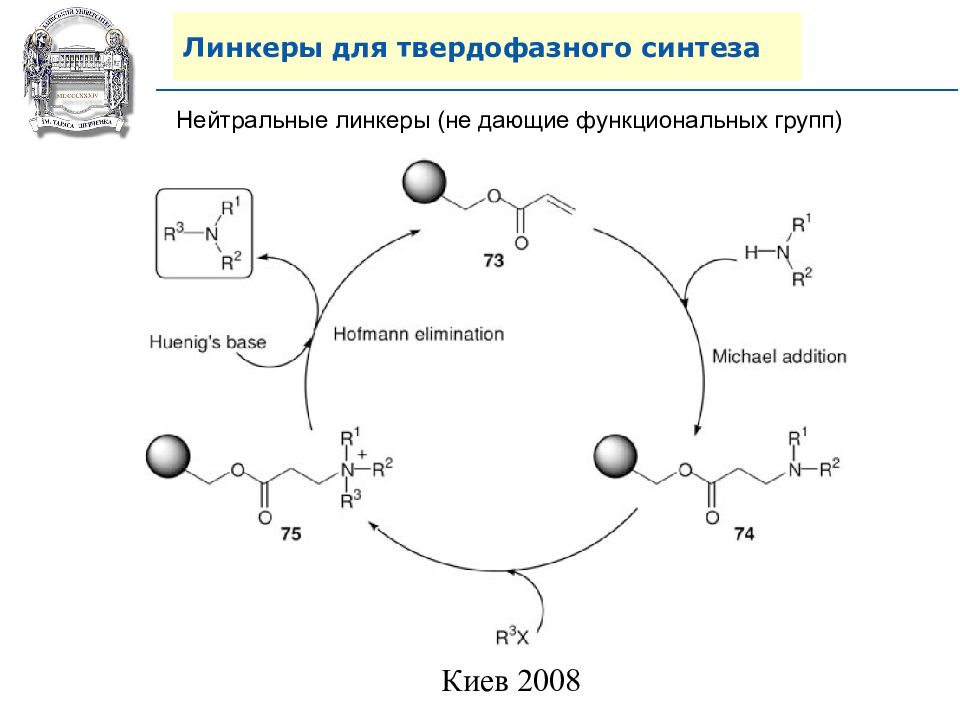
Слайд 81: Линкеры для твердофазного синтеза
Нейтральные линкеры (не дающие функциональных групп)
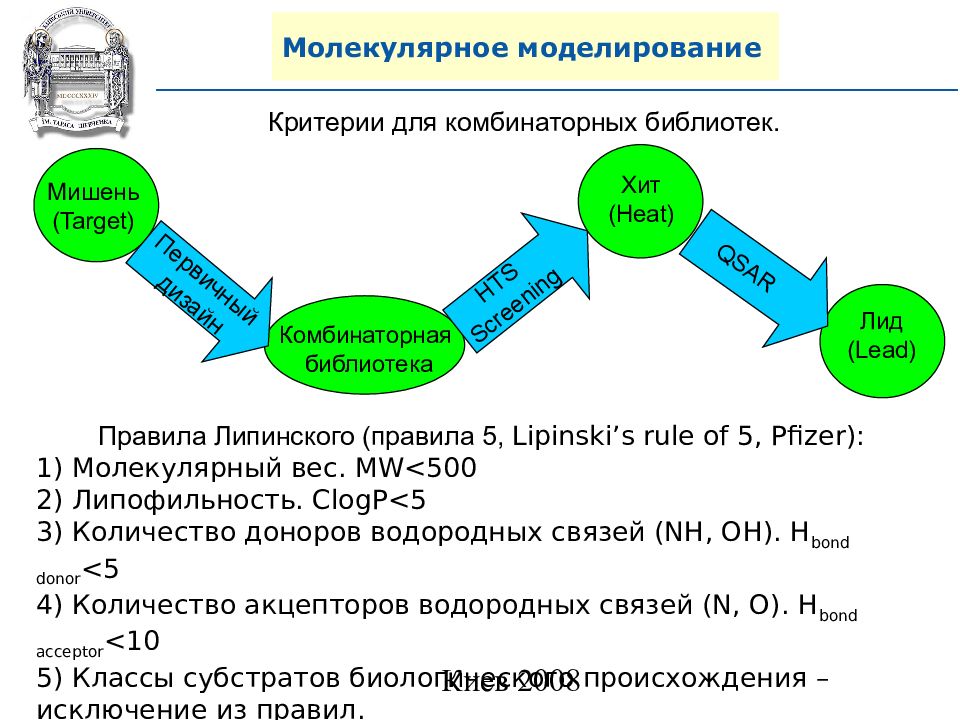
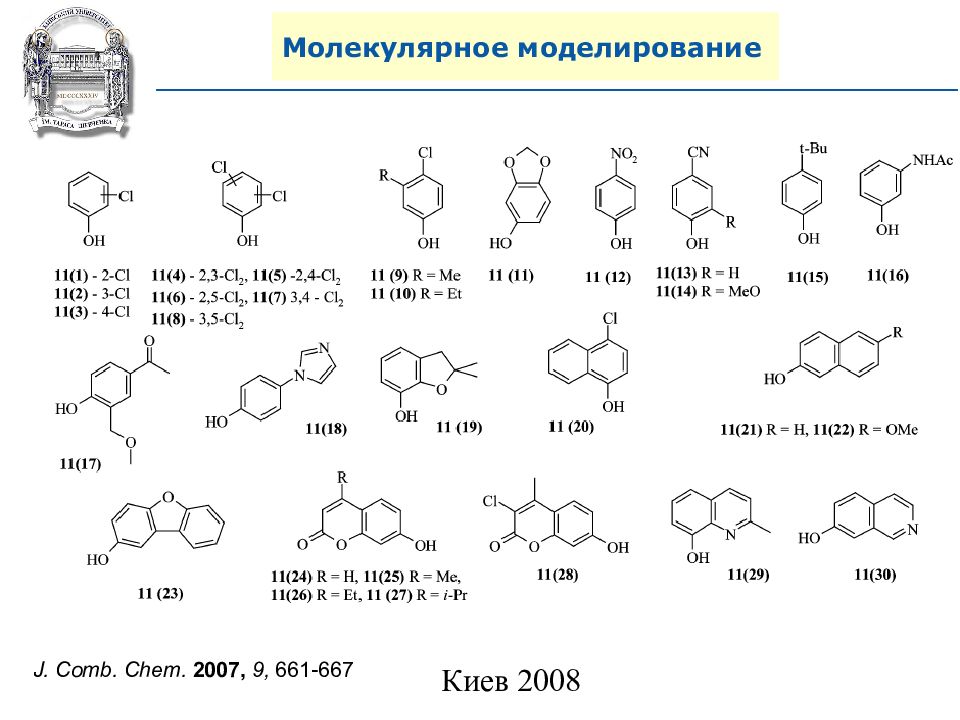
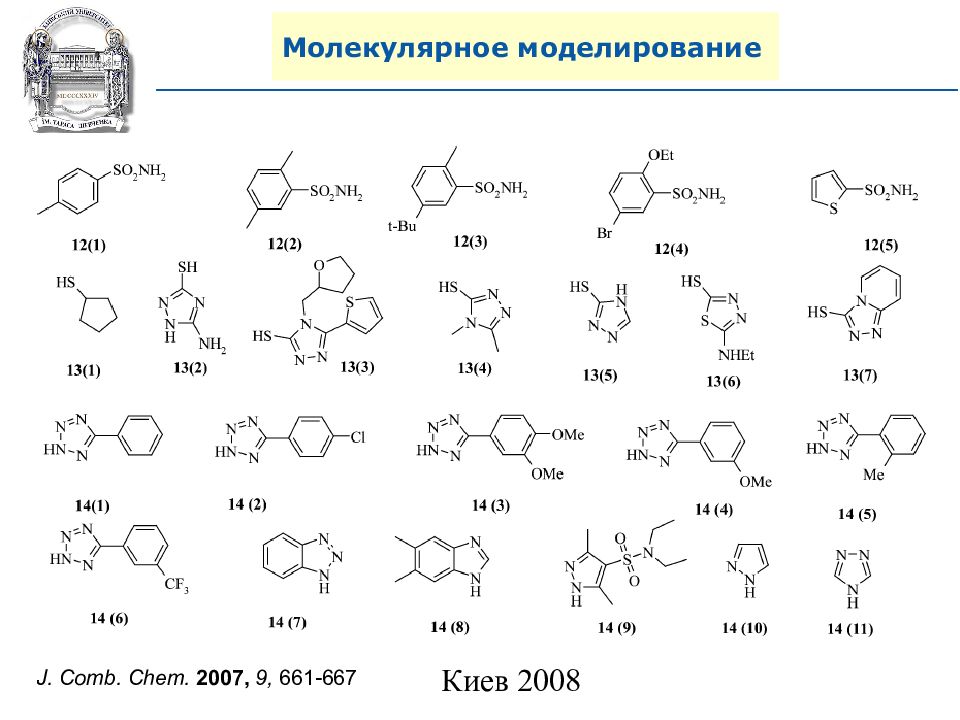
Слайд 87: Молекулярное моделирование
Хит (Heat) Молекулярное моделирование Критерии для комбинаторных библиотек. Правила Липинского (правила 5, Lipinski’s rule of 5, Pfizer ): 1) Молекулярный вес. MW<500 2) Липофильность. ClogP<5 3) Количество доноров водородных связей ( NH, OH). H bond donor <5 4) Количество акцепторов водородных связей (N, O). H bond acceptor <10 5) Классы субстратов биологического происхождения – исключение из правил. Мишень ( Target) Комбинаторная библиотека Лид (Lead) Первичный дизайн HTS Screening QSAR
Слайд 88: Молекулярное моделирование
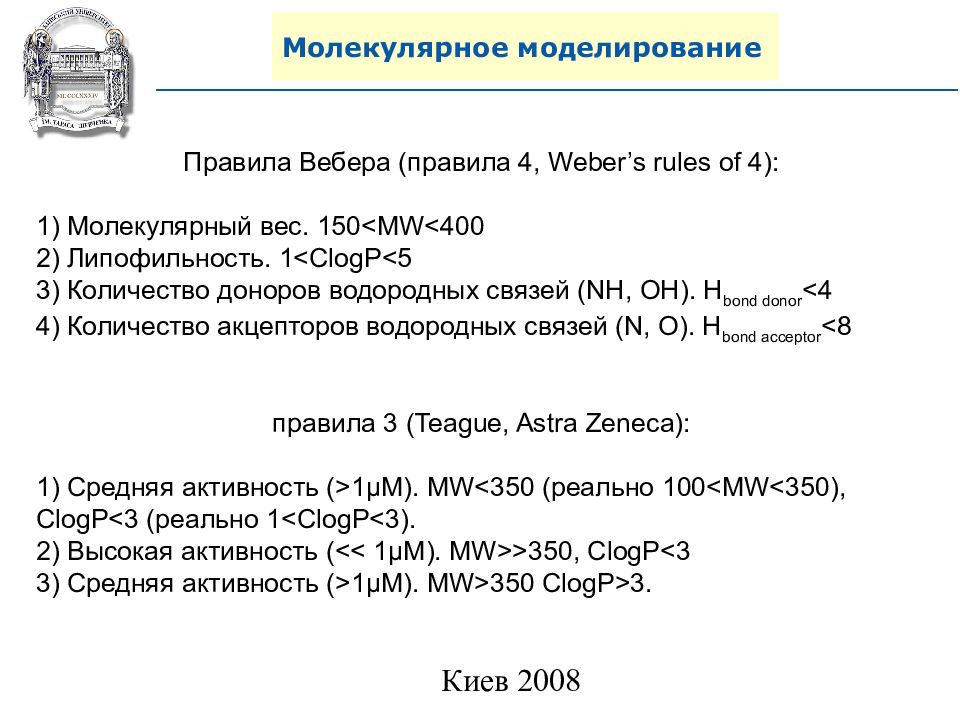
Правила Вебера (правила 4, Weber’s rules of 4) : 1) Молекулярный вес. 150<MW<400 2) Липофильность. 1<ClogP<5 3) Количество доноров водородных связей ( NH, OH). H bond donor <4 4) Количество акцепторов водородных связей (N, O). H bond acceptor <8 правила 3 (Teague, Astra Zeneca) : 1) Средняя активность ( >1 μ M). MW<350 ( реально 1 0 0 <MW< 350), ClogP< 3 (реально 1<ClogP< 3). 2) Высокая активность ( << 1 μ M). MW>>350, ClogP<3 3) Средняя активность ( >1 μ M). MW>350 ClogP> 3.
Слайд 90: Линкеры для твердофазного синтеза
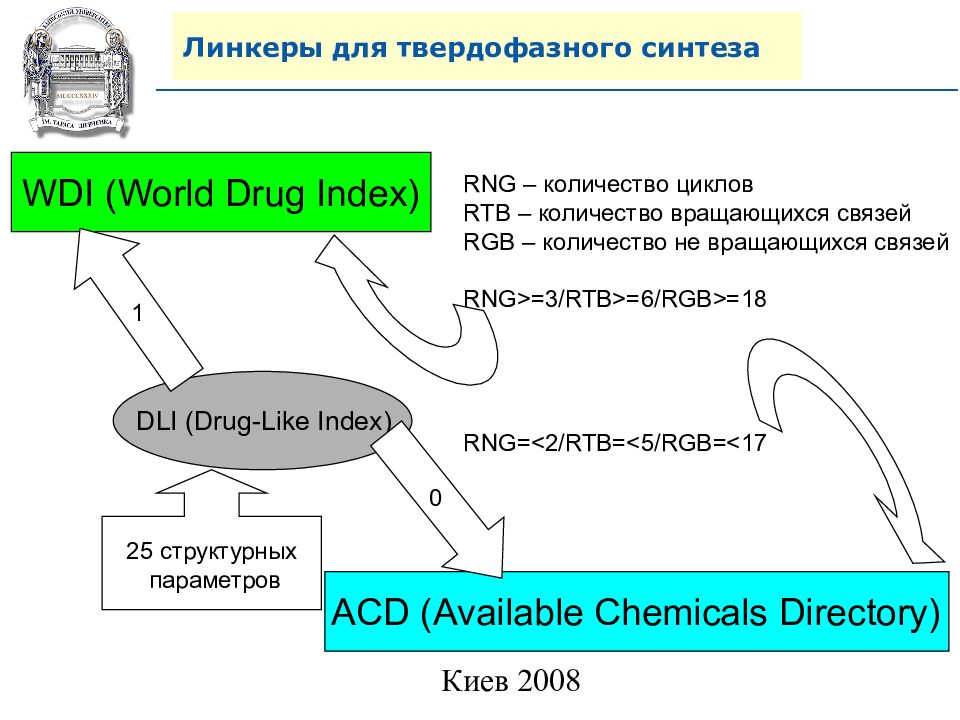
WDI (World Drug Index) ACD (Available Chemicals Directory) DLI (Drug-Like Index) 1 0 25 структурных параметров RNG – количество циклов RTB – количество вращающихся связей RGB – количество не вращающихся связей RNG>=3/RTB>=6/RGB>=18 RNG=<2/RTB=<5/RGB=<17
Слайд 91: Молекулярное моделирование
Типы библиотек: 1) Первичная библиотека для скрининга. ( Primary Screening Library) Должна удовлетворять правилу 4 (по возможности даже 3). 2) Таргетная (направленная) библиотека. ( Targeted Library) Должна удовлетворять правилу 5 (возможны некоторые послабления). 3) Фокусная библиотека. ( Focus Library) Построение QSAR, Heat-to-Lead оптимизация. ADME/PK- параметры (Absorption, Distribution, Metabolism, Excretion/ PharmacoKinetics).
Слайд 92: Молекулярное моделирование
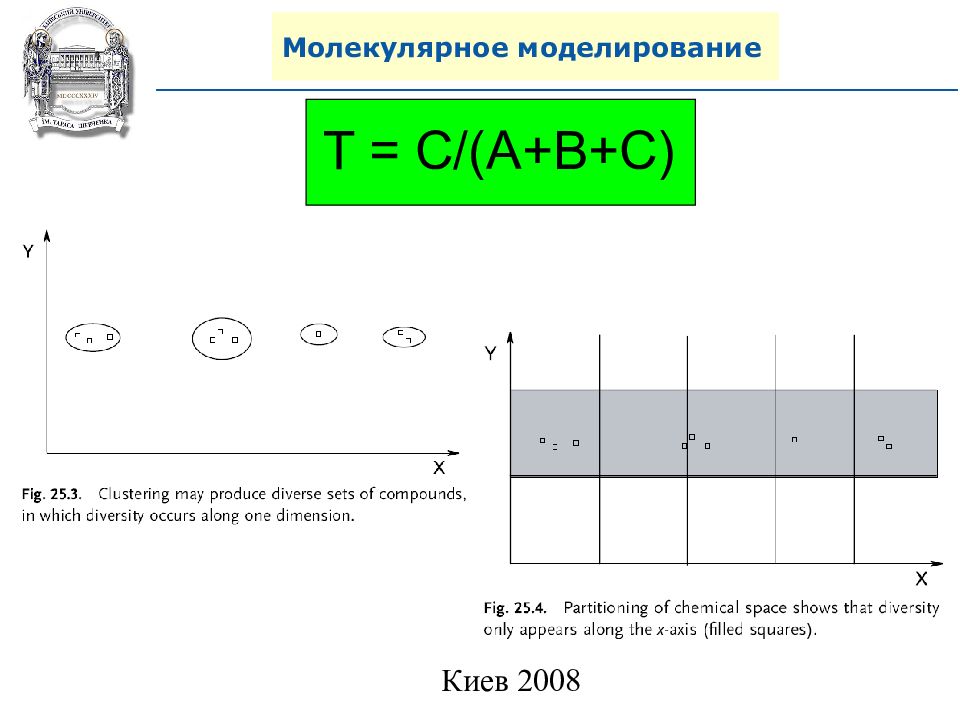
Дискрипторы: 1) Одномерные ( 1D). ( MW, ClogP, H bond donor, H bond acceptor, и т.п. ) 2) Двумерные (2 D). ( Структурные фрагменты) 3) Трехмерные ( 3D). ( Конформации и пространственное строение молекулы) Разнообразие ( Diversity). Коефициент Танимото. ( Tanimoto) T = C/(A+B+C) T – коефициент Танимото. A – молекула в стринговом виде B – другая молекула в стринговом виде, C – общий фрагмент в А и B.
Слайд 94: Молекулярное моделирование
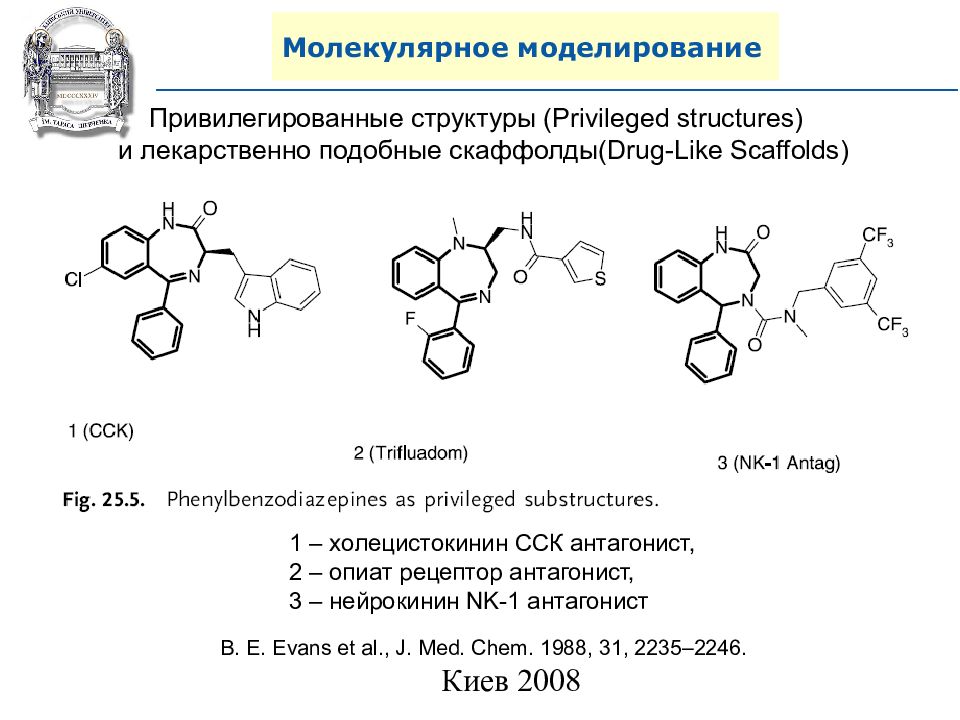
Привилегированные структуры ( Privileged structures) и лекарственно подобные скаффолды (Drug-Like Scaffolds) B. E. Evans et al., J. Med. Chem. 1988, 31, 2235–2246. 1 – холецистокинин ССК антагонист, 2 – опиат рецептор антагонист, 3 – нейрокинин NK-1 антагонист
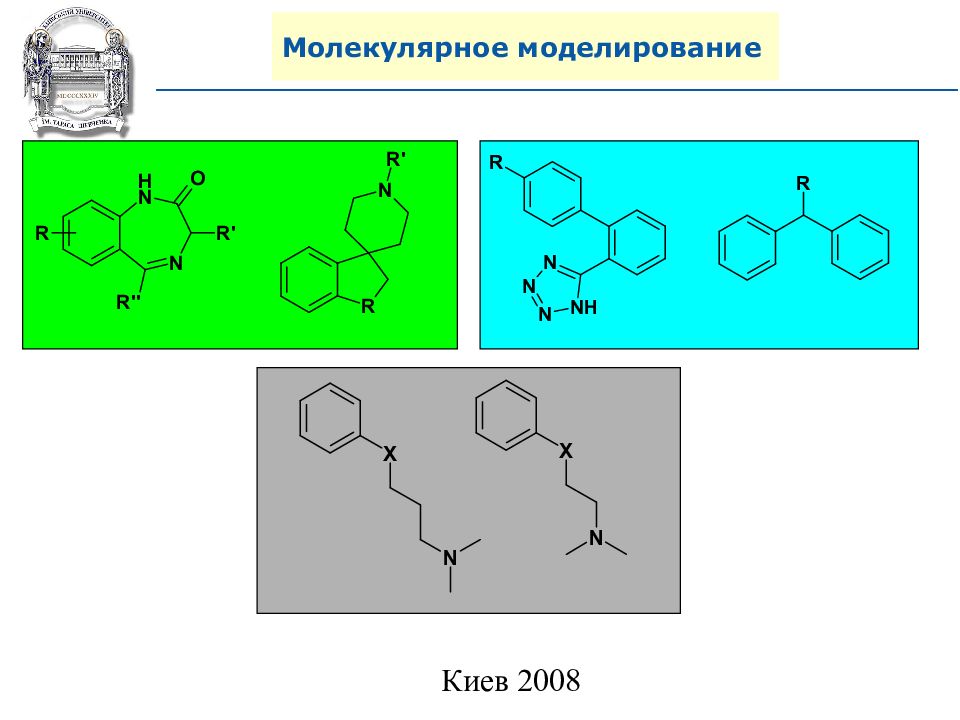
Слайд 95: Молекулярное моделирование
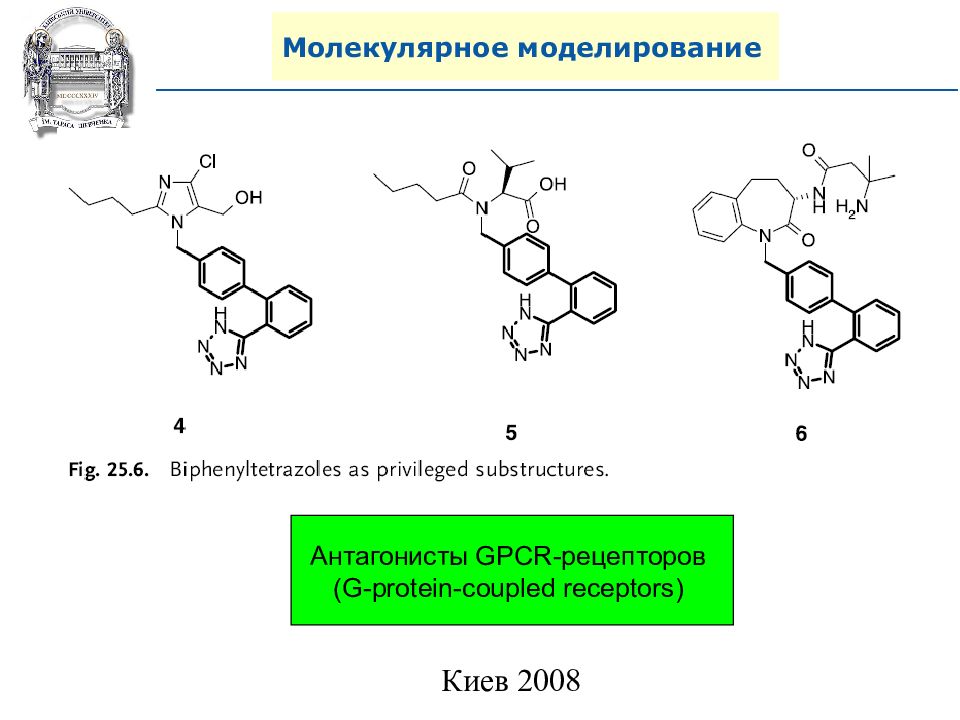
Антагонисты GPCR- рецепторов ( G-protein-coupled receptors )
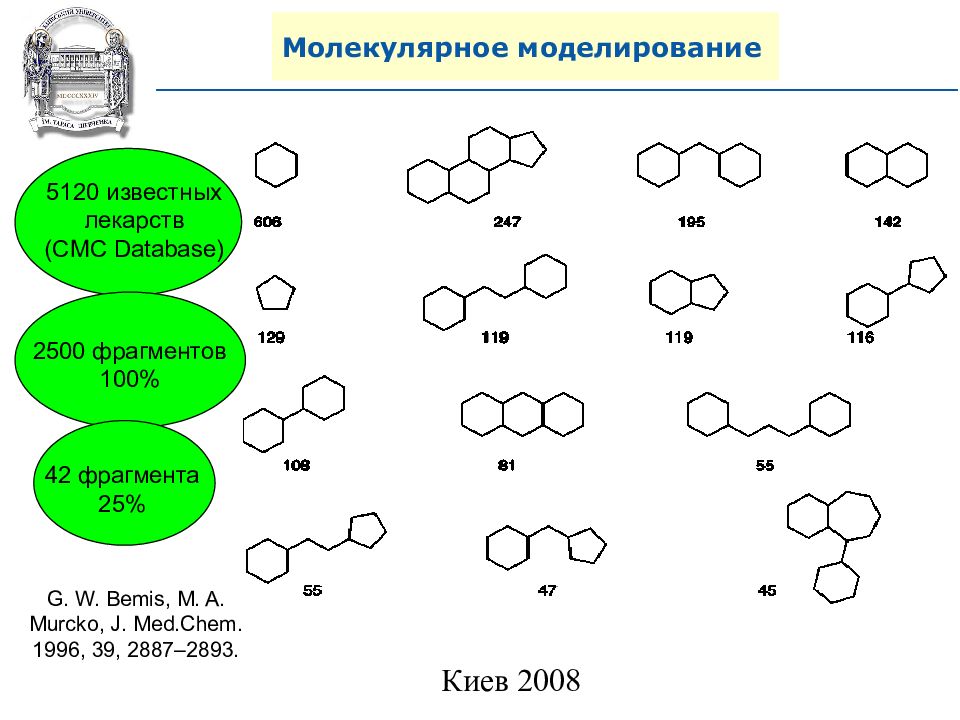
Слайд 99: Молекулярное моделирование
G. W. Bemis, M. A. Murcko, J. Med.Chem. 1996, 39, 2887–2893. 5120 известных лекарств ( CMC Database) 2500 фрагментов 100% 42 фрагмента 25%
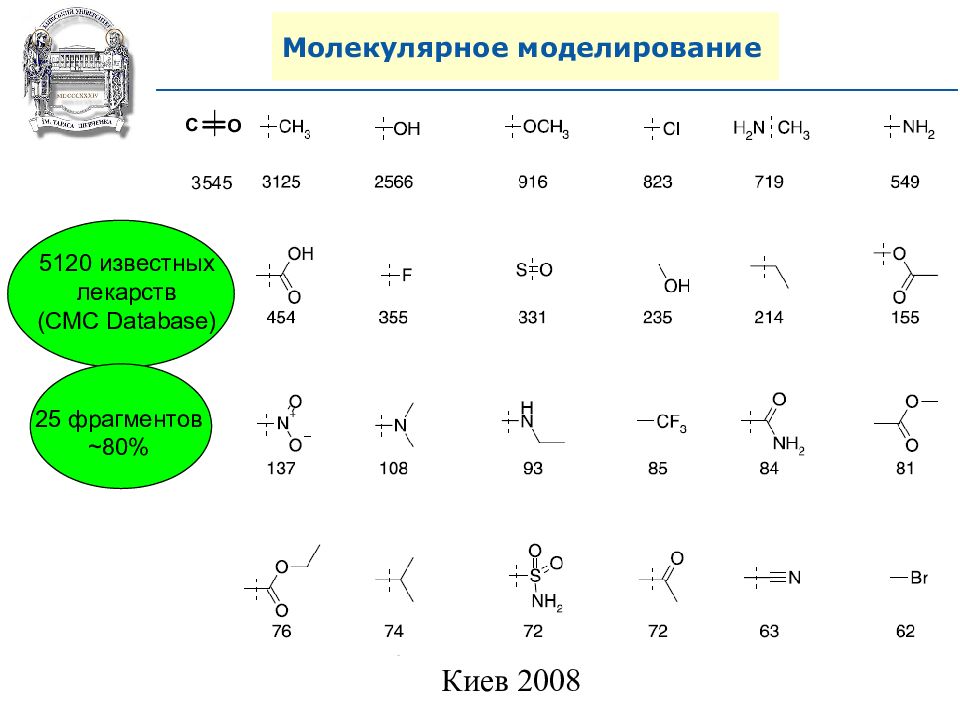
Слайд 100: Молекулярное моделирование
5120 известных лекарств ( CMC Database) 25 фрагментов ~80 %
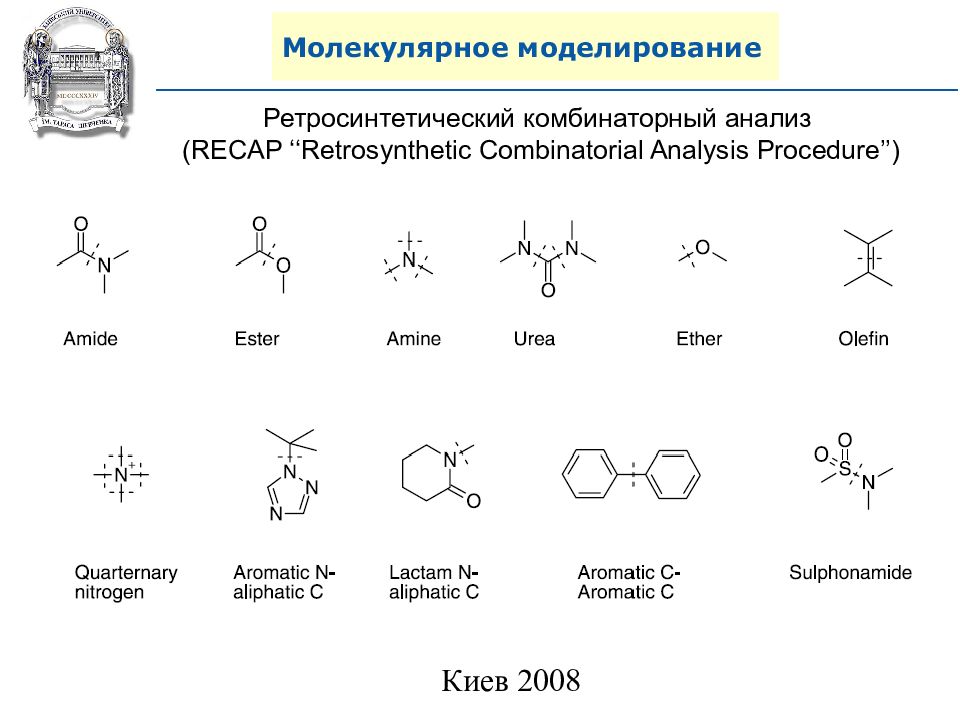
Слайд 101: Молекулярное моделирование
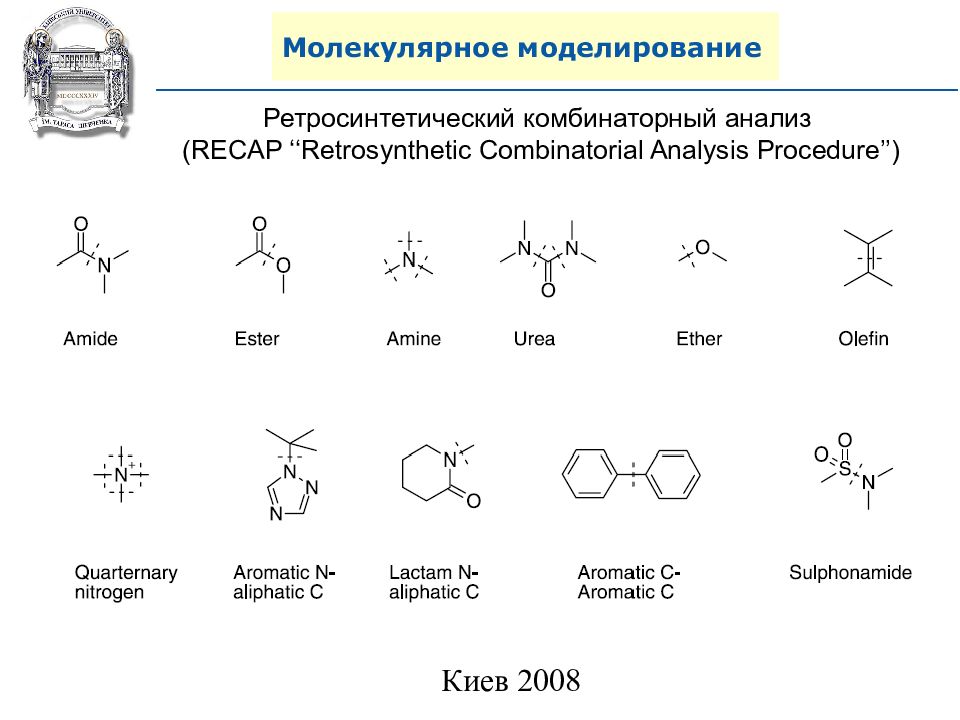
Ретросинтетический комбинаторный анализ (RECAP ‘‘Retrosynthetic Combinatorial Analysis Procedure’’)
Слайд 102: Молекулярное моделирование
Ретросинтетический комбинаторный анализ (RECAP ‘‘Retrosynthetic Combinatorial Analysis Procedure’’)
Слайд 103: Молекулярное моделирование
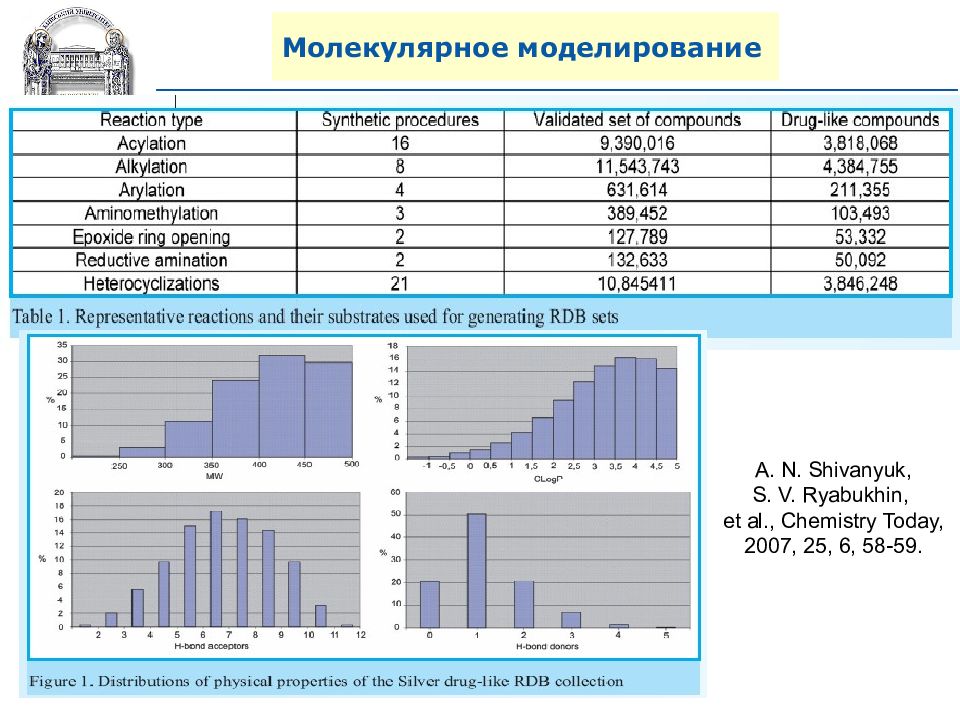
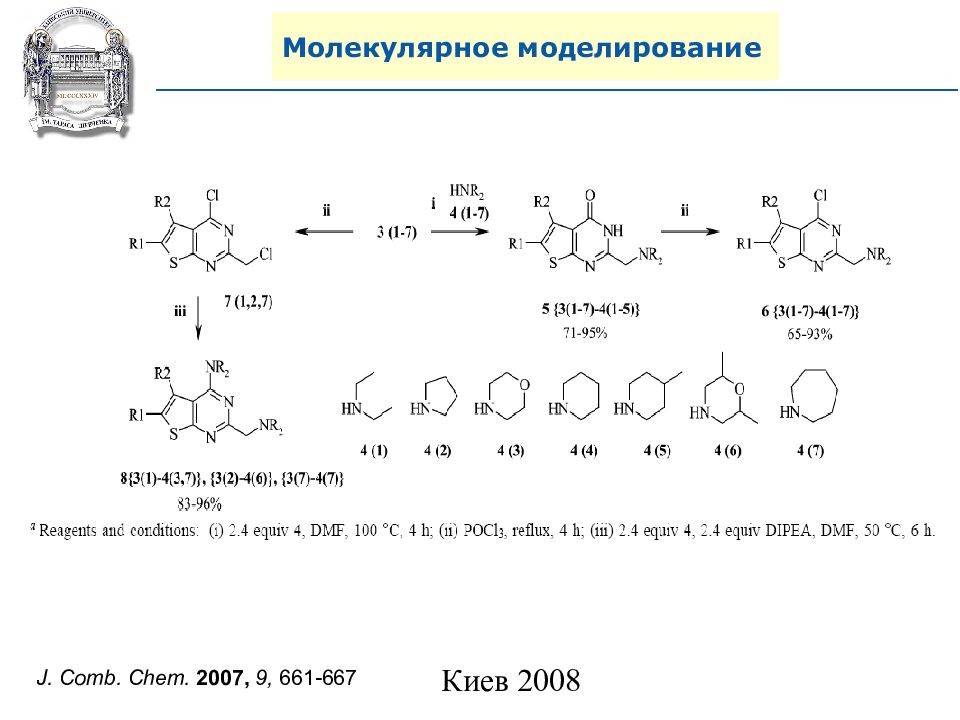
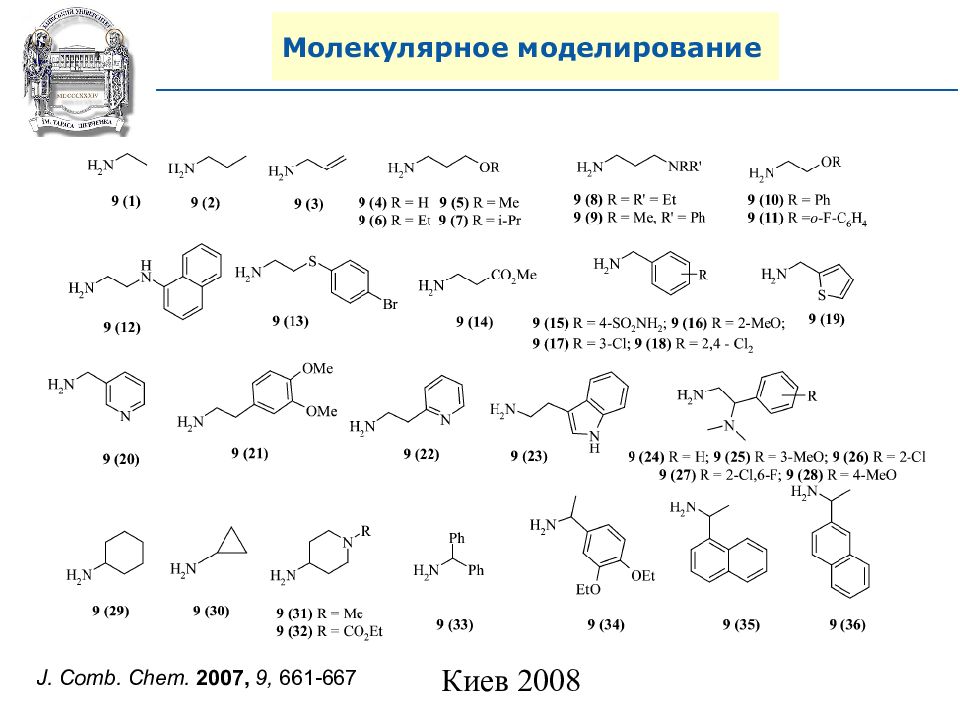
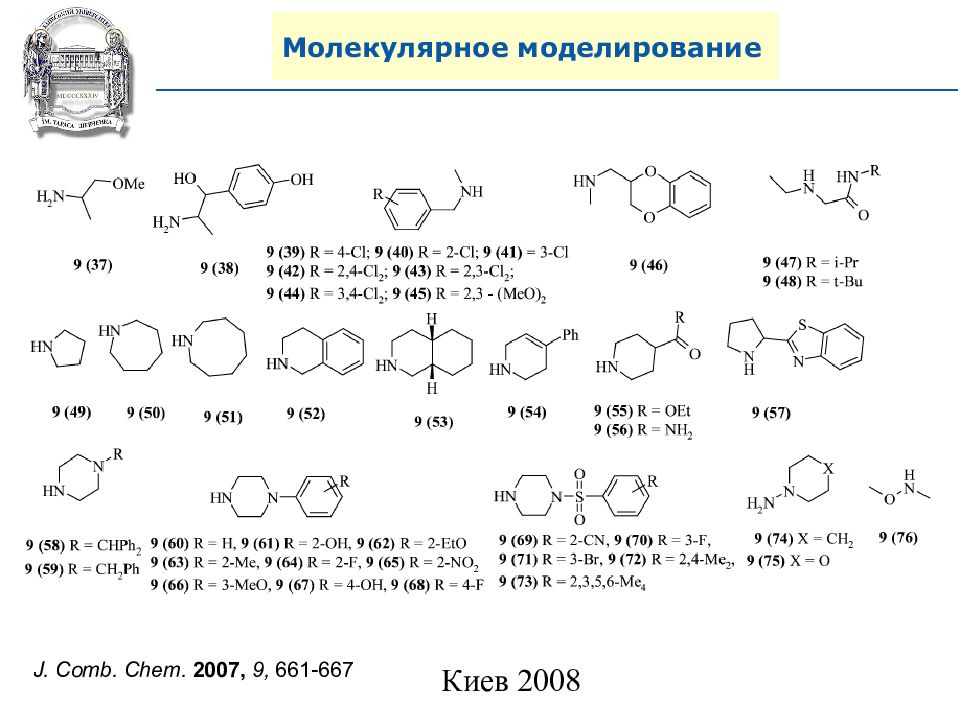
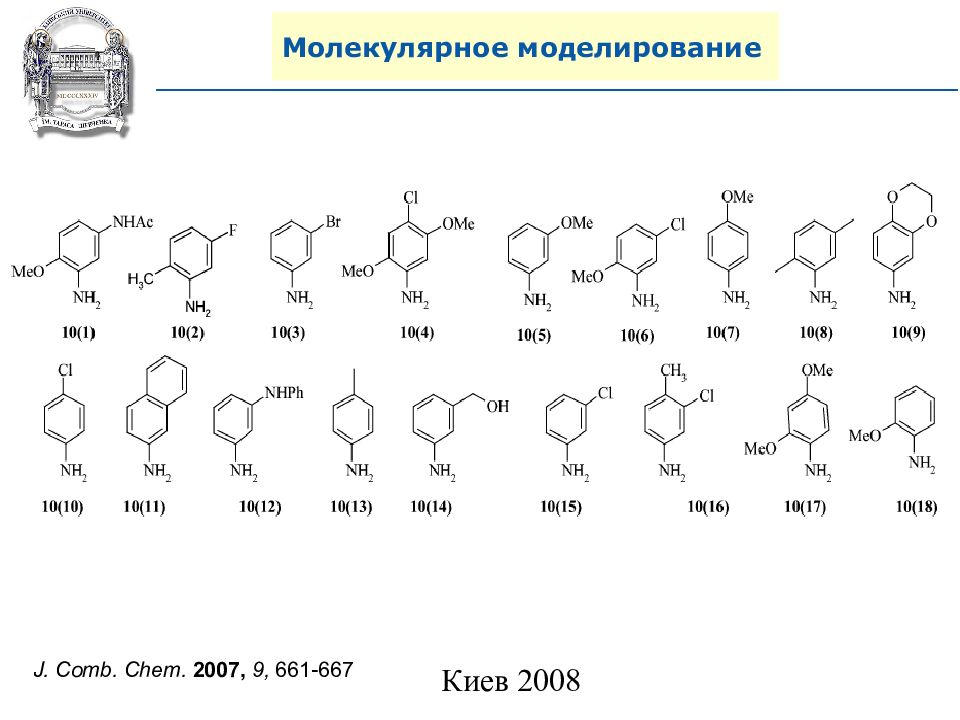
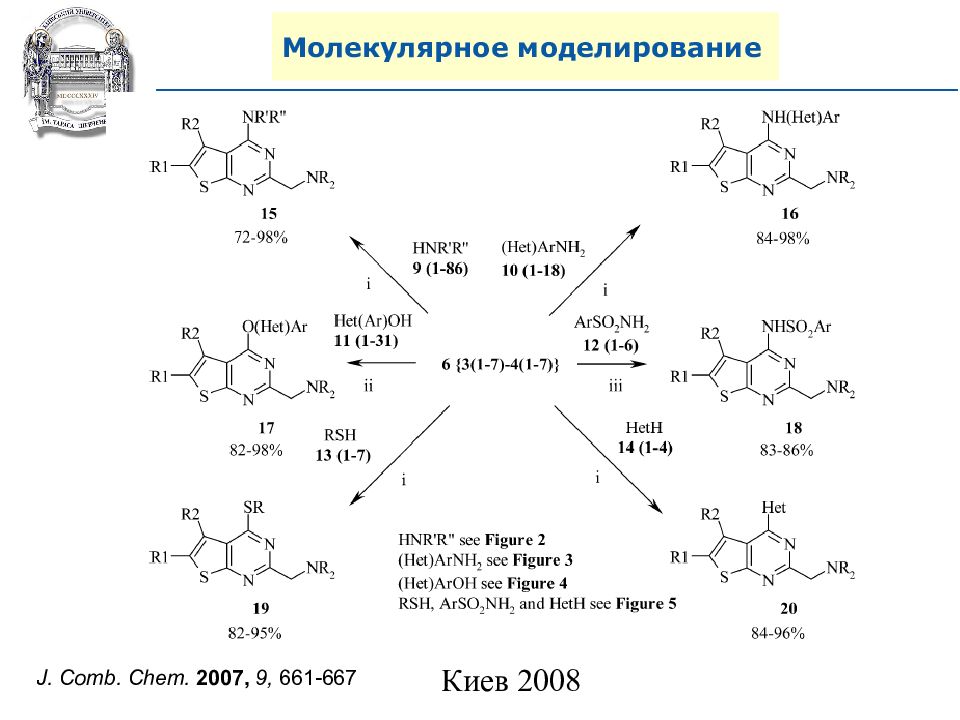
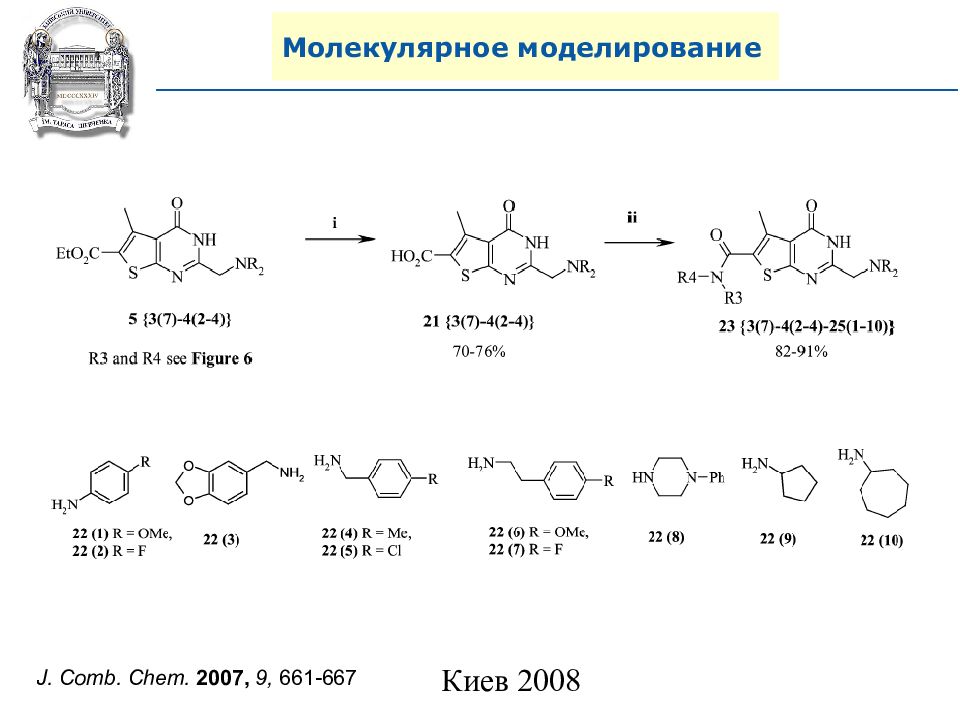
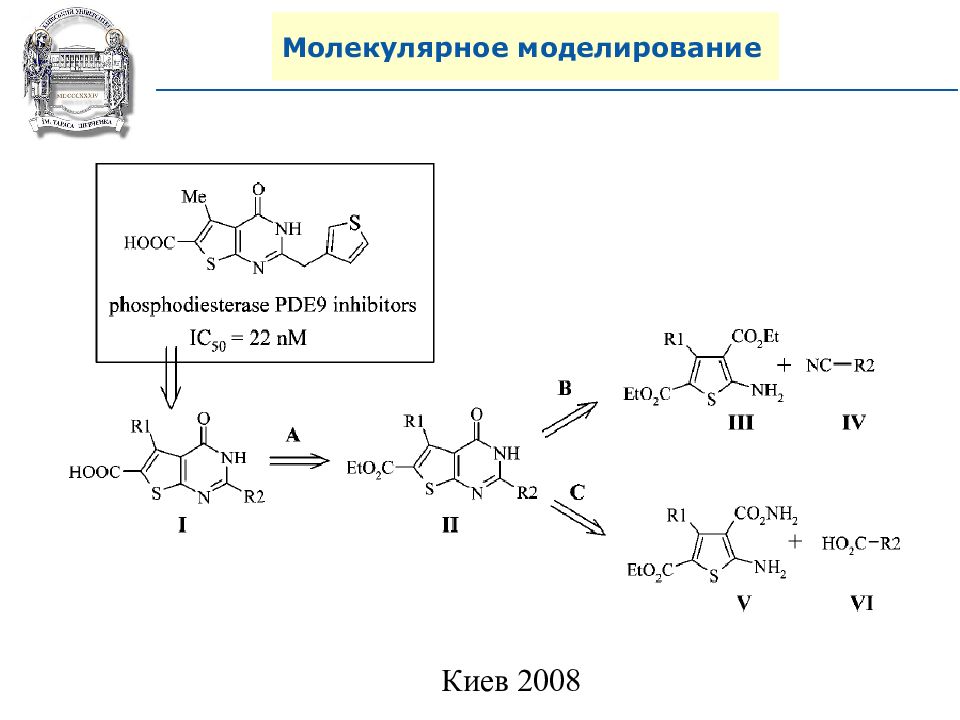
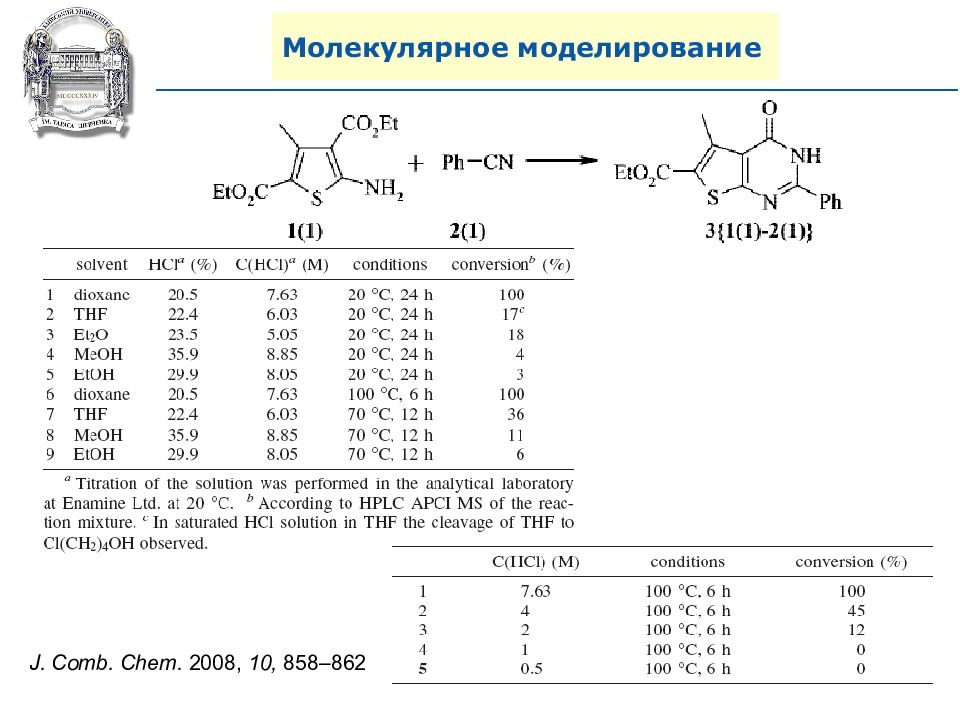
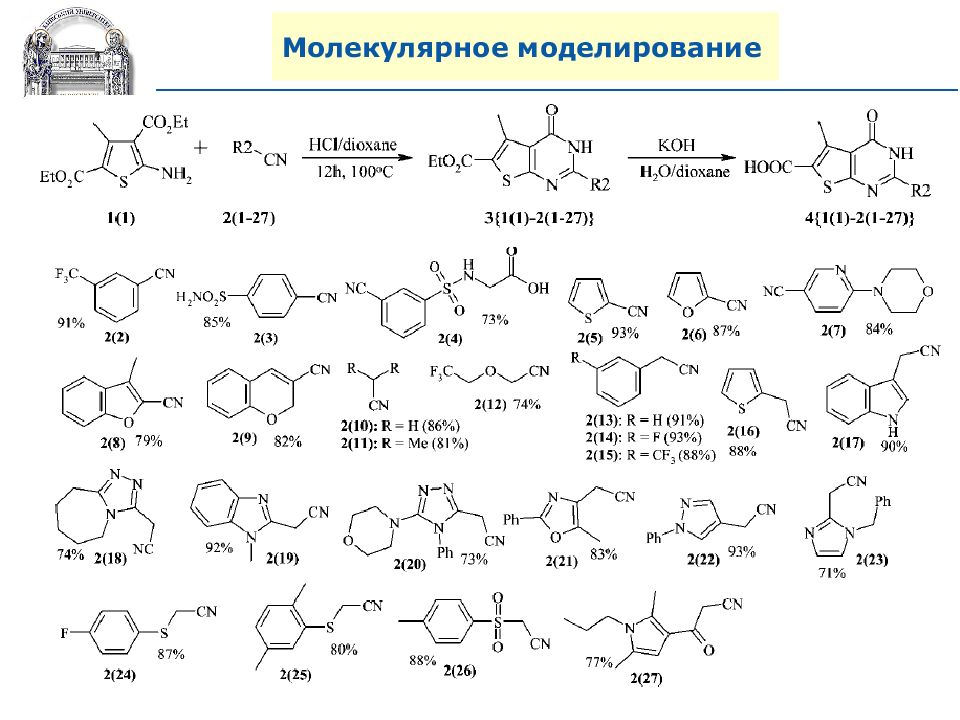
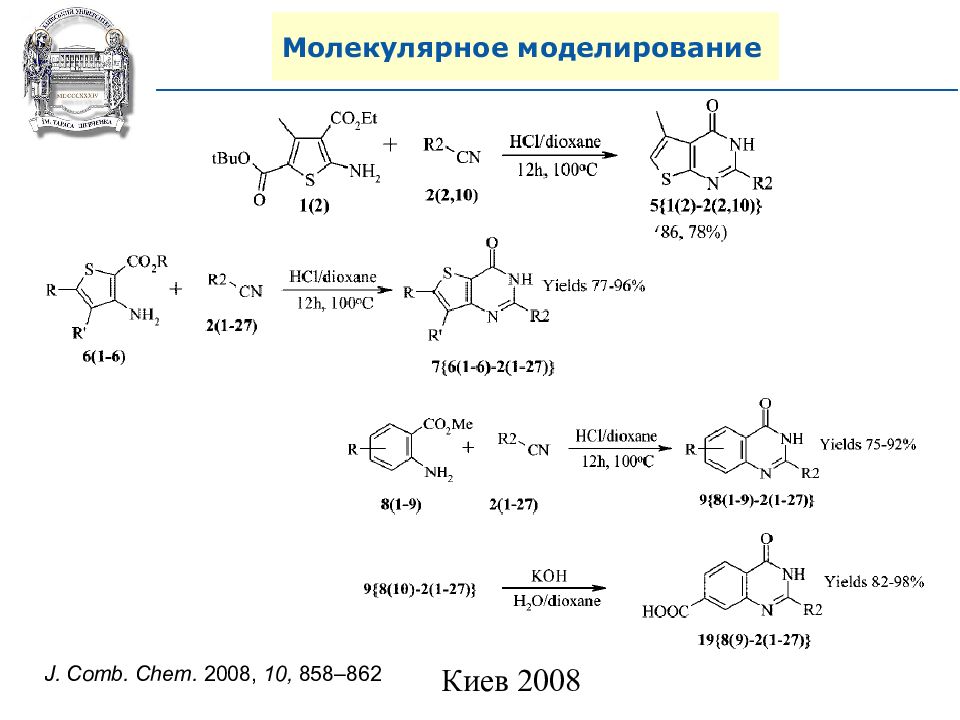
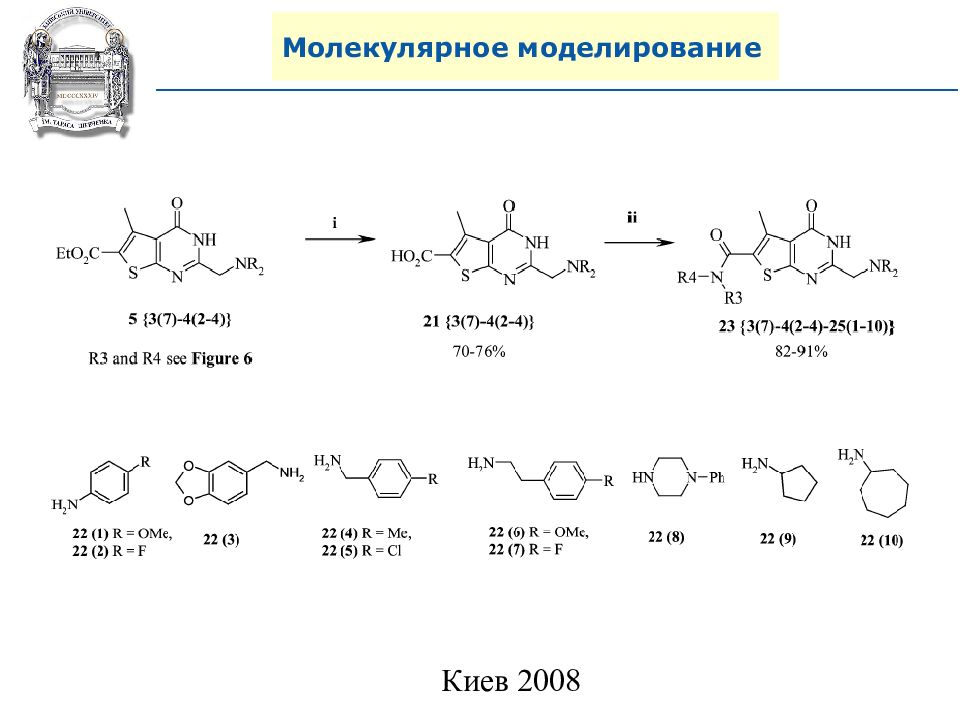
A. N. Shivanyuk, S. V. Ryabukhin, et al., Chemistry Today, 2007, 25, 6, 58-59.
Слайд 104: Молекулярное моделирование
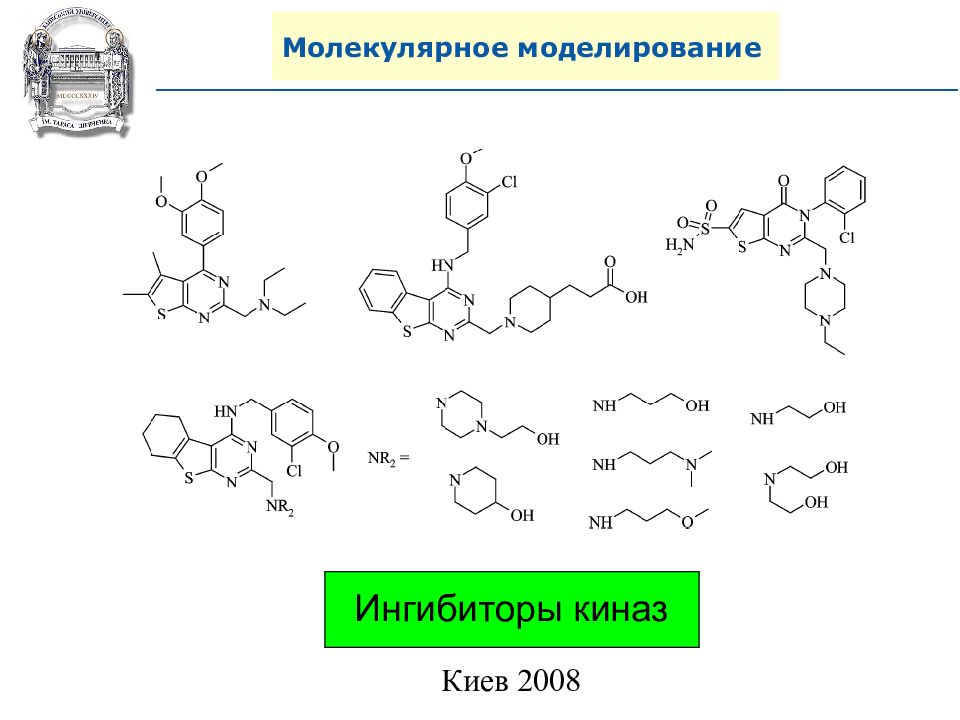
Современные “drug-like” библиотеки. 1) Соблюдение правила 4 с критериями по MW и ClogP из правила 3. 2) Должны соблюдаться критерии фармакофорности: а) Количество фармакофоров не меньше 2 но и не больше 7; б) Первичные, вторичные и третичные амины – фармакофоры, а азотсодержащие гетероциклы нет (исключение – имидазол); в) Фармакофоры соединенные непосредственно друг с другом считаются как 1; г) Соединения с более чем одной карбоксильной группой не подходят; д) Соединения не содержащие ни одного цикла не подходят; е) Аминогруппы находящиеся в 1 цикле считаются как 1 фармакофор (пипиразин и т.п.)
Слайд 105: Молекулярное моделирование
Современные “drug-like” библиотеки. 1) Соблюдение правила 4 с критериями по MW и ClogP из правила 3. 2) Должны соблюдаться критерии фармакофорности: а) Количество фармакофоров не меньше 2 но и не больше 7; б) Первичные, вторичные и третичные амины – фармакофоры, а азотсодержащие гетероциклы нет (исключение – имидазол); в) Фармакофоры соединенные непосредственно друг с другом считаются как 1; г) Соединения с более чем одной карбоксильной группой не подходят; д) Соединения не содержащие ни одного цикла не подходят; е) Аминогруппы находящиеся в 1 цикле считаются как 1 фармакофор (пипиразин и т.п.)