Первый слайд презентации: Комплексные соединения в аналитической химии
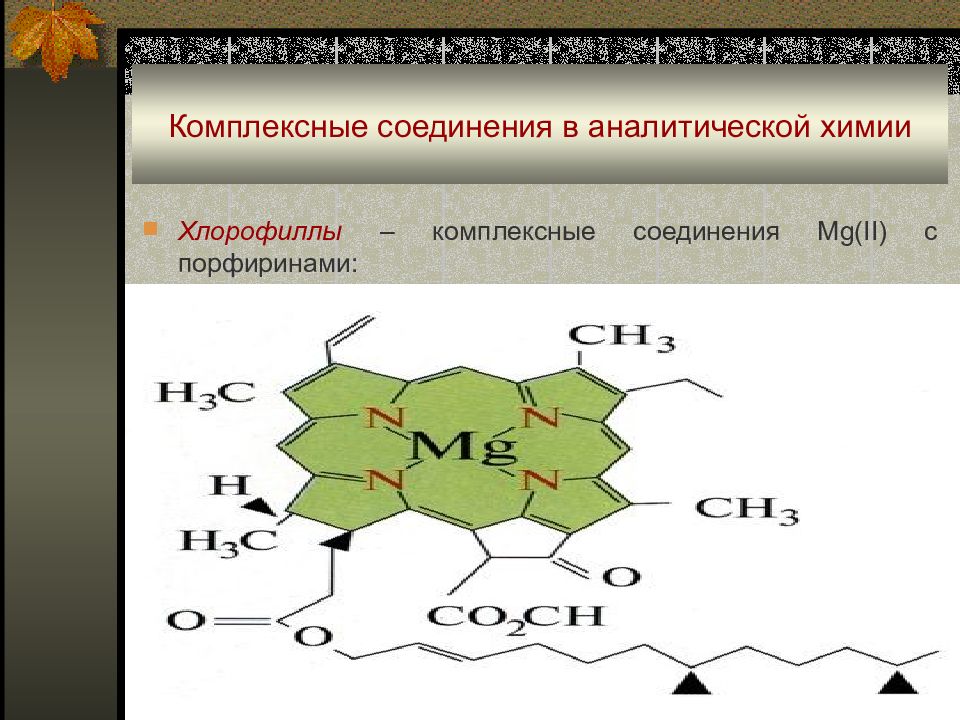
Хлорофиллы – комплексные соединения Mg(II) с порфиринами:
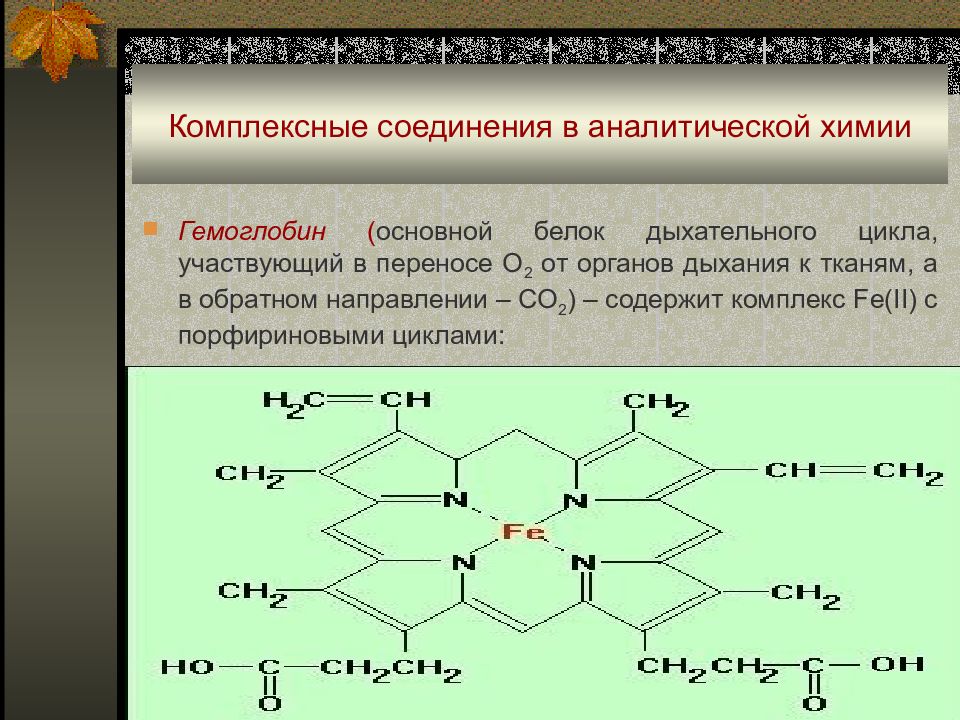
Гемоглобин ( основной белок дыхательного цикла, участвующий в переносе О 2 от органов дыхания к тканям, а в обратном направлении – СО 2 ) – содержит комплекс Fe(II) с порфириновыми циклами:
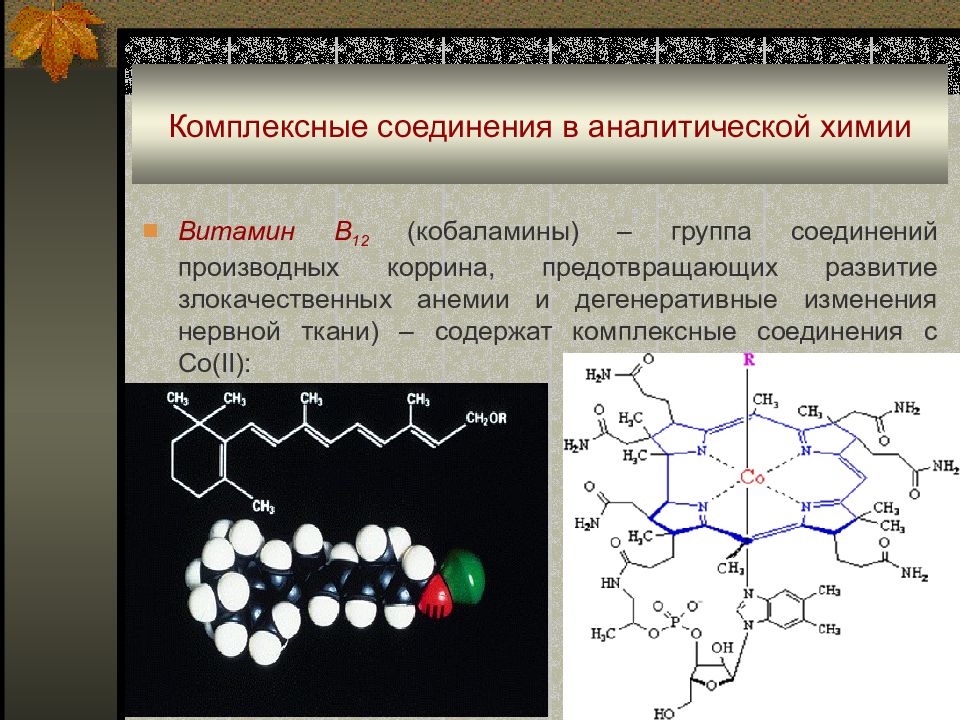
Витамин В 12 (кобаламины) – группа соединений производных коррина, предотвращающих развитие злокачественных анемии и дегенеративные изменения нервной ткани) – содержат комплексные соединения с Со(II):
Слайд 4: Комплексные соединения в аналитической химии
Основателем теории комплексных соединений является швейцарский химик Альфред Вернер (1866-1919); за работы в этой области в 1913 г. ему присуждена Нобелевская премия.
Слайд 5: Комплексные соединения в аналитической химии
По словам известного русского ученого в области координационной химии Ю.Н. Кукушкина «Наиболее лаконичное определение комплексных (координационных) соединений, хотя и не охватывающее всего их многообразия, следующее – это соединения, образованные из простых, способных к самостоятельному существованию » ( Соросовский образовательный журнал. 1977. № 12. С. 59 – 64).
Слайд 6: Комплексные соединения в аналитической химии
Основные признаки комплексных соединений : - способность отдельных составных частей к самостоятельному существованию; - cложность состава; - частичная диссоциация на составные части в растворе; - наличие положительно заряженной центральной частицы – комплексообразователя, связанной с лигандом; - наличие определенной устойчивой пространственной геометрии расположения лигандов вокруг комплексообразователя. Ni(NH 3 ) 6 2+ ↔ Ni 2+, NH 3 [Co(NH 3 ) 6 ]SO 4 ↔ Co(NH 3 ) 6 2+, SO 4 2-, Co 2+, NH 3
Основные понятия : комплексное соединение (комплекс) состоит из атома металла-комплексообразователя М, с которым связаны лиганды (старое название адденды) L. Лиганды, связанные с центральным атомом непосредственно, образуют внутреннюю сферу комплекса, а непосредственно не связанные – внешнюю сферу. Лиганд L образует с металлом-комплексообразователем М координационную связь различной химической природы (ионная, ковалентная, полярная ; по происхождению – донорно-акцепторная, дативная) ; ■ Координационное число (к.ч.) : число связей, которое комплексообразователь может образовывать с лигандами.
Слайд 8: Комплексные соединения в аналитической химии
Дентатность лиганда – число атомов лиганда L, способных к координации с ионом металла М; Примеры: донорно-акцепторная связь ↔ комплексы металлов с к.ч. = 2 ( монодентатный L – NH 3 ) и 8 ( бидентатный L – C 2 O 4 2- )
Слайд 9: Классификации комплексных соединений
По зарядности : нейтральные – [Pt(NH 3 ) 2 CI 2 ]; катионные – [Co(NH 3 ) 4 ] 2+ ; анионные – [Fe(CN 6 )] 4- ; По типу лигандов : однороднолигандные HgI 4 2- ; смешанолигандные PtCI 2 (NH 3 ) 2 ; По типу координирующегося атома лиганда : O – лигандные – [Ca(SO 4 ) 2 ] 2- ; N - лигандные – [Ag(NH 3 ) 2 ] + и т. д. ; По числу атомов комплексообразователей : моноядерные [Fe(SCN) 6 ] 3- ; полиядерные [AI 2 CI 6 ]; По скорости обмена лигандами : лабильные (реагирующие быстро) и инертные (реагирующие медленно) ; По природе связи между составными частями комплекса : внутрисферные и внешнесферные.
Слайд 10: Внутрисферные комплексные соединения (в.к.с.)
отличительный признак : наличие непосредственной, как правило, кооординационной связи центрального атома с лигандами ; в.к.с. (хелаты) – комплексы, образованные с участием полидентатных лигандов и имеющие циклы : в.к.с. (внутрикомплексные соединения) – хелаты, в которых замыкание цикла сопровождается вытеснением из кислотных функциональных групп протонов :
Слайд 11: Классификации комплексных соединений
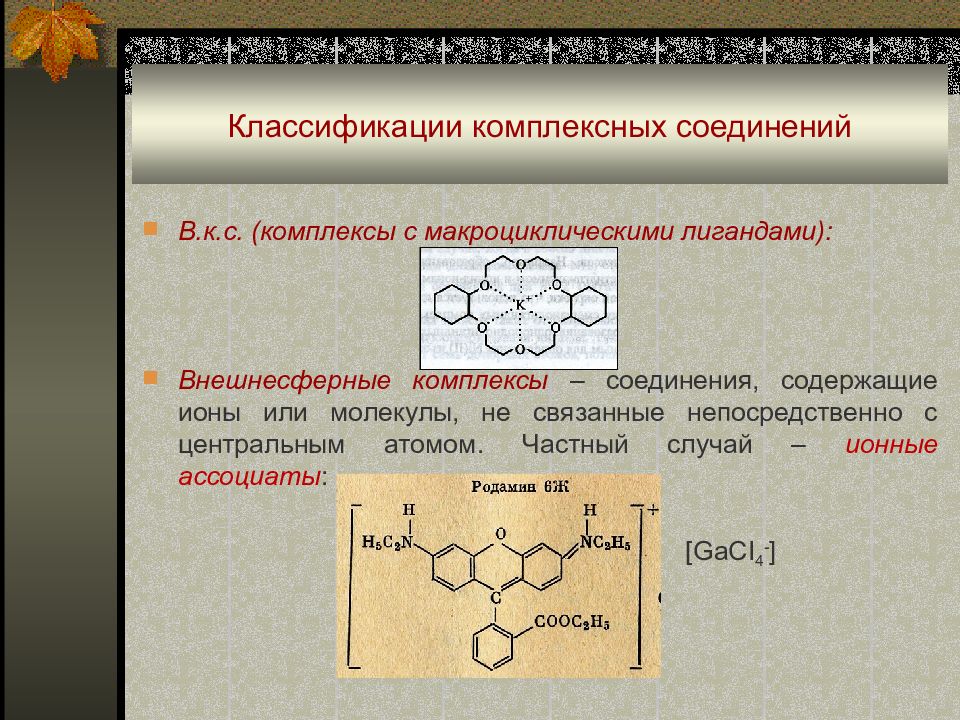
В.к.с. (комплексы с макроциклическими лигандами): Внешнесферные комплексы – соединения, содержащие ионы или молекулы, не связанные непосредственно с центральным атомом. Частный случай – ионные ассоциаты : [GaCI 4 - ]
Слайд 12: Номенклатура комплексных соединений
Традиционные специфические номенклатурные названия: отсутствует какая-либо логическая схема; комплексным соединениям присвоены исторически сложившиеся названия, например, K 4 [Fe(CN) 6 ] – желтая кровяная соль, ферроцианид калия; K 3 [Fe(CN) 6 ] – красная кровяная соль, феррицианид калия; K 2 [PtCI 4 ] – хлорплатинит калия; K 2 [PtCI 6 ] – хлорплатинат калия; Fe 3 [[Fe(CN) 6 ] 2 – турнбулева синь ; Fe 4 [[Fe(CN) 6 ] 2 – берлинская лазурь; [Pt(NH 3 ) 4 ](OH) 2 – первое основание Рейзе ; транс- [Pt(OH) 2 (NH 3 ) 2 ] – второе основание Рейзе ; Номенклатура, рекомендованная в 1960 г. Международным союзом по чистой и прикладной химии (ИЮПАК – IUPAC – International Union of Pure and Applied Chemistry).
Слайд 13: Номенклатура комплексных соединений (IUPAC)
Одноядерные комплексы : - вначале называют катион, затем анион ; - при перечислении лигандов сначала называют отрицательно заряженные, затем нейтральные с соответствующими числительными (ди-, три-, тетра-) ; - после этого называют атом металла-комплексообразователя, указывая после названия металла его степень окисления римскими цифрами в круглых скобках ; - в последнюю очередь называют внешнесферные ионы ; - если комплекс представляет собой анион, то к названию центрального атома добавляют суффикс –ат ; - если лиганды сложные многоатомные молекулы, то используют числительные бис-, трис-, тетракис-, пентакис-, гексакис-.
Слайд 14: Номенклатура комплексных соединений (IUPAC)
Примеры : [Pt(NH 3 ) 4 ]CI 2 – тетрамминплатина( II) хлорид ; [Co(NH 3 ) 5 CI]SO 4 – хлоропентамминкобальт( III) сульфат ; [Pt(PPh 3 ) 3 Br]Br -бромотрис(трифенилфосфин)платина( II) бромид.
Слайд 15: Равновесия реакций комплексообразования
С учетом замещения молекул растворителя ( S) при комплексообразовании: Упрощенная запись равновесий комплексообразования:
Слайд 16: Равновесия реакций комплексообразования
а ML f ML f ML • ML β т = ———— = β c • ————— = β у • ——————; a M • a L f M •f L f M • M • f L • L
Слайд 17: Равновесия реакций комплексообразования
В соответствии с законом действия масс равновесия можно представить набором соответствующих термодинамических констант: При ионной силе отличной от нуля используют концентрационные (реальные) константы устойчивости:
Слайд 18: Равновесия реакций комплексообразования
При протекании конкурирующих реакций с участием центрального иона или лиганда используют условные (обычно общие) константы устойчивости: C ML i α М • (α L ) i α М • (α L ) i f M • (f L ) i β у ML i = ———— = β i к ———— = β i т × ———— × ———; C M • (C L ) i α ML i α ML i f ML
Слайд 20: Равновесия реакций комплексообразования
Зная константы устойчивости комплексных соединений и равновесные концентрации свободного лиганда, можно рассчитать молярную долю (степень образования) иона металла и любой комплексной формы: или в общем виде:
Слайд 21: Равновесия реакций комплексообразования
Реакции образования внешнесферных комплексов описывают с помощью констант ассоциации :
Слайд 22: Кинетика комплексообразования
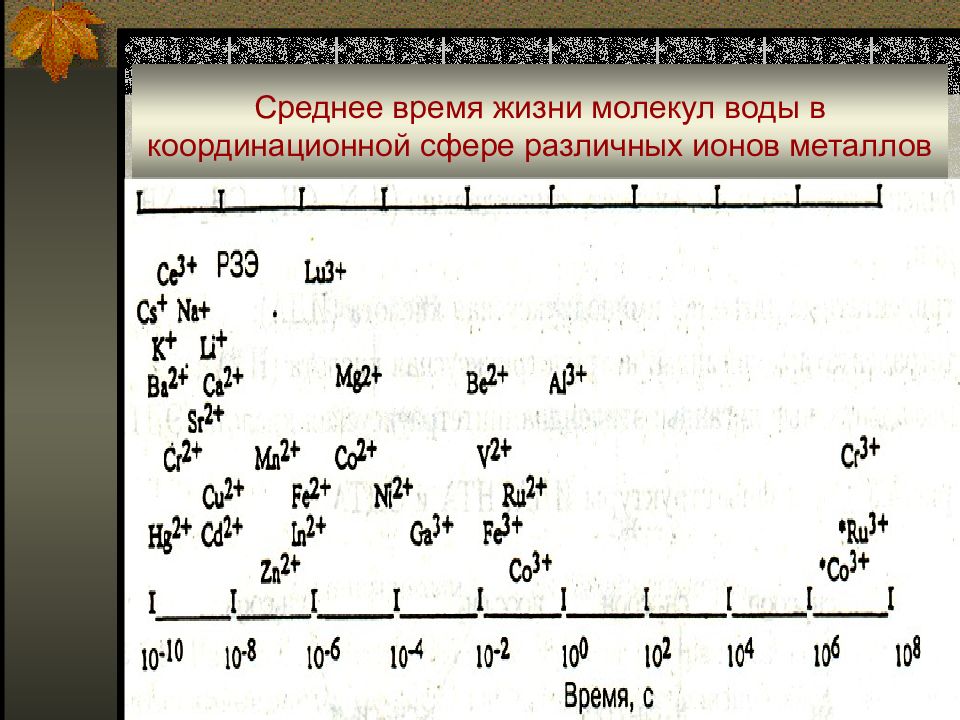
Скорость комплексообразования лучше всего описывается средним временем жизни отдельного лиганда в координационной сфере иона металла. В водных растворах для реакции первого порядка уравнение скорости обмена аквалиганда записывается в виде при интегрировании получим : если t = t ½, то по определению : тогда
Слайд 23: Среднее время жизни молекул воды в координационной сфере различных ионов металлов
Слайд 24: Факторы, влияющие на устойчивость комплексов
Природа центрального и донорного атомов: Ральф Г. Пирсон, профессор химии в Северо-Западном университете в г. Эванстон (штат Иллинойс, США) разделил атомы лигандов и ионы металлов на «мягкие» и «жесткие» кислоты и основания в соответствии с их электроотрицательностью и поляризуемостью (ионы металлов действуют как кислоты Льюиса, а большинство лигандов – как основания Льюиса ). М ягкость кислоты или основания Льюиса означает его склонность к образованию связей преимущественно ковалентного, а жесткость - преимущественно ионного характера.
Слайд 25: Факторы, влияющие на устойчивость комплексов
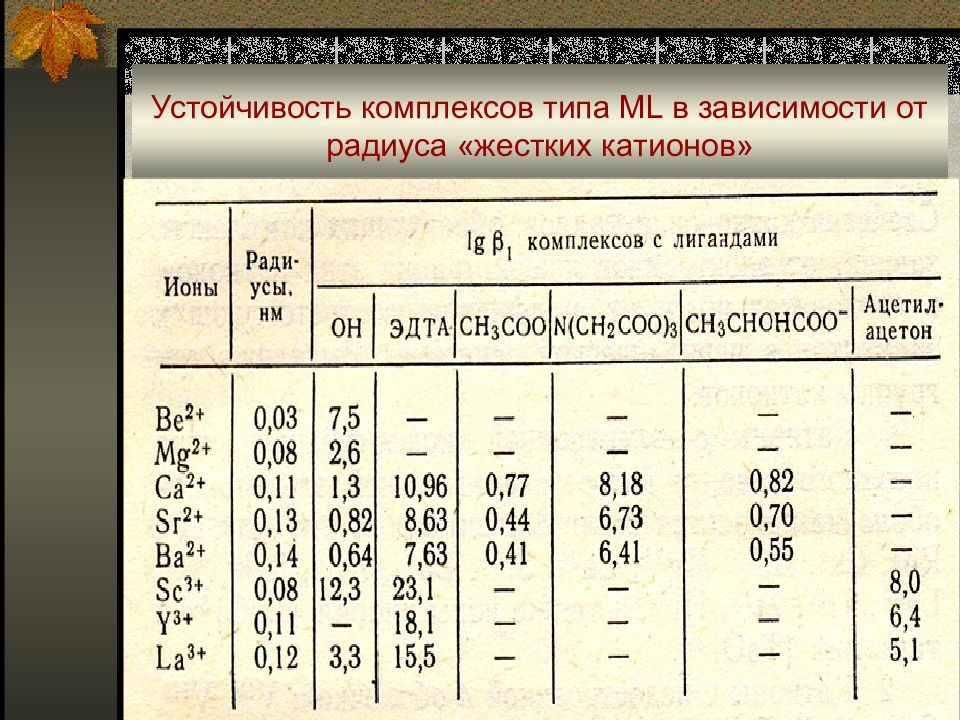
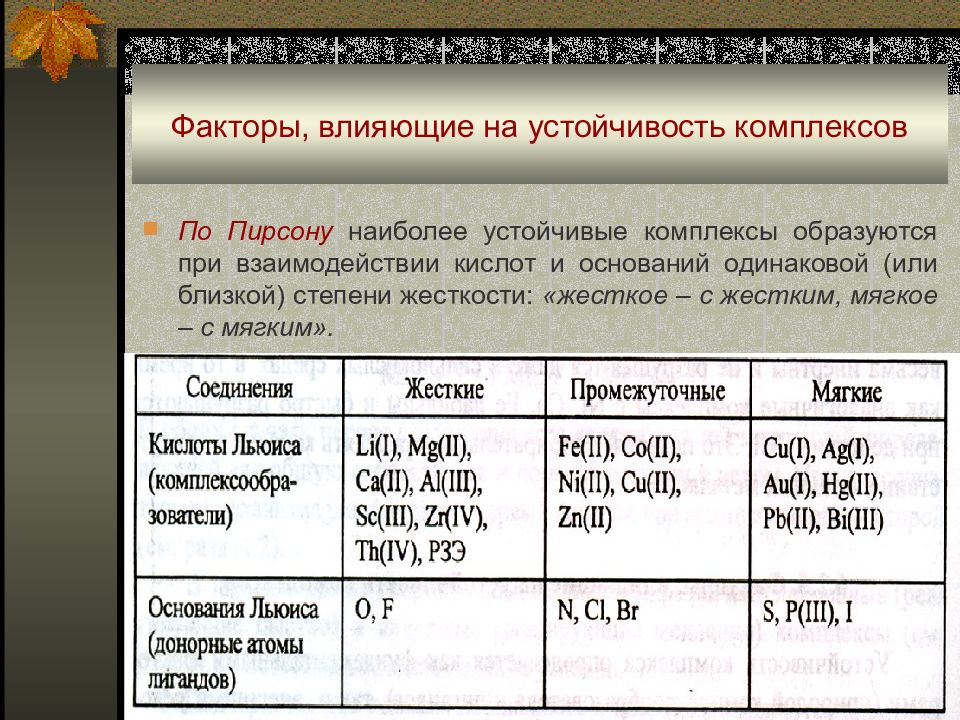
Типичные жесткие кислоты Льюиса характеризуются достаточно низкой электроотрицательностью, высокой поляризующей силой, малым размером иона; для мягких кислот эти свойства противоположны. Жесткость или мягкость иона в значительной степени определяется его электронным строением: - «жесткие катионы» с электронной конфигурацией типа инертного газа (на внешней электронной оболочке 2 или 8 электронов) Li(I), Na(I), K(I), Rb(I), Cs(I), Be(II), Mg(II), Ca(II), Sr(II), Ba(II), AI(III), Sc(III), Y(III), La(III),Th(IV), Zr(IV), Hf(IV), [NbO] 3+, [TaO] 3+ ;
Слайд 26: Факторы, влияющие на устойчивость комплексов
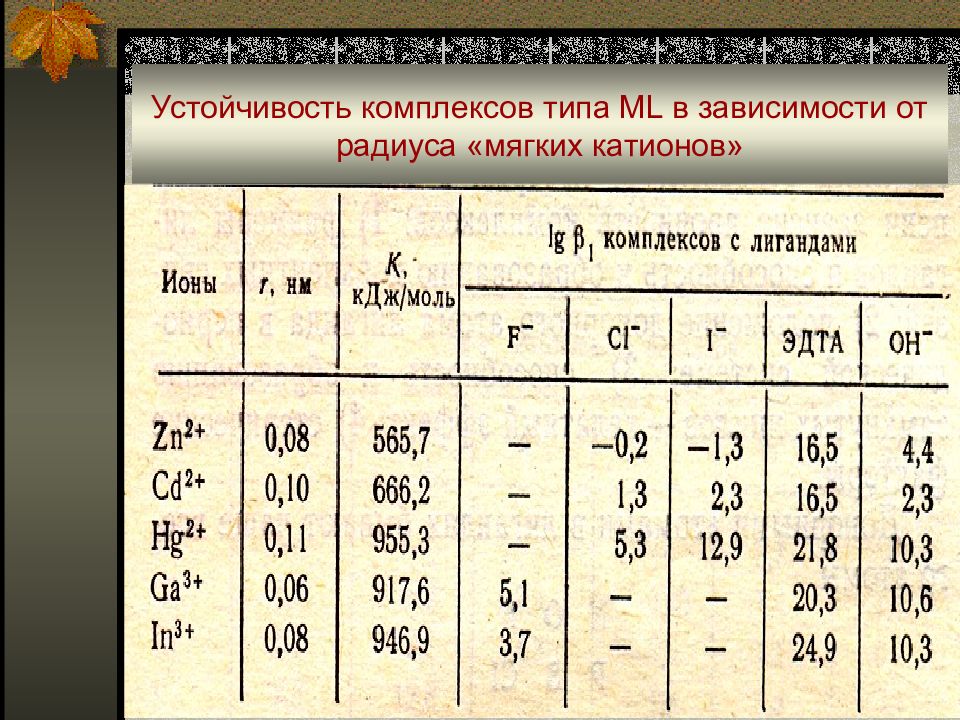
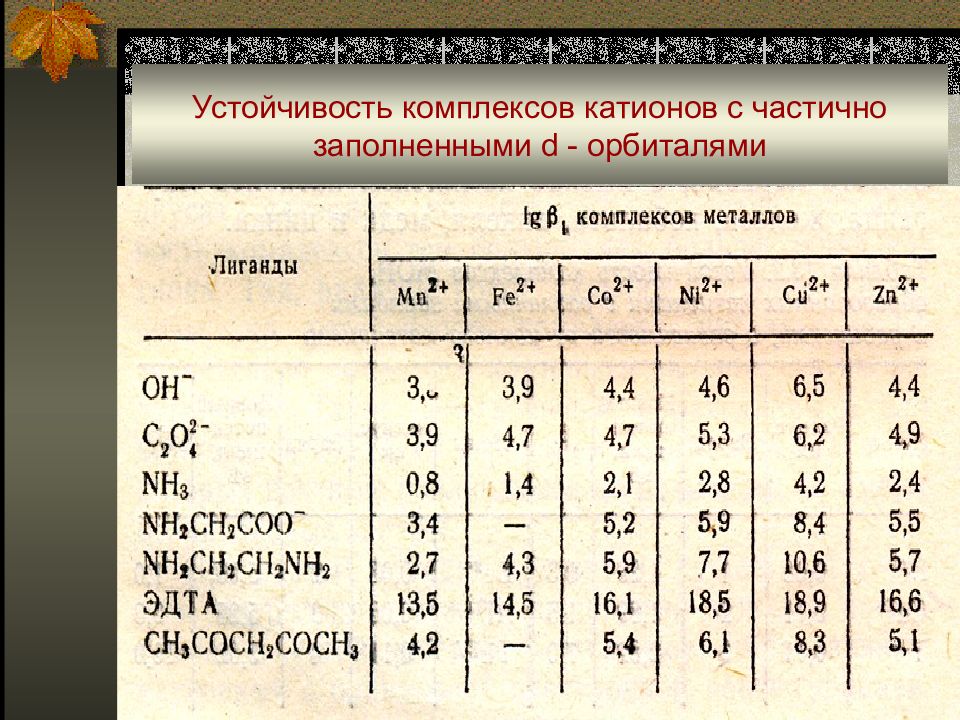
Жесткость или мягкость иона в значительной степени определяется его электронным строением: - «мягкие катионы» с полностью заполненными d-орбиталями (на внешней электронной оболочке 18 или 18+2 электронов) Zn(II), Cd(II), Hg(II), Ga(III), In(III), TI(III), Ge(IV), Sn(II,IV), As(III,V), Sb(III,V), Pb(II), Вi(III); - катионы с недостроенной d-оболочкой (промежуточное положение) V(III,IV), Cr(III), Mn(II), Fe(II), Co(II,III), Ni(II), Cu(II), Ru(IV), Rh(III), Pd(II), Os(IV), Ir(III,IV), Pt(II,IV).
Слайд 27: Устойчивость комплексов типа ML в зависимости от радиуса «жестких катионов»
Слайд 28: Устойчивость комплексов типа ML в зависимости от радиуса «мягких катионов»
Слайд 29: Устойчивость комплексов катионов с частично заполненными d - орбиталями
Слайд 30: Факторы, влияющие на устойчивость комплексов
По Пирсону наиболее устойчивые комплексы образуются при взаимодействии кислот и оснований одинаковой (или близкой) степени жесткости: «жесткое – с жестким, мягкое – с мягким».
Слайд 31: Факторы, влияющие на устойчивость комплексов
Размеры и природа лиганда : (N O F P S CI As Se Br Sb Te I) для «жестких катионов» (предпочтительнее О, чем S ) устойчивость, например, галогенидных комплексов уменьшается в ряду F - < CI - < Br - < I - ; для «мягких катионов» – все наоборот. Устойчивость комплексов «мягких катионов» в зависимости от размеров лигандов
Слайд 32: Факторы, влияющие на устойчивость комплексов (хелатный эффект)
Герольд Карл Шварценбах (1904-1978) – Швейцарский химик сформулировал хелатный эффект, состоящий в том, что полидентатные лиганды образуют более устойчивые комплексы (ML n ), чем их монодентатные аналоги (ML m ): 1 ∆Ig β = Ig β n - Ig β m = - ————— (∆G n 0 - ∆G m 0 ) = 2,303•RT 1 - ————— [(∆H n o - ∆H m o ) – T(∆S n 0 - ∆S m 0 )]; 2,303•RT ∆Ig β > 0, если ∆H n o - ∆H m o < 0 ( энтальпийный эффект ) ; ∆S n 0 - ∆S m 0 > 0 ( энтропийный эффект ).
Слайд 33: Факторы, влияющие на устойчивость комплексов (хелатный эффект)
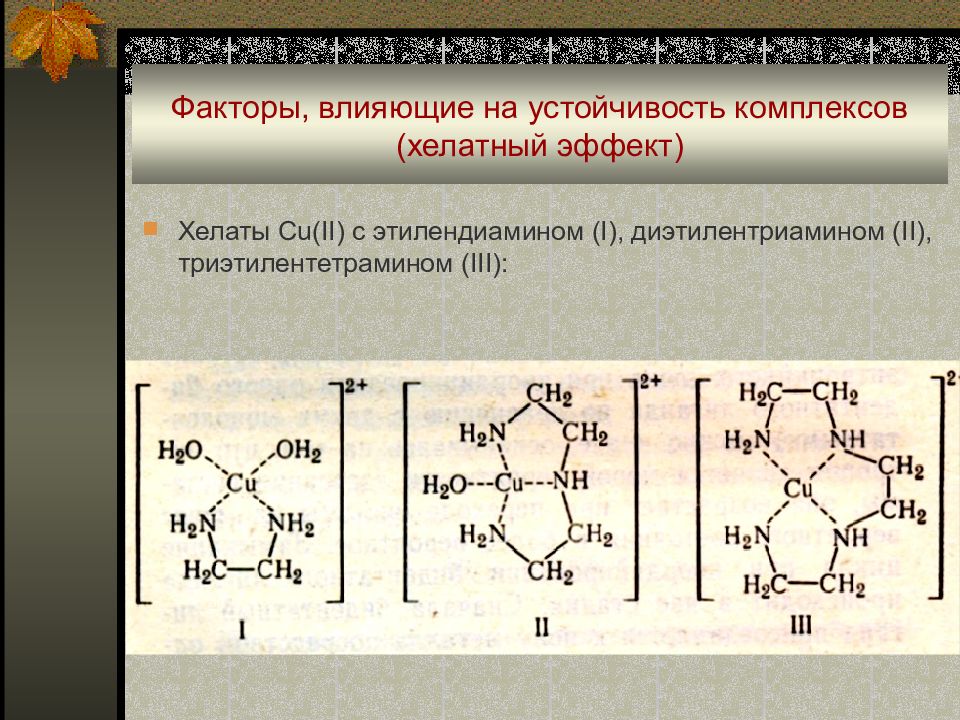
Хелаты Cu(II) с этилендиамином (I), диэтилентриамином (II), триэтилентетрамином (III):
Слайд 34: Факторы, влияющие на устойчивость комплексов (хелатный эффект)
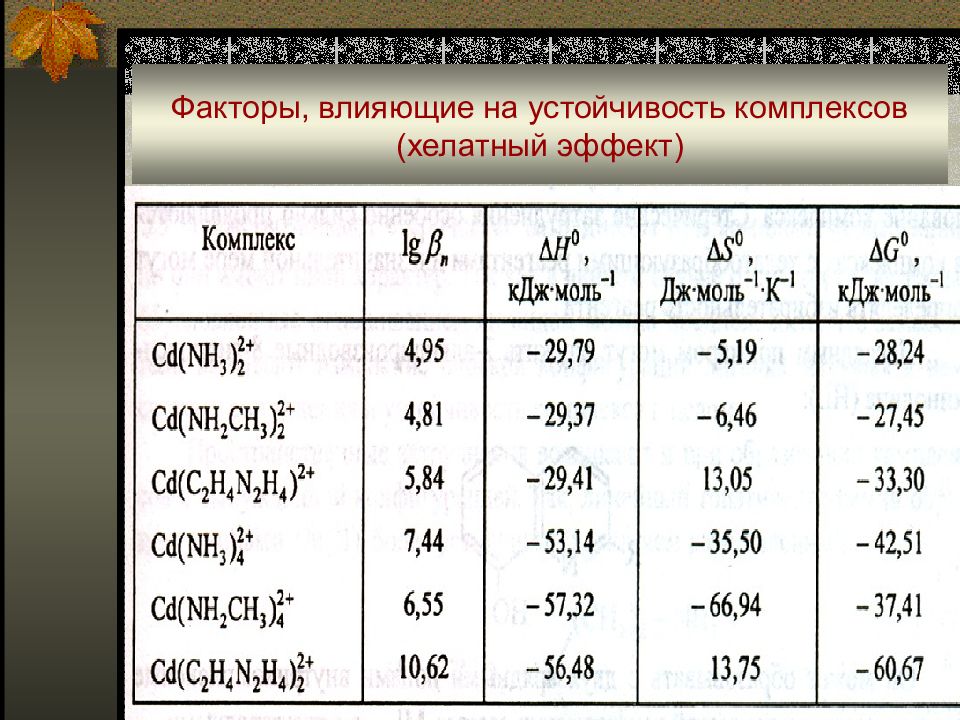
Энтропийная составляющая. В первом приближении ∆ S i 0 определяется изменением числа частиц : - Cd(H 2 O) 4 2+ + 4 NH 3 ↔ Cd(NH 3 ) 4 2+ + 4H 2 O (лиганд монодентатен, число частиц не изменяется, ∆ S m 0 = 0); - Cd(H 2 O) 4 2+ + 2 en ↔ Cd(en) 2 2+ + 4H 2 O (лиганд полидентатен, число частиц увеличивается, ∆ S n 0 > 0); отсюда ∆ S n 0 - ∆ S m 0 > 0;
Слайд 35: Факторы, влияющие на устойчивость комплексов (хелатный эффект)
■ Энтальпийная составляющая. В первом приближении это энергия, которую необходимо затратить для ориентации лигандов вокруг центрального атома для образования комплекса. ■ При прочих равных условиях в случае образования пяти- шестичленных циклов затраты энергии минимальны.
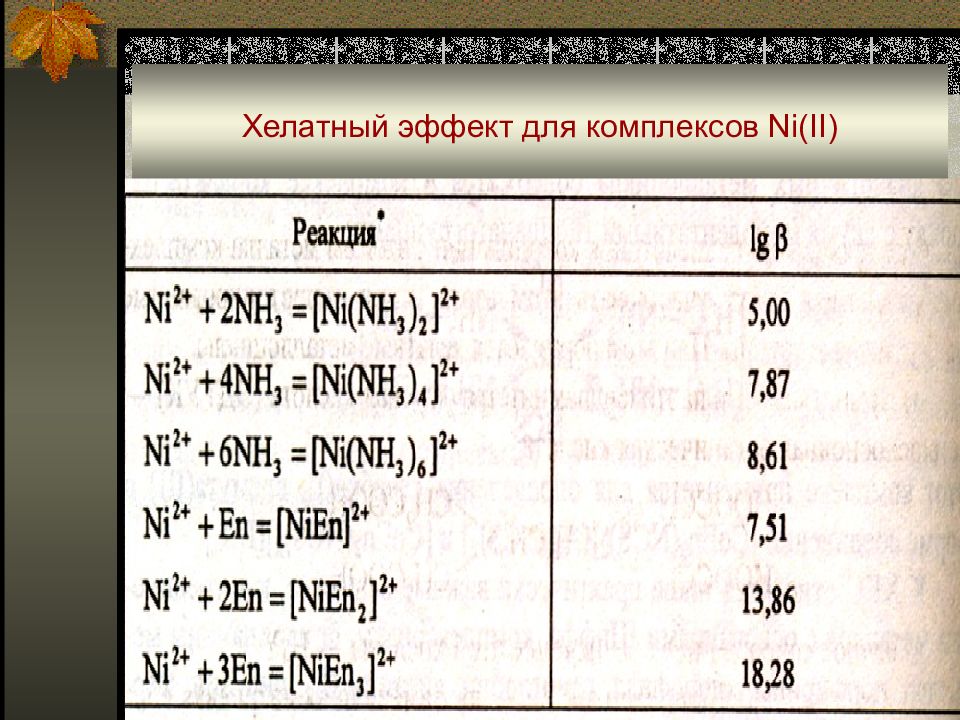
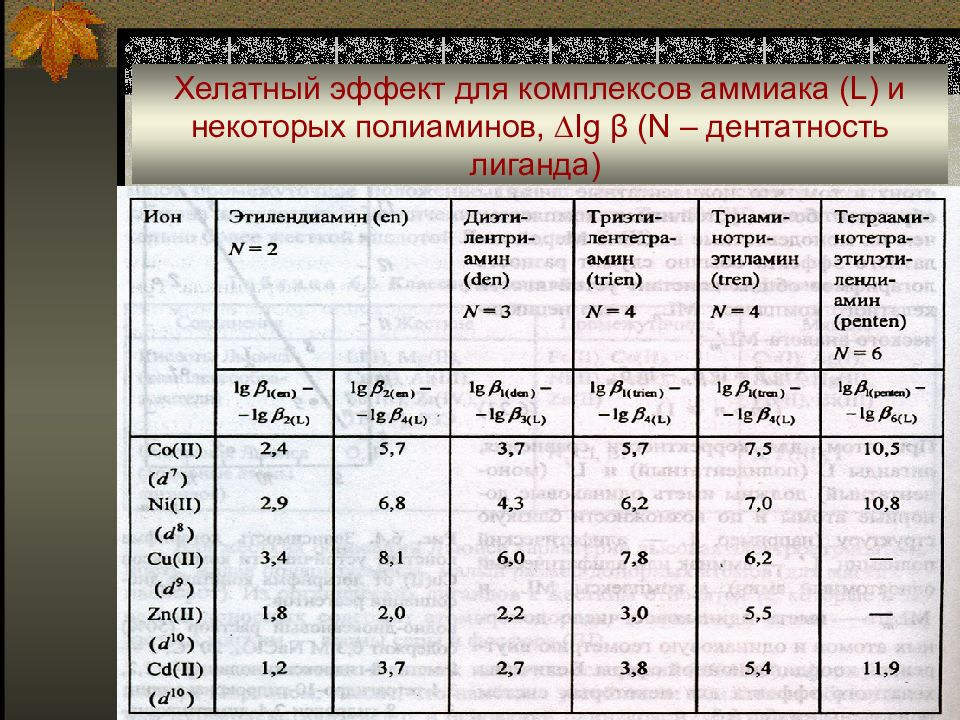
Слайд 38: Хелатный эффект для комплексов аммиака ( L) и некоторых полиаминов, ∆ Ig β (N – дентатность лиганда)
Слайд 39: Факторы, влияющие на устойчивость комплексов (стерические эффекты)
Введение заместителей в положения, близкие к донорным атомам, может затруднить образование комплекса : - 2- алкил производные 8-гидроксихинолина ( HL) образуют с М 2+ м.р. соединения тетраэдрической конфигурации ML 2, а с M 3+ - м.р. октаэдрические комплексы ML 3. Однако для ионов малого радиуса, например AI(III) образование ML 3 невозможно ввиду стерических затруднений, создаваемых группой в положении 2. Образуются растворимые ML + и ML 2 +. Эту ситуацию используют для осаждения 2-замещенными 8-гидроксихинолина Cr(III), Fe(III), Ga(III), Be(II), Zn(II) в присутствии AI(III)
Слайд 40: Факторы, влияющие на устойчивость комплексов (стерические эффекты)
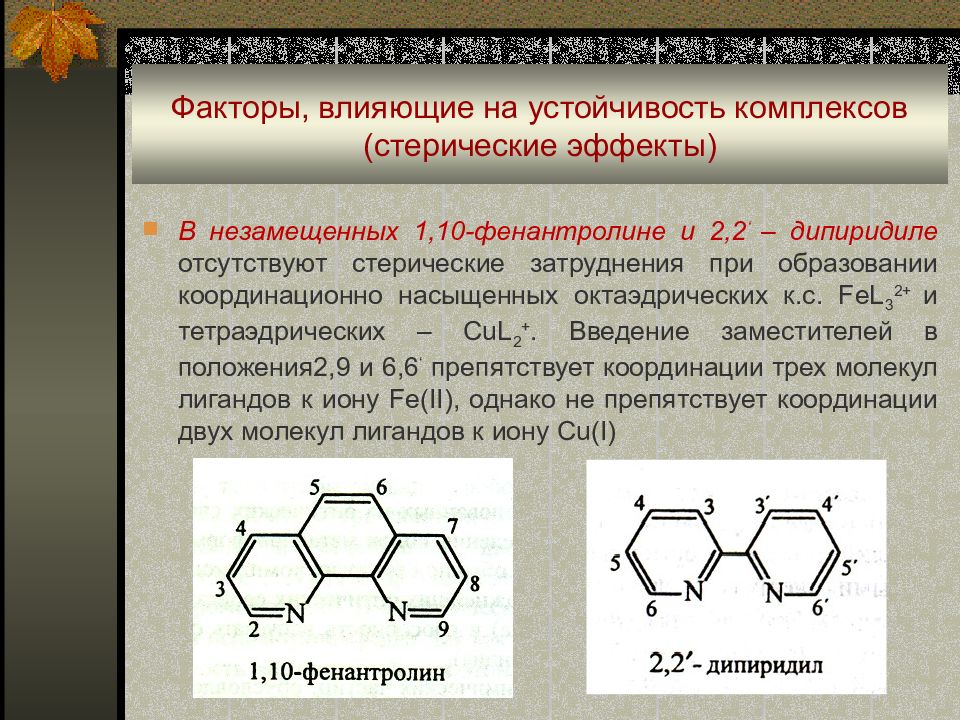
В незамещенных 1,10-фенантролине и 2,2 ‘ – дипиридиле отсутствуют стерические затруднения при образовании координационно насыщенных октаэдрических к.с. FeL 3 2+ и тетраэдрических – CuL 2 +. Введение заместителей в положения2,9 и 6,6 ‘ препятствует координации трех молекул лигандов к иону Fe(II), однако не препятствует координации двух молекул лигандов к иону Cu(I)
Слайд 41: Факторы, влияющие на устойчивость комплексов (стерические эффекты)
Линейный триэтилентетрамин образует с Cu(II) более устойчивый хелат, чем разветвленный, поскольку реализуется более благоприятная плоская квадратная конфигурация в первом случае, а не характерная для Cu(II) тетраэдрическая структура – во втором случае :
Слайд 42: Другие факторы, влияющие на процессы комплексообразования
Влияние концентрации компонентов : M + L ↔ ML; при увеличении концентрации лиганда равновесие смещается вправо ; а ML f ML f ML • ML β т = ———— = β c • ————— = β у • ———————; a M • a L f M •f L f M • M • f L • L Влияние ионной силы раствора : через f i ;
Слайд 43: Другие факторы, влияющие на процессы комплексообразования
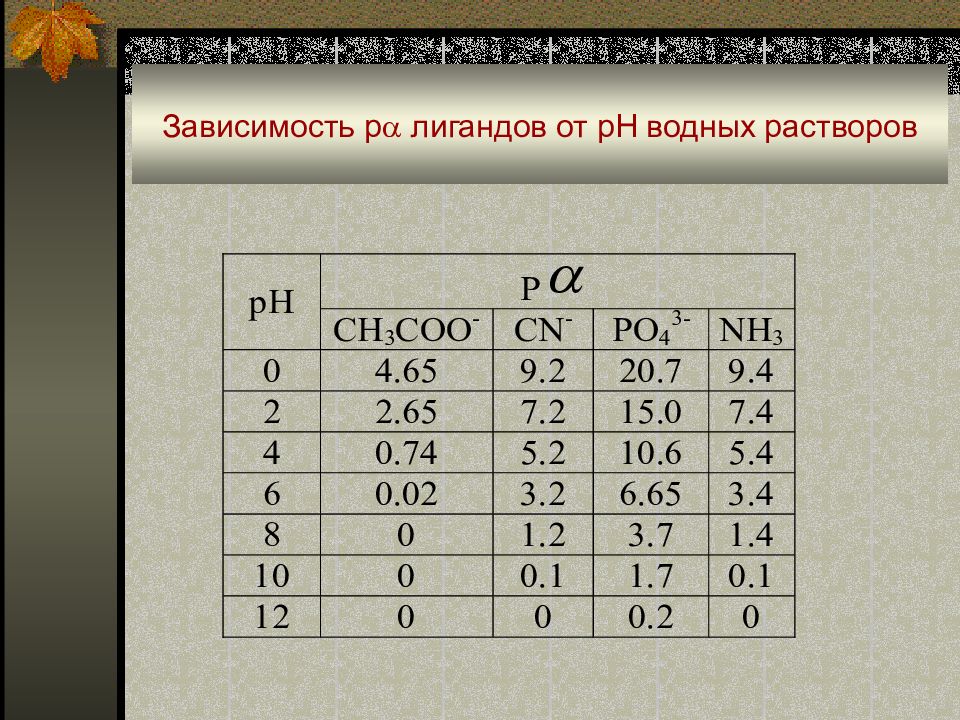
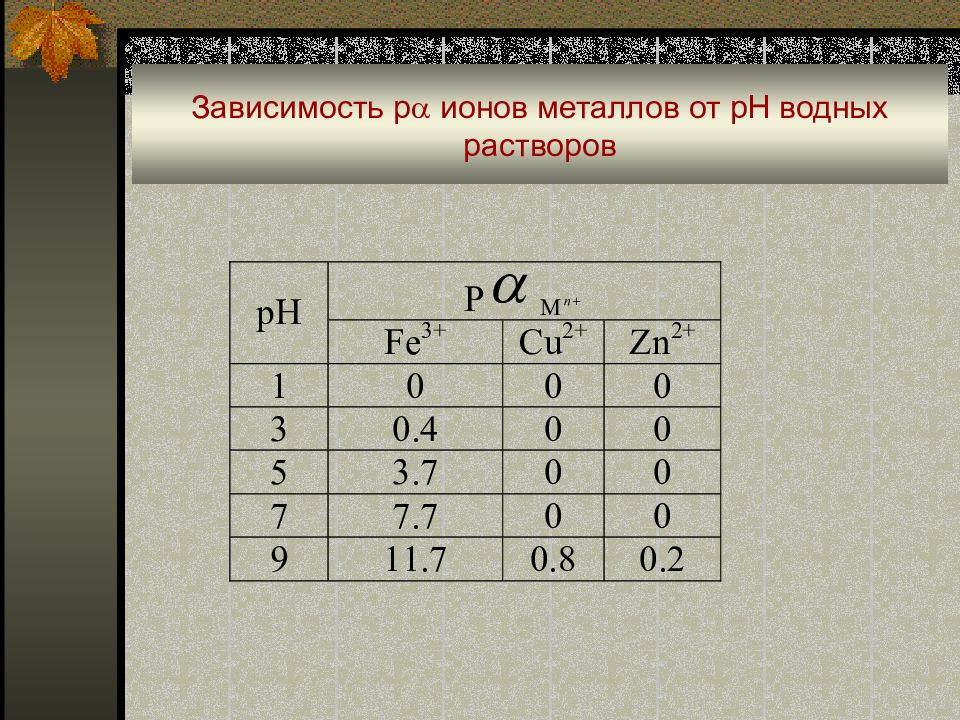
Влияние рН среды : когда в реакциях образования комплексов или конкурирующих реакциях участвуют ионы Н 3 О + или ОН - : M + L ↔ ML; L + Н 3 О + ↔ HL + Н 2 О ; M + ОН - ↔ MOH [Ag(NH 3 ) 2 ] + + CI - + 2 Н 3 О + ↔ AgCI + 2NH 4 + + 2 Н 2 О в кислой среде идет разрушение комплекса
Слайд 48: Равновесия реакций комплексообразования (пример)
Условная константа устойчивости меньше, чем реальная, почти в 10 14 раз: Устойчивость АgF в нейтральном водном растворе и при рН = 3 уменьшается более, чем в два раза: K a (HF) 6,5 •10 -4 F - = ——————— = ————————— = 0,4 [H 3 O] + + K a (HF) 1 •10 -3 + 6,5 •10 -4 β у AgF = β т AgF • F - = 2,29 • 0,4 = 0,91
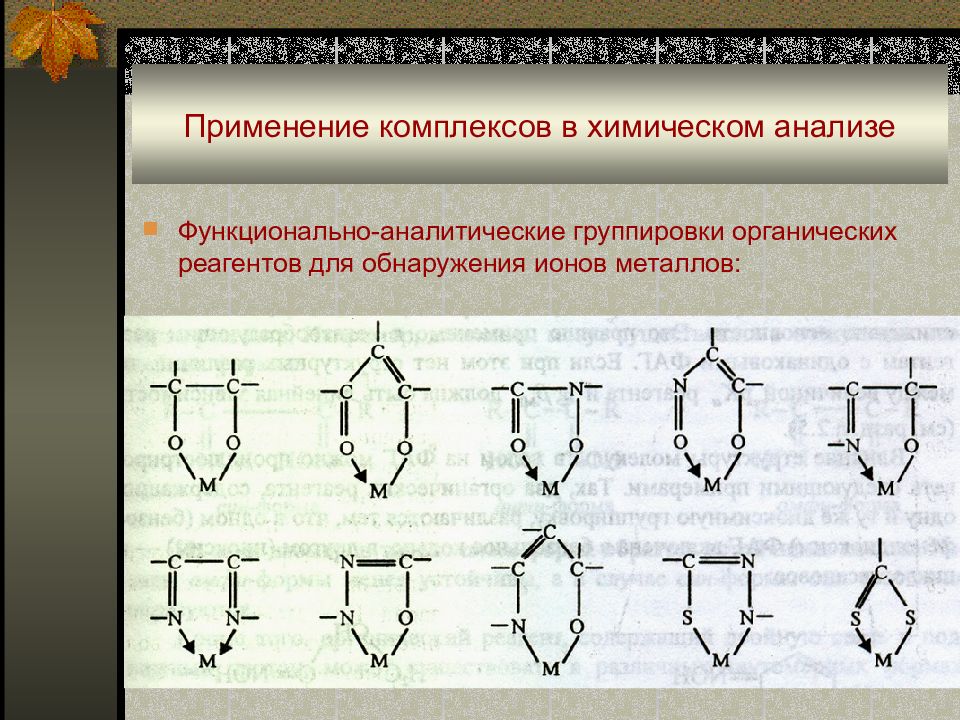
Слайд 49: Применение комплексов в химическом анализе
Функционально-аналитические группировки органических реагентов для обнаружения ионов металлов :
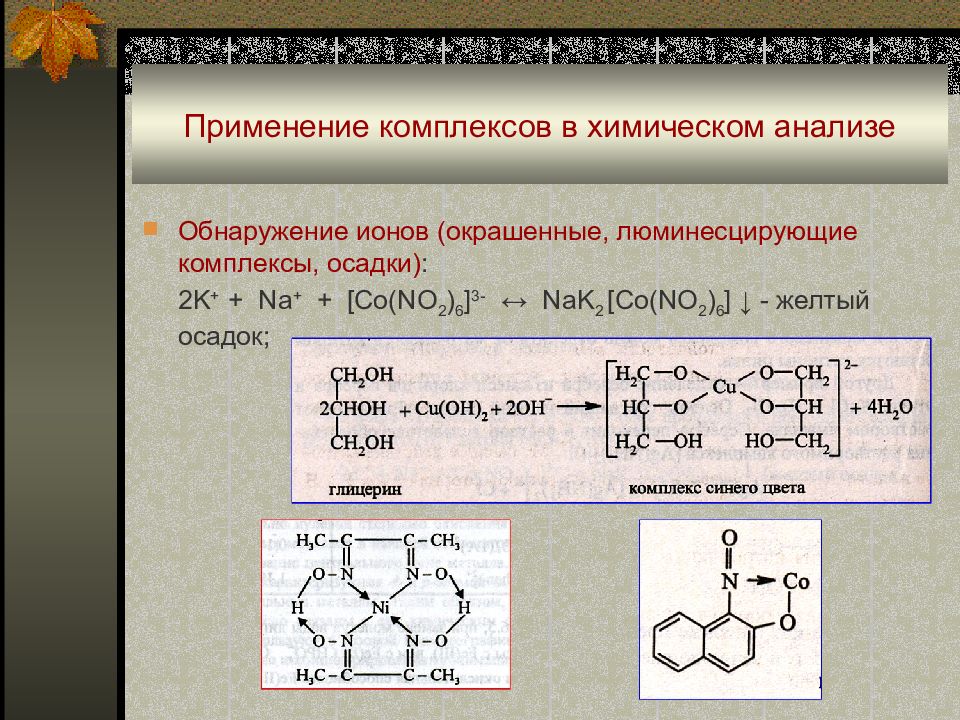
Слайд 50: Применение комплексов в химическом анализе
Обнаружение ионов ( окрашенные, люминесцирующие комплексы, осадки) : 2K + + Na + + [Co(NO 2 ) 6 ] 3- ↔ NaK 2 [Co(NO 2 ) 6 ] ↓ - желтый осадок ;
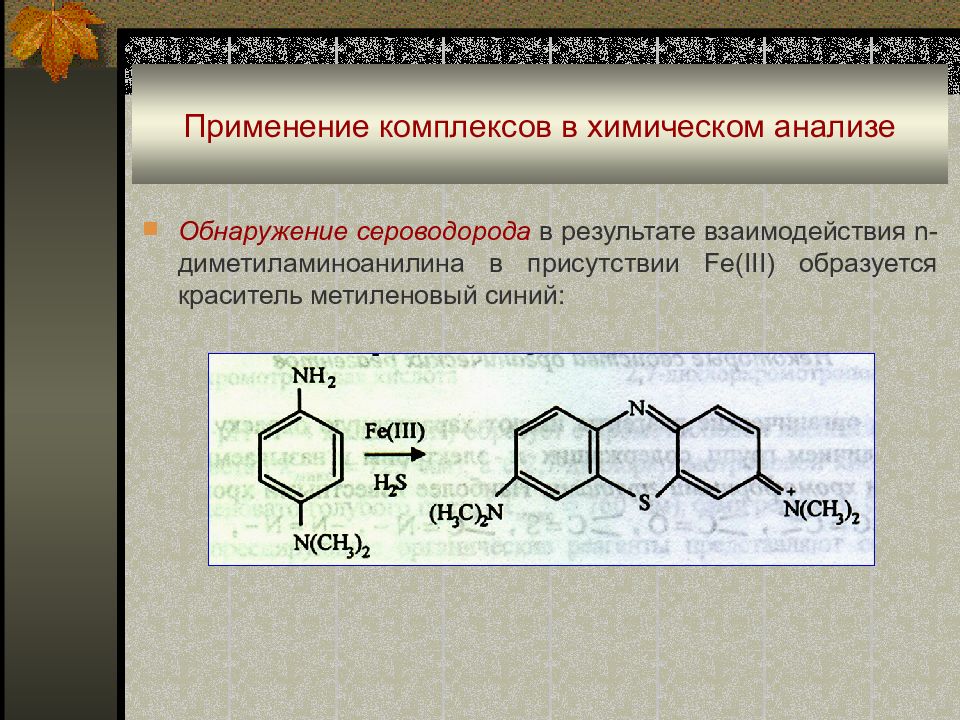
Слайд 51: Применение комплексов в химическом анализе
Обнаружение сероводорода в результате взаимодействия n- диметиламиноанилина в присутствии Fe(III) образуется краситель метиленовый синий :
Слайд 52: Применение комплексов в химическом анализе
Реакция Фуджиравы для обнаружения полигалоидных алифатических соединений ( CHCI 3, CCI 4, С HBr 3 и др.) :
Слайд 53: Применение комплексов в химическом анализе
Маскирование мешающих ионов: Fe 3+ + nSCN - ↔ [Fe(SCN) n ] (3-n) ; Igβ 6 = 3,23; Co 2+ + mSCN - ↔ [Co(SCN) m ] (2-m) ; Igβ 4 = 2,20; Fe 3+ + nF - ↔ [FeF n ] (3-n) ; Igβ 3 = 11,86.
Слайд 54: Применение комплексов в химическом анализе
Изменение величин окислительно-восстановительных потенциалов:
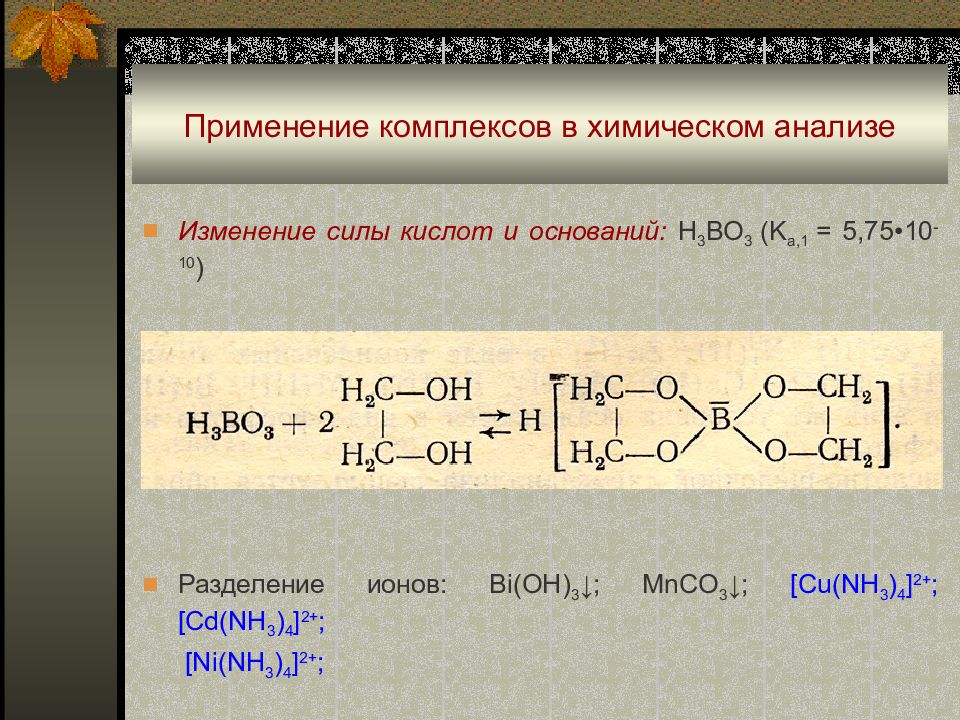
Последний слайд презентации: Комплексные соединения в аналитической химии: Применение комплексов в химическом анализе
Изменение силы кислот и оснований : H 3 BO 3 (K a,1 = 5,75 •10 -10 ) Разделение ионов : Bi(OH) 3 ↓; MnCO 3 ↓; [Cu(NH 3 ) 4 ] 2+ ; [Cd(NH 3 ) 4 ] 2+ ; [Ni(NH 3 ) 4 ] 2+ ;