Первый слайд презентации: Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Слайд 2: Основные вопросы темы:
Современные представления о строении и свойствах комплексных соединений. Биологическая роль и применение в медицине комплексных соединений.
Слайд 3
Реагенты в химии Катализаторы Лекарственные препараты Витамины Хлорофилл Гемоглобин И др.
Чугаев Л.А. Комплексные соединения (КС) – это продукт сочетания простых соединений, способных к самостоятельному существованию
Слайд 5: Примеры реакций комплексообразования
HgI 2 + 2KI = K 2 [HgI 4 ] KF + BF 3 = K[BF 4 ] Al(OH) 3 + NaOH = Na[Al(OH) 4 ] AgCl + 2NH 3 = [Ag( NH 3 ) 2 ]Cl
Слайд 6
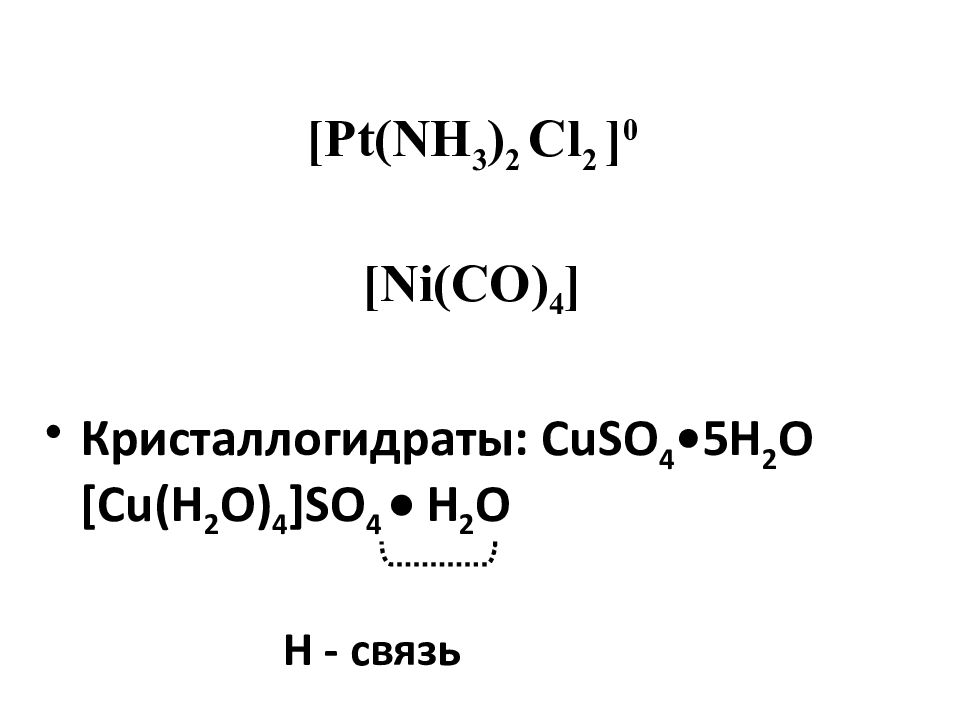
Кристаллогидраты: CuSO 4 •5H 2 O [Cu(H 2 O) 4 ]SO 4 Н 2 О Н - связь [Pt(NH 3 ) 2 Cl 2 ] 0 [Ni(CO) 4 ]
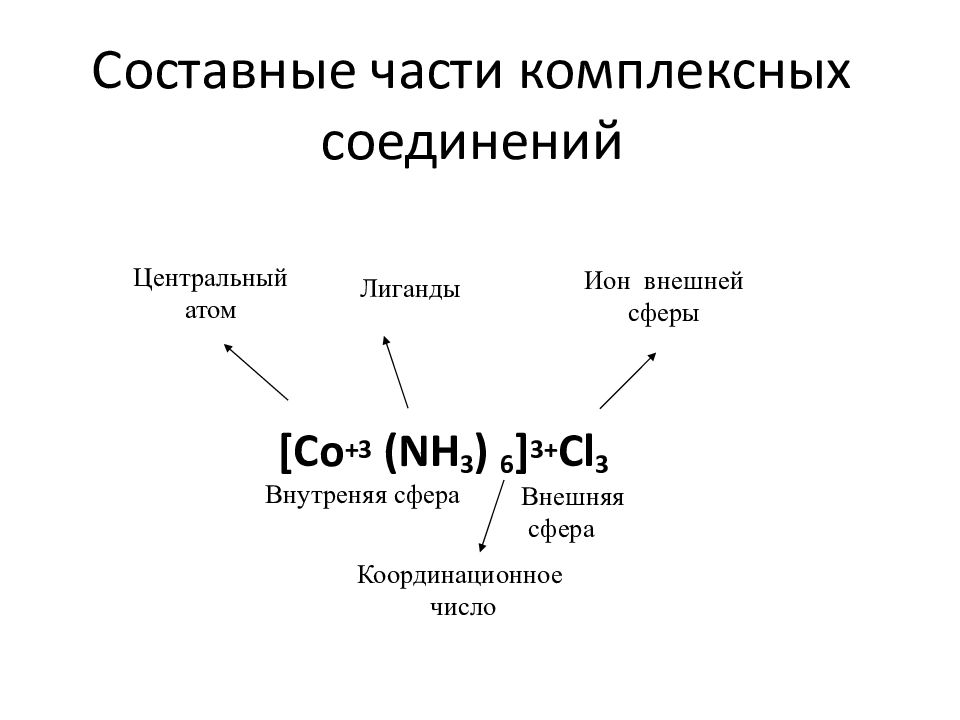
Слайд 8: Составные части комплексных соединений
[ Co +3 (NH 3 ) 6 ] 3+ Cl 3 Центральный атом Лиганды Ион внешней сферы Внутреняя сфера Внешняя сфера Координационное число
Слайд 9: Характеристика центрального атома
Комплексообразующая способность элементов f > d > p > s Инертные газы также могут выступать в качестве комплексообразователя: Cs [XeF 7 ]
Слайд 10: Важнейшие характеристики центрального атома :
Степень окисления Координационное число Ионный потенциал
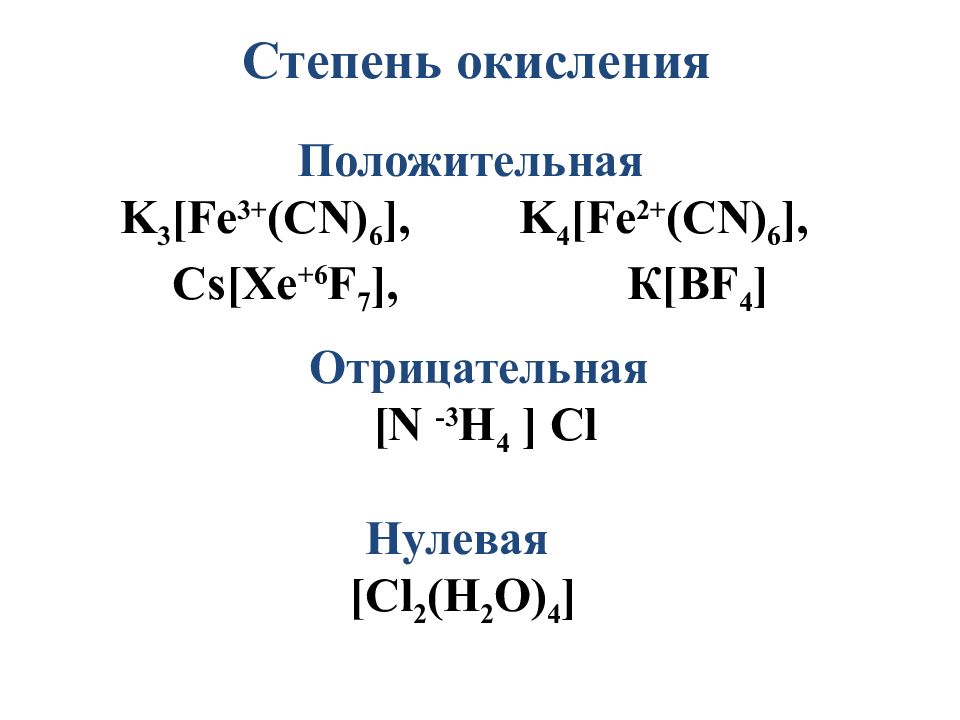
Слайд 11
Степень окисления Положительная K 3 [Fe 3+ (CN) 6 ], K 4 [Fe 2 + (CN) 6 ], Cs[Xe +6 F 7 ], К[ BF 4 ] Отрицательная [N -3 H 4 ] Cl Нулевая [ Cl 2 (H 2 O) 4 ]
Слайд 12: Координационное число ( КЧ )
Это число атомов или групп атомов, непосредственно связанных с центральным атомом
Слайд 13: от размеров центрального атома и лигандов
Лат. liganda -то, что должно быть связано КЧ зависит:
Слайд 14: Na[BF 4 ] Na 3 [AlF 6 ]
F F F F F F F F F F F - F - F - F - B 3+ F - F - F - F - F - F - Al 3+ r B 3+ = 0,02 нм r Al 3+ = 0,057 нм
Слайд 15: Na 3 [AlF 6 ] Na [AlCl 4 ]
F F F F F F l l l l F - Al 3+ Cl - F - F - F - F - F - Cl - Cl - Cl - Al 3+ r F _ = 0,133 нм r Cl - = 0,181 нм
Слайд 16: от степени окисления центрального атома:
Степень окисления ц.а. КЧ (подчеркнуто характерное ) Примеры +1 2, 3 [ Ag(NH 3 ) 2 ] Cl +2 3, 4, 6 [ Cu(NH 3 ) 4 ] Cl 2 +3 4, 5, 6 Na 3 [Co(NO 2 ) 6 ] +4 6, 8 H 2 [SnCl 6 ]
Слайд 17
чаще всего кч устойчивого комплекса в два раза больше степени окисления ц.а. КЧ = 2 Z Эмпирическое правило:
Слайд 18: Al(OH) 3 + NaOH= Na[Al(OH) 4 ]
Al(OH) 3 +3 NaOH= Na 3 [Al(OH) 6 ] - концентрации исходных компонентов :
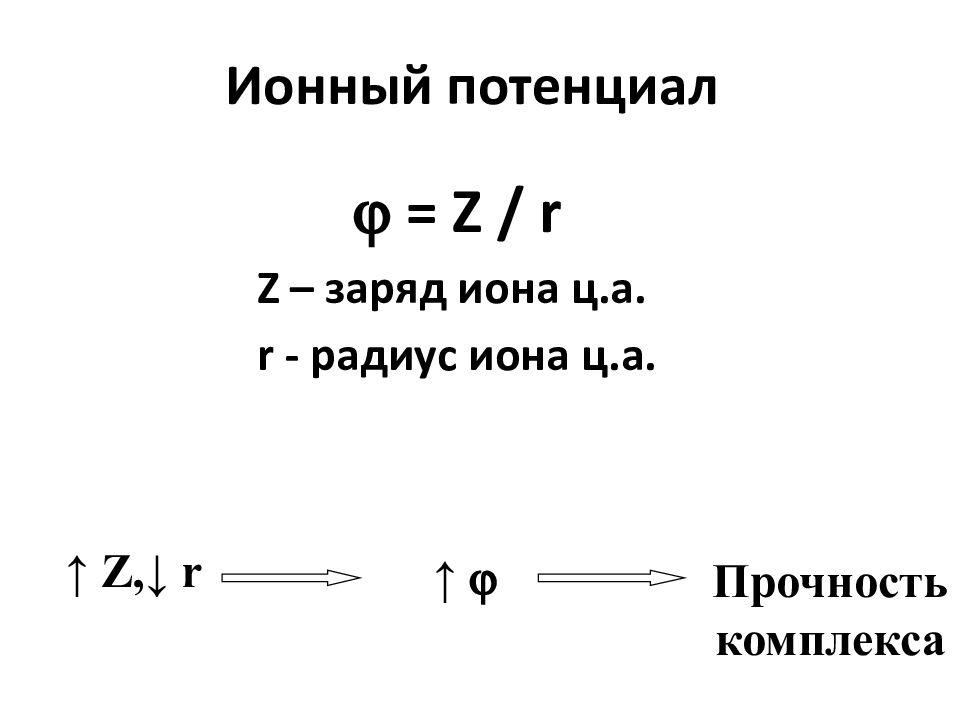
Слайд 19: Ионный потенциал
= Z / r Z – заряд иона ц.а. r - радиус иона ц.а. ↑ Z, ↓ r ↑ Прочность комплекса
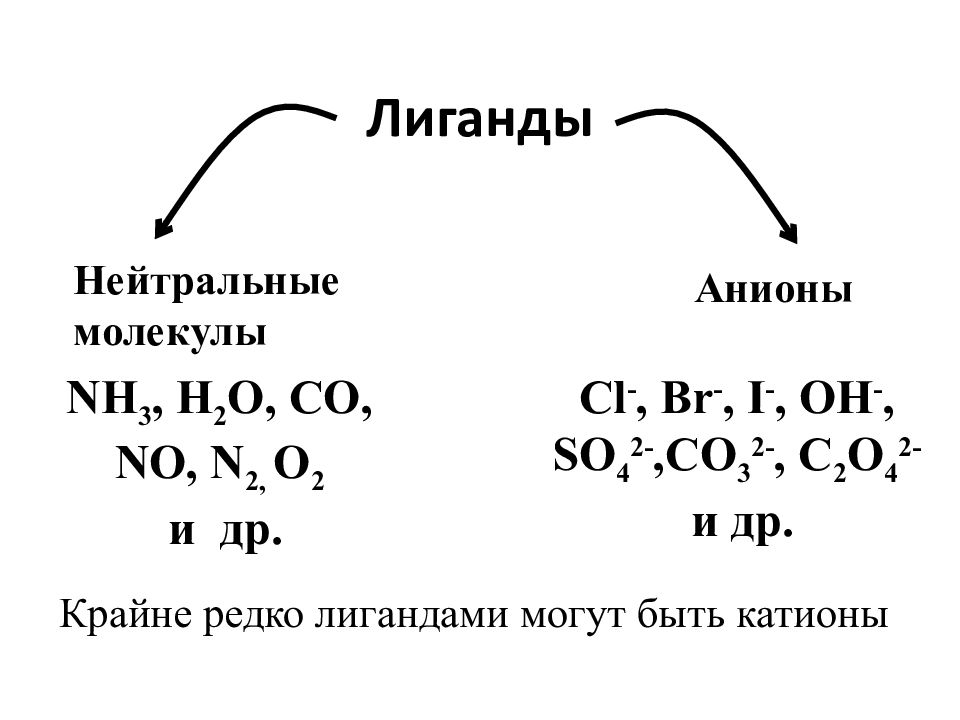
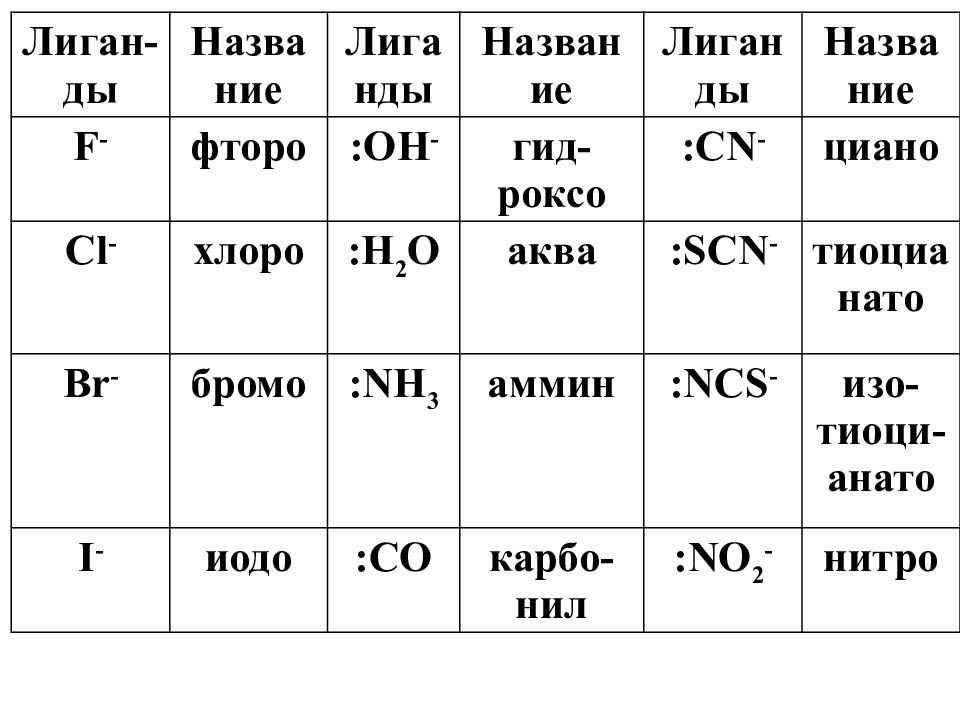
Слайд 21: Лиганды
NH 3, H 2 O, CO, NO, N 2, O 2 и др. Cl -, Br -, I -, OH -, SO 4 2-,CO 3 2-, C 2 O 4 2- и др. Крайне редко лигандами могут быть катионы Нейтральные молекулы Анионы
Слайд 22: монодентатные лиганды, содержат 1 донорный атом ( H 2 O, N H 3, O H -, Cl -, Br - )
Число донорных атомов в лиганде характеризует его координационную ёмкость – дентатность Лат. dentalus – имеющий зубы
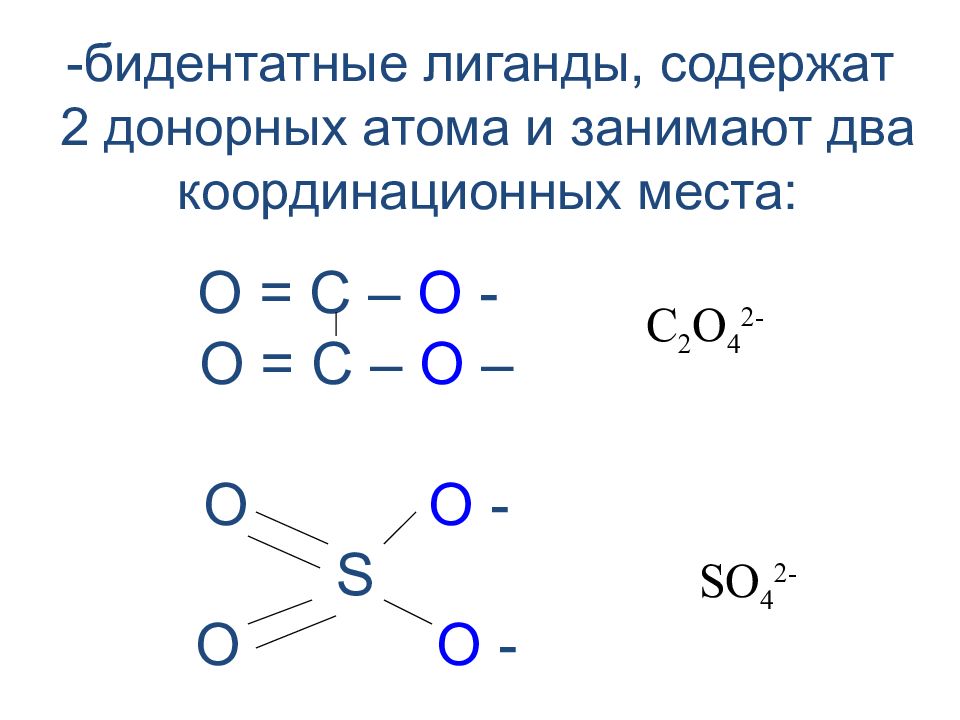
Слайд 23
-бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места: О = С – О - О = С – О – O O - S O O - С 2 О 4 2- S О 4 2-
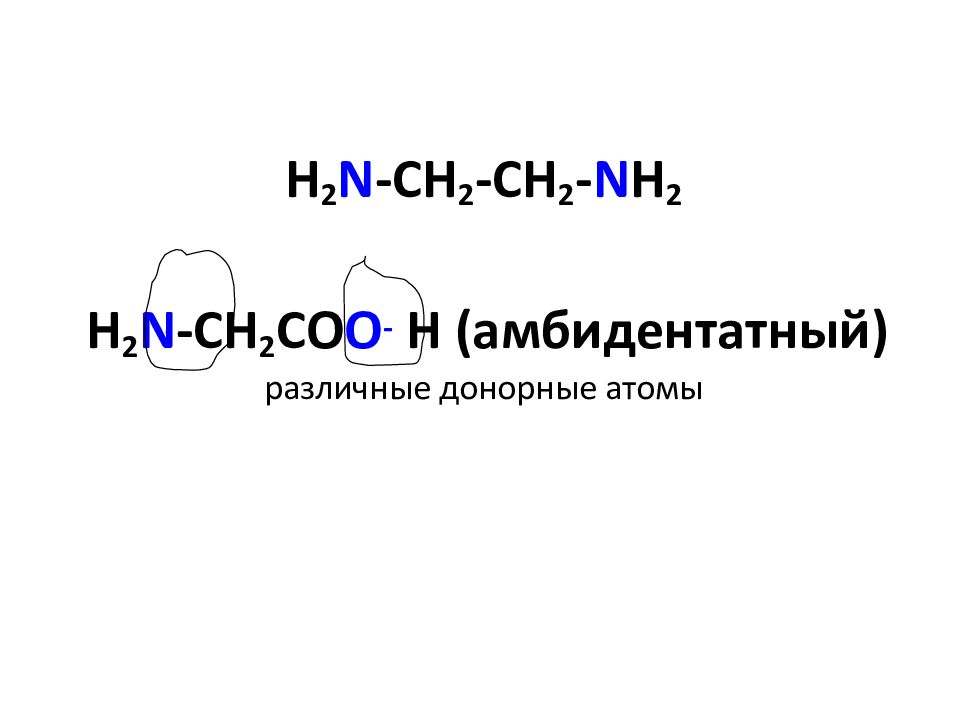
Слайд 24: H 2 N -CH 2 -CH 2 - N H 2 H 2 N -CH 2 CO O - H ( амбидентатный ) различные донорные атомы
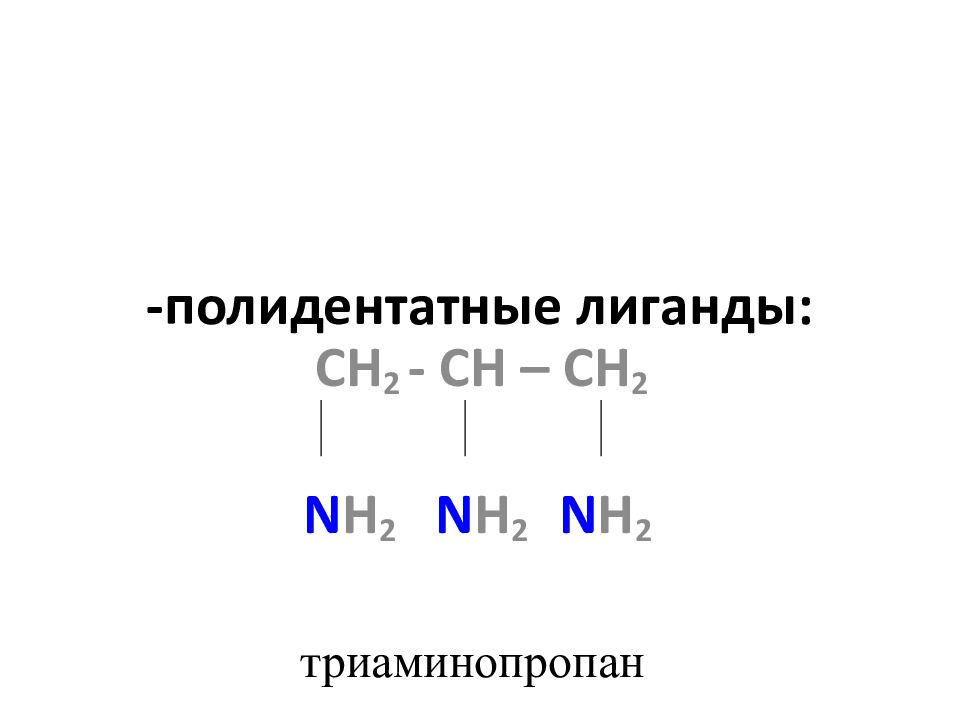
Слайд 25: полидентатные лиганды:
СН 2 - С H – CH 2 N H 2 N H 2 N H 2 триаминопропан
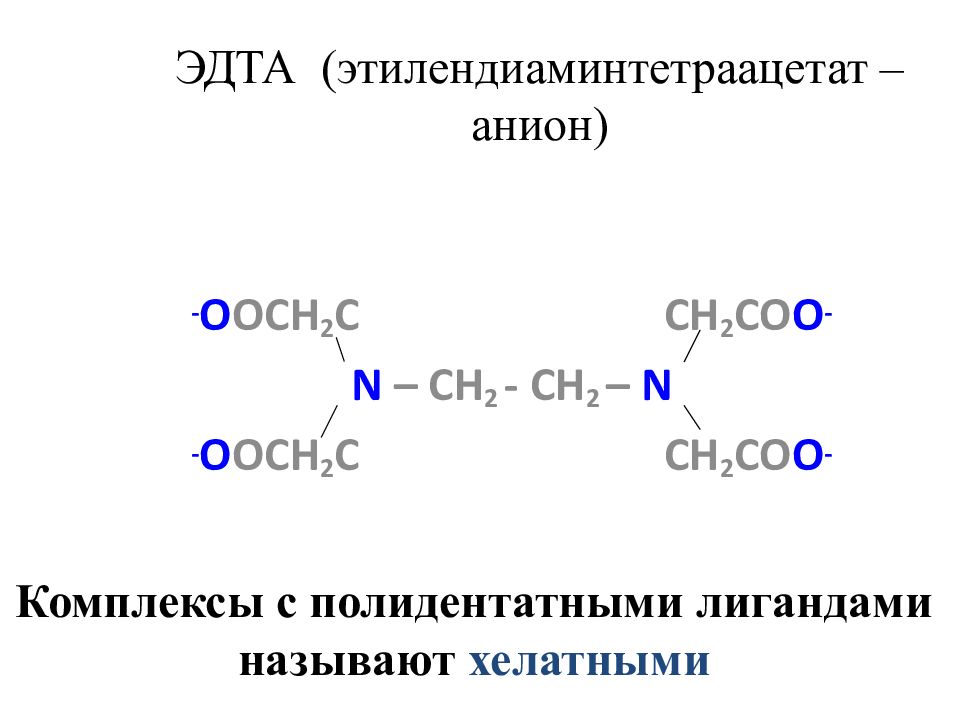
Слайд 26: ЭДТА (этилендиаминтетраацетат –анион)
- O OCH 2 C CH 2 CO O - N – CH 2 - CH 2 – N - O OCH 2 C CH 2 CO O - Комплексы с полидентатными лигандами называют хелатными
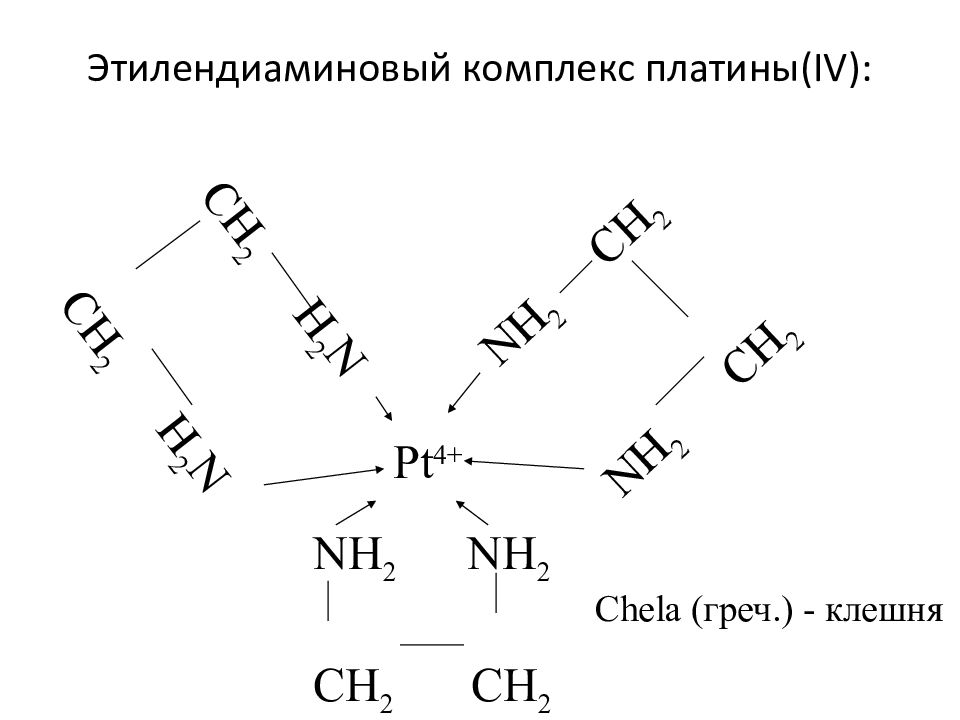
Слайд 27: Этилендиаминовый комплекс платины( IV) :
Pt 4+ NH 2 NH 2 CH 2 CH 2 NH 2 CH 2 NH 2 CH 2 CH 2 H 2 N CH 2 H 2 N Chela (греч.) - клешня
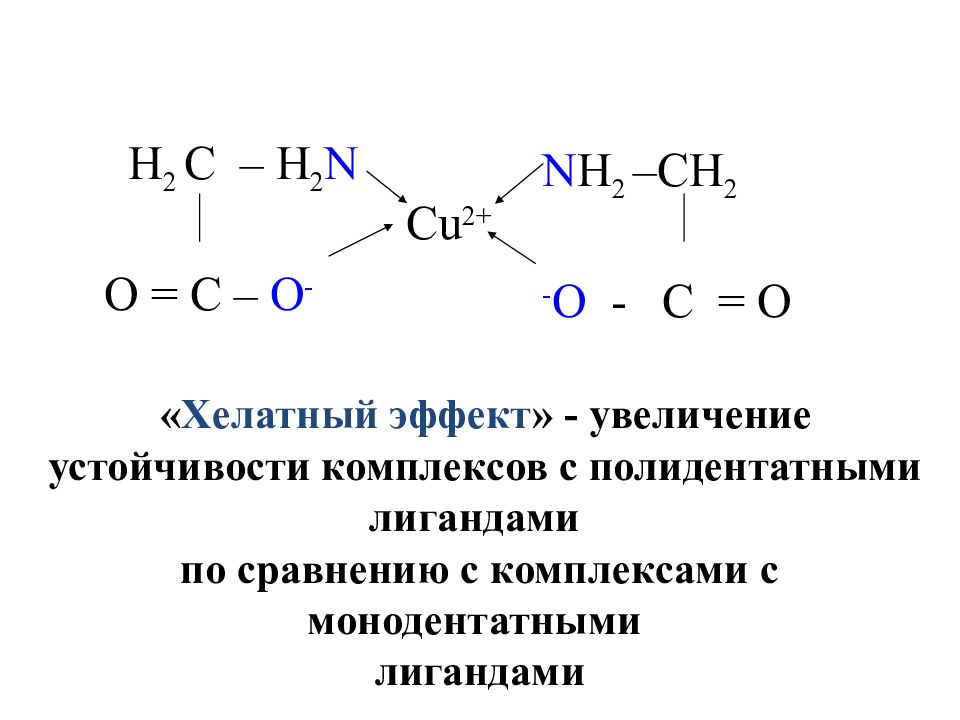
Слайд 28
Cu 2+ N H 2 –CH 2 - O - C = O H 2 C – H 2 N O = C – O - « Хелатный эффект » - увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
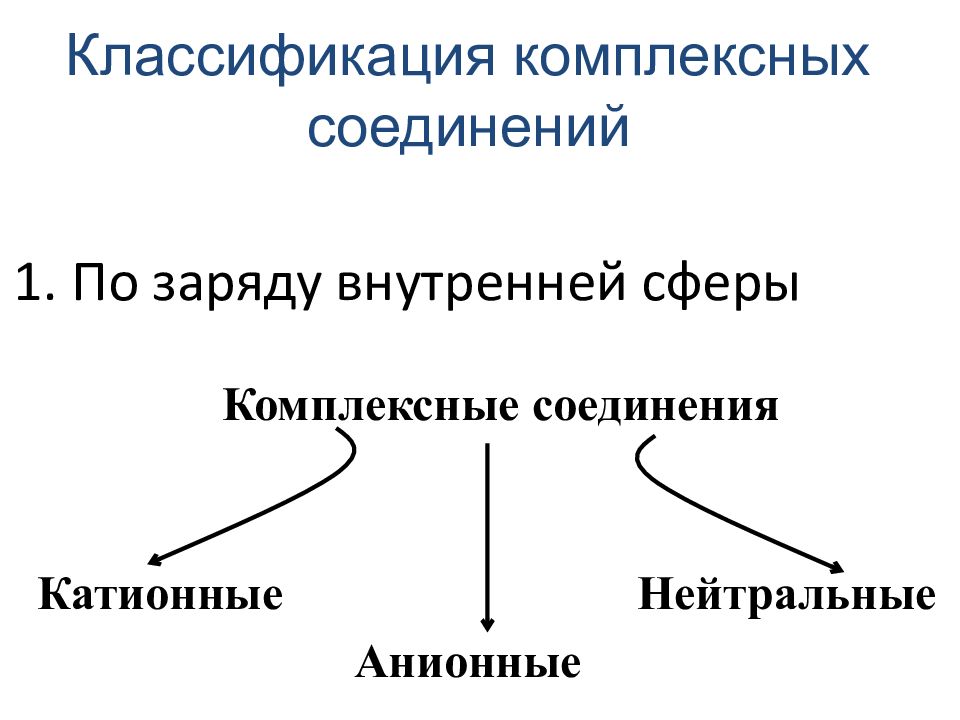
Слайд 29: 1. По заряду внутренней сферы
Классификация комплексных соединений Нейтральные Комплексные соединения Катионные Анионные
Слайд 30: [ Cu(NH 3 ) 4 ] SO 4 Na 3 [ Co(NO 2 ) 6 ] [ Co(NH 3 ) 4 Cl 2 ] Cl [ Pt(NH 3 ) 2 Cl 2 ] [ Fe(CO) 5 ] K 3 [ Fe(CN) 6 ]
2+ 3- + 0 0 3-
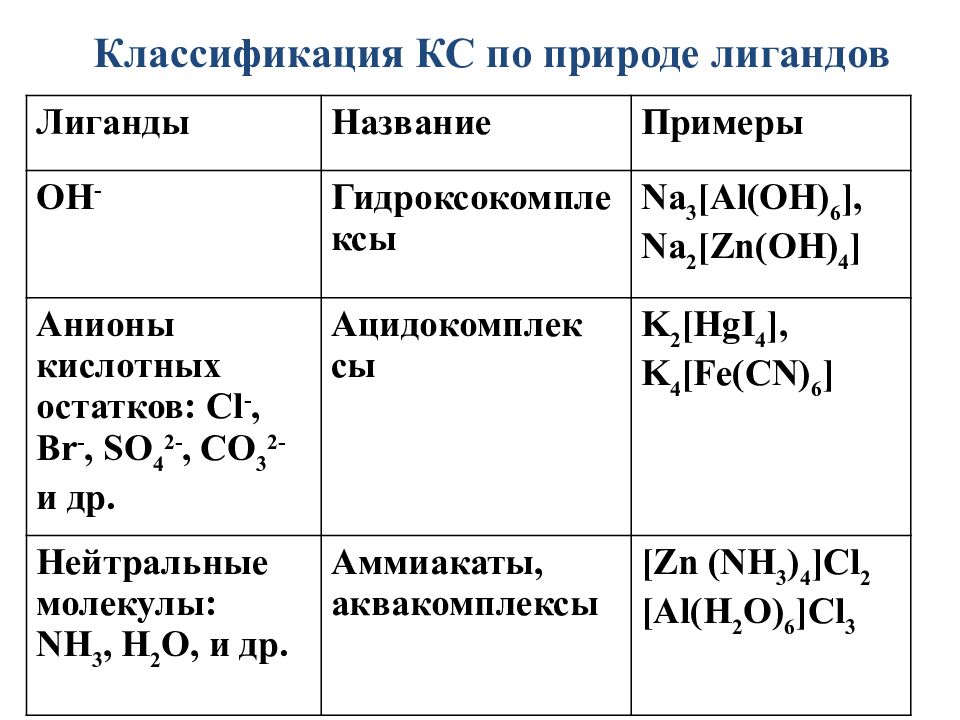
Слайд 31: 2. По природе лиганда:
Гидроксокомплексы ( ОН - ) Аквакомплексы (Н 2 О) Аммиакатные комплексы ( NH 3 ) Ацидокомплексы ( CN - - циано, CNS — тиоциано, NO 2 - - нитро, С l - - хлоро, SO 4 2– сульфато и т. д.) Карбонильные (СО) И др.
Слайд 32
Лиганды Название Примеры OH - Гидроксокомплексы Na 3 [Al(OH) 6 ], Na 2 [Zn(OH) 4 ] Анионы кислотных остатков: Cl -, Br -, SO 4 2-, CO 3 2- и др. Ацидокомплек сы K 2 [HgI 4 ], K 4 [Fe(CN) 6 ] Нейтральные молекулы: NH 3, H 2 O, и др. Аммиакаты, аквакомплексы [ Zn ( NH 3 ) 4 ] Cl 2 [Al(H 2 O) 6 ]Cl 3 Классификация КС по природе лигандов
Слайд 33: 3. По способности ионизировать:
Электролиты [ Cu(NH 3 ) 4 ] SO 4 Неэлектролиты [ Pt (NH 3 ) 2 Cl 2 ] 4. По свойствам электролита: Кислоты Н [ AuCl 4 ] Основания [ Cu (Н 2 О) 4 ](ОН) 2 Соли [ Ag(NH 3 ) 2 ] Cl
Слайд 35
Лиган-ды Название Лиганды Название Лиганды Название F - фторо : OH - гид- роксо :CN - циано Cl - хлоро : H 2 O аква : SCN - тиоцианато Br - бромо : NH 3 аммин : NCS - изо- тиоци - анато I - иодо : CO карбо- нил : NO 2 - нитро
Слайд 36
[ Cu(NH 3 ) 4 ] SO 4 [Cr (NH 3 ) 3 (H 2 O) 2 Cl ] Br 2 Бромид хлородиакватриамминхрома ( III) Na 3 [ Co(NO 2 ) 6 ] ГГ ексанитрокобальтат ( III) натрия [ Pt (NH 3 ) 2 Cl 2 ] Сульфат тетраамминмеди ( II) Гексанитрокобальтат (Ш) натрия Дихлородиамминплатина
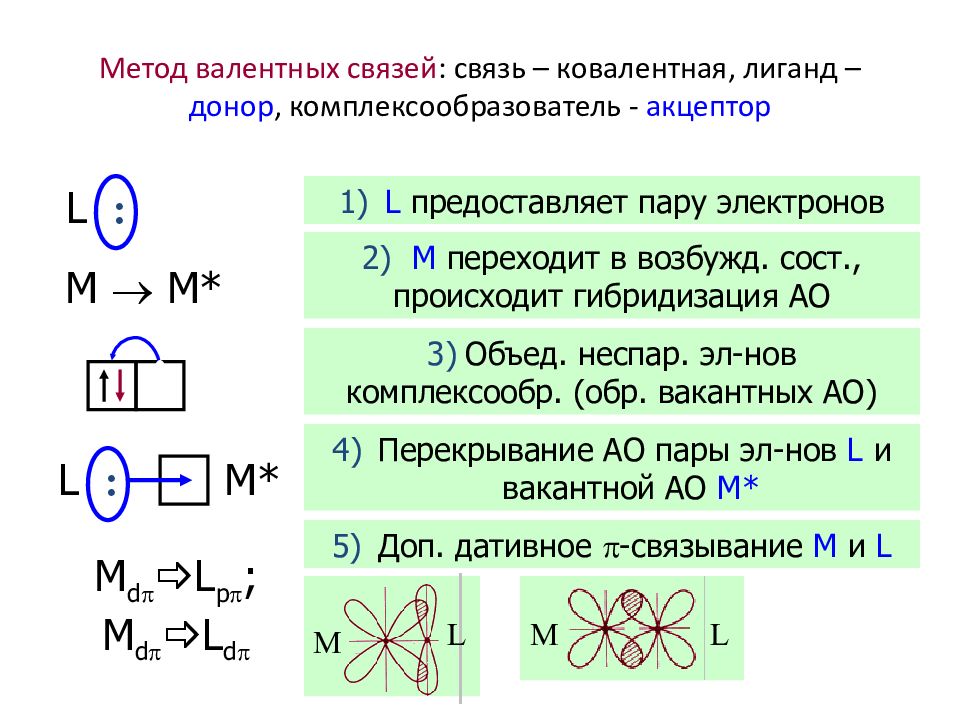
Слайд 38: Метод валентных связей : связь – ковалентная, лиганд – донор, комплексообразователь - акцептор
L : M M* L : M * M d L p ; M d L d 1) L предоставляет пару электронов 2) M переходит в возбужд. сост., происходит гибридизация АО 3) Объед. неспар. эл-нов комплексообр. (обр. вакантных АО) 4) Перекрывание АО пары эл-нов L и вакантной АО M* 5) Доп. дативное - связывание M и L M L L M
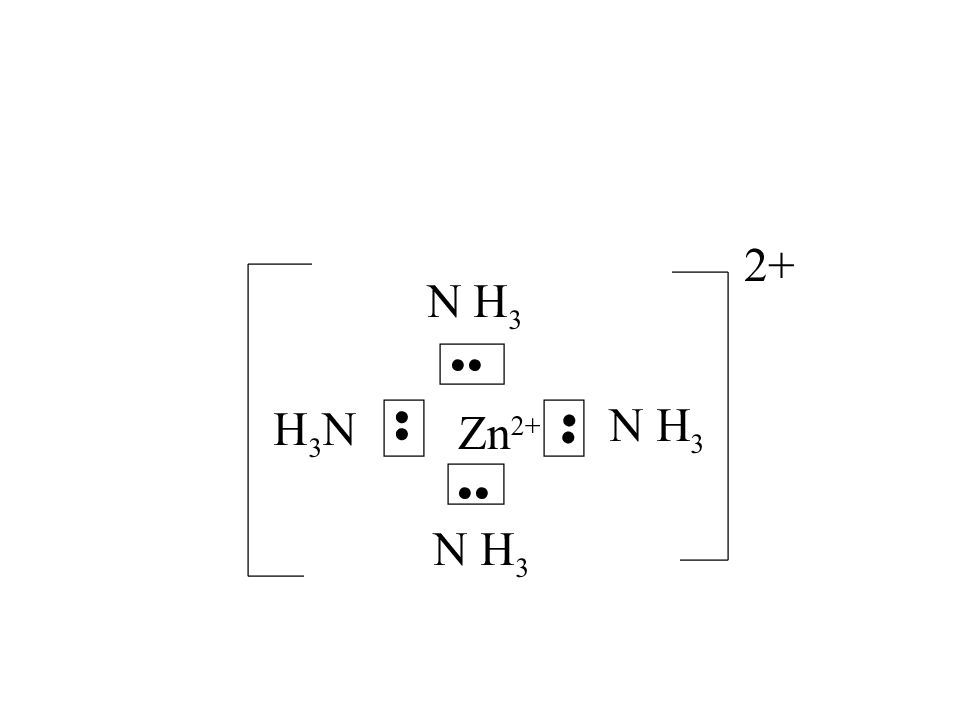
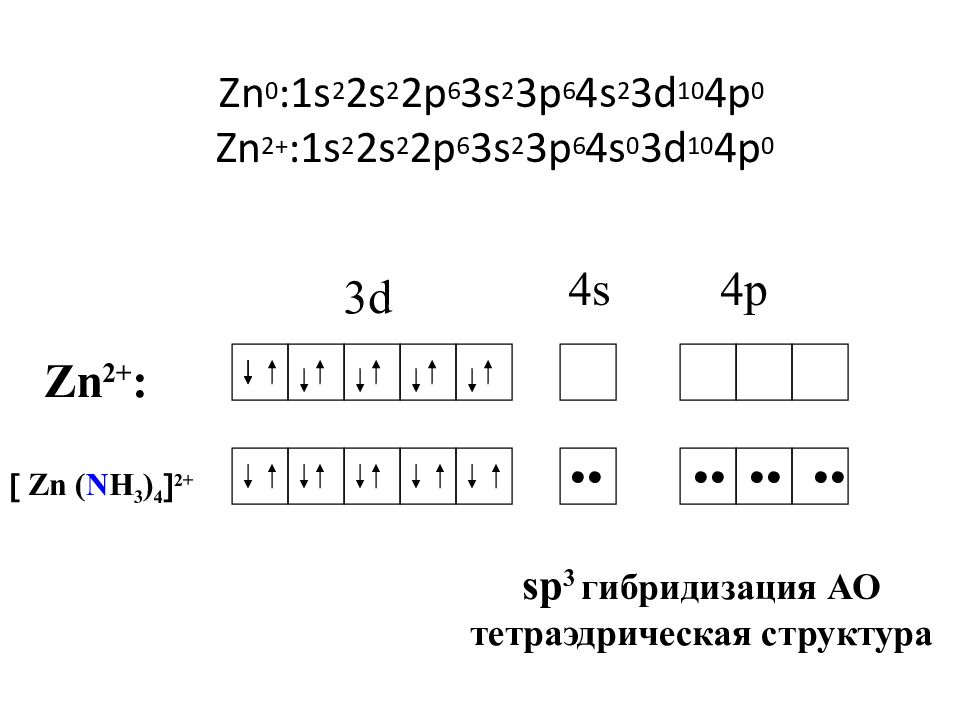
Слайд 41: Zn 0 :1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 0 Zn 2+ :1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 10 4p 0
3d 4s 4p Zn 2+ : •• •• •• •• Zn ( N H 3 ) 4 2+ sp 3 гибридизация АО тетраэдрическая структура
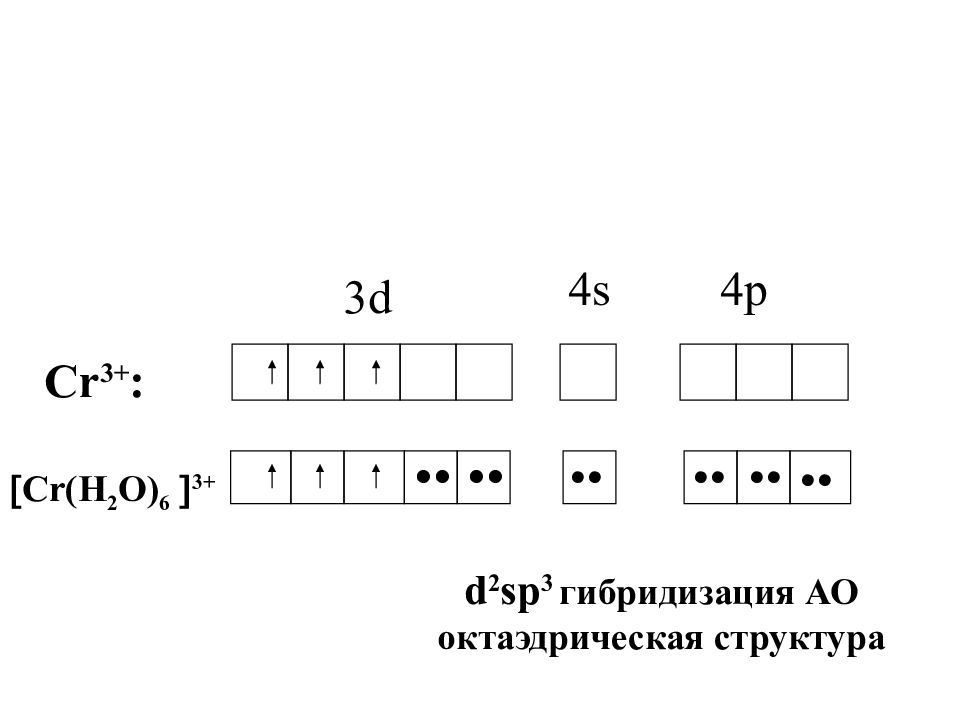
Слайд 42
3d 4s 4p Cr 3+ : •• •• •• •• Cr (H 2 O) 6 3+ •• •• d 2 sp 3 гибридизация АО октаэдрическая структура
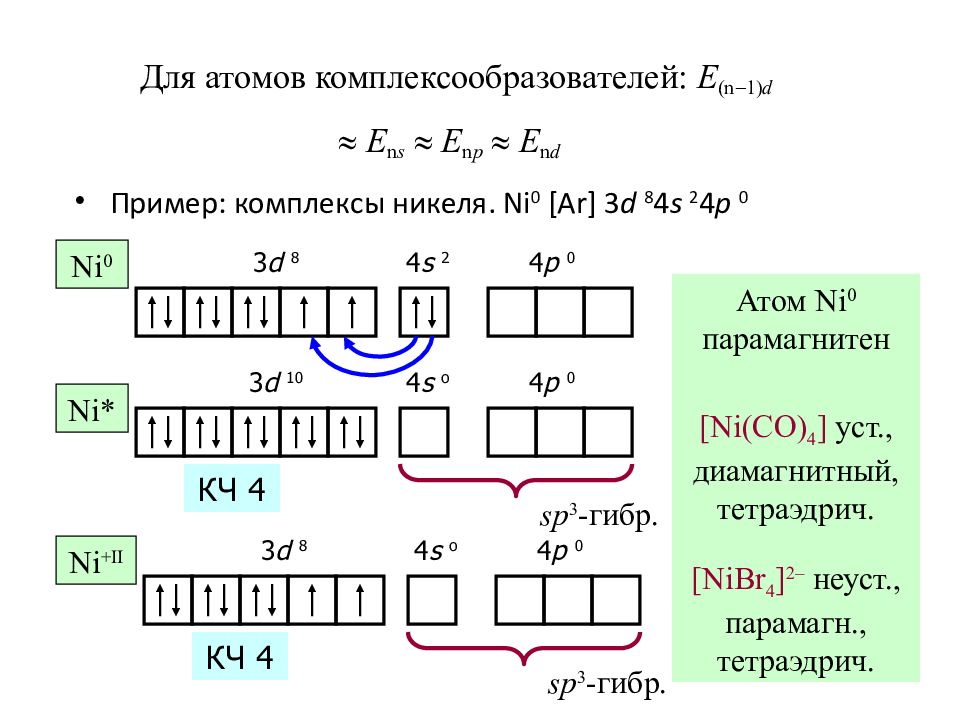
Слайд 43: Для атомов комплексообразователей: E (n - 1) d » E n s » E n p » E n d
Пример : комплексы никеля. Ni 0 [Ar] 3 d 8 4 s 2 4 p 0 3 d 8 4 s 2 4 p 0 Атом Ni 0 парамагнитен Ni 0 Ni* 3 d 10 4 s o 4 p 0 sp 3 - гибр. [Ni(CO) 4 ] уст., диамагнитный, тетраэдрич. 3 d 8 4 s o 4 p 0 Ni + II sp 3 - гибр. [NiBr 4 ] 2 – неуст., парамагн., тетраэдрич. КЧ 4 КЧ 4
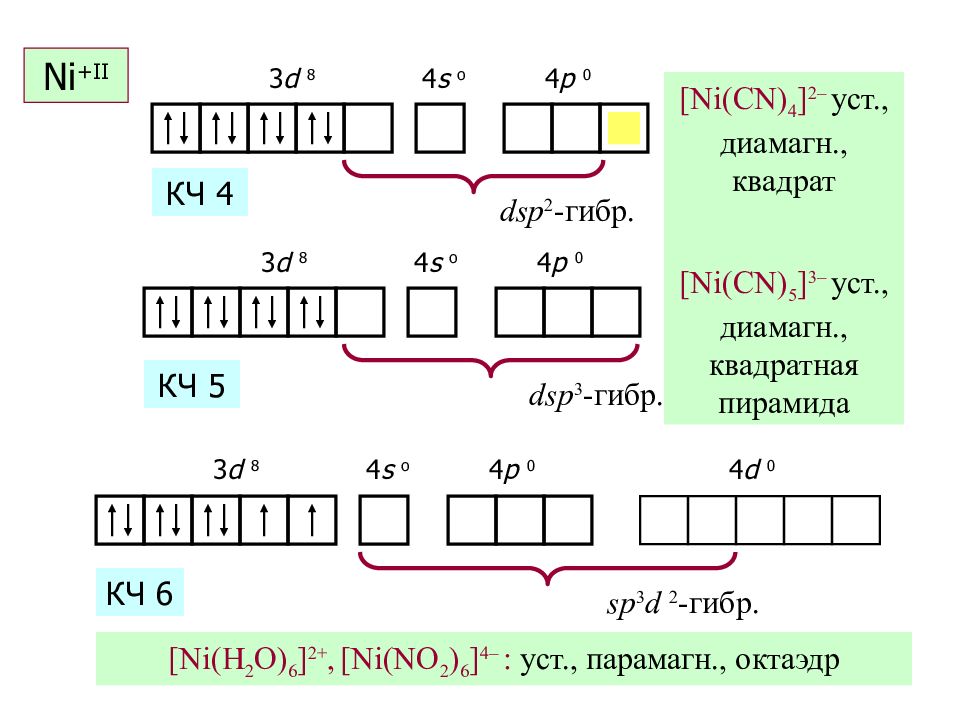
Слайд 44: Ni + II
3 d 8 4 s o 4 p 0 Ni + II dsp 2 - гибр. [Ni(CN) 4 ] 2 – уст., диамагн., квадрат КЧ 4 3 d 8 4 s o 4 p 0 dsp 3 - гибр. [Ni(CN) 5 ] 3 – уст., диамагн., квадратная пирамида КЧ 5 3 d 8 4 s o 4 p 0 sp 3 d 2 - гибр. [Ni(H 2 O) 6 ] 2 +, [Ni(NO 2 ) 6 ] 4 – : уст., парамагн., октаэдр КЧ 6 4 d 0 Ni + II
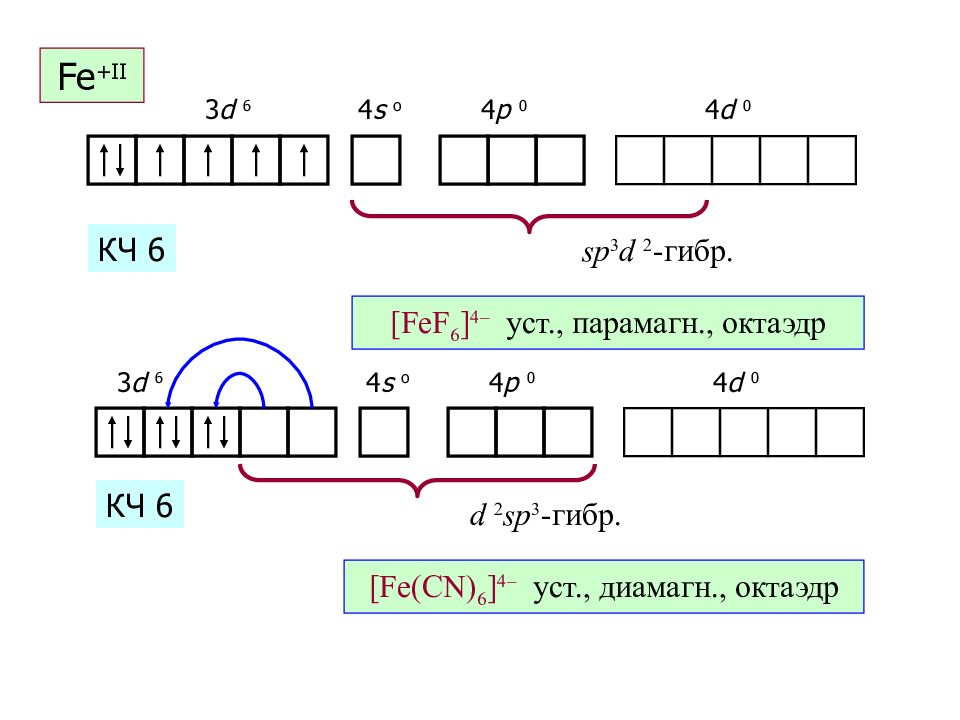
Слайд 45: Fe + II
sp 3 d 2 - гибр. [FeF 6 ] 4 – уст., парамагн., октаэдр КЧ 6 3 d 6 4 s o 4 p 0 4 d 0 Fe + II d 2 sp 3 - гибр. [Fe(CN) 6 ] 4 – уст., диамагн., октаэдр КЧ 6 3 d 6 4 s o 4 p 0 4 d 0
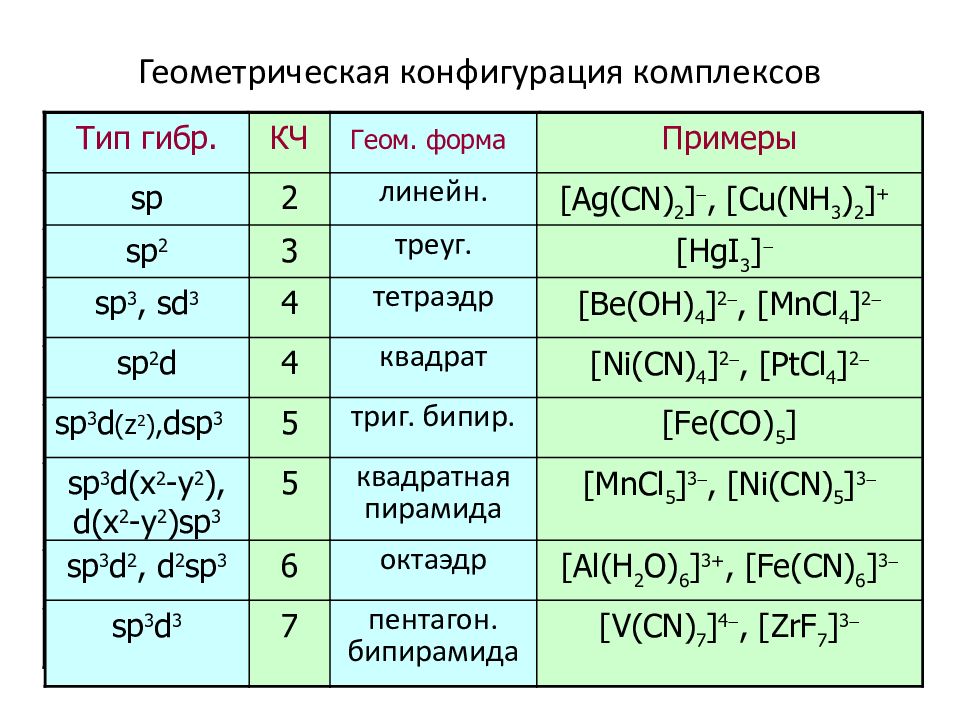
Слайд 46: Геометрическая конфигурация комплексов
Тип гибр. КЧ Геом. форма Примеры sp 2 л инейн. [ Ag ( CN ) 2 ] -, [ Cu ( NH 3 ) 2 ] + sp 2 3 т реуг. [HgI 3 ] - s p 3, sd 3 4 тетраэдр [Be(OH) 4 ] 2 -, [MnCl 4 ] 2 - sp 2 d 4 квадрат [ Ni ( CN ) 4 ] 2 -, [ PtCl 4 ] 2 - sp 3 d (z 2 ), dsp 3 5 т риг. бипир. [Fe(CO) 5 ] sp 3 d(x 2 - y 2 ), d(x 2 - y 2 )sp 3 5 квадратная пирамида [ MnCl 5 ] 3 -, [ Ni ( CN ) 5 ] 3 - sp 3 d 2, d 2 sp 3 6 октаэдр [Al(H 2 O) 6 ] 3+, [Fe(CN) 6 ] 3 - sp 3 d 3 7 п ентагон. бипирамида [V(CN) 7 ] 4 -, [ZrF 7 ] 3 -
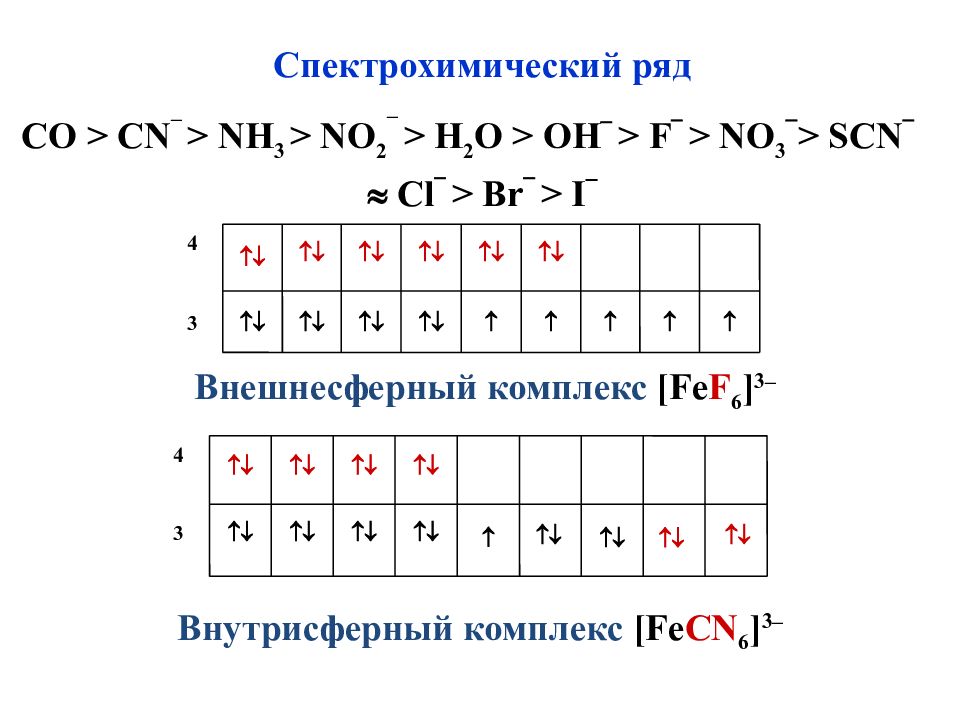
Слайд 47
3 4 Спектрохимический ряд С O > CN – > NH 3 > NO 2 – > H 2 O > OH > F > N О 3 > SCN Cl > Br > I Внешнесферный комплекс [ Fe F 6 ] 3– 3 4 Внутрисферный комплекс [ Fe CN 6 ] 3–
Слайд 48
ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ Лиганды – точечные заряды (кристаллическое поле). Связь между лиогандами и ценртральным атомом чисто ионная. Вырожденный d -подуровень центрального атома под действием поля лигандов расщепляется в соответствии с симметрией окружения.
Слайд 49: В случае [ML 6 ] ±,0 : октаэдрическое поле лигандов
Поле слабо влияет (энергия падает) в случае АО d(xy), d(xz) и d(yz), располож. между осей координат (между лигандами) Поле сильно влияет (энергия растет) в случае АО d(z 2 ) и d(x 2 – y 2 ), располож. вдоль осей координат (ближе всего к лигандам) d -АО E о d d – параметр расщепления | E – E о | = 3/5 ; | E – E о | = 2/5
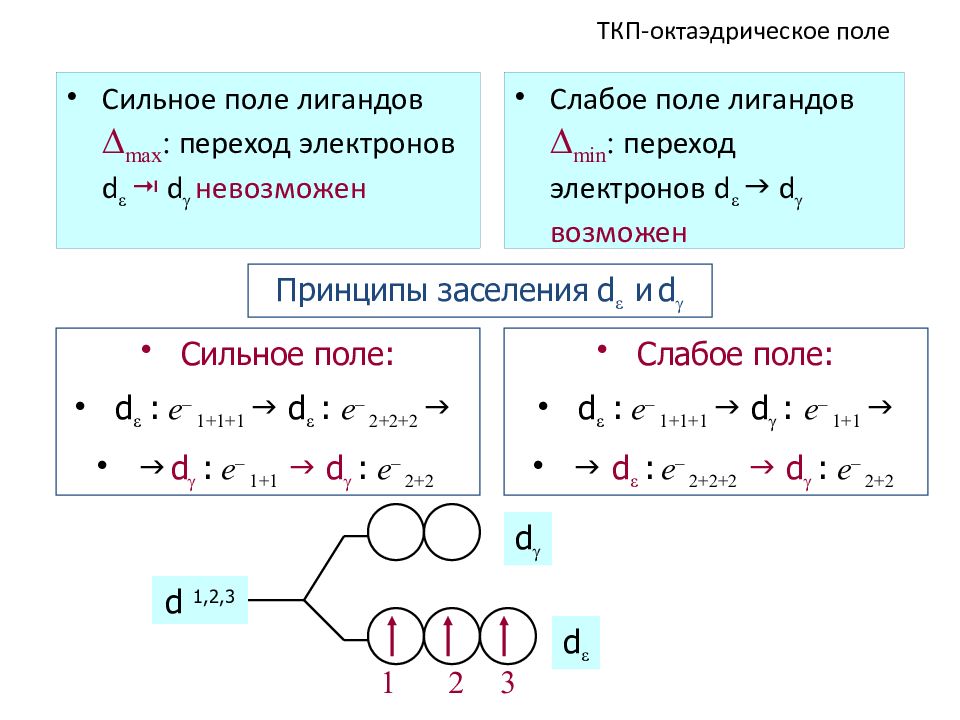
Слайд 50: ТКП - октаэдрическое поле
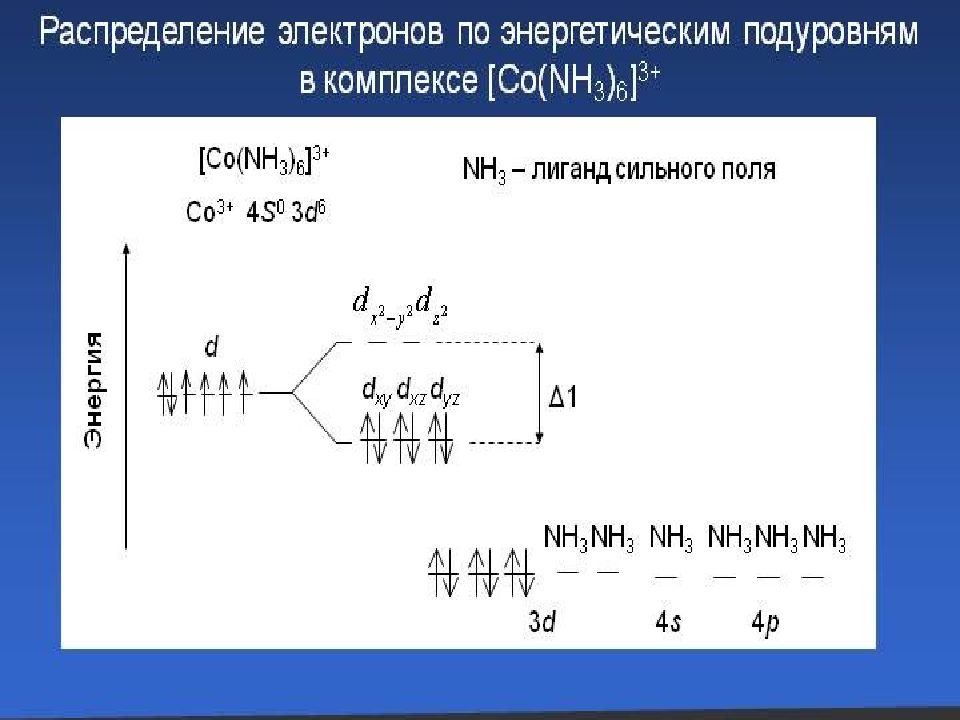
Сильное поле лигандов max : переход электронов d d невозможен Слабое поле лигандов min : переход электронов d d возможен Принципы заселения d и d Сильное поле: d : e – 1+1+1 d : e – 2+2+2 d : e – 1+1 d : e – 2+2 Слабое поле: d : e – 1+1+1 d : e – 1+1 d : e – 2+2+2 d : e – 2+2 d 1,2,3 1 2 3 d d
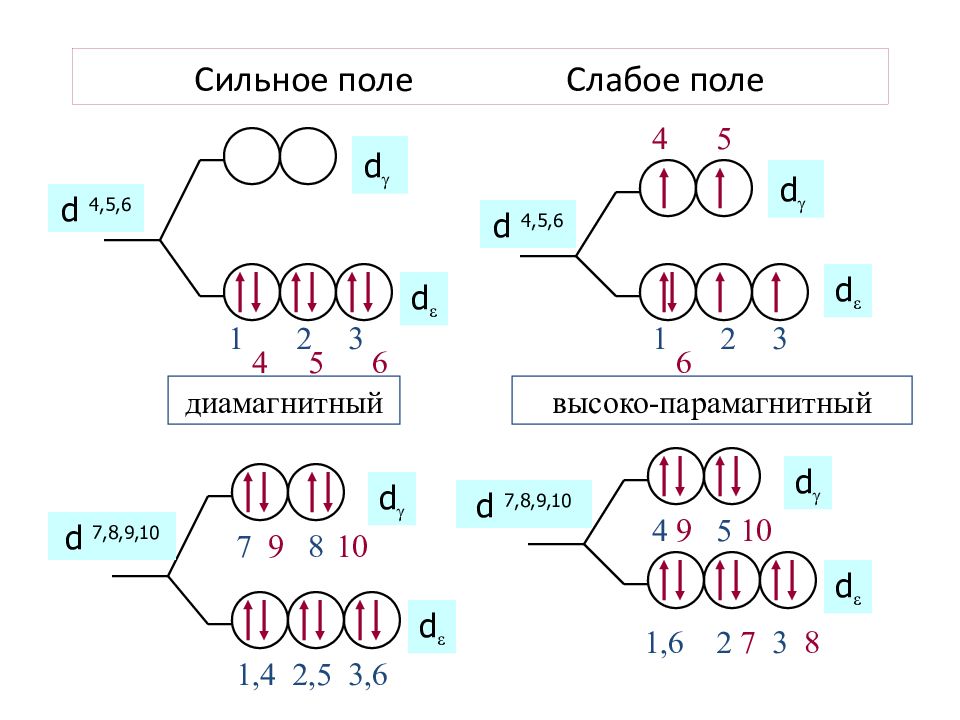
Слайд 51: Сильное поле Слабое поле
4 4 6 5 5 d 4, 5, 6 1 2 3 d d 1 2 3 d d 6 d 4, 5, 6 диамагнитный высоко-парамагнитный 9 7 10 8 10 9 7 8 1,4 2,5 3,6 d d 1,6 5 4 3 2 d d d 7, 8, 9,10 d 7, 8, 9,10
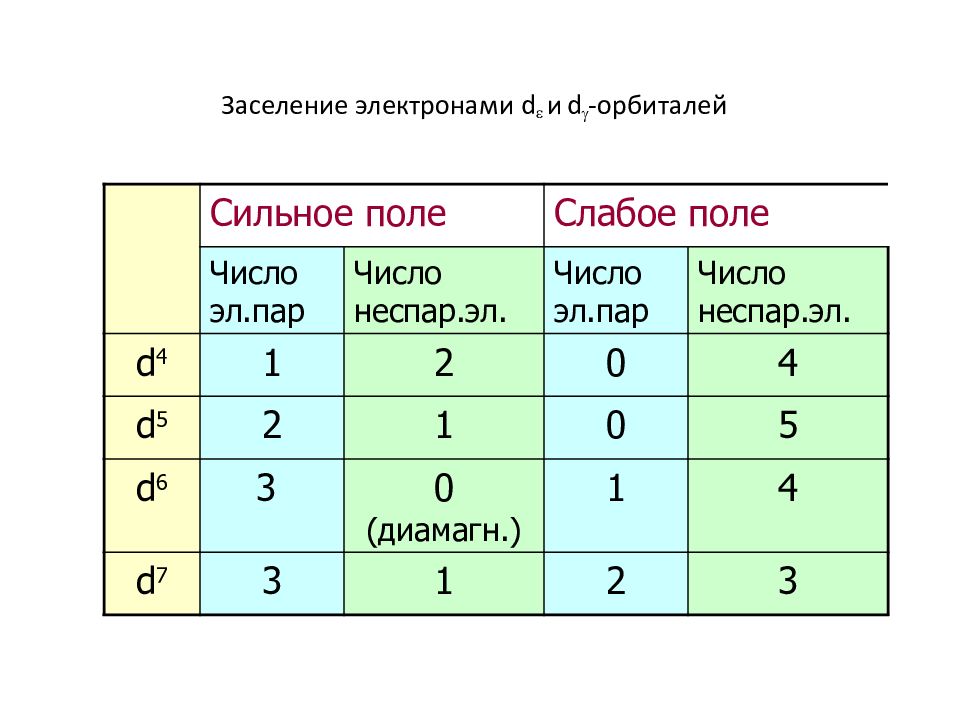
Слайд 52: Заселение электронами d и d -орбиталей
Сильное поле Слабое поле Число эл.пар Число неспар.эл. Число эл.пар Число неспар.эл. d 4 1 2 0 4 d 5 2 1 0 5 d 6 3 0 (диамагн.) 1 4 d 7 3 1 2 3
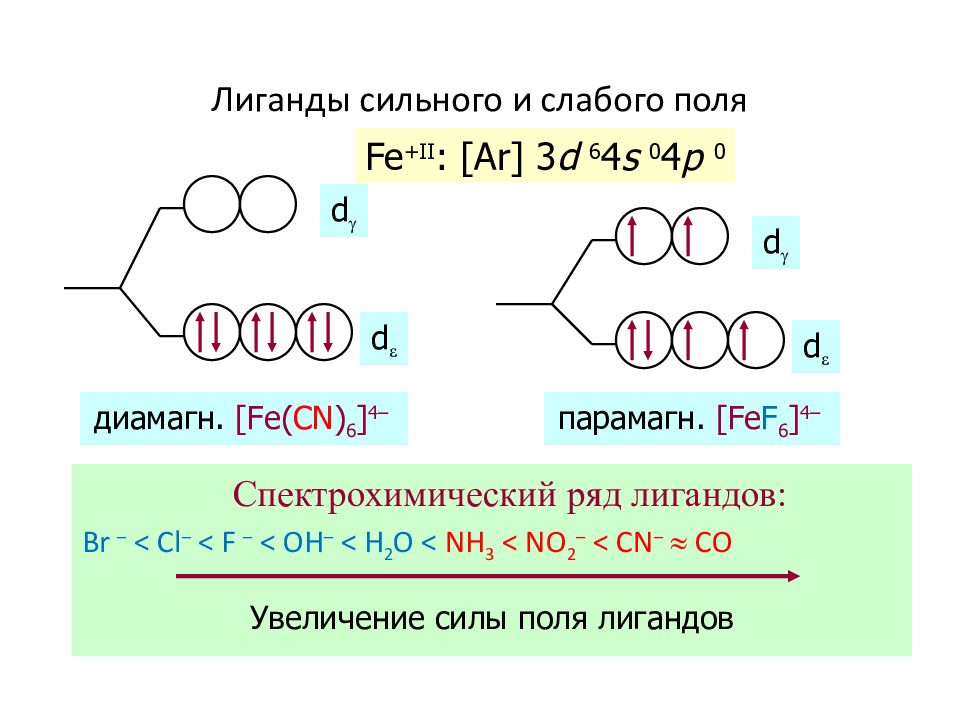
Слайд 53: Лиганды сильного и слабого поля
С пектрохимический ряд лигандов: Br – < Cl – < F – < OH – < H 2 O < NH 3 < NO 2 – < CN – CO Fe + II : [Ar] 3 d 6 4 s 0 4 p 0 d d d d диамагн. [Fe( CN ) 6 ] 4 – парамагн. [Fe F 6 ] 4 – Увеличение силы поля лигандов
Слайд 54
[Co(H 2 O) 6 ] 2+ розовый [Co(CH 3 COO) 2 ] ярко-розовый [Co(NO 2 ) 6 ] 4- оранжевый [Co(NH 3 ) 6 ] 2+ буро-розовый Усиление поля лигандов Влияние поля лигандов на окраску комплексов
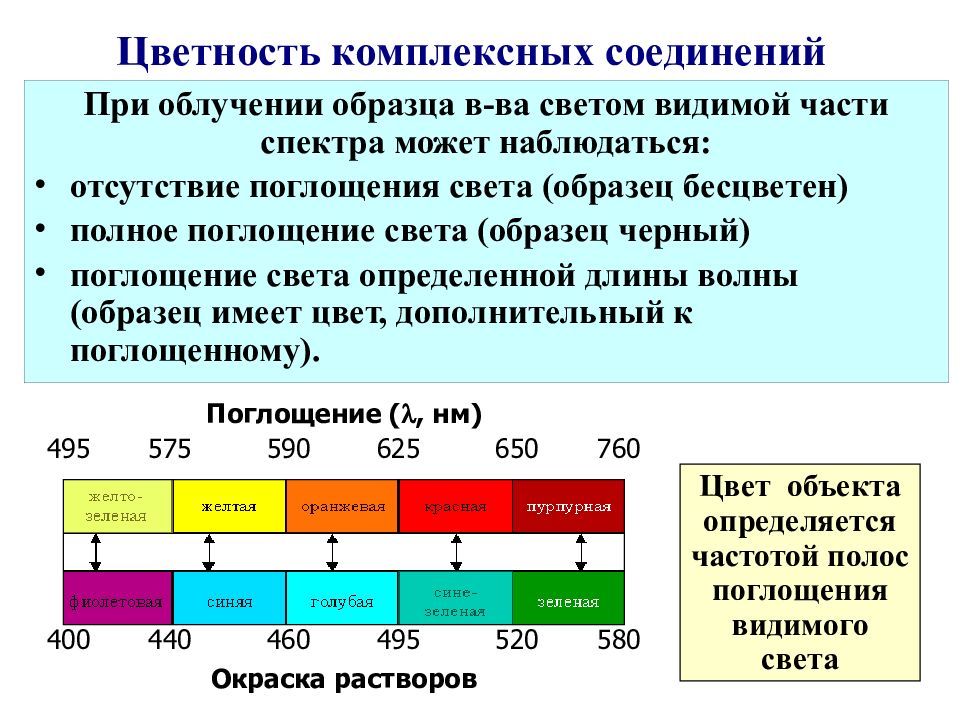
Слайд 55: Цветность комплексных соединений
При облучении образца в- ва светом видимой части спектра может наблюдаться: отсутствие поглощения света (образец бесцветен) полное поглощение света (образец черны й ) поглощение света определенной длины волны (образец имеет цвет, дополнительный к поглощенному). Цвет объекта определяется частотой полос поглощения видимого света Поглощение ( , нм) 495 575 590 625 650 760 400 440 460 495 520 580 Окраска растворов
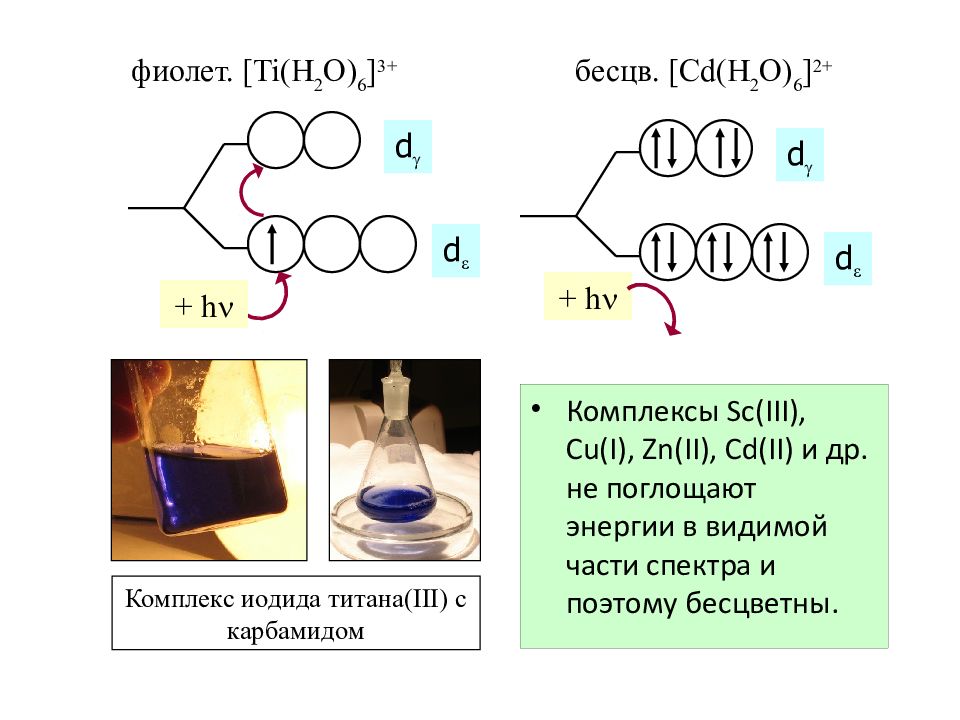
Слайд 56: Цветность комплекс ов
Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии в видимой части спектра и поэтому бесцветны. d d d d фиолет. [Ti(H 2 O) 6 ] 3+ бесцв. [ Cd (H 2 O) 6 ] 2 + + h + h Комплекс иодида титана( III) с карбамидом
Слайд 59: Изомерия комплексных соединений
Изомерия – явление существования соединений, одинаковых по составу и мол. массе, но различающихся по строению и свойствам ( изомеров ). В случае компл ексных соед инений изомери я обусловлен а : различ ием в строении и координации лигандов различ ием в строении внутр енней коорд инационной сферы раз личным распред елением частиц между внутр енней и внеш ней сферой
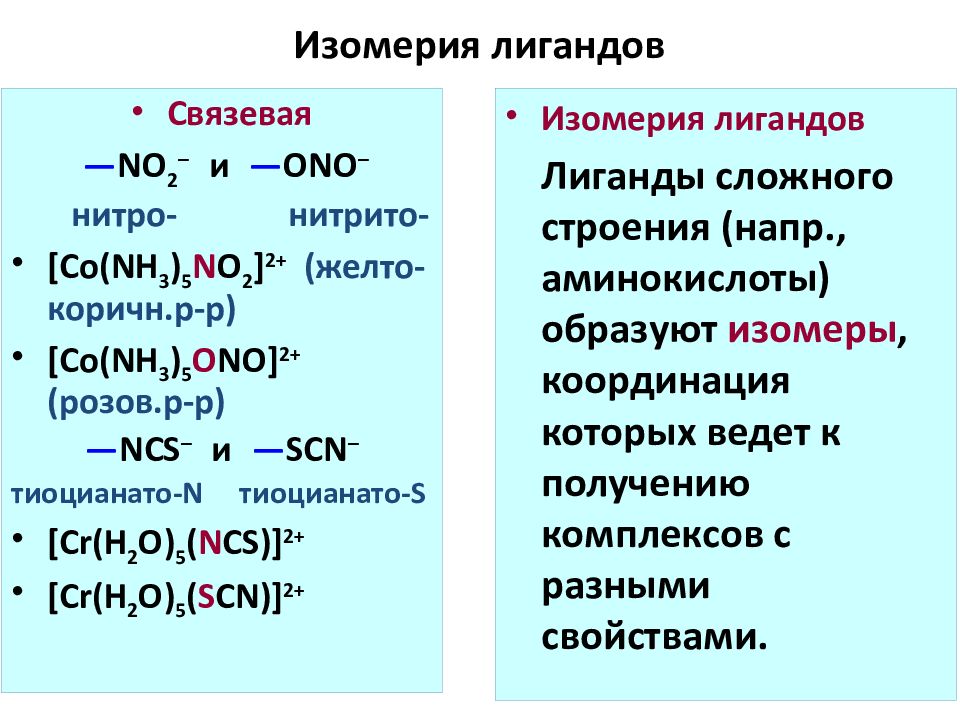
Слайд 60: Изомерия лигандов
Связевая — NO 2 – и — ONO – нитро- нитрито- [Co(NH 3 ) 5 N O 2 ] 2+ (желто-коричн.р-р) [Co(NH 3 ) 5 O NO] 2+ (розов.р-р) — NCS – и — SCN – тиоцианато- N тиоцианато- S [Cr(H 2 O) 5 ( N CS)] 2+ [Cr(H 2 O) 5 ( S CN)] 2+ Изомерия лигандов Лиганды сложного строения ( напр., аминокислоты ) образуют изомеры, координация которых ведет к получению комплексов с разными свойствами.
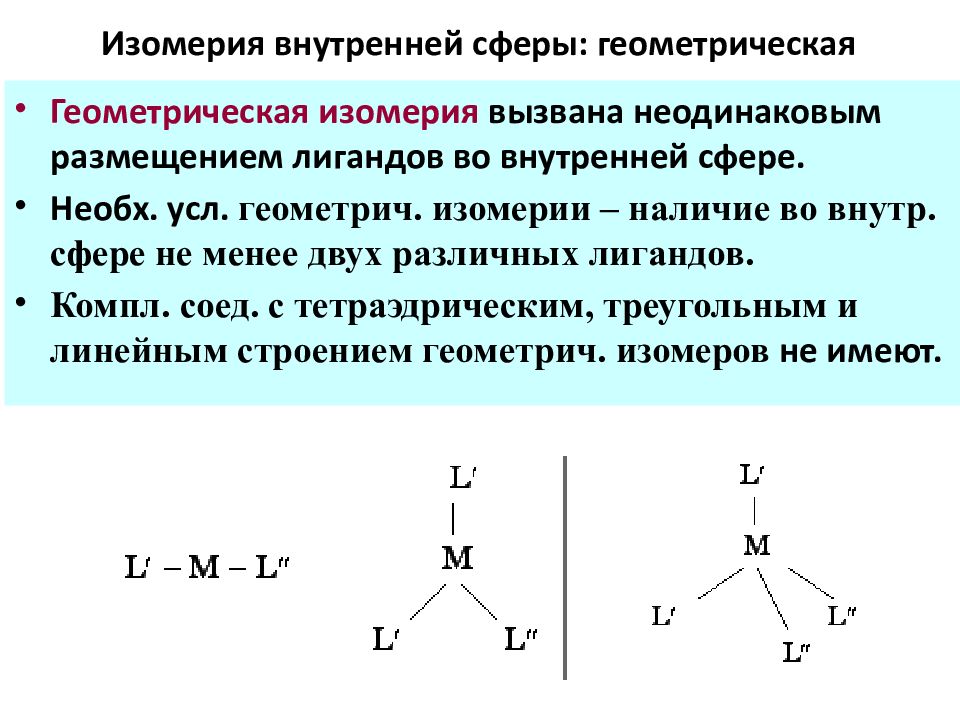
Слайд 61: Изомерия внутренней сферы: геометрическая
Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере. Необх. усл. геом етрич. изомерии – наличие во внутр. сфере не менее двух разл ичных лигандов. Компл. соед. с тетраэдрич еским, треугольным и линейным строением геометр ич. изомеров не имеют.
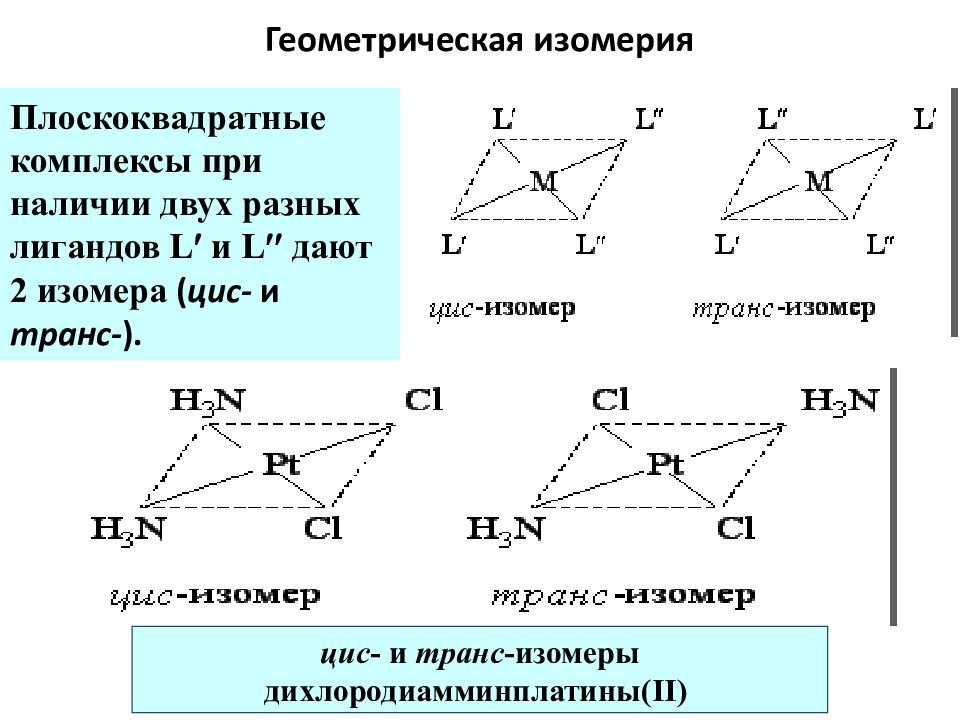
Слайд 62: Геометрическая изомерия
Плоскоквадратные комплексы при наличии двух разных лигандов L и L дают 2 изомера ( цис- и транс- ). цис - и транс -изомеры дихлородиамминплатин ы (II)
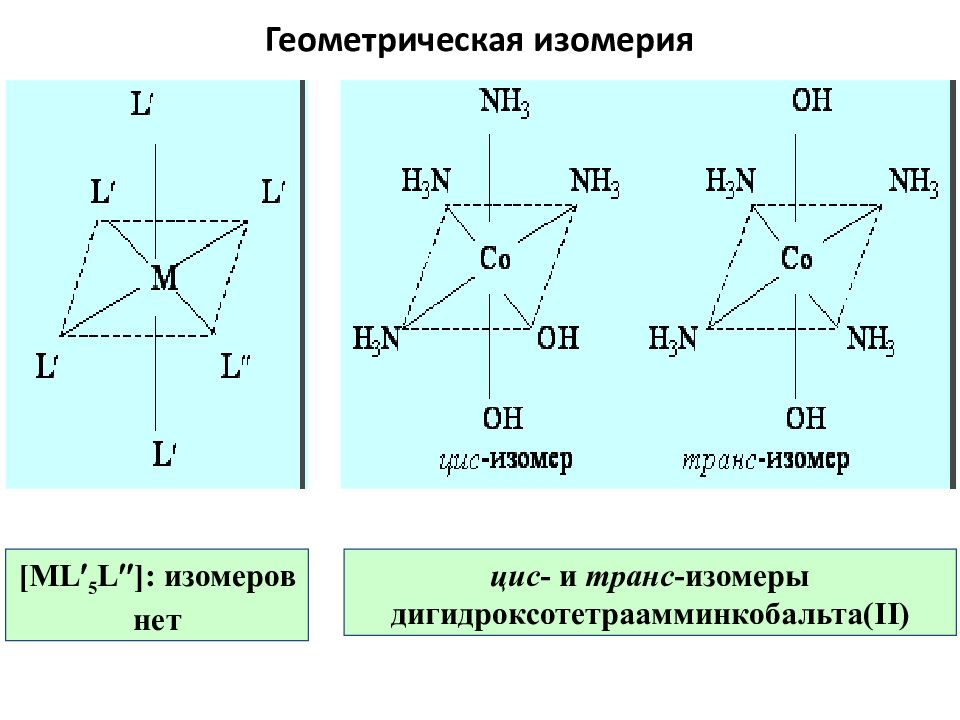
Слайд 63: Геометрическая изомерия
[ML 5 L ]: изомеров нет цис - и транс -изомеры дигидроксотетраамминкобальта( II )
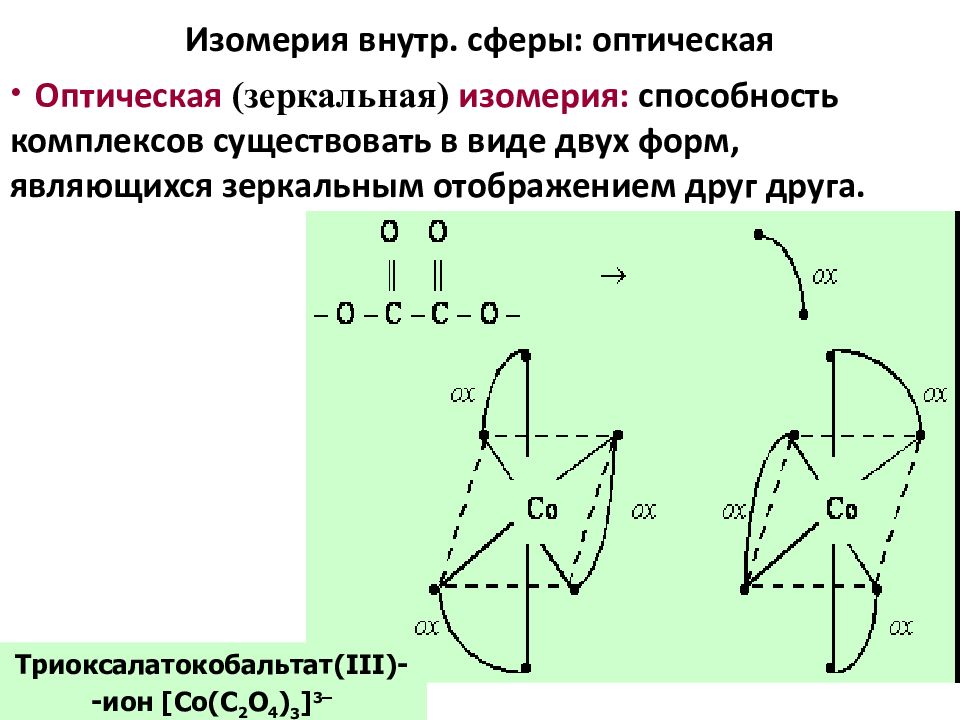
Слайд 64: Изомерия внутр. сферы: оптическая
Оптическая (зеркальная) изомерия : способность комплексов существовать в виде двух форм, являющихся зеркальным отображением друг друга. Триоксалатокобальтат (III) - -ион [Co( С 2 O 4 ) 3 ] 3 –
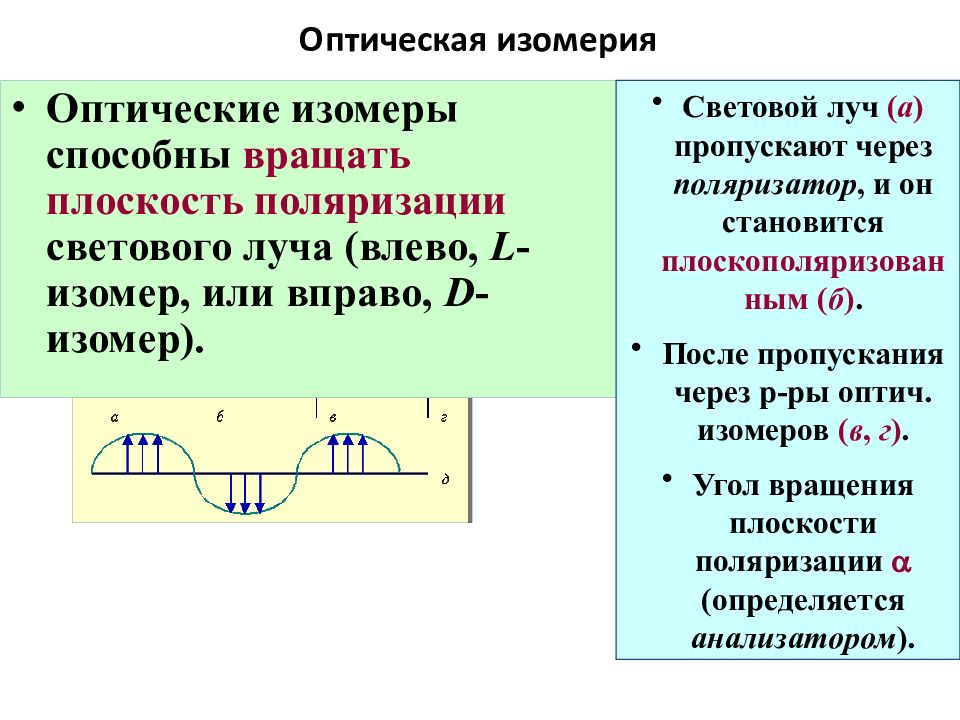
Слайд 65: Оптическая изомерия
Оптические изомеры способны вращать плоскость поляризации светового луча ( влево, L -изомер, или вправо, D -изомер ). Световой луч ( а ) пропус кают через поляризатор, и он стан овится плоскополяризованным ( б ). После пропускания через р-ры оптич. изомеров ( в, г ). Угол вращения плоскости поляризации a (определяется анализатором ).
Слайд 66: Междусферная изомерия: 1) с ольватная (гидратная) ; 2) и онная изомерия
[Co(en) 2 Cl 2 ] Cl · H 2 O [Co( H 2 O ) (en) 2 Cl] Cl 2 [Co(NH 3 ) 5 I ] SO 4 [Co(NH 3 ) 5 SO 4 ] I 1 Cl – ; H 2 O (AgCl ) 2 Cl – (2 AgCl ) SO 4 2– (BaSO 4 ) I – (AgI ) гидратная ионная
Слайд 67: Междусферная изомерия
Ионные (ионизационные) изомеры [Pt(NH 3 ) 4 Cl 2 ] Br 2 и [Pt(NH 3 ) 4 Br 2 ] Cl 2 [Pt(NH 3 ) 4 SO 4 ] ( OH ) 2 и [Pt(NH 3 ) 4 ( OH ) 2 ] SO 4 pH 7 pH 7 Координационные изомеры [Cr ( NH 3 ) 4 ( NCS ) 2 ] [Cr ( NH 3 ) 2 ( NCS ) 4 ] [Cr ( NH 3 ) 6 ] [Cr( NCS ) 6 ]
Слайд 69: K 4 [Fe(CN) 6 ]
Ионная связь (диссоциация по типу сильного электролита) Ковалентная (диссоциация по типу слабого электролита)
Слайд 71
[Fe(CN) 6 ] 4- Fe 2+ +6(CN) - вторичная диссоциация Константа нестойкости (К н ): К н = [Fe 2+ ] · [CN - ] 6 [[Fe (CN) 6 ] 4- ] K н = 1 ּ 10 -31 (очень прочный комплекс)
Слайд 74: Правило циклов Чугаева
Наибольшей устойчивостью обладают пяти- и шестичленные металлоциклы. Соединения с трех-, четырехчленными циклами и с числом звеньев больше семи образуются редко из-за их малой устойчивости. Стабильность хелатных комплексов возрастает с увеличением числа металлоциклов в комплексе.
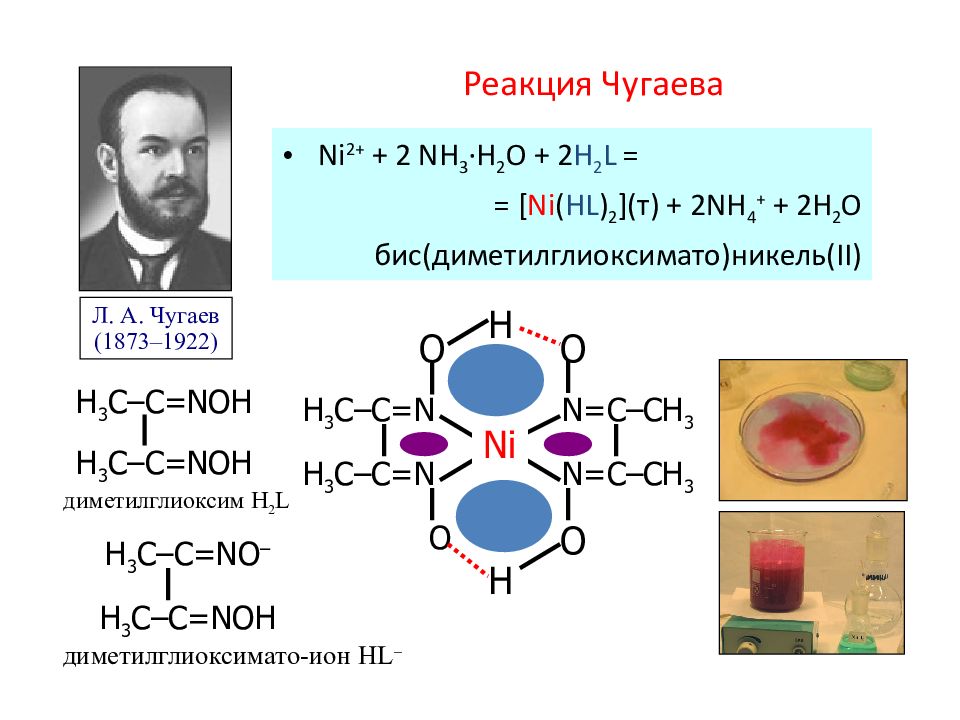
Слайд 75: Реакция Чугаева
Ni 2+ + 2 NH 3 ·H 2 O + 2 H 2 L = = [ Ni ( HL ) 2 ]( т ) + 2NH 4 + + 2H 2 O бис(диметилглиоксимато)никел ь (II) Л. А. Чугаев (1873–1922) H 3 C –C=NOH H 3 C –C=NOH диметилглиоксим H 2 L H 3 C –C=N H 3 C –C=N N = C– CH 3 N=C– CH 3 Ni O O O O H H H 3 C –C=NO – H 3 C –C=NOH диметилглиоксимато-ион HL –
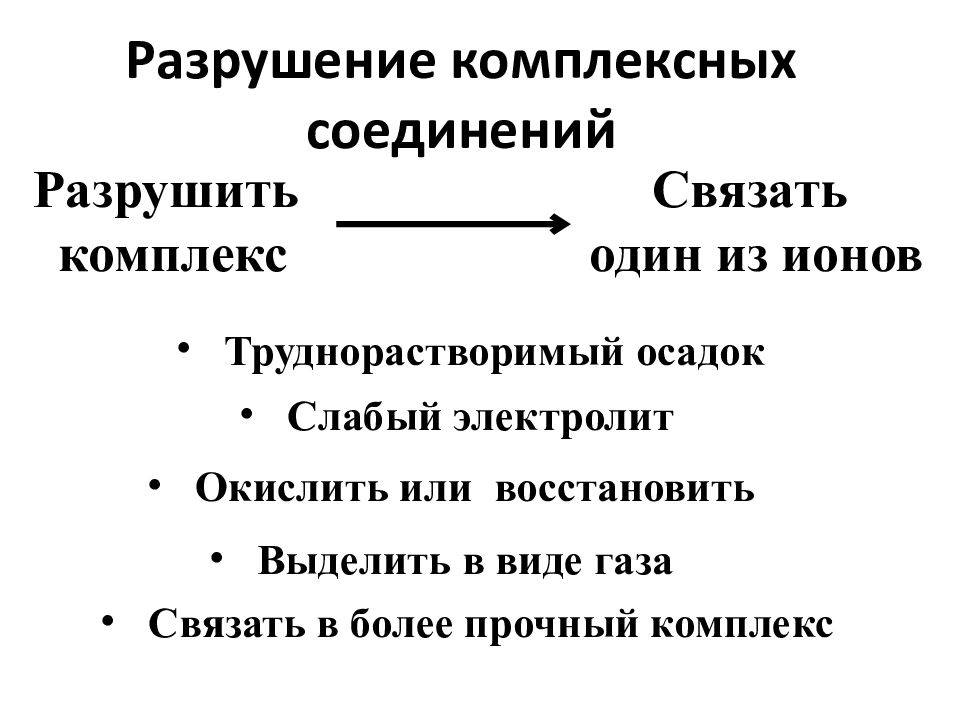
Слайд 76: Разрушение комплексных соединений
Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
Слайд 78: [Ag (NH 3 ) 2 ] + + KI = AgI + NH 3 +K + К s( AgI ) = 1,5 · 10 -16
[Ag (NH 3 ) 2 ] + + 2CN - = [Ag(CN) 2 ] - +2NH 3 К н = 8 · 10 -22
Слайд 79: [Ag (NH 3 ) 2 ] + Ag + + 2 NH 3
+ KI Образование труднорастворимого осадка + HNO 3 NH 4 NO 3 + KCN Образование более прочного комплекса
Слайд 80
Использование реакций комплексообразования в фармацевтическом анализе: Для обнаружения ионов. Например, ионы кобальта (II) можно отрыть реакцией с рубеановодородной кислотой в результате которой образуется коричнево- желтый осадок H 2 N – C – C–NH 2 HN = C – C = NH + Co 2+ HN = C – C = NH + H + || || | | | | S S HS SH S S Co Для разделения ионов. Так, если надо ионы Cu 2+ и М g 2+ отделить друг от друга, то в раствор, содержащий их, добавляют избыток N Н 4 ОН. При этом ионы меди ( II ) переходят в раствор в виде тетраамминмеди ( II ), а катионы М g 2+ осаждаются в гидроксид магния Мg(ОН) 2.
Слайд 81
Для маскировки мешающих ионов. Например, при обнаружении ионов Ni 2+ в присутствии F е 3+, последний связывают в устойчивый комплексный ион гексафтороферрат ( III ): Fe 3+ + 6 F - [ FeF 6 ] 3- После маскировки F е 3+ проводят аналитические реакции на ионы никеля (II). Для растворения осадков. Так, при добавлении к хлориду серебра концентрированной хлороводородной кислоты осадок АgС l растворяется : AgCl + 2 HCl H 2 [ AgCl 3 ]
Слайд 82
Для изменения окислительно-восстановительных свойств ионов. Например, молибден ( VI ) в виде МоО 3 Н 2 О не окисляет бензидин, а комплексный ион [ P ( Mo 2 O 7 ) 6 ] 7- по отношению к нему является окислителем. В экстракционном концентрировании и разделении веществ получают нейтральные комплексы, способные переходить из воды в органический растворитель, не смешивающийся с ней. Для количественного определения различных химических соединений в том числе и лекарственных веществ, в состав которых входят анионы, способные образовывать с титрантом комплексные соединения. Для этой цели применяют такие методы, как комплексонометрия, куприметрия и другие.
Слайд 85
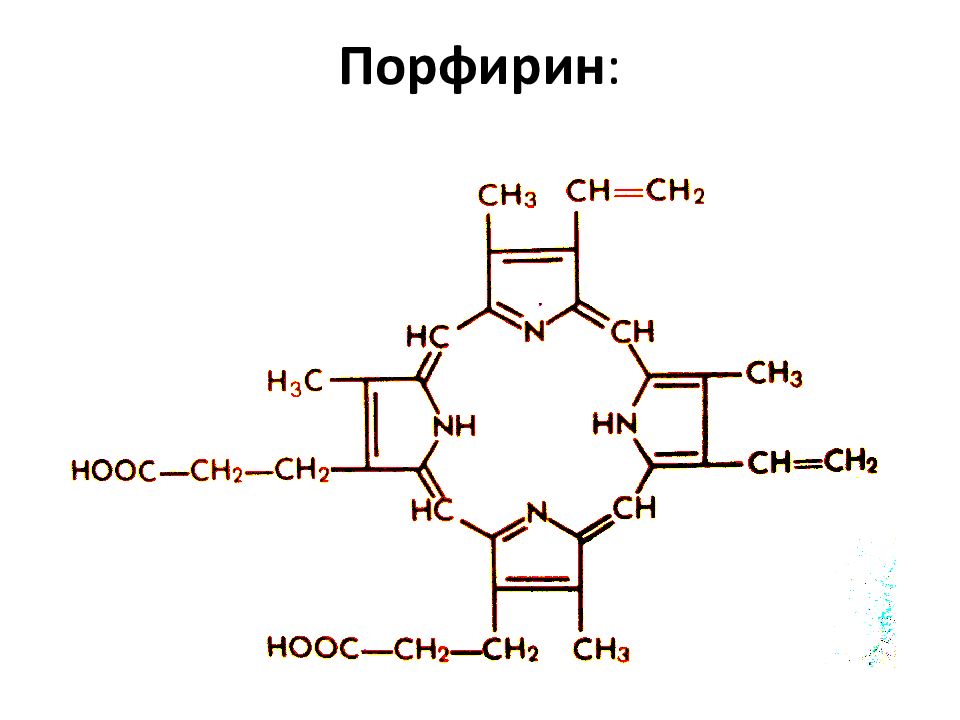
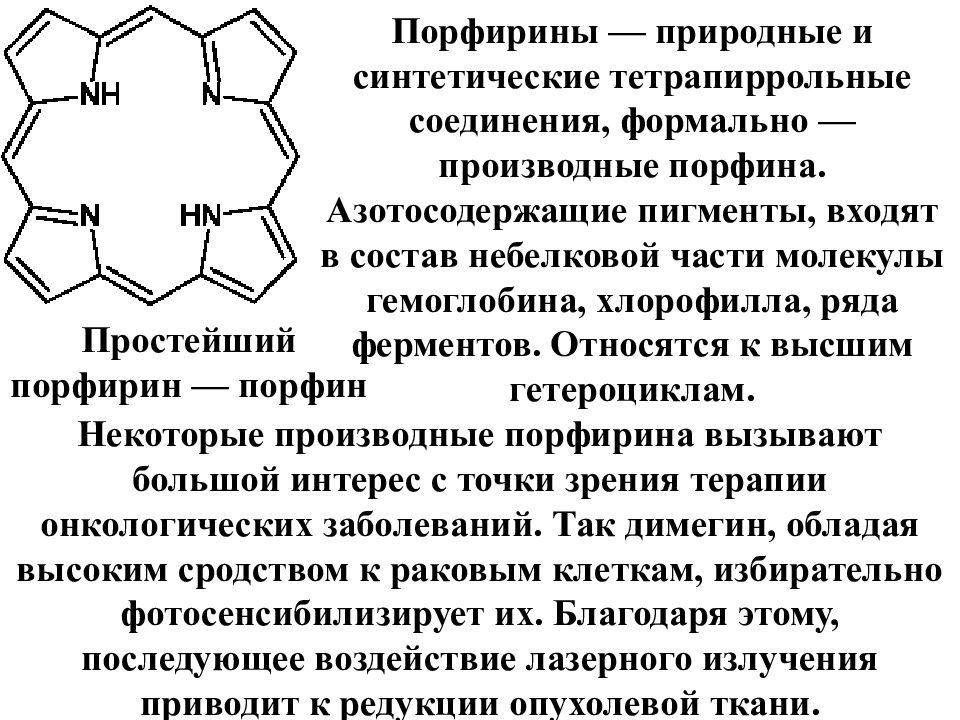
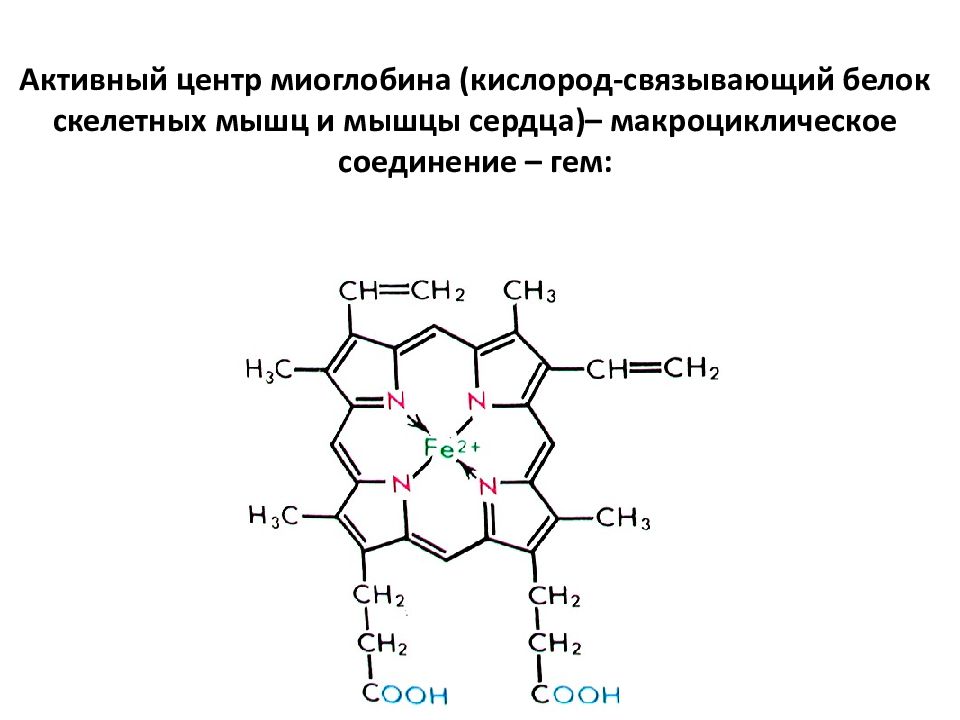
Простейший порфирин — порфин Порфирины — природные и синтетические тетрапиррольные соединения, формально — производные порфина. Азотосодержащие пигменты, входят в состав небелковой части молекулы гемоглобина, хлорофилла, ряда ферментов. Относятся к высшим гетероциклам. Некоторые производные порфирина вызывают большой интерес с точки зрения терапии онкологических заболеваний. Так димегин, обладая высоким сродством к раковым клеткам, избирательно фотосенсибилизирует их. Благодаря этому, последующее воздействие лазерного излучения приводит к редукции опухолевой ткани.
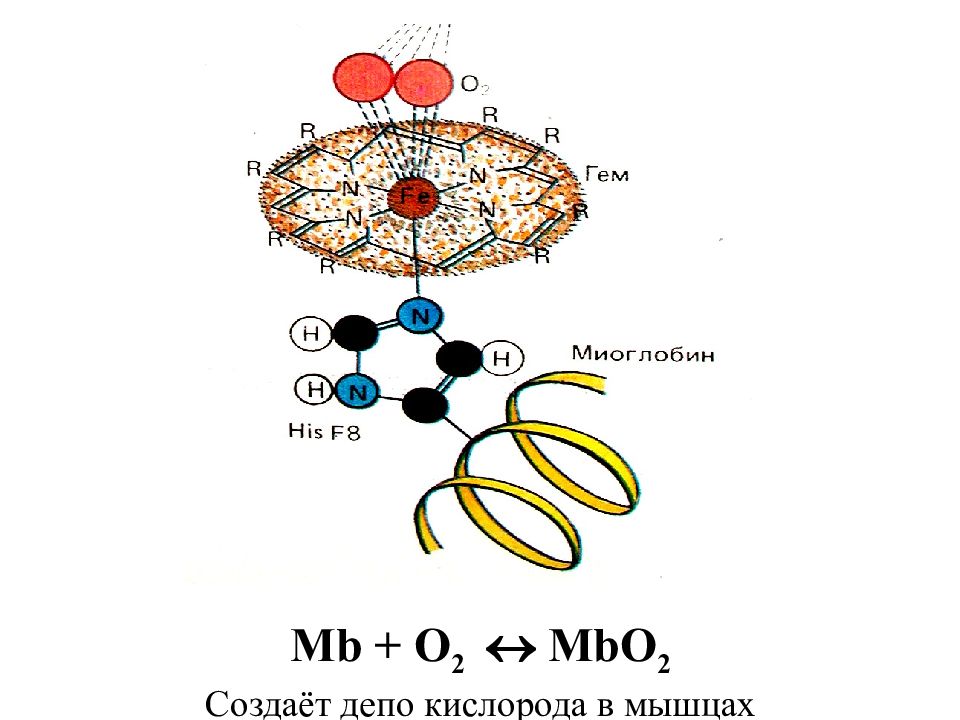
Слайд 86: Активный центр миоглобина (кислород-связывающий белок скелетных мышц и мышцы сердца)– макроциклическое соединение – гем :
Слайд 90
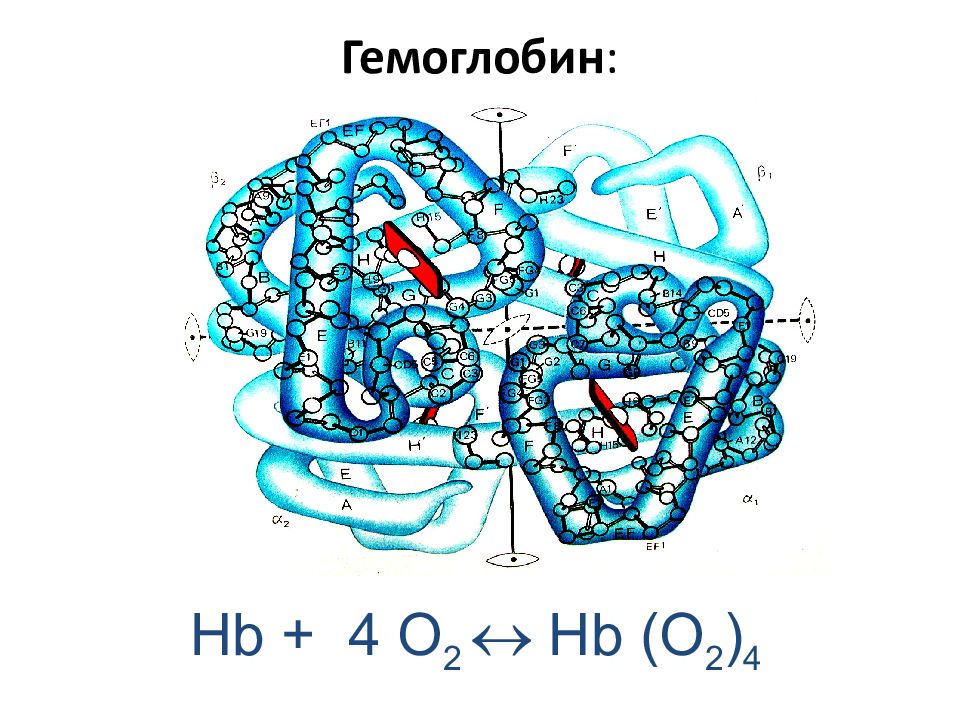
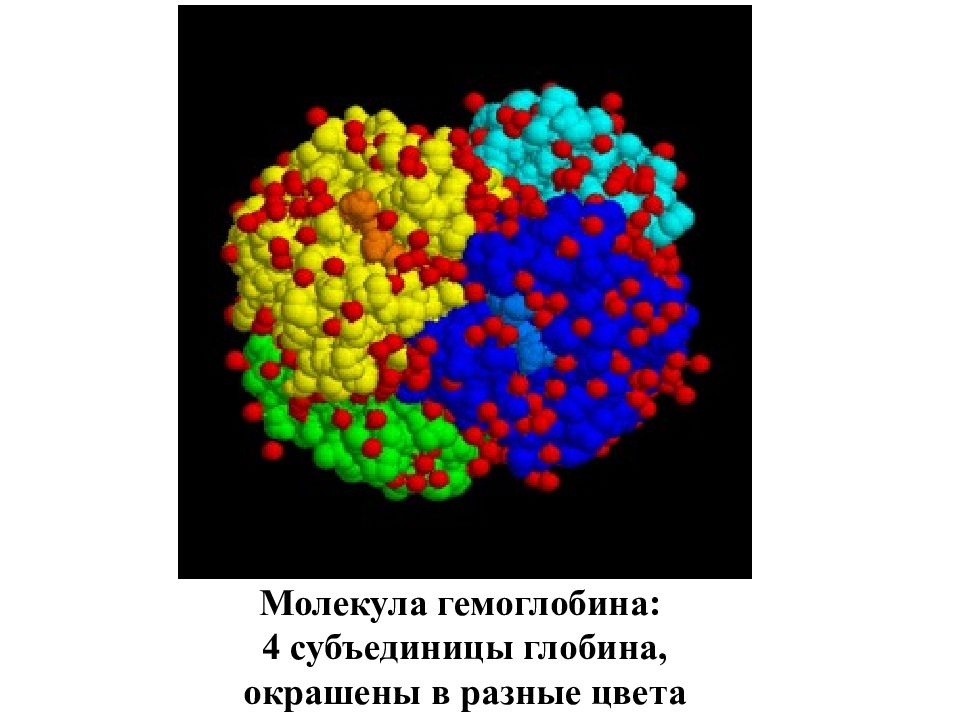
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок. Главная функция гемоглобина заключается в трех этапах, определяющих три его свойства. 1-ый этап - присоединение O 2 к гемоглобину. 2-ой - образование сложных взаимоотношений между гемом и O 2, а именно превращение O 2 в синглетный кислород. Данный этап является этапом трансформации O 2 в его реакционно-способную форму, необходимую для дальнейшего взаимодействия с клетками и является главной функцией гемоглобина. 3-ий этап - отдача синглетного кислорода в ткани. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где O 2 мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином.
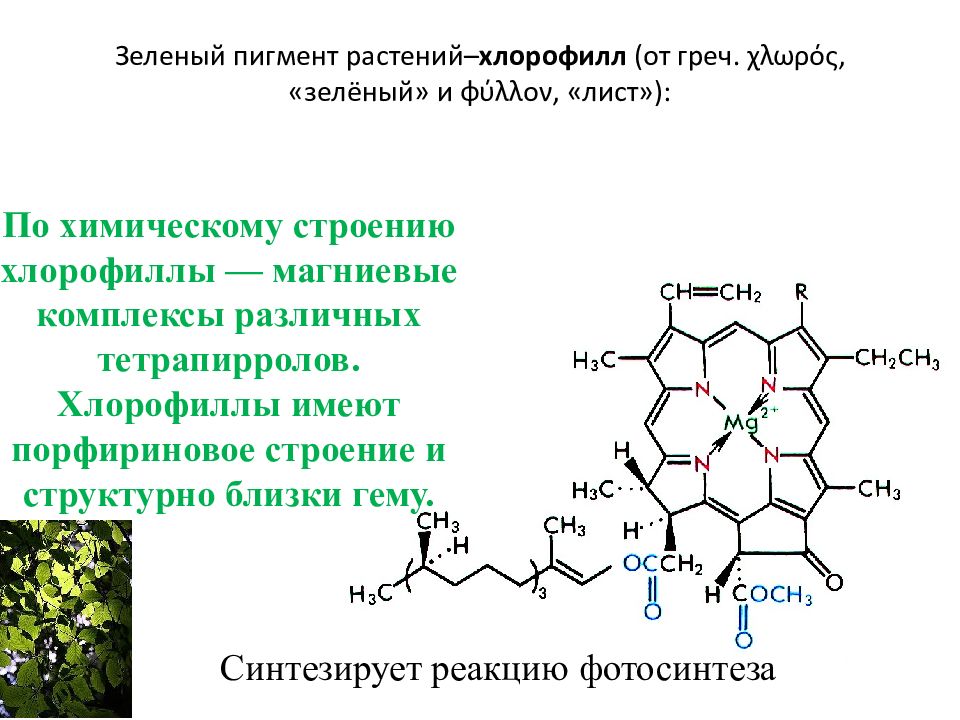
Слайд 91: Зеленый пигмент растений– хлорофилл (от греч. χλωρός, «зелёный» и φύλλον, «лист»):
Синтезирует реакцию фотосинтеза По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему.
Слайд 93
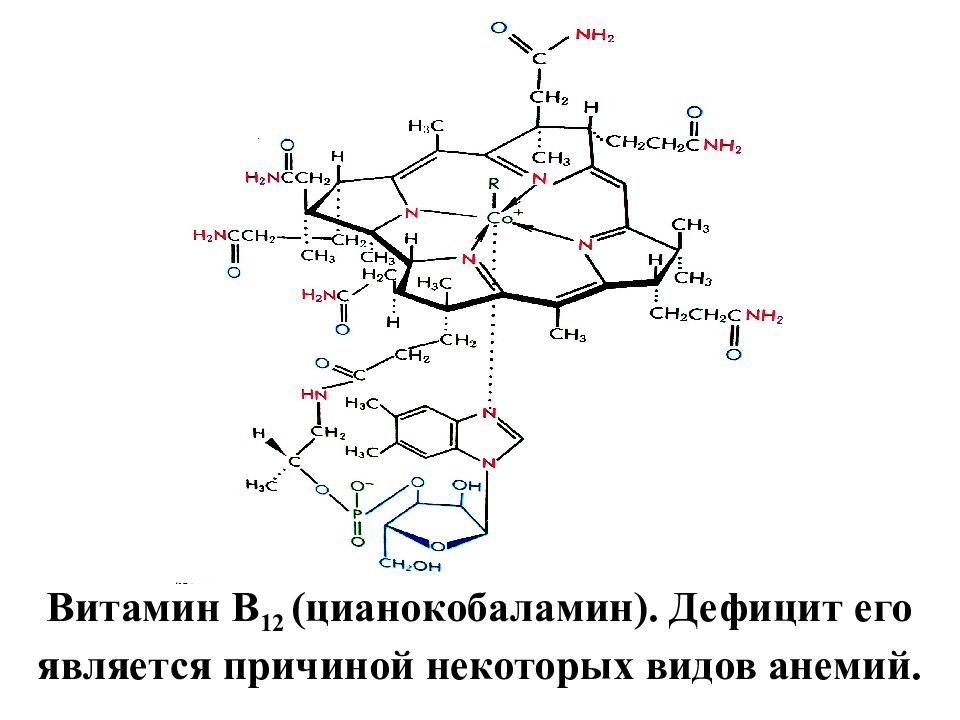
Витамин В 12 (цианокобаламин). Дефицит его является причиной некоторых видов анемий.
Слайд 94: Унитиол - антидот при отравлениях соединениями мышьяка, ртути и солями тяжелых металлов )
Меркаптидная связь
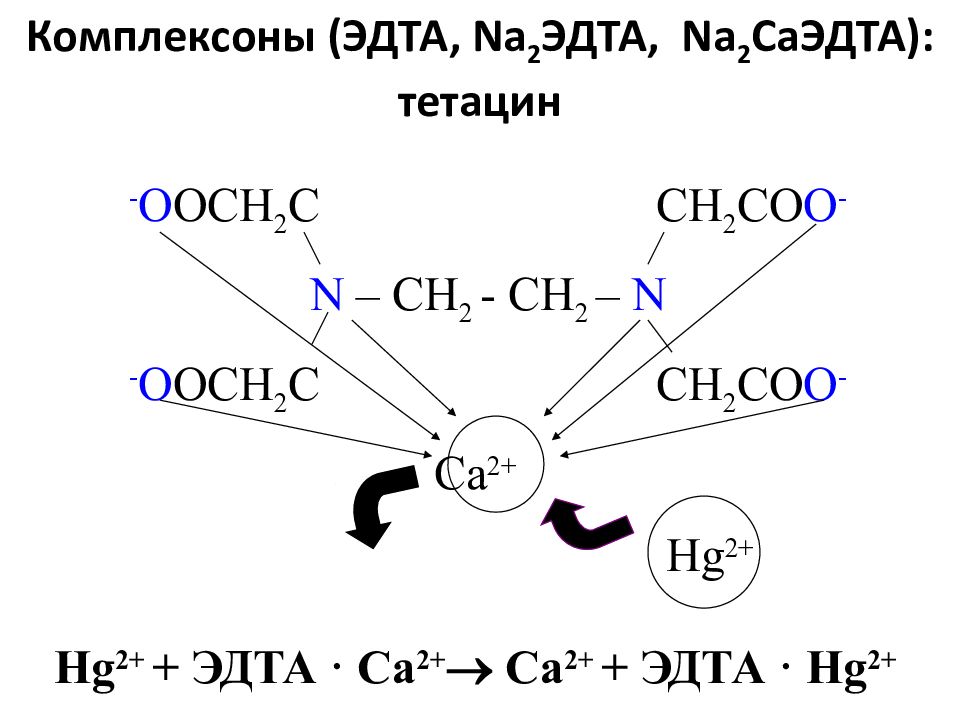
Слайд 95: Комплексоны (ЭДТА, Na 2 ЭДТА, Na 2 Ca ЭДТА): тетацин
- O OCH 2 C CH 2 CO O - N – CH 2 - CH 2 – N - O OCH 2 C CH 2 CO O - С a 2+ Hg 2+ Hg 2+ + ЭДТА · Ca 2+ Ca 2+ + ЭДТА · Hg 2+










![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na[BF 4 ] Na 3 [AlF 6 ]](https://s1.showslide.ru/s_slide/5648/9e9174c8-a3bb-4221-a773-b3c0fc04a845.jpeg)
![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3 [AlF 6 ] Na [AlCl 4 ]](https://s1.showslide.ru/s_slide/4c85/d903e21c-7c27-4fa0-9a69-4c222c18b626.jpeg)


![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Al(OH) 3 + NaOH= Na[Al(OH) 4 ]](https://s1.showslide.ru/s_slide/8ccc/6036b692-f5c2-4da6-b8d2-bbf54028a002.jpeg)


![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [ Cu(NH 3 ) 4 ] SO 4 Na 3 [ Co(NO 2 ) 6 ] [ Co(NH 3 ) 4 Cl 2 ] Cl [ Pt(NH 3 ) 2 Cl 2 ] [ Fe(CO) 5 ] K 3 [ Fe(CN) 6 ]](https://s1.showslide.ru/s_slide/97bf/e1f54e1c-5bc2-494e-8935-f5fbba386974.jpeg)





![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Zn 2+ + 4 NH 3 [Zn(NH 3 ) 4 ] 2+](https://s1.showslide.ru/s_slide/d5af/2de0840c-989a-4e17-9fb3-d7e234ab66d0.jpeg)

![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ В случае [ML 6 ] ±,0 : октаэдрическое поле лигандов](https://s1.showslide.ru/s_slide/116d/a3a3b08f-4897-49f8-a01c-07e7545a24fd.jpeg)






![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ K 4 [Fe(CN) 6 ]](https://s1.showslide.ru/s_slide/097f/8b04d5d2-b501-4e77-a7a8-b4967518ac38.jpeg)
![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ K 4 [Fe(CN) 6 ] 4 K + + [Fe(CN) 6 ] 4- первичная диссоциация](https://s1.showslide.ru/s_slide/51c2/3ca6c565-539d-4ba9-9341-4cac28a28e00.jpeg)

![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Ni(NH 3 ) 6 ] 2+ К н = 2·10 -9 (непрочный комплекс)](https://s1.showslide.ru/s_slide/26a3/94b35072-3730-48ca-901f-c36372238360.jpeg)


![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Ag (NH 3 ) 2 ] + Ag + + 2 NH 3 К н = 9,3 · 10 -8](https://s1.showslide.ru/s_slide/4f08/17df3a08-3d81-42b8-8b86-02c2aa862f42.jpeg)
![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Ag (NH 3 ) 2 ] + + KI = AgI + NH 3 +K + К s( AgI ) = 1,5 · 10 -16](https://s1.showslide.ru/s_slide/2c0d/efdc5d30-a19c-4b54-b6e5-0a7b93ddc500.jpeg)
![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Ag (NH 3 ) 2 ] + Ag + + 2 NH 3](https://s1.showslide.ru/s_slide/7d8d/60e43086-3fda-41d0-ab33-8d7e6d30a08b.jpeg)







![Лекция КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Противоопухолевый препарат: цис-изомер дихлородиамминплатины ЦИСПЛАТИН — цитотоксический препарат алкилирующего действия [ Pt(NH 3 ) 2 Cl 2 ]](https://s1.showslide.ru/s_slide/8370/49cc6650-96c3-40a6-aa7c-bd71e193aec8.jpeg)


