Первый слайд презентации: Лекция № 20
ГБОУ ВПО КрасГМУ им. проф.В.Ф. Войно-Ясенецкого Минздрава России Фармацевтический колледж Лектор Ростовцева Л.В., преподаватель химии высшей квалификационной категори и Красноярск, 2013 Тема: Производные ненасыщенных полиокси-γ-лактонов
Слайд 2
План лекции: 1) Понятие о производных ненасыщенных полиокси-γ-лактонов 2) Кислота аскорбиновая
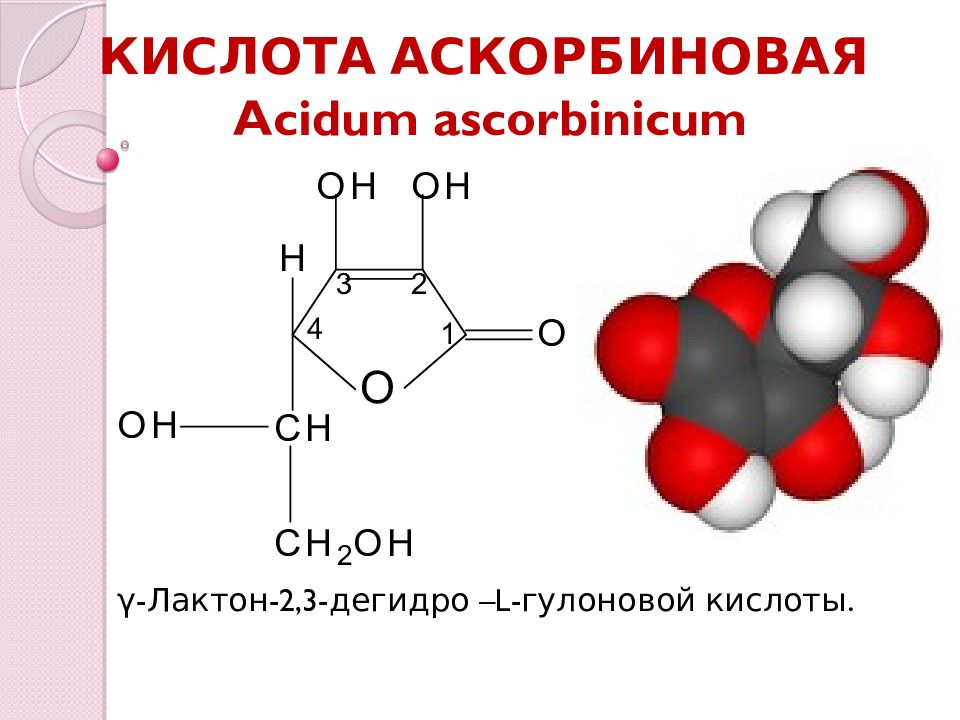
Слайд 3: КИСЛОТА АСКОРБИНОВАЯ Acidum ascorbinicum
γ -Лактон-2,3-дегидро – L - гулоновой кислоты.
Слайд 4: Получение:
Впервые аскорбиновая кислота была получена из капусты Бессоновым. Синтез был осуществлён в 1933г. В промышленности кислоту аскорбиновую получают из D- глюкозы, которая в больших количествах получается при расщеплении крахмала серной кислотой. Суточная потребность человека в витамине С составляет примерно 30 мг. Природные источники: цитрусовые, ягоды, помидоры, цветная капуста, картофель, шиповник.
Слайд 5: Описание:
Кислота аскорбиновая – белый кристаллический порошок без запаха, кислого вкуса; легко растворим в воде и спирте, нерастворим в эфире и хлороформе. Имеет 2 ассиметрических атома углерода. Оптически активна. Температура плавления 190°С - 193°С
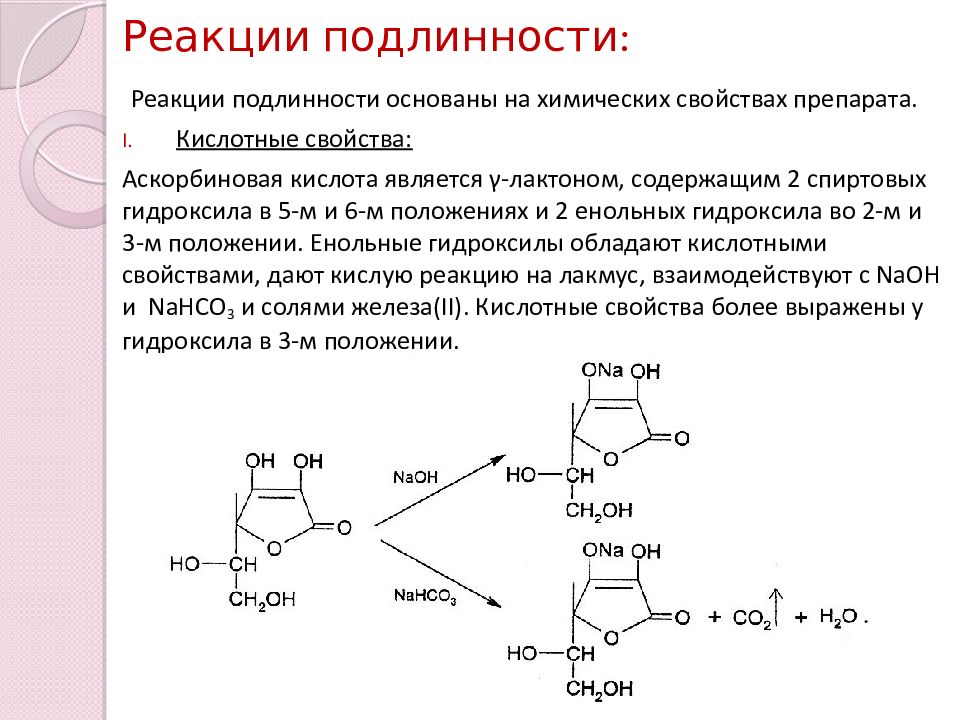
Слайд 6: Реакции подлинности:
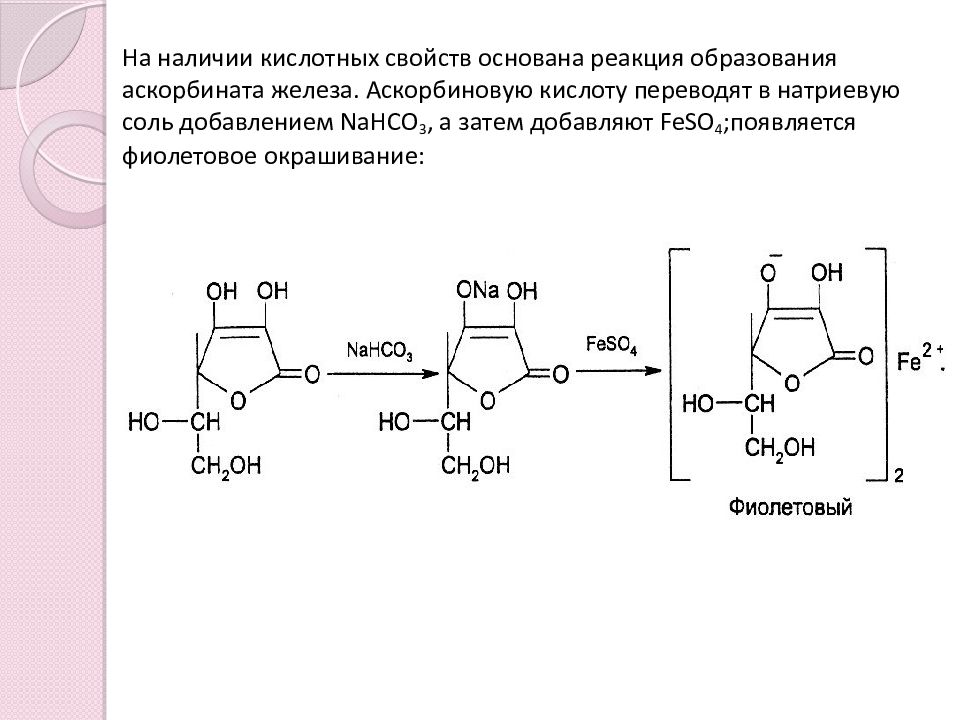
Реакции подлинности основаны на химических свойствах препарата. Кислотные свойства: Аскорбиновая кислота является γ -лактоном, содержащим 2 спиртовых гидроксила в 5-м и 6-м положениях и 2 енольных гидроксила во 2-м и 3-м положении. Енольные гидроксилы обладают кислотными свойствами, дают кислую реакцию на лакмус, взаимодействуют с NaOH и NaHCO 3 и солями железа( II ). Кислотные свойства более выражены у гидроксила в 3-м положении.
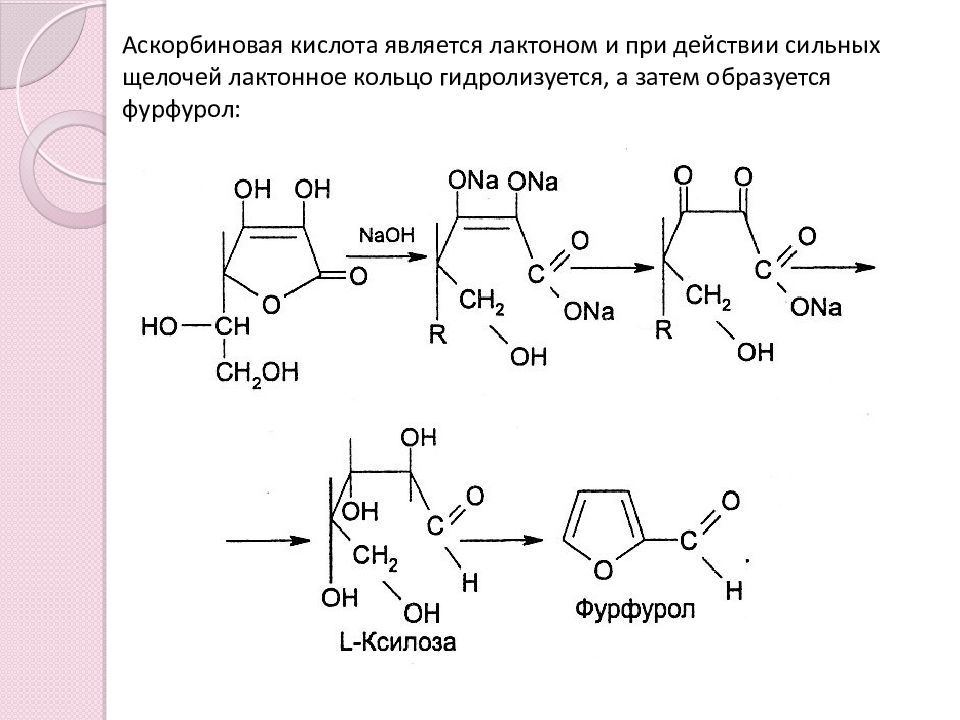
Слайд 8: Аскорбиновая кислота является лактоном и при действии сильных щелочей лактонное кольцо гидролизуется, а затем образуется фурфурол:
Слайд 9
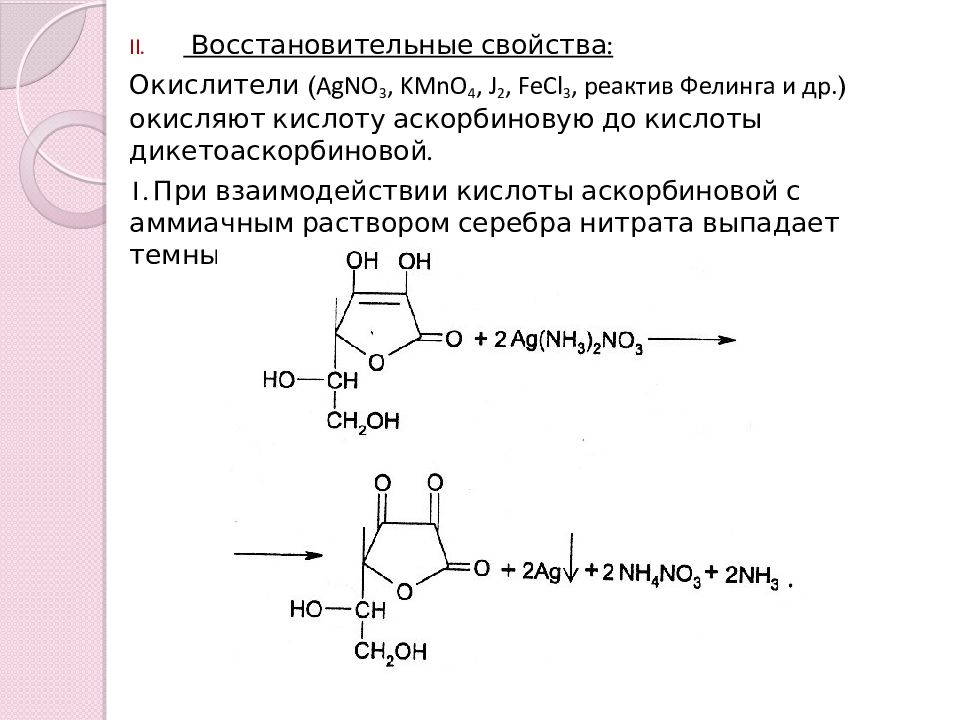
Восстановительные свойства: Окислители ( AgNO 3, KMnO 4, J 2, FeCl 3, реактив Фелинга и др. ) окисляют кислоту аскорбиновую до кислоты дикетоаскорбиновой. 1. При взаимодействии кислоты аскорбиновой с аммиачным раствором серебра нитрата выпадает темный осадок металлического серебра:
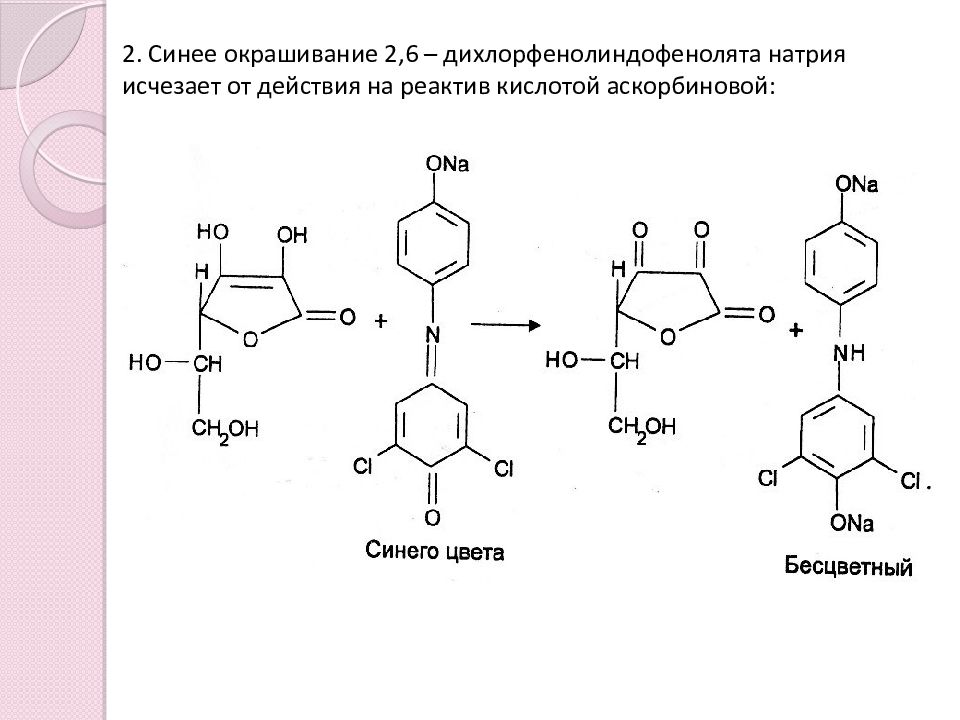
Слайд 10: 2. Синее окрашивание 2,6 – дихлорфенолиндофенолята натрия исчезает от действия на реактив кислотой аскорбиновой:
Слайд 11
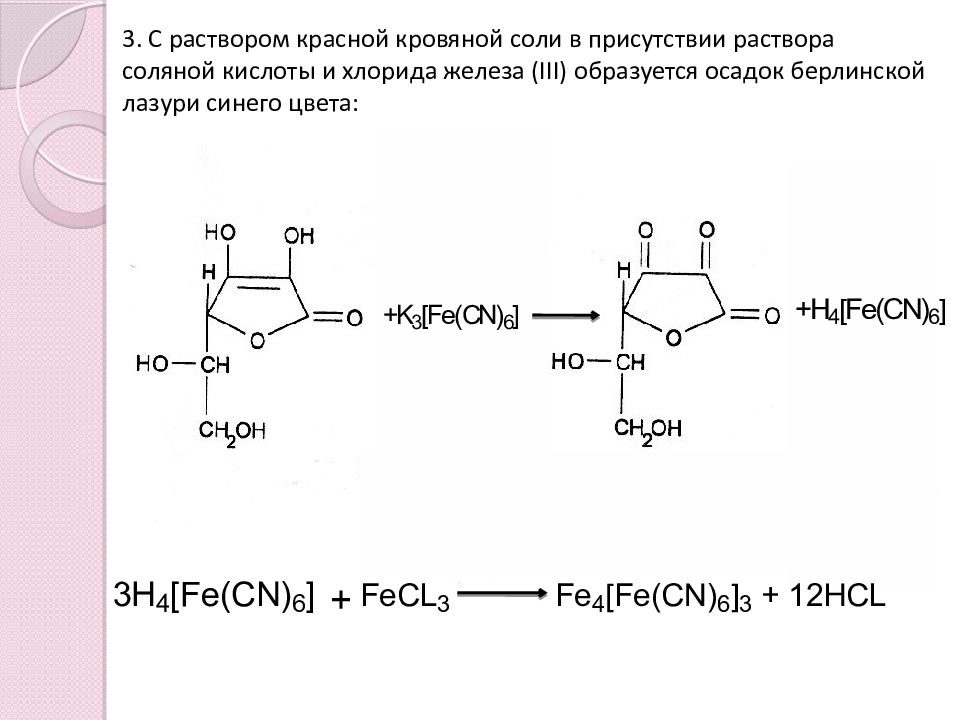
3. С раствором красной кровяной соли в присутствии раствора соляной кислоты и хлорида железа ( III ) образуется осадок берлинской лазури синего цвета:
Слайд 12: Испытание на чистоту:
В качестве допустимых примесей рассматривают сульфатную золу (не более 0,1%) и тяжелые металлы (не более 0,001%). Содержание органических примесей определяют после добавления к препарату концентрированной серной кислоты: окраска раствора через 30 мин не должна превышать окраску эталонного раствора, разведенного в соотношении 1:2 (ГФ). Обязателен тест на щавелевую кислоту (возможный продукт окисления).
Слайд 13: Методы количественного определения:
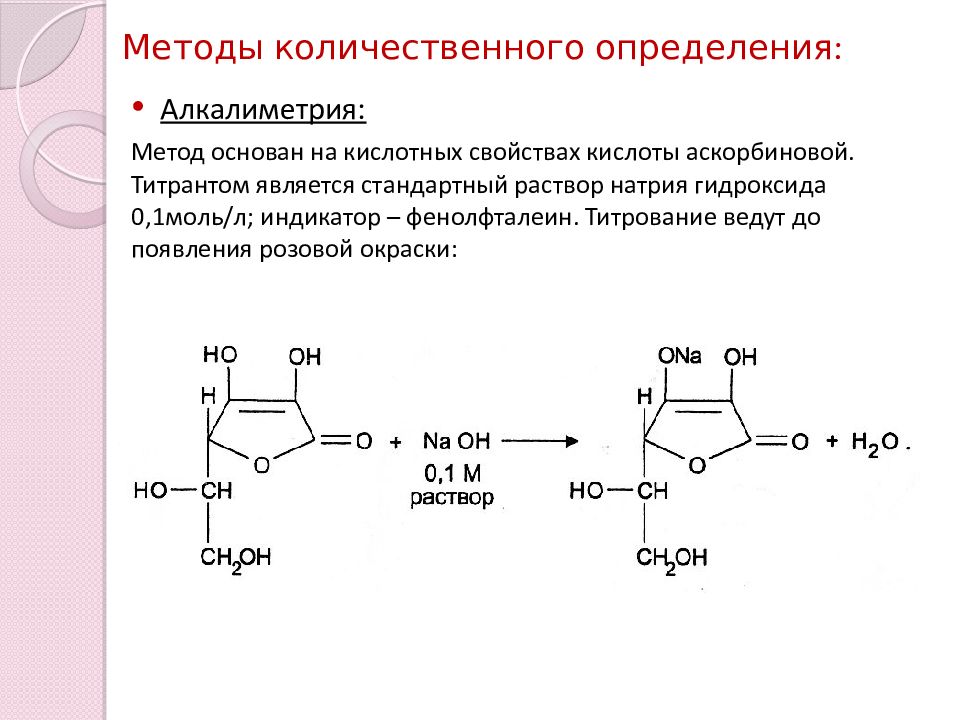
Алкалиметрия: Метод основан на кислотных свойствах кислоты аскорбиновой. Титрантом является стандартный раствор натрия гидроксида 0,1моль / л; индикатор – фенолфталеин. Титрование ведут до появления розовой окраски:
Слайд 14
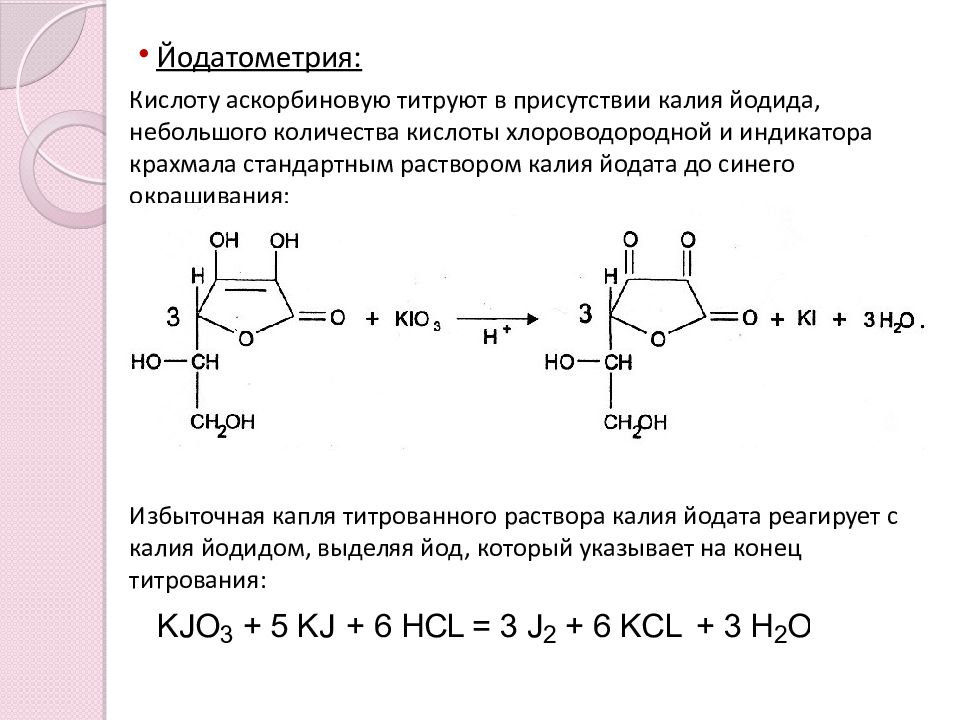
Йодатометрия : Кислоту аскорбиновую титруют в присутствии калия йодида, небольшого количества кислоты хлороводородной и индикатора крахмала стандартным раствором калия йодата до синего окрашивания: Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
Слайд 15
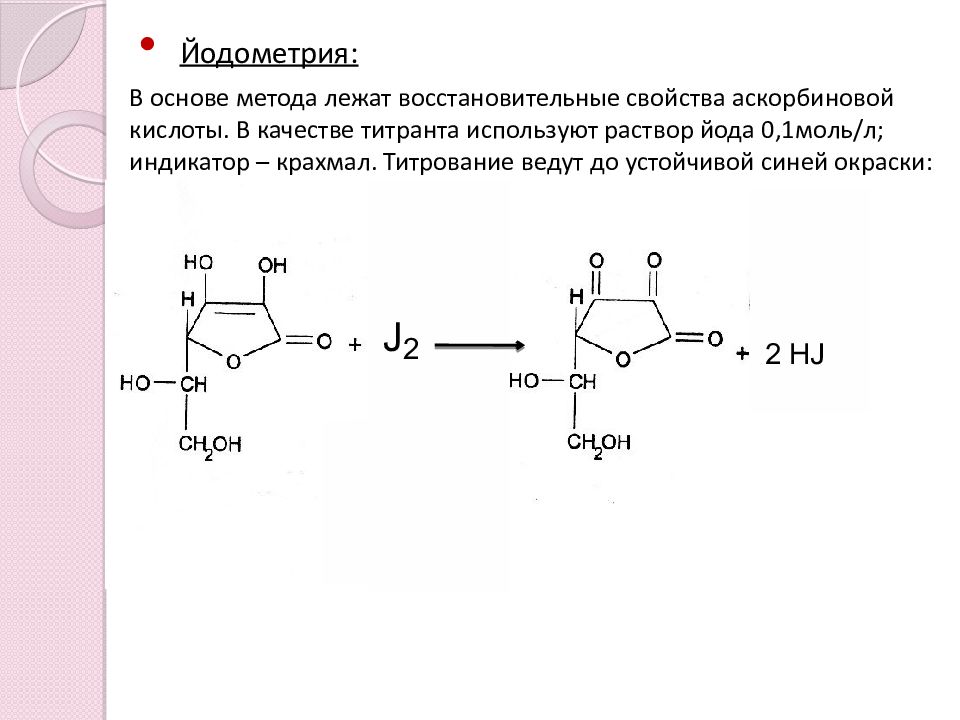
Йодометрия : В основе метода лежат восстановительные свойства аскорбиновой кислоты. В качестве титранта используют раствор йода 0,1моль / л; индикатор – крахмал. Титрование ведут до устойчивой синей окраски:
Слайд 16: Применение:
Витаминное средство, оказывает метаболическое действие, не образуется в организме человека, а поступает только с пищей. Участвует в регулировании окислительно-восстановительных процессов, углеводного обмена, свертываемости крови, регенерации тканей; повышает устойчивость организма к инфекциям, уменьшает сосудистую проницаемость, снижает потребность в витаминах B1, B2, А, Е, фолиевой кислоте, пантотеновой кислоте. Обладает антиагрегантными и выраженными антиоксидантными свойствами.
Слайд 17
Формы выпуска: порошок; таблетки; таблетки по с глюкозой (в профилактических целях), 5 % и 10 % растворы в ампулах по 1 и 2 мл (в лечебных целях). Хранение: порошок аскорбиновой кислоты - в хорошо укупоренной таре, предохраняющей от действия света, в сухом прохладном месте; таблетки и ампулы - в прохладном, защищенном от света месте.
Последний слайд презентации: Лекция № 20
Л итература Обязательная: Глущенко Н.Н., Плетнева Т.В., Попков В.А. Фармацевтическая химия. М.: Академия, 2004.- 384 с. 198-200 Государственная фармакопея Российской Федерации/ Издательство «Научный центр экспертизы средств медицинского применения», 2008.-704с.:ил. Дополнительная: 1. Государственная фармакопея 11 изд., вып. 2-М: Медицина, 1989. - 400 с. 2. Беликов В. Г. Фармацевтическая химия. – 3-е изд., М., МЕДпресс-информ - 2009, 616 с.:ил. 26.05.2013 18