Выполнила студентка АГМУ 053 группы Кузнецова Юлия Владиславовна
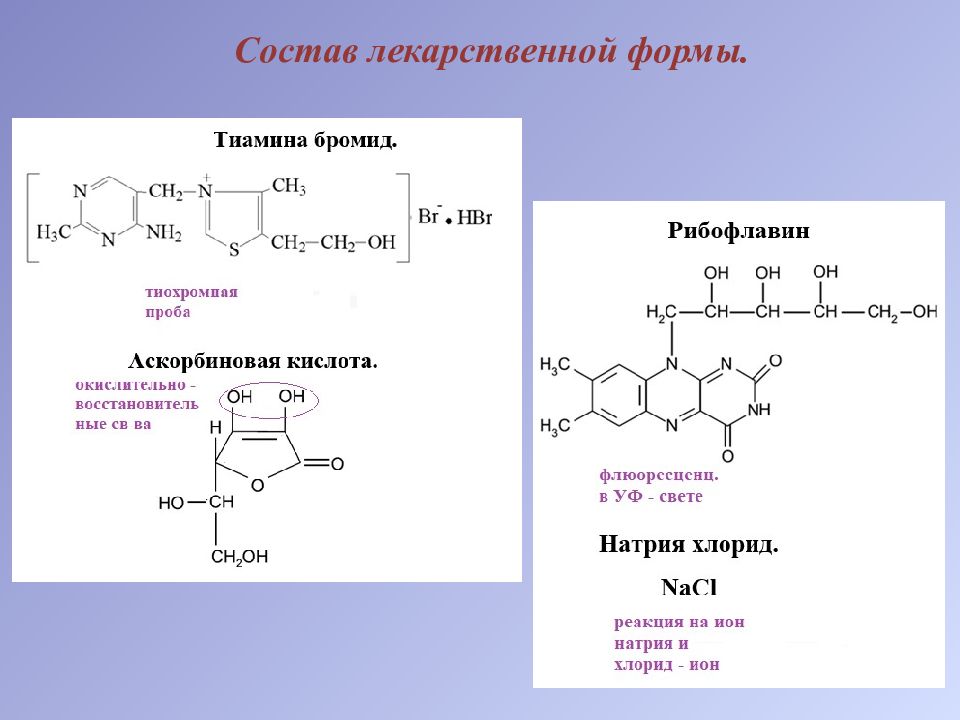
Слайд 2: Состав лекарственной формы
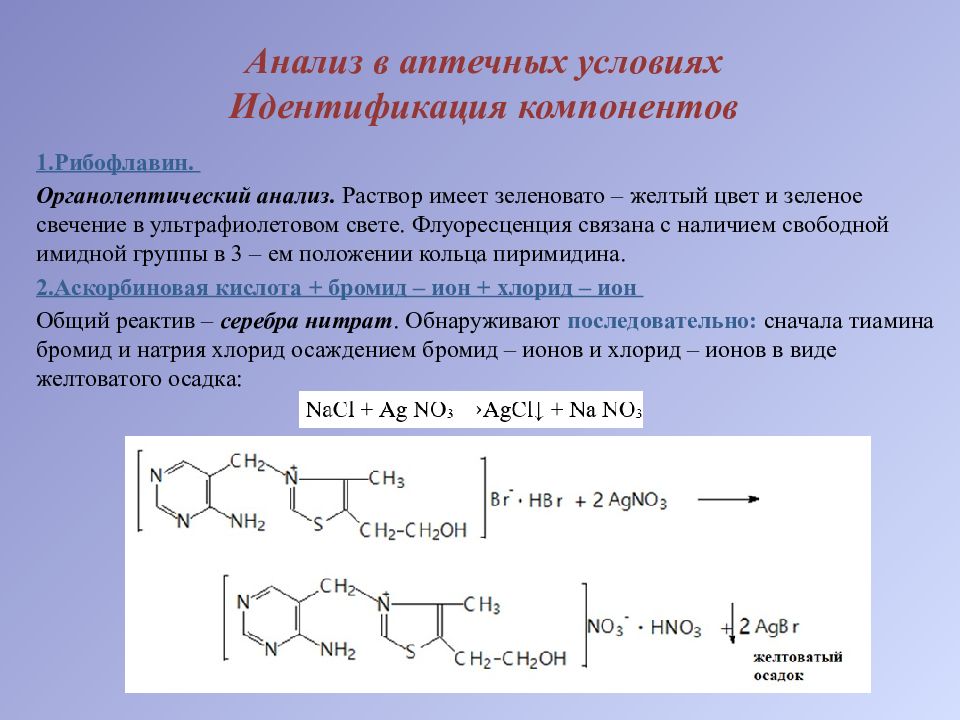
1.Рибофлавин. Органолептический анализ. Раствор имеет зеленовато – желтый цвет и зеленое свечение в ультрафиолетовом свете. Флуоресценция связана с наличием свободной имидной группы в 3 – ем положении кольца пиримидина. 2.Аскорбиновая кислота + бромид – ион + хлорид – ион Общий реактив – серебра нитрат. Обнаруживают последовательно: сначала тиамина бромид и натрия хлорид осаждением бромид – ионов и хлорид – ионов в виде желтоватого осадка:
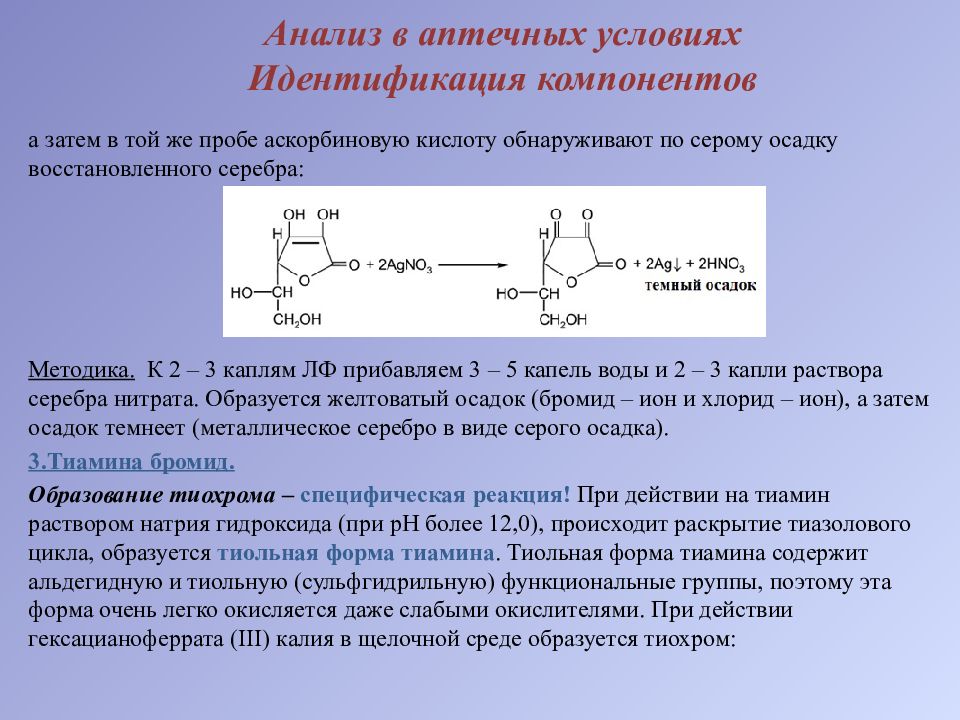
а затем в той же пробе аскорбиновую кислоту обнаруживают по серому осадку восстановленного серебра: Методика. К 2 – 3 каплям ЛФ прибавляем 3 – 5 капель воды и 2 – 3 капли раствора серебра нитрата. Образуется желтоватый осадок (бромид – ион и хлорид – ион), а затем осадок темнеет (металлическое серебро в виде серого осадка). 3.Тиамина бромид. Образование тиохрома – специфическая реакция! При действии на тиамин раствором натрия гидроксида (при рН более 12,0), происходит раскрытие тиазолового цикла, образуется тиольная форма тиамина. Тиольная форма тиамина содержит альдегидную и тиольную (сульфгидрильную) функциональные группы, поэтому эта форма очень легко окисляется даже слабыми окислителями. При действии гексацианоферрата ( III ) калия в щелочной среде образуется тиохром :
Слайд 5: Анализ в аптечных условиях Идентификация компонентов
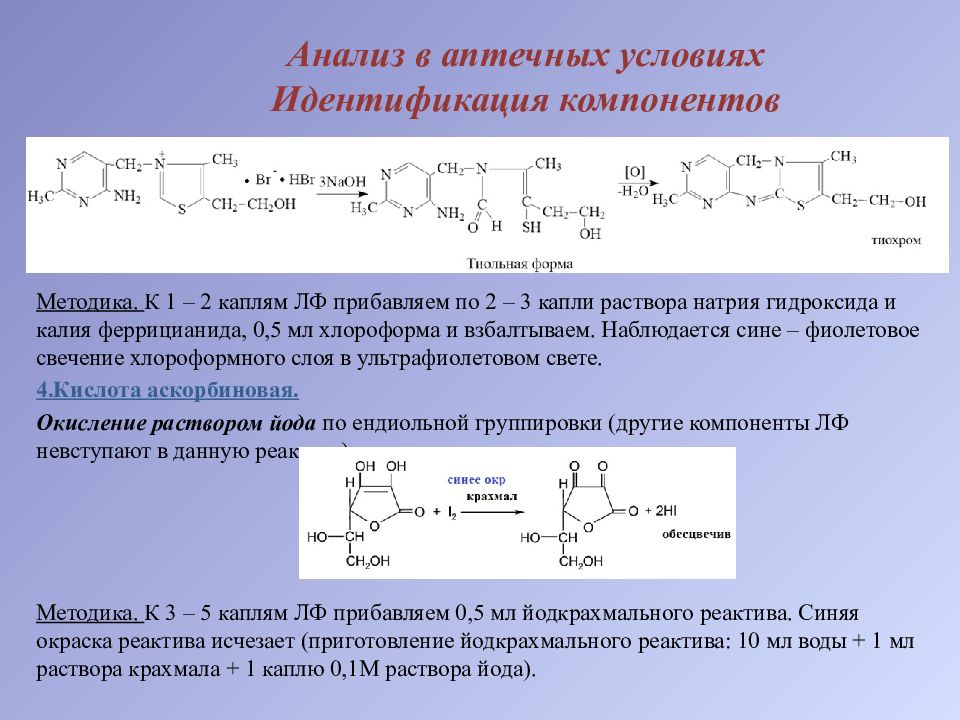
Методика. К 1 – 2 каплям ЛФ прибавляем по 2 – 3 капли раствора натрия гидроксида и калия феррицианида, 0,5 мл хлороформа и взбалтываем. Наблюдается сине – фиолетовое свечение хлороформного слоя в ультрафиолетовом свете. 4.Кислота аскорбиновая. Окисление раствором йода по ендиольной группировки (другие компоненты ЛФ невступают в данную реакцию): Методика. К 3 – 5 каплям ЛФ прибавляем 0,5 мл йодкрахмального реактива. Синяя окраска реактива исчезает (приготовление йодкрахмального реактива: 10 мл воды + 1 мл раствора крахмала + 1 каплю 0,1М раствора йода).
Слайд 6: Анализ в аптечных условиях Идентификация компонентов
Образования турнбулевой сини, основана на окислении кислоты аскорбиновой по ендиольной группировки железа (III) хлоридом (другие компоненты смеси данной реакции не дают): Методика. К 5 каплям раствора прибавляем по 2 капли растворов ферроцианида калия и железа (III) хлорида. Появляется синее окрашивание. 5.Ион натрия. Окрашивание пламени. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет.
Слайд 7: Анализ в аптечных условиях Количественное определение компонентов
Проводят без разделения компонентов. 1.Рибофлавин. ФЭК – измерение оптического поглощения раствора в видимой области спектра по собственной желтой окраски, т.е предварительные реакции окрашивания не проводим! Методика. К 0,5 мл ЛФ прибавляем 9,5 мл воды и измеряем оптическую плотность (А 1 ) полученного раствора при длине волны около 445 нм в кювете с толщиной слоя 10 мм. Раствор сравнения: вода. Параллельно измеряем оптическую плотность раствора (А 2 ), содержащего 2,5 мл 0,004% стандартного раствора рибофлавина (0,0001 г) и 7,5 мл воды. Содержание рибофлавина (X) в граммах вычисляем по формуле стандартного раствора: Х = А 1 • 0,0001 • 10 А 2 • 0,5 Где 0,5 – навеска, взятая на анализ, гр ; 10 – объем ЛФ, мл
Слайд 8: Анализ в аптечных условиях Количественное определение компонентов
2.Кислота аскорбиновая. Йодометрия. Аскорбиновая кислота окисляется по ендиольной группировке стандартным раствором йода в нейтральной, слабокислой или слабощелочной среде до кислоты дегидроаскорбиновой (индикатор — раствор крахмала) Методика. К 1 мл ЛФ прибавляем 1 мл воды и титруют 0,02 М раствором йода (А мл) до буро – синего окрашивания (индикатор — крахмал). Содержание кислоты аскорбиновой (X) в граммах вычисляем по формуле: Хг = 0,00176 ∙ А мл ∙ K ∙ 10 1,0 10 – объем ЛФ по прописи, мл; 1,0 – объем ЛФ, взятый на анализ, мл; А – объем 0,02М раствора йода, пошедшего на титрование, мл.
Слайд 9: Анализ в аптечных условиях Количественное определение компонентов
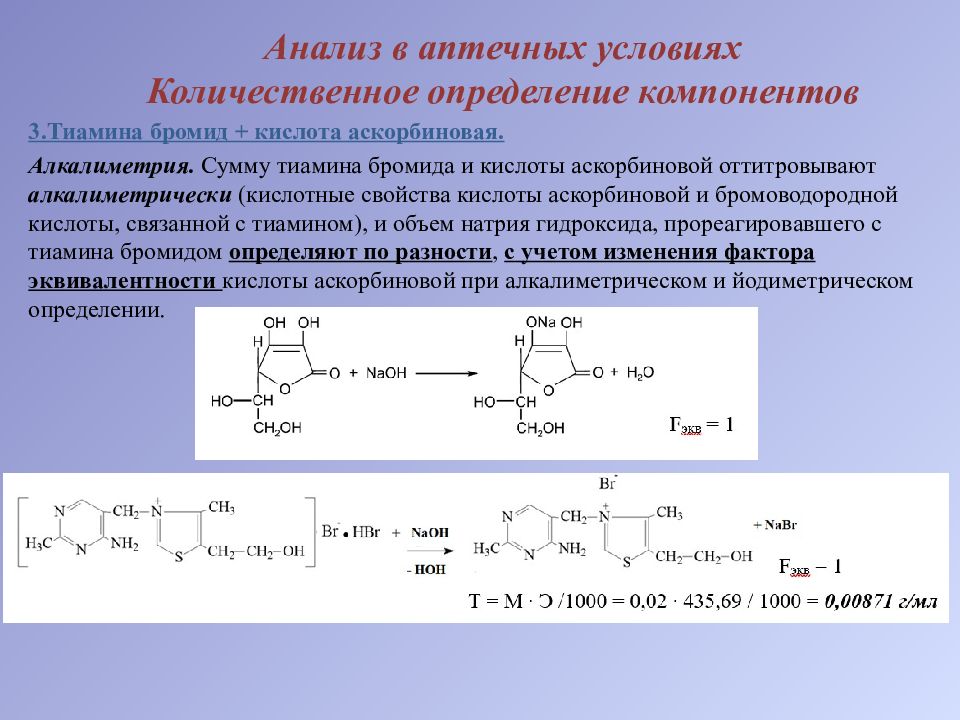
3.Тиамина бромид + кислота аскорбиновая. Алкалиметрия. Сумму тиамина бромида и кислоты аскорбиновой оттитровывают алкалиметрически (кислотные свойства кислоты аскорбиновой и бромоводородной кислоты, связанной с тиамином), и объем натрия гидроксида, прореагировавшего с тиамина бромидом определяют по разности, с учетом изменения фактора эквивалентности кислоты аскорбиновой при алкалиметрическом и йодиметрическом определении.
Слайд 10: Анализ в аптечных условиях Количественное определение компонентов
Методика. Титруем в 1 мл ЛФ сумму тиамина бромида и кислоты аскорбиновой 0,02 М раствором натрия гидроксида (Б мл) до появления розового окрашивания (индикатор – фенолфталеин). Количество 0,02М раствора натрия гидроксида, израсходованного на титрование тиамина бромида (Х мл) рассчитываем по разности: Х = Б – А /2 где А/2 – учет изменения эквивалентов кислоты аскорбиновой при алкалиметрическом титровании и йодометрическом. Содержание тиамина бромида (X) в граммах вычисляем по формуле: Хг = 0,00871 ∙ Х мл ∙ 10 1,0 10 – объем ЛФ по прописи, мл; 1,0 – объем ЛФ, взятый на анализ, мл; Х – объем 0,02М раствора натрия гидроксида, пошедшего на титрование только тиамина бромида, мл.
Слайд 11: Анализ в аптечных условиях Количественное определение компонентов
4.Натрия хлорид + тиамина бромид. Аргентометрия (видоизмененный метод Фольгарда ). Метод заключается во введении в анализируемый раствор 0,1 мл 0,1М раствора NH 4 SCN и железоаммониевых квасцов для получения роданида железа, имеющего кроваво – красную окраску и последующим прямым титрованием серебра нитратом. После осаждения бромидов серебра нитрат будет взаимодействовать с роданидом железа. В точке эквивалентности красная окраска исчезает, но расход титранта будет завышен на 0,1 мл, то есть, на объем раствора аммония роданида, который был введен для образования индикатора. Поэтому в расчетах из объема серебра нитрата, израсходованного на титрование, вычитают 0,1 мл 0,1М раствора NH4SCN.
Слайд 12: Анализ в аптечных условиях Количественное определение компонентов
Методика. К 1 мл ЛФ прибавляем по 1 мл разведенной кислоты азотной и железо – аммониевых квасцов, 0,1 мл 0,1М раствора роданида аммония и титруем сумму галогенидов (хлорид – ион + бромид – ион) раствором серебра нитрата (В мл) до исчезновения красной окраски. Количество 0,1М раствора серебра нитрата, израсходованного на титрование только натрия хлорида (Х 1 ) рассчитываем по разности: Х 1 = В – 0,1 – Х / 5 где В – объем раствора серебра нитрата, пошедший на титрование суммы галогенидов, мл; 0,1 – объем взятого на анализ 0,1М раствора роданида аммония, мл; Х – количество 0,02М раствора натрия гидроксида, израсходованного на титрование тиамина бромида, мл; 5 – учет разности молярности титрантов (0,1М / 0,02 М = 5 раз) Содержание натрия хлорида (X) в граммах вычисляем по формуле: Хг = 0,005844 ∙ Х 1 ∙ 10 1,0 10 – объем ЛФ по прописи, мл; 1,0 – объем ЛФ, взятый на анализ, мл; Х 1 – количество 0,1М раствора серебра нитрата, израсходованного на титрование только натрия хлорида, мл
Слайд 13: Анализ в лабораторных условиях
Метод ТСХ основан на способности жидкой фазы, продвигающейся по слою сорбента (силикагель), перемещать компоненты разделяемой смеси с разными скоростями. Положение пятен разделяемых витаминов на хроматограмме характеризуют значением Rf. Ход опыта. В угол силуфоловой пластинки на расстоянии 2 см от каждой стороны наносят раствор ЛФ и стандартные образцы (растворов тиамина, аскорбиновой кислоты и рибофлавина). Используют подвижную фазу (бензол – этанол – уксусная кислота – ацетон; 70:20:5:5), затем подсушивают и выявляют пятна отдельных витаминов в ультрафиолетовом свете, используя значения Rf
Слайд 14: Анализ в лабораторных условиях
Определение подлинности (идентификация) 1. Раствор имеет зеленовато – желтый цвет и зеленое свечение в ультрафиолетовом свете ( рибофлавин ) 2. К 1 – 2 каплям ЛФ прибавляем по 2 – 3 капли раствора натрия гидроксида и калия феррицианида, 0,5 мл хлороформа и взбалтываем. Наблюдается сине – фиолетовое свечение хлороформного слоя в ультрафиолетовом свете ( тиамин ) 3. К 3 – 5 каплям ЛФ прибавляем 0,5 мл йодкрахмального реактива. Синяя окраска реактива исчезает ( кислота аскорбиновая ) 5. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет ( ион натрия ) Подлинность и количественное содержание (ВЭЖХ). Высокоэффективная жидкостная хроматография является удобным, быстрым способом разделения, и проведения качественного и количественного анализа. Исследуемый образец вводят в колонку хроматографа. Анализируя полученную хроматограмму, идентифицируют вещества и рассчитывают их количество. Идентификацию проводят по параметрам удерживания, сравнивая их с параметрами удерживания стандартов. Определяют время от момента ввода пробы до появления максимума пика на хроматограмме
Последний слайд презентации: КУРСОВАЯ РАБОТА ЛФ состава: Рибофлавина Тиамина бромида по 0,002 Кислоты: Анализ в лабораторных условиях
Параметры удерживания анализируемых веществ должны совпасть с параметрами удерживания стандартных образцов. Количественное содержание ингредиентов лекарственного препарата прямо пропорционально высоте или площади пиков. Количество действующих веществ определяем по площади пиков, используя расчетную формулу: Х = S ∙ a ст ∙ в S ст ∙ а где S – площадь пика определяемого компонента на хроматограмме испытуемого раствора; Sст – площадь пика определяемого компонента на хроматограмме раствора РСО; a ст – навеска РСО (г); a – навеска порошка (г); в – средняя масса ЛФ.