Слайд 2
I. Исторические сведения II. Марганец – химический элемент: 1. Положение марганца в периодической системе химических элементов Д.И.Менделеева 2. Строение атома. III. Марганец – простое вещество 3. Нахождение в природе 1. Состав. Физические свойства. 2. Получение. 3. Химические свойства 4. Биологическая роль 5. Применение IV. Соединения марганца
Слайд 3
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». 1774 г. шведский химик К.Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда). Карл Вильгельм Шееле 09.12. 1742 г. – – 21.05 1786 г. 19.08.1745 — – 08.12 1818 Юхан Готлиб Ган
Слайд 6
Положение марганца в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Mn металл 25 4 VII B +25 4 2 2 8 валентные электроны 1 3 1 s 2 2 s 2 2 p 6 4 s 2 3 s 2 3 p 6 3 d 5 Mn 0 ─ 2e → Mn +2 Mn 0 ─ 3 e → Mn +3 Mn 0 ─ 7e → Mn +7 Mn 0 ─ 4 e → Mn +4
Слайд 7
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Марганец, рассеянный в горных породах вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10 −7 —10 −6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO 2 · x H 2 O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности. Распространение в природе
Слайд 8
пиролюзит Mn О 2 x H 2 O, самый распространённый минерал (содержит 63,2 % марганца); манганит (бурая манганцевая руда) MnO (OH) (62,5 % марганца); браунит 3 Mn 2 O 3 ·MnSiO 3 (69,5 % марганца); гаусманит ( Mn II Mn 2 III )O 4 родохрозит (марганцевый шпат, малиновый шпат) MnCO 3 (47,8 % марганца); псиломелан m MnO • MnO 2 • n H 2 O (45-60 % марганца); пурпурит ( Mn 3+ [PO 4 ]), 36,65 % марганца. Минералы марганца 1 2 4 5 6 7 3
Слайд 10
Марганец твёрдый, хрупкий металл светло-серого цвета t плавления = 1247°С t кипения = 2080°С плотность = 7,2 г/см 3 На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn 3 O 4 и внутреннего слоя состава MnO. Физические свойства
Слайд 11
1. Алюминотермическим методом, восстанавливая оксид Mn 2 O 3, образующийся при прокаливании пиролюзита: 4MnO 2 → 2Mn 2 O 3 + О 2 Mn 2 O 3 + 2Al → 2 Mn + Al 2 O 3 2. Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (80 % Mn ). 3. Чистый металлический марганец получают электролизом. MnSO 4 + 2H 2 O Mn + H 2 + O 2 + H 2 SO 4 Получение марганца. электролиз MnO 2 (пиролюзит) + 2C = Mn + 2CO
Слайд 12
Химические свойства Li,K,Ba,Ca,Na,Mg, Al, Zn,Cr Fe Co,Sn,Pb, H 2, Cu, Hg,Ag,Au Mn Mn + + + H 2 SO 4 (конц.) ; HNO 3 + О 2 ; неметаллы растворы HCl, H 2 SO 4 H 2 O + оксиды металлов
Слайд 13
Взаимодействие марганца с неметаллами Марганец при взаимодействии с неметаллами, дает продукты со степенью окисления +2. Составьте уравнения реакций марганца с кислородом, серой, фосфором, азотом, хлором, кремнием: 2Mn + O 2 = 2MnO 3Mn + 2P = Mn 3 P 2 Mn + S = MnS также образуются Mn 2 O 3 и Mn 3 O 4 3Mn + N 2 = Mn 3 N 2 Mn + Cl 2 = MnCl 2 2Mn + Si = Mn 2 Si
Слайд 14
При нагревании марганец взаимодействует с водой Составьте уравнение реакции марганца с водой. Рассмотрите данную реакцию как окислительно-восстановительную: Mn 0 + H 2 +1 O → Mn +2 (OH) 2 + H 2 0 t Mn 0 – 2e → Mn +2 1 восстановитель, окисление 2H +1 + 2e → H 2 0 1 окислитель, восстановление Mn + 2 H 2 O = Mn(OH) 2 + H 2 t
Слайд 15
Li,K,Ba,Ca,Na,Mg, Al, Zn,Cr Fe Co,Sn,Pb, H 2, Cu, Hg,Ag,Au Mn В электрохимическом ряду напряжений металлов марганец находится между алюминием и цинком, поэтому растворяется в кислотах, у которых окислителем является ион водорода, образуя соли марганца ( II): Составьте уравнение реакции марганца с растворами кислот: серной и соляной. Рассмотрите данные реакции с точки зрения ТЭД: Mn + H 2 SO 4 = MnSO 4 + H 2 Mn + 2HCl = MnCl 2 + H 2 Mn + 2H + = Mn 2+ + H 2
Слайд 16
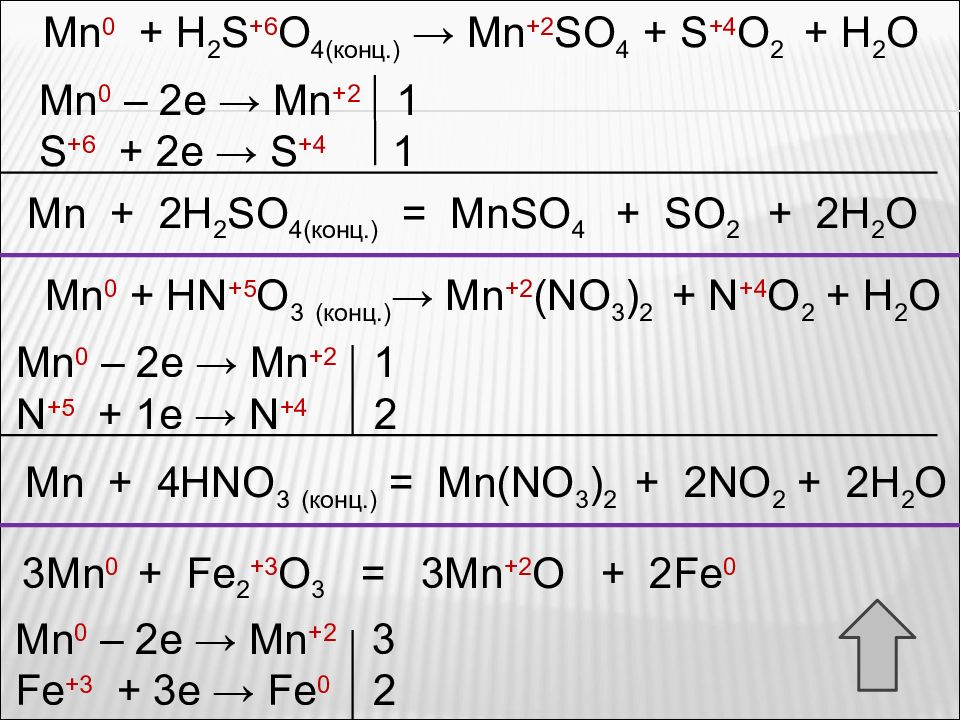
С концентрированной серной кислотой марганец реагирует при нагревании: С концентрированной азотной кислотой марганец реагирует при обычных условиях: Рассмотрите реакции как окислительно-восстановительные. Расставьте коэффициенты. Mn + H 2 SO 4( конц.) → MnSO 4 + SO 2 + H 2 O Mn + HNO 3 (конц.) → Mn(NO 3 ) 2 + NO 2 + H 2 O t Марганец может восстанавливать оксиды многих металлов. Это его свойство используется в металлургии при выплавке сталей. Mn + Fe 2 O 3 → MnO + Fe t
Слайд 17
Mn 0 + H 2 S +6 O 4( конц.) → Mn +2 SO 4 + S +4 O 2 + H 2 O Mn 0 – 2e → Mn +2 1 S +6 + 2e → S +4 1 Mn + 2H 2 SO 4( конц.) = MnSO 4 + SO 2 + 2H 2 O Mn 0 + HN +5 O 3 (конц.) → Mn +2 (NO 3 ) 2 + N +4 O 2 + H 2 O Mn 0 – 2e → Mn +2 1 N +5 + 1e → N +4 2 Mn + 4HNO 3 (конц.) = Mn(NO 3 ) 2 + 2NO 2 + 2H 2 O 3Mn 0 + Fe 2 +3 O 3 = 3Mn +2 O + 2Fe 0 Mn 0 – 2e → Mn +2 3 Fe +3 + 3e → Fe 0 2
Слайд 18
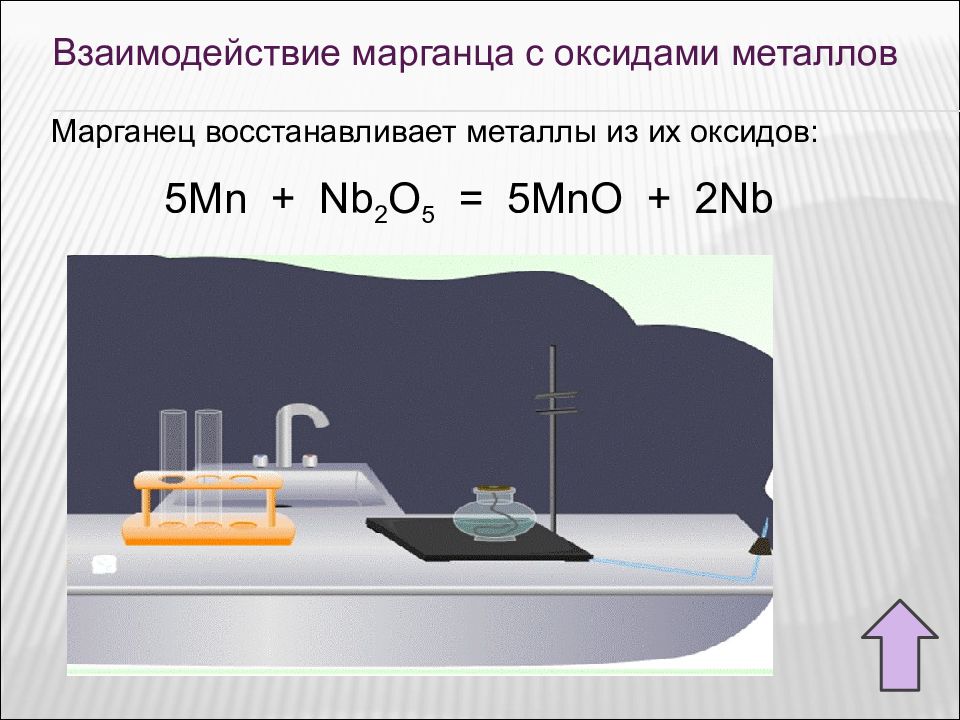
Взаимодействие марганца с оксидами металлов Марганец восстанавливает металлы из их оксидов: 5Mn + Nb 2 O 5 = 5MnO + 2Nb
Слайд 19
M арганец — микроэлемент, постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия). Однако избыток марганца для человеческого организма вреден. При отравлении соединениями марганца происходит поражение нервной системы, развивается так называемый марганцевый паркинсонизм. Биологическая роль
Слайд 20
Применение марганца 1 черная металлургия легирование сталей производство ферритных материалов Покрытия из марганца на металлических поверхностях использование в сплавах 2 3 4 5
Слайд 21
1 Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других).
Слайд 22
Марганец используют для легирования сталей, т. е. улучшения их механических и коррозионных свойств. 2
Слайд 23
Марганец применяется также в медных, алюминиевых и магниевых сплавах. Ферромарганец является сплавом железа и марганца 3
Слайд 24
Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn 2 (CO) 10. 4
Слайд 25
Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений. 5
Слайд 26
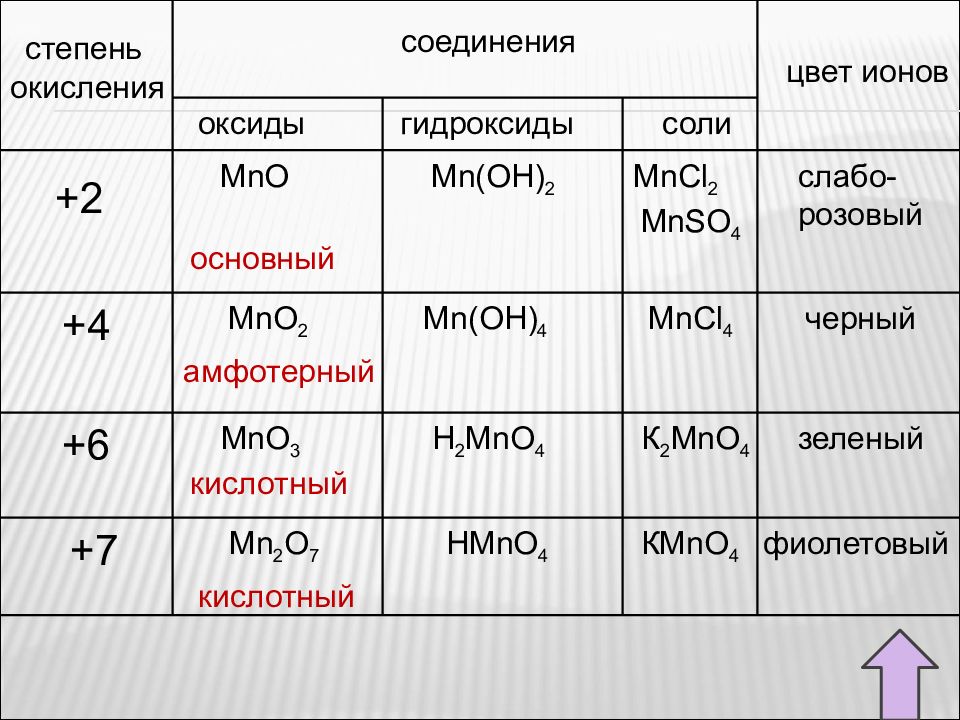
Соединения марганца Соединения марганца ( II) Соединения марганца (IV) Соединения марганца (VII) оксид гидроксид соли оксид соли гидроксид оксид Соединения марганца ( VI)
Слайд 27
Соединения марганца (II) MnO Оксид марганца ( II ) – кристаллы зеленовато- серого цвета. В воде не растворим. Температура плавления 1569 °C. Температура кипения 3127 °C. Получают оксид марганца ( II ) восстановлением других оксидов марганца водородом, алюминием или оксидом углерода ( II ): Mn 2 O 3 + 3H 2 = 2Mn + 3H 2 O Mn 2 O 3 + 2Al = 2Mn + Al 2 O 3 MnO 2 + 2 H 2 = Mn + 2 H 2 O MnO 2 + 2 CO = Mn + 2 CO 2 Mn 2 O 3 + 3 CO = 2Mn + 3 CO 2
Слайд 28
Химические свойства Оксид марганца – основный оксид Перечислите свойства характерные для основных оксидов Составьте уравнения реакций оксида марганца ( II ) с оксидом кремния ( IV ),оксидом азота ( V), соляной кислотой : MnO + SiO 2 = MnSiO 3 MnO + 2HCl = MnCl 2 + H 2 O MnO + 2H + = Mn 2+ + H 2 O MnO + N 2 O 5 = Mn(NO 3 ) 2
Слайд 29
Mn(OH) 2 Гидроксид марганца ( II) Гидроксид марганца(II) — студнеобразный светло-розовый осадок. Нерастворим в воде. Получение. Гидроксид марганца ( II ) получают при действии раствора щелочи на растворы солей Mn 2+ MnSO 4 + 2NaOH = ↓Mn(OH) 2 + Na 2 SO 4 Mn 2+ + 2OH – = ↓Mn(OH) 2
Слайд 30
Химические свойства Гидроксид марганца (II) обладает основными свойствами. Перечислите свойства характерные для оснований Составьте уравнения реакций гидрооксида марганца ( II ) с оксидом серы ( VI ), соляной кислотой : Mn ( OH) 2 + SO 3 = MnSO 4 Mn ( OH) 2 + 2HCl = MnCl 2 + 2H 2 O Mn ( OH) 2 + 2H + = Mn 2+ + 2H 2 O
Слайд 31
Гидроксид марганца (II) легко окисляется на воздухе до бурого оксогидроксида марганца, который далее разлагается на оксид марганца (IV) Mn(OH) 2 + 1 / 2O 2 + H 2 O → MnO(OH) 2 → MnO 2
Слайд 32
Гидроксид марганца (II) обладает восстановительными свойствами. В присутствии сильных окислителей он может окисляться до перманганата: Mn(OH) 2 + KBrO + KOH → KMnO 4 + KBr + H 2 O Рассмотрите реакцию как окислительно-восстановительную. Расставьте коэффициенты. Mn +2 (OH) 2 + KBr +1 O + KOH → KMn +7 O 4 + KBr – 1 + H 2 O Mn +2 – 5 e → Mn + 7 2 Br +1 + 2e → Br –1 5 2Mn(OH) 2 + 5KBrO + 2KOH = 2KMnO 4 + 5KBr + 3H 2 O окисление, восстановитель восстановление, окислитель
Слайд 33
Сульфат марганца (II) — белый, при прокаливании плавится и разлагается. Кристаллогидрат MnSO 4 · 5H 2 O — красно-розовый, техническое название марганцевый купорос. Хорошо растворим в воде, Применяется для получения Mn, MnO 2 и других соединений марганца, как микроудобре- ние и аналитический реагент. Соли марганца (II)
Слайд 34
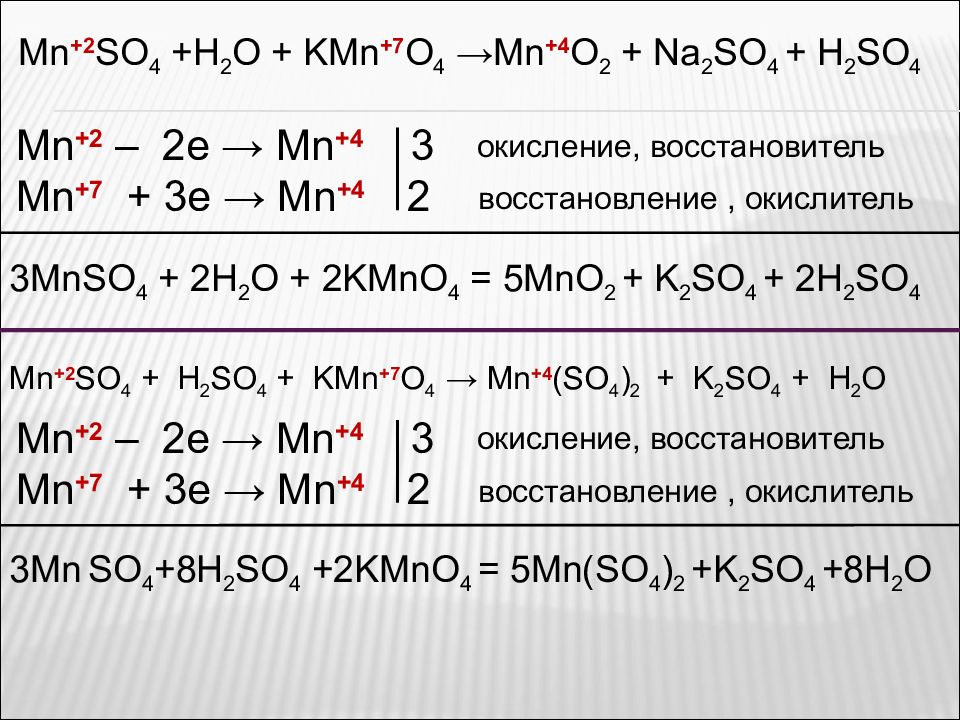
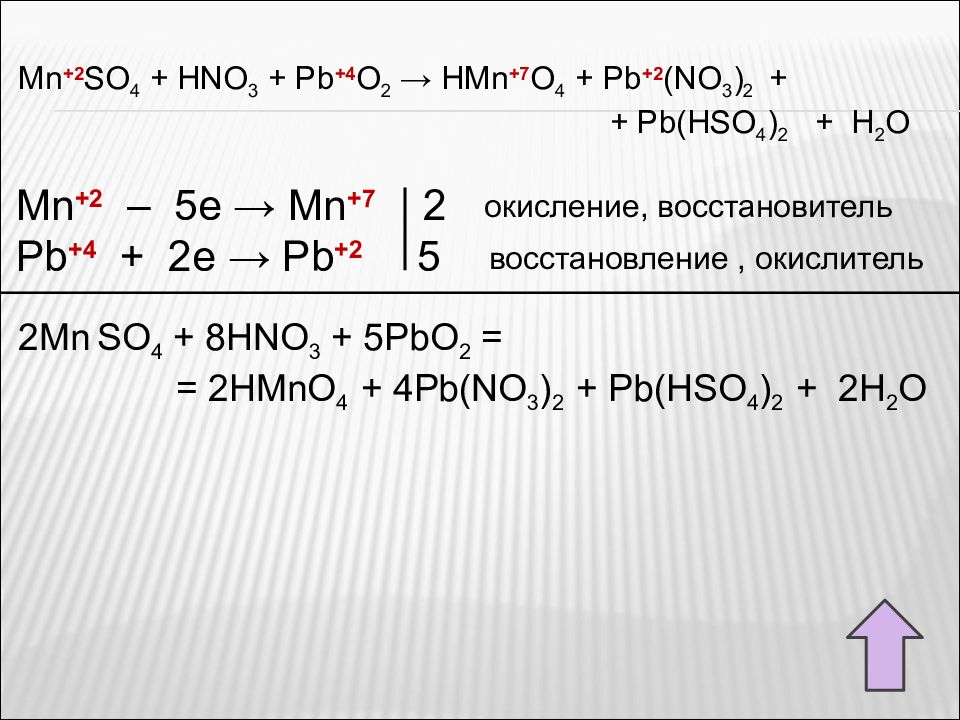
Реагирует со щелочами, гидратом аммиака. MnSO 4 + 2(NH 3 ·H 2 O) = Mn(OH) 2 ↓ + (NH 4 ) 2 SO 4 Слабый восстановитель, реагирует с типичными окислителями. MnSO 4 + 2NaOH = Mn(OH) 2 ↓ + Na 2 SO 4 MnSO 4 + H 2 O + KMnO 4 → MnO 2 + K 2 SO 4 + H 2 SO 4 MnSO 4 + H 2 SO 4 + KMnO 4 → Mn(SO 4 ) 2 + K 2 SO 4 + H 2 O MnSO 4 + HNO 3( конц.) + PbO 2 → HMnO 4 + Pb(NO 3 ) 2 + Pb(HSO 4 ) 2 + + H 2 O Рассмотрите реакции как окислительно-восстановительные. Расставьте коэффициенты.
Слайд 35
Mn +2 SO 4 +H 2 O + KMn +7 O 4 →Mn +4 O 2 + Na 2 SO 4 + H 2 SO 4 Mn +2 – 2e → Mn + 4 3 Mn +7 + 3e → Mn +4 2 3MnSO 4 + 2H 2 O + 2KMnO 4 = 5MnO 2 + K 2 SO 4 + 2H 2 SO 4 окисление, восстановитель восстановление, окислитель Mn +2 SO 4 + H 2 SO 4 + KMn + 7 O 4 → Mn + 4 (SO 4 ) 2 + K 2 SO 4 + H 2 O Mn +2 – 2e → Mn + 4 3 Mn +7 + 3e → Mn +4 2 3Mn SO 4 +8H 2 SO 4 +2KMnO 4 = 5Mn(SO 4 ) 2 +K 2 SO 4 +8H 2 O окисление, восстановитель восстановление, окислитель
Слайд 36
Mn +2 SO 4 + HNO 3 + Pb + 4 O 2 → HMn +7 O 4 + Pb +2 (NO 3 ) 2 + + Pb(HSO 4 ) 2 + H 2 O Mn +2 – 5e → Mn +7 2 Pb +4 + 2e → Pb +2 5 2Mn SO 4 + 8HNO 3 + 5PbO 2 = = 2HMnO 4 + 4Pb(NO 3 ) 2 + Pb(HSO 4 ) 2 + 2H 2 O окисление, восстановитель восстановление, окислитель
Слайд 37
Оксид марганца(IV) (диоксид марганца) MnO 2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Слайд 38
В лабораторных условиях получают термическим разложением перманганата калия 2KMnO 4 → MnO 2 + K 2 MnO 4 + O 2 ↑ Также можно получить реакцией перманганата калия с пероксидом водорода. 2KMnO 4 + H 2 O 2 = 2KOH + 2MnO 2 + 2O 2 При температуре выше 100 °C перманганат калия восстанавливается водородом: 2KMnO 4 + 2H 2 = K 2 MnO 4 + MnO 2 + 2H 2 O Получение диоксида марганца t° опыт
Слайд 39
Химические свойства диоксида марганца Диоксид марганца проявляет амфотерные свойства и поэтому сплавляется с щелочами, образуя манганиты, если реакция проводится без доступа воздуха: MnO 2 + 2KOH = K 2 MnO 3 + H 2 O Если реакция проводится в присутствии кисло- рода воздуха, который играет роль окислителя, то образуется манганат: 2 MnO 2 + 4 KOH + O 2 = 2 K 2 MnO 4 + 2 H 2 O Полученный манганат самопроизвольно разлагается и образу- ет перманганат калия и оксид марганца( IV ) : 3 K 2 MnO 4 + 2 H 2 O = 2 KMnO 4 + MnO 2 + 4KOH
Слайд 40
При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора: 4HCl + MnO 2 = MnCl 2 + 2H 2 O + Cl 2 ↑ С серной и азотной кислотами MnO 2 разлагается с выделением кислорода: 2MnO 2 + 2H 2 SO 4 = 2MnSO 4 + O 2 + 2H 2 O Окислительные свойства усиливаются в кислотной c реде 2MnO 2 + 2 FeSO 4 +2H 2 SO 4 = MnSO 4 + Fe 2 (SO 4 ) 3 + 2H 2 При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn 7+ и Mn 6+ : 3MnO 2 + KClO 3 +6KOH = 3K 2 MnO 4 + KCl + 3H 2 O. опыт
Слайд 42
Существенно ускорять химические реакции могут некоторые вещества ‑ катализаторы. Пероксид водорода медленно разлагается на кислород и воду. Диоксид марганца значительно ускоряет реакцию, кислорода выделяется значительно больше. Значит диоксид марганца – катализатор реакции разложения пероксида водорода. катализатор ( MnO 2 ) Н 2 О 2 2Н 2 О + О 2 опыт
Слайд 43
Наиболее характерными соединениями Mn(VI) являются манганаты – соли марганцоватой кислоты Н 2 Mn О 4. Кислота и ее соли неустойчивы. В 19 веке раствор манганата калия называли «минеральным хамелеоном»: при стоянии он менял цвет с ярко-зеленого, соответствующего иону Mn О 4 2–, на фиолетовую (цвет иона Mn О 4 – ) 3K 2 MnO 4 + 3H 2 O = 2KMnO 4 + MnO 2 · H 2 O↓ + 4KOH зеленый фиолетовый MnO 2 + K 2 CO 3 + KNO 3 = K 2 MnO 4 + KNO 2 + CO 2 ↑ MnO 2 + 2KOH + KNO 3 = K 2 MnO 4 + KNO 2 + H 2 O 3MnO 2 + 3K 2 CO 3 + KClO 3 = 3K 2 MnO 4 + KCl + 3CO 2 ↑ Соединения марганца ( VI) или восстановлением перманганата калия в щелочной среде 2KMnO 4 + Na 2 SO 3 + 2KOH = K 2 MnO 4 + Na 2 SO 4 Манганаты получают окислением оксида марганца ( VII)
Слайд 44
Манганат калия — соль темно-зеленого цвета. Плавится под избыточным давлением кислорода. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону MnO 4 2−. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства. K 2 MnO 4
Слайд 45
Химические свойства манганата калия Поскольку атом марганца ( VI ) в манганатах находится в промежуточной степени окисления, то он может как повышать, так и понижать ее. K 2 MnO 4 + KI + H 2 O → MnO 2 + I 2 + KOH K 2 MnO 4 + Cl 2 → KMnO 4 + KCl Рассмотрите реакции как окислительно-восстановительные. Определите окислитель и восстановитель K 2 MnO 4 + H С l → KMnO 4 + MnO 2 + KCl + H 2 O
Слайд 46
K 2 Mn + 6 O 4 + KI – 1 + H 2 O → Mn +4 O 2 + I 2 0 + KOH Mn + 6 + 2e → Mn + 4 1 2 I – 1 – 2e → I 2 0 1 K 2 MnO 4 + 2KI + H 2 O = MnO 2 + I 2 + 4KOH K 2 MnO 4 (за счет Mn + 6 ) – окислитель, процесс восстановления KI (за счет I – 1 ) – восстановитель, процесс окисления K 2 Mn + 6 O 4 + Cl 2 0 → KMn +7 O 4 + KCl – 1 Mn + 6 – 1e → Mn +7 2 Cl 2 0 + 2e → 2 Cl – 1 1 2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KCl K 2 MnO 4 (за счет Mn + 6 ) – восстановитель, процесс окисления Cl 2 0 – окислитель, процесс восстановления
Слайд 47
K 2 Mn + 6 O 4 + H С l → KMn + 7 O 4 + Mn + 4 O 2 + KCl + H 2 O Mn + 6 – 1e → Mn +7 2 Mn + 6 + 2e → Mn +4 1 3K 2 MnO 4 + 4H С l = 2KMnO 4 + MnO 2 + 4KCl + 2H 2 O K 2 MnO 4 (за счет Mn + 6 ) – восстановитель, процесс окисления K 2 MnO 4 (за счет Mn + 6 ) – окислитель, процесс восстановления
Слайд 48
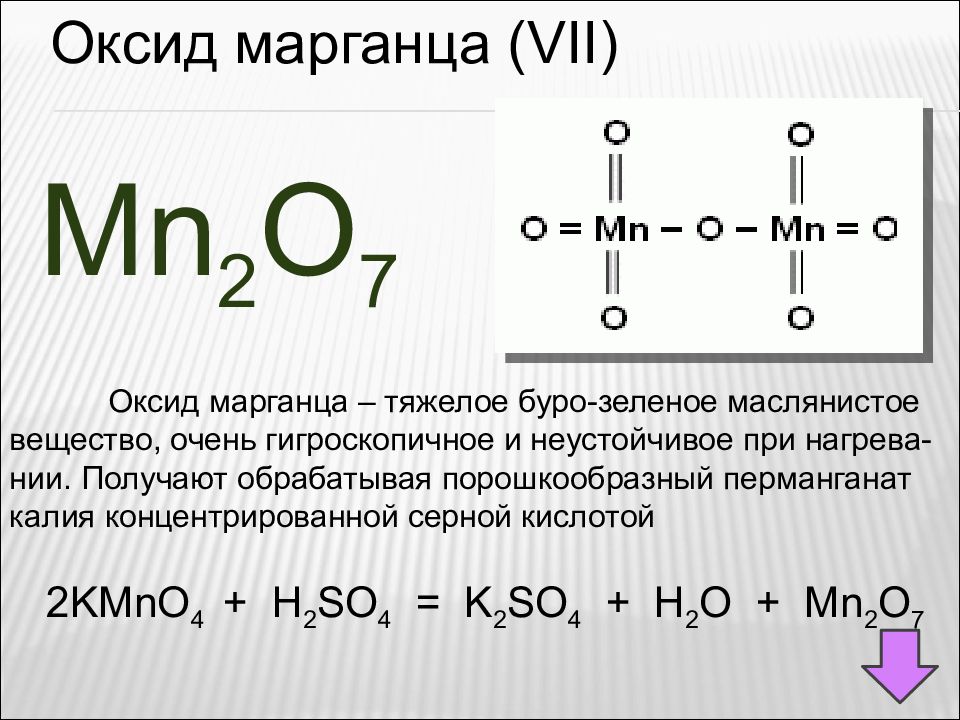
Оксид марганца ( VII ) Mn 2 O 7 Оксид марганца – тяжелое буро-зеленое маслянистое вещество, очень гигроскопичное и неустойчивое при нагрева- нии. Получают обрабатывая порошкообразный перманганат калия концентрированной серной кислотой 2KMnO 4 + H 2 SO 4 = K 2 SO 4 + H 2 O + Mn 2 O 7
Слайд 49
2Mn 2 O 7 = 4MnO 2 + 3O 2 + Q Оксид марганца () настолько неустойчив, что взрывается при простом встряхивании или при нагревании выше 55°С. В неподвижном состоянии при комнатной температуре сравни- тельно устойчив. Оксид марганца ( VII ) сильнейший окислитель, он поджигает любые вещества – при контакте с ним они воспламеняются
Слайд 50
При попадании кристаллов перманганата калия в серную кислоту образуется марганцевый ангидрид (оксид марганца ( VII ) - очень сильный окислитель. Он взаимодействует с этиловым спиртом. При этом образуется уксусный альдегид. опыт Окисление оксидом марганца ( VII ) этилового спирта
Слайд 51
Марганцовая кислота HMnO 4 Марганцо́вая кислота́ — сильная кислота. В чистом виде не выделена, существует в виде раствора. Максимальная концентрация в водном растворе составляет 20 %. Растворы марганцовой кислоты имеют фиолетовую окраску. При температуре ниже 20 °C образует кристаллогидрат HMnO 4 · 2H 2 O Марганцовая кислота может быть получена взаимодействием оксида марганца(VII) с водой на холоде: Mn 2 O 7 + H 2 O = 2HMnO 4 Соли марганцовой кислоты называются перманганаты. Самым известным производным марганцовой кислоты является перманганат калия (марганцовка).
Слайд 52
Химические свойства HMnO 4 Марганцовая кислота в растворе медленно разлагается, при этом выделяется кислород и выпадает осадок диоксида марганца. Составьте уравнение реакции. 4HMnO 4 = 4MnO 2 + 3O 2 + 2H 2 O Проявляет общие для сильных кислот свойства, например вступает в реакции нейтрализации с сильными и слабыми o снованиями. Составьте уравнение реакции марганцовой кислоты с гидроксидом натрия и гидрксидом аммония HMnO 4 + NaOH = KMnO 4 + H 2 O HMnO 4 + (NH 3 · H 2 O) NH 4 MnO 4 + H 2 O < 20°C 2HMnO 4 + 2(NH 3 · H 2 O) 2MnO 2 + N 2 + 6H 2 O > 20°C
Слайд 53
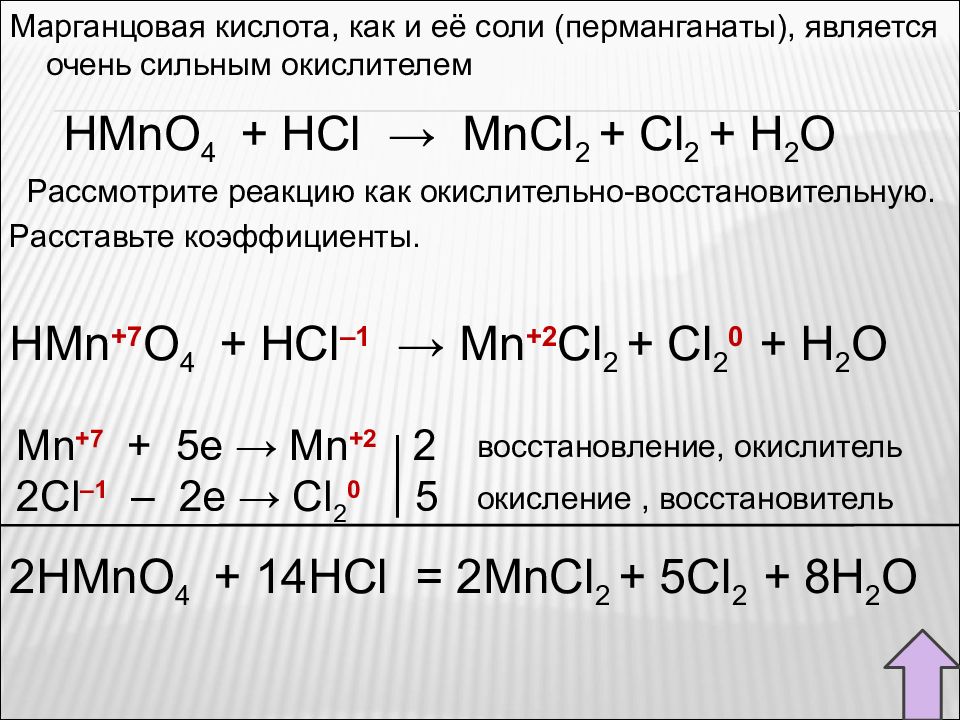
Марганцовая кислота, как и её соли (перманганаты), является очень сильным окислителем HMnO 4 + HCl → MnCl 2 + Cl 2 + H 2 O Рассмотрите реакцию как окислительно-восстановительную. Расставьте коэффициенты. HMn +7 O 4 + HCl – 1 → Mn +2 Cl 2 + Cl 2 0 + H 2 O Mn +7 + 5e → Mn + 2 2 2С l – 1 – 2e → Cl 2 0 5 восстановление, окислитель окисление, восстановитель 2HMnO 4 + 14HCl = 2MnCl 2 + 5Cl 2 + 8H 2 O
Слайд 54
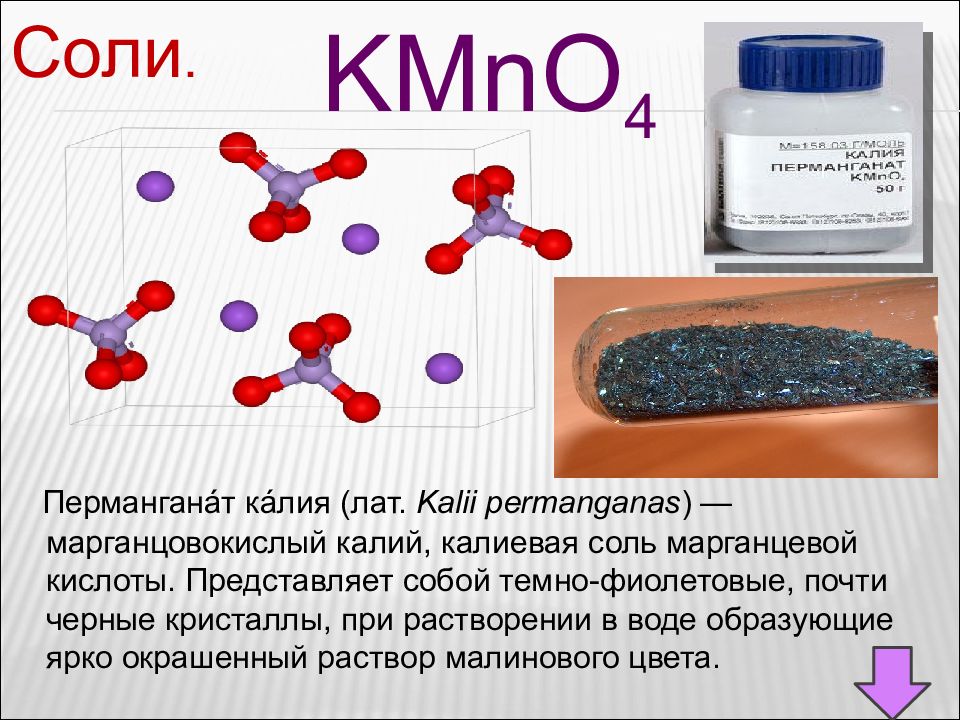
Соли. KMnO 4 Пермангана́т ка́лия (лат. Kalii permanganas ) — марганцовокислый калий, калиевая соль марганцевой кислоты. Представляет собой темно-фиолетовые, почти черные кристаллы, при растворении в воде образующие ярко окрашенный раствор малинового цвета.
Слайд 55
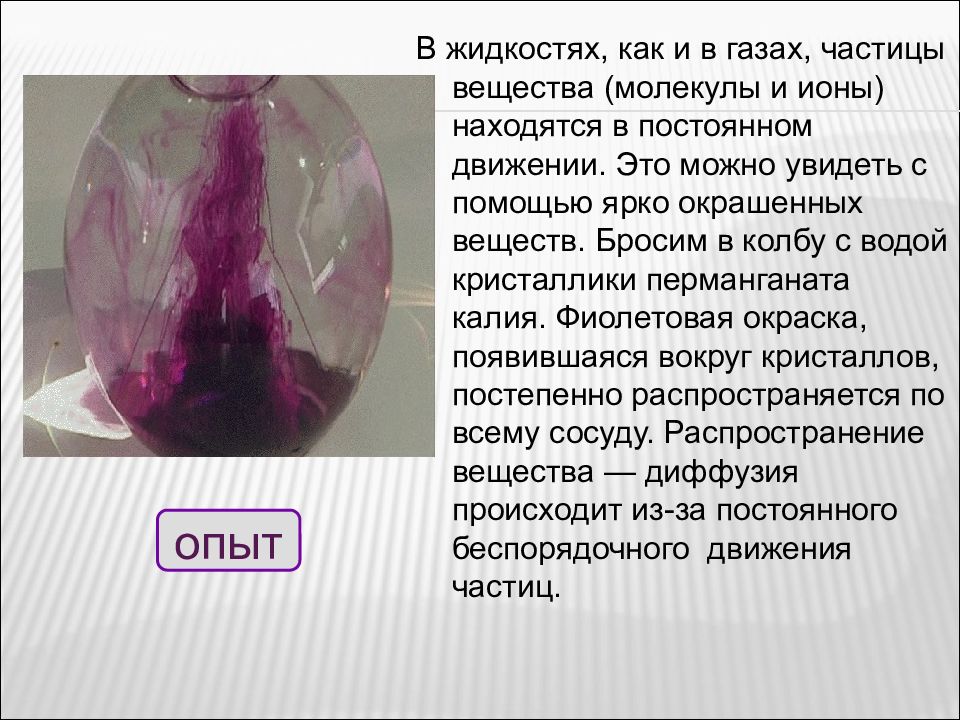
В жидкостях, как и в газах, частицы вещества (молекулы и ионы) находятся в постоянном движении. Это можно увидеть с помощью ярко окрашенных веществ. Бросим в колбу с водой кристаллики перманганата калия. Фиолетовая окраска, появившаяся вокруг кристаллов, постепенно распространяется по всему сосуду. Распространение вещества — диффузия происходит из-за постоянного беспорядочного движения частиц. опыт
Слайд 56
Получение KMnO 4 Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия 2MnO 2 + 3Cl 2 + 8KOH → 2KMnO 4 + 6KCl + 4H 2 O 2K 2 MnO 4 + Cl 2 → 2KMnO 4 + 2KCl 3K 2 MnO 4 +2H 2 O → 2KMnO 4 + MnO 2 + 4KOH 2K 2 MnO 4 + 2H 2 O → 2KMnO 4 +H 2 ↑ + 2KOH Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Слайд 57
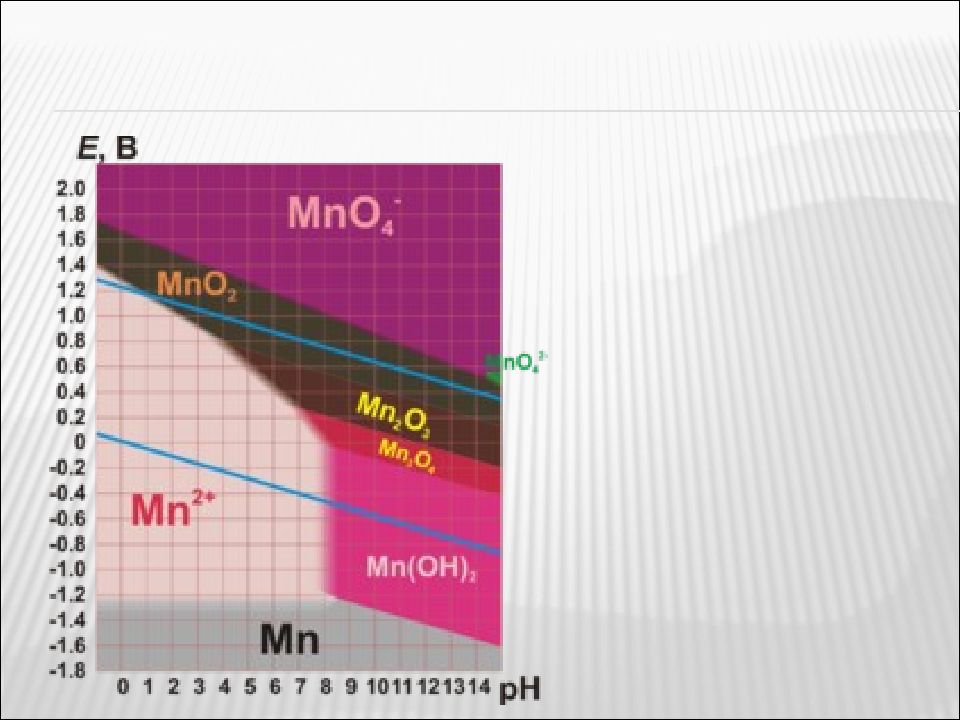
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI) Химические свойства перманганата калия
Слайд 58
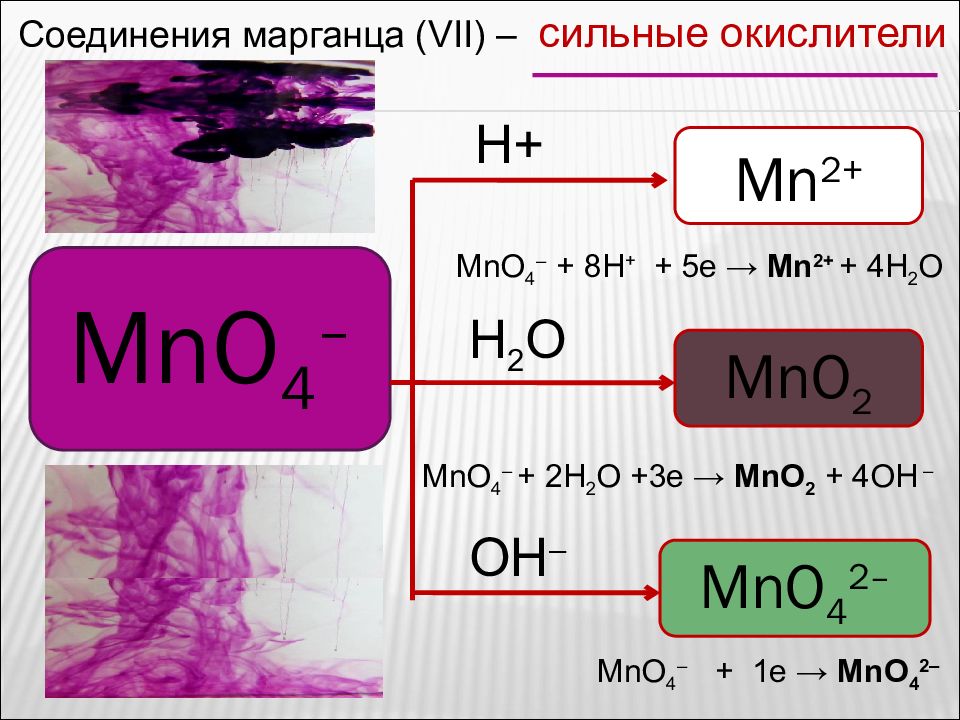
Соединения марганца ( VII) – сильные окислители MnO 4 – Mn 2+ MnO 2 MnO 4 2– H+ H 2 O OH – MnO 4 – + 8H + + 5e → Mn 2+ + 4H 2 O MnO 4 – + 1e → MnO 4 2– MnO 4 – + 2H 2 O + 3 e → MnO 2 + 4OH –
Слайд 59
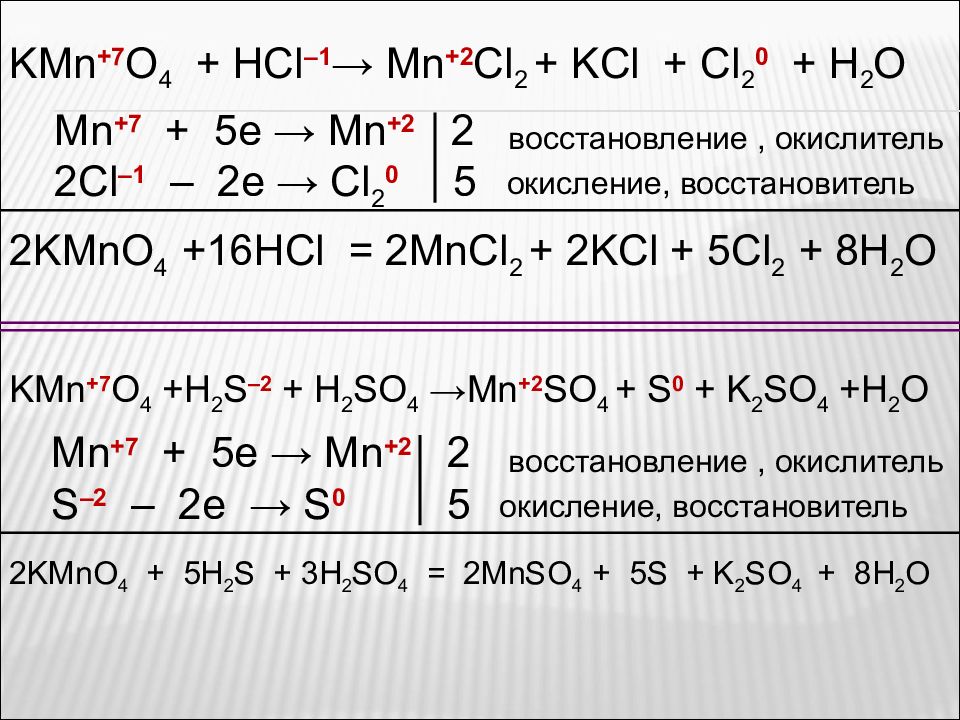
В кислой среде перманганат восстанавливается до солей Mn 2+ KMnO 4 + H 2 S + H 2 SO 4 → MnSO 4 + S + K 2 SO 4 + H 2 O Рассмотрите реакции как окислительно-восстановительные. Расставьте коэффициенты. KMnO 4 + H 2 O 2 + H 2 SO 4 → MnSO 4 + O 2 + K 2 SO 4 + H 2 O KMnO 4 + KNO 2 + H 2 SO 4 → MnSO 4 +KNO 3 +K 2 SO 4 + H 2 O KMnO 4 + FeSO 4 + H 2 SO 4 → MnSO 4 + Fe 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O KMnO 4 + HCl → MnCl 2 + KCl + Cl 2 + H 2 O опыт
Слайд 61
KMn +7 O 4 + HCl –1 → Mn +2 Cl 2 + KCl + Cl 2 0 + H 2 O Mn +7 + 5e → Mn + 2 2 2С l – 1 – 2e → Cl 2 0 5 2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O окисление, восстановитель восстановление, окислитель KMn +7 O 4 +H 2 S –2 + H 2 SO 4 →Mn +2 SO 4 + S 0 + K 2 SO 4 +H 2 O Mn +7 + 5e → Mn + 2 2 S –2 – 2e → S 0 5 2KMnO 4 + 5H 2 S + 3H 2 SO 4 = 2MnSO 4 + 5S + K 2 SO 4 + 8H 2 O восстановление, окислитель окисление, восстановитель
Слайд 62
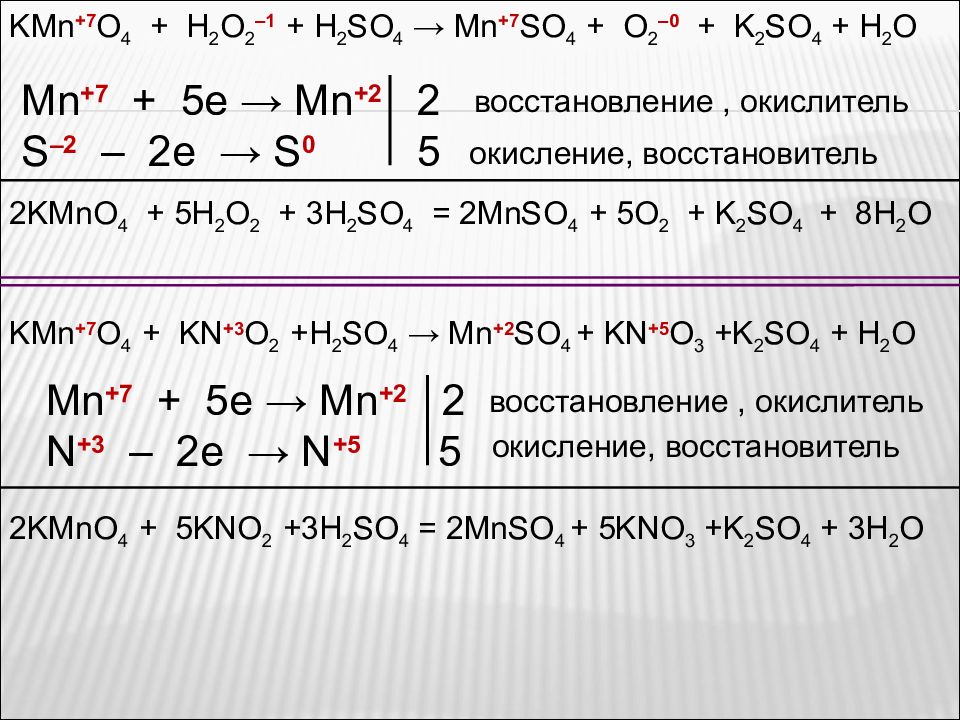
KMn +7 O 4 + H 2 O 2 –1 + H 2 SO 4 → Mn +7 SO 4 + O 2 –0 + K 2 SO 4 + H 2 O Mn +7 + 5e → Mn + 2 2 S –2 – 2e → S 0 5 восстановление, окислитель окисление, восстановитель 2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 = 2MnSO 4 + 5O 2 + K 2 SO 4 + 8H 2 O KMn +7 O 4 + KN +3 O 2 +H 2 SO 4 → Mn +2 SO 4 + KN +5 O 3 +K 2 SO 4 + H 2 O Mn +7 + 5e → Mn + 2 2 N +3 – 2e → N +5 5 восстановление, окислитель окисление, восстановитель 2KMnO 4 + 5KNO 2 +3H 2 SO 4 = 2MnSO 4 + 5KNO 3 +K 2 SO 4 + 3H 2 O
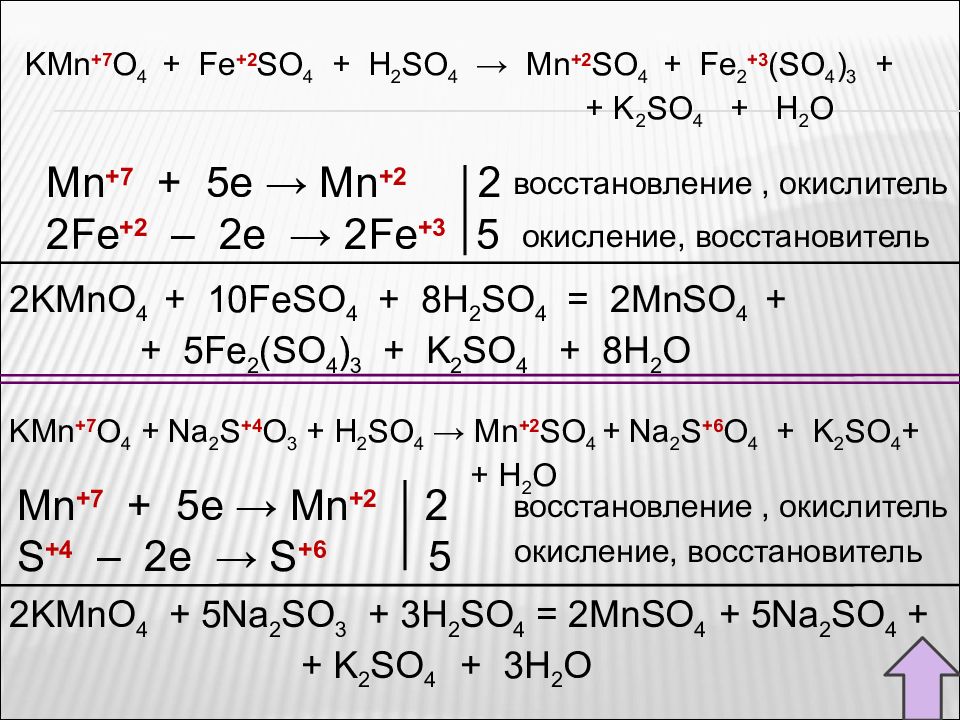
Слайд 63
2KMnO 4 + 10FeSO 4 + 8H 2 SO 4 = 2MnSO 4 + + 5Fe 2 (SO 4 ) 3 + K 2 SO 4 + 8H 2 O Mn +7 + 5e → Mn + 2 2 2Fe +2 – 2e → 2Fe +3 5 восстановление, окислитель окисление, восстановитель KMn +7 O 4 + Fe +2 SO 4 + H 2 SO 4 → Mn +2 SO 4 + Fe 2 +3 (SO 4 ) 3 + + K 2 SO 4 + H 2 O KMn +7 O 4 + Na 2 S +4 O 3 + H 2 SO 4 → Mn +2 SO 4 + Na 2 S +6 O 4 + K 2 SO 4 + + H 2 O Mn +7 + 5e → Mn + 2 2 S +4 – 2e → S +6 5 восстановление, окислитель окисление, восстановитель 2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + + K 2 SO 4 + 3H 2 O
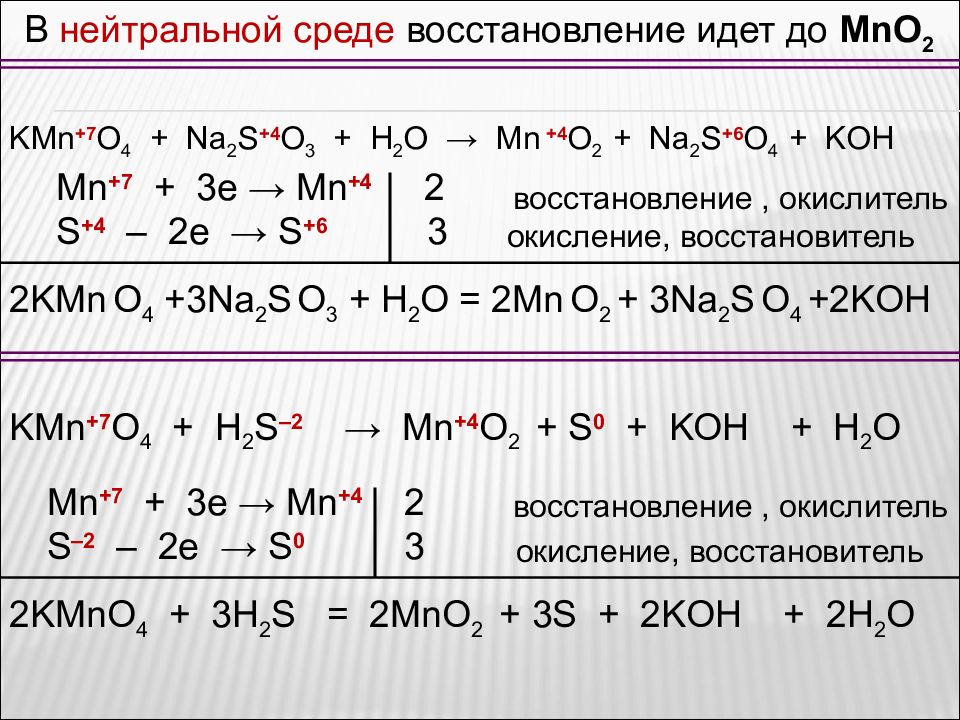
Слайд 64
В нейтральной среде восстановление идет до MnO 2 KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 + Na 2 SO 4 + KOH KMnO 4 + H 2 S → MnO 2 + S + KOH + H 2 O KMnO 4 + MnSO 4 + H 2 O → MnO 2 + K 2 SO 4 + H 2 SO 4 В щелочной среде образуются соли маргонцоватой кислоты KMnO 4 + K 2 SO 3 + KOH → K 2 MnO 4 + K 2 SO 4 + H 2 O KMnO 4 + KI + KOH → K 2 MnO 4 + KIO 4 + H 2 O KMnO 4 + KOH → K 2 MnO 4 + O 2 + H 2 O Рассмотрите реакции как окислительно-восстановительные. Расставьте коэффициенты.
Слайд 65
KMn + 7 O 4 + Na 2 S +4 O 3 + H 2 O → Mn +4 O 2 + Na 2 S +6 O 4 + KOH Mn +7 + 3e → Mn +4 2 S +4 – 2e → S +6 3 2KMn O 4 +3Na 2 S O 3 + H 2 O = 2Mn O 2 + 3Na 2 S O 4 +2KOH восстановление, окислитель окисление, восстановитель KMn + 7 O 4 + H 2 S –2 → Mn +4 O 2 + S 0 + KOH + H 2 O Mn +7 + 3e → Mn +4 2 S –2 – 2e → S 0 3 восстановление, окислитель окисление, восстановитель 2 KMnO 4 + 3 H 2 S = 2 MnO 2 + 3 S + 2 KOH + 2 H 2 O В нейтральной среде восстановление идет до MnO 2
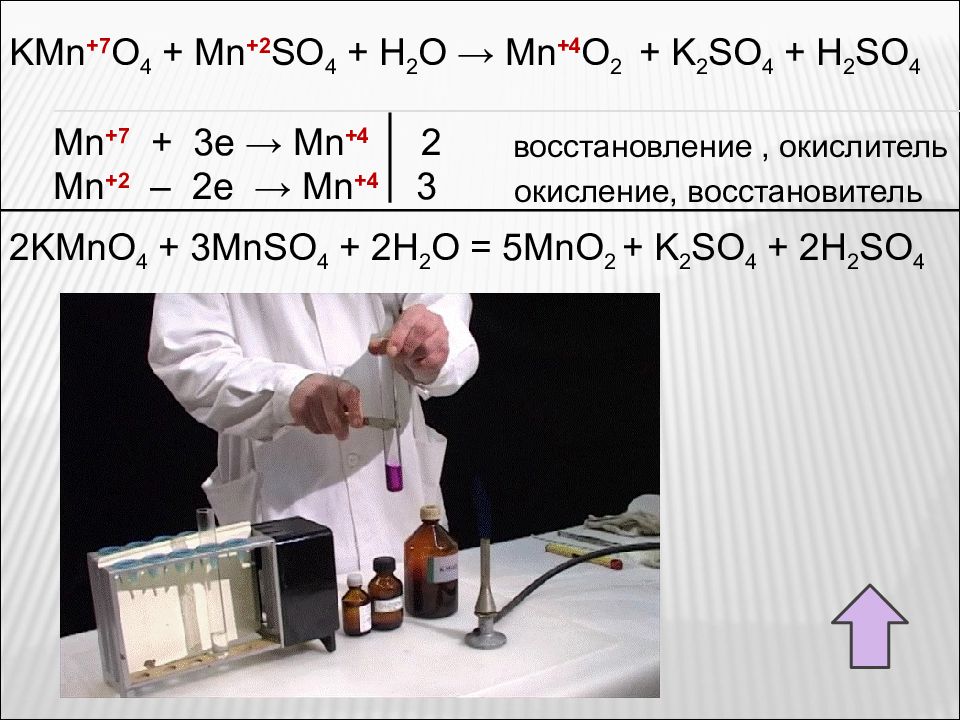
Слайд 66
KMn + 7 O 4 + Mn +2 SO 4 + H 2 O → Mn +4 O 2 + K 2 SO 4 + H 2 SO 4 Mn +7 + 3e → Mn +4 2 Mn +2 – 2e → Mn +4 3 восстановление, окислитель окисление, восстановитель 2KMnO 4 + 3MnSO 4 + 2H 2 O = 5MnO 2 + K 2 SO 4 + 2H 2 SO 4
Слайд 67
В щелочной среде образуются соли маргонцоватой кислоты KMn + 7 O 4 +Na 2 S + 4 O 3 +KOH →K 2 Mn + 6 O 4 +Na 2 S + 6 O 4 + H 2 O Mn +7 + 1e → Mn +6 2 S +4 – 2e → S +6 1 восстановление, окислитель окисление, восстановитель 2KMnO 4 + Na 2 SO 3 + 2KOH = 2K 2 MnO 4 + Na 2 SO 4 + H 2 O KMn + 7 O 4 + KI –1 + KOH → K 2 Mn + 6 O 4 + KI + 7 O 4 + H 2 O Mn +7 + 1e → Mn +6 8 I –1 – 8e → I +7 1 восстановление, окислитель окисление, восстановитель 8KMnO 4 + KI + 8KOH = 8K 2 MnO 4 + KIO 4 + 4H 2 O
Слайд 68
KMn + 7 O 4 –2 + KOH → K 2 Mn + 7 O 4 + O 2 0 + H 2 O Mn +7 + 1e → Mn +6 4 2O –2 – 4e → O 2 0 1 восстановление, окислитель o кисление, восстановитель 4 KMnO 4 + 4KOH = 4K 2 MnO 4 + O 2 + 2H 2 O
Слайд 69
К растертому в тонкий порошок перманганату калия добавляют глицерин. Через некоторое время над смесью появляется дымок, а затем происходит загорание глицерина. Под действием сильных окислителей глицерин сгорает с образованием углекислого газа и воды. 2 С 3 Н 8 О 3 + 7 О 2 = 6 СО 2 + 8Н 2 О Взаимодействие кристаллического перманганата калия с глицерином o пыт
Слайд 70
Спирты легко окисляются раствором перманганата калия. В пробирку с этиловым спиртом прильем немного подкисленного раствора перманганата калия. Осторожно подогреем пробирку. Раствор постепенно обесцвечивается. В данных условиях этиловый спирт окисляется, превращаясь в уксусный альдегид. Окисление этилового спирта раствором перманганата калия опыт C 2 H 5 OH + KMnO 4 + H 2 SO 4 → CH 3 COH + MnSO 4 + K 2 SO 4 + H 2 O C 2 H 6 O – 2e → C 2 H 4 O + 2H + 5 MnO 4 – + 8H + + 5e → Mn 2+ + 4H 2 O 2 5 C 2 H 6 O + 2 MnO 4 – + 16 H + → 5 C 2 H 4 O + 10 H + + 2 Mn 2+ + 8 H 2 O 5 C 2 H 5 OH +2KMnO 4 +3H 2 SO 4 → 5 CH 3 COH +2MnSO 4 +K 2 SO 4 + 8 H 2 O
Слайд 71
При пропускании ацетилена через подкисленный раствор перманганата калия наблюдается быстрое обесцвечивание раствора. Происходит окисление ацетилена по месту разрыва тройной связи с образованием продукта окисления – щавелевой кислоты. В избытке перманганата калия щавелевая кислота окисляется до углекислого газа и воды. Взаимодействие ацетилена с раствором перманганата калия опыт C 2 H 2 +KMnO 4 +H 2 SO 4 →HOOC–COOH + MnSO 4 + K 2 SO 4 + H 2 O C 2 H 2 + 4H 2 O – 8e → C 2 H 2 O 4 + 8H + 5 MnO 4 – + 8H + + 5e → Mn 2+ + 4H 2 O 8 5 C 2 H 2 + 20H 2 O + 8MnO 4 – + 64H + → 5 C 2 H 4 O + 4 0 H + + 8Mn 2+ + 32H 2 O 5C 2 H 2 + 8KMnO 4 + 12H 2 SO 4 → 5HOOC–COOH + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
Слайд 72
При пропускании этилена через раствор перманганата калия. Раствор быстро обесцвечивается. При этом этилен окисляется в двухатомный спирт этиленгликоль. Взаимодействие этилена с раствором перманганата калия опыт C 2 H 4 + KMnO 4 + H 2 O → CH 2 OH–CH 2 OH + MnO 2 + KOH C 2 H 4 + 2OH – – 2e → C 2 H 6 O 2 3 MnO 4 – + 2H 2 O + 3e → MnO 2 + 4OH – 2 3C 2 H 4 + 6OH – + 2MnO 4 – + 4H 2 O → 3C 2 H 6 O 2 + 2MnO 2 + 8OH – 3C 2 H 4 + 2KMnO 4 + 4H 2 O → 3CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
Слайд 73
При нагревании перманганат калия разлагается 2KMnO 4 K 2 MnO 4 + MnO 2 + O 2 t° опыт
Слайд 75
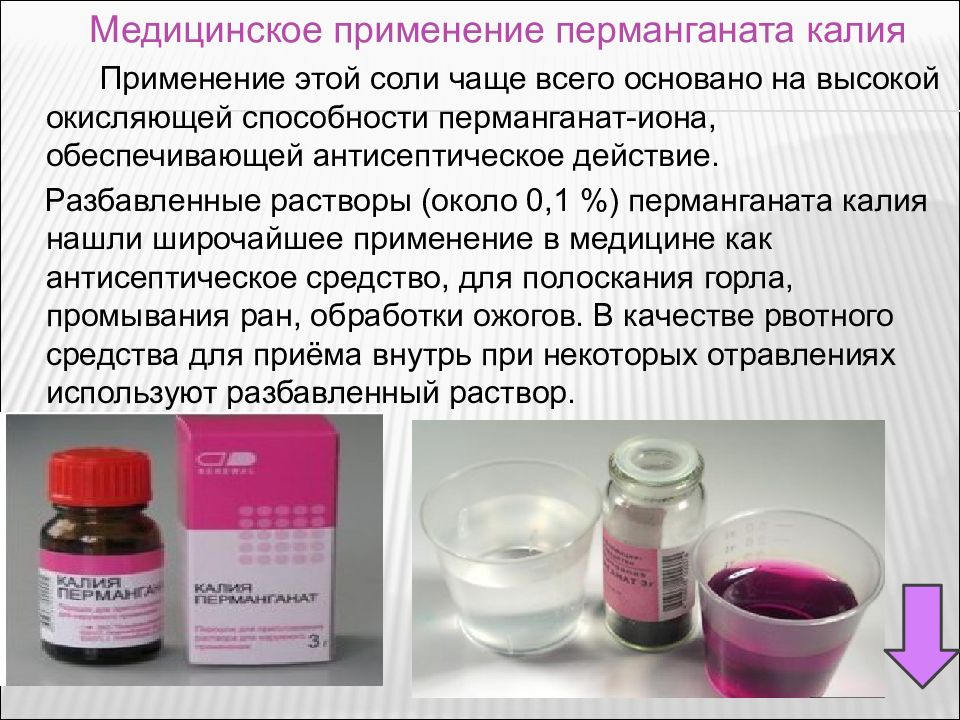
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие. Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор. Медицинское применение перманганата калия
Слайд 76
Фармакологическое действие Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счет этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии). Используется также в гомеопатии.
Слайд 77
Другие сферы применения перманганата калия 1) Применяется для определения перманганатной окисляемости при оценке качества воды 2) Щелочной раствор перманганата калия хорошо отмывает лабораторную посуду от жиров и других органических веществ. 3) Растворы (концентрации примерно 3 г/л) широко применяются при тонировании фотографий. 4) В пиротехнике применяют в качестве сильного окислителя. 5) Применяют в качестве катализатора разложения перекиси водорода в космических жидкостно-ракетных двигателях. 6) Водный раствор перманганата калия используется для травления дерева, в качестве морилки. 7) Водный раствор применяется также для выведения татуировок. Результат достигается посредством химического ожога, при котором отмирают ткани, в которых содержится красящее вещество. 8) Перманганат калия или бихромат натрия используются в качестве окислителя при получении мета- и парафталевые кислот из мета- и параксилолов соответственно.
Слайд 78
Влияние изменения степени окисления марганца на свойства его соединений. Кислотно-основные свойства оксидов и гидроксидов марганца зависят от степени окисления марганца. MnO Mn 2 O 3 MnO 2 (MnO 3 ) Mn 2 O 7 Mn(OH) 2 Mn(OH) 3 Mn(OH) 4 (H 2 MnO 4 ) HMnO 4 основные кислотные амфотерные Ослабление основных и усиление кислотных свойств
Слайд 79
степень окисления соединения цвет ионов оксиды гидроксиды соли +6 +4 +2 +7 Mn 2 O 7 MnO 2 Mn(OH) 2 MnO MnCl 2 MnSO 4 слабо- розовый основный Mn(OH) 4 MnCl 4 черный амфотерный MnO 3 H 2 MnO 4 К 2 MnO 4 кислотный зеленый HMnO 4 К MnO 4 фиолетовый кислотный