Первый слайд презентации: Окислительно-восстановительное равновесие
Равновесия с изменением степеней окисления реагирующих компонентов называют окислительно-восстановительными (редокс-реакции). Под степенью окисления понимают формальный заряд, который приобретает атом элементарного объекта при его переходе в данное химическое соединение при условии, что все химические связи (за исключением неполярных ковалентных связей) были бы ионными. Окисление – повышение, а восстановление – понижение степени окисления.
Процессы с присоединением и отдачей электронов рассматривают как полуреакции восстановления и окисления соответственно. Данные реакции неосуществимы одна без другой. Окисленная и восстановленная форма вещества составляет сопряженную пару: Ox 1 + ne ↔ Red 1 (I) Red 2 - ne ↔ Ox 2 (II) Ox 1 + Red 2 ↔ Red 1 + Ox 2 (III)
Слайд 3: Окислительно-восстановительное равновесие
Для оценки окислительно-восстановительной способности используют соответствующие константы и значение ЭДС гальванического элемента ( потенциала): В основном используют К 0 3
Слайд 4: Окислительно-восстановительное равновесие
Электрохимические процессы сопровождаются одновременно протеканием электрохимических реакций и изменением электрических свойств системы, которую в подобном случае называют электрохимической системой. В аналитической практике электрохимическая система обычно содержит электрохимическую ячейку, включающую сосуд с электропроводящим анализируемом раствором, в который погружены электроды.
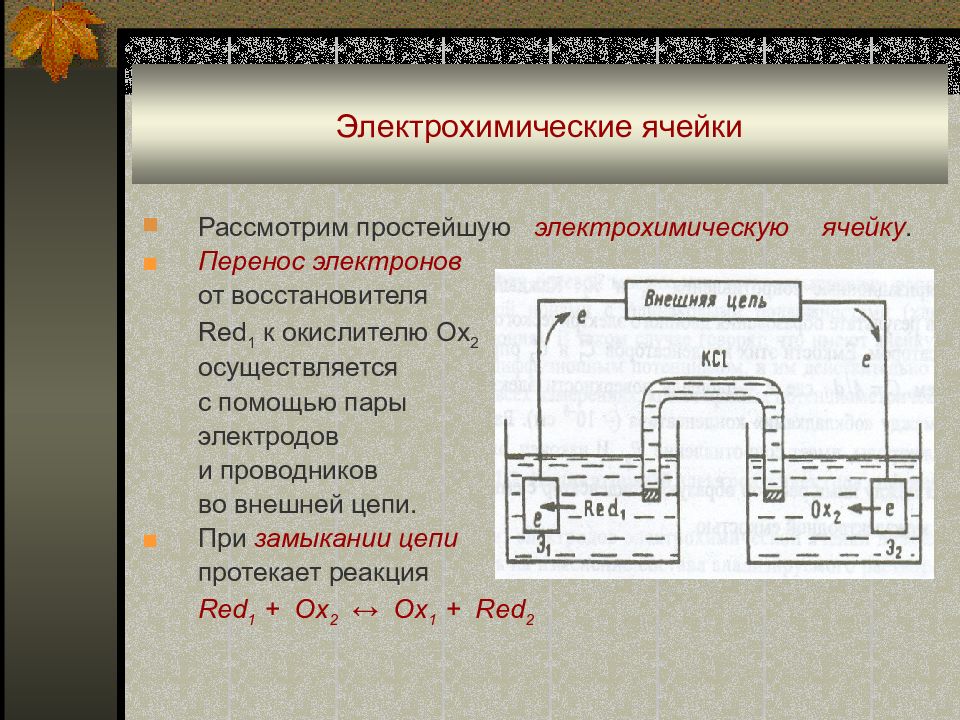
Слайд 5: Электрохимические ячейки
Рассмотрим простейшую электрохимическую ячейку. ■ Перенос электронов от восстановителя Red 1 к окислителю Ox 2 осуществляется с помощью пары электродов и проводников во внешней цепи. ■ При замыкании цепи протекает реакция Red 1 + Ox 2 ↔ Ox 1 + Red 2
Слайд 6: Электрохимические ячейки
Электрохимические ячейки, вырабатывающие и потребляющие электрическую энергию, называются соответственно гальваническими элементами и электролитическими ячейками :
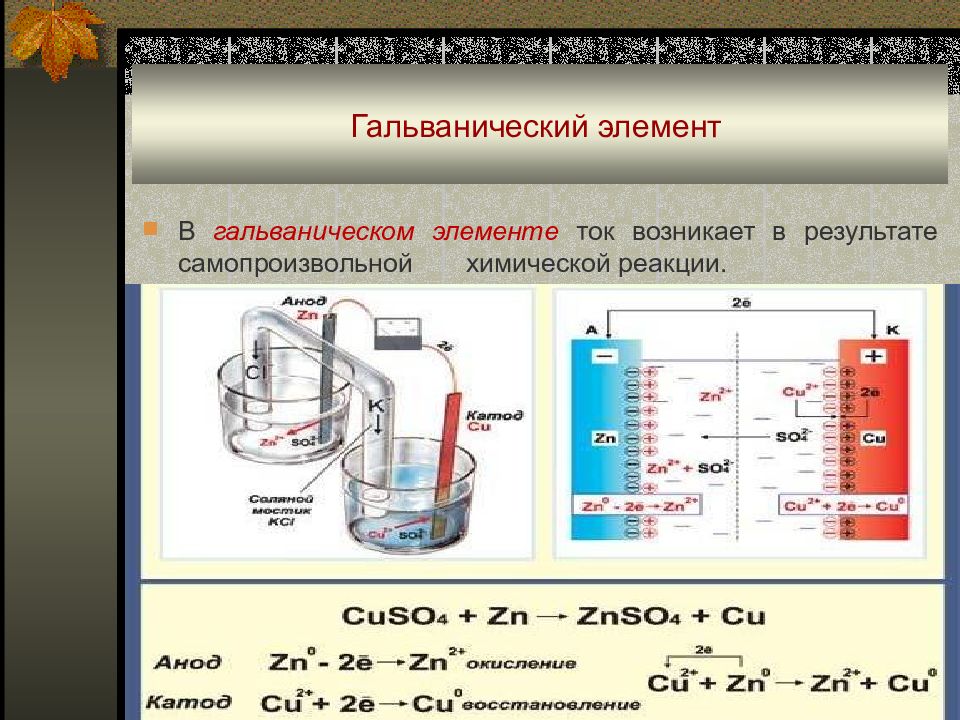
Слайд 7: Гальванический элемент
В гальваническом элементе ток возникает в результате самопроизвольной химической реакции.
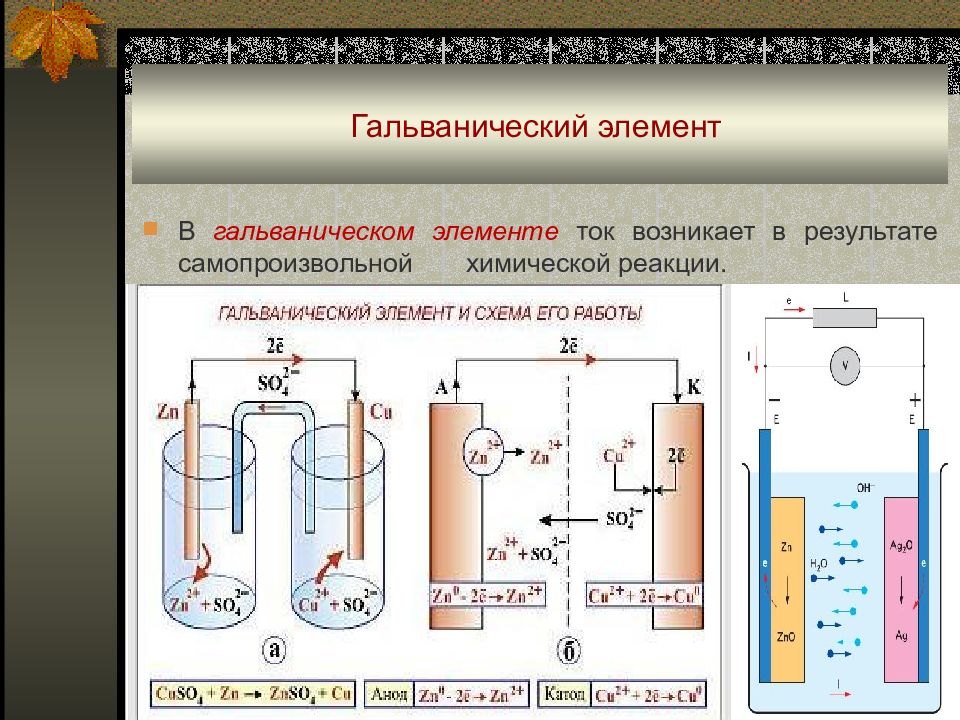
Слайд 8: Гальванический элемент
В гальваническом элементе ток возникает в результате самопроизвольной химической реакции.
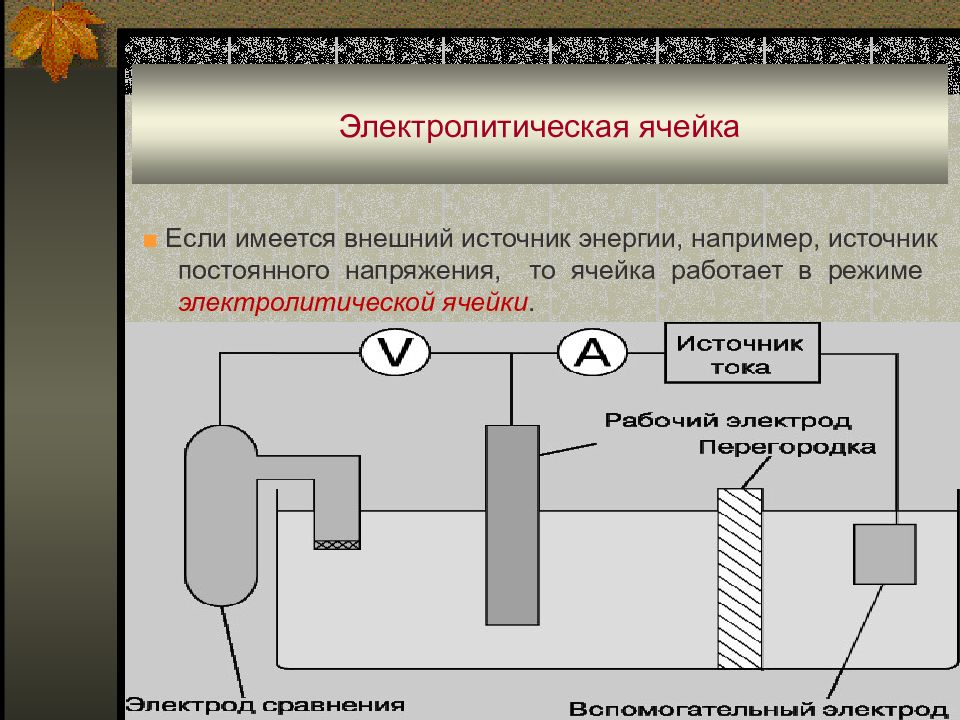
Слайд 9: Электролитическая ячейка
■ Если имеется внешний источник энергии, например, источник постоянного напряжения, то ячейка работает в режиме электролитической ячейки.
Слайд 10: Описание окислительно-восстановительных реакций
На электрохимическое превращение 1 моля вещества затрачивается работа А = n • F • E (n- число электронов ; F- число Фарадея, 9,65 •10 4 кл ; E- ЭДС гальванического элемента).
Слайд 11: Потенциал
Под потенциалом в широком смысле понимают способность системы совершать работу. Химический потенциал ( μ i ) соответствует затратам полезной работы на перенос некоторого количества вещества (n i ) из бесконечности в данную точку рассматриваемой фазы : (dG/dn i ) = μ i. Электрический потенциал характеризует способность единичного положительного заряда совершать работу в электрическом поле. Под электродным потенциалом понимают равновесное значение потенциала между металлом и раствором, содержащим его катионы.
Слайд 12: Электродный потенциал
Для измерения электродного потенциала полуреакции составляют гальванический элемент из водородного электрода и электрода, на котором протекает интересующая нас реакция. При замкнутой цепи в гальваническом элементе протекают реакции: M(тв.) ↔ M n+ + ne; 2H + + 2e ↔ H 2 (газ);
Слайд 13: Электродный потенциал ( 1953 г. Стокгольм, IUPAC)
Электродный потенциал (более правильно относительный электродный потенциал ) относится исключительно к полуреакциям, записанным в виде восстановления. Нет возражений против применения термина окислительный потенциал к процессам, протекающим на электроде в противоположном направлении, но в этом случае окислительный потенциал не следует называть электродным. За знак электродного потенциала принимают действительный знак изучаемого электрода относительно стандартного водородного электрода (СВЭ).
Слайд 14: Электродный потенциал ( 1953 г. Стокгольм, IUPAC)
Знак электродного потенциала указывает, будет ли процесс восстановления протекать самопроизвольно относительно стандартного водородного электрода. Положительный знак электродного потенциала означает, что реакция восстановления при обычных условиях протекает слева направо; с другой стороны, отрицательный знак электродного потенциала означает, что аналогичная реакция не протекает, т.к. ее равновесие смещено справа налево. Так Zn и Cd – электроды в гальваническом элементе ведут себя как аноды (отрицательные полюсы), от которых поток электронов во вешней цепи направлен к СВЭ.
Слайд 15: Электродный потенциал
Zn 2+ + 2e ↔ Zn(тв.), Е = - 0,8 В; Cd 2+ + 2e ↔ Cd(тв.), Е = - 0,4 В; Cu – электрод в гальваническом элементе является катодом (положительный полюс): Cu 2+ + 2e ↔ Cu(тв.), Е = + 0,3 В. Стандартный электродный потенциал (Е 0 Ox/Red ) – это электродный потенциал полуреакции (относительно СВЭ ) при условии, что активности всех реагентов и продуктов равны единице ; чем больше величина Е 0 Ox/Red, тем более сильным окислителем является форма Ox и более слабым восстановителем форма Red.
Слайд 17: Уравнение Нернста
Уравнение Нернста { Вальтер Фридрих Герман Нернст (1864-1941) } – немецкий физик и физикохимик, лауреат Нобелевской премии (1920). ЭДС любого элемента равна разности электродных потенциалов составляющих его полуэлементов Е 2 – Е 1 ; в случае C ВЭ, Е 1 = 0 и ЭДС = Е 2 : для реакции Ox + ne ↔ Red RT a Ox Е Ox/Red = Е 0 Ox/Red + ——— In ———, где nF a Red Е Ox/Red – равновесный электродный потенциал ; Е 0 Ox/Red – стандартный электродный потенциал (зависит только от Т, Р и природы растворителя) ; R – молярная газовая постоянная, 8,314 Дж •моль -1 •К -1.
Слайд 18: Уравнение Нернста
Объединяя постоянные величины в одну константу и заменив натуральный логарифм на десятичный, получим: 0,059 a Ox Е Ox/Red = Е 0 Ox/Red + ——— Ig ——— n a Red На практике обычно пользуются концентрациями С Ox ; C Red, а не активностями. Поскольку а i = f i • i •C, ур-ние Нернста запишем 0,059 С Ox Е Ox/Red = Е 0,ф Ox/Red + ——— Ig ———, n C Red где Е 0,ф Ox/Red – формальный электродный потенциал полуреакции ; 0,059 f Ox • Ox Е 0,ф Ox/Red = ——— Ig ————— + Е 0 Ox/Red n f Red • Red
Слайд 19: Формальный электродный потенциал полуреакции ( Е 0,ф Ox/Red )
Е 0,ф Ox/Red зависит от ионной силы раствора, глубины протекания конкурирующих реакций и концентрации всех других частиц, принимающих участие в полуреакции; Пример: MnO 4 - + 8H + + 5e ↔ Mn 2+ + 4H 2 O; 0,059 a MnO 4 - (a H + ) 8 Е = Е 0 MnO 4 - / Mn 2+ + ——— Ig ——————; 5 a Mn 2+ 0,059 С MnO 4 - Е = Е 0,ф MnO 4 - / Mn 2+ + ——— Ig ————; 5 С Mn 2+ 0,059 f MnO 4 - • MnO 4 - • f 8 H + • 8 H + 0,059 Е 0,ф MnO 4 - / Mn 2+ = ——— Ig ——————————— + —— Ig (С H + ) 8 + 5 f Mn 2+ • Mn 2+ 5 + Е 0 MnO 4 - / Mn 2+
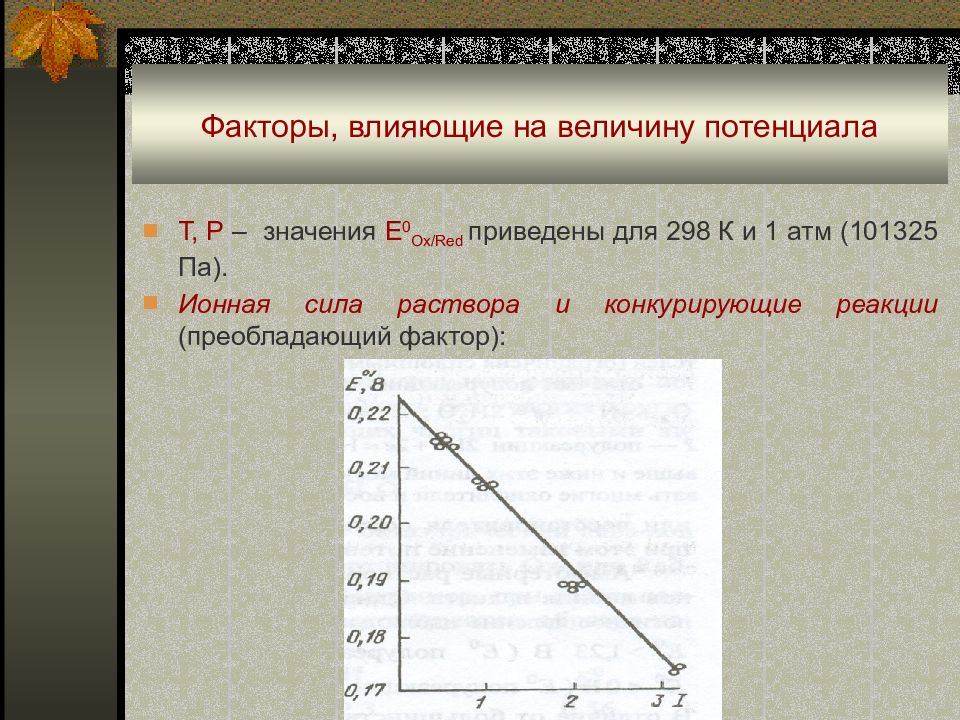
Слайд 20: Факторы, влияющие на величину потенциала
Т, Р – значения Е 0 Ox/Red приведены для 298 К и 1 атм (101325 Па). Ионная сила раствора и конкурирующие реакции (преобладающий фактор):
Слайд 21: Факторы, влияющие на величину потенциала
Кинетика реакции: 2H 2 O + 2e ↔ H 2 (г) + 2ОН - ; E 0 H 2 O/H 2,OH - = - 0,81 В; 2H + + 2e ↔ H 2 (г); E 0 H + / H 2 = 0 В; O 2 (г) + 4 H + + 4e ↔ 2H 2 O; E O 2,H + /H 2 O = + 1,23 B. Теоретически в воде не могут существовать Ox/Red системы (восстановители) с Е 0 < 0 В; - 0,81 В, а также Ox/Red системы (окислители) с Е 0 > 1,23 B.
Слайд 22: Факторы, влияющие на величину потенциала
Например: 2K + 2 H 2 O ↔ H 2 (г) + 2KOH; E 0 K + /K = - 3,045 B; 2F 2 + 2 H 2 O ↔ 2H 2 F 2 + O 2 (г) ; E 0 F 2 /F - = + 2,87 B. Вследствие кинетической заторможенности в воде существуют многие Ox/Red системы с ( E 0 ) : MnO 4 -,Н + /MnO 2 (+ 1,695 B); Mn 2+ / Mn (- 1,18 B).
Слайд 23: Факторы, влияющие на величину потенциала
Все Ox/Red системы с Е о > 1,23 В и Е о < 0 В неустойчивы.
Слайд 25: Факторы, влияющие на величину потенциала
Кислотность среды: MnO 4 - + 5e + 8H 3 O + ↔ Mn 2+ + 12H 2 O (I) MnO 4 - + 5e + 4H 2 O ↔ Mn 2+ + 8OH - (II) Ox + ne + mH 3 O + ↔ Red + 3/2•m H 2 O (III) Ox + ne + m/2 H 2 O ↔ Red + mOH - (IV)
Слайд 26: Факторы, влияющие на величину потенциала
Кислотность среды: MnO 4 - + 5e + 8H 3 O + ↔ Mn 2+ + 12H 2 O (I) Ox + ne + mH 3 O + ↔ Red + 3/2•m H 2 O (III) 0,059 f Ox • Ox • f m H 3 O + • m H 3 O + 0,059 C Ox •C m H 3 O + Е = Е 0 + ——— Ig —————————— + ——— Ig ————— ; n f Red • Red n C Red 0,059 f Ox • Ox • f m H 3 O + • m H 3 O + 0,059 Е 0,ф = Е 0 + ——— Ig —————————— - m ———— pH. n f Red • Red n C уменьшением рН вероятность реакций (I, III) возрастает!
Слайд 27: Факторы, влияющие на величину потенциала
Кислотность среды: аналогично для реакций (II, IV) запишем: 0,059 f Ox • Ox 0,059 C Ox Е = Е 0 + ——— Ig —————————— + ——— Ig ————— ; n f Red • Red • f m OH - • m OH - n C Red •C m OH - 0,059 f Ox • Ox 0,059 C m H 3 O + Е 0,ф = Е 0 + ——— Ig —————————— + ———— Ig ————— ; n f Red • Red • f m OH - • m OH - n K m w 0,059 f Ox • Ox 0,059 0,826 Е 0,ф = Е 0 + ——— Ig —————————— - m ——— pH + m ———. n f Red • Red • f m OH - • m OH - n n
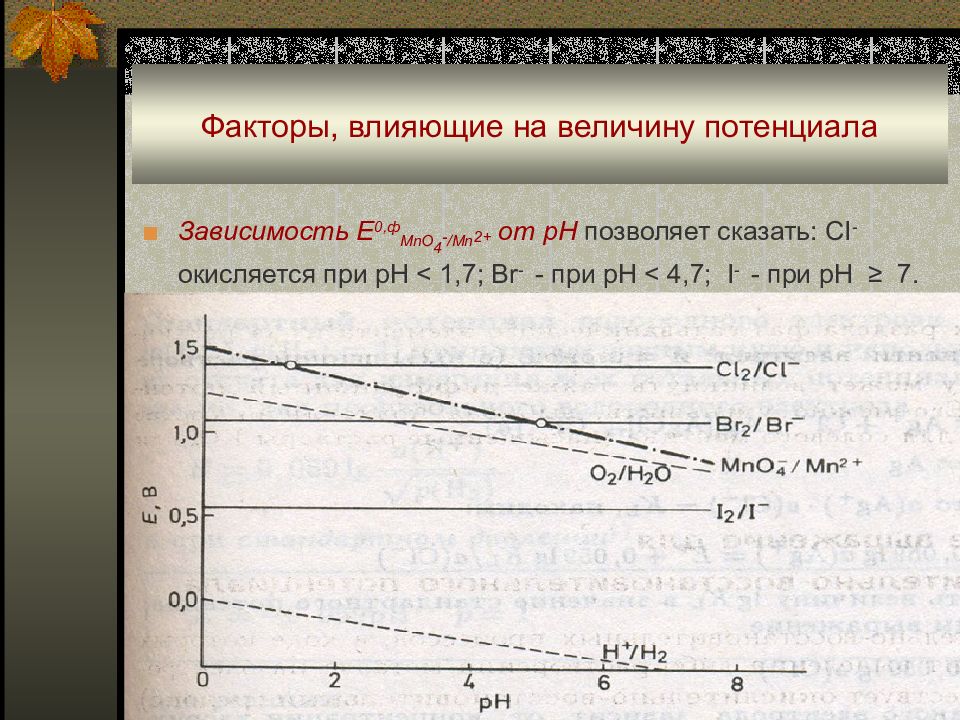
Слайд 28: Факторы, влияющие на величину потенциала
Зависимость Е 0,ф MnO 4 - /Mn 2+ от рН позволяет сказать : CI - окисляется при рН < 1,7; Br - - при pH < 4,7; I - - при рН ≥ 7.
Слайд 29: Факторы, влияющие на величину потенциала
Образование комплексных соединений: окисленная форма образует комплексы OxL …..OxL m OxL m + ne ↔ Red + mL a OxL m OxL m ↔ Ox + mL β OxL m = ————— Ox + ne ↔ Red a Ox • a m L 0,059 a Ox 0,059 a OxL m Е = Е 0 + ——— Ig ——— = Е 0 + ——— Ig ——————— n a Red n β OxL m • a m L • a Red 0,059 0,059 a OxL m Е = Е 0 - ——— Ig β OxL m + ——— Ig —————— n n a m L • a Red ↓ Е 0,ф для системы Ox/ Red
Слайд 30: Факторы, влияющие на величину потенциала
Образование комплексных соединений: восстановленная форма образует комплексы RedL …..RedL m Ox + ne + mL ↔ RedL m a RedL m Ox + ne ↔ Red β RedL m = ————— Red+ mL ↔ RedL m a Red • a m L 0,059 a Ox 0,059 a Ox • β RedL m • a m L Е = Е 0 + ——— Ig ——— = Е 0 + ——— Ig ——————— n a Red n a RedL m 0,059 0,059 a Ox • a m L Е = Е 0 + ——— Ig β RedL m + ——— Ig ———— n n a RedL m ↓ Е 0,ф для системы Ox/ Red
Слайд 31: Факторы, влияющие на величину потенциала
Образование комплексных соединений: Ox и Red формы образуют комплексные соединения OxL …..OxL m ; RedL …..RedL m 0,059 β RedL m 0,059 a OxL m Е = Е 0 + ——— Ig ——— + ——— Ig ———. n β OxL m a RedL m Величина потенциала определяется соотношением β i : Fe 3+ + е ↔ Fe 2+ E 0 = 0,771 B в присутствии СN - E 0 = 0,36 B Fe(CN) 6 3- + е ↔ Fe(CN) 6 4- Ig β= 43,9 Ig β= 36,9
Слайд 32: Факторы, влияющие на величину потенциала
Образование малорастворимых соединений : окисленная форма образует малорастворимое соединение OxA ↓ OxA ↓ + ne ↔ Red + A OxA ↓ ↔ Ox + A ПР т OxA↓ = a Ox • a A Ox + ne ↔ Red 0,059 a Ox 0,059 ПР т OxA Е = Е 0 + ——— Ig ——— = Е 0 + ——— Ig ———— n a Red n a Red • a A 0,059 0,059 1 Е = Е 0 + ——— Ig ПР т OxA + ——— Ig ———— n n a Red • a A
Слайд 33: Факторы, влияющие на величину потенциала
Образование малорастворимых соединений : восстановленная форма образует малорастворимое соединение RedA ↓ Ox + ne + A ↔ RedA↓; RedA↓ ↔ Red + A; ПР RedA↓ = a Red • a A ; 0,059 0,059 Е = Е 0 - ——— Ig ПР т RedA + ——— Ig a Ox • a A ; n n ■ Ox и Red формы образуют малорастворимые соединения AgCI ↓ + е ↔ Аg ↓ + CI - ; E AgCI ↓/ Аg ↓ = E 0 AgCI ↓/ Аg ↓ + 0,059 Ig 1/a CI- ;
Слайд 34: Константы равновесия окислительно-восстановительных реакций
Ox/Red – реакции сопровождаются переносом электрона. Вместе с тем, свободные электроны существуют а растворе лишь несколько микросекунд в малых концентрациях при действии излучений или в результате реакций, например, щелочных металлов с водой. Поэтому, Ox/Red – реакция реальна, если имеются min 2 компонента : восстановитель – донор электронов и окислитель – акцептор электронов : Ox 1 + ne ↔ Red 1 | m Red 2 - me ↔ Ox 2 | n m Ox 1 + n Red 2 ↔ m Red 1 + nOx 2 При прочих равных условиях возможность самопроизвольного протекания данной реакции определяется разностью потенциалов (∆Е 0,ф ), направление – знаком этой разности, а вероятность – ее абсолютной величиной
Слайд 35: Константы равновесия окислительно-восстановительных реакций
В состоянии равновесия потенциалы полуреакций одинаковы : 0,059 C ox,1 0,059 C ox,2 E 1 0,ф + ——— Ig ——— = E 2 0,ф + ——— Ig ——— n C Red,1 m C Red,2 0,059 C ox,2 0,059 C ox,1 E 1 0,ф - E 2 0,ф = ——— Ig ——— - ——— Ig ——— m C Red,2 n C Red,1 0,059 C m Red,1 • C n ox,2 E 1 0,ф - E 2 0,ф = ——— (Ig ———————) m•n C m Ox,1 • C n Red,2 ( E 1 0,ф - E 2 0,ф ) •m•n Ig K = ————————— 0,059
Слайд 36: Константы равновесия окислительно-восстановительных реакций
Нетрудно показать, что если мы ставим условие протекания реакции до конца (99,99 %), т.е. Ig K ≥ 8, то: при m•n = 1 ↔ разность ∆Е 0,ф ~ 0,47 B ; при m•n = 2 ↔ разность ∆Е 0,ф ~ 0,24 B и т.д.; пример:
Слайд 37: Константы равновесия окислительно-восстановительных реакций
■ Если в растворе присутствуют несколько Ox/Red пар, то в первую очередь взаимодействуют те, для которых ∆Е 0,ф – max: KCI (E 0 CI 2 /CI - = 1,359 B) KBr (E 0 Br 2 /Br - = 1,087 B) KMnO 4 (E MnO 4 -,H 3 O + /Mn 2+ ) = 1,51 B KI (E 0 I 3 - /I - = 1,087 B)
Слайд 38: Особенности протекания окислительно-восстановительных реакций
mA + nB ↔ pC + qD = k C m A C n B, где С А,C B – молярные к-ии; показатели степени m и n – порядки реакции по веществам A и B; (m + n) – порядок реакции; (3Cl -) ■ BrO 3 - + 3[SbCI 5 ] 2- + 6H 3 O + ↔ Br - + 3[SbCI 6 ] - + 9H 2 O E o BrO 3 - / Br - = 1,45 B; E o SbCI 6 - /SbCl 5 2- ~ 0,5 B; ∆E = 0,95 B; K ~ 1 0 48 ; реакция при комнатной температуре не идет! ■ 2J - + H 2 O 2 + 2H 3 O + ↔ J 2 + 4H 2 O; ∆E = 1,156 B; K ~ 10 19 ; = k [J - ] 2 [H 2 O 2 ] [H 3 O + ] 2 – реакция пятого порядка J - + H 2 O 2 ↔ JO - + H 2 O (медленно) JO - + H 3 O + ↔ HJO + H 2 O (быстро) HJO + J - + H 3 O + ↔ J 2 + 2H 2 O (быстро)
Слайд 39: Особенности протекания окислительно-восстановительных реакций
■ Факторы, влияющие на скорость реакции: 1. Концентрация реагирующих веществ: 6J - + Cr 2 O 7 2- + 14H + ↔ 2Cr 3+ + 3J 2 + 7H 2 O – реакция протекает медленно (используют избыточное количество иодида); 4J - + O 2 + 4H + ↔ 2J 2 + 2H 2 O (при хранении растворов иодида снижают концентрацию ионов водорода). 2. Температура: k = Ae -E/RT – правило Вант-Гоффа (при повышении Т на каждые 10 о скорость реакции увеличивается в 2-4 раза 2MnO 4 - + 5H 2 C 2 O 4 + 6H + ↔ 2Mn 2+ 10CO 2 + 8H 2 O (реакцию проводят при Т = 60-70 о С).
Слайд 40: Особенности протекания окислительно-восстановительных реакций
3. Катализатор : 2Ce(IV) + As(III) ↔ 2Ce(III) + As(V) 2Ce(IV) + 2J - ↔ 2Ce(III) + J 2 J 2 + 2H 2 O ↔ HJO + J - + H 3 O + H 2 O H 3 AsO 3 + HJO ↔ H 3 AsO 4 + H 3 O + + J - 2Ce(IV) + 3 H 2 O + H 3 AsO 3 ↔ 2Ce(III) + H 3 AsO 4 + 2H 3 O + 3.1. Aвтокаталитические реакции: 2MnO 4 - + 5C 2 O 4 2- + 16H 3 O + ↔ 2Mn 2+ + 10CO 2 + 24H 2 O
Слайд 41: Особенности протекания окислительно-восстановительных реакций
4. Индуцированные реакции: A + B ↔ M + D – первичная реакция (протекает быстро) A + C ↔ K + L – индуцированная реакция (протекает медленно) A – актор ; B (вызывает реакцию между А и С) – индуктор ; C (принимает на себя действие индуктора) – акцептор число эквивалентов в индуц. реакции F i (фактор индукции) = ————————————————————: число эквивалентов в первичной реакции скорость расходования акцептора F i = —————————————————; расходования индуктора Если F i >> 1, то реакция индуцированная цепная; при F i ~ 0,5 ÷ 1,2 – индуцированная сопряженная.
Слайд 42: Особенности протекания окислительно-восстановительных реакций (индуцированные цепные реакции)
Слайд 43: Особенности протекания окислительно-восстановительных реакций (индуцированные сопряженные реакции)
Слайд 44: Особенности протекания окислительно-восстановительных реакций (индуцированные сопряженные реакции)
5Fe 2+ + MnO 4 - + 8H 3 O + ↔ Mn 2+ + 5Fe 3+ + 12H 2 O: в этом случае возможно протекание индуцированной сопряженной реакции окисления хлорид-иона : 2MnO 4 - + 10Cl - + 16H 3 O + ↔ 2Mn 2+ + 24 H 2 O + 5Cl 2 – индуцированная реакция ; проходит через стадию образования Mn(III): MnO 4 - + Fe 2+ + H 3 O + ↔ Mn(IV) + Fe 3+ + H 2 O; Mn(IV) + Mn 2+ + 4 Cl - ↔ 2MnCl 2 + далее возможно протекание следующих реакций : MnCl 2 + + 2Cl - ↔ Mn 2+ + 2•Cl 2 - •Cl 2 - + Fe 2+ ↔ Fe 3+ + 2Cl - •Cl 2 - + MnCl 2 + ↔ Mn 2+ + 2Cl 2 2Cl 2 + 2 Fe 2+ ↔ 2 Cl - + 2 Fe 3+ E o Mn(III)/Mn(II) > 1,6 B понижают добавлением H 3 PO 4 + H 2 SO 4 + MnSO 4 ( смесь Рейнгарда-Циммермана)
Слайд 45: Особенности протекания окислительно-восстановительных реакций (индуцированные сопряженные реакции)
2MnO 4 - + 5C 2 O 4 2- + 16H 3 O + ↔ 2Mn 2+ + 10CO 2 + 24H 2 O – индуцированная реакция ; MnO 4 - + Mn 2+ - первичная реакция : 2MnO 4 - + 3Mn 2+ + 16H 3 O + ↔ 5Mn(IV) + 24H 2 O Mn(IV) + Mn 2+ ↔ 2Mn 3+ Mn(IV) + C 2 O 4 2- ↔ Mn 3+ + CO 2 + •CO 2 - •CO 2 - + Mn(IV) ↔ Mn 3+ + CO 2 Mn 3+ + 2 C 2 O 4 2- ↔ [Mn(C 2 O 4 ) 2 ] - [Mn(C 2 O 4 ) 2 ] - + 8 H 3 O + ↔ Mn 2+ + CO 2 + •CO 2 - + 12H 2 O
Слайд 46: Применение окислительно-восстановительных реакций в аналитической практике
Растворение веществ Сплавы: 2AI + 6HCI ↔ 2AICI 3 + 3H 2 (г); Малорастворимые сульфиды: 3HgS + 6HCI + 2HNO 3 ↔ 3Hg 2 CI 2 + 2NO + 3S(тв) + 4H 2 O; Приготовление и стабилизация растворов: Hg 2 2+ ↔ 2 Hg 2+ + 2e ( добавляют Hg + Hg 2+ ↔ Hg 2 2+ ); Прогнозирование состава растворов: восстановители Fe 2+, I 3 -, S 2-, SO 3 2- не могут существовать с окислителями MnO 4 -, NO 2 -, CIO 3 -, Cr 2 O 7 2-, Fe 3+, Sn(IV); Разделение веществ: Mn 2+ + H 2 O 2 + 2OH - ↔ MnO 2 (тв) + 2 H 2 O; Mg 2+ + 2OH - ↔ Mg(OH) 2 (тв) – растворим в присутствии NH 4 CI;
Последний слайд презентации: Окислительно-восстановительное равновесие: Применение окислительно-восстановительных реакций в аналитической практике
Обнаружение веществ : Hg 2+ + Cu ↔ Hg ( тв) + С u 2+ ; Mn 2+ ↔ MnO 4 - - малиновая окраска ; Cr 3+ ↔ Cr 2 O 7 2- - оранжевая окраска ; I - ↔ I 3 - - соединение с крахмалом синего цвета.