Первый слайд презентации: Окислительно-восстановительные реакции
Химические реакции в результате которых изменяются степени окисления элементов называют окислительно-восстановительными реакциями. Zn 0 + H Cl - → H 2 0 + Zn 2+ Cl 2 2K I -1 + Cl 2 0 → 2K Cl -1 + I 2 0 Изменение степени окисления связано с от - тягиванием или перемещением электронов от атомов.
Слайд 3: Степень окисления
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Степень окисления элемента в соединении определяется как число электронов, смещенных от атома данного элемента к другим атомам. К + 2 Cr +6 2 O -2 7 Степень окисления (С.О.) может быть положительной, нулевой и отрицательной. Знак степени окисления ставится перед числом:-1, -2, +3.
Слайд 4: Окисление и восстановление
Окислительно-восстановительная реакция состоит из двух полуреакций: окисления и восстановления. Окисление всегда сопровождается восстановле-нием, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями: Восстановитель – е - ↔ Окислитель Окислитель + е - ↔ Восстановитель Число электронов, отдаваемых восстанови-телем, равно числу электронов, присоединяемых окислителем.
Слайд 5: Окисление
Окисление — процесс отдачи электронов атомом или ионом, при этом степень окисления повышается. Вещество, атомы или ионы которого в процессе реакции отдают электроны, называется восстановителем. Восстановители S ־ 2 - 2 е→ S 0 процесс окисления H 2 0 - 2ē → 2H + Восстановители : металлы, водород, углерод, HCl, HBr, HI, СО, H 2 S, SO 2, H 2 SO 3, SnCl 2, FeSO 4, MnSO 4, NH 3, NO, альдегиды, спирты муравьиная и щавелевая кислота, глюкоза, электрический ток на катоде.
Слайд 6: Восстановление
Восстановление — процесс присоединения электронов атомом или ионом, при этом степень окисления понижается. Вещество, атомы или ионы которого в процессе реакции принимают электроны, называется окислителем. Окислители Mn +7 +5 e → Mn +2 процесс восстановления. Cr +6 +3ē → Cr +3 O 2 0 + 4ē → 2O -2 Окислители: галогены, KMnO 4, K 2 MnO 4, K 2 Cr 2 O 7, O 2, O 3, H 2 O 2, H 2 SO 4 (конц.), HNO 3, Ag 2 O, PbO 2, ионы Au +3, Ag +, гипохлориты, хлораты царская водка, электрический ток на аноде.
Слайд 7: Правила определения степени окисления
степень окисления элемента в простом веществе равна нулю; алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю; алгебраическая сумма всех степеней окисления атомов в ионе равна заряду иона; отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность ; максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической системе.
Слайд 8: Постоянная степень окисления
Фтор имеет степень окисления -1; Водород проявляет степень окисления +1, кроме гидридов металлов (-1); Металлы I группы главной подгруппы имеют степень окисления +1; металлы II группы главной подгруппы, а также цинк и кадмий имеют степень окисления +2; степень окисления алюминия +3; степень окисления кислорода равна -2, за исключением пероксидных иона (-1), озонидного аниона, а также фторидов кислорода О xF 2.
Слайд 9: Классификация окислительно-восстановительных реакций
Межмолекулярные (окислитель и восстановитель разные вещества) 4 N 3- H 3 + 3 O 0 2 → 2 N 0 2 + 6H 2 O 2- Внутримолекулярные (окислитель и восстановитель находятся в одном веществе) Диспропорционирования 4K Cl 5+ O 3 → 3 K Cl 7+ O 4 + K Cl - Обратного диспропорционирования (конмутации) N 3- H 4 N 5+ O 3 → N 2 1+ O + 2H 2 O
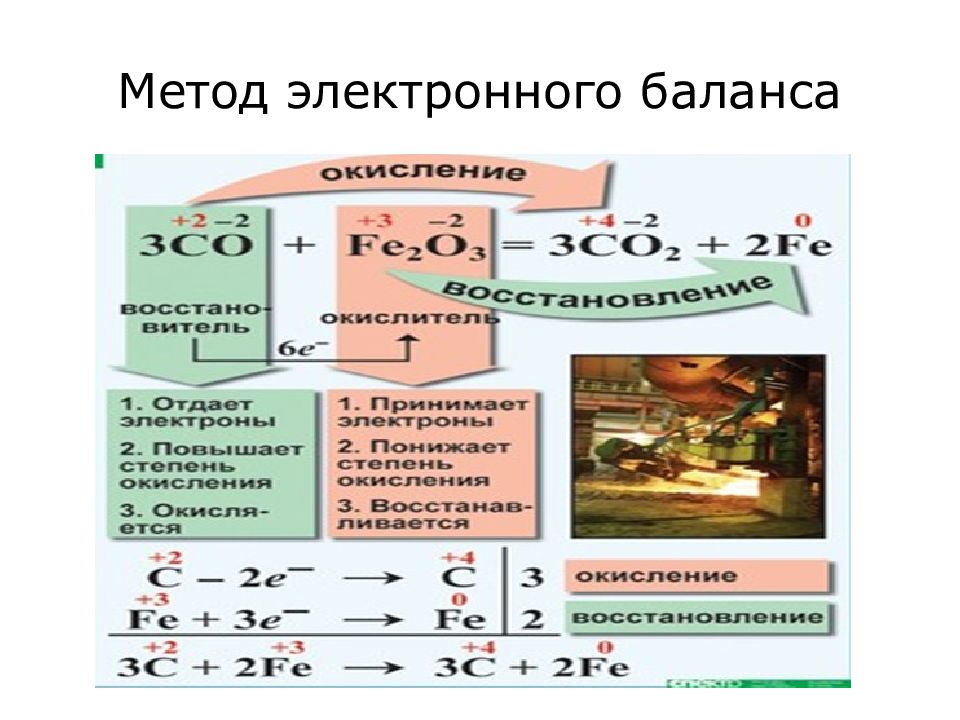
Слайд 10: Составление уравнений окислительно-восстановительных реакций
Принципы: равенства числа одних и тех же атомов до и после реакции; равенство числа электронов, отдаваемых восстановителем, и числа электронов, принимаемых окислителем. Реакцию представляют в виде системы двух полуреакций – окисления и восстановления, суммирование которых с учетом указанных принципов приводит к составлению общего уравнения процесса. Для составления уравнений окислительно -восстановительных реакций наиболее часто используют метод электронного баланса и метод электронно-ионных полуреакций.
Слайд 11: Применимость метода электронного баланса
Применяется для уравнивания окислительно-восстановительных реакций протекающих между газами, твердыми веществами и в расплавах. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции.
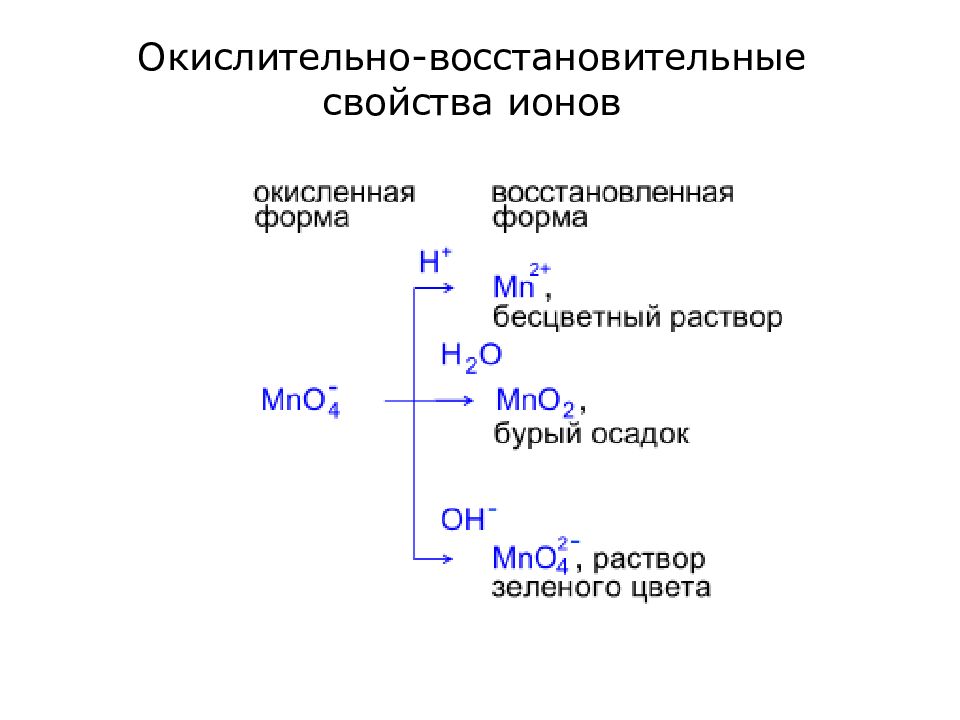
Слайд 13: Применимость метода электронно-ионных полуреакций
Метод позволяет составлять сложные уравнения реакций в растворах с точным указанием продуктов реакции. Метод оперирует реальными частицами, которые присутствуют в реакционной системе. Окислительно-восстановительные реакции в растворах протекают в одной из сред: кислой, щелочной, нейтральной. При этом окислительно-восстановительный процесс сопровождается изменением количества кислорода в реагирующей частице. Возможны следующие случаи: количество кислорода возрастает или убывает или остается неизменным.
Слайд 14: Если кислорода больше в продуктах реакции, чем в исходных реагентах Таблица 1
Слайд 15: Если кислорода меньше в продуктах реакции, чем в исходных реагентах Таблица 2
Слайд 17: Метод электронно-ионных полуреакций. Этапы метода
а) записывают формулы реагентов данной реакции K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 ↔ и устанавливают химическую функцию каждого из них (K 2 Cr 2 O 7 − окислитель, H 2 SO 4 − кислотная среда реакции, H 2 S − восстановитель ); б) записывают реагенты в ионном виде, указывая только те ионы и молекулы, которые примут участие в реакции в качестве окислителя (Cr 2 O 7 2− ), среды (Н + ) и восстановителя (H 2 S): Cr 2 O 7 2− + H 2 S + H + ↔
Слайд 18: Метод электронно-ионных полуреакций. Этапы метода
в) определяют восстановленную форму окислителя и окисленную форму восстановителя, что должно быть известно или задано. На основе этих данных составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают дополнительные множители для уравнений полуреакций: полуреакция восстановления Cr 2 O 7 2− + 14H + + 6 e − = 2Cr 3+ + 7H 2 O * 1 полуреакция окисления H 2 S − 2 e − = S(т) + 2H + * 3
Слайд 19: Метод электронно-ионных полуреакций. Этапы метода
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции : Cr 2 O 7 2− + 3H 2 S + 8H + = 2Cr 3+ + 7H 2 O + 3S (т) д) на основе ионного уравнения составляют молекулярное уравнение данной реакции, при этом формулы катионов и анионов, отсутствующие в ионном уравнении, группируют в формулы дополнительных продуктов : K 2 Cr 2 O 7 + 3H 2 S + 4H 2 SO 4 = Cr 2 (SO 4 ) 3 + 7H 2 O + 3S (т) + K 2 SO 4 е) для проверки подобранных коэффициентов в левой и правой частях уравнения достаточно проверить число атомов кислорода.
Слайд 20: Составление уравнений окислительно-восстановительных реакций. Пример 1. Восстановление перманганата калия в кислой среде
а) KMnO 4 + Na 2 SO 3 + H 2 SO 4 = MnSO 4 + H 2 O + Na 2 SO 4 + K 2 SO 4 б) MnO 4 − + SO 3 2− + H + = Mn 2+ + H 2 O + SO 4 2− в) MnO 4 − + 8H + + 5 e − = Mn 2+ + 4H 2 O * 2 SO 3 2− + H2O − 2 e − = SO 4 2− + 2H + * 5 д) 2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 3H 2 O + 5Na 2 SO 4 + K 2 SO 4
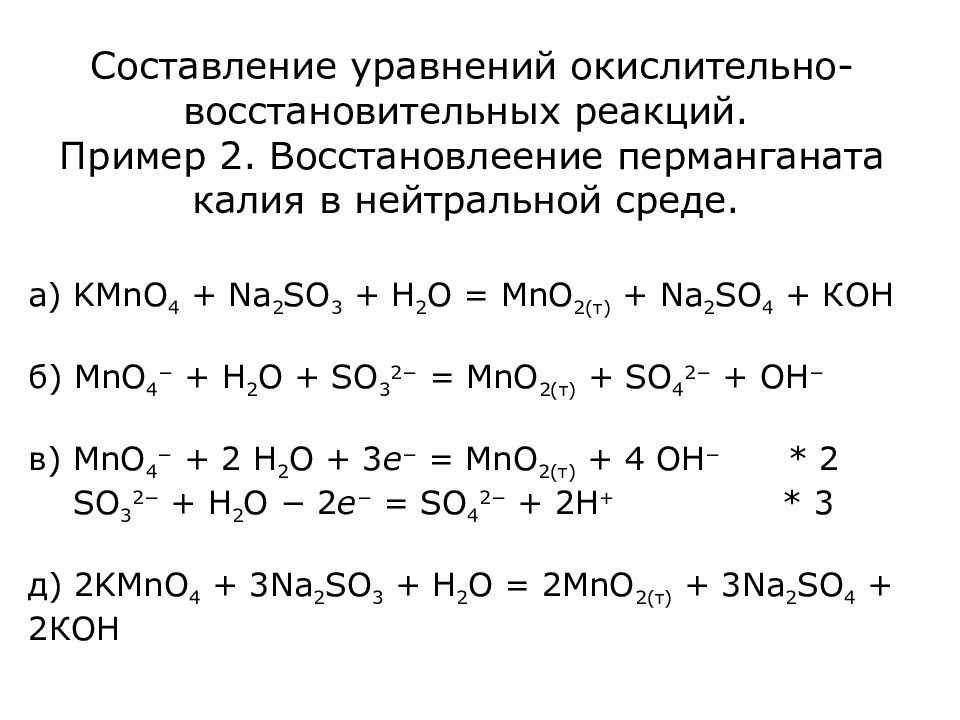
Слайд 21: Составление уравнений окислительно-восстановительных реакций. Пример 2. Восстановлеение перманганата калия в нейтральной среде
а) KMnO 4 + Na 2 SO 3 + H 2 О = Mn О 2(т) + Na 2 SO 4 + КОН б) MnO 4 − + H 2 О + SO 3 2− = Mn О 2(т) + SO 4 2− + ОН − в) MnO 4 − + 2 H 2 О + 3 e − = Mn О 2(т) + 4 ОН − * 2 SO 3 2− + H 2 O − 2 e − = SO 4 2− + 2H + * 3 д) 2KMnO 4 + 3 Na 2 SO 3 + H 2 О = 2Mn О 2(т) + 3 Na 2 SO 4 + 2 КОН
Слайд 22: Составление уравнений окислительно-восстановительных реакций. Пример 3. Восстановлеение перманганата калия в щелочной среде
а) Na 2 SO 3 + KMnO 4 + KOH = Na 2 SO 4 + H 2 O + K 2 MnO 4 б) SO 3 2− + MnO 4 − + OH − = SO 4 2− + H 2 O + MnO 4 2− в) MnO 4 − + 1 e − = MnO 4 2− * 2 SO 3 2− + 2 OH − − 2 e − = SO 4 2− + H 2 О * 1 д) Na 2 SO 3 + 2KMnO 4 + 2KOH = Na 2 SO 4 + H 2 O + 2K 2 MnO 4