Первый слайд презентации
МАСС-СПЕКТРОМЕТРИЯ В ПРОТЕОМНЫХ ИССЛЕДОВАНИЯХ Часть 1: Масс-спектрометрия Лекция 6
Слайд 2
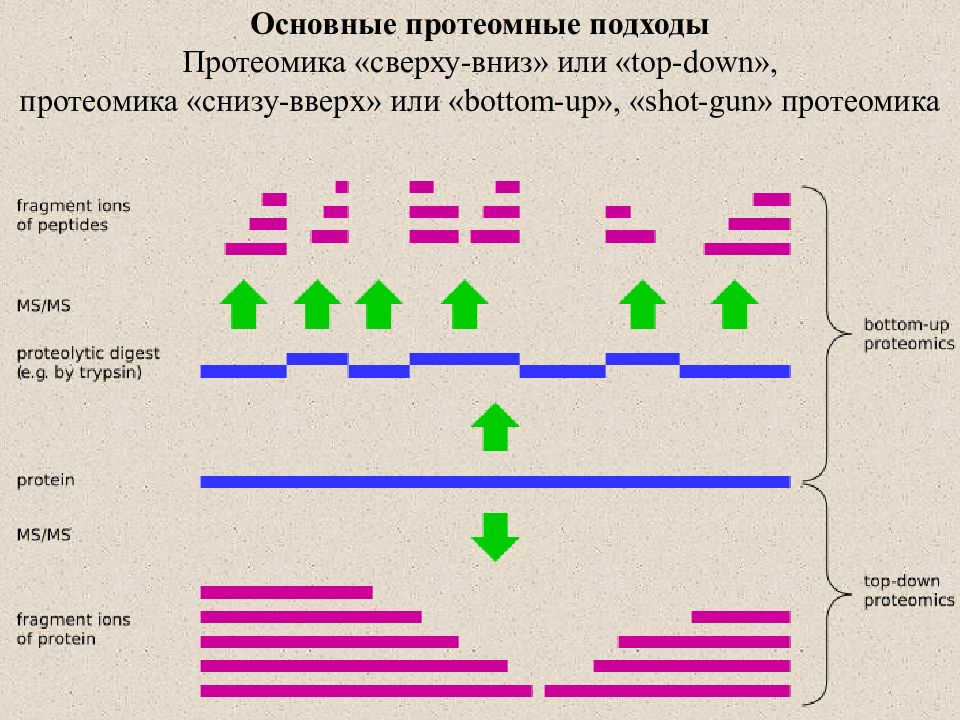
Основные протеомные подходы Протеомика «сверху-вниз» или « top-down », протеомика «снизу-вверх» или « bottom-up », « shot-gun » протеомика
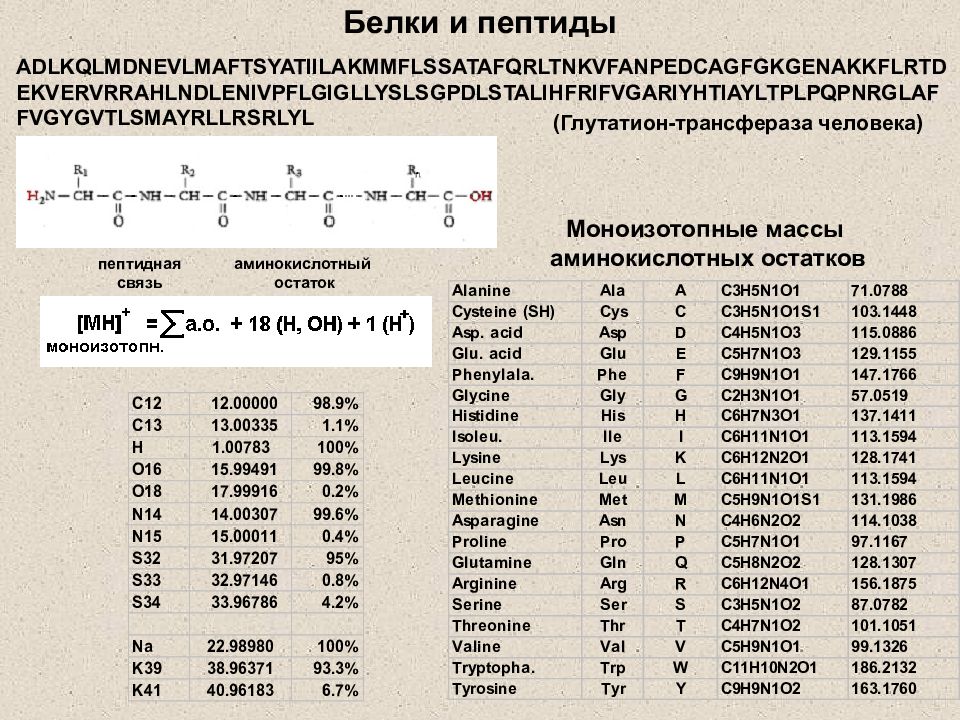
Слайд 3: Белки и пептиды
Моноизотопные массы аминокислотных остатков ADLKQLMDNEVLMAFTSYATIILAKMMFLSSATAFQRLTNKVFANPEDCAGFGKGENAKKFLRTDEKVERVRRAHLNDLENIVPFLGIGLLYSLSGPDLSTALIHFRIFVGARIYHTIAYLTPLPQPNRGLAFFVGYGVTLSMAYRLLRSRLYL (Глутатион-трансфераза человека) пептидная связь аминокислотный остаток
Слайд 4: Пептидный фингерпринт
S APASTTQPIGSTTSTTTKTAGATPATASGLFTIPDGDFFSTARAIVASNAVATNEDLSKIEAIWKDMKVPTDTMAQAAWDLVRHCADVGSSAQTEMIDTGPYSNGISRARLAAAIKEVCTLRQFCMKYAPVVWNWMLTNNSPPANWQAQGFKPEHKFAAFDFFNGVTNPAAIMPKEGLIRPPSEAEMNAAQTAAFVKITKARAQSNDFASLDAAVTRGRITGTTTAEAVVTLPPP (Белок оболочки Х-вируса картофеля) Пептидный фингерпринт Num From-To MH+ HPLC pI Sequence 1 1- 19 1836.92 14,27 9,85 SAPASTTQPIGSTTSTTT K 1 1- 19 1878.93 14,27 9,85 S APASTTQPIGSTTSTTT K 2 20- 44 2472.20 24,79 3,92 TAGATPA..PDGDFFSTA R 3 45- 60 1602.83 12,87 4,11 AIVASNAVATNEDLS K 4 61- 66 759.44 19,33 6,99 IEAIW K 5 67- 69 393.18 4,27 6,99 DM K 6 70- 84 1673.83 19,51 3,92 VPTDTMAQAAWDLV R 7 85-109 2595.13 22,48 4,34 HCADVGSS..GPYSNGIS R 8 110-111 246.16 1,78 11,20 A R 9 112-117 586.39 12,82 10,10 LAAAI K 10 118-123 719.36 14,84 6,29 EVCTL R 11 124-128 655.28 17,08 8,68 QFCM K 12 129-157 3410.65 28,07 9,42 YAPVVWNWM..QGFKPEH K 13 158-176 2058.02 24,21 6,97 FAAFDFFNGVTNPAAIMP K 14 177-198 2330.18 20,92 4,60 EGLIRPPS..AAQTAAFV K 15 199-201 361.25 6,80 10,15 IT K 16 202-203 246.16 1,78 11,20 A R 17 204-218 1565.76 14,77 3,92 AQSNDFASLDAAVT R 18 219-220 232.14 2,11 11,15 G R 19 221-236 1567.86 17,90 3,15 ITGTTTAEAVVTLPPP Num From-To MH+ HPLC pI Sequence 1 1- 56 5430.68 29,08 4,35 SAPASTTQPI…IVASNAVATN E 1 1- 56 5472.69 29,08 4,35 S APASTTQPI…IVASNAVATN E 2 57- 62 704.38 12,90 4,11 DLSKI E 3 63- 96 3730.75 28,42 4,58 AIWKDMKVPT..ADVGSSAQT E 4 97-118 2334.22 22,73 9,58 MIDTGPYSNGISRARLAAAIK E 5 119-155 4353.07 35,01 9,02 VCTLRQFCMKY…NWQAQGFKP E 6 156-177 2452.21 24,30 7,58 HKFAAFDFFNGVTNPAAIMPK E 7 178-185 868.49 16,16 7,04 GLIRPPS E 8 186-187 219.10 1,83 3,25 A E 9 188-228 4255.19 24,38 10,52 MNAAQTAAFV…RGRITGTTTA E 10 229-236 793.48 14,07 6,96 AVVTLPPP Трипсин ( / R,K) Стафилококковая протеаза V8 ( /E) Пептидный калькулятор GPMAW 4.04
Слайд 5: История масс-спектрометрии
1912 год — Томсон создает первый масс-спектрограф и получает масс-спектры молекул кислорода, азота, угарного газа, углекислого газа и фосгена. 1948 год — Камероном и Эггером создан первый масс-спектрометр с время-пролётным масс-анализатором. 1953 год — Пауль патентует квадрупольный масс-анализатор и ионную ловушку. 1956 год — МакЛаферти и Голке создают первый газовый хромато-масс-спектрометр. 1966 год — Мансон и Филд создают ионный источник с химической ионизацией. 1972 год — Каратаев и Мамырин изобретают время-пролётный масс-анализатор с фокусировкой, значительно улучшающий разрешение анализатора. 1974 год — Первый жидкостный хромато-масс-спектрометр создан Арпино, Болдуином и МакЛаферти 1981 год — Барбер, Бордоли, Седжвик и Тайлор создают ионизатор с бомбардировкой быстрыми атомами (FAB). 1982 год — Первый масс-спектр целого белка (инсулин) с помощью бомбардировки быстрыми атомами (FAB). 1983 год — Бланки и Бестал изобретают термоспрей. 1984 год — Галль, а затем Фенн публикуют работы по методу электроспрей. 1987 год — Карас, Бахман, Бар и Хилленкамп изобретают ионизацию лазерной десорбцией при содействии матрицы (MALDI). 1999 год — Александр Макаров изобретает электростатическую ионную ловушку.
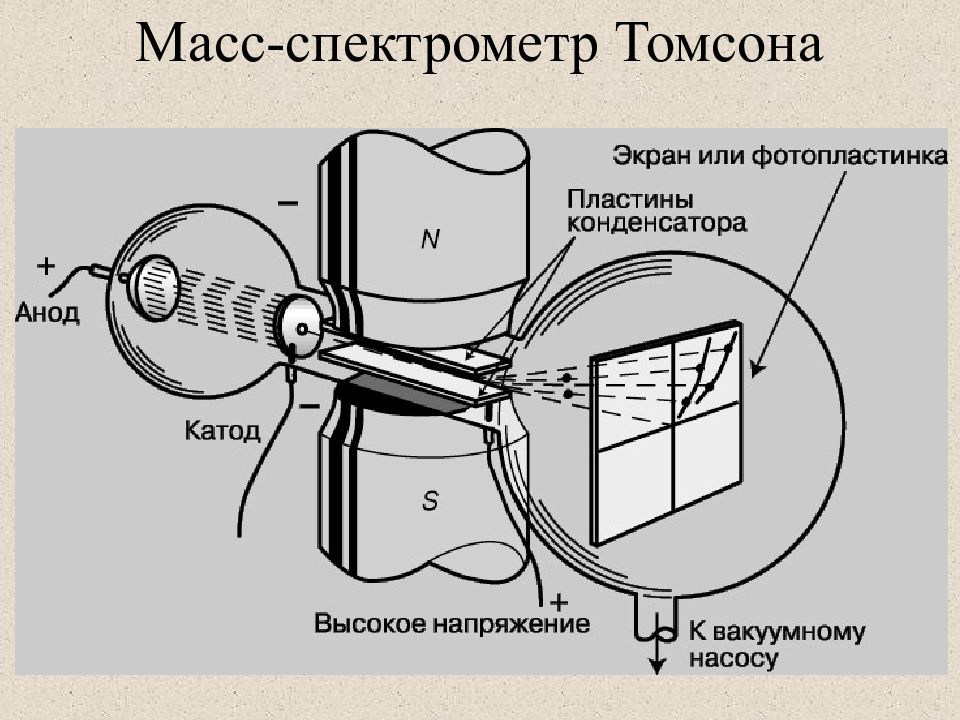
Слайд 6: Масс-спектрометр Томсона
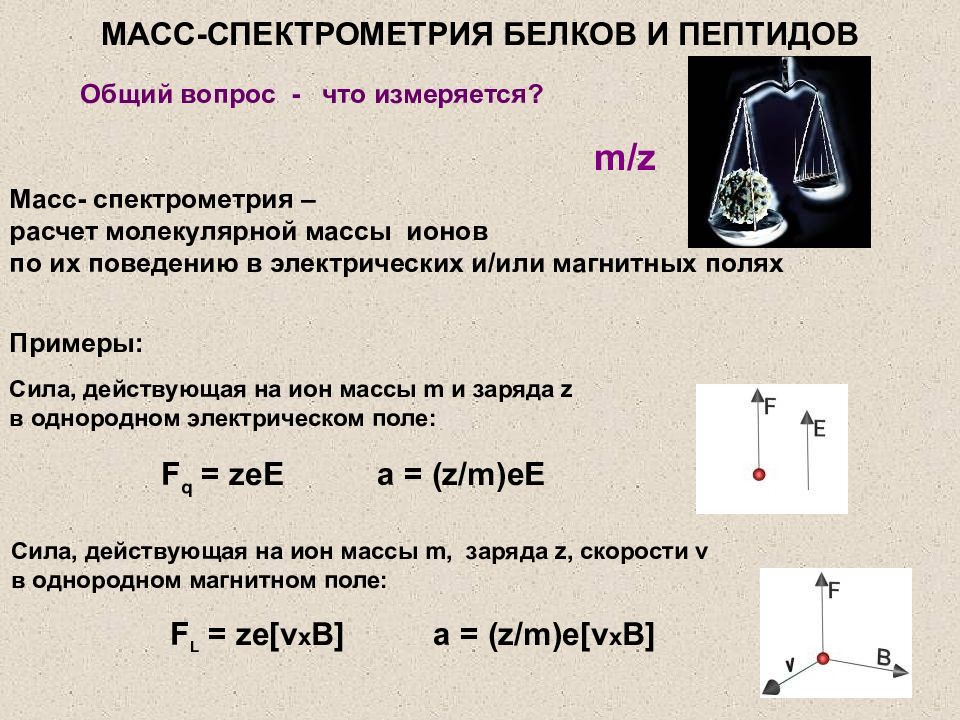
Слайд 14: МАСС-СПЕКТРОМЕТРИЯ БЕЛКОВ И ПЕПТИДОВ
Общий вопрос - что измеряется? Масс- спектрометрия – расчет молекулярной массы ионов по их поведению в электрических и/или магнитных полях Сила, действующая на ион массы m и заряда z в однородном электрическом поле: Сила, действующая на ион массы m, заряда z, скорости v в однородном магнитном поле: Примеры: F q = zeE F L = ze[v x B] a = (z/m)eE a = (z/m)e[v x B] m/z МАСС-СПЕКТРОМЕТРИЯ БЕЛКОВ И ПЕПТИДОВ
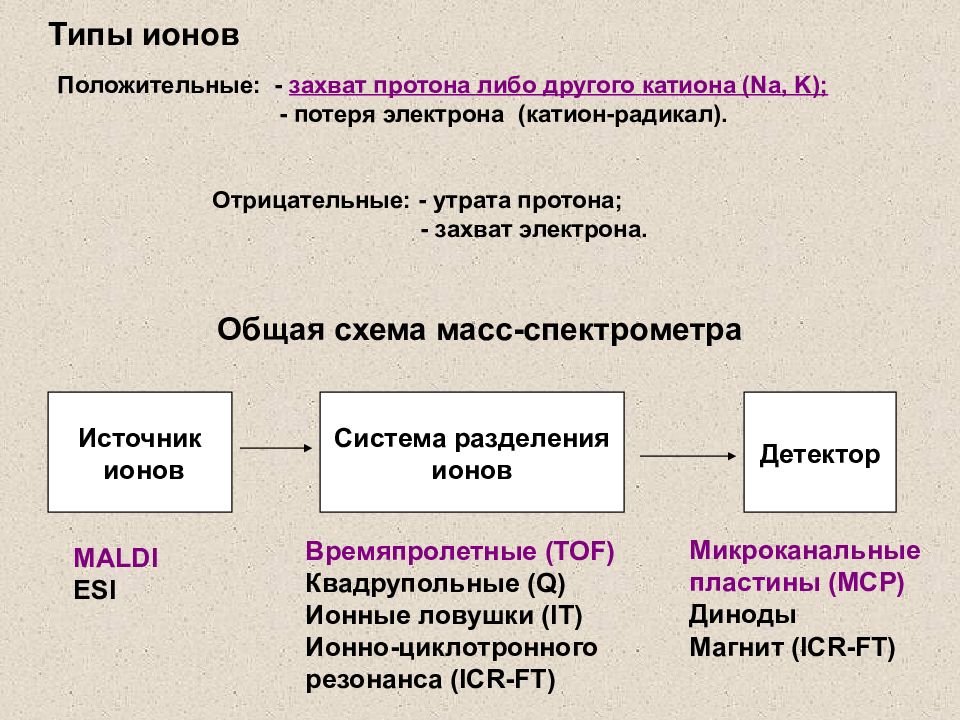
Слайд 15: Типы ионов
Источник ионов Система разделения ионов Детектор Общая схема масс-спектрометра MALDI ESI Времяпролетные (TOF) Квадрупольные (Q) Ионные ловушки (IT) Ионно-циклотронного резонанса ( ICR-FT) Микроканальные пластины ( MCP ) Диноды Магнит ( ICR-FT) Положительные: - захват протона либо другого катиона ( Na, K) ; - потеря электрона (катион-радикал). Отрицательные: - утрата протона; - захват электрона. Типы ионов
Слайд 17: Способы ионизации
Газовая фаза электронная ионизация (EI) химическая ионизация (CI) электронный захват (EC) ионизация в электрическом поле (FI) Жидкая фаза термоспрей ионизация при атмосферном давлении (AP) электроспрей (APESI) химическая ионизация при атмосферном давлении (APCI) фотоионизация при атмосферном давлении (APPI) Твёрдая фаза прямая лазерная десорбция - масс-спектрометрия (LDMS) матрично-активированная лазерная десорбция/ионизация (MALDI) масс-спектрометрия вторичных ионов (SIMS) бомбардировка быстрыми атомами (FAB) десорбция в электрическом поле (FD) плазменная десорбция (PD)
Слайд 19: Масс-анализаторы
Непрерывные масс-анализаторы Магнитный и электростатический секторный масс-анализатор (англ. Sector instrument ) Квадрупольный масс-анализатор (англ. Quadrupole mass analyzer ) Импульсные масс-анализаторы Времяпролётный масс - анализатор ( англ. Time-of-flight mass spectrometry) Ионная ловушка (англ. Ion trap ) Квадрупольная линейная ловушка (англ. Quadrupole ion trap ) Масс-анализатор ионно-циклотронного резонанса с Фурье-преобразованием (англ. Fourier transform ion cyclotron resonance ) Орбитрэп (англ. Orbitrap ) Тандемные масс-анализаторы Квадруполь-квадрупольный ( 3Q) Квадруполь-времяпролетный (Q-TOF) другие
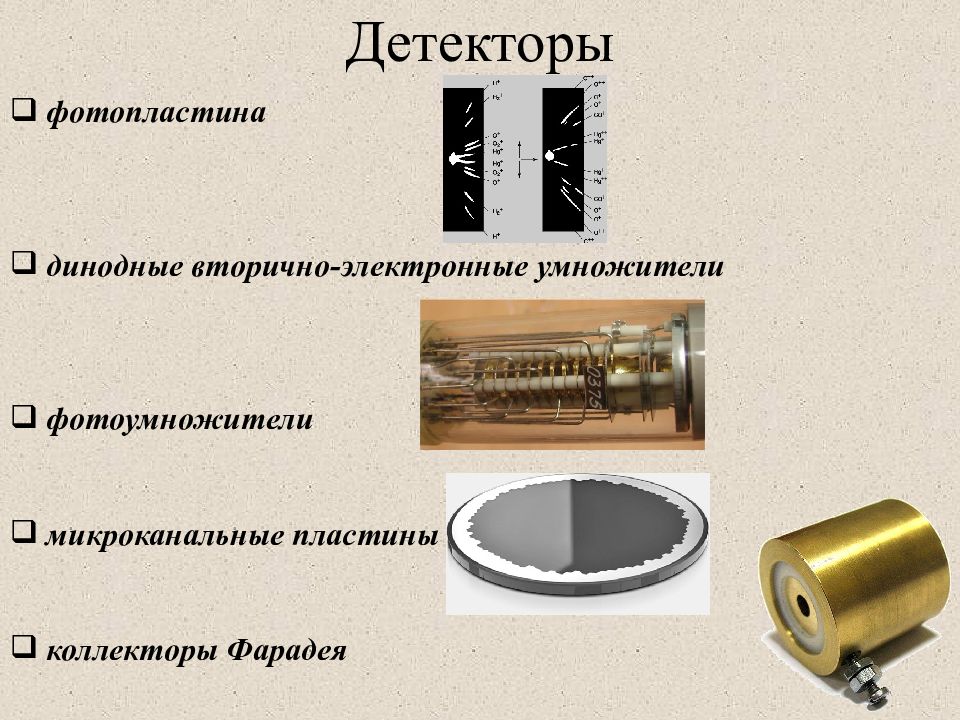
Слайд 20: Детекторы
фотопластина динодные вторично-электронные умножители фотоумножители микроканальные пластины коллекторы Фарадея
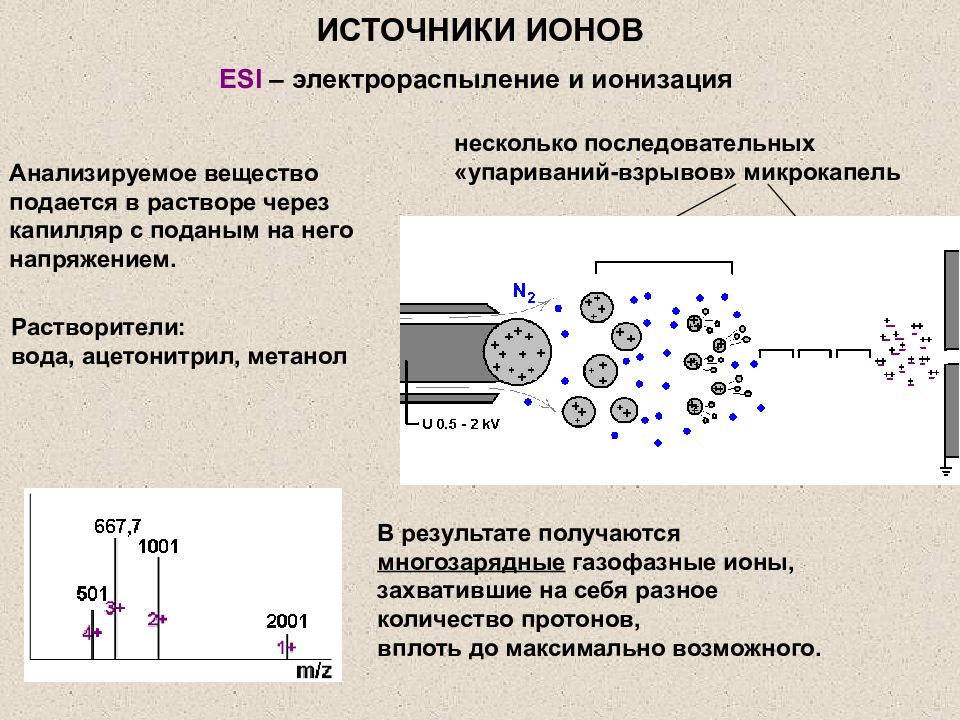
Слайд 21: ИСТОЧНИКИ ИОНОВ
ESI – электрораспыление и ионизация Растворители: вода, ацетонитрил, метанол Анализируемое вещество подается в растворе через капилляр с поданым на него напряжением. несколько последовательных «упариваний-взрывов» микрокапель В результате получаются многозарядные газофазные ионы, захватившие на себя разное количество протонов, вплоть до максимально возможного. ИСТОЧНИКИ ИОНОВ
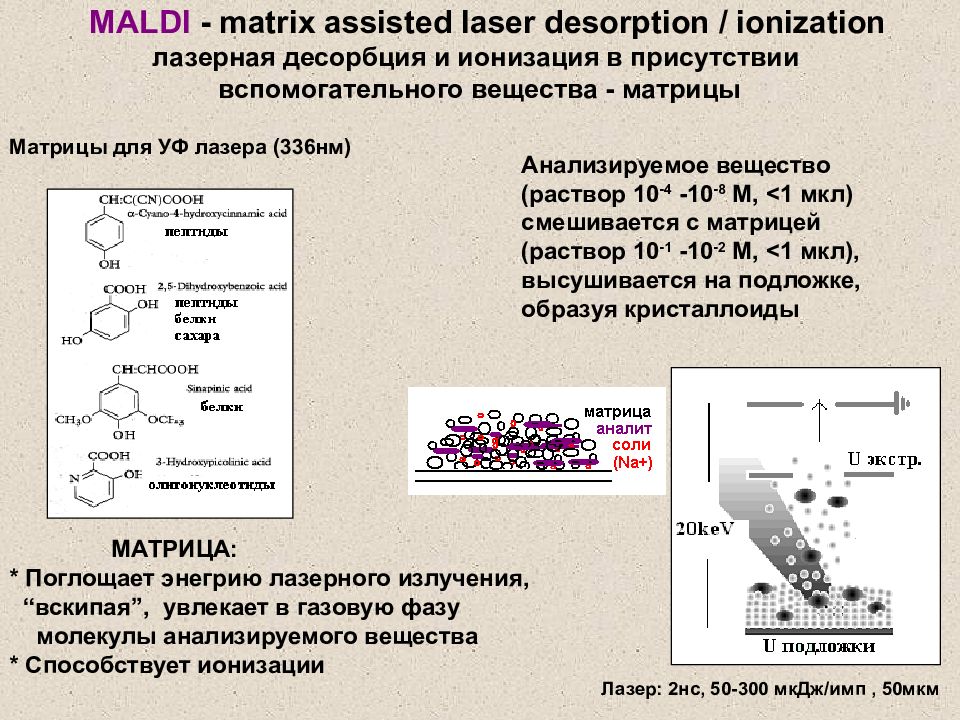
Слайд 22: MALDI - matrix assisted laser desorption / ionization лазерная десорбция и ионизация в присутствии вспомогательного вещества - матрицы
МАТРИЦА: * Поглощает энегрию лазерного излучения, “ вскипая ”, увлекает в газовую фазу молекулы анализируемого вещества * Способствует ионизации Матрицы для УФ лазера (336нм) Лазер: 2нс, 50-300 мкДж / имп, 50мкм Анализируемое вещество (раствор 10 -4 -10 -8 М, <1 мкл) смешивается с матрицей (раствор 10 -1 -10 -2 М, <1 мкл), высушивается на подложке, образуя кристаллоиды MALDI - matrix assisted laser desorption / ionization лазерная десорбция и ионизация в присутствии вспомогательного вещества - матрицы
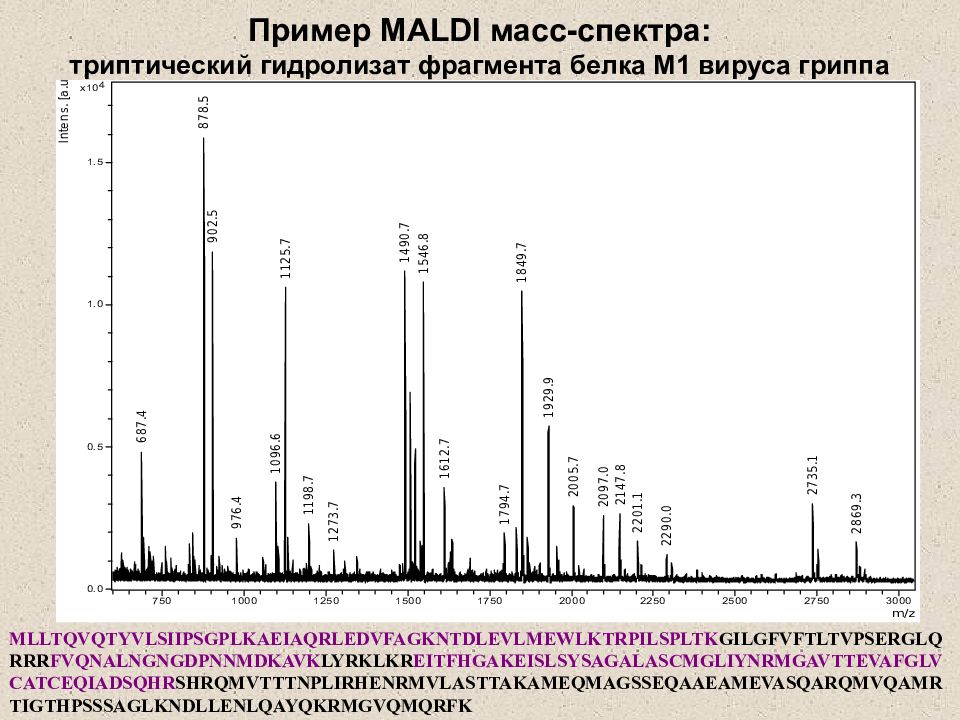
Слайд 24: Пример MALDI масс-спектра: триптический гидролизат фрагмента белка М1 вируса гриппа
MLLTQVQTYVLSIIPSGPLKAEIAQRLEDVFAGKNTDLEVLMEWLKTRPILSPLTK GILGFVFTLTVPSERGLQRRR FVQNALNGNGDPNNMDKAVK LYRKLKR EITFHGAKEISLSYSAGALASCMGLIYNRMGAVTTEVAFGLVCATCEQIADSQHR SHRQMVTTTNPLIRHENRMVLASTTAKAMEQMAGSSEQAAEAMEVASQARQMVQAMRTIGTHPSSSAGLKNDLLENLQAYQKRMGVQMQRFK Пример MALDI масс-спектра: триптический гидролизат фрагмента белка М1 вируса гриппа
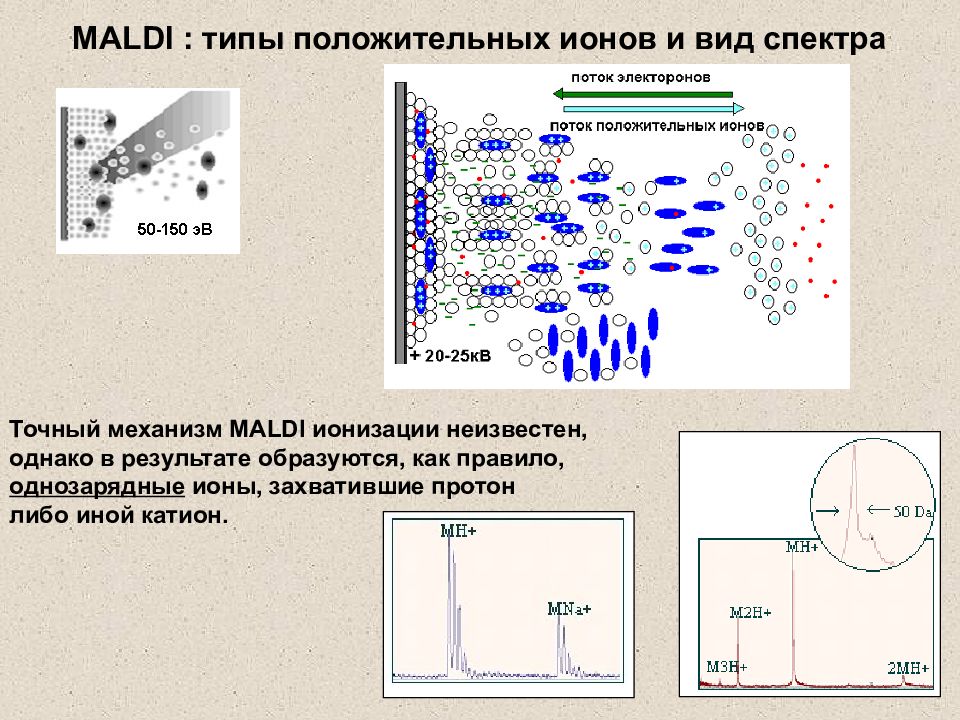
Слайд 25: MALDI : типы положительных ионов и вид спектра
Точный механизм MALDI ионизации неизвестен, однако в результате образуются, как правило, однозарядные ионы, захватившие протон либо иной катион. MALDI : типы положительных ионов и вид спектра
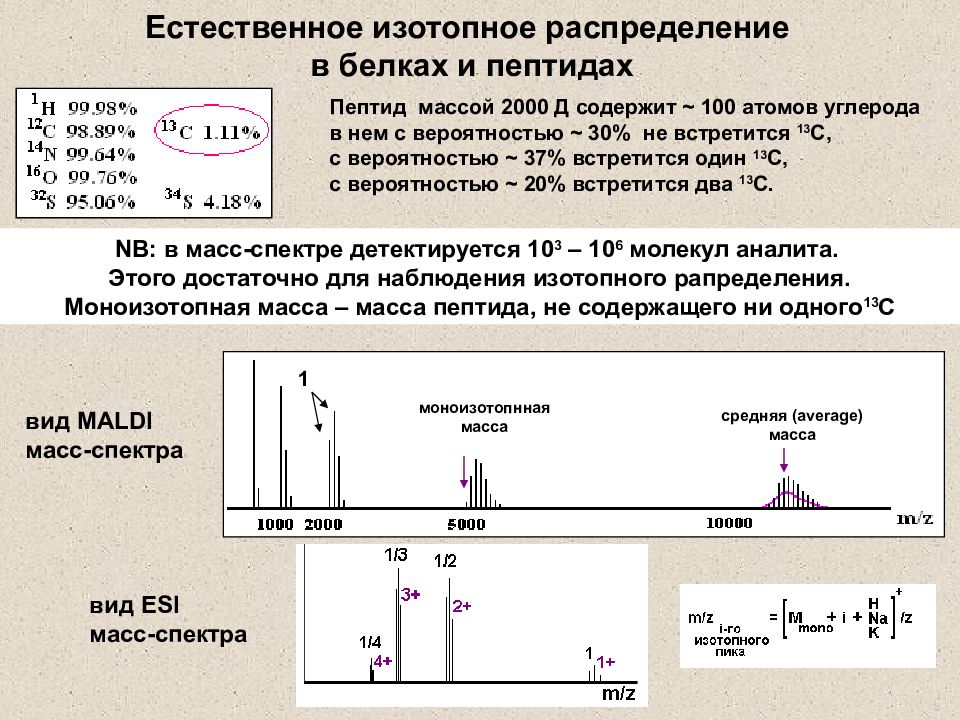
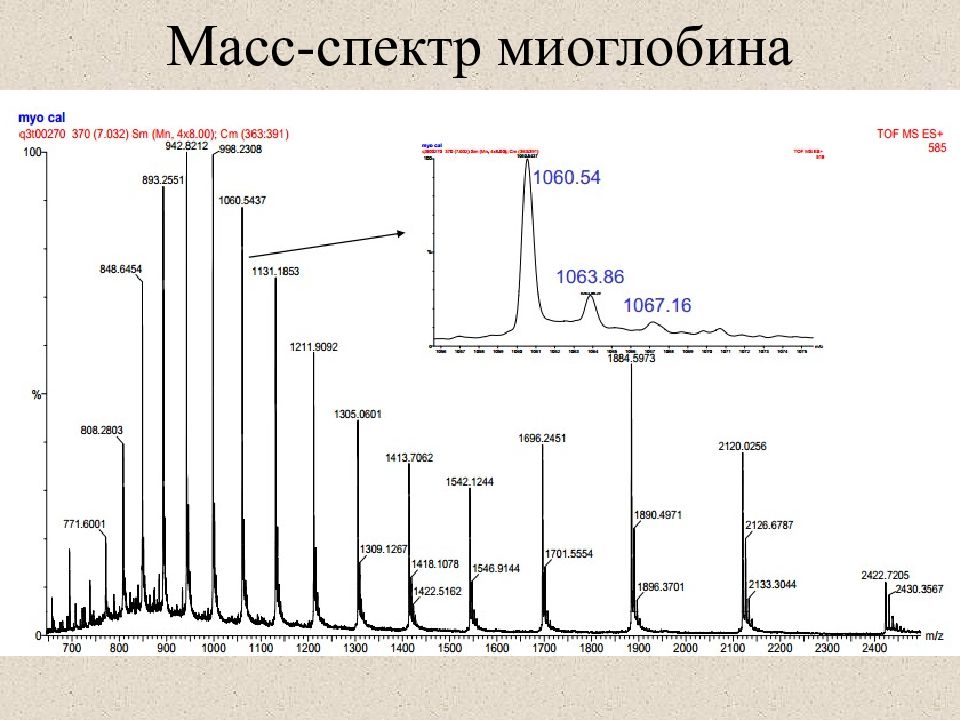
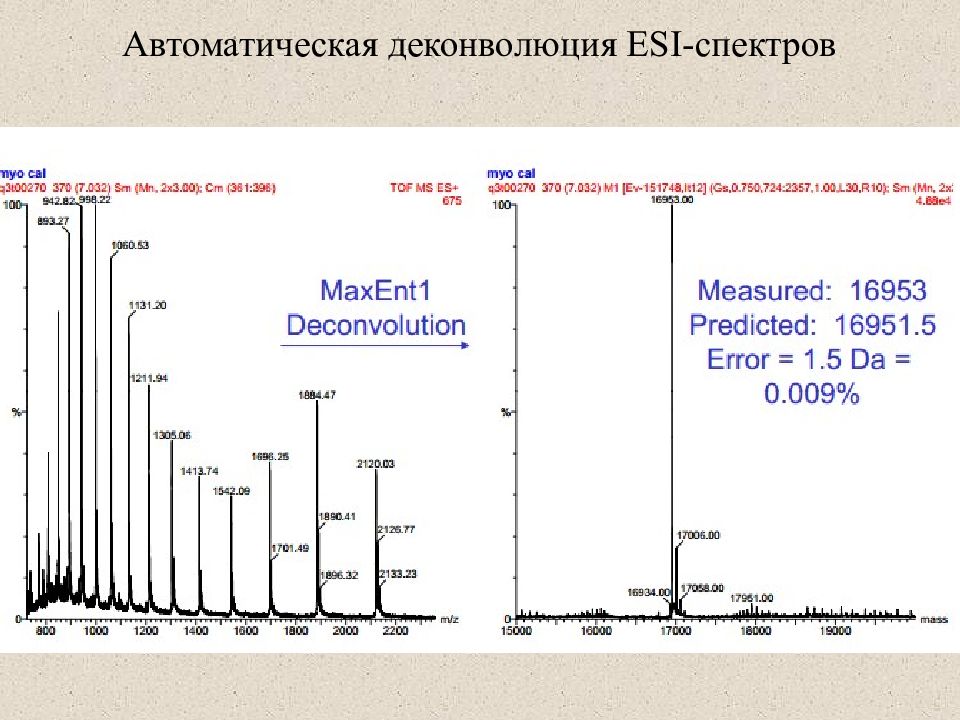
Слайд 26: Естественное изотопное распределение в белках и пептидах
Пептид массой 2000 Д содержит ~ 100 атомов углерода в нем с вероятностью ~ 30% не встретится 13 С, с вероятностью ~ 37% встретится один 13 С, с вероятностью ~ 20% встретится два 13 С. 1 NB: в масс-спектре детектируется 10 3 – 10 6 молекул аналита. Этого достаточно для наблюдения изотопного рапределения. Моноизотопная масса – масса пептида, не содержащего ни одного 13 С вид MALDI масс-спектра вид ESI масс-спектра моноизотопнная масса средняя (average) масса Естественное изотопное распределение в белках и пептидах
Слайд 27: Замечания о ESI и MALDI :
* Оба метода ионизации требуют высокой химической чистоты анализируемого вещества. * Диапазон концентрации аналита при ESI и MALDI 10 -3 – 10 -7 M. * Поскольку разные вещества (например, пептиды) обладают разной способностью к ионизации (захвату протона либо другого катиона), то невозможно делать выводы о количественном соотношении компонентов сложной смеси на основании высот пиков в спектре. При ESI образуется непрерывный поток ионов, при MALDI - сильно ограниченный во времени (до 10нс) пакет ионов. При ESI анализу подлежит более 10 фемтомолей вещества, при MALDI - более 1 фемтомоля вещества. При ESI образуются ионы m/z 0- 5 000, возможно измерение белков до ~ 50 000 Да. При MALDI возможно измерение белков до ~ 200 000 Да, диапазон измеряемых масс ограничен снизу до ~ 500 Да из-за присутсвия с спектрах пиков матрицы. ESI является более “ мягким ” способом ионизации, чем MALDI. Замечания о ESI и MALDI :
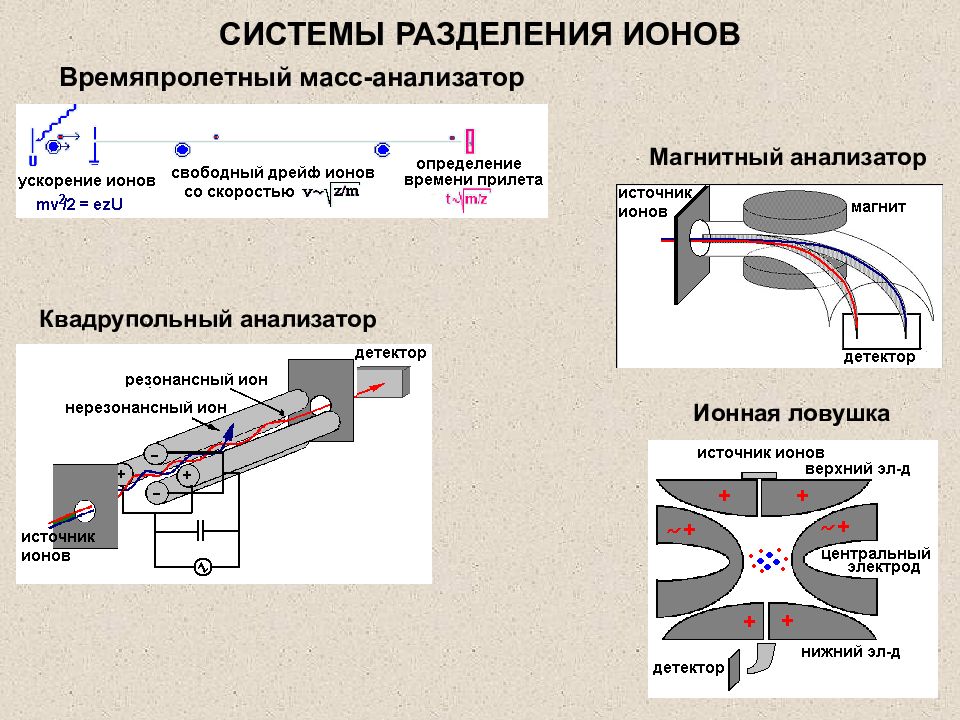
Слайд 28: СИСТЕМЫ РАЗДЕЛЕНИЯ ИОНОВ
Квадрупольный анализатор Ионная ловушка Магнитный анализатор Времяпролетный масс-анализатор СИСТЕМЫ РАЗДЕЛЕНИЯ ИОНОВ
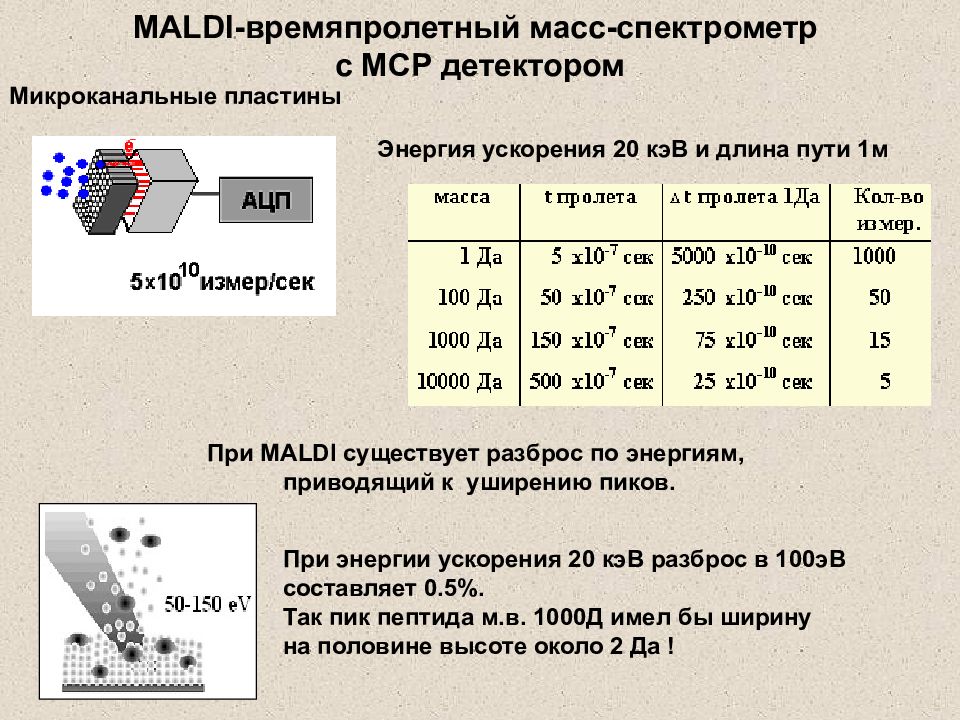
Слайд 29: MALDI -времяпролетный масс-спектрометр с MCP детектором
Микроканальные пластины При MALDI существует разброс по энергиям, приводящий к уширению пиков. Энергия ускорения 20 кэВ и длина пути 1м При энергии ускорения 20 кэВ разброс в 100эВ составляет 0.5%. Так пик пептида м.в. 1000Д имел бы ширину на половине высоте около 2 Да ! MALDI -времяпролетный масс-спектрометр с MCP детектором
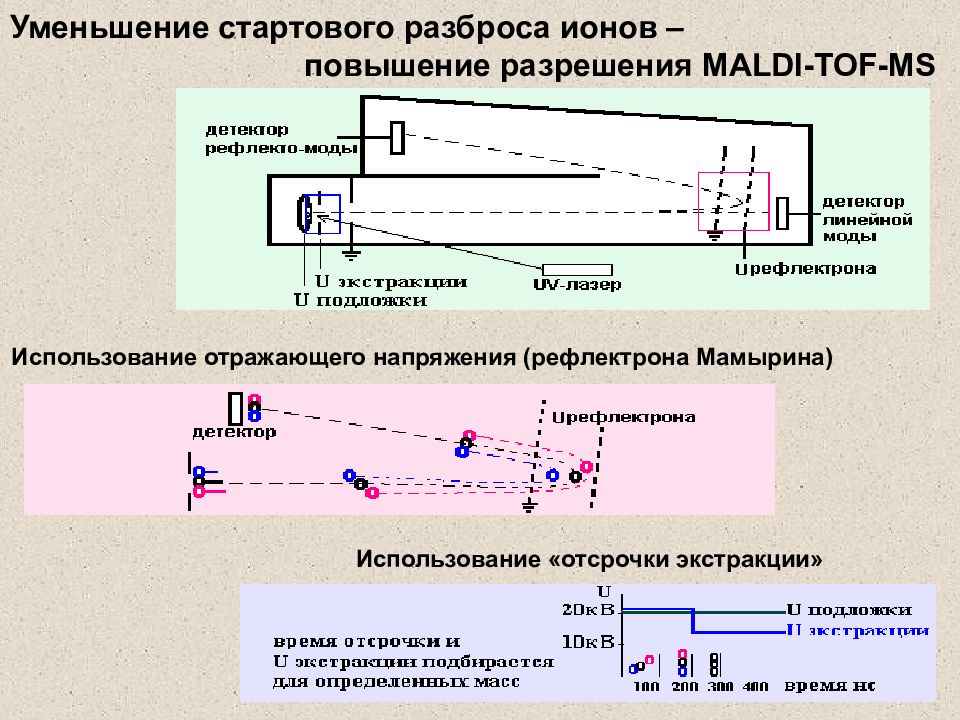
Слайд 30: Уменьшение стартового разброса ионов – повышение разрешения MALDI-TOF-MS
Использование отражающего напряжения (рефлектрона Мамырина) Использование «отсрочки экстракции» вакуум Уменьшение стартового разброса ионов – повышение разрешения MALDI-TOF-MS
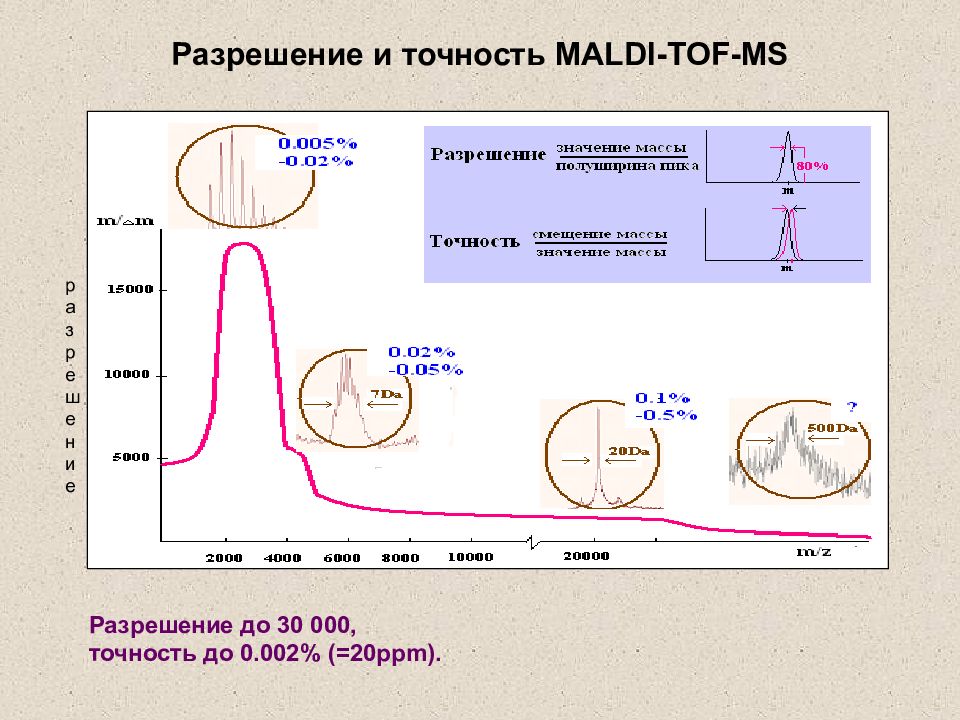
Слайд 32: Разрешение и точность MALDI-TOF-MS
разрешение Разрешение до 30 000, точность до 0.0 02 % (= 2 0 ppm ). Разрешение и точность MALDI-TOF-MS
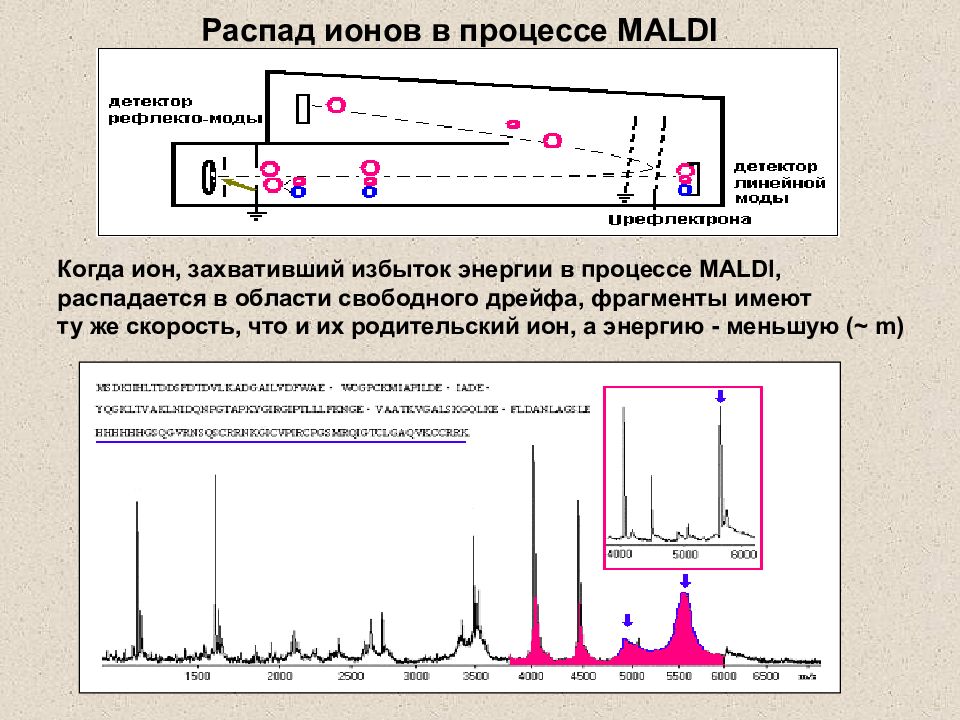
Слайд 33: Распад ионов в процессе MALDI
Когда ион, захвативший избыток энергии в процессе MALDI, распадается в области свободного дрейфа, фрагменты имеют ту же скорость, что и их родительский ион, а энергию - меньшую ( ~ m) Распад ионов в процессе MALDI
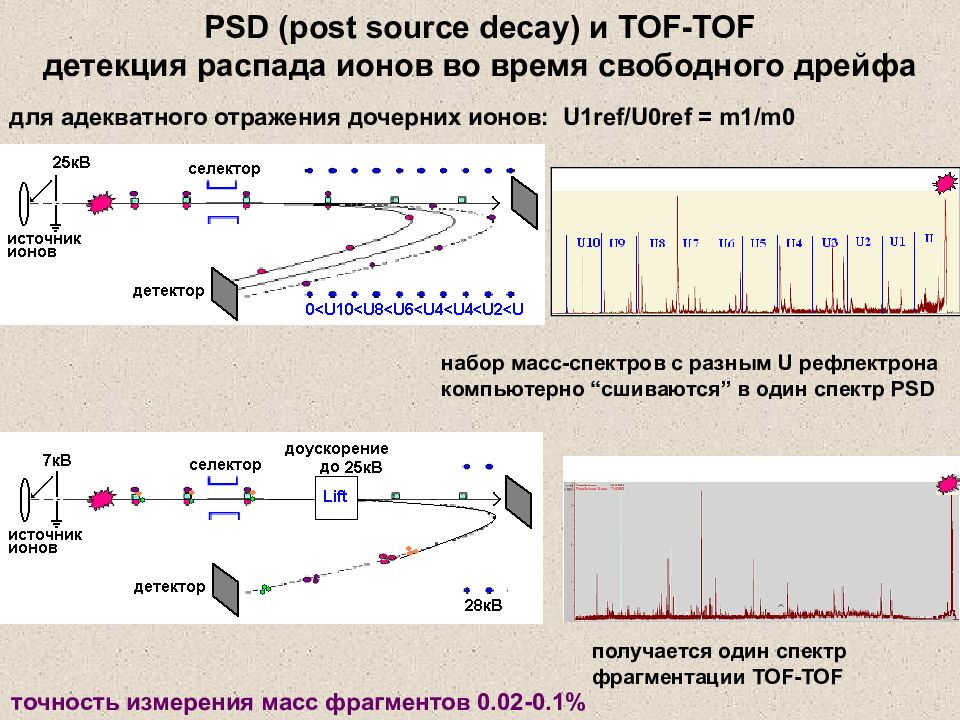
Слайд 34: PSD (post source decay) и TOF-TOF детекция распада ионов во время свободного дрейфа
для адекватного отражения дочерних ионов: U1ref/U0ref = m1/m0 набор масс-спектров с разным U рефлектрона компьютерно “ сшиваются ” в один спектр PSD получается один спектр фрагментации TOF-TOF точность измерения масс фрагментов 0.02-0.1% PSD (post source decay) и TOF-TOF детекция распада ионов во время свободного дрейфа
Слайд 35: ESI – ионная ловушка с МСР детектором
На верхний и нижний электроды подано постоянное положительное напряжение. На короткое время отталкивающее напряжение с верхнего электрода снимается, позволяя пакету ионов влететь в ловушку. На центральном электроде -быстропеременное напряжение, которое заставляет ионы всех m/z двигаться со своими частотами по своим орбитам. Затем, на экстрагирующие линзы подается осцилируещее напряжение, последовательно вытягивающее ионы согласно их m/z. Характеристиками ловушки являются: ёмкость (верхнее значение разделяемых m/z ) до 4000, разрешение до 0.2 Да по диапазону, точность до 0.01% (=100 ppm) для родительских ионов и фрагментов. Ионные ловушки позволяют, варьируя напряжения, оставлять в ловушке определенные ионы и получать спектры их фрагментов. При этом возможен ряд последовательных фрагментаций иона. Ионная ловушка хорошо сочетается с жидкостным хроматографом. ESI – ионная ловушка с МСР детектором
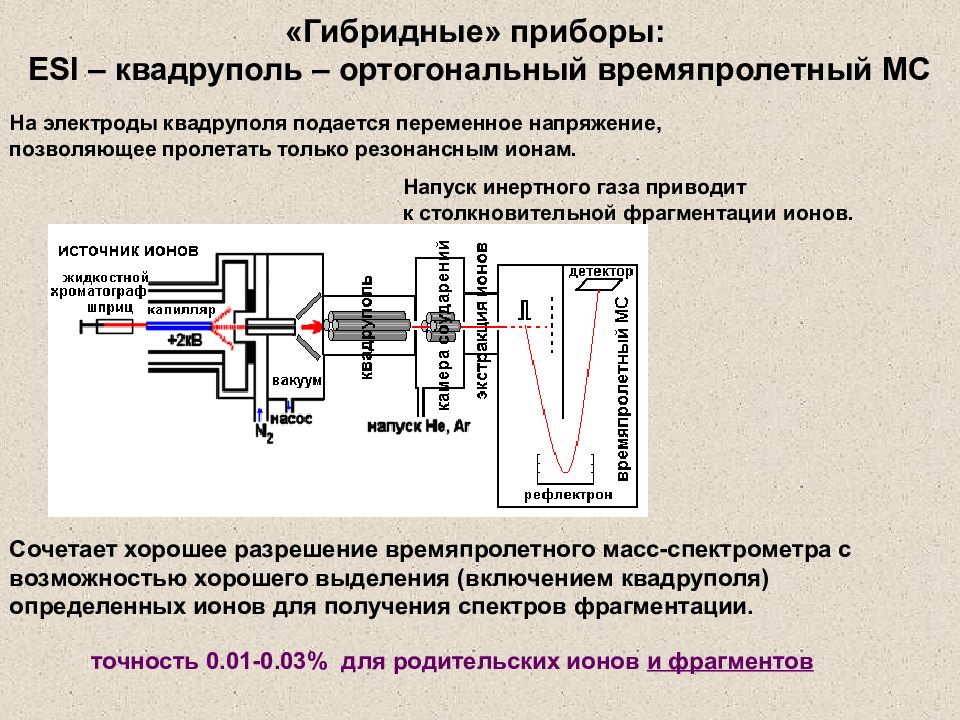
Слайд 36: Гибридные» приборы: ESI – квадруполь – ортогональный времяпролетный МС
Сочетает хорошее разрешение времяпролетного масс-спектрометра с возможностью хорошего выделения (включением квадруполя) определенных ионов для получения спектров фрагментации. На электроды квадруполя подается переменное напряжение, позволяющее пролетать только резонансным ионам. Напуск инертного газа приводит к столкновительной фрагментации ионов. точность 0.01-0.03% для родительских ионов и фрагментов «Гибридные» приборы: ESI – квадруполь – ортогональный времяпролетный МС
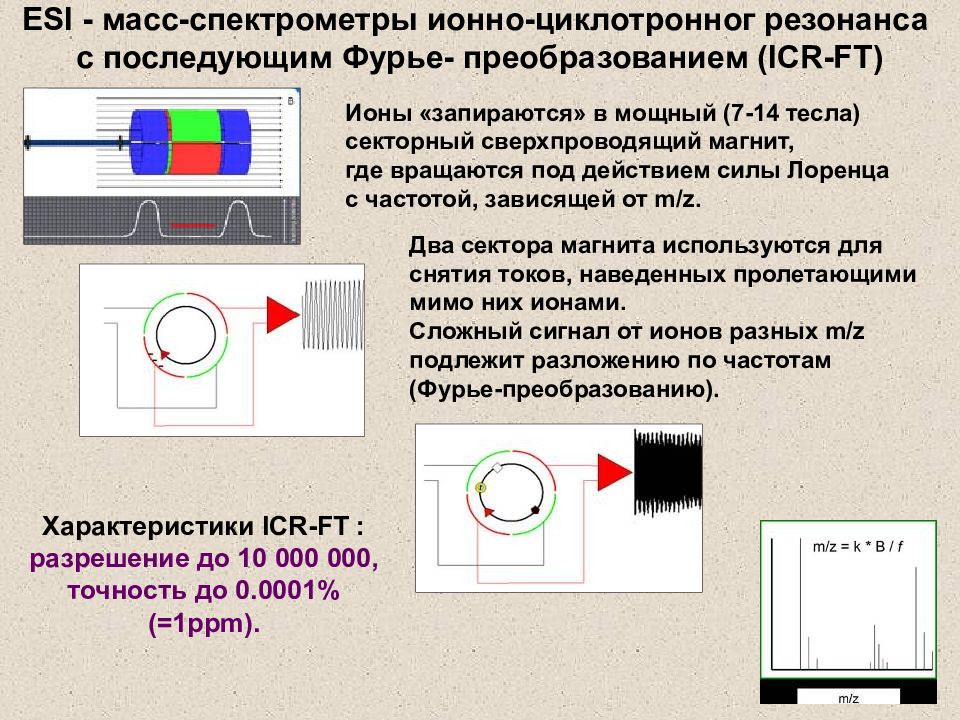
Слайд 37: ESI - масс-спектрометры ионно-циклотронног резонанса с последующим Фурье- преобразованием ( ICR-FT )
Ионы «запираются» в мощный (7-14 тесла) секторный сверхпроводящий магнит, где вращаются под действием силы Лоренца с частотой, зависящей от m/z. Два сектора магнита используются для снятия токов, наведенных пролетающими мимо них ионами. Сложный сигнал от ионов разных m/z подлежит разложению по частотам (Фурье-преобразованию). Характеристики ICR-FT : разрешение до 10 000 000, точность до 0.0001% (=1 ppm). ESI - масс-спектрометры ионно-циклотронног резонанса с последующим Фурье- преобразованием ( ICR-FT )
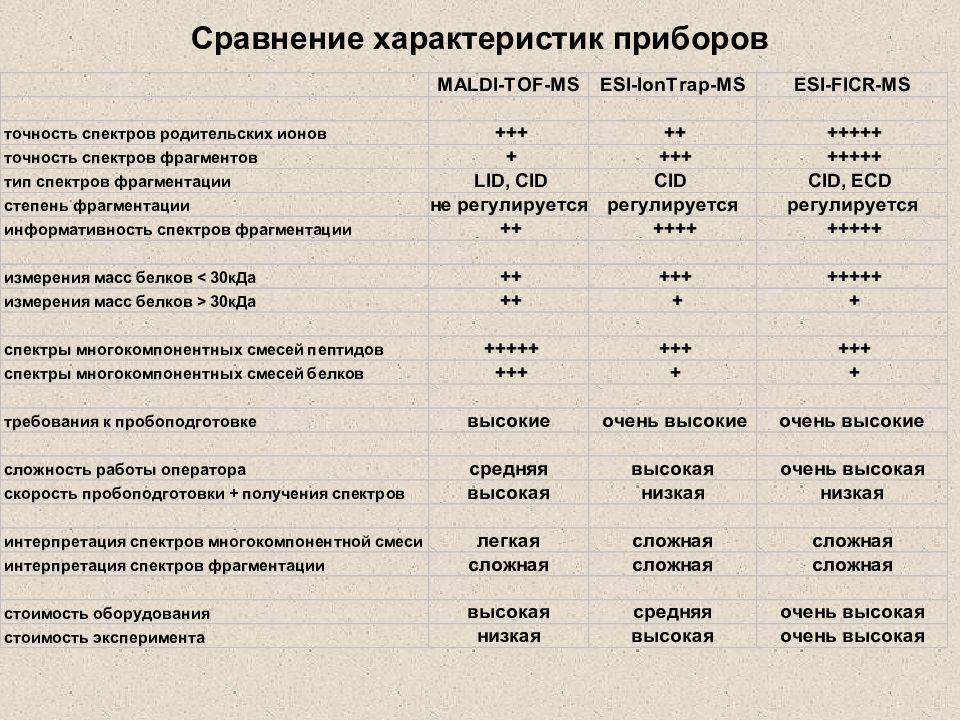
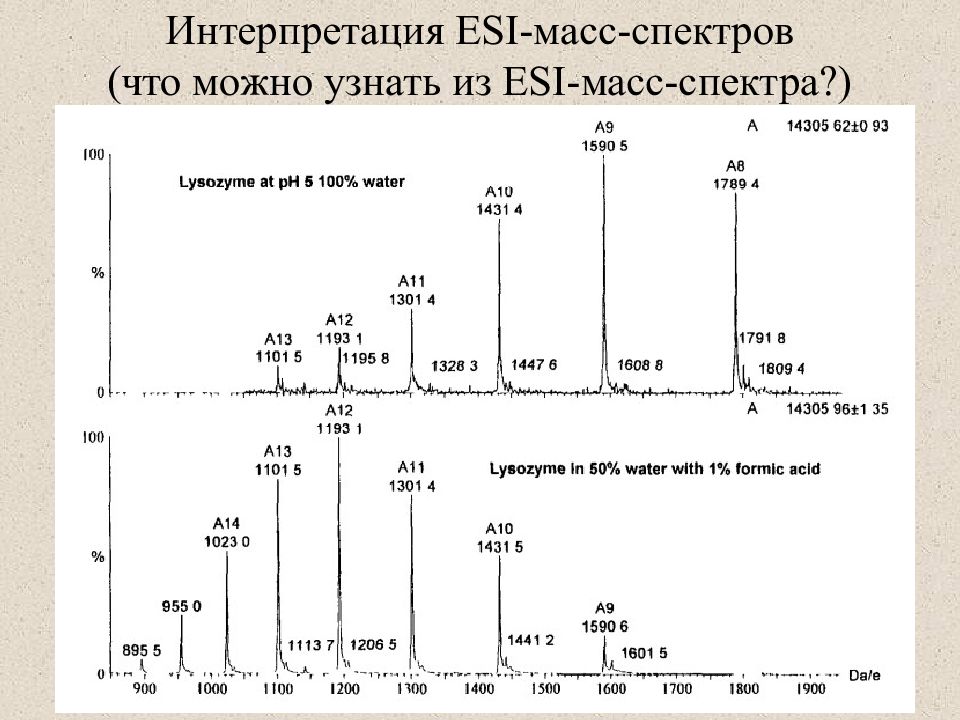
Слайд 39: Интерпретация ESI- масс-спектров (что можно узнать из ESI- масс-спектра?)
Слайд 41: ESI- масс-спектры
Определение молекулярной массы белка Исследование вторичной структуры (распределение зарядов и водородный обмен) Как определить молекулярную массу белка из ESI масс-спектров Определить заряды используя m/z рядом стоящих ионов Z x =(Y-1)/(X-Y) Определить массу белка M=X* z x -z x =Y* z y -z y
Последний слайд презентации: МАСС-СПЕКТРОМЕТРИЯ В ПРОТЕОМНЫХ ИССЛЕДОВАНИЯХ Часть 1:: Историческая справка:
Cовременный масс-спектрометр основан на работе, сделанной сэром Дж. Томсоном в Кэвендишевской лаборатории Кембриджского университета. Исследования Томсона, приведшие к открытию электрона в 1897 году, также привели к созданию первого масс-спектрометра, построенного им для изучения влияния электрического и магнитного полей на ионы, генерируемые в остаточном газе на катоде рентгеновской трубки. В 1906 году Томсон получил Нобелевскую премию по физике за " Выдающиеся заслуги в теоретическом и экспериментальном изучении электропроводимости газов ". К концу Первой мировой войны работы Френсиса Астона и Артура Демпстера привели к значительному улучшению точности и воспроизводимости измерений на масс-спектрометрах. Позднее Альфред Нир воплотил эти достижения вместе со значительным продвижением в вакуумной технике и электронике в конструкцию масс-спектрометра, значительно сократив его размеры. Еще раньше, в 1946 году, Уильям Стивенс предложил концепцию времяпролетных анализаторов. В середине 1950-ых годов Вольфганг Пол разработал квадрупольный масс-анализатор. Другой разработкой Пола было создание квадрупольной ионной ловушки, специально предназначенной для захвата и измерения масс ионов. З а свои инновационные работы Вольфганг Пол получил в 1989 году Нобелевскую премию по физике. В 1950-е годы впервые были соединены газовый хроматограф и масс-спектрометр ( Голке, Маклаферти и Рихаге ). Затем появились новые методы ионизации - бомбардировка быстрыми атомами ( Барбер ), химическая ионизация ( Тальрозе, Филд, Мансон ), полевая десорбция / ионизация ( Беки ), MALDI ( Танака, Карас, Хилленкампф ), ESI ( Доул, Фенн ), ионизация в инуктивно-связанной плазме ( Фассел ). Были разработаны масс-спектрометры ионно-циклотронного резонанса ( Хиппл ) и, затем, с Фурье-преобразованием сигнала ( Комиссаров, Маршалл ), тройные квадрупольные тандемные масс-спектрометры ( Йоуст, Энке ). Историческая справка: