Первый слайд презентации: Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Слайд 2: Вспомним!
Степень окисления – это условный заряд, который приобрел бы атом в молекуле, если бы все электронные пары его химических связей сместились в сторону более электроотрицательных атомов.
Слайд 3
1. Степень окисления атомов в простых веществах равна нулю: 0 0 0 H 2, C l 2, Na. 2. В сложных веществах О -2. 3. В сложных веществах Н +1. 4. С.О. металлов всегда положительна, максимальное значение С.О. металлов главных подгрупп обычно совпадает с номером группы, в которой расположен металл.
Слайд 4
Алгебраическая сумма степеней окисления всех атомов в соединении всегда равна нулю: +1 -2 H 2 SO 4 (+1)·2 + (+6)·1 + (–2)·4 = 0
Слайд 5
В реакциях ионного обмена составные части веществ переходили в состав других веществ без изменений, степени окисления элементов и заряды ионов не менялись : +1 +5 -2 +1 -1 +1 -1 +1 +5 -2 AgNO 3 + HCl = AgCl + HNO 3
Слайд 6
Однако существует огромное множество реакций, в ходе которых меняются степени окисления элементов: 0 0 +2 -2 Fe + S = FeS
Слайд 7
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями (ОВР).
Слайд 8
Элемент, отдающий электроны, называется восстановителем, а принимающий электроны - окислителем. Процесс отдачи электронов называется окислением, а принятия - восстановлением. В процессе окисления степень окисления повышается, в процессе восстановления - понижается.
Слайд 9
Эти процессы неразрывно связаны между собой, число принятых окислителем электронов должно быть равно числу отданных восстановителем электронов. На этом основании составляется электронный баланс и расставляются коэффициенты.
1. Определить степень окисления элементов. 2. Определить элементы, изменившие степень окисления. 3. Составить схему: определить элемент, теряющий, и элемент, принимающий электроны. 4. Составить электронный баланс (число отданных электронов всегда должно равняться числу электронов, принятых). 5. Расставить коэффициенты в уравнении по электронному балансу, определить окислитель и восстановитель.
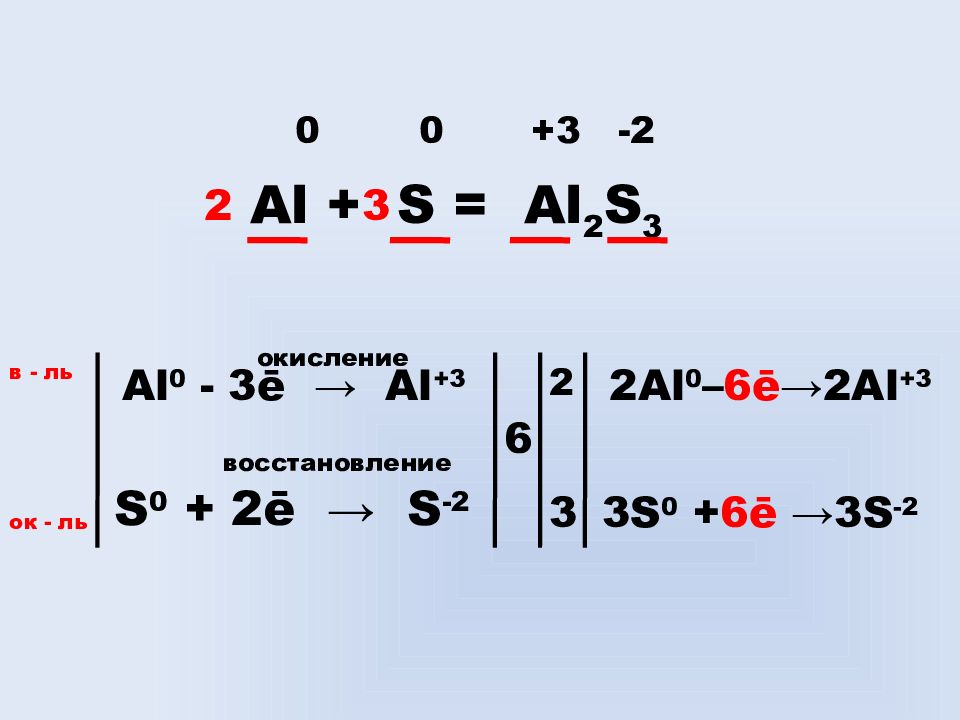
Слайд 11: 0 0 +3 -2
Al + S = Al 2 S 3 Al 0 - 3ē → Al +3 окисление S 0 + 2ē → S -2 восстановление в - ль ок - ль 6 2 3 2 Al 0 – 6 ē → 2 Al +3 3 S 0 + 6ē →3 S -2 2 3
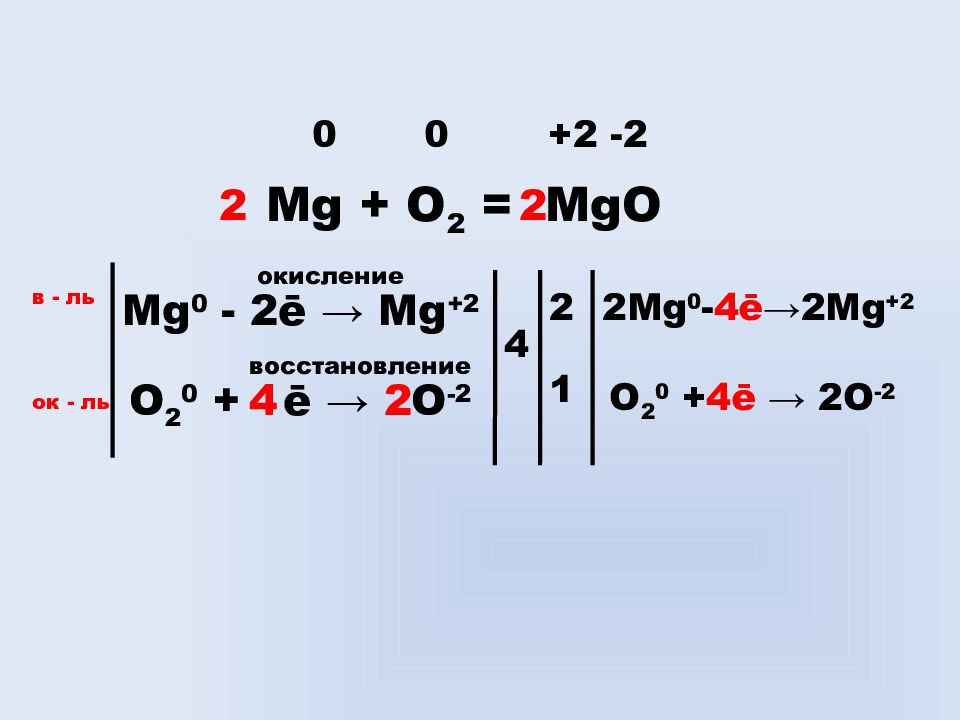
Слайд 12
Mg + O 2 = MgO 0 0 +2 -2 Mg 0 - 2ē → Mg +2 окисление O 2 0 + ē → O -2 2 4 восстановление в - ль ок - ль 4 2 1 2 Mg 0 - 4ē →2 Mg +2 O 2 0 + 4ē → 2 O -2 2 2
Слайд 14: Задание 1
Определите степени окисления всех химических элементов, входящих в состав веществ: NaOH, MgCl 2, K 2 CO 3, AlCl 3, H 3 PO 4, K 2 SO 4, HNO 3, CuSO 4, Fe, Zn ( NO 3 ) 2.
Слайд 15: Задание 2
Расставьте коэффициенты методом электронного баланса в следующих уравнениях реакций: 1) HgO = Hg + O 2 2) H 2 S + O 2 = SO 2 + H 2 O 3) KClO 3 = KCl + O 2 4) CuS + O 2 = CuO + SO 2 5) N 2 + H 2 = NH 3
Последний слайд презентации: Метод электронного баланса для уравнивания окислительно-восстановительных: Домашнее задание:
Расставьте коэффициенты в уравнениях методом электронного баланса: 1) Fe + Cl 2 → FeCl 3 2) Zn + HCl → ZnCl 2 3) HBr + O 2 → H 2 O + Br 2 4) NH 3 + O 2 → NO + H 2 O 5) Zn + HNO 3 → Zn(NO 3 ) 2 + N 2 + H 2 O