Первый слайд презентации: МИКРОЭКОЛОГИЯ ПОЛОСТИ РТА
ГБОУ ВПО КемГМА Кафедра микробиолоии, иммунологии и вирусологии 2013 г.
В полости рта более 500 видов бактерий; Микроорганизмы полости рта находятся в состоянии экологического равновесия; Микроорганизмы полости рта могут вызывать различные стоматологические заболевания (кариес, гингивит, пародонтит и др.)
Слайд 3: Формирование микрофлоры полости рта
Процесс формирования микрофлоры полости рта начинается после рождения ребенка. Источником бактерий являются живые (родители, братья, сестры и пр.) и неживые объекты; На процесс состав микрофлоры влияет прорезывание зубов (основная микрофлора – стрептококки и актиномицеты);
Слайд 4: Формирование микрофлоры полости рта
Период полового созревания – колонизация ПР грамотрицательными анаэробами и спирохетами; На микрофлору ПР взрослых людей влияют многие факторы (возрастные изменения, уровень физической нагрузки, стрессы, образ жизни, привычки и пр.); Пожилой возраст – повышение риска кандидоза.
Слайд 5: Значение нормальной микрофлоры полости рта
Отрицательные функции: Образование зубных бляшек обезображивает зубы, вызывает запах изо рта, приводит к воспалению десен; Микроорганизмы ПР могут участвовать в развитии стоматологических заболеваний; Положительные функции: Резиденты полости рта обеспечивают защиту тканей организма-хозяина; Препятствуют росту патогенных бактерий (конкуренция за рецепторы адгезии, выработка токсических метаболитов):
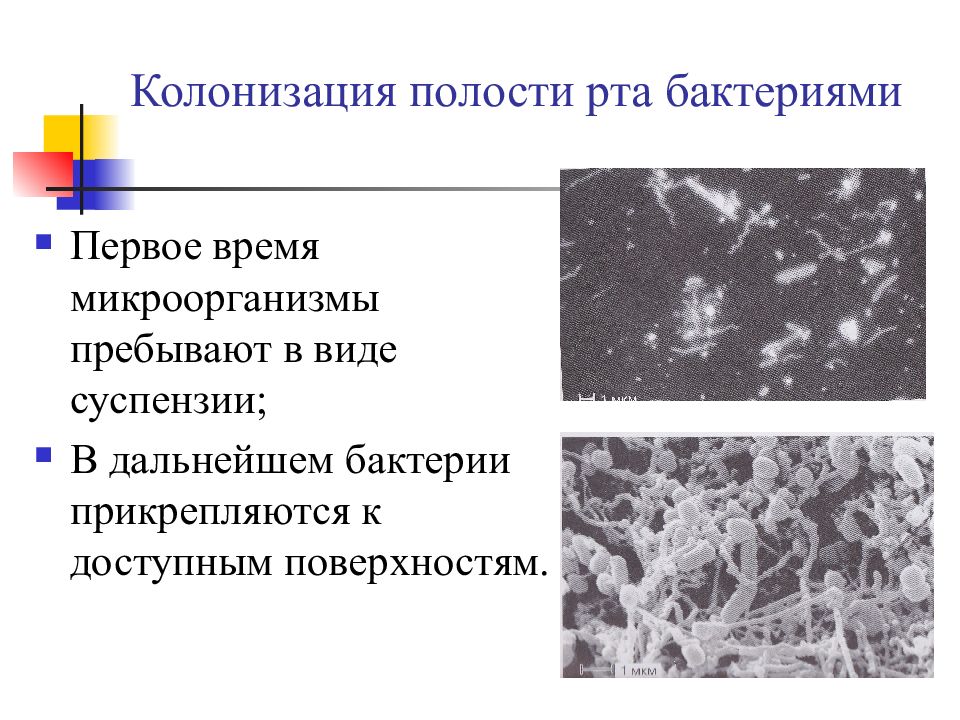
Слайд 6: Колонизация полости рта бактериями
Первое время микроорганизмы пребывают в виде суспензии; В дальнейшем бактерии прикрепляются к доступным поверхностям.
Слайд 7: Механизмы колонизации у бактерий
КС грам+ и грам- бактерий содержат в разных количествах белки, гликопротеины, липопротеины, ЛПС (у грам-) и липотейхоевые кислоты (у грам+); Адгезины – множество специальных поверхностных молекул у бактерий, связывающихся с рецепторами клеток организма-хозяина. У грам- бактерий главными адгезинами являются фимбрии или основные белки наружной мембраны. У грам + - фибриллы, фимбрии или наружные поверхностные белки. Actinomyces naeslundii – фимбрии 1 типа обуславливают адгезию к поверхности зубов, фимбрии 2 типа отвечают за адгезию к углеводным рецепторам эпителиальных клеток;
Слайд 8: Механизмы колонизации у бактерий
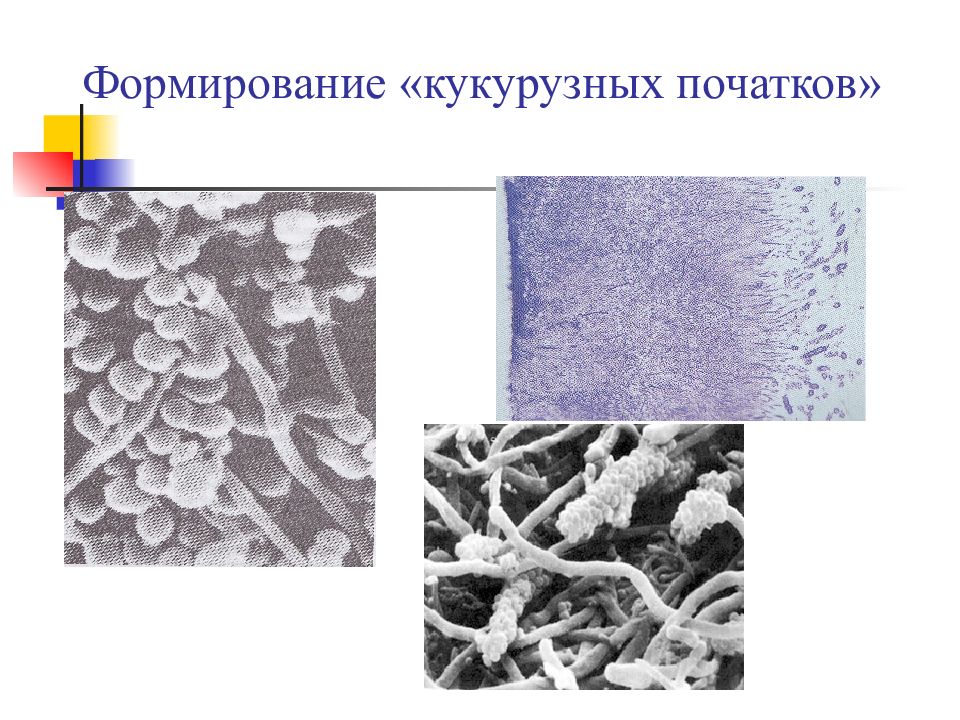
У грам+ стрептококков: S. parasanguis адгезия обусловлена фимбриями (состоят из белка Fal ), S.gordonii, S.mitis, S.cristatus – фибриллами (состоят из белка CshA ). Фибриллы обеспечивают прикрепление этих бактерий к другим бактериям и человеческому фибронектину. S.cristatus связываются с Fusobacterium nucleatum, формируя для зрелых зубных бляшек бактериальные конгломераты, напоминающие кукурузные початки. S.mutans – в адгезии участвует главный поверхностный белок антигенного семейства I/II (AgI/II), связывающийся с рецепторами слюнных пелликул, агглютининов и др. бактерий; Другие виды стрептококков имеются специальные белки ( AbpA и AbpB ) для связывания с амилазой слюны. Многие стрептококки, а также Actinomyces naeslundii синтезируют внеклеточные полисахариды, играющие ключевую роль в формировании бляшки.
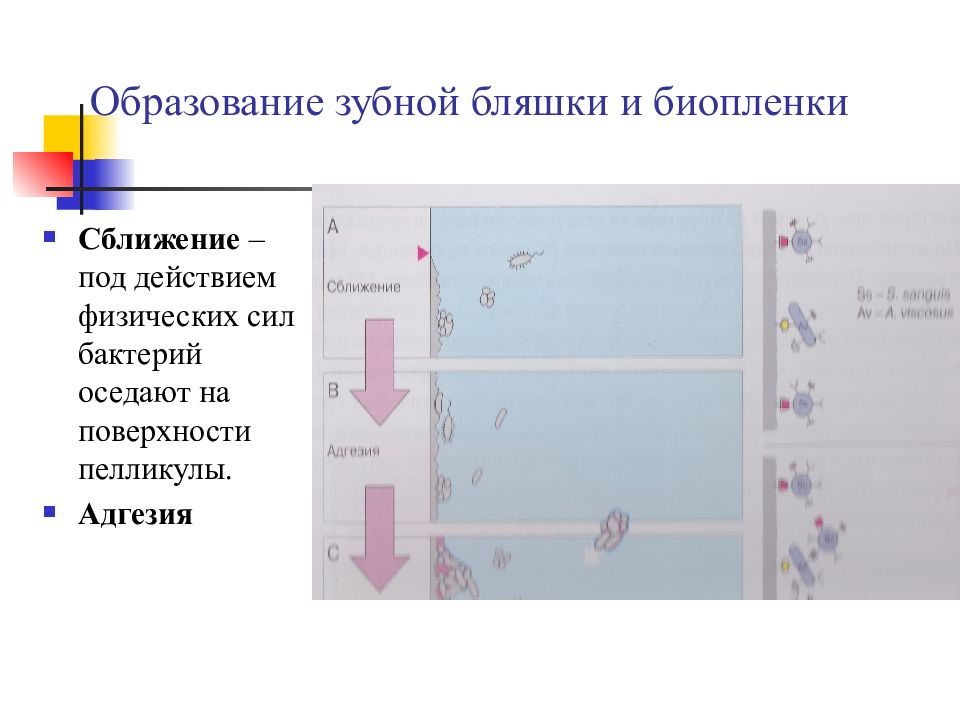
Слайд 10: Образование зубной бляшки и биопленки
Сближение – под действием физических сил бактерий оседают на поверхности пелликулы. Адгезия
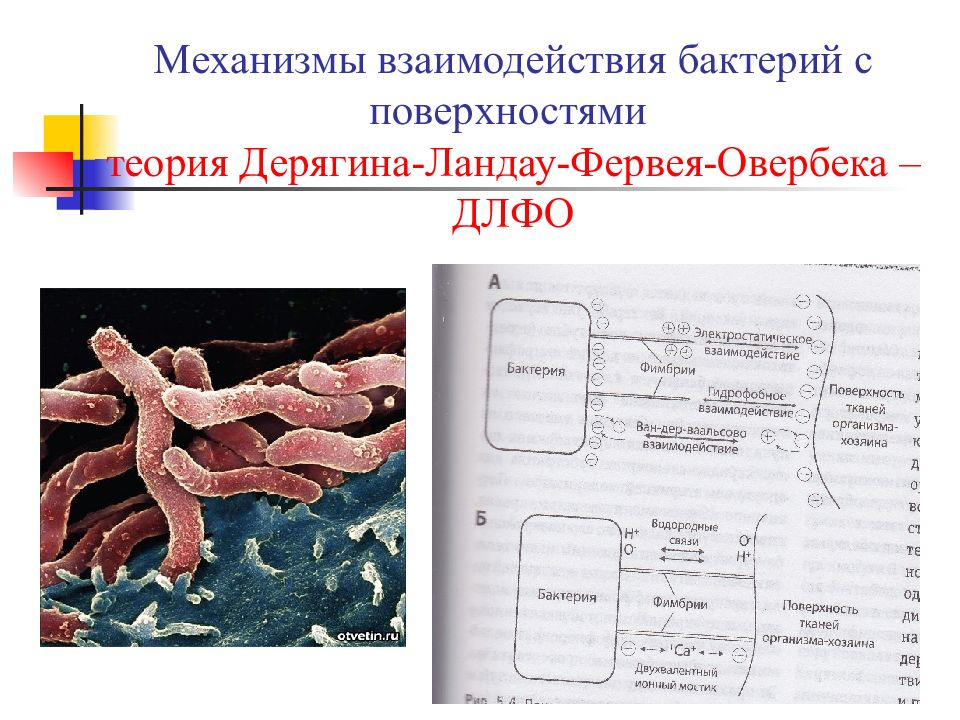
Слайд 11: Механизмы взаимодействия бактерий с поверхностями теория Дерягина-Ландау-Фервея-Овербека – ДЛФО
Слайд 12: Образование зубной бляшки и биопленки
Адгезия – Некоторые бактерии (стрептококки, актиномицеты) осуществляют первичную колонизацию. Для этого на их поверхности имеются специфические рецепторы (адгезины), соединяющиеся с рецепторами пелликулы. В дальнейшем микроорганизмы примыкают к «первичным колонизаторам»
Слайд 13: Образование зубной бляшки и биопленки
Размножение бактерий Формирование микроколоний. Бактерии, участвующие в первичной колонизации зубов (стрептококки до 80% микрофлоры ранней бляшки, A.naeslunndii ) вырабатывают защитные внеклеточные полисахариды (декстраны, леваны).
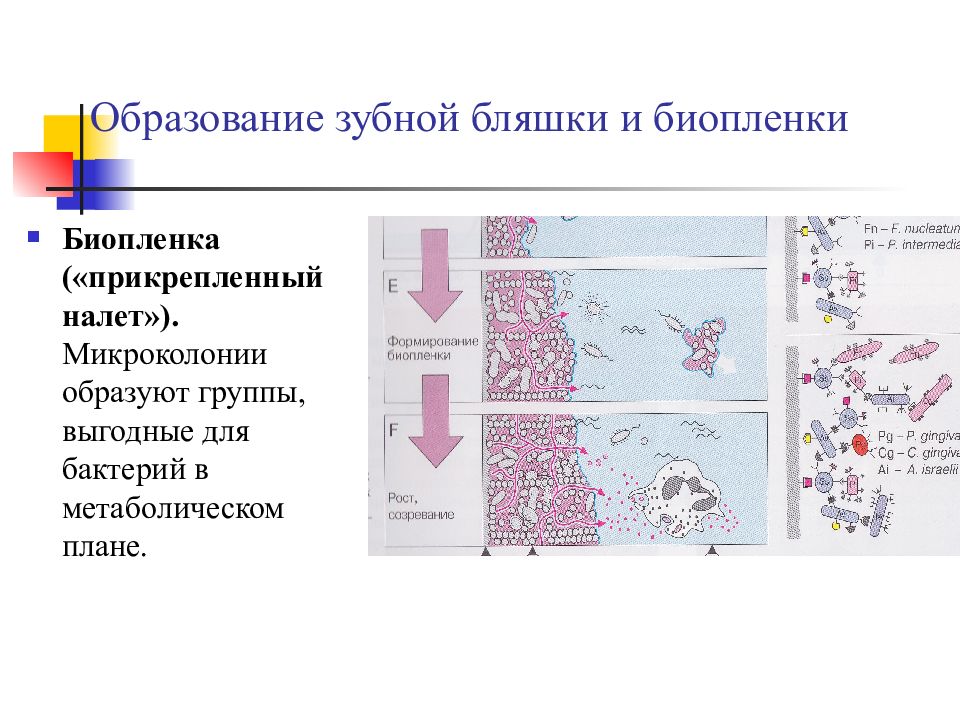
Слайд 14: Образование зубной бляшки и биопленки
Биопленка («прикрепленный налет»). Микроколонии образуют группы, выгодные для бактерий в метаболическом плане.
Слайд 15: Коадгезия
Примеры: Грам- анаэробы: Fusobacterium nucleatum, Tanerella forsythia, Porphyromonas gingivalis образуют различные ассоциации друг с другом и грам+ бактериями; Такие ассоциации полезны для питания метаболически зависимых грам- бактерий; Porphyromonas gingivalis и Selenomonas gordonii сильнее связываются если они фиксированы на поверхности. P. gingivalis после прикрепления к стрептококкам быстро накапливаются в тех местах биопленки, где для этого имеются необходимые условия для выживания.
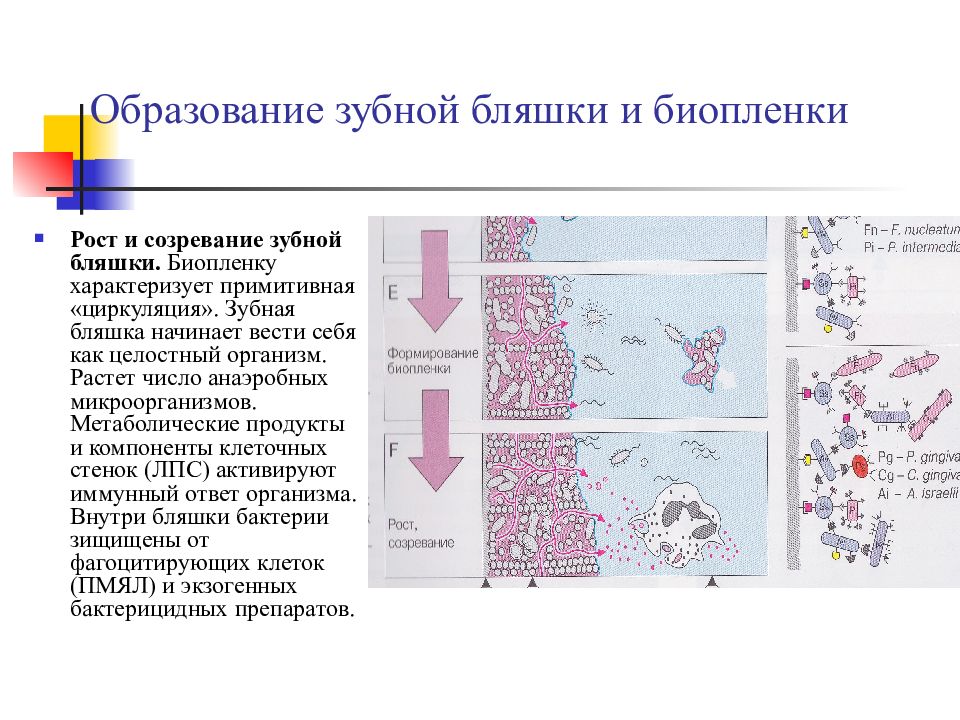
Слайд 17: Образование зубной бляшки и биопленки
Рост и созревание зубной бляшки. Биопленку характеризует примитивная «циркуляция». Зубная бляшка начинает вести себя как целостный организм. Растет число анаэробных микроорганизмов. Метаболические продукты и компоненты клеточных стенок (ЛПС) активируют иммунный ответ организма. Внутри бляшки бактерии зищищены от фагоцитирующих клеток (ПМЯЛ) и экзогенных бактерицидных препаратов.
Слайд 18: Социальное поведение бактерий в биоплёнке ( Q uorum sensing)
Чувство кворума - регуляция экспрессии генов (генов плазмид), зависимая от концентрации клеток. Взаимодействие между бактериями сопровождается продукцией особых сигнальных молекул – аутоиндукторов (АИ); Благодаря чувству кворума бактерии могут регулировать свою вирулентность, компетентность, способность к конъюгации и продукции антибиотиков, подвижность, образование спор и формирование биопленки.
Слайд 19: Взаимодействие бактерий с человеческими клетками
Эпителиоциты выполняют барьерную функцию; Эпителиоциты передают сигналы о присутствии бактерий по сложной коммуникативной сети между бактериями и клетками хозяина; В ходе молекулярного «диалога» информация передается среди бактерий, эпителиоцитов, местных иммуноцитов и клеток воспаления в слизистой оболочке. Результаты общения – от выработки эффекторных молекул иммунитета (цитокинов) до гибели клеток хозяина;
Слайд 20: Взаимодействие бактерий с человеческими клетками
Результатом интимных взаимодействий бактерий с ЭК может быть проникновение (интернализация) микроорганизмов в клетки хозяина ( P. gingivalis, A. actinomycetemcomitans ). Внутриклеточная среда обеспечивает бактерий необходимыми питательными веществами и частичную защиту от разрушительного действия факторов иммунитета. Treponema denticola не проникают в живые клетки, а индуцируют деполимеризацию и реанжировку актиновых микрофиламентов наряду с ослаблением крепления самих эпителиоцитов. Кроме того спирохеты образуют хемотрипсиноподобный фермент, который разрушает соединительные комплексы и может транспортироваться в клетку, где он повреждает актиновый цитоскелет.
Слайд 21: Строение биопленки:
Грибовидные образования, образуемые микроколониями бактерий; Плотно «упакованные» клетки; Многочисленные протяженные мембранные структуры; Мембранные пузырьки или везикулы; Проводящие водные каналы; Экзополимерный матрикс: - Экзополисахариды - ДНК - Белки, включая гликопротеины
Слайд 22: Основные функции ЭПС:
►ЭПС матрикса защищает бактерии в биопленке от антибактериальных препаратов, повреждающих факторов внешней среды ► ЭПС сорбирует металлы и минералы, растворенные органические вещества, концентрирует питательные вещества, ферменты и ростовые факторы. ► ЭПС матрикса фиксирует и закрепляет бактерии в тех экологических нишах, где существует угроза смыва. Основные функции ЭПС:
Слайд 23: Способы защиты бактерии в биопленке:
1. Блокировка - предотвращение глубокого проникновения в матрикс биопленки крупных молекул (например, антител) и клеток, вызывающих воспаление. 2. Взаимная защита - например, антибиотикоустойчивые бактерии способны выделять защитные энзимы, которые могут защищать соседние антибиотикочувствительные бактерии в биопленке. 3. Бездействие – это образование метаболически неподвижных субпопуляций(неактивные бактерии в биопленках не подвергаются действию антибиотиков, уничтожающих обычно активные бактерии).
Слайд 24
Действие антибиотиков на бактерии Антибиотики, проникающие в биопленки и угнетающие или убивающие образующие их микроорганизмы. Антибиотики, практически не проникающие в биопленки, но эффективно препятствующие их расселению за счет мигрирующих бактерий.
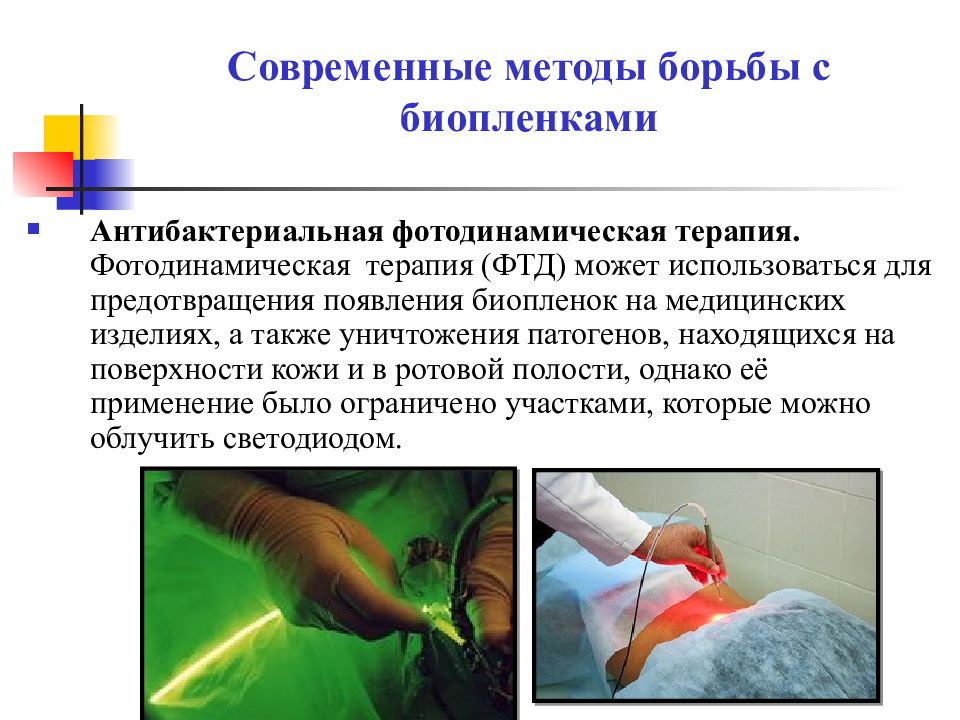
Слайд 25: Современные методы борьбы с биопленками
Антибактериальная фотодинамическая терапия. Фотодинамическая терапия (ФТД) может использоваться для предотвращения появления биопленок на медицинских изделиях, а также уничтожения патогенов, находящихся на поверхности кожи и в ротовой полости, однако её применение было ограничено участками, которые можно облучить светодиодом.
Слайд 26
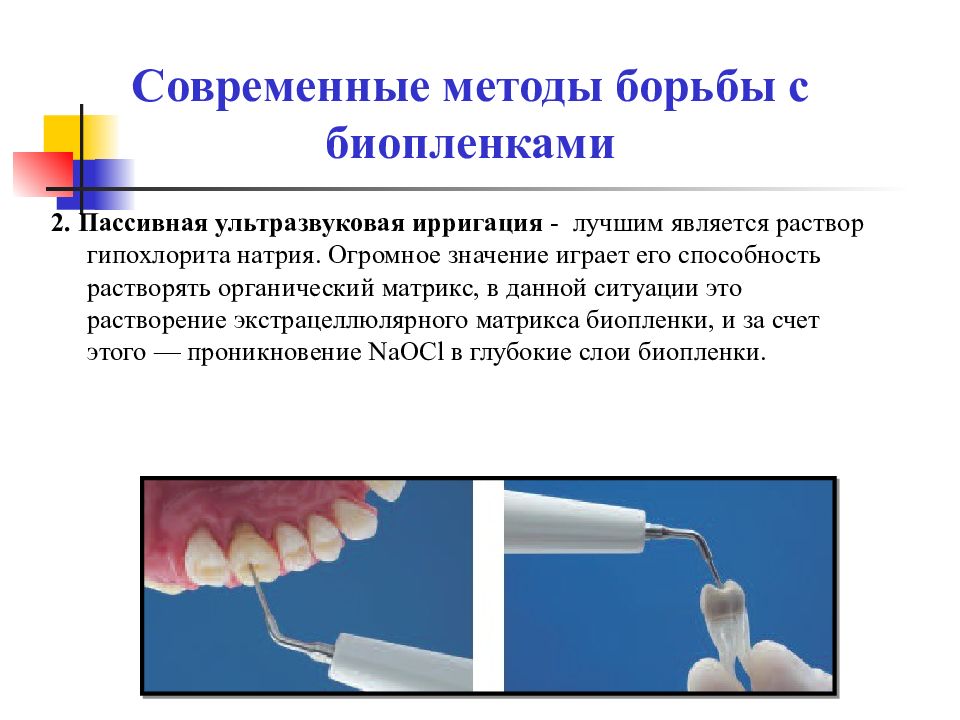
2. Пассивная ультразвуковая ирригация - лучшим является раствор гипохлорита натрия. Огромное значение играет его способность растворять органический матрикс, в данной ситуации это растворение экстрацеллюлярного матрикса биопленки, и за счет этого — проникновение NaOCl в глубокие слои биопленки. Современные методы борьбы с биопленками
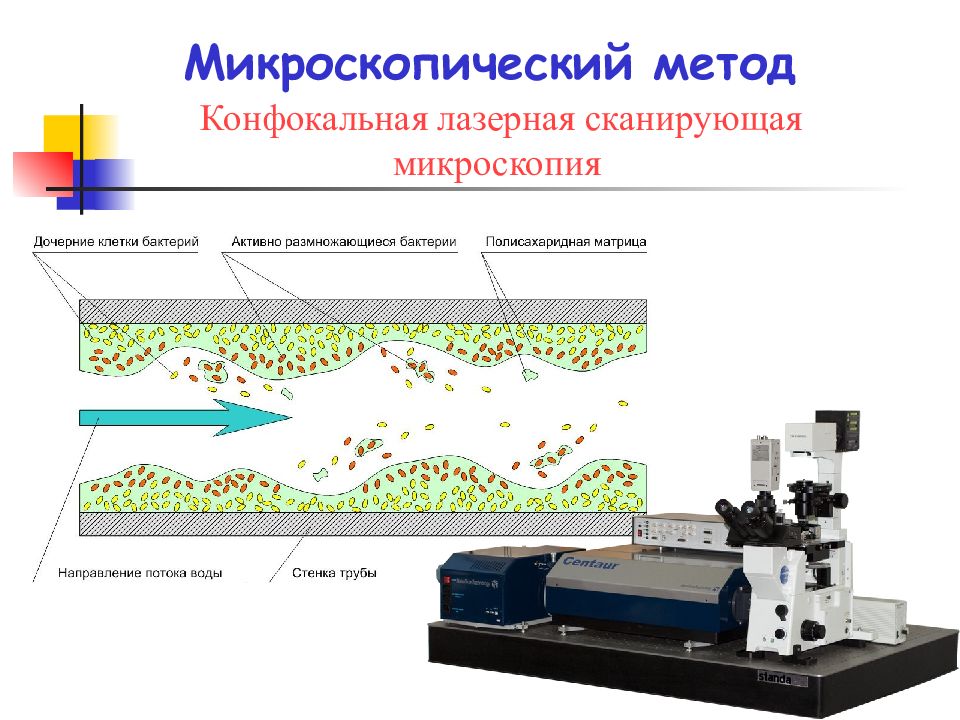
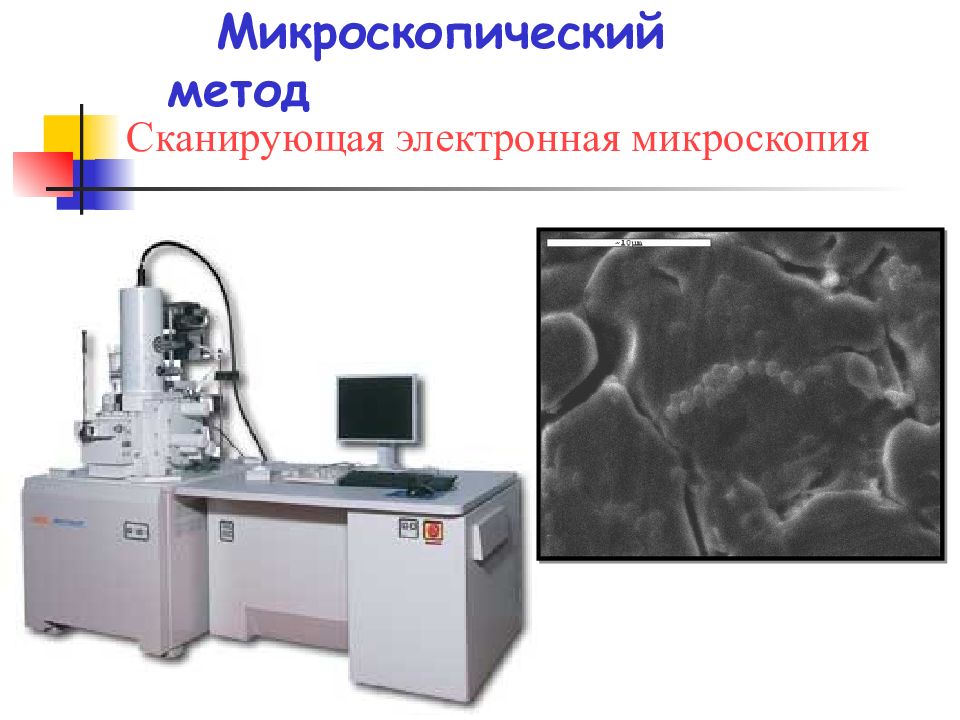
Слайд 27: Методы исследования биопленок:
микроскопические исследования, проводимые in situ ; генетические исследования; транскриптомные и протеомные исследования; метагеномные исследования.
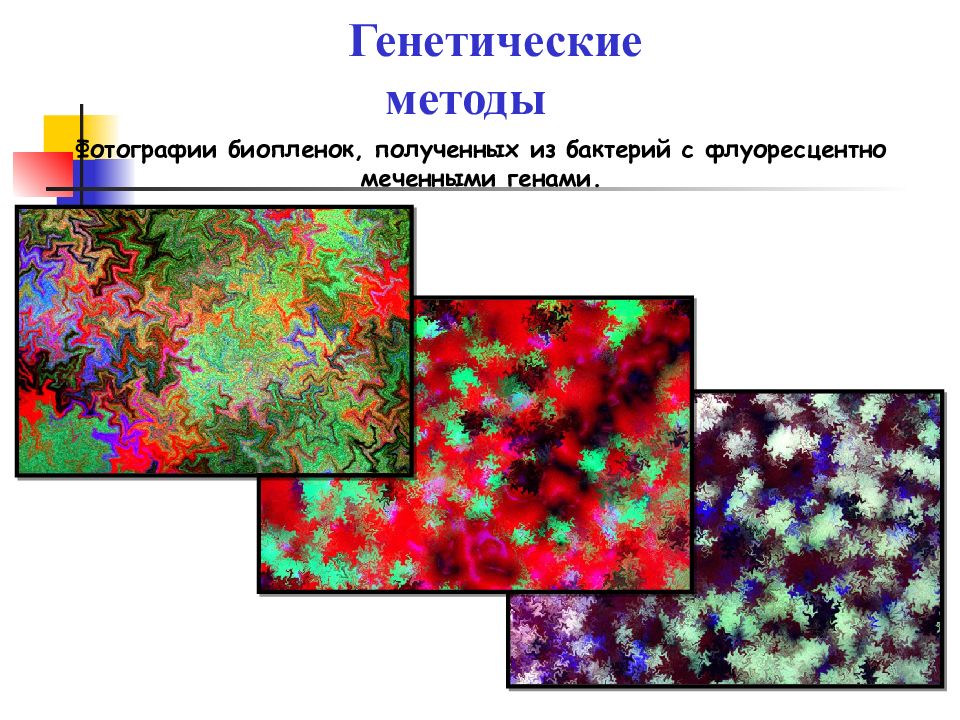
Слайд 32
Генетические методы Фотографии биопленок, полученных из бактерий с флуоресцентно меченными генами.