Слайд 2
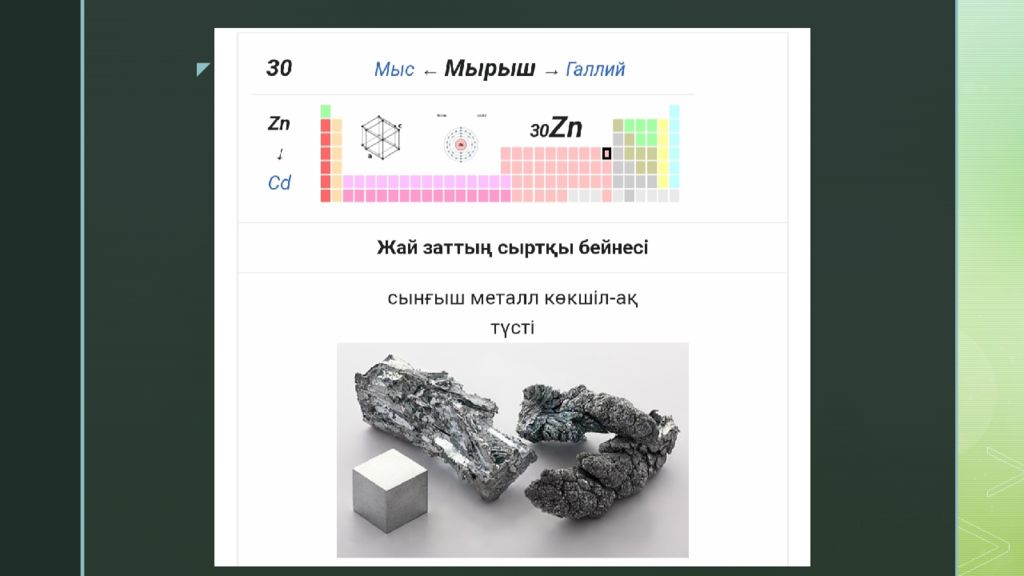
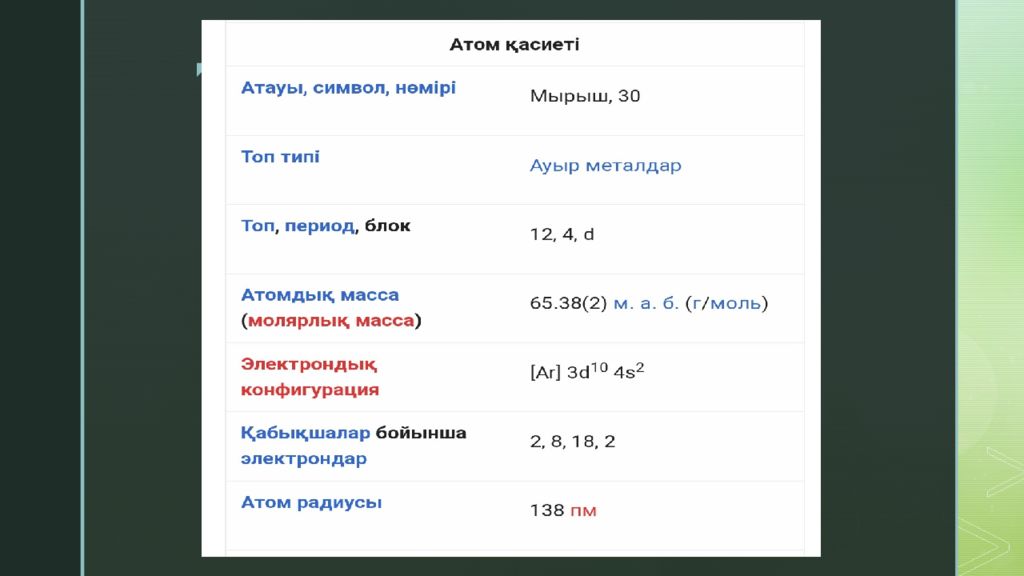
Мырыш ( лат. Zincum ; Zn ) — элементтердің периодты жүйесінің II- тобындағы химиялық элемент, асыл металдардың бірі. Реттік нөмірі 30, атом массасы 65,39. [1] Мырыш ерте заманда жез түрінде белгілі болған, таза түрі 16 ғасырда алынған. Жер қыртысындағы массасы бойынша мөлш. 8,3×10 -3 %. Ол полиметалды сульфид кендерінің құрамында кездеседі..
Слайд 7
Негізгі минералдары: сфалерит (мырыш алдамышы) және вюрцит, смитсонит, каламин, цинкит. Мырыш гексагональды тығыз қапталған торы бар күміс түсті ақ металл, тығызд. 7,133 г/см 3, балқу t 419,5 ° С, қайнау t 906 ° С. Тотығу дәрежесі +2. Ылғал ауада және суда 200°С-қа дейін тұрақты, тотығуға гидроксикарбонатты беттік пленкасы кедергі жасайды; қышқылдар және сілтілермен, аммиак және аммоний тұздарымен, ылғал күйіндегі Cl 2, Br 2 - мен, қыздырғанда О 2 -мен әрекеттеседі. Құрамында М. бар концентраттарды күйдіріп, әрі қарай алынған күйдіргіні Н 2 SO 4 - пен сілтісіздендіру және ZnSO 4 ерітіндісінен Мырышты электрлік тұндыру арқылы алынады. Мырыш жез, нейзильбер, томпак, тағы басқа қорытпалардың құраушысы; болат және шойынды мырыштау үшін (бұл кезде коррозияға қарсы қаптама түзіледі), ұшақтар мен автомобильдердің майда бөлшектерін, химиялық ток көздерінің электродтарын жасауда, күміс пен алтынды қорғасыннан бөлуде қолданылады.
Слайд 8
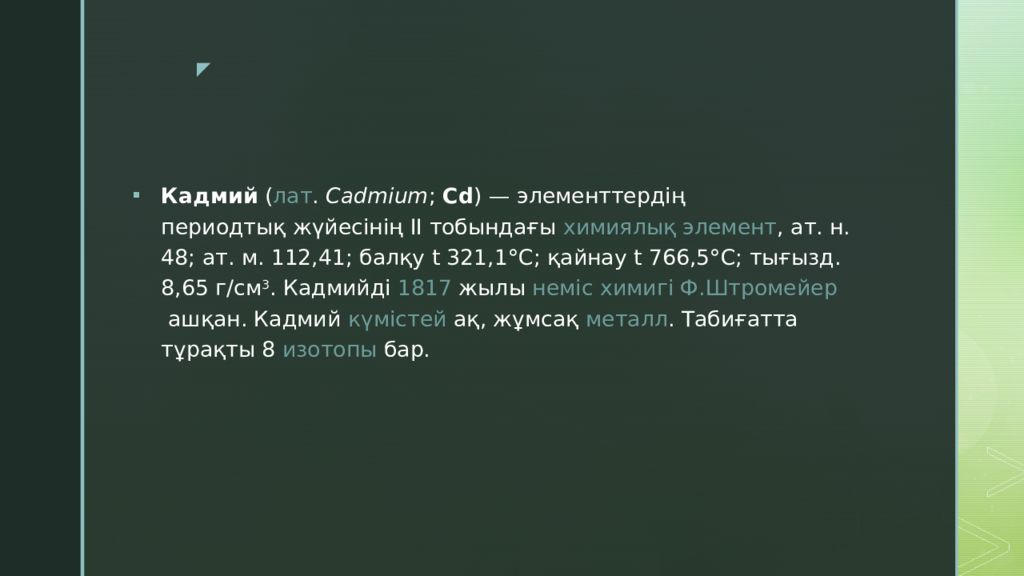
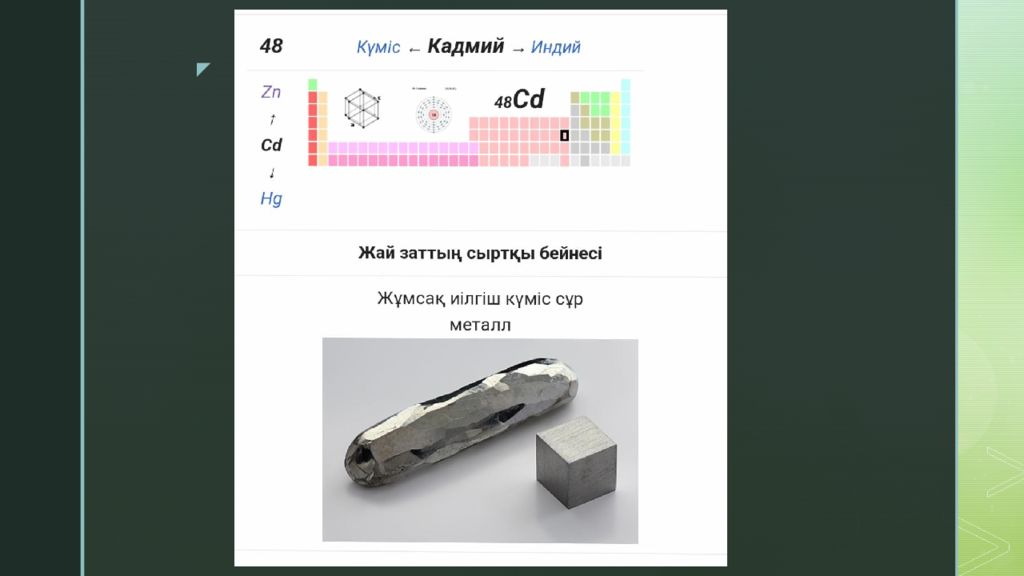
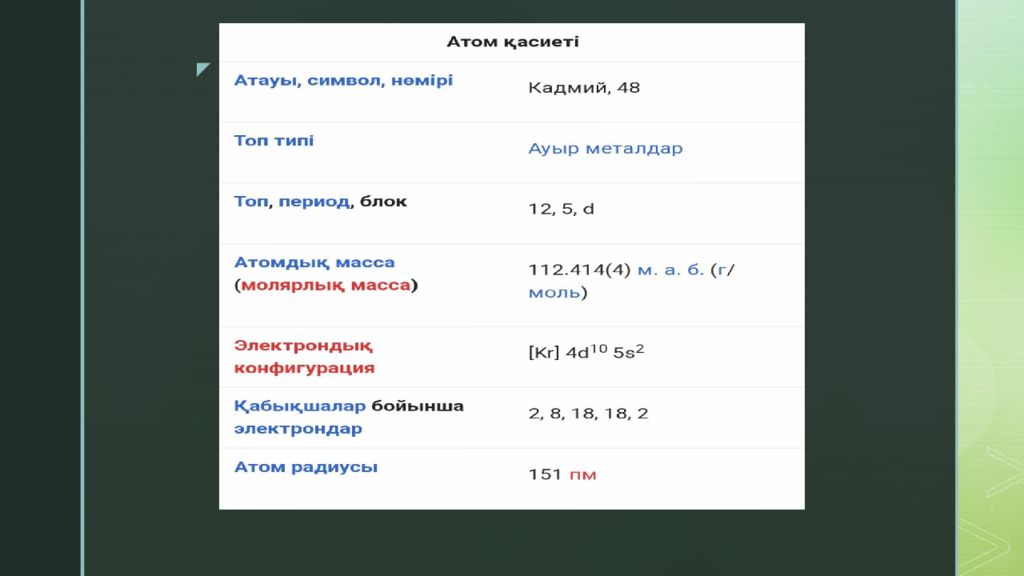
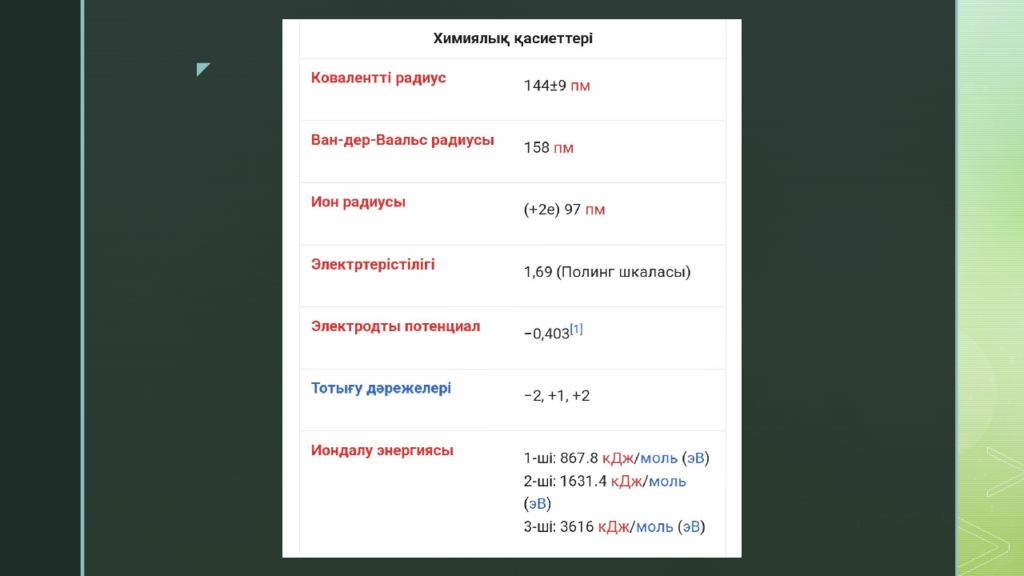
Кадмий ( лат. Cadmium ; Cd ) — элементтердің периодтық жүйесінің ІІ тобындағы химиялық элемент, ат. н. 48; ат. м. 112,41; балқу t 321,1° С; қайнау t 766,5° С; тығызд. 8,65 г/см 3. Кадмийді 1817 жылы неміс химигі Ф.Штромейер ашқан. Кадмий күмістей ақ, жұмсақ металл. Табиғатта тұрақты 8 изотопы бар.
Последний слайд презентации: Мырыш және Кадмий
Негізгі минералдары : гринокит, отавит, монтепонит. Изоморфты қоспа ретінде мырыш, көбінесе сфалерит минералдарының құрамына кіреді. Құрғақ ауада Кадмий тұрақты, дымқыл ауада оның бетіне оксидтің жұқа қабыршағы түзіліп, әрі қарай тотығуын тежейді. Кадмий буы су буымен әрекеттесіп сутек бөледі. Минералдық қышқылдармен өзара әрекеттесіп тұздар түзеді. Оның тұздарының ерітінділері гидролиздің нәтижесінде әлсіз қышқылдық қасиет көрсетеді. Балқу температурасынан жоғары температурада Кадмий галогендермен әрекеттесіп, галогенидтер түзеді. Кадмийді қорғасын - мырыш, мыс кентастарын өңдеу кезінде өндіріп алады. Кадмий металл бетін коррозиядан қорғау үшін ( кадмийлеу ), аккумулятор жасауда, пегмент, шала өткізгіш материалды дайындауда, ядролық энергетикада, т.б. қолданылады. Кадмийдің буы және оның қосылыстары улы. Бұл қосылыстармен демалған жағдайда олар қанға сіңіп орта жүйке жүйесін, бүйрек, бауырды жарақаттап, фосфор - кальций алмасуын бұзады. Кадмий алуға қызығушылық тудыратын жалғыз минерал- гринокит, "кадмий алдау"деп аталады. Оны мырыш кендерін өңдеу кезінде сфалеритпен бірге өндіреді. Қайта өңдеу барысында кадмий процестің жанама өнімдерінде шоғырланады, одан кейін оны алады. Қазіргі уақытта жылына 20000 тоннаға жуық кадмий өндіріледі.