Первый слайд презентации: Наноразмерные цеолитные и цеолитоподобные материалы
НТ-08
Слайд 2: Цеолиты
1756 г. - Ф. Кронштедт обнаружил вспучивание стильбита при нагревании термин " цеолит " - в переводе с греческого « кипящий камень ». Цеолиты - это пористые кристаллические водные алюмосиликаты с каркасной структурой, характеризующиеся также регулярной геометрией пор. Цеолиты обладают: селективными, адсорбционными и ионообменными свойствами. Важная особенность цеолитов - возможность варьирования химического состава кристаллов и геометрических параметров внутрикристаллических пор. Природные цеолиты: клиноптилолит; анальцим; эрионит; гейландит; лаумонит; морденит. В природе цеолиты образуются в результате гидротермального синтеза. В промышленных масштабах используют синтетические цеолиты более 600 структурных типов
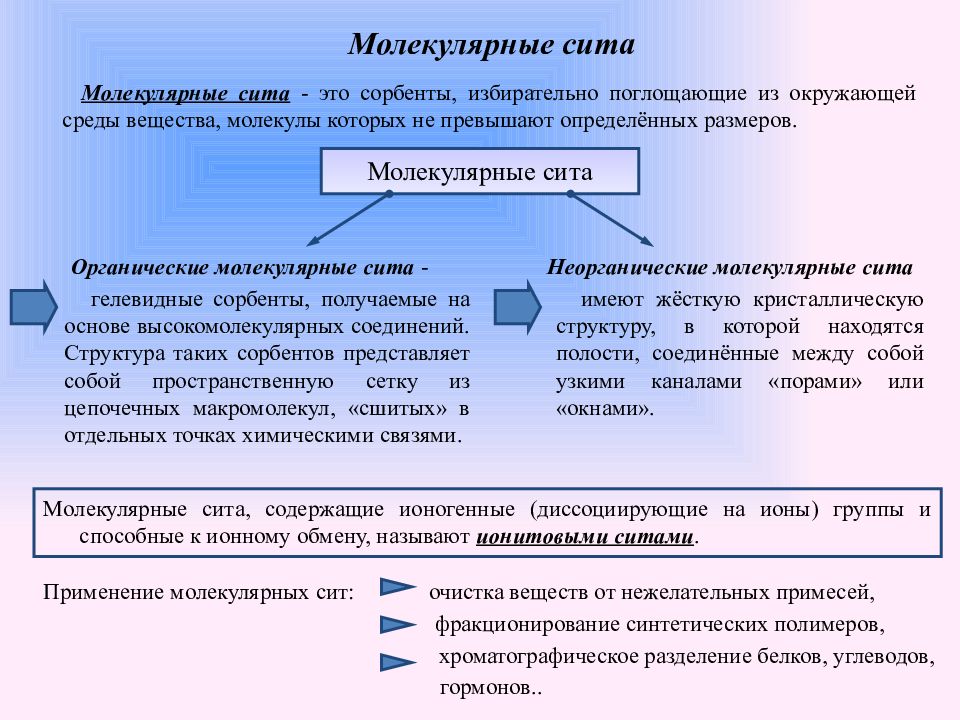
Слайд 3: Молекулярные сита
Молекулярные сита - это сорбенты, избирательно поглощающие из окружающей среды вещества, молекулы которых не превышают определённых размеров. Молекулярные сита Неорганические молекулярные сита имеют жёсткую кристаллическую структуру, в которой находятся полости, соединённые между собой узкими каналами «порами» или «окнами». Органические молекулярные сита - гелевидные сорбенты, получаемые на основе высокомолекулярных соединений. Структура таких сорбентов представляет собой пространственную сетку из цепочечных макромолекул, «сшитых» в отдельных точках химическими связями. Молекулярные сита, содержащие ионогенные (диссоциирующие на ионы) группы и способные к ионному обмену, называют ионитовыми ситами. Применение молекулярных сит: очистка веществ от нежелательных примесей, фракционирование синтетических полимеров, хроматографическое разделение белков, углеводов, гормонов..
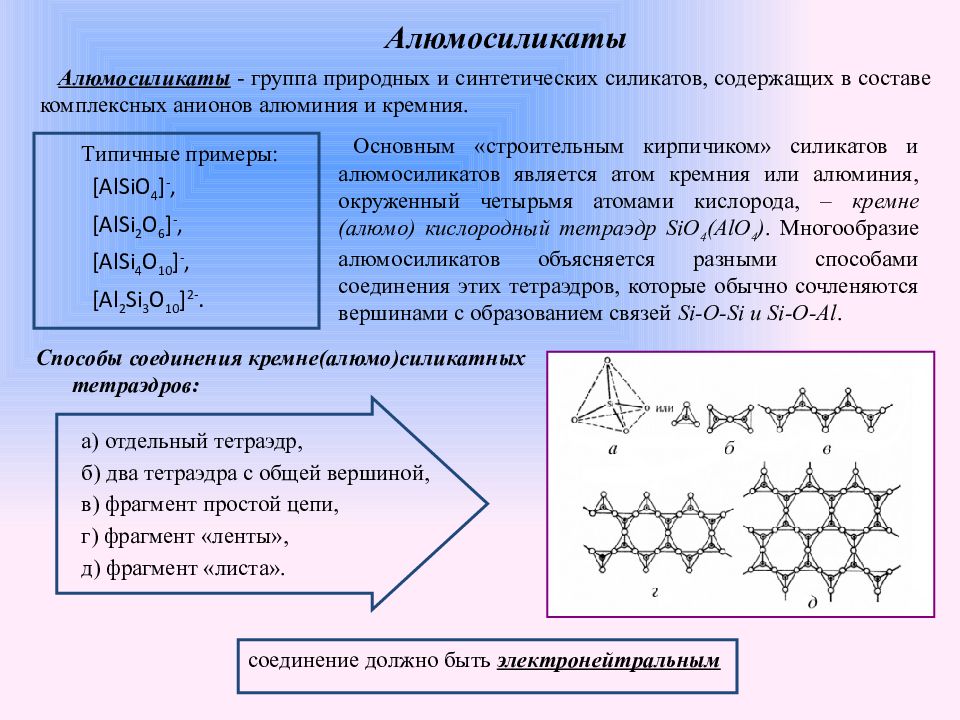
Слайд 4: Алюмосиликаты
Типичные примеры: [AlSiO 4 ] -, [AlSi 2 O 6 ] -, [AlSi 4 O 10 ] -, [Al 2 Si 3 O 10 ] 2-. Основным «строительным кирпичиком» силикатов и алюмосиликатов является атом кремния или алюминия, окруженный четырьмя атомами кислорода, – кремне (алюмо) кислородный тетраэдр SiO 4 (AlO 4 ). Многообразие алюмосиликатов объясняется разными способами соединения этих тетраэдров, которые обычно сочленяются вершинами с образованием связей Si-O-Si и Si-O-Al. Алюмосиликаты - группа природных и синтетических силикатов, содержащих в составе комплексных анионов алюминия и кремния. а) отдельный тетраэдр, б) два тетраэдра с общей вершиной, в) фрагмент простой цепи, г) фрагмент «ленты», д) фрагмент «листа». Способы соединения кремне(алюмо)силикатных тетраэдров: соединение должно быть электронейтральным
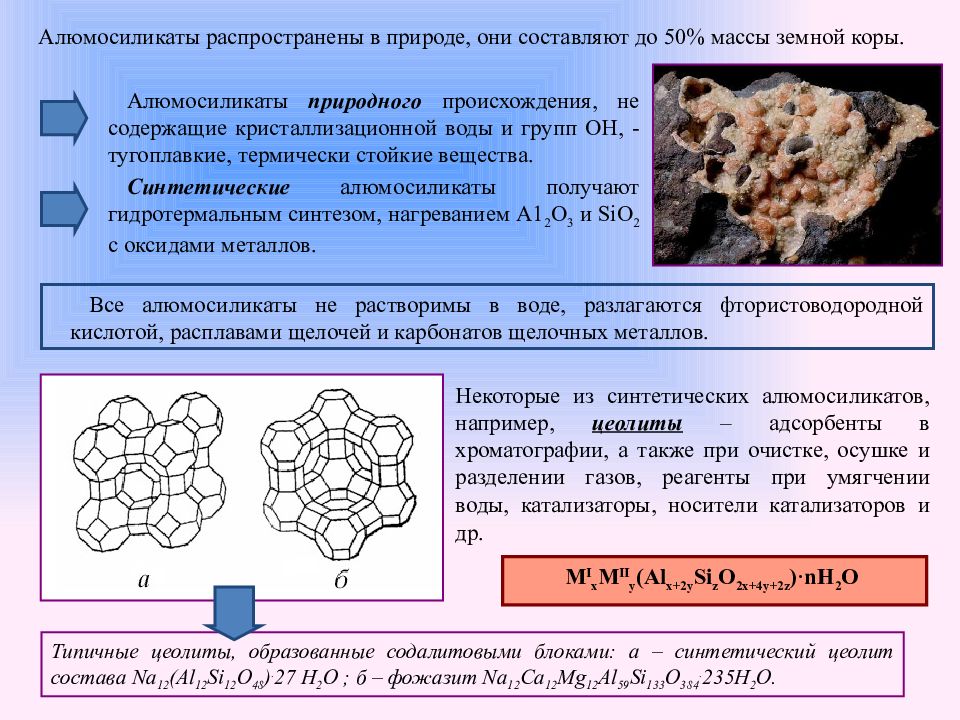
Слайд 5: Алюмосиликаты распространены в природе, они составляют до 50% массы земной коры
Алюмосиликаты природного происхождения, не содержащие кристаллизационной воды и групп ОН, - тугоплавкие, термически стойкие вещества. Синтетические алюмосиликаты получают гидротермальным синтезом, нагреванием А1 2 О 3 и SiO 2 с оксидами металлов. Некоторые из синтетических алюмосиликатов, например, цеолиты – адсорбенты в хроматографии, а также при очистке, осушке и разделении газов, реагенты при умягчении воды, катализаторы, носители катализаторов и др. Все алюмосиликаты не растворимы в воде, разлагаются фтористоводородной кислотой, расплавами щелочей и карбонатов щелочных металлов. Типичные цеолиты, образованные содалитовыми блоками: а – синтетический цеолит состава Na 12 (Al 12 Si 12 O 48 ). 27 H 2 O ; б – фожазит Na 12 Ca 12 Mg 12 Al 59 Si 133 O 384. 235H 2 O. M I x M II y (Al x+2y Si z O 2x+4y+2z )·nH 2 O
Слайд 6: Классификация цеолитов
По структурной характеристике: трёхмерные каркасные структуры (филлипсит и шабазит); волокнистые структуры (натролит и сколецит); пластинчатые (или листоватые) структуры (гейландит и клиноптилолит). Классификация Брэка (в зависимости от типа содержащихся в структуре "вторичных элементов структуры" ): Группа Вторичные элементы структуры 1 Одиночное четырёхчленное кольцо S4R 2 Одиночное шестичленное кольцо S6R 3 Двойное четырёхчленное кольцо D4R 4 Двойное шестичленное кольцо D6R 5 Сложный 4-1 (единица T 5 O 10 ) 6 Сложный 5-1 (единица T 8 O 16 ) 7 Сложный 4-4-1 (единица T 10 O 20 ) шабазит натролит гейландит
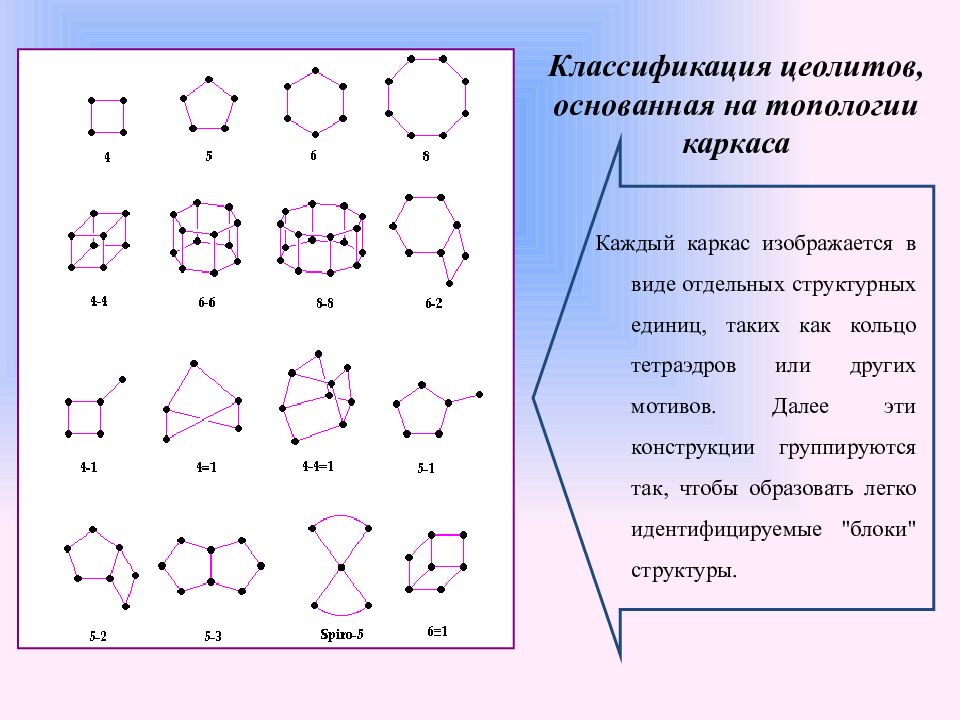
Слайд 7: Классификация цеолитов, основанная на топологии каркаса
Каждый каркас изображается в виде отдельных структурных единиц, таких как кольцо тетраэдров или других мотивов. Далее эти конструкции группируются так, чтобы образовать легко идентифицируемые "блоки" структуры.
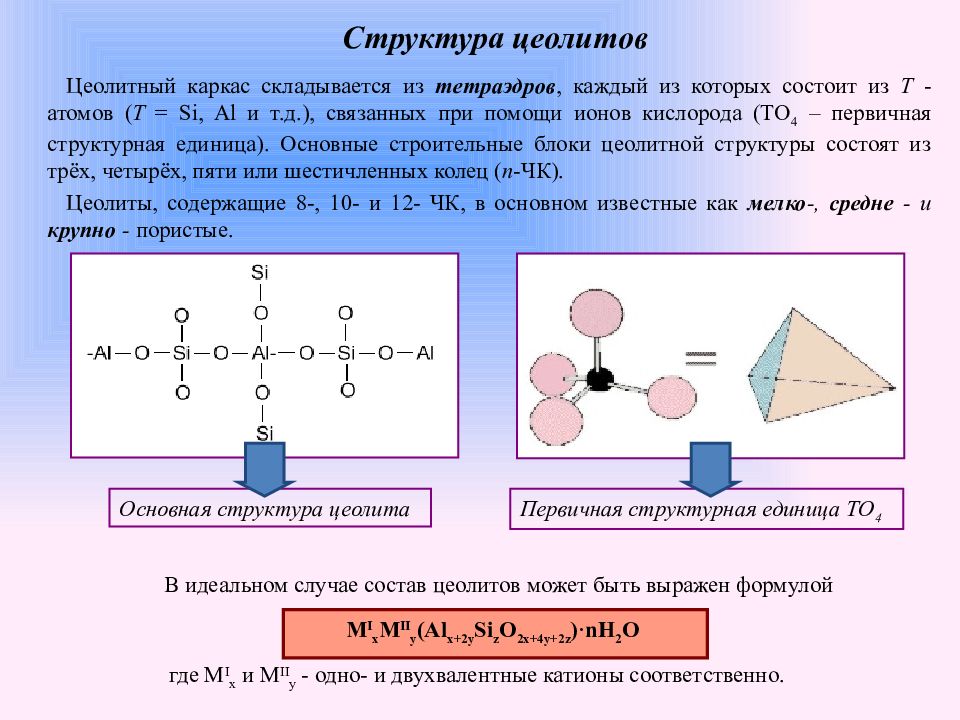
Слайд 8: Структура цеолитов
Цеолитный каркас складывается из тетраэдров, каждый из которых состоит из T - атомов ( T = Si, Al и т.д.), связанных при помощи ионов кислорода ( TO 4 – первичная структурная единица). Основные строительные блоки цеолитной структуры состоят из трёх, четырёх, пяти или шестичленных колец ( n -ЧК). Цеолиты, содержащие 8-, 10- и 12- ЧК, в основном известные как мелко -, средне - и крупно - пористые. Основная структура цеолита Первичная структурная единица TO 4 В идеальном случае состав цеолитов может быть выражен формулой где M I x и M II y - одно- и двухвалентные катионы соответственно. M I x M II y (Al x+2y Si z O 2x+4y+2z )·nH 2 O
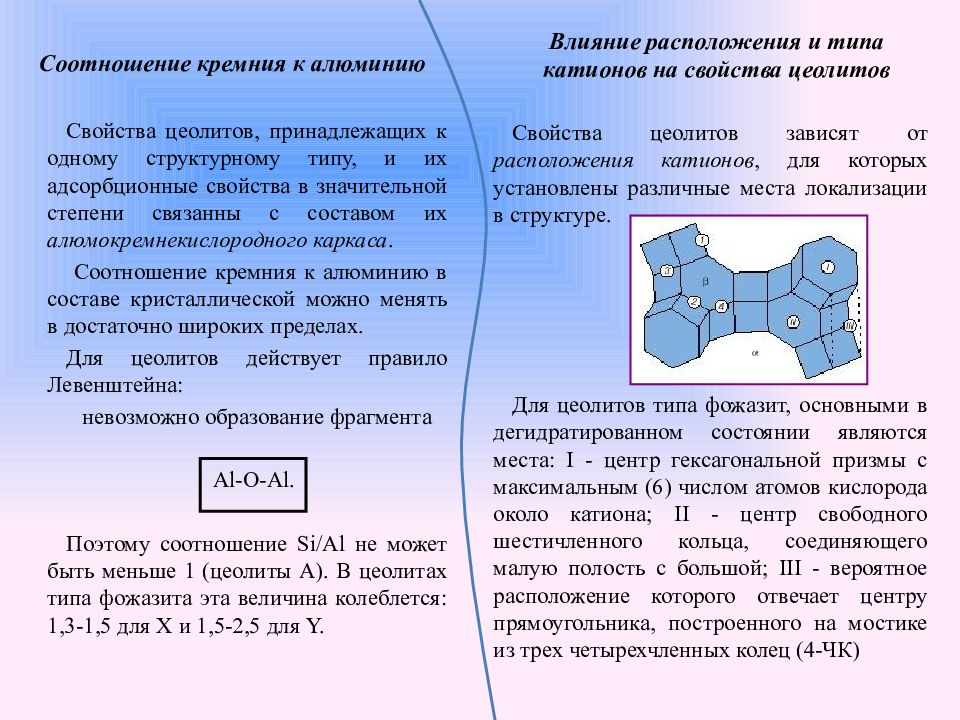
Слайд 9: Соотношение кремния к алюминию
Свойства цеолитов, принадлежащих к одному структурному типу, и их адсорбционные свойства в значительной степени связанны с составом их алюмокремнекислородного каркаса. Соотношение кремния к алюминию в составе кристаллической можно менять в достаточно широких пределах. Для цеолитов действует правило Левенштейна: невозможно образование фрагмента Al-O-Al. Поэтому соотношение Si/Al не может быть меньше 1 (цеолиты А). В цеолитах типа фожазита эта величина колеблется: 1,3-1,5 для Х и 1,5-2,5 для Y. Свойства цеолитов зависят от расположения катионов, для которых установлены различные места локализации в структуре. Для цеолитов типа фожазит, основными в дегидратированном состоянии являются места: I - центр гексагональной призмы с максимальным (6) числом атомов кислорода около катиона; II - центр свободного шестичленного кольца, соединяющего малую полость с большой; III - вероятное расположение которого отвечает центру прямоугольника, построенного на мостике из трех четырехчленных колец (4-ЧК) Влияние расположения и типа катионов на свойства цеолитов
Слайд 10: Природные цеолиты
Среди более 10 млн химических соединений установлено всего лишь около 3600 минералов (середина 90-х). Месторождения цеолитов Поистине феноменальным стало открытие в последние 25-30 лет ряда крупных месторождений цеолитов принципиально нового промышленного типа, образовавшихся за счет преобразования вулканического стекла. В начале 60-х годов прошлого столетия первые месторождения цеолитов такого типа были открыты в США, Японии и некоторых других странах. На территории России открыто более 70 месторождений и проявлений цеолитовых пород. Основные из них: Амурская область, Камчатка, Орловская область, Приморье, Урал и Тиман, Юго-восточная Сибирь, Якутия. пикнолиты клатрасилы цеолиты Силикаты
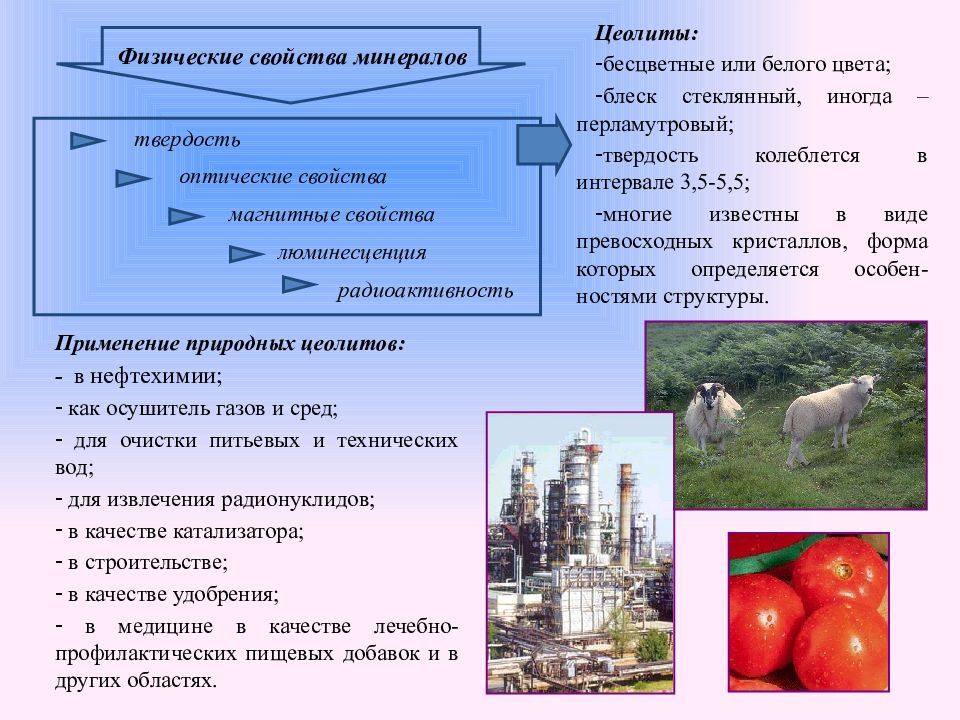
Слайд 11: Физические свойства минералов
Цеолиты: бесцветные или белого цвета; блеск стеклянный, иногда – перламутровый; твердость колеблется в интервале 3,5-5,5; многие известны в виде превосходных кристаллов, форма которых определяется особен-ностями структуры. Применение природных цеолитов: - в нефтехимии; как осушитель газов и сред; для очистки питьевых и технических вод; для извлечения радионуклидов; в качестве катализатора; в строительстве; в качестве удобрения; в медицине в качестве лечебно-профилактических пищевых добавок и в других областях. радиоактивность люминесценция твердость магнитные свойства оптические свойства
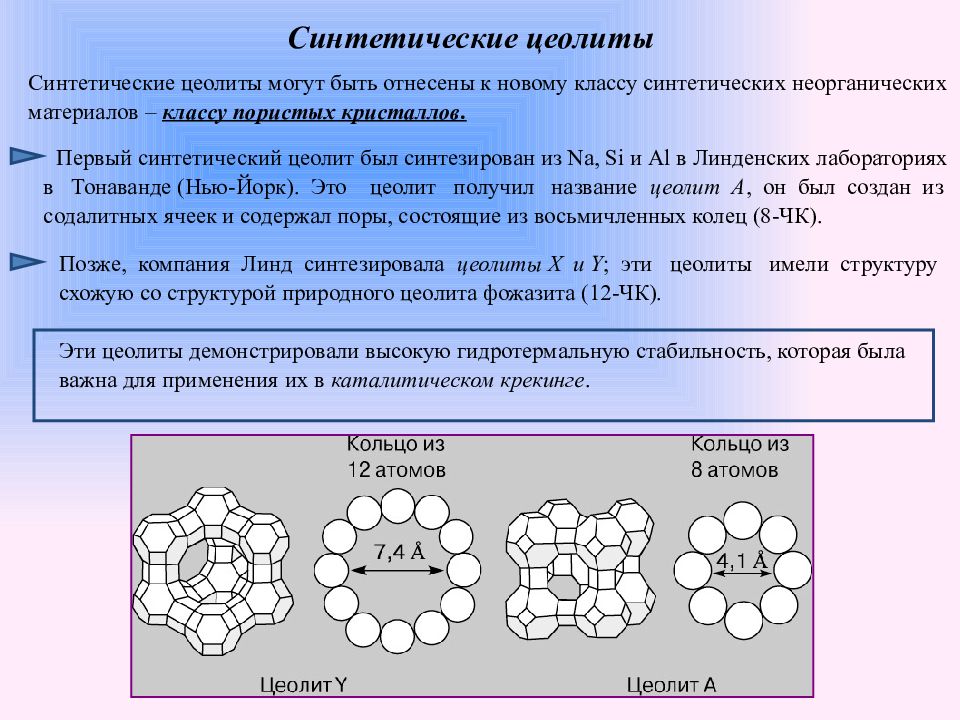
Слайд 12: Синтетические цеолиты
Синтетические цеолиты могут быть отнесены к новому классу синтетических неорганических материалов – классу пористых кристаллов. Первый синтетический цеолит был синтезирован из Na, Si и Al в Линденских лабораториях в Тонаванде ( Нью-Йорк ). Это цеолит получил название цеолит A, он был создан из содалитных ячеек и содержал поры, состоящие из восьмичленных колец (8-ЧК). Позже, компания Линд синтезировала цеолиты X и Y ; эти цеолиты имели структуру схожую со структурой природного цеолита фожазита (12-ЧК). Эти цеолиты демонстрировали высокую гидротермальную стабильность, которая была важна для применения их в каталитическом крекинге.
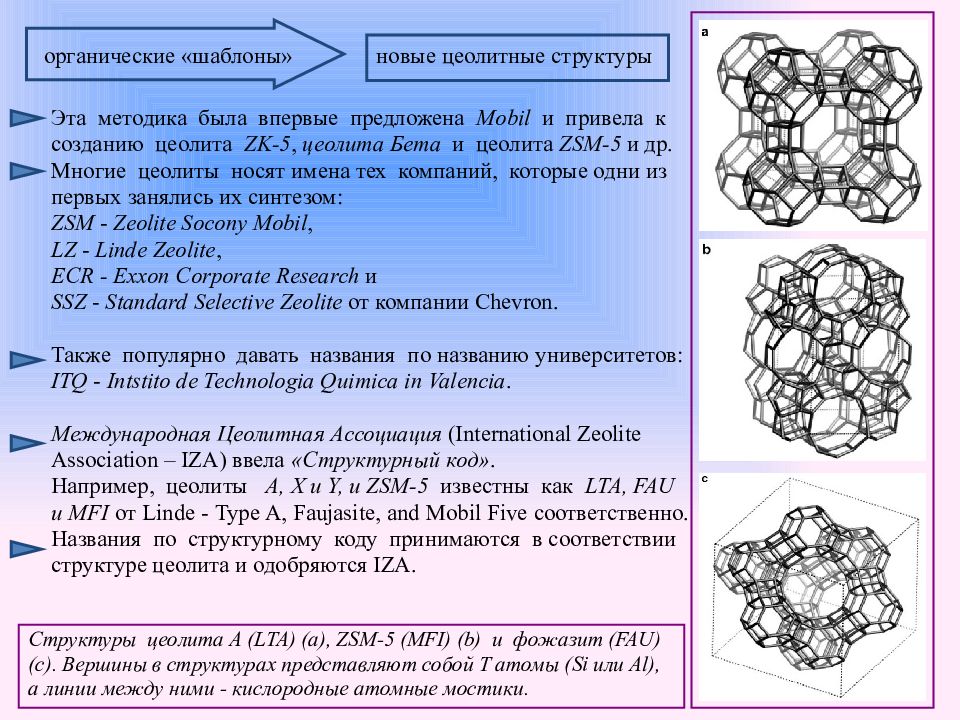
Слайд 13
новые цеолитные структуры органические «шаблоны» Эта методика была впервые предложена Mobil и привела к созданию цеолита ZK -5, цеолита Бета и цеолита ZSM -5 и др. Многие цеолиты носят имена тех компаний, которые одни из первых занялись их синтезом: ZSM - Zeolite Socony Mobil, LZ - Linde Zeolite, ECR - Exxon Corporate Research и SSZ - Standard Selective Zeolite от компании Chevron. Также популярно давать названия по названию университетов: ITQ - Intstito de Technologia Quimica in Valencia. Международная Цеолитная Ассоциация (International Zeolite Association – IZA ) ввела «Структурный код». Например, цеолиты A, X и Y, и ZSM -5 известны как LTA, FAU и MFI от Linde - Type A, Faujasite, and Mobil Five соответственно. Названия по структурному коду принимаются в соответствии структуре цеолита и одобряются IZA. Структуры цеолита A ( LTA ) ( a ), ZSM -5 ( MFI ) ( b ) и фожазит ( FAU ) ( c ). Вершины в структурах представляют собой T атомы ( Si или Al ), а линии между ними - кислородные атомные мостики.
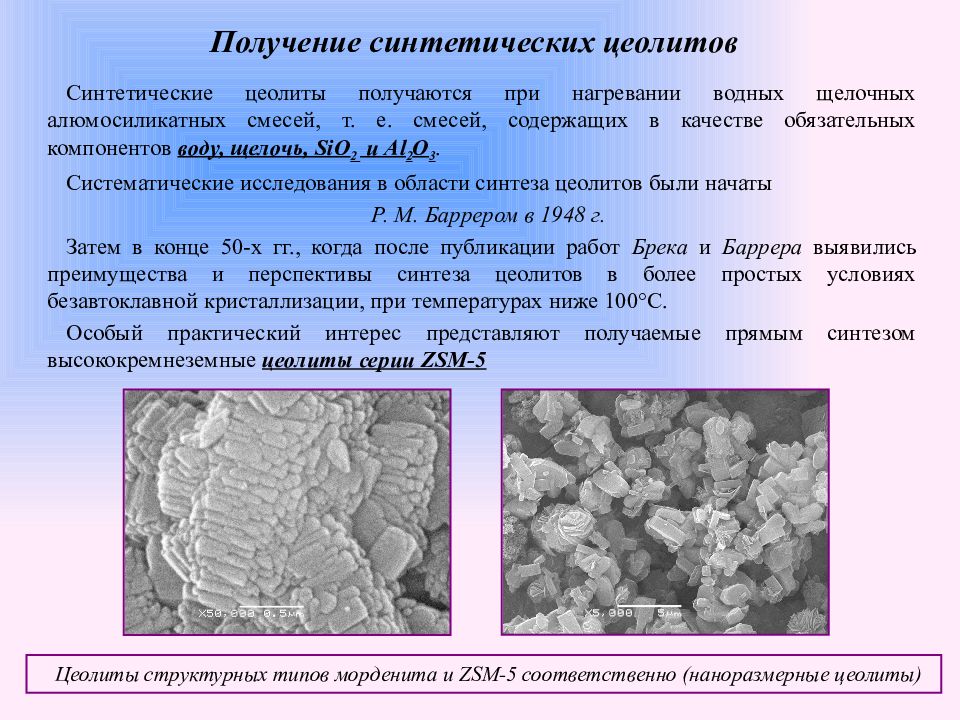
Слайд 14: Получение синтетических цеолитов
Синтетические цеолиты получаются при нагревании водных щелочных алюмосиликатных смесей, т. е. смесей, содержащих в качестве обязательных компонентов воду, щелочь, SiO 2 и Al 2 O 3. Систематические исследования в области синтеза цеолитов были начаты Р. М. Баррером в 1948 г. Затем в конце 50-х гг., когда после публикации работ Брека и Баррера выявились преимущества и перспективы синтеза цеолитов в более простых условиях безавтоклавной кристаллизации, при температурах ниже 100°С. Особый практический интерес представляют получаемые прямым синтезом высококремнеземные цеолиты серии ZSM -5 Цеолиты структурных типов морденита и ZSM -5 соответственно (наноразмерные цеолиты)
Слайд 15: Направленный синтез цеолитов
Условиями синтеза являются : умеренные температуры (обычно ниже 200° С); -высокореакционный исходный материал, (например, силикаалюмогели); высокое значение pH (до 14), получаемое введением щелочей или других сильных оснований; давление насыщенных паров воды; перенасыщение компонентов геля для получения большого числа кристаллов. Однако некоторые Na-цеолиты (например, Na-морденит) не могут быть синтезированы из силикаалюмогелей. Высококремнеземный синтетический фожазит (цеолит Na-Y) может быть получен из таких силикаалюмогелей, но кристаллизуется не воспроизводимо и не в виде чистой фазы. Поэтому при синтезе этих высококремнеземных натриевых цеолитов используются другие источники SiO 2 (золи SiO 2 ). При применении затравок синтез цеолита Na-Y может быть легко осуществлен и из алюмосиликатных гелей. В качестве таких затравок могут быть применены кристаллы цеолита Na-X, и даже гели (аморфные затравки).
Слайд 16: После анализа данных разных авторов по влиянию кристаллических затравок на кинетику кристаллизации были сделаны следующие выводы :
Введение в силикаалюмогели в качестве затравок порошков кристаллических цеолитов ускоряет процесс кристаллизации; Ускоряющий эффект затравки выражен тем более, чем больше масса кристаллов затравки (при одинаковой степени дисперсности кристаллов); При одинаковой массе кристаллов, затравка обычно не кристаллизуется, или кристаллизуется лишь в виде примесной фазы, и это может стимулировать образование кристаллов затравки. В отдельных случаях введение затравок порошкообразных цеолитов в гели может не оказывать заметного влияния на кинетику процесса кристаллизации.
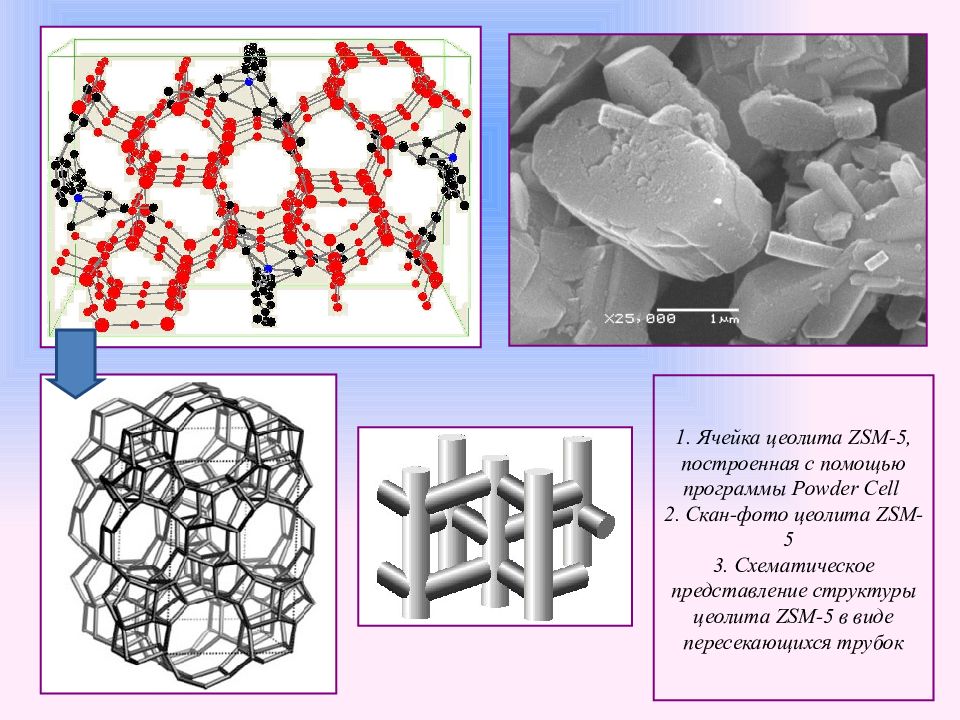
Слайд 17
1. Ячейка цеолита ZSM -5, построенная с помощью программы Powder Cell 2. Скан-фото цеолита ZSM -5 3. Схематическое представление структуры цеолита ZSM -5 в виде пересекающихся трубок
Слайд 18: Новые цеолитоподобные материалы
В 1982 год - под руководством Э. Фланигена были получены алюмофосфаты, структуры которых связаны со структурами цеолитов, но в отличие от них содержат Al не только в тетраэдрической координации. Для их гидротермального синтеза требуются нейтральные среды, и образование полиэдрического каркаса идет вокруг органических молекул. В 1986 году Дж. Л. Гут положил начало синтезу из фторсодержащих кислых сред новой группы микропористых материалов, характеризующихся присутствием F в полостях полиэдрических каркасов. Одно из наиболее известных соединений этой серии - галофосфат кловертит.
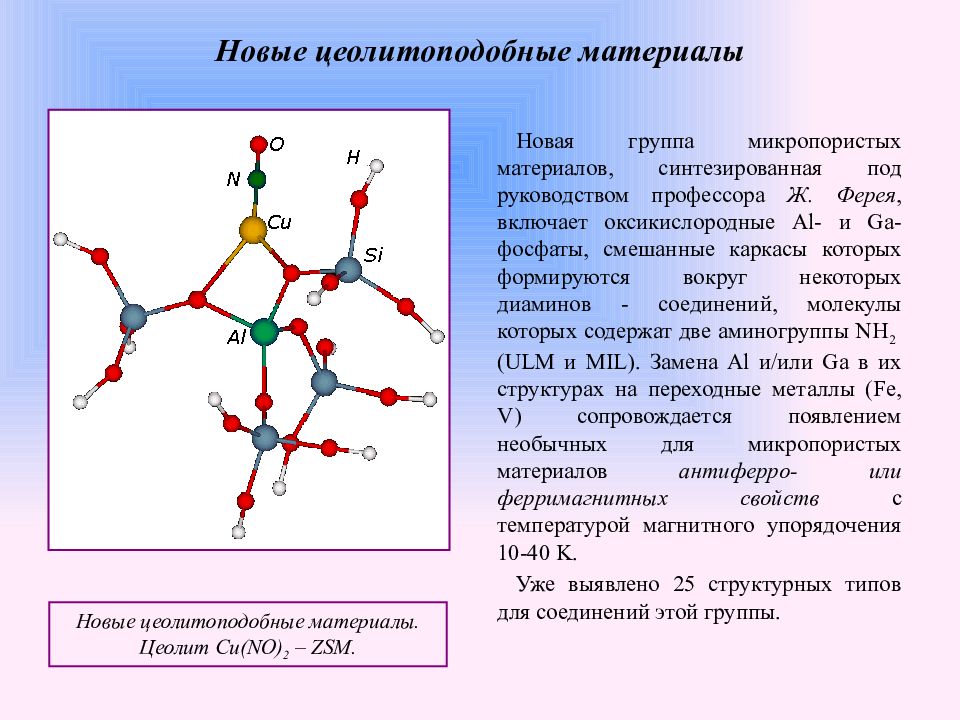
Слайд 19: Новые цеолитоподобные материалы
Новая группа микропористых материалов, синтезированная под руководством профессора Ж. Ферея, включает оксикислородные Al- и Ga-фосфаты, смешанные каркасы которых формируются вокруг некоторых диаминов - соединений, молекулы которых содержат две аминогруппы NH 2 (ULM и MIL). Замена Al и/или Ga в их структурах на переходные металлы (Fe, V) сопровождается появлением необычных для микропористых материалов антиферро- или ферримагнитных свойств с температурой магнитного упорядочения 10-40 K. Уже выявлено 25 структурных типов для соединений этой группы. Новые цеолитоподобные материалы. Цеолит Cu ( NO ) 2 – ZSM. Новые цеолитоподобные материалы
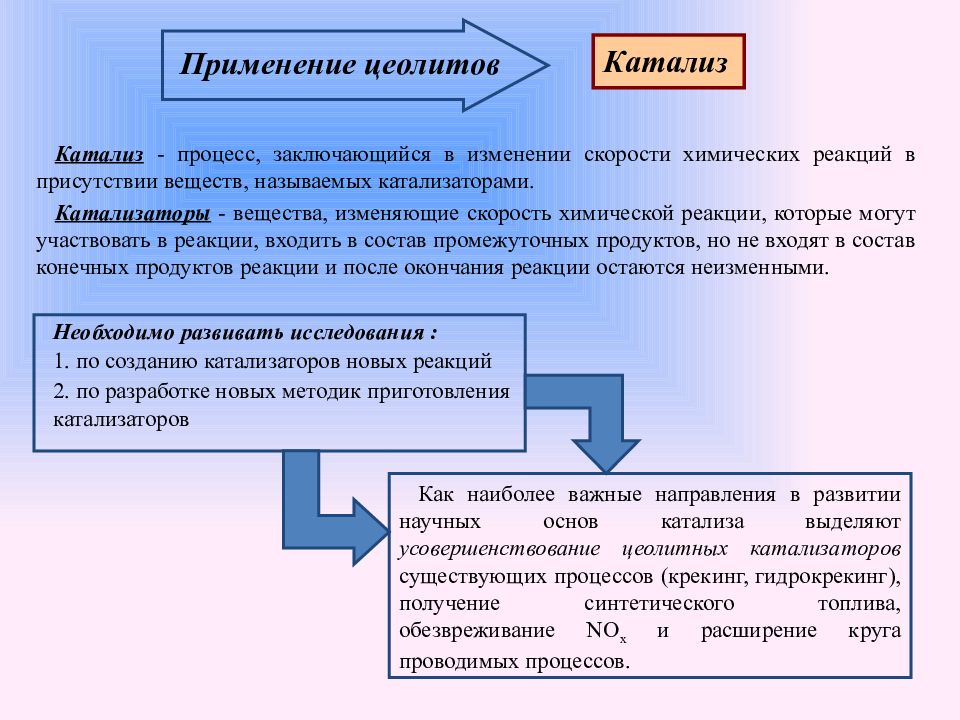
Слайд 20: Применение цеолитов
Катализ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными. Катализ Необходимо развивать исследования : 1. по созданию катализаторов новых реакций 2. по разработке новых методик приготовления катализаторов Как наиболее важные направления в развитии научных основ катализа выделяют усовершенствование цеолитных катализаторов существующих процессов (крекинг, гидрокрекинг), получение синтетического топлива, обезвреживание NO x и расширение круга проводимых процессов.
Слайд 21: Цеолитные катализаторы в переработке нефти
Обезвоженное и освобожденное от солей и механических примесей сырье подвергают перегонке при атмосферном давлении. Продуктами являются газы, легкая и тяжелая нафта, керосин, легкий и тяжелый газойли, мазут и гудрон. Относительное содержание этих фракций и их состав зависят от типа месторождения нефти. Перегонку нефти обычно прекращают при 350°С, а остаток подвергают вакуумной перегонке. В нефти всегда присутствуют S-, N- и O-содержащие соединения, а также металлы (Na, V, Fe, Ni и другие, чаще в комплексе с порфиринами). Поскольку эти примеси снижают активность катализаторов, перед проведением крекинга (не всегда) и гидрокрекинга для их удаления сырье предварительно подвергают гидроочистке - каталитической обработке H 2 под давлением.
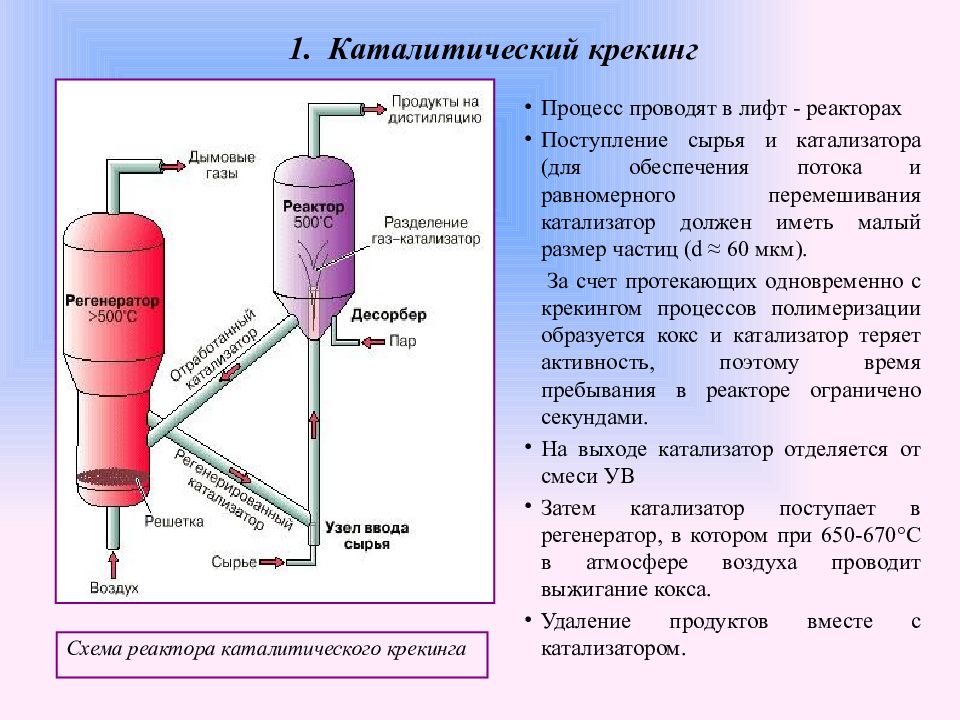
Слайд 22: 1. Каталитический крекинг
Каталитический крекинг - самый многотоннажный промышленный химический процесс. Сырьё - фракции, кипящие при >360°С. Продукты - газ (до 20%), бензин (до 50-60% с октановым числом (ОЧ) до 80), легкий и тяжелый газойли (до 30%). Процесс проводят в реакторе в при 450-520°С и атмосферном или повышенном давлении (до 0,4 МПа). С 1962 года начато внедрение цеолитов (были аморфные алюмосиликаты), поскольку они способны более полно и селективно перерабатывать нефтяное сырье. Для приготовления цеолита как компонента катализатора проводят замещение ионов Na+ в цеолите Y на ионы NH 4+ (с целью создания кислотных центров при последующем прокаливании) и/или обмен на ионы редкоземельных элементов (РЗЭ). Во все большей степени цеолит используют в ультрастабильной форме (USY). Однако цеолит является лишь основой катализатора. В первых катализаторах было 8-12% цеолита. Совершенствование технологии позволило повысить его содержание до 20-30%, и возможно дальнейшее увеличение.
Слайд 23: 1. Каталитический крекинг
Схема реактора каталитического крекинга Процесс проводят в лифт - реакторах Поступление сырья и катализатора (для обеспечения потока и равномерного перемешивания катализатор должен иметь малый размер частиц ( d ≈ 60 мкм). За счет протекающих одновременно с крекингом процессов полимеризации образуется кокс и катализатор теряет активность, поэтому время пребывания в реакторе ограничено секундами. На выходе катализатор отделяется от смеси УВ Затем катализатор поступает в регенератор, в котором при 650-670°С в атмосфере воздуха проводит выжигание кокса. Удаление продуктов вместе с катализатором. 1. Каталитический крекинг
Слайд 24: 1. Каталитический крекинг
Требования, предъявляемые технологией при создании промышленного катализатора : Слишком большая активность может увеличить образование газа и кокса → потери сырья и выделение большого количества тепла (разрушение кристаллической структуры цеолита) ← В состав катализатора вводят аморфный алюмосиликат – матрицу → увеличение прочности микросферы. Для повышения коэффициента скольжения частиц (предотвращение истирания) ← Поверхность покрывают солями бария или другими модификаторами. Так как, в десорбере проводят обработку водяным паром ← Для повышения стабильности к пару вводят катионы РЗЭ и используют USY. Чтобы обеспечить замкнутый поток катализатора в цикле реактора - регенератора, удаление кокса в регенераторе должно произойти достаточно быстро ← В катализатор добавляют переходные металлы, увеличивающие скорость и полноту окисления до CO 2. Для повышения стойкости дезактивирующего цеолитного компонента к примесям металлов ← Добавляют пассиваторы - соединения Sb, P, Sn, B, реагирующих с примесями (катализаторы не теряют активность в присутствии Ni и V). Для уменьшения выбросов оксидов S и N также вводят специальные добавки. 1. Каталитический крекинг ZSM - 5
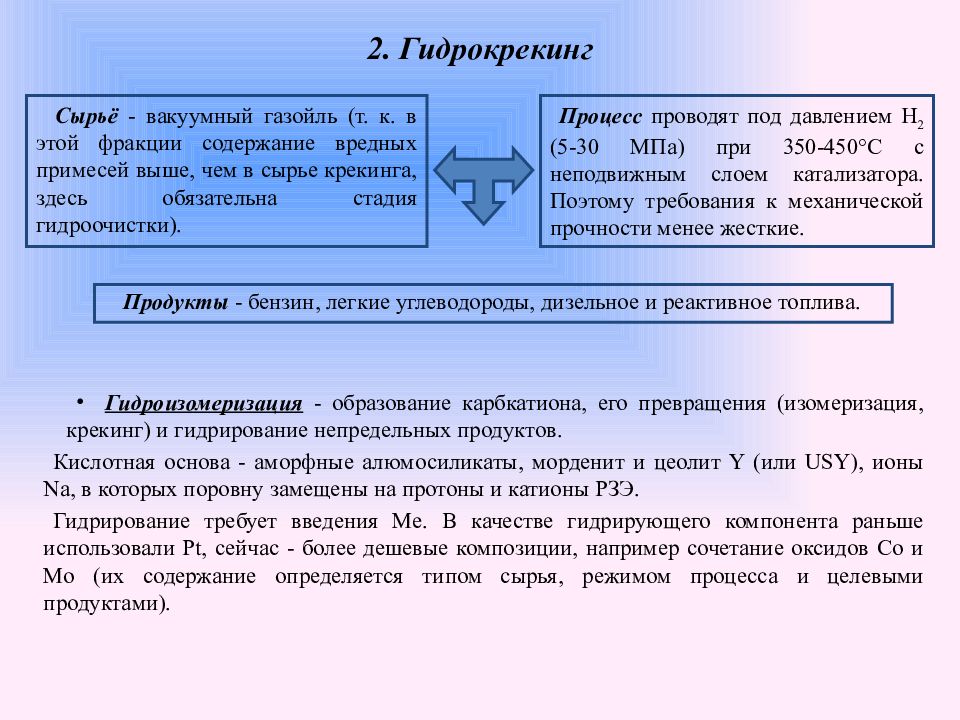
Слайд 25: 2. Гидрокрекинг
Продукты - бензин, легкие углеводороды, дизельное и реактивное топлива. Сырьё - вакуумный газойль (т. к. в этой фракции содержание вредных примесей выше, чем в сырье крекинга, здесь обязательна стадия гидроочистки). Процесс проводят под давлением H 2 (5-30 МПа) при 350-450°С с неподвижным слоем катализатора. Поэтому требования к механической прочности менее жесткие. Гидроизомеризация - образование карбкатиона, его превращения (изомеризация, крекинг) и гидрирование непредельных продуктов. Кислотная основа - аморфные алюмосиликаты, морденит и цеолит Y (или USY), ионы Na, в которых поровну замещены на протоны и катионы РЗЭ. Гидрирование требует введения Ме. В качестве гидрирующего компонента раньше использовали Pt, сейчас - более дешевые композиции, например сочетание оксидов Со и Мо (их содержание определяется типом сырья, режимом процесса и целевыми продуктами).
Слайд 26: Новые методы создания каталитических систем
Нанесение металлов. При создании бифункциональных катализаторов не всегда выгодно равномерное распределение металла по объему. Например, в гидрогенолизе бутана Ir (иридий), распределенный в объеме NaY, менее активен и селективен (53% этана), чем на внешней поверхности (83%), где образуются более крупные и активные микрокристаллиты Ir. Кластеры и комплексы в структуре цеолитов. Широкие возможности создает синтез кластеров металла (нанотехнология) или синтез комплекса непосредственно в полостях структуры цеолита. Например, восстановлением комплексов Rh в полостях NaX получены октаэдрические кластеры, активные в гидрировании толуола. Цеолиты и ферменты. Использование цеолитов как моделей ферментативных катализаторов. Внедрение сложных органических молекул в цеолиты может дать системы, аналогичные ферментам. Например, фталоцианин - цеолитные комплексы действуют подобно фосфолипидной мембране и при комнатной температуре скорость окисления алканов третбутилпероксидом на них сопоставима со скоростью ферментативного процесса. Цеолитные мембраны. Цеолиты позволяют создавать системы, обладающие свойствами мембран, способных пропускать только определенные вещества. Например, цеолит ZSM-5, нанесённый в виде плёнки (40-500мк) на Al 2 O 3, эффективно разделяет смеси н - бутан - изобутан.
Слайд 27: Синтез микропористых систем: достижения последних лет
Синтез цеолитов и цеолитоподобных структур как направление в области химии цеолитов решает ряд задач, которые можно разделить следующим образом: Синтез новых структур Поиск новых условий синтеза цеолитов Оптимизация синтеза известных структур. Синтез цеолитов с целенаправленными свойствами Получение композиционных материалов Исследования по механизму кристаллизации цеолитов. Синтез микропористых систем: достижения последних лет
Слайд 28: Синтез микропористых систем: достижения последних лет
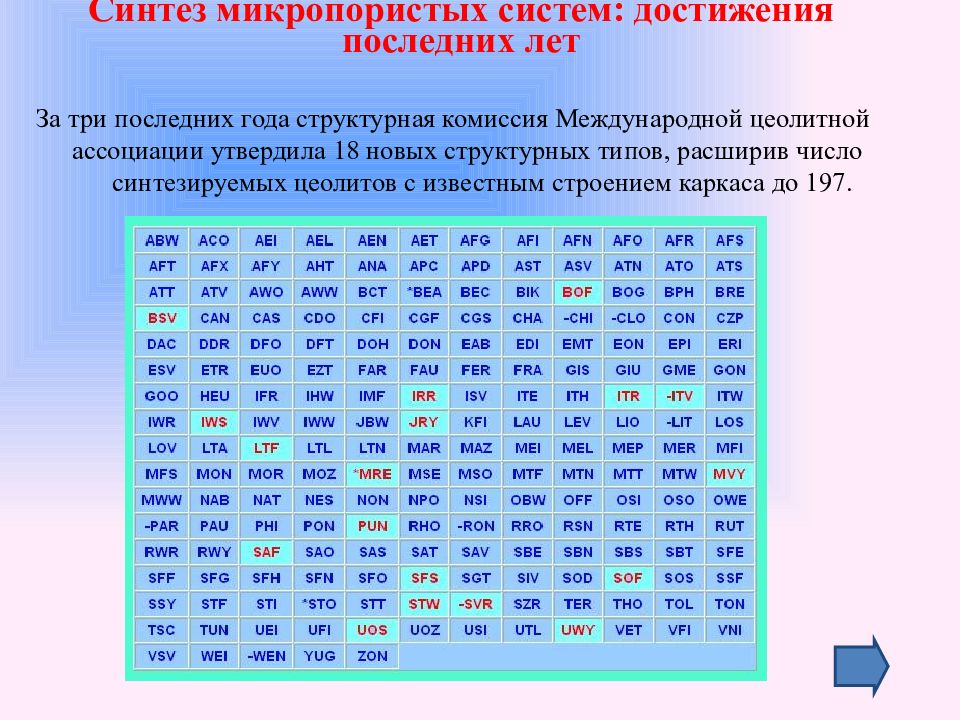
За три последних года структурная комиссия Международной цеолитной ассоциации утвердила 18 новых структурных типов, расширив число синтезируемых цеолитов с известным строением каркаса до 197. Синтез микропористых систем: достижения последних лет
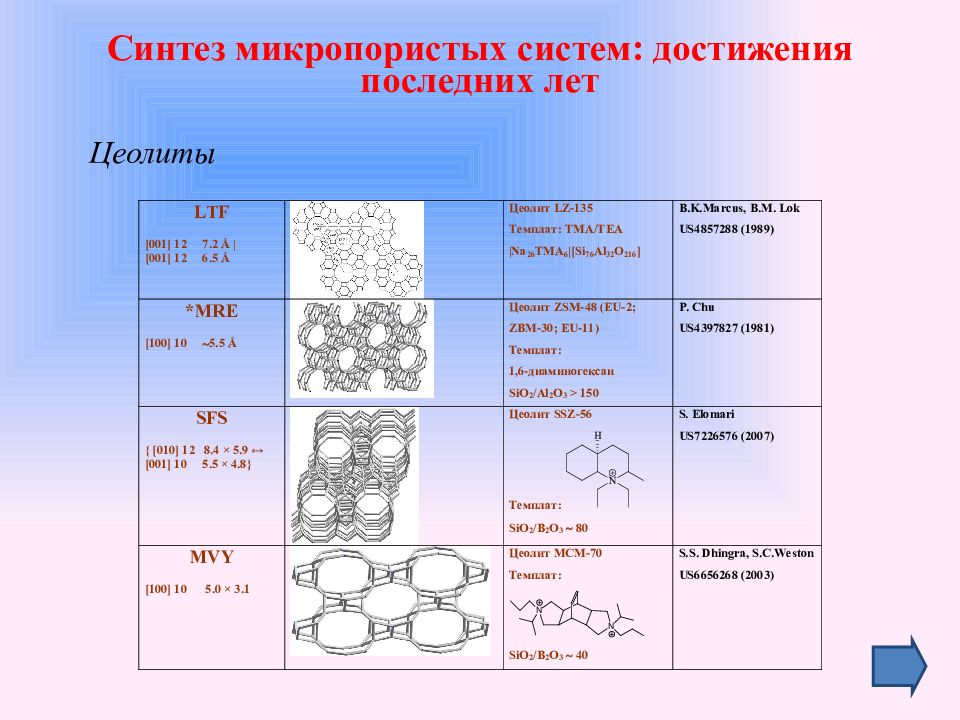
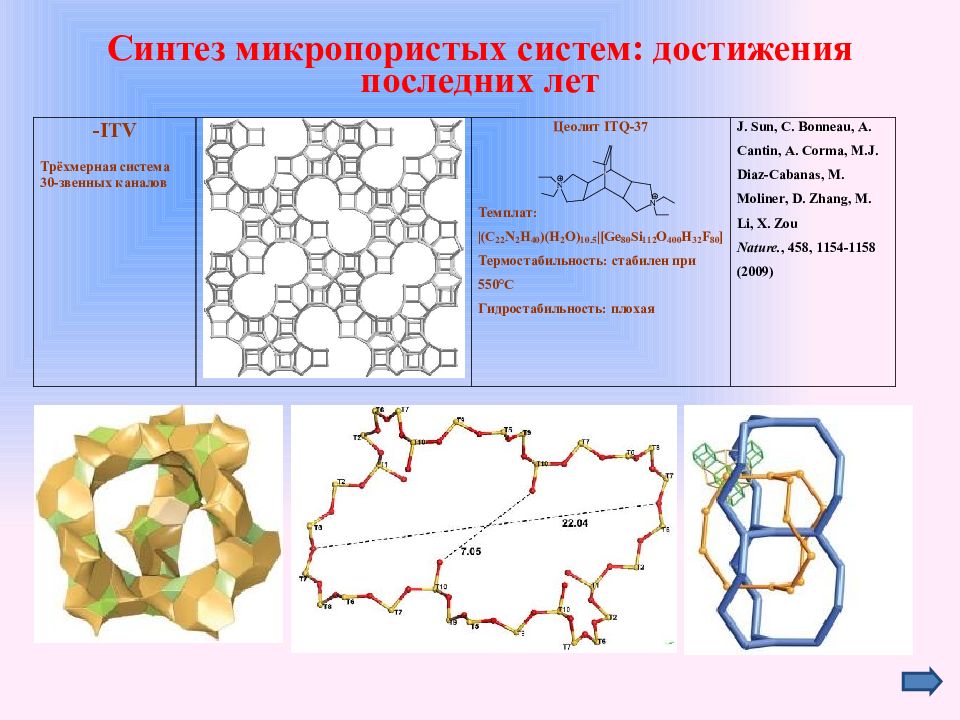
Слайд 30: Синтез микропористых систем: достижения последних лет
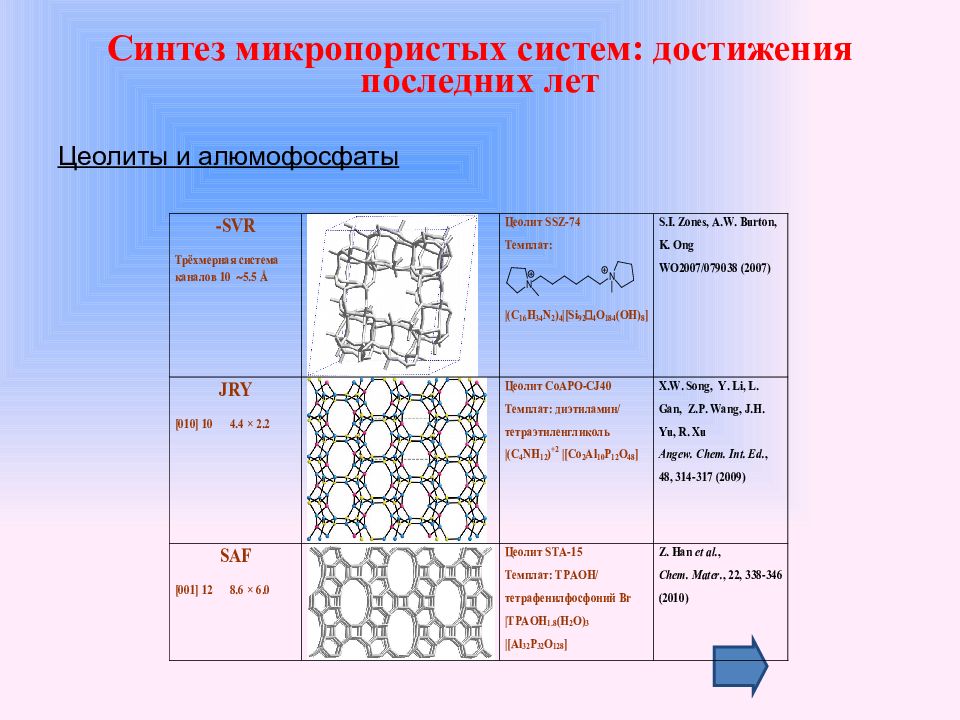
Цеолиты и алюмофосфаты
Слайд 31: Синтез микропористых систем: достижения последних лет
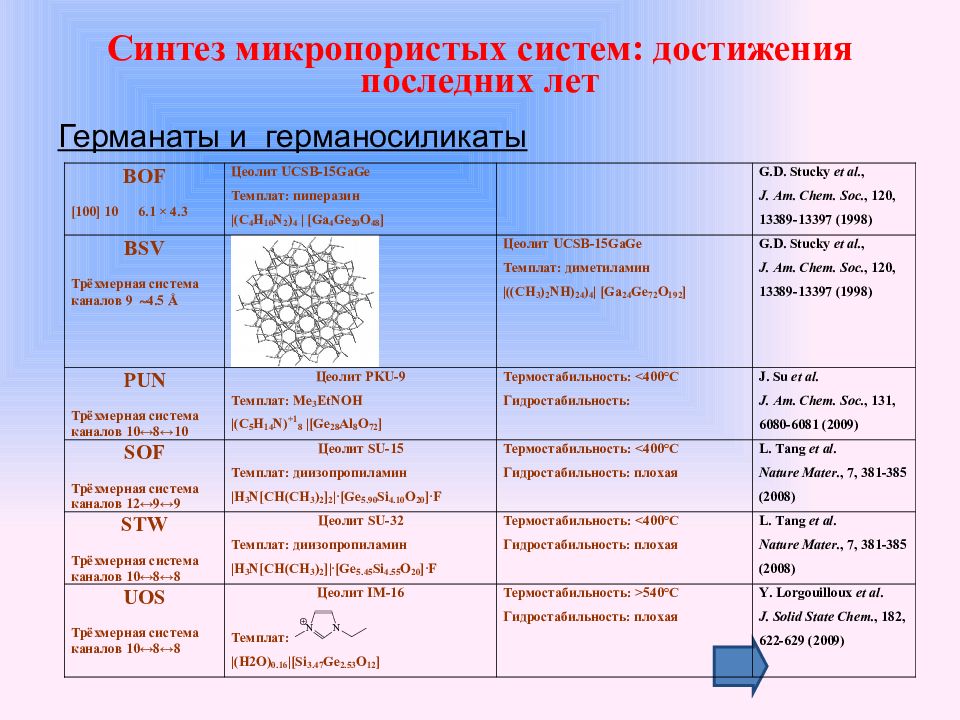
Германаты и германосиликаты
Слайд 34: Синтез микропористых систем: достижения последних лет
Для силикогерманатных цеолитов просматриваются две примечательные черты: среди них не встречается ни одной структуры, имеющей одномерную систему каналов или полостей большинство силикогерманатных цеолитов является широкопористыми Оба эти свойства являются более чем привлекательными с точки зрения практического интереса. Есть только один существенный отрицательный момент для силико-германатных систем: атомы германия лабильны в составе каркаса при высоких температурах и при паровой обработке. Поэтому с точки зрения их каталитического применения, чем меньше содержание атомов германия в составе цеолита, тем лучше. Синтез микропористых систем: достижения последних лет
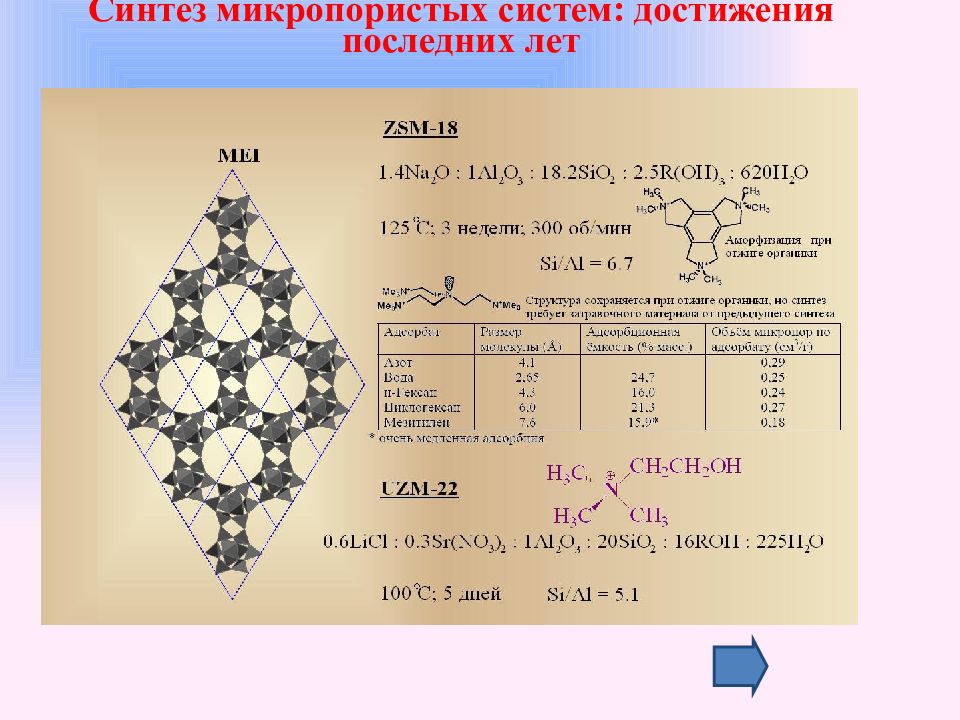
Слайд 35: Синтез микропористых систем: достижения последних лет
Компания UOP разработала новую методологию синтеза низкомодульных цеолитов, которую назвали Дисбаланс Плотности Зарядов. Объёмный органический катион должен выполнять две роли: заполнять объём каналов (полостей) образующейся цеолитной матрицы и компенсировать отрицательный заряд цеолитного каркаса в случае изоморфного замещения атомов кремния на атомы алюминия. Если поместить такой объёмный катион (в виде соответствующей гидроокиси) в алюмосиликатный раствор с низким модулем ( 1< Si / Al <10 ), то получим то самое несоответствие объёмной плотности зарядов «канал-каркас», и в итоге система «алюмосиликат органического катиона» при гидротермальной выдержке не образует кристаллической фазы, оставаясь в виде чистого раствора. Если добавлять в такой раствор малые количества неорганического катиона в виде нейтральной соли, то в какой-то момент баланс выполняется и, как результат, кристаллизуется цеолит. Синтез микропористых систем: достижения последних лет
Слайд 36: Синтез микропористых систем: достижения последних лет
Принципиальными в выполнении данной методологии являются два момента : Синтез микропористых систем: достижения последних лет высокая концентрация органического катиона, RN +( OH -)/ Si > 0.8, для того, чтобы перевести алюмосиликатную основу в растворённое состояние; субстехиометрические по отношению к введённому в синтез алюминию количества неорганического катиона ( M +/ Al не превышает 1 ), иначе будет сказываться преобладающее влияние данного катиона на результат синтеза. Реализация концепции Дисбаланса Плотности Зарядов позволила авторам синтезировать с использованием простых и относительно дешёвых четвертичных аммонийных оснований, ряд интересных низкомодульных цеолитных материалов как с новой топологией каркаса ( UZM -5 ( UFI ), система полостей, соединяющихся через 8-членные окна в двух направлениях), так и с известной структурой, но необычного состава. Так цеолит UZM -9, получаемый в системе TEA/TMA/Na (Si/Al = 8), представляет собой цеолит типа А с SiО2/Al2О3 до 11. Цеолит UZM -4 (структурный тип ВРН, Si/Al 1.7 ) является аналогом цеолита Q ( Si/Al = 1 ).
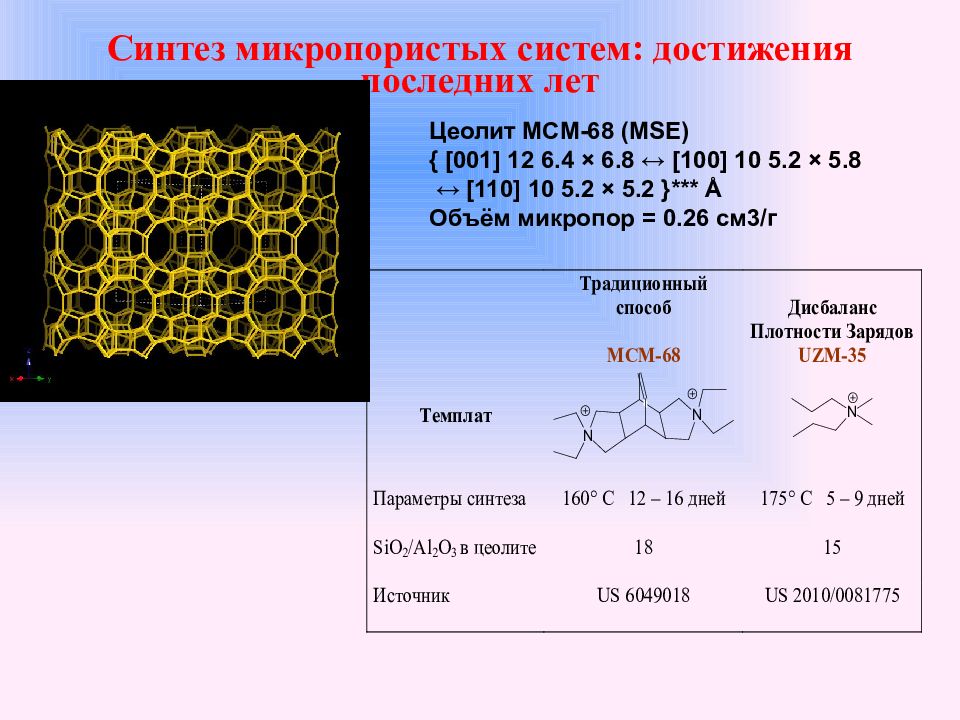
Слайд 38: Синтез микропористых систем: достижения последних лет
Цеолит MCM -68 ( MSE ) { [001] 12 6.4 × 6.8 ↔ [100] 10 5.2 × 5.8 ↔ [110] 10 5.2 × 5.2 }*** Å Объём микропор = 0.26 см3/г
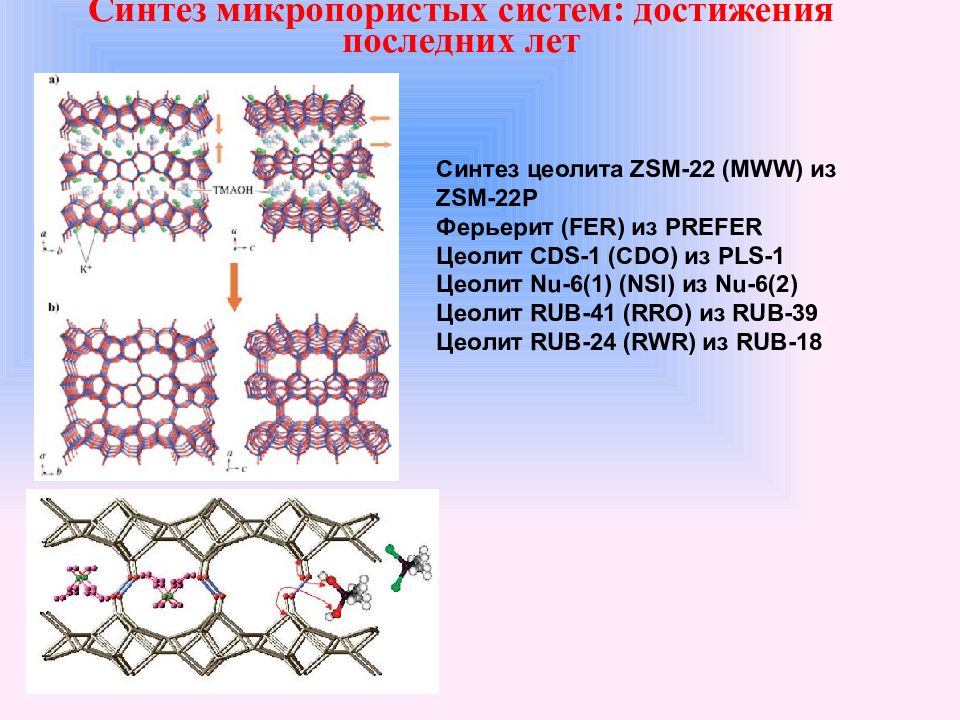
Слайд 39: Синтез микропористых систем: достижения последних лет
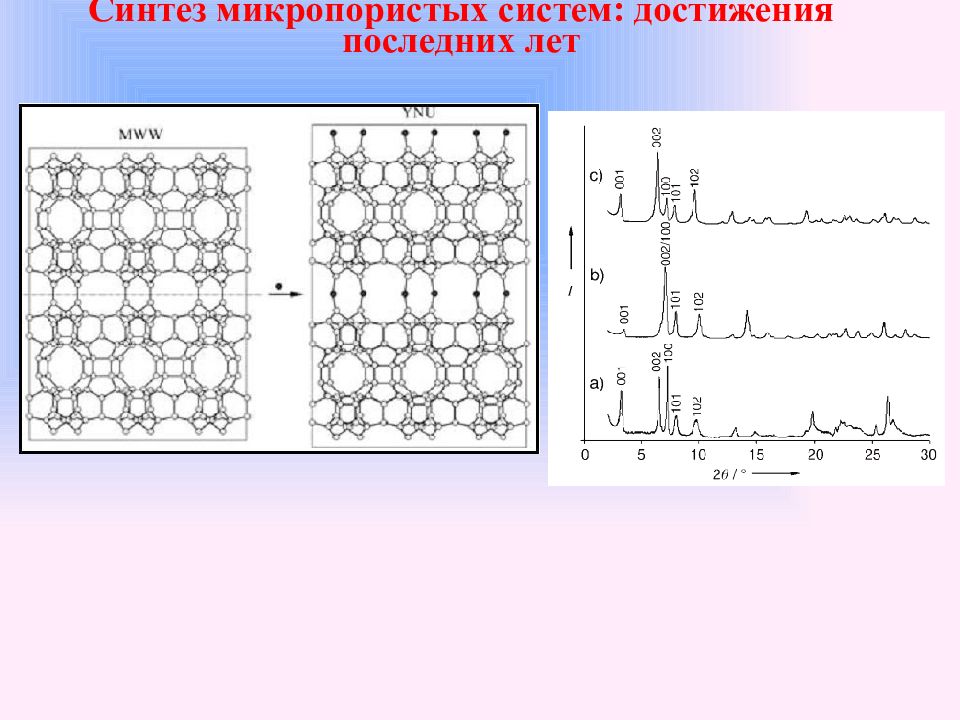
Синтез цеолита ZSM-22 (MWW) из ZSM-22P Ферьерит (FER) из PREFER Цеолит CDS-1 (CDO) из PLS-1 Цеолит Nu-6(1) (NSI) из Nu-6(2) Цеолит RUB-41 (RRO) из RUB-39 Цеолит RUB-24 (RWR) из RUB-18
Слайд 41: Синтез микропористых систем: достижения последних лет
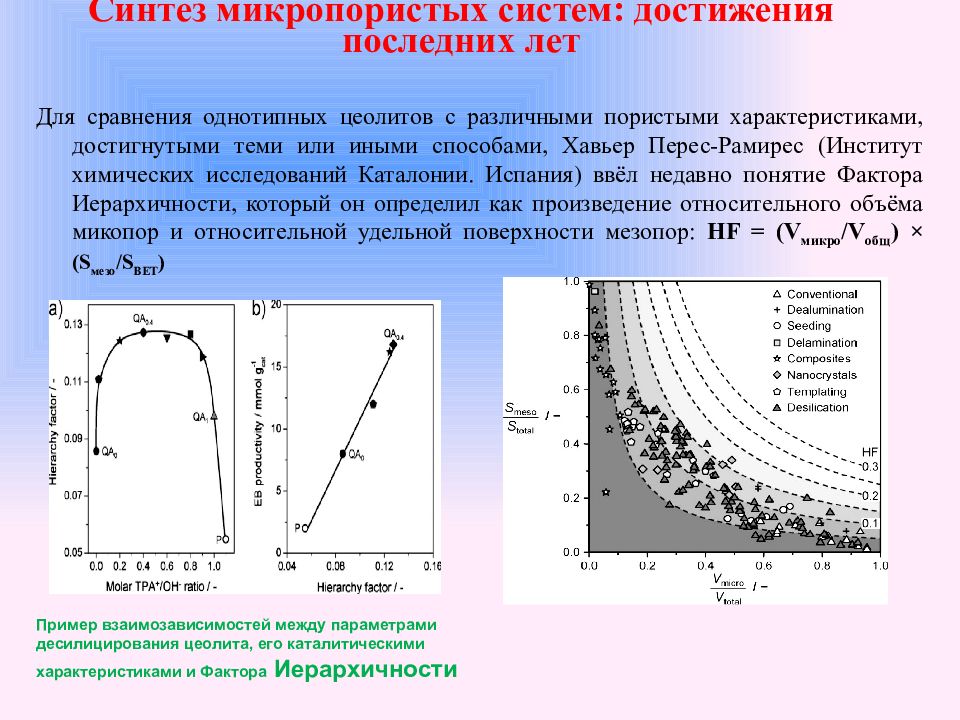
Для сравнения однотипных цеолитов с различными пористыми характеристиками, достигнутыми теми или иными способами, Хавьер Перес-Рамирес (Институт химических исследований Каталонии. Испания) ввёл недавно понятие Фактора Иерархичности, который он определил как произведение относительного объёма микопор и относительной удельной поверхности мезопор: HF = (V микро /V общ ) × (S мезо /S BET ) Синтез микропористых систем: достижения последних лет Пример взаимозависимостей между параметрами десилицирования цеолита, его каталитическими характеристиками и Фактора Иерархичности
Слайд 42: Синтез микропористых систем: достижения последних лет
Морфообразующий агент: [3-( триметоксисилил ) пропил ] гекадецилдиметиламмоний хлорид [ ( CH 3 O ) 3 SiC 3 H 6 N ( CH 3 ) 2C 16 H 33 ]Cl 1 Al2O3 : 10 TPABr : 10 Na2O : 38 SiO2 : 1. 6 TPHAC : 7200 H2O 1 Al2O3 : 3. 3 Na2O : 2 SiO2 : 128 H2O : 0. 08 TPHAC 95°С 4ч Синтез микропористых систем: достижения последних лет Размер мезопор (2-20 нм) можно регулировать как температурой синтеза, так и длиной алкильной цепи
Слайд 43: Синтез микропористых систем: достижения последних лет
Двумерный ZSM-5 цеолит с толщиной слоя в одну элементарную ячейку M. Choi, K. Na, J. Kim, Y. Sakamoto, O. Terasaki, R. Ryoo, Nature 461 (2009) 246–249 30 Na2O:1Al2O3:100 SiO2:10 C22-6-6Br2:18 H2SO4: 4000 H2O 1 Al2O3:100 SiO2:15 C22-6-6(ОН)2:3 H2SO4: 6000 H2O Обычный ZSM-5 S уд = 420 м 2 /г Мультислойный ZSM-5 S уд = 520 м 2 /г Однослойный ZSM-5 S уд = 710 м 2 /г
Слайд 44: Синтез микропористых систем: достижения последних лет
Синтез иерархически организованных кристаллов SAPO -34 с применением природного каолина Синтез микропористых систем: достижения последних лет Jie Zhu, Yu Cui, Yao Wang, Fei Wei, Chem. Commun., 2009, 3282–3284
Слайд 45: Синтез микропористых систем: достижения последних лет
Гигантские кристаллы цеолитов Синтез микропористых систем: достижения последних лет TPAOH/HF/H2O = 9/7.3–50/885 175 ºC 30 дней 1 TEAOH:1.5 HF:15 H2O : nano Beta seed 150 ºC 30 дней
Слайд 46: Синтез микропористых систем: достижения последних лет
Применение барьерного разряда для удаления темплата из синтезированного цеолита Синтез микропористых систем: достижения последних лет Температура в образце не превышает 140 °С Время удаления темплата не более 1,5 часов Изменение окраски образца цеолита в ходе процесса
Слайд 47: Гидротермальный и сольвотермальный синтез
В основе гидротермального метода синтеза - высокая растворимость большого количества неорганических веществ в воде при повышенных температуре и давлении; возможность последующей кристаллизации растворенного материала из жидкой фазы. Высокая температура воды играет важную роль в трансформации материала прекурсора, поскольку при этом создается повышенное давление паров, а сама структура воды отличается от таковой при комнатной температуре. К тому же при высокой температуре изменяются свойства самих реагентов (растворимость, скорость диффузии, реакционная способность). Контроль давления паров, температуры и времени реакции предоставляет широкие возможности для синтеза высококачественных частиц и нанотрубок. В ходе процесса эти параметры могут варьироваться для достижения максимально возможной скорости спонтанного зародышеобразования и узкого распределения наночастиц по размерам. Гидротермальный и сольвотермальный синтез
Слайд 48: Гидротермальный и сольвотермальный синтез
Выбор растворителя не ограничивается лишь водой, а включает и другие полярные и неполярные растворители, такие как толуол, бензол, спирт и т.д. Практически метод реализуется нагревом смеси реагентов в подходящем растворителе и автоклаве. Гидротермальный синтез проводится, как правило, при температурах 100-370 о С (критическая точка воды 374.2 о С, 21.4 МПа). В случае использования высококипящих растворителей температура синтеза может достигать 600 о С. При более высоких тепературах реализуют синтез в сверхкритических условиях. Гидротермальный и сольвотермальный синтез
Слайд 49: Гидротермальный и сольвотермальный синтез
Методы сольвотермального синтеза и синтеза в сверхкритических условиях позволяют получать самые разные типы наноструктур, начиная от простых веществ ( Ge, Si ), оксидов и халькогенидов, таких как SiO 2, TiO 2, ZnO, PbS, ZnS, CdS, и заканчивая сложными соединениями ( SrFe 12 O 19, LaMnO 3) и сложными наноструктурами (цеолиты, мезопористый диоксид кремния, диоксид титана). Нанокристаллы, полученные этим методом, обычно хорошо закристаллизованы, н имеют широкое распределение по размерам. Качественный контроль размера и формы наночастиц, синтезируемых гидротермально, все еще остается предметом активных исследований. Гидротермальный и сольвотермальный синтез
Слайд 50: Гидротермальный и сольвотермальный синтез
C интез, гидротермальный (англ. hydrothermal synthesis) — метод получения различных химических соединений и материалов с использованием физико-химических процессов в закрытых системах, протекающих в водных растворах при температурах свыше 100 о С и давлениях выше 1 атм. Гидротермальный и сольвотермальный синтез
Слайд 51: Гидротермальный и сольвотермальный синтез
Основными параметрами гидротермального синтеза, определяющими как кинетику протекающих процессов, так и свойства образующихся продуктов, являются начальное значение pH среды, продолжительность и температура синтеза, величина давления в системе. Синтез осуществляется в автоклавах, представляющих собой герметичные стальные цилиндры, способные выдерживать высокие температуры и давление в течение длительного времени. Гидротермальный и сольвотермальный синтез
Слайд 52: Гидротермальный и сольвотермальный синтез
Преимуществами метода гидротермального синтеза являются возможность синтеза кристаллов веществ, нестабильных вблизи температуры плавления, возможность синтеза крупных кристаллов высокого качества. В качестве недостатков стоит отметить дороговизну оборудования и невозможность наблюдения за кристаллами в процессе роста. Проведение гидротермального синтеза возможно как при температуре и давлении ниже критической точки для данного растворителя, выше которой исчезают различия между жидкостью и паром, так и в сверхкритических условиях. Растворимость многих оксидов в гидротермальных растворах солей значительно выше, чем в чистой воде; соответствующие соли получили название минерализаторов. Гидротермальный и сольвотермальный синтез
Слайд 53: Гидротермальный и сольвотермальный синтез
Существует также родственная гидротермальному группа сольвотермальных методов синтеза, основанная на использовании органических растворителей и сверхкритического CO 2. Существенному расширению возможностей гидротермального метода способствует применение дополнительных внешних воздействий на реакционную среду в процессе синтеза. В настоящее время подобный подход реализован в гидротермально-микроволновом, гидротермально-ультразвуковом, гидротермально-электрохимическом и гидротермально-механохимическом методах синтеза. Гидротермальный и сольвотермальный синтез
Слайд 54: Гидротермальный и сольвотермальный синтез
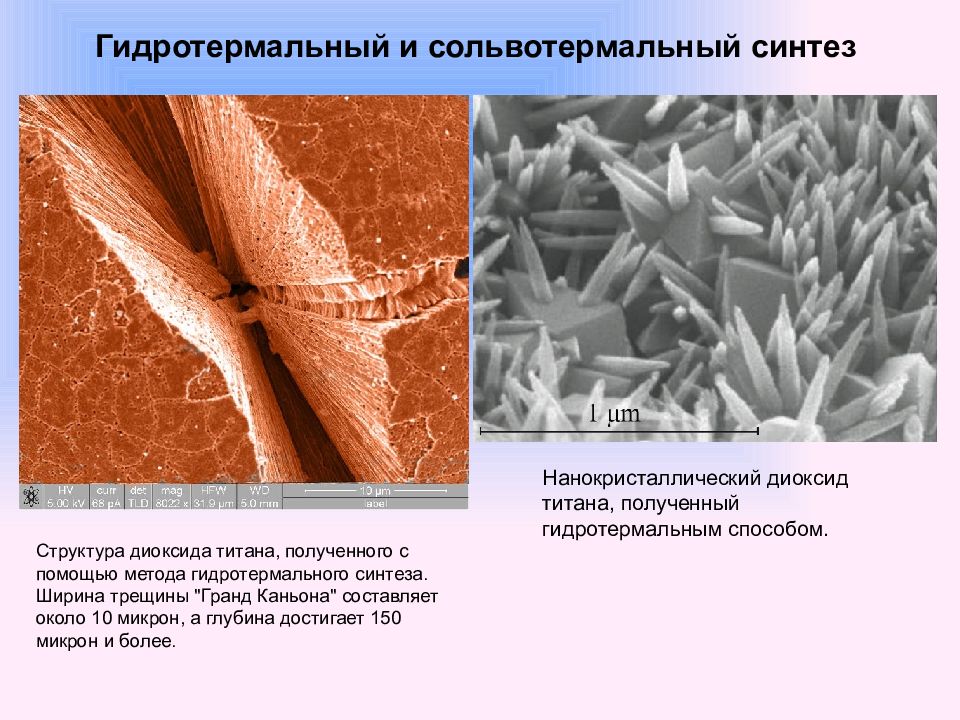
Одним из наиболее известных наноматериалов, производимых гидротермальным методом, являются синтетические цеолиты. Необходимым условием их получения является присутствие в растворе некоторых поверхностно-активных веществ (ПАВ), активно влияющих на морфологическую эволюцию оксидных соединений в гидротермальных растворах. Выбор условий синтеза и типа ПАВ позволяет целенаправленно получать пористые наноматериалы с заданным размером пор, регулируемым в достаточно широких пределах. Гидротермальный и сольвотермальный синтез Нанокристаллический TiO 2, полученный гидротермальным способом. Автор: Б. Р. Чурагулов, МГУ им. М. В. Ломоносова.
Слайд 55: Гидротермальный и сольвотермальный синтез
Структура диоксида титана, полученного с помощью метода гидротермального синтеза. Ширина трещины "Гранд Каньона" составляет около 10 микрон, а глубина достигает 150 микрон и более. Нанокристаллический диоксид титана, полученный гидротермальным способом.
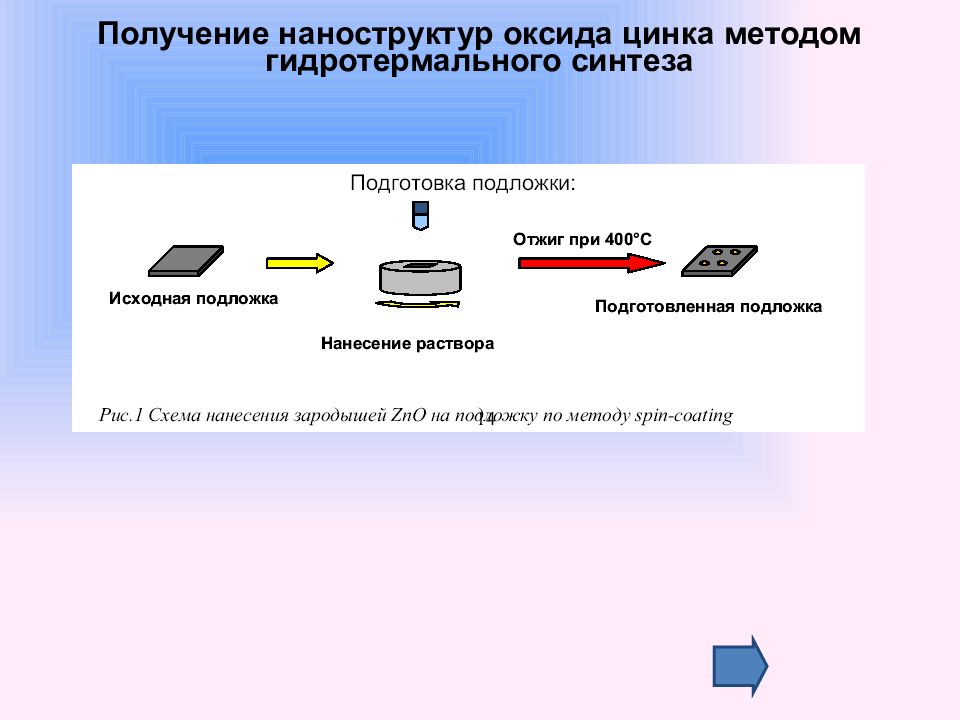
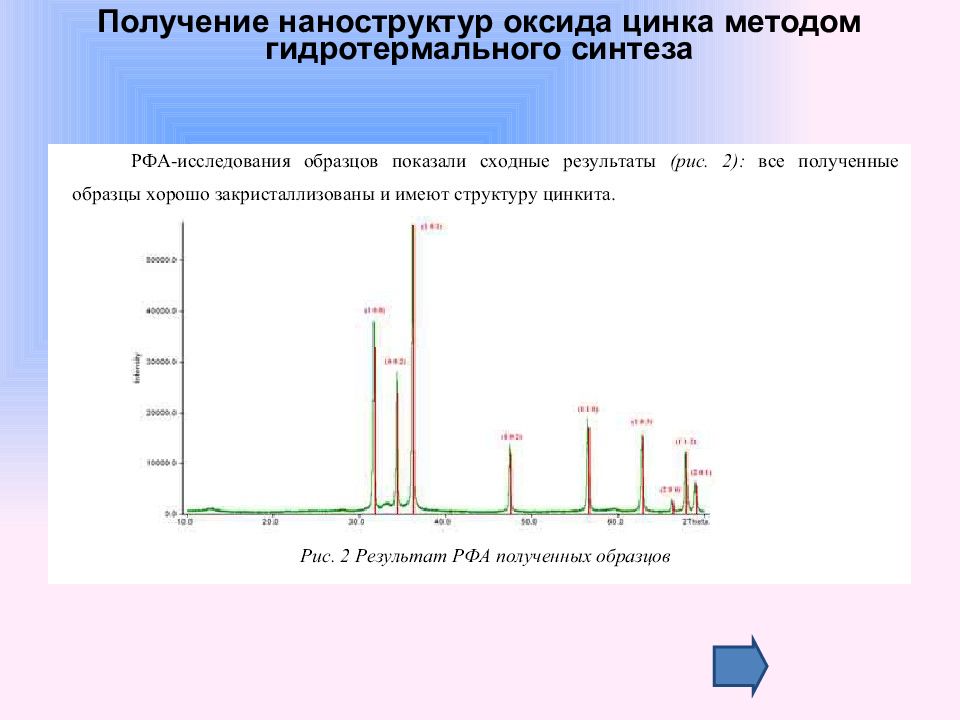
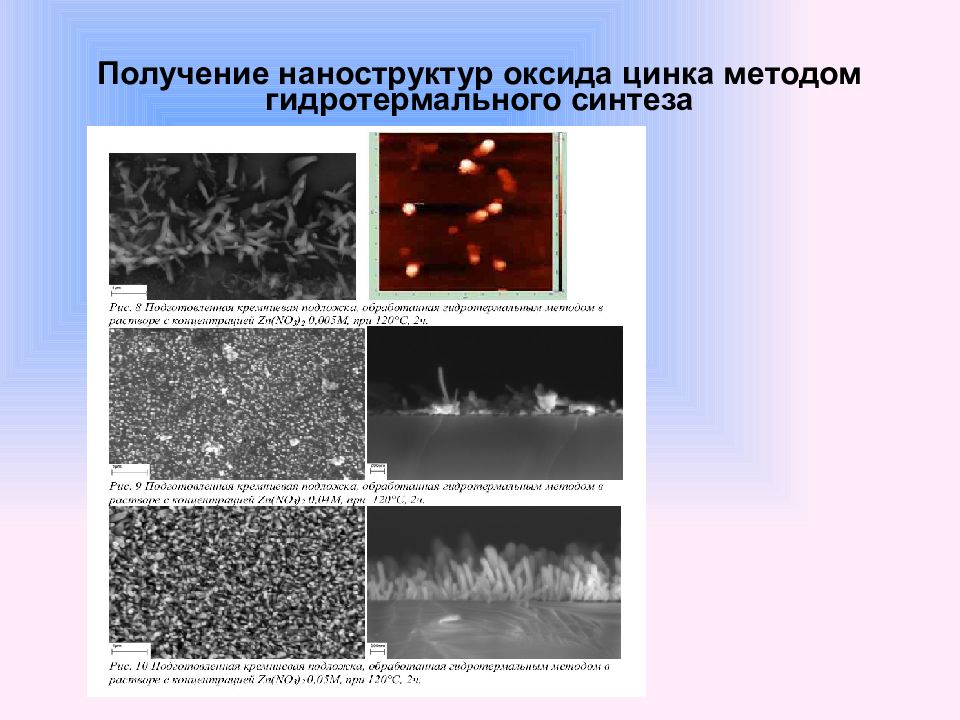
Слайд 59: Получение наноструктур оксида цинка методом гидротермального синтеза
Синтез наностержней ZnO диной 40-150 нм и толщиной 30 нм на подложке ориентированного Si (100) c нанесенным слоем Au (3-20нм)- выполнен используя метод транспорта через газовую фазу с последующей конденсацией ( метод CVTC ). Морфологию наностержней контролировали изменяя толщину золотой пленки и температуру синтеза. При этом полученные наностержни были ориентированы строго перпендикулярно поверхности подложки. Синтез наностержней оксида цинка со случайной ориентацией был осуществлен путем осаждения паров ZnO на кремниевую подложку в трубчатой печи в потоке аргона при температуре 1380 оС. Синтез одномерных наноструктур ZnO проводят и без использования подложек. Известно получение квавзиодномерных структур оксида цинка из металлического цинка и водяного пара по реакции: Получение наноструктур оксида цинка методом гидротермального синтеза
Последний слайд презентации: Наноразмерные цеолитные и цеолитоподобные материалы: Темплатный синтез
– совокупность реакций, протекающих между координированными молекулами. Комплексообразователь определенным образом ориентирует их реагирующие фрагменты; тем самым достигается образование целевого продукта синтеза, получить который в реакциях без участия атома или иона металла, как правило, невозможно. Темплатный синтез