Слайд 3
3 неполярные, или гидрофобные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин); полярные, но незаряженные (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин); положительно заряженные (лизин, гистидин, аргинин); отрицательно заряженные (аспарагиновая кислота, глутаминовая кислота). Аминокислоты подразделяются на 4 основные класса:
Слайд 4
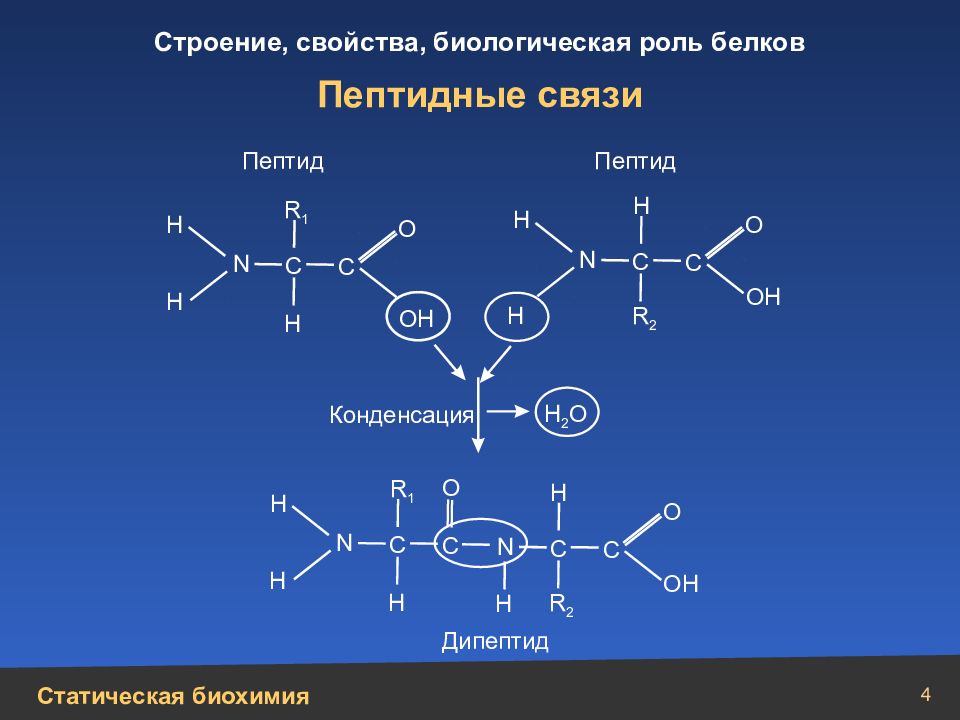
4 Пептидные связи Н Н Н Н N N N N Н Н Н Н Н Н Н ОН Н 2 О ОН ОН О О О О С С С С С С С С Конденсация Дипептид Пептид Пептид R 1 R 2 R 1 R 2
Слайд 5
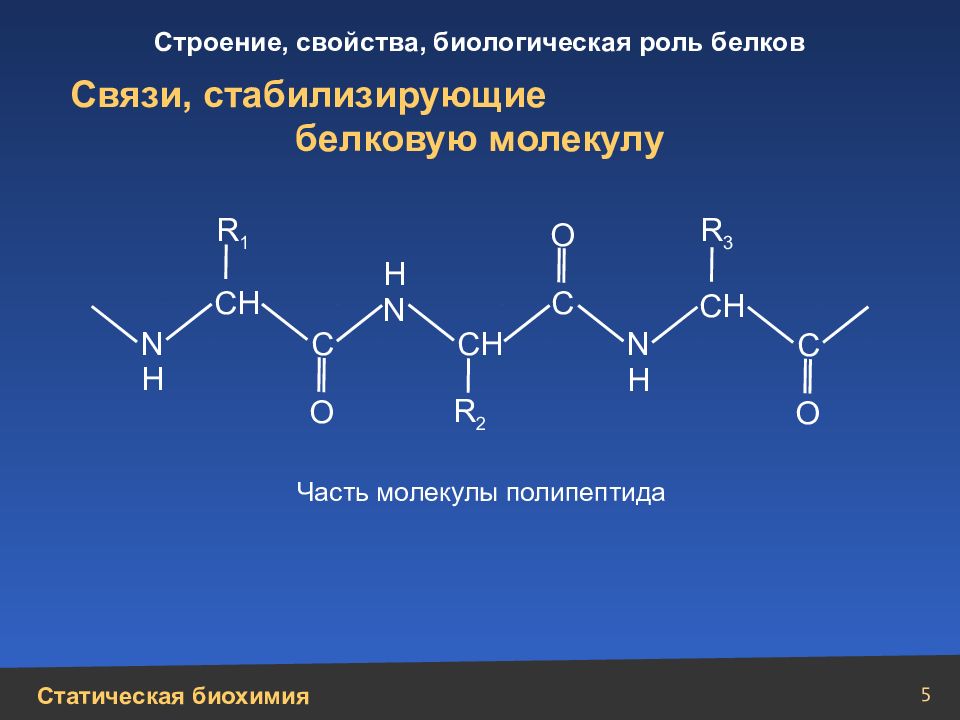
5 Связи, стабилизирующие белковую молекулу N Н N Н Н N О О О С С СН СН СН С Часть молекулы полипептида R 1 R 2 R 3
Слайд 6
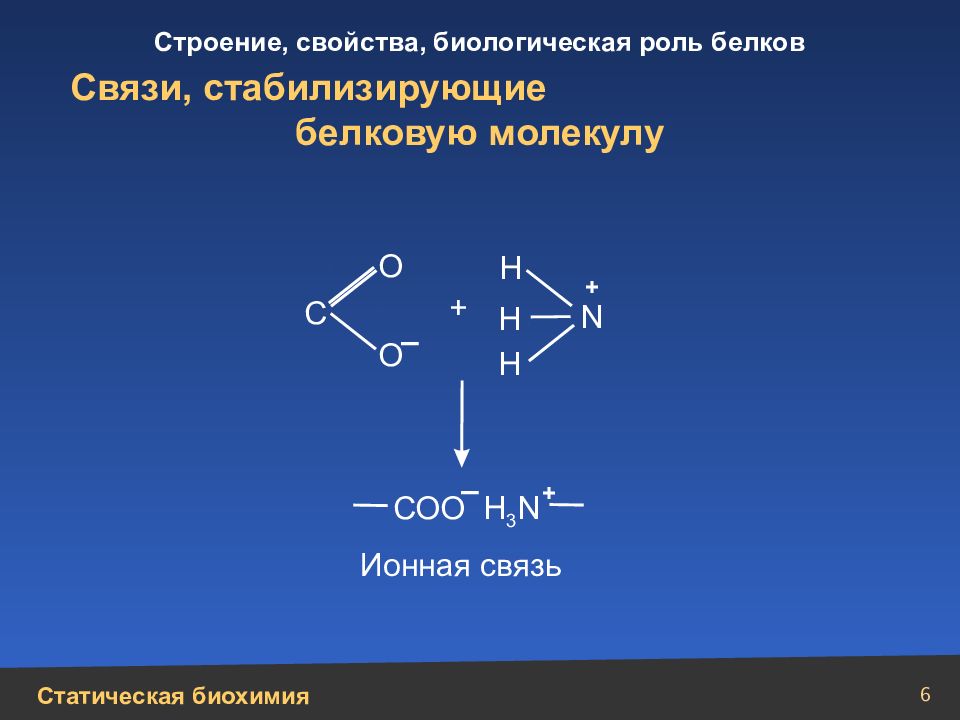
6 Связи, стабилизирующие белковую молекулу Н Н N Н + + О О С СОО Н 3 N – – + Ионная связь
Слайд 7
7 Связи, стабилизирующие белковую молекулу S Н S S Н S Дисульфидная связь Окисление Восстановление
Слайд 8
8 Связи, стабилизирующие белковую молекулу Водородная связь Локализованное электростатическое притяжение – ОН........... ОС Электроположительные водородные атомы, соединенные с кислородом или азотом в группах –ОН или –NH, стремятся обобществить электроны с находящимся по соседству электроотрицательным атомом кислорода, например, с кислородом группы =СО.
Слайд 9: Свойства белков:
1. Видовая специфичность. Каждая клетка способна к синтезу строго определенных белков, что является ее наследственным свойством. Первичная структура (последовательность аминокислот), определяющая все более высокие уровни организации белковой молекулы закодирована в ДНК. 2. Денатурация и ренатурация. Утрата белков структурной организации называется денатурацией. Если под действием денатурирующего фактора (спирт, кислота, щелочь,температура, облучение и др.) не затрагивается первичная структура, то при возвращении белковых молекул в нормальные условия их структура полностью восстанавливается, т. е. происходит ренатурация. При необратимой денатурации (разрушении первичной структуры) белки теряют свои свойства. 9
Слайд 10: Свойства белков:
3. Сократимость. Молекулы белка актина и миозина способны взаимодействовать друг с другом, изменяя форму молекулы, и тем самым совершать движение, выполнять работу. 4. Различная химическая активность. 5. Способность переходить из состояния золя в состояние гель. Белки, растворенные в воде (гиалоплазма, кариолимфа), придают раствору коллоидные свойства. 10
Слайд 11: Функции белков:
Структурная - белки входят в состав мембран и органелл клетки. Из кератина и коллагена состоят хрящи, сухожилия, волосы, ногти, когти, рога, копыта, паутина, перья. Транспортная - некоторые белки способны присоединять и переносить различные вещества (гемоглобин переносит кислород и углекислый газ, альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны). Двигательная (сократительная) - актин и миозин входят в состав миофибрилл мышечной ткани, органоидов движения - ресничек и жгутиков. 11
Слайд 12: Функции белков:
12 Защитная - иммуноглобулины (антитела) обеспечивают защитные реакции иммунитета, протромбин и фибриноген участвуют в защитной реакции свертывания крови. Сигнальная (рецепторная) - некоторые белки, встроенные в плазмалемму способны изменять свою пространственную конфигурацию под действием факторов внешней среды (родопсин палочек сетчатки глаза, фитохром - регулирующий фотопериодизм растений). Регуляторная - многие гормоны имеют белковую природу (инсулин, глюкагон, АКТГ). Энергетическая - иногда белки используются клеткой в качестве энергетического субстрата, при расщеплении 1г белка выделяется 17,6 кДж энергии, Каталитическая - все ферменты являются белками (трипсин, ДНК-полимераза).
Слайд 13
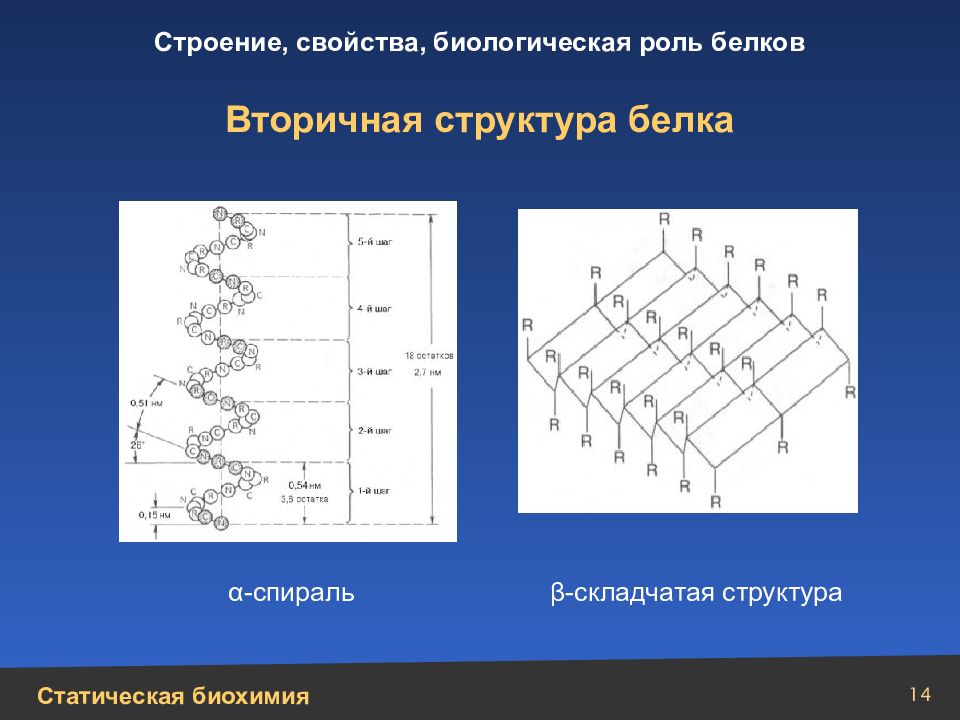
13 Последовательность аминокислот для каждого белка уникальна и закреплена генетически Первичная структура характеризуется последовательностью аминокислотных остатков в полипептидной цепи, связанных ковалентными связями Трипептид: глицилаланиллизин N — конец NH 2 — CH 2 — C — N — CH — C — N — CH — COOH C — конец O O H (CH 2 ) 4 NH 2 H СH 3
Слайд 15
15 Характерные мотивы укладки белковой цепи в α -, β -, α / β -, и α + β -белках
Слайд 16
16 Третичная структура белка Доменное строение глобулярных белков (по А. А. Болдыреву)
Слайд 17
17 Четвертичная структура белка а – гемоглобин, состоящий из четырех субъединиц (двух α -цепей и двух β -цепей), б – одна субъединица, в – простетическая группа гемоглобина а б в
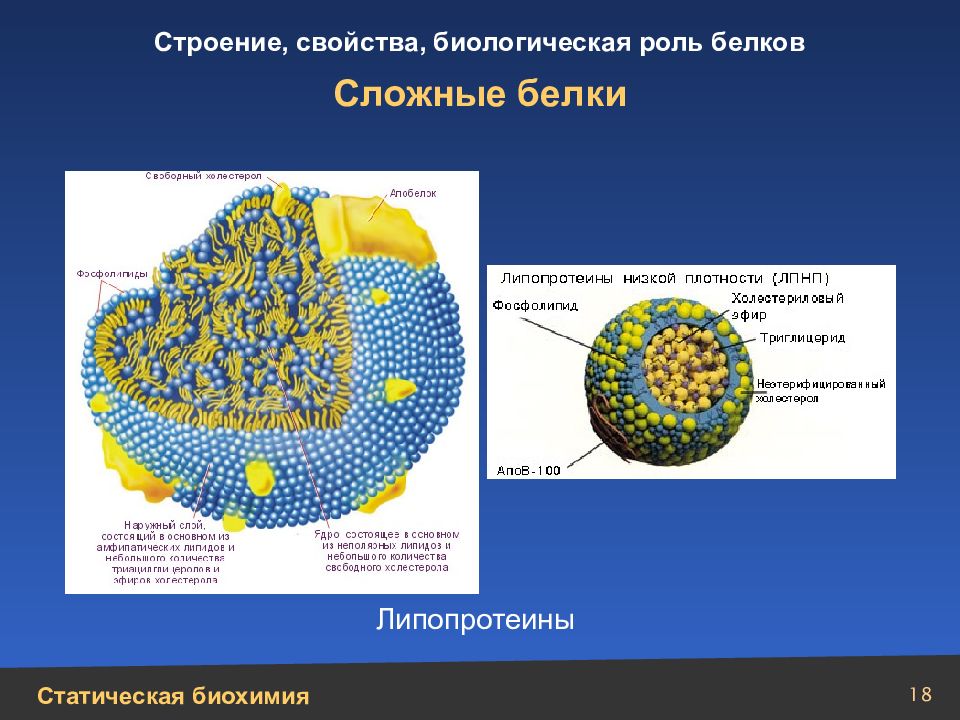
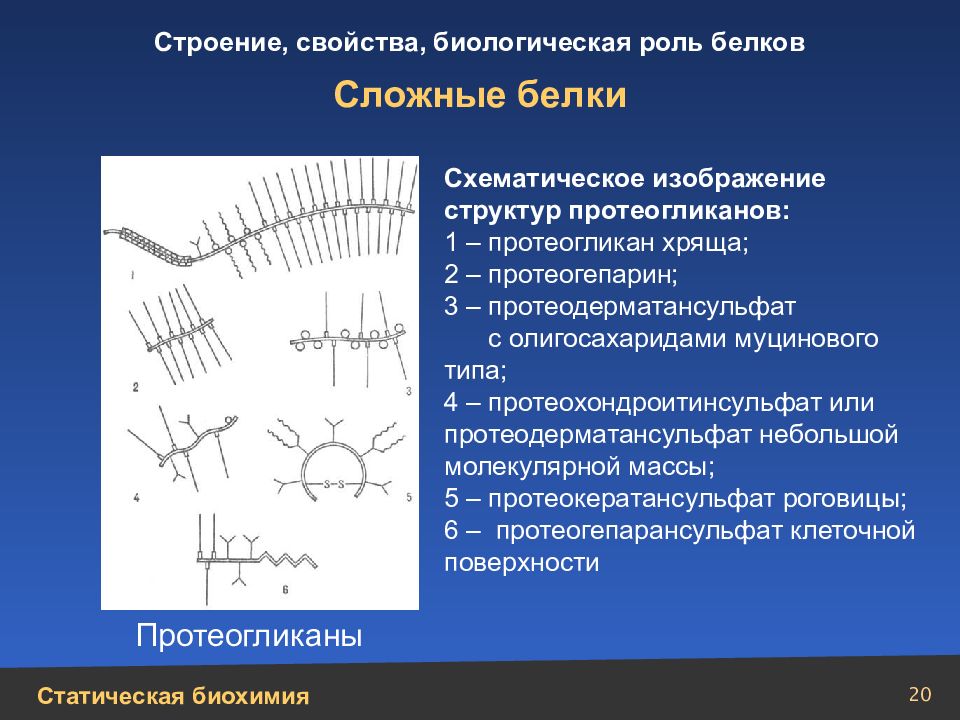
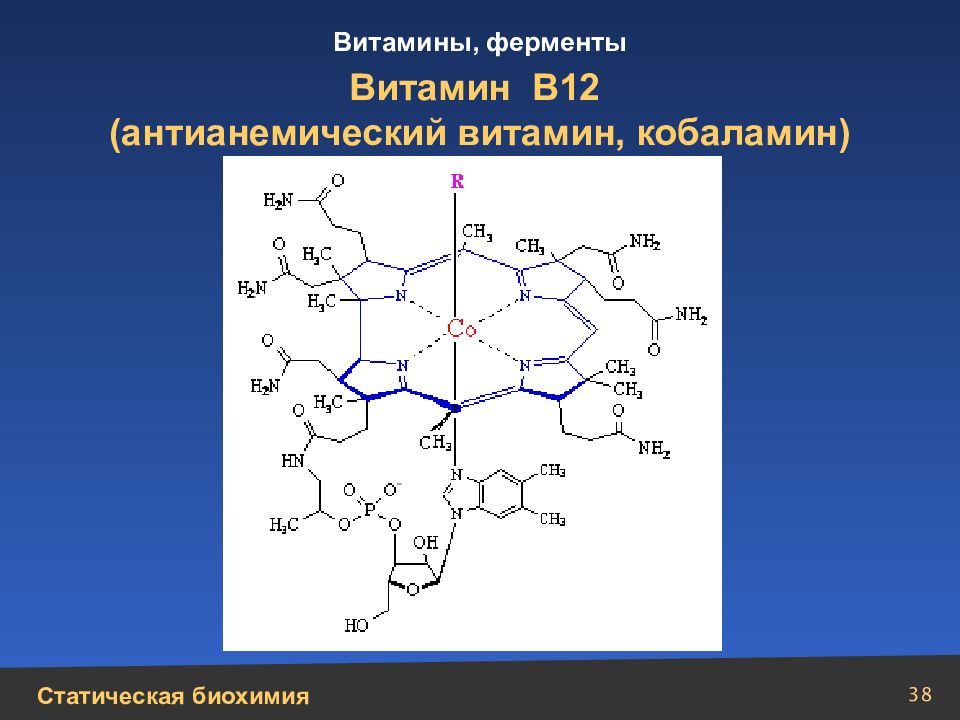
Слайд 20
20 Сложные белки Схематическое изображение структур протеогликанов: 1 – протеогликан хряща; 2 – протеогепарин; 3 – протеодерматансульфат с олигосахаридами муцинового типа; 4 – протеохондроитинсульфат или протеодерматансульфат небольшой молекулярной массы; 5 – протеокератансульфат роговицы; 6 – протеогепарансульфат клеточной поверхности Протеогликаны
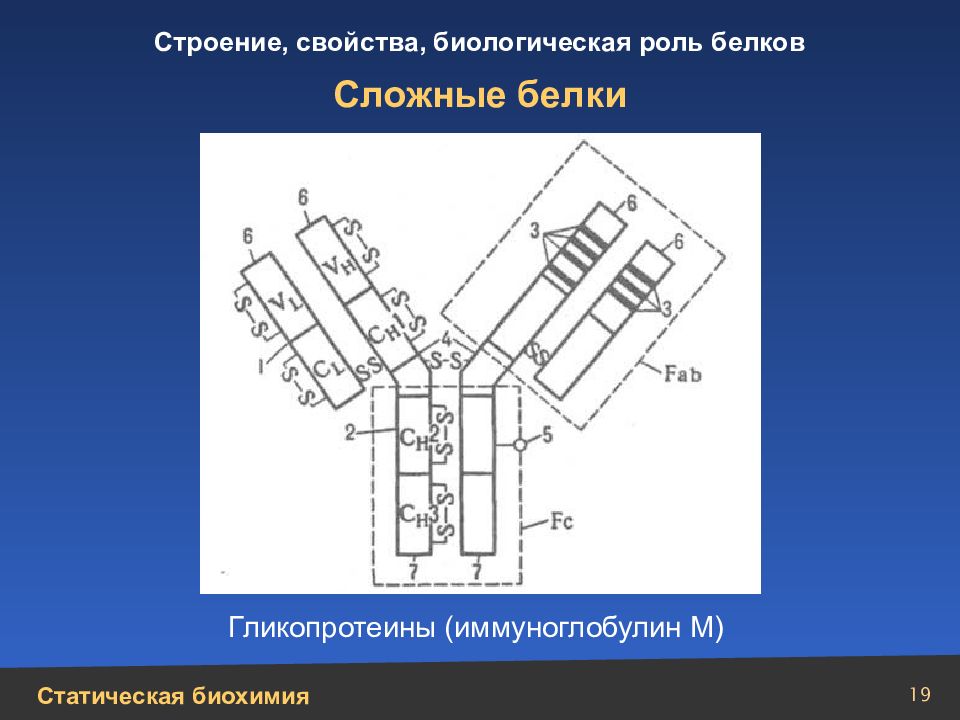
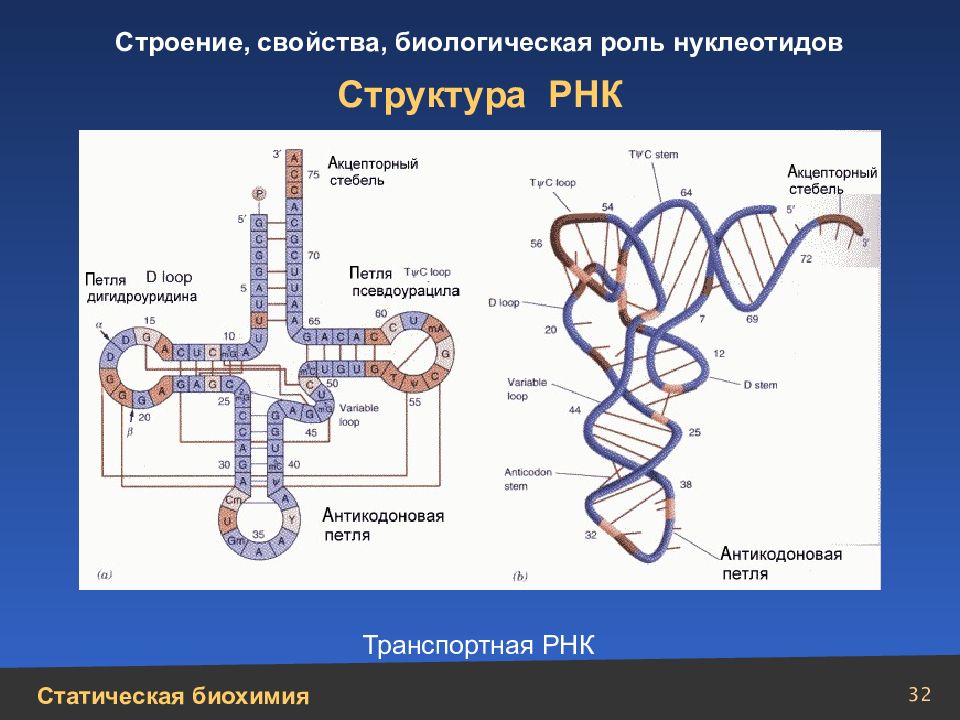
Слайд 22
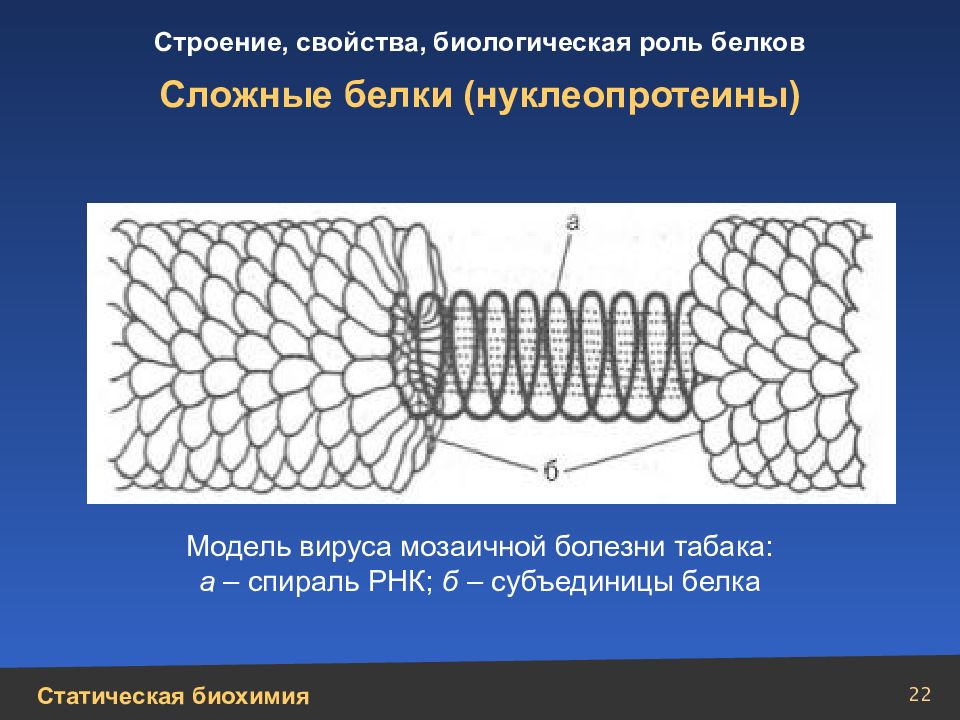
22 Сложные белки (нуклеопротеины) Модель вируса мозаичной болезни табака: а – спираль РНК; б – субъединицы белка
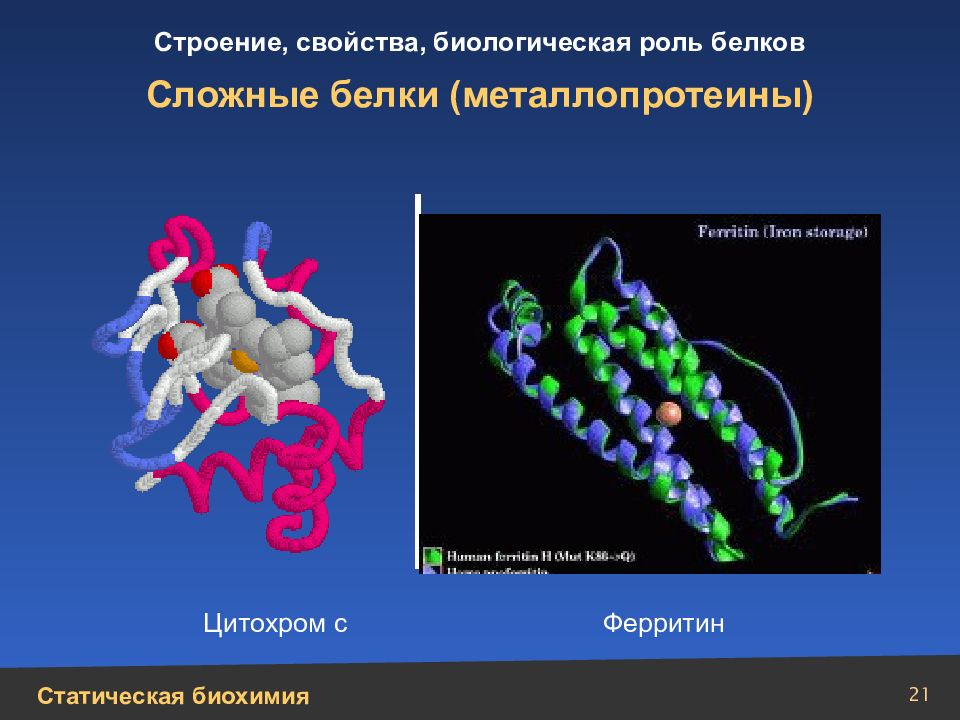
Слайд 26
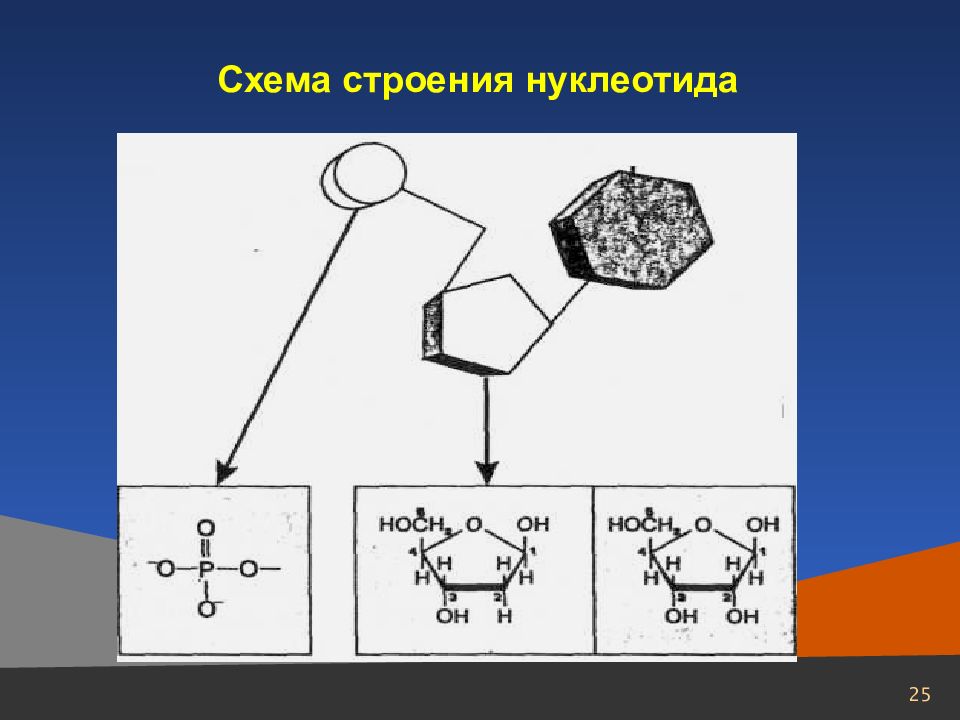
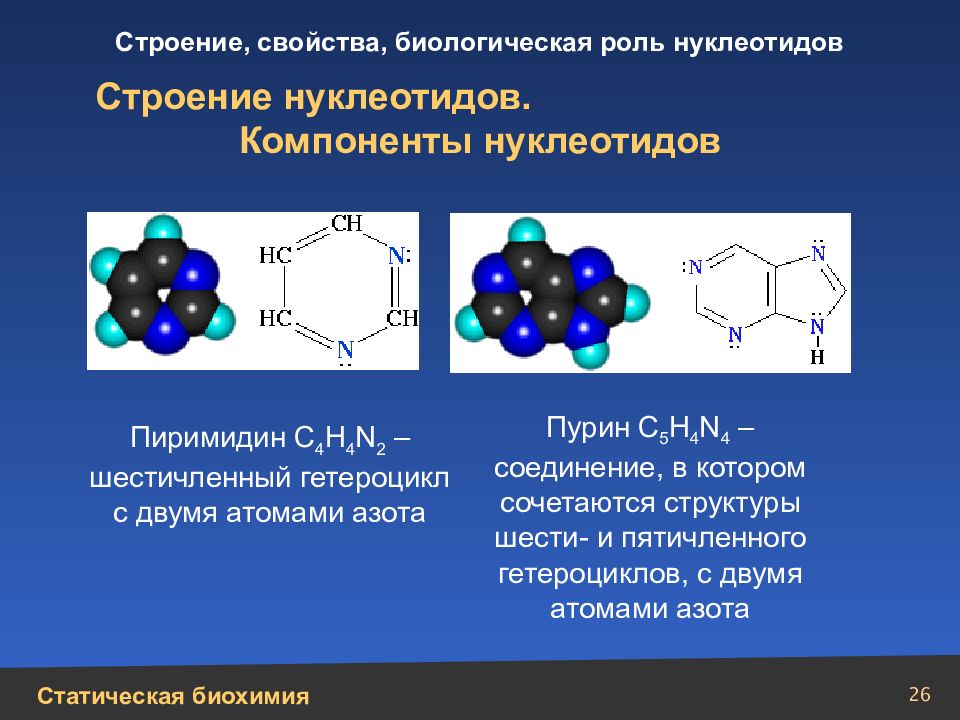
26 Строение нуклеотидов. Компоненты нуклеотидов Пиримидин С 4 Н 4 N 2 – шестичленный гетероцикл с двумя атомами азота Пурин С 5 H 4 N 4 – соединение, в котором сочетаются структуры шести- и пятичленного гетероциклов, с двумя атомами азота
Слайд 27
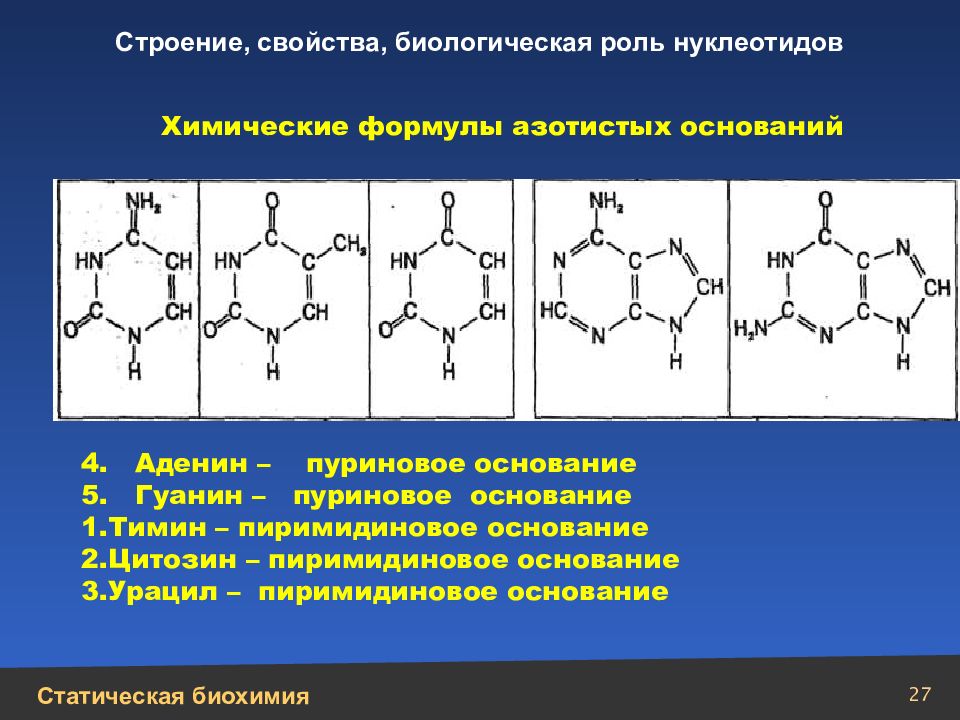
27 Химические формулы азотистых оснований 4. Аденин – пуриновое основание 5. Гуанин – пуриновое основание Тимин – пиримидиновое основание Цитозин – пиримидиновое основание Урацил – пиримидиновое основание
Слайд 29
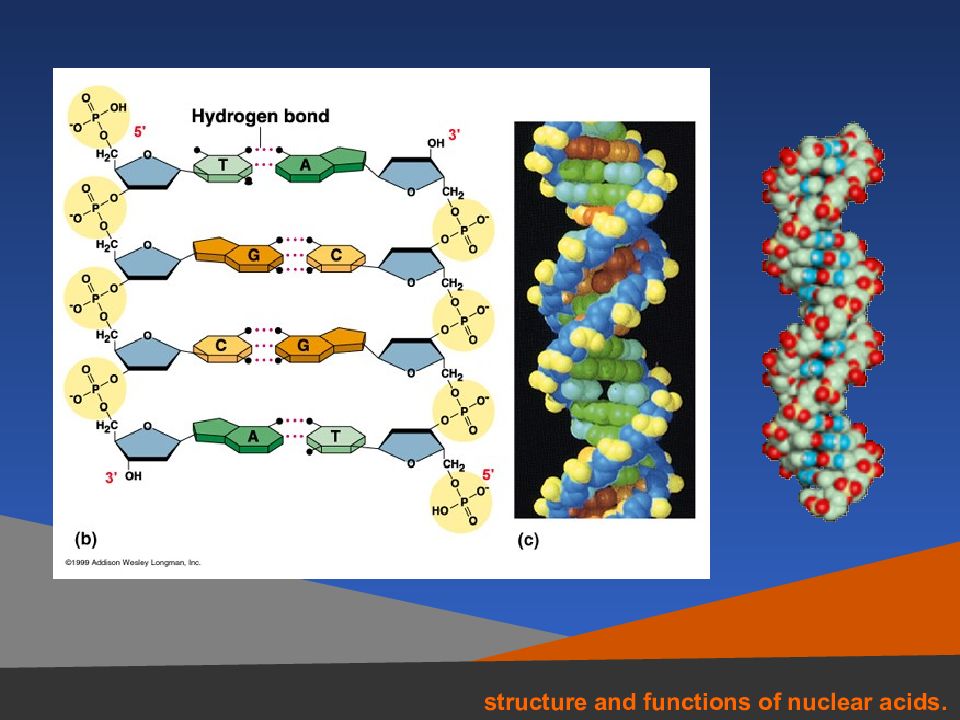
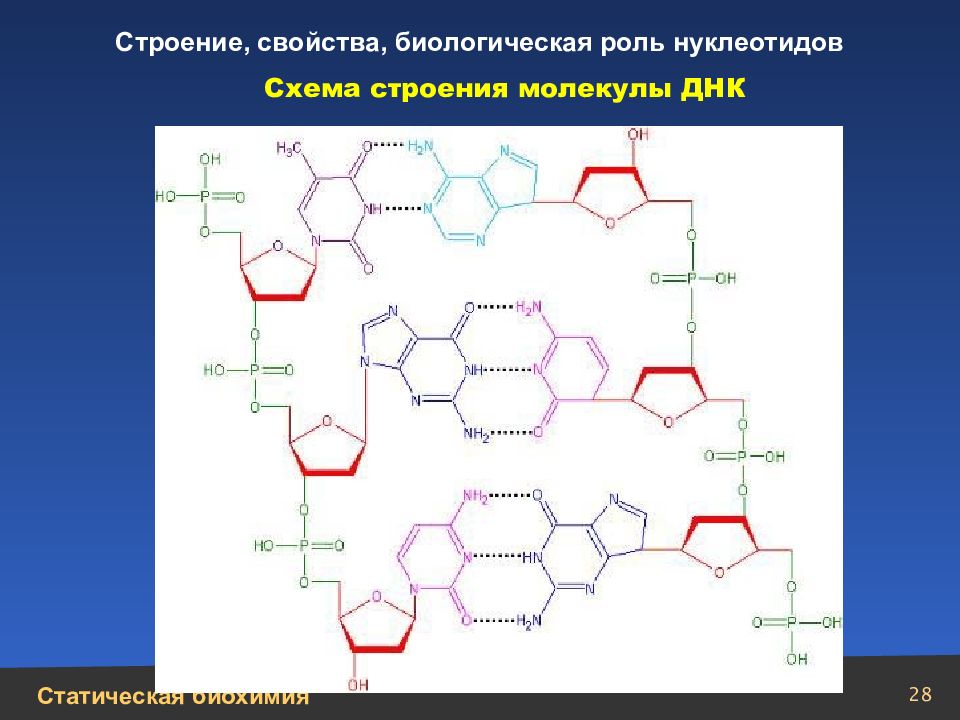
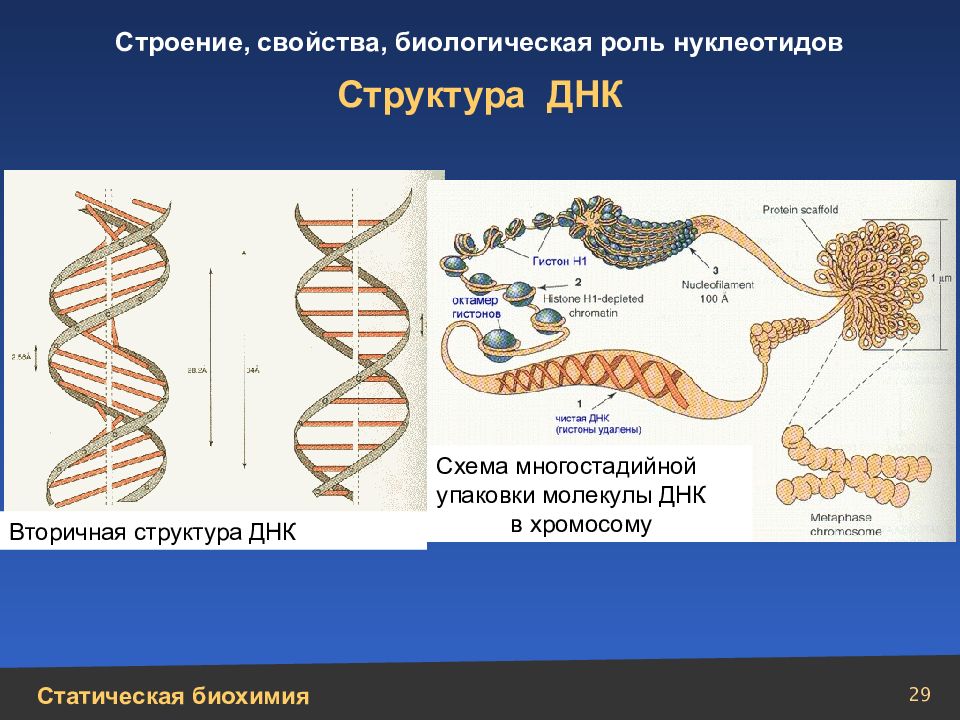
29 Структура ДНК Вторичная структура ДНК Схема многостадийной упаковки молекулы ДНК в хромосому
Слайд 30: Функции ДНК:
Хранение генетической информации. Воспроизведение и передача генетической информации. Реализация генетической информации. 30
Слайд 31
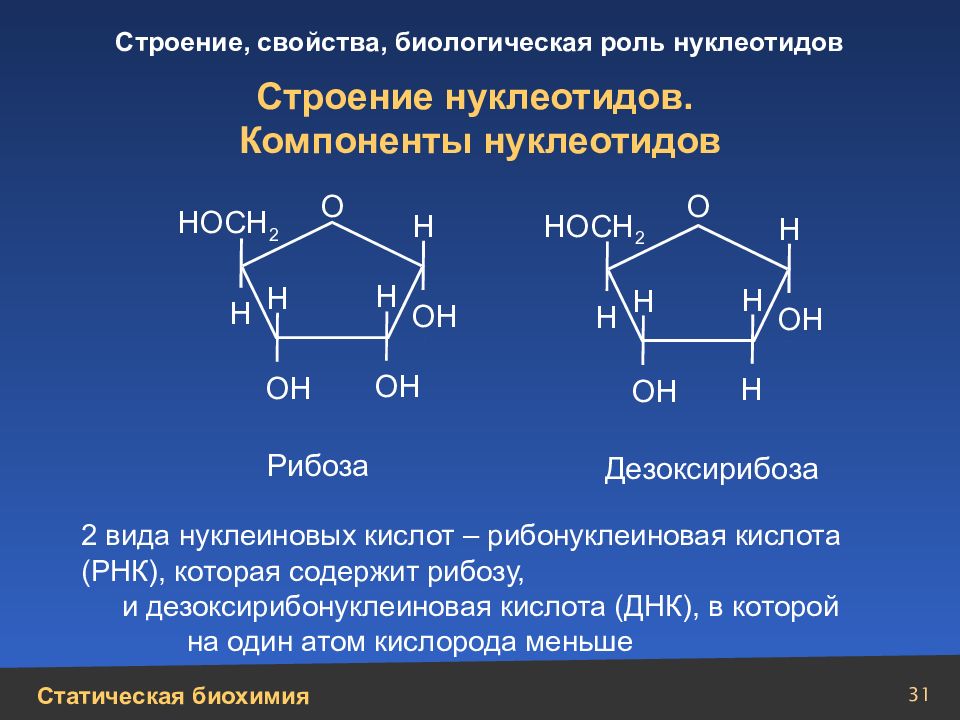
31 Строение нуклеотидов. Компоненты нуклеотидов 2 вида нуклеиновых кислот – рибонуклеиновая кислота (РНК), которая содержит рибозу, и дезоксирибонуклеиновая кислота (ДНК), в которой на один атом кислорода меньше НОСН 2 НОСН 2 Н Н Н Н Н Н ОН ОН Н Н ОН ОН ОН Н О О Рибоза Дезоксирибоза
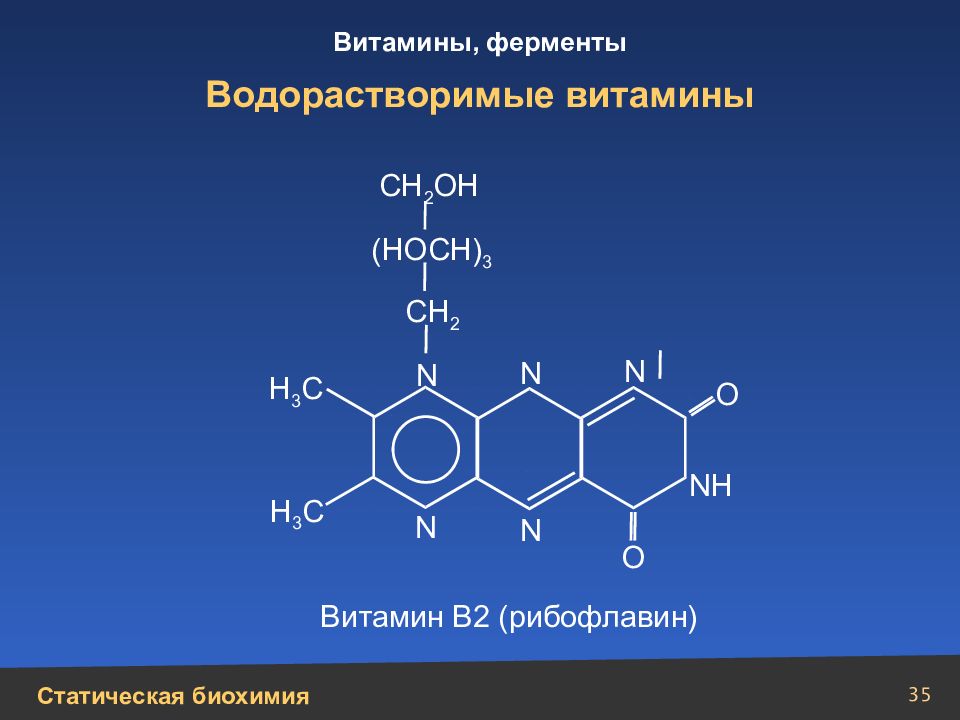
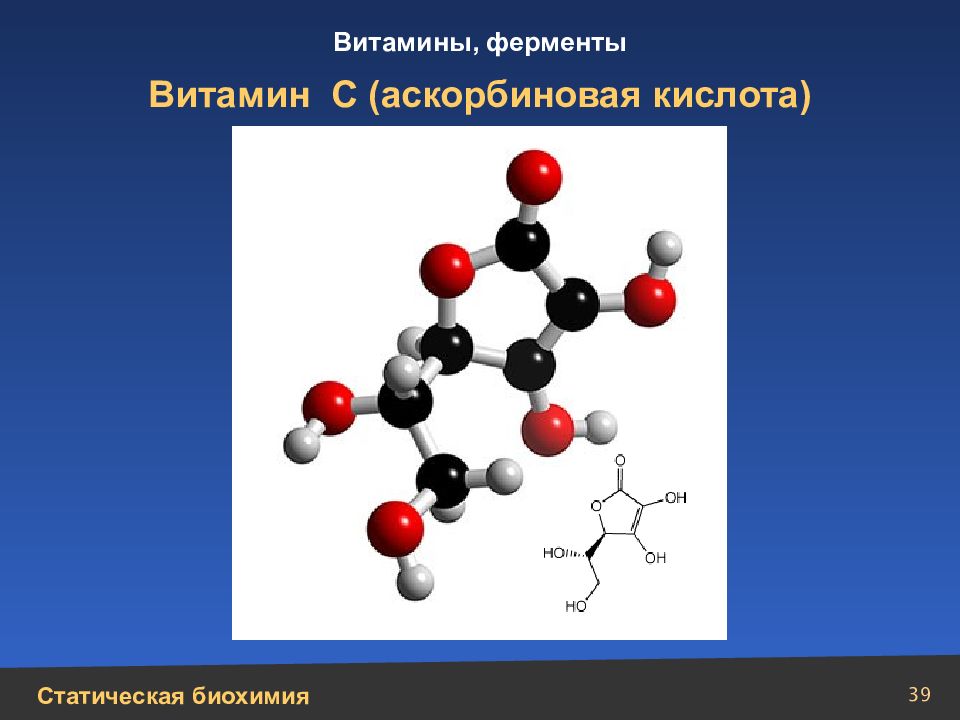
Слайд 35
35 Водорастворимые витамины N N N N N СН 2 СН 2 ОН (НОСН) 3 N Н Н 3 С Н 3 С О О Витамин В2 (рибофлавин)
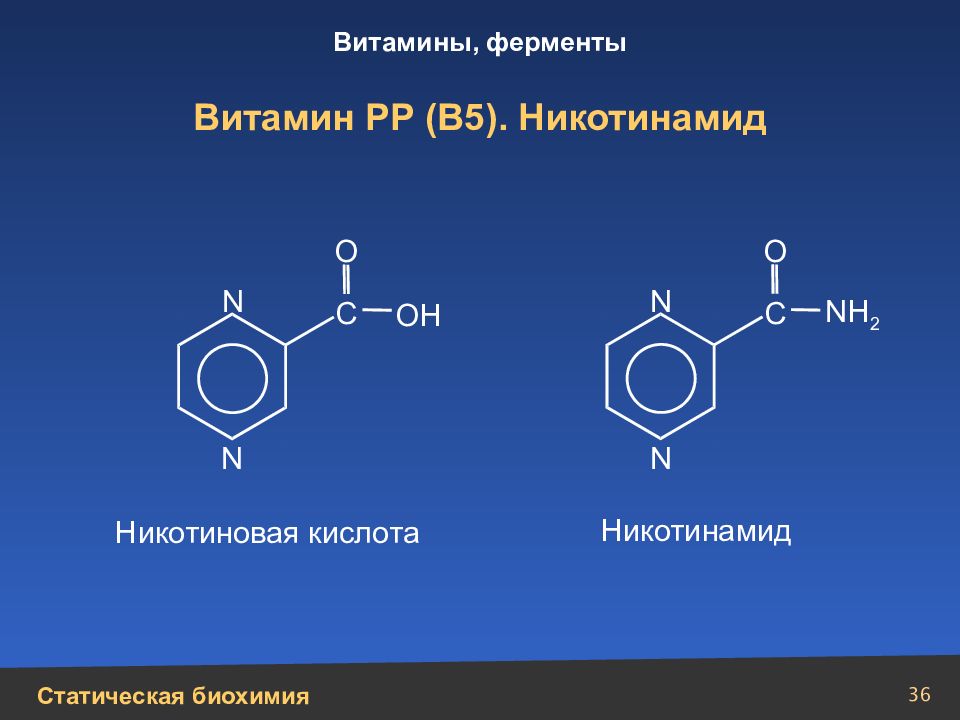
Слайд 36
36 Витамин РР (В5). Никотинамид N N N N С С N Н 2 ОН О О Никотиновая кислота Никотинамид
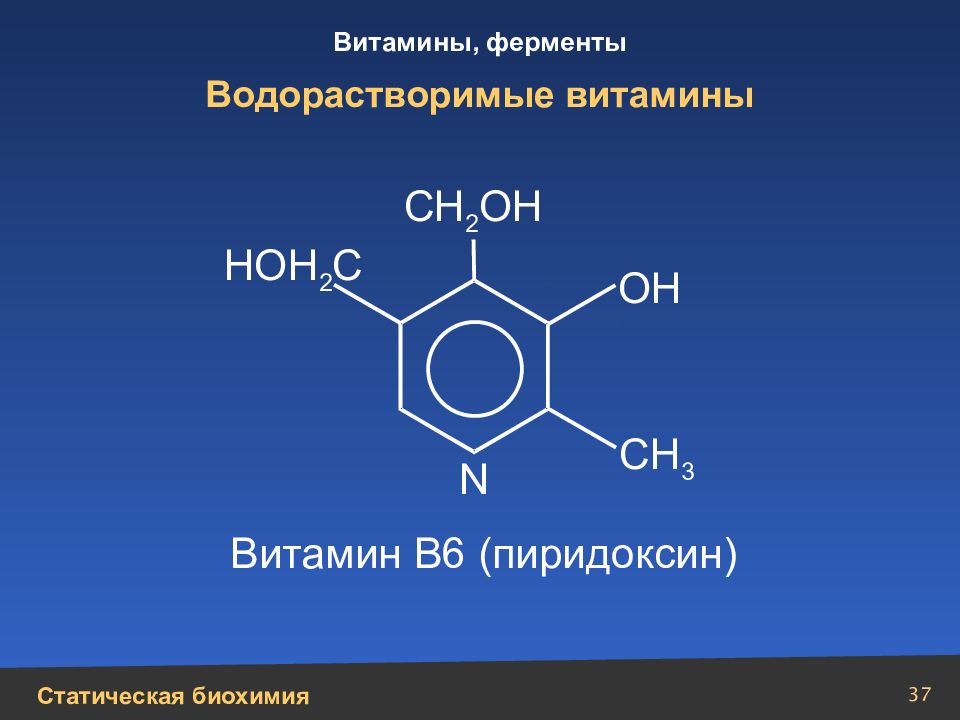
Слайд 37
37 Водорастворимые витамины N СН 3 СН 2 ОН ОН Витамин В6 (пиридоксин) НОН 2 С
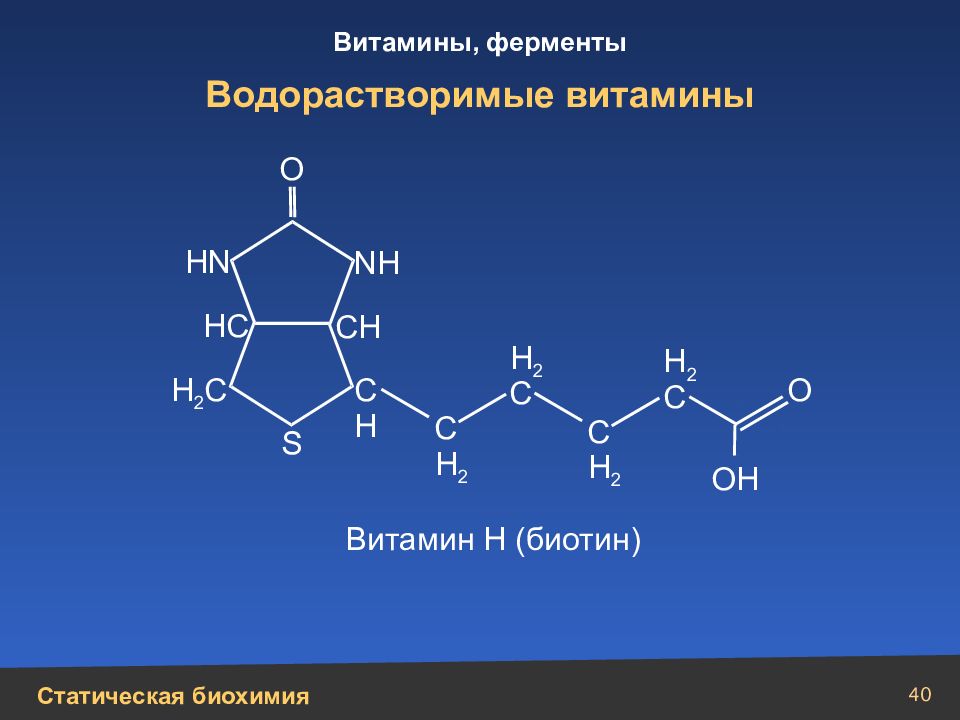
Слайд 40
40 Водорастворимые витамины Н 2 С Н N N Н НС СН С Н С Н 2 С Н 2 Н 2 C Н 2 C ОН S О О Витамин Н (биотин)
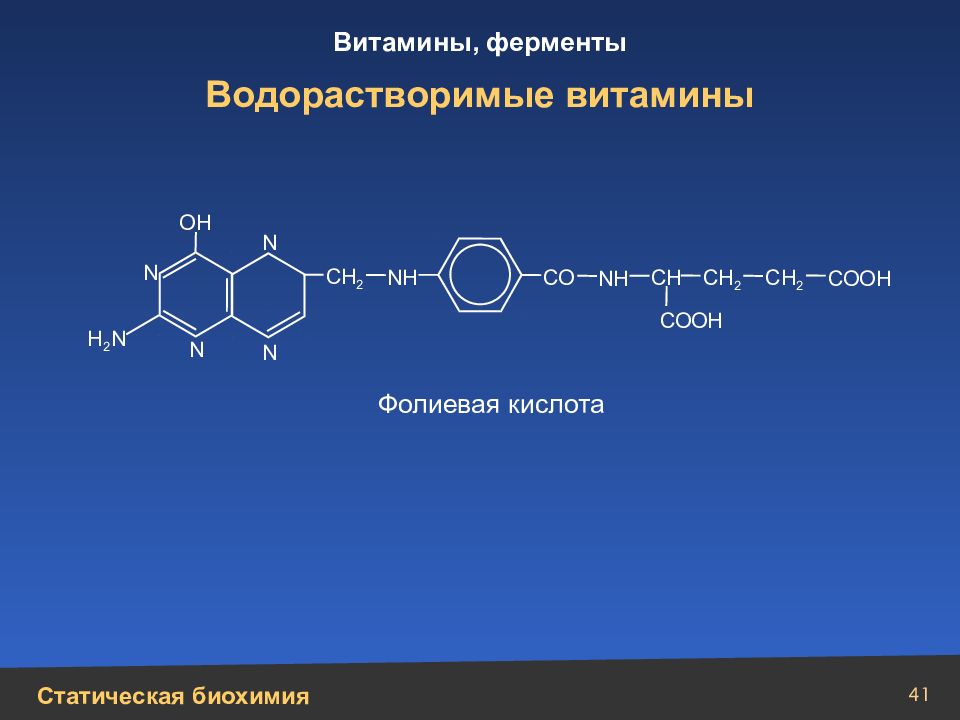
Слайд 41
41 Водорастворимые витамины N N N N СН 2 СН СН 2 СН 2 СО СООН СООН N Н N Н Н 2 N ОН Фолиевая кислота
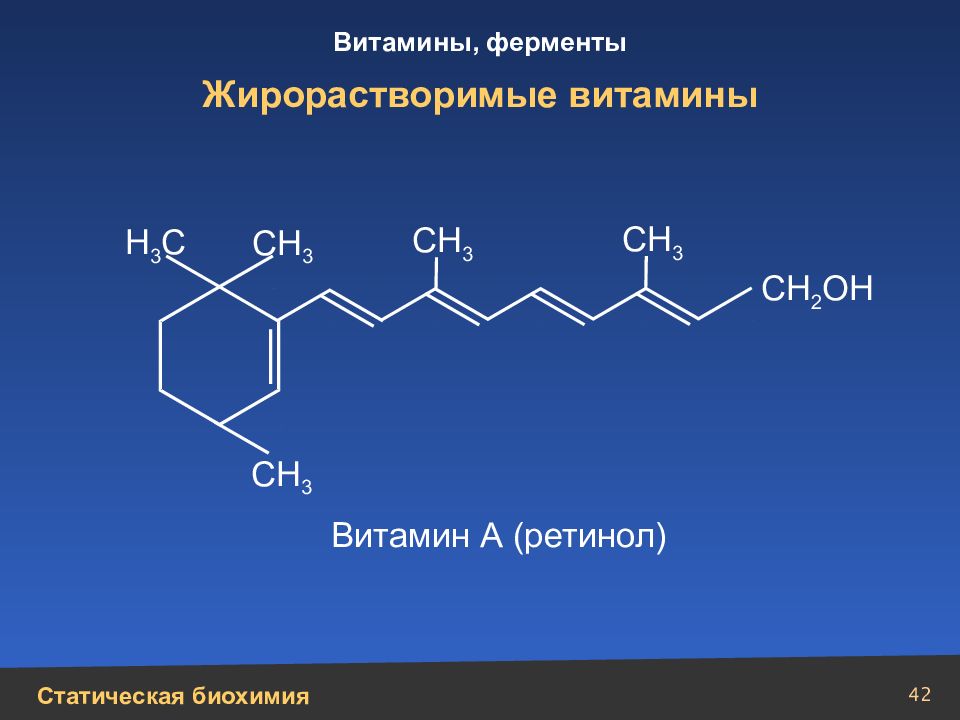
Слайд 42
42 Жирорастворимые витамины Н 3 С СН 3 СН 3 СН 3 СН 3 СН 2 ОН Витамин А (ретинол)
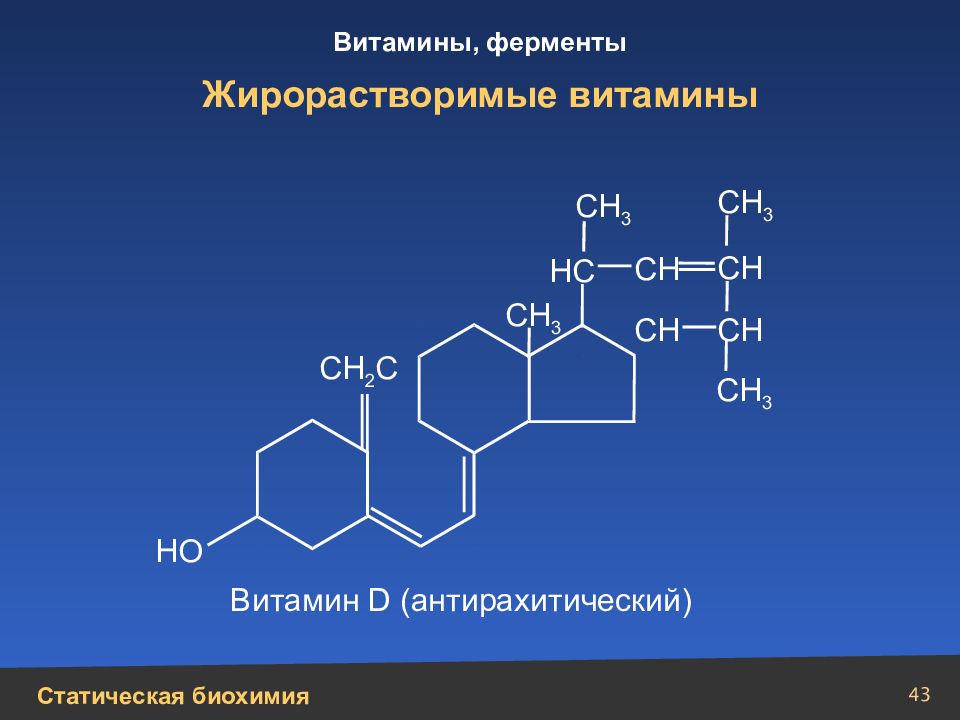
Слайд 43
43 Жирорастворимые витамины НС СН СН СН СН 3 СН 3 СН 3 СН 3 СН СН 2 С Витамин D (антирахитический) НО
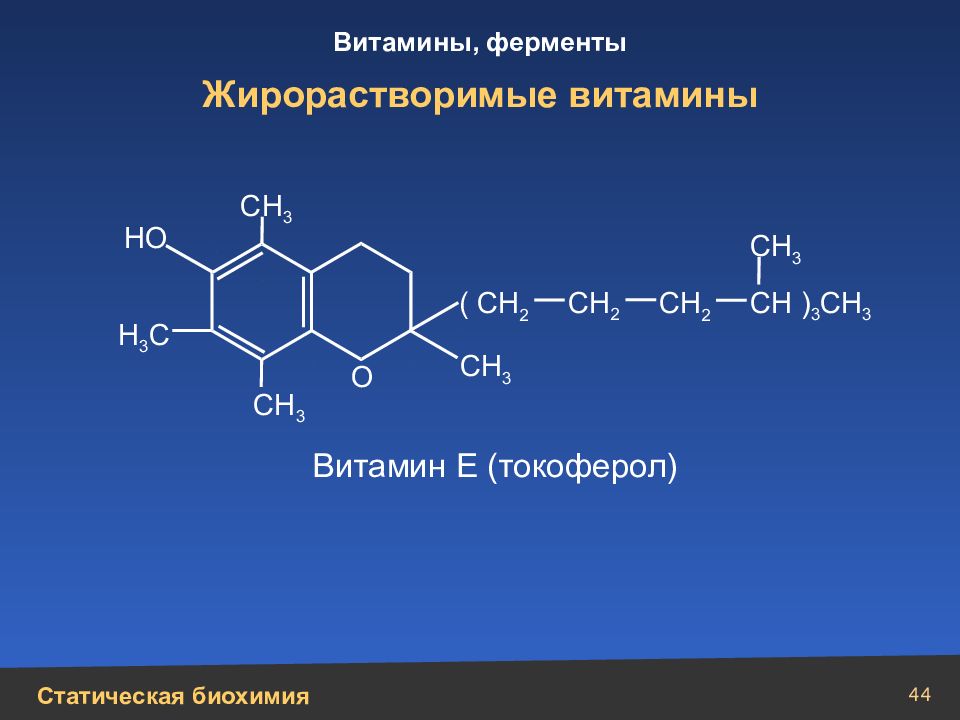
Слайд 44
44 Жирорастворимые витамины СН ) 3 СН 3 СН 3 СН 3 СН 3 СН 3 Н 3 С ( СН 2 СН 2 СН 2 Витамин Е (токоферол) НО О
Слайд 45
45 Ферменты Наиболее крупный специализированный класс белковых молекул, катализирующих химические реакции, из которых слагается клеточный обмен. Белки, увеличивающие скорости биохимических реакций в 1010 раз по сравнению со скоростями тех же реакций в отсутствие ферментов.
Слайд 46
46 Химическая кинетика В соответствии с законом действующих масс для реакции А + В С + Д скорость может выражаться уравнением v = К [ A ] · [ B ], где v – скорость реакции; К – константа скорости, отражающая влияние химической природы вещества и условий, в которых протекает реакция, на ее скорость; [ A ] и [ B ] – концентрация реагентов.
Слайд 47
47 Кинетика ферментативных реакций Вещества, реакцию превращения которых ускоряют ферменты ( E ), называются субстратами ( S ). В ходе ферментативной реакции образуется фермент-субстратный комплекс ( ES ). Фермент-субстратный комплекс становится нестабильным и затем преобразуется в комплекс «фермент – продукт», который распадается на фермент и продукты реакции ( P ): S + E ES E + P.
Слайд 48
48 Кинетика ферментативных реакций Действие ферментов как катализаторов обладает некоторыми особенностями: фермент не способен вызвать новую химическую реакцию, он ускоряет уже идущую; фермент не изменяет направление реакции, определяемое концентрациями реагентов, катализирует как прямую, так и обратную реакции.
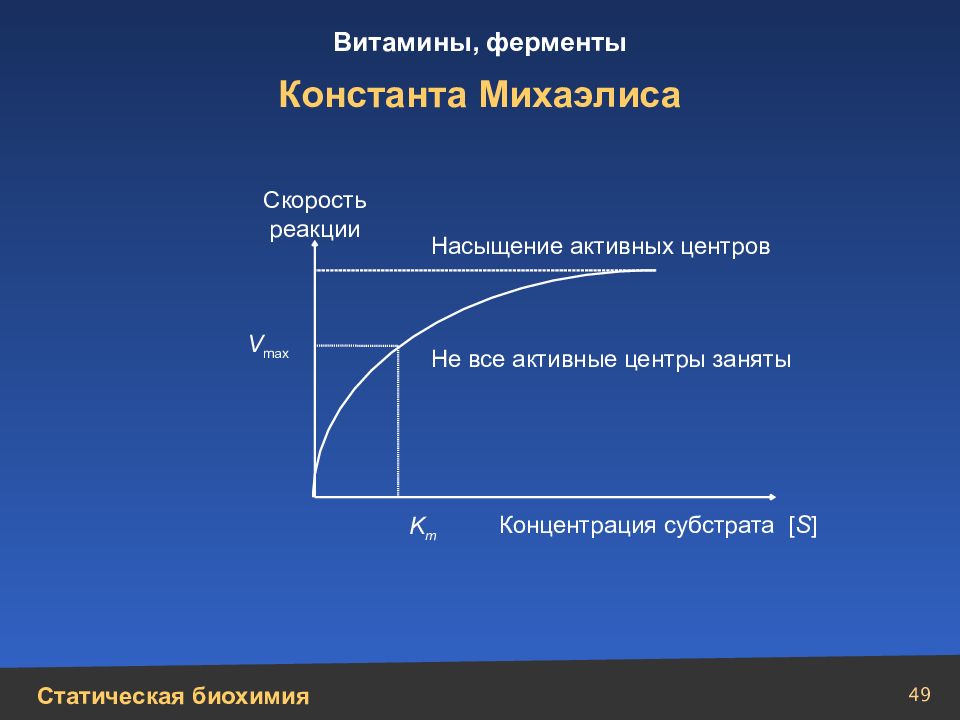
Слайд 49
49 Константа Михаэлиса K m V max Насыщение активных центров Скорость реакции Не все активные центры заняты Концентрация субстрата [ S ]
Слайд 50
50 Фермент увеличивает скорость реакции понижая свободную энергию переходного состояния путем стабилизации активированного комплекса; увеличивая энергию субстрата, когда тот связывается с ферментом при образовании фермент-субстратного комплекса; поддерживая микроокружение активного центра в состоянии, отличном от такового в водной среде; располагая реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга так, чтобы обеспечить оптимальное протекание реакции.
Слайд 51
51 Классификация активности ферментов Оксидоредуктазы (окислительно-восстановительные реакции) Оксидоредуктазы осуществляют перенос атомов Н и О или электронов от одного вещества к другому. Дегидрогеназы катализируют окислительно-восстановительные реакции, происходящие путем отнятия электронов и протонов от одного субстрата и переноса их на другой: АН + В А + ВН. Оксидазы катализируют перенос водорода с субстрата на кислород: А Н 2 +1/2 О 2 А + Н 2 О Гидроксилазы и оксигеназы ускоряют некоторые реакции биологического окисления, протекающие с присоединением гидроксила или кислорода к окисляемому веществу.
Слайд 52
52 Классификация активности ферментов Трансферазы (перенос функциональных групп) Ускоряют перенос определенной группы атомов от одного вещества к другому: АВ + С А + ВС Метилтрансферазы переносят метильную группу, Ацилтрансферазы – кислотный остаток (ацил), Гликозилтрансферазы – моносахаридный остаток (гликозил), Аминотрансферазы – аминную группу, Фосфотрансферазы – остаток фосфорной кислоты (фосфорил).
Слайд 53
53 Классификация активности ферментов Гидролазы (реакции гидролиза) Ускоряют реакции гидролиза, при которых из субстрата образуются 2 продукта. К гидролазам относятся все пищеварительные ферменты: АВ + Н 2 О А ОН + В Н Эстеразы ускоряют гидролиз сложных эфиров (различных липидов) на спирты и кислоты. Фосфатазы катализируют гидролитическое отщепление фосфорной кислоты от нуклеотидов и фосфорных эфиров углеводов. Глюкозидазы ускоряют гидролиз сложных углеводов. Пептидгидролазы ускоряют гидролиз пептидных связей в белках и пептидах.
Слайд 54
54 Классификация активности ферментов Лиазы Лиазы ускоряют негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи: С–С, С–N, C–O, C–S.
Слайд 55
55 Классификация активности ферментов Изомеразы (реакции изомеризации) Внутримолекулярные перестройки: АВ ВА
Слайд 56
56 Классификация активности ферментов Лигазы (образование связей за счет АТФ) Лигазы катализируют реакции синтеза высокомолекулярных полимеров из мономеров за счет энергии гидролиза АТФ: X + Y + АТФ XY + AДФ + Фн
Слайд 58
58 Гормоны Гормоны – это биологически активные вещества, синтезируемые эндокринными железами, выделяемые ими в кровь или лимфу и регулирующие внутриклеточный метаболизм. Гормональная регуляция биологических процессов есть высшая форма гуморальной регуляции. Гормоны обладают специфичностью и воздействуют только на те клетки-мишени, которые обладают специальными рецепторами белковой или липопротеиновой природы, реагирующими с данным гормоном.
Слайд 59
59 Механизм действия гормонов Гормоны регулируют метаболизм клеток-мишеней через изменение активности ферментных систем: путем изменения индукции ферментов; путем изменения проницаемости плазматических мембран; путем изменения количества ц-АМФ.
Слайд 60
60 Гормоны гипоталамуса Гормоны гипоталамуса являются относительно простыми по структуре олигопептидами. К ним относятся: кортиколиберин, тиролиберин, люлилиберин, фоллиберин, соматолиберин, соматостатин, пролакстатин, пролактолиберин, меланолиберин, меланостатин.
Слайд 61
61 Гормоны гипофиза Гипофиз синтезирует тропные и эффекторые гормоны Тропные гормоны: АКТГ (адренокортикотропный гормон) – пептид, регулирующий биосинтез и секрецию гормонов коры надпочечников; ТТГ (тиреотропный гормон) – гликопротеид, регулирующий биосинтез и секрецию гормонов щитовидной железы; ФСГ (фолликулостимулирующий гормон), ЛГ (лютеинизирующий гормон) – гликопротеиды, регулирующие биосинтез и секрецию гормонов половых желез.
Слайд 62
62 Гормоны гипофиза Гипофиз синтезирует тропные и эффекторые гормоны Эффекторные гормоны АДГ (антидиуретический гормон, вазопрессин) – простой пептид, регулирующий водный обмен, уменьшает мочеотделение. Окситоцин – простой пептид, вызывающий сокращение матки во время родов и активное выделение молока молочными железами. Меланостимулирующий гормон – простой пептид, регулирующий сезонное окрашивание кожи, шерсти. Пролактин – простой белок, регулирующий выделение молока молочными железами при кормлении. Гормон роста (соматотропный ) – простой белок, регулирующий рост тела в длину, усиливает процессы анаболизма.
Слайд 63
63 Гормоны поджелудочной железы Гормоны поджелудочной железы инсулин ( белок из 51 аминокислотного остатка) и глюкагон ( одноцепочечный полипептид из 29 аминокислотных остатков ) не находятся под контролем гормонов гипофиза. Секреция гормонов регулируется содержанием глюкозы в крови.
Слайд 64
64 Гормоны щитовидной железы Тиреоидные гормоны Тироксин и трийодтиронин являются производными аминокислотами тирозина и содержат в своем составе 4 и 3 атома йода соответственно. Тиреоидные гормоны регулируют активность ферментных систем обмена углеводов и липоидов, синтеза белка, интенсивность транспорта субстратов и кофакторов, биоэнергетические процессы.
Слайд 65
65 Гормоны коры надпочечников Секреция гормонов коры надпочечников регулируется адренокортикотропным гормоном (АКТГ) гипофиза. Из коры надпочечников выделено 46 соединений стероидной природы, производных циклопентапергидрофенантрена. Они подразделяются на 3 функциональные группы – глюкокортикоиды, минералокортикоиды и половые гормоны.
Слайд 66
66 Гормоны мозгового вещества надпочечников Гормоны мозгового вещества надпочечников – адреналин и норадреналин (катехоламины).
Слайд 67
67 Гормоны половых желез Мужские половые гормоны ( андрогены ) образуются в семенниках, женские половые гормоны ( эстрогены, прогестины ) продуцируются преимущественно в яичниках. Половые гормоны являются производными циклопентапергидрофенантрена.
Слайд 68
68 Гормоны паращитовидной железы Паращитовидные железы секретируют 2 гормона ( паратгормон и кальцитонин ), которые вместе с витамином Д обеспечивают регуляцию кальциевого обмена.
Слайд 69
69 Гормоны тимуса (вилочковой железы) В тимусе продуцируется 5 гормонально-активных факторов (полипептидов по природе): тимозин, гомеостатический тимусный гормон, тимопоэтины 1 и 11, тимусный гуморальный фактор. Основная функция гормонов вилочковой железы – регуляция созревания определенных популяций лимфоидных клеток, то есть участие в регуляции функционирования иммунной системы.
Слайд 71
71 Оглавление 2.1. Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата 2.2. Аэробный метаболизм углеводов 2.3. Липидный обмен 2.4. Белковый обмен 2.5. Интеграция клеточного обмена
72 2. 1. Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата
Слайд 73
73 В обмене веществ выделяют внешний обмен и промежуточный. Внешний обмен – внеклеточное переваривание веществ на путях их поступления и выделения из организма. Промежуточный обмен – совокупность всех ферментативных реакций в клетке. Метаболические пути и обмен энергии
Слайд 74
74 Метаболизм выполняет 4 основные функции: извлечение энергии из окружающей среды (либо в форме химической энергии органических веществ, либо в форме энергии солнечного света); превращение экзогенных веществ в строительные блоки – в предшественников макромолекулярных компонентов клетки; сборку белков, нуклеиновых кислот, жиров и др. клеточных компонентов из этих строительных блоков; синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки. Метаболические пути и обмен энергии
Слайд 75
75 Метаболические пути: катаболические; анаболические; амфиболические. Метаболические пути и обмен энергии
Слайд 76
76 Катаболизм включает 3 основных этапа: крупные пищевые молекулы расщепляются на составляющие их строительные блоки (аминокислоты, моносахариды, жирные кислоты и др.); продукты, образовавшиеся на 1-й стадии, превращаются в более простые молекулы, число которых невелико – ацетил-КоА и др.; эти продукты окисляются до СО 2 и воды. Метаболические пути и обмен энергии
Слайд 77
77 Анаболические пути – это ферментативный синтез сравнительно крупных клеточных компонентов из простых предшественников. Процессы связаны с потреблением свободной энергии, которая поставляется в форме энергии фосфатных связей АТФ. Анаболизм включает в себя также 3 стадии, в результате чего образуются биополимеры. Метаболические пути и обмен энергии
Слайд 78
78 Амфиболические пути – двойственные. Связывают катаболические и анаболические пути. Метаболические пути и обмен энергии
Слайд 79
79 Полисахариды и олигосахариды распадаются до более простых соединений путем гидролиза. Расщепление крахмала и гликогена начинается в полости рта под действием амилазы слюны, относящейся к классу гидролаз, подклассу гидролаз гликозидов. Известны 3 вида амилаз, различающиеся по конечным продуктам: -амилаза, -амилаза и -амилаза. Переваривание углеводов
Слайд 80
80 Продукты полного переваривания углеводов – глюкоза, галактоза, фруктоза – через стенки кишечника поступают в кровь. Моносахариды поступают через клеточные мембраны путем облегченной диффузии, с участием специальных переносчиков. Для переноса глюкозы и галактозы существует активный транспорт по механизму симпорта. Всасывание моносахаридов
Слайд 81
81 Гликолиз – центральный путь катаболизма глюкозы в животных, растительных клетках и микроорганизмах. Это наиболее древний путь, в результате которого глюкоза подвергается анаэробному расщеплению. Может протекать в клетке в аэробных и анаэробных условиях. Гликолиз
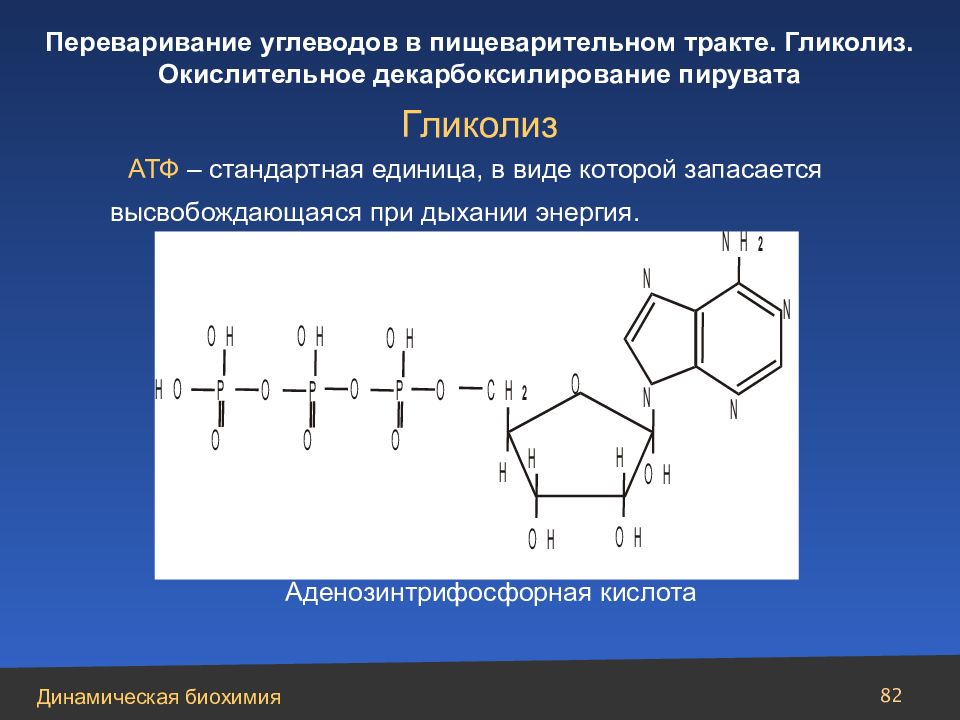
Слайд 82
82 АТФ – стандартная единица, в виде которой запасается высвобождающаяся при дыхании энергия. Гликолиз Аденозинтрифосфорная кислота
Слайд 83
83 (АТФ) Аденозин – Ф ~ Ф ~ Ф “Высокоэнергетическая” связь +Н 2 О Гидролиз (АДФ) Аденозин – Ф ~ Ф + Ф + 30,6 кДж/моль Работа Гликолиз
Слайд 84
84 Аэробные условия Анаэробные условия Гликолиз Глюкоза Продукты брожения Брожение Глюкоза Продукты брожения Брожение СО 2 + Н 2 О Дыхание О 2 2 Лактат Глюкоза Брожение и дыхание
Слайд 85
85 С 6 Н 12 О 6 + 2Фн + 2АДФ → 2СН 3 СНОНСООН + 2АТФ + 2Н 2 О Глюкоза → 2 Лактат G 1` = – 47,0 ккал 2Фн + 2АДФ → 2АТФ + 2Н 2 О G 2` = +2∙7,30 = +14,6 ккал Суммарная реакция: Глюкоза + 2Фн + 2АДФ → 2Лактат + 2АТФ + 2Н 2 О G s ` = G 1` + G 2` = – 47,0 + 14,6 = – 32,4 ккал Гликолиз
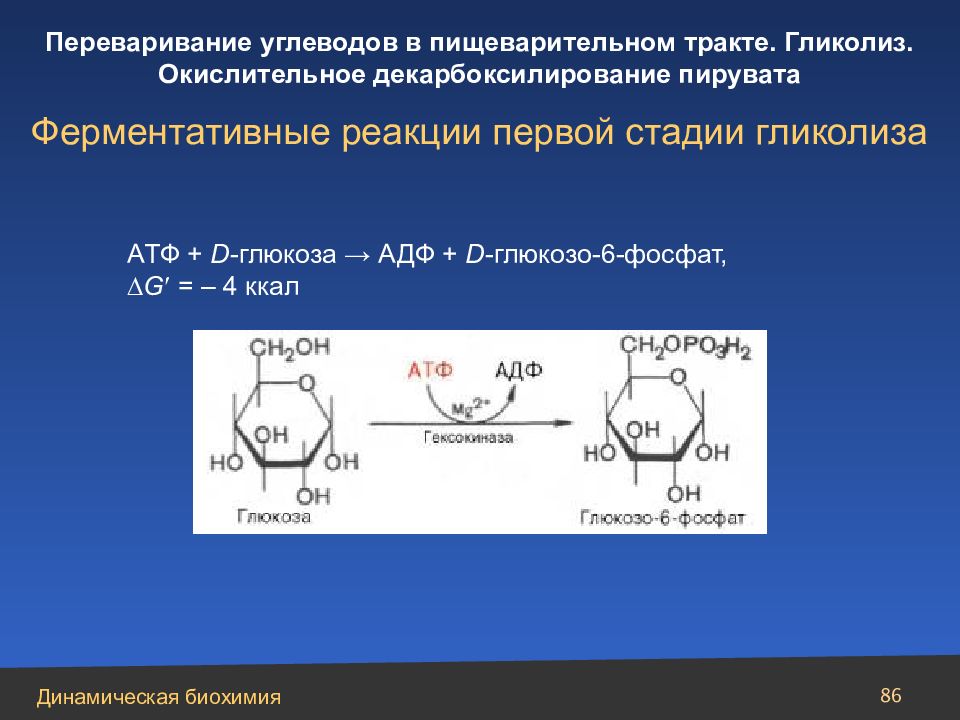
Слайд 86
86 A ТФ + D -глюкоза → АДФ + D -глюкозо-6-фосфат, G = – 4 ккал Ферментативные реакции первой стадии гликолиза
Слайд 88
88 Превращение глюкозо-6-фосфат во фруктозо-6-фосфат D -глюкозо-6-фосфат ↔ D -фруктозо-6-фосфат, G = + 0,4 ккал
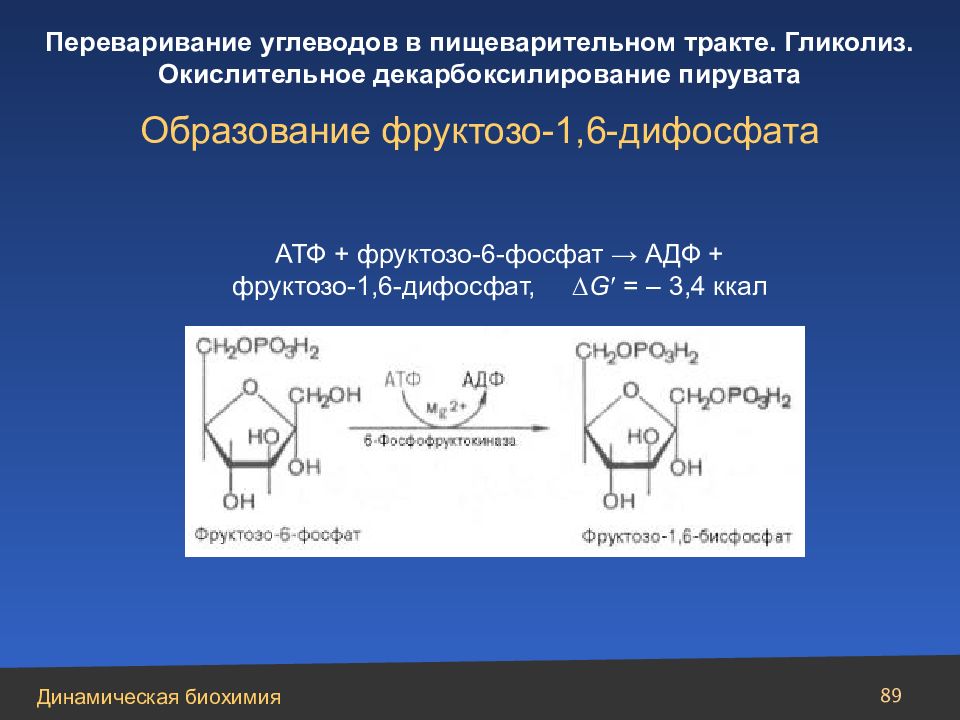
Слайд 89
89 АТФ + фруктозо-6-фосфат → АДФ + фруктозо-1,6-дифосфат, G = – 3,4 ккал Образование фруктозо-1,6-дифосфата
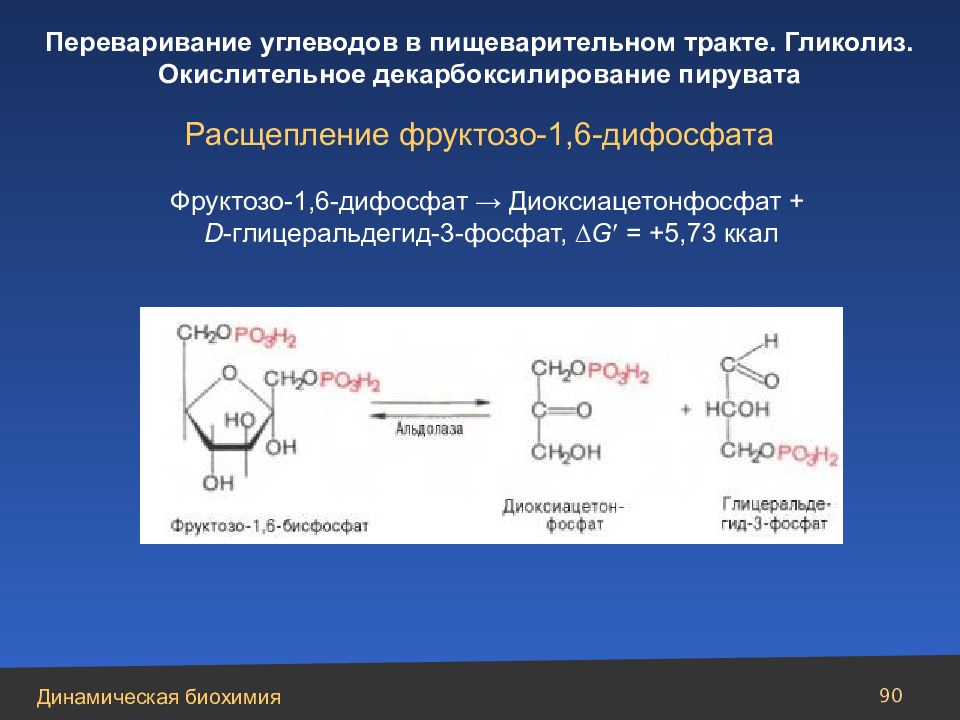
Слайд 90
90 Расщепление фруктозо-1,6-дифосфата Фруктозо-1,6-дифосфат → Диоксиацетонфосфат + D -глицеральдегид-3-фосфат, G = +5,73 ккал
Слайд 91
91 Взаимопревращение триозофосфатов Диоксиацетонфосфат ↔ D -глицеральдегид-3-фосфат
Слайд 92
92 Окисление глицеральдегид-3-фосфата до 1,3-дифосфоглицерата Глицеральдегид-3-фосфат+ НАД++ Фн → 1,3-дифосфоглицерат + НАД * Н + Н+, G = +1,5 ккал
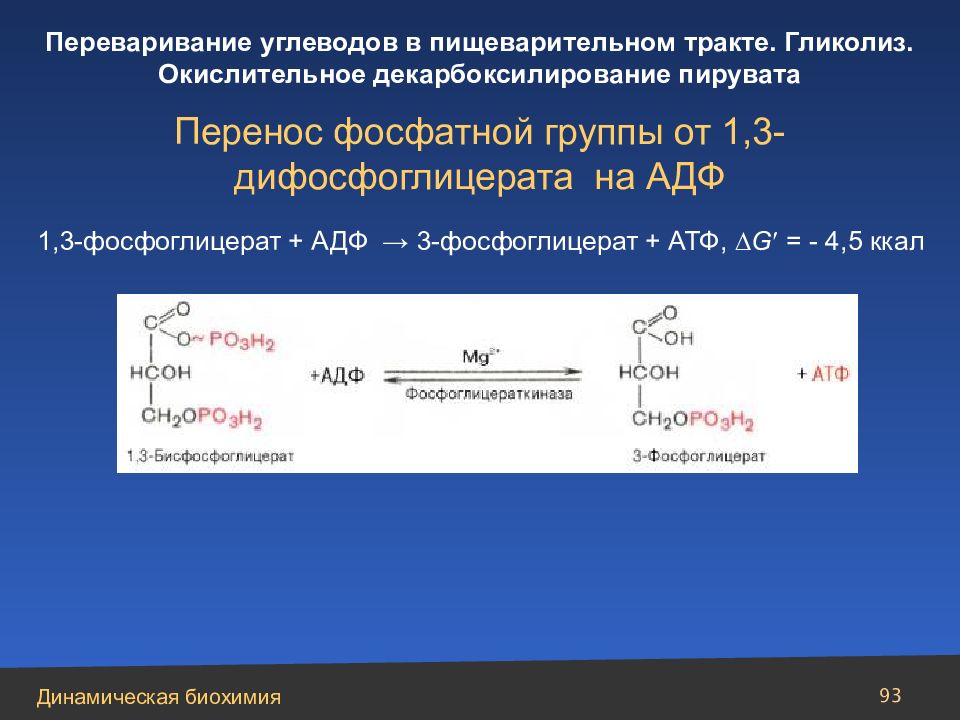
Слайд 93
93 Перенос фосфатной группы от 1,3-дифосфоглицерата на АДФ 1,3-фосфоглицерат + АДФ → 3-фосфоглицерат + АТФ, G = - 4,5 ккал
Слайд 94
94 Превращение 3-фосфоглицерата в 2-фосфоглицерат 3-фосфоглицерат ↔ 2-фосфоглицерат
Слайд 95
95 2-фосфоглицерат → Фосфоенолпируват + Н 2 О, G = + 0,44 ккал Дегидратация 2-фосфоглицерата с образованием фосфоенолпирувата
Слайд 96
96 Фосфоенолпируват + АДФ → Пируват + АТФ, G = - 7,5 ккал Перенос фосфатной группы от фосфоенолпирувата на АДФ
Слайд 97
97 Пируват + НАД*Н + Н ↔ Лактат + НАД +, G = - 6,0 ккал Восстановление пирувата до лактата
Слайд 98
98 Глюкоза + 2АТФ + 2НАД + + 2Фн + 4АДФ + 2НАДН +2Н+ +2Лактат + 2АДФ + 2НАДH + 2H + + 2НАД + + 4АТФ + 2Н 2 О Вычеркнув одни и те же члены получим: Глюкоза + 2Фн + 2АДФ → 2Лактат + 2АТФ + 2Н 2 О Полный баланс гликолиза
Слайд 99
99 Гликоген → глюкозо-1-фосфат → глюкозо-6-фосфат → … → 2лактат Гликогенолиз
Слайд 101
Глюкоза 2Лактат, G = – 47 ккал (гликолиз) Глюкоза + 6О 2 6СО 2 + 6Н 2 О, G = – 686 ккал (дыхание) Энергетика брожения и дыхания
Слайд 102
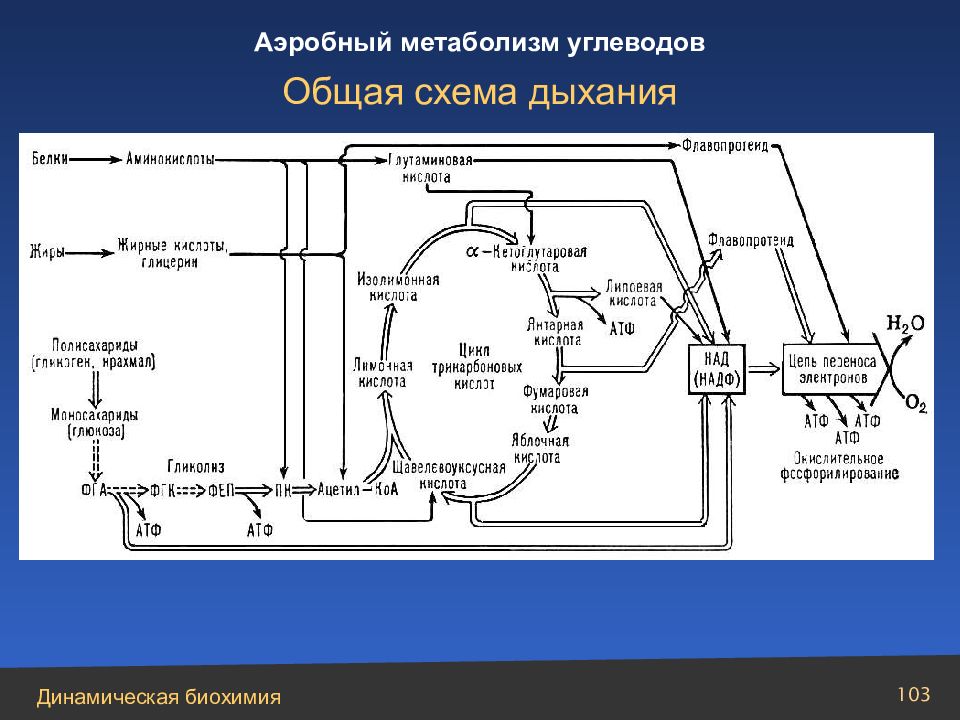
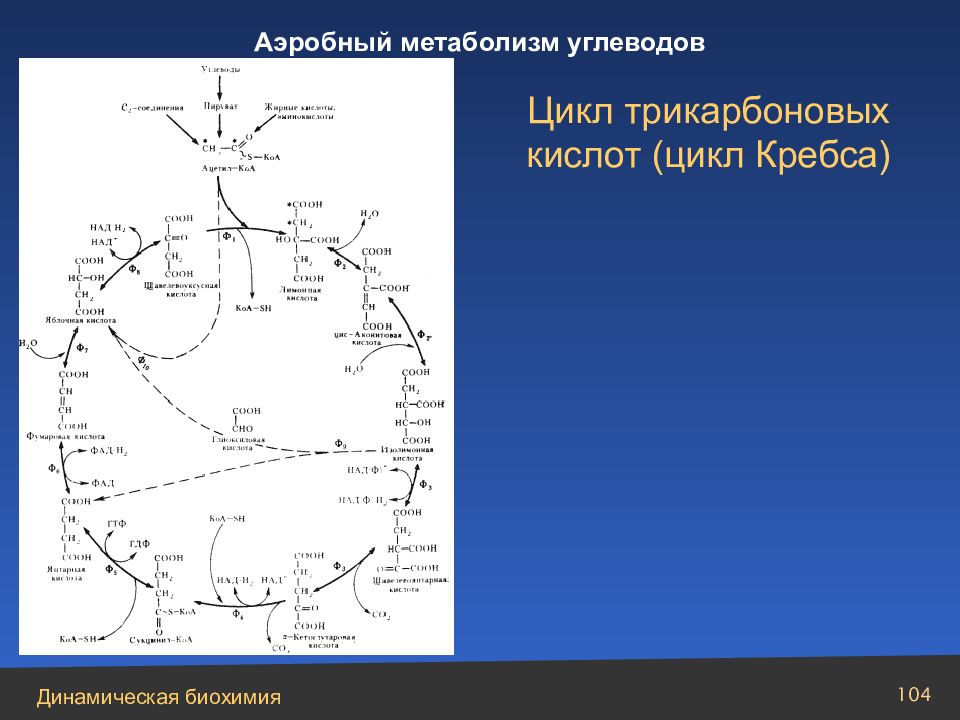
Суммарная реакция цикла трикарбоновых кислот описывается уравнением: Ацетил-СоА + 3НАД+ + ФАД + ГДФ + Фн + Н 2 О 2СО 2 + +3НАДН + ФАДН 2 + ГТФ + 2Н+ + СоА Общая схема дыхания
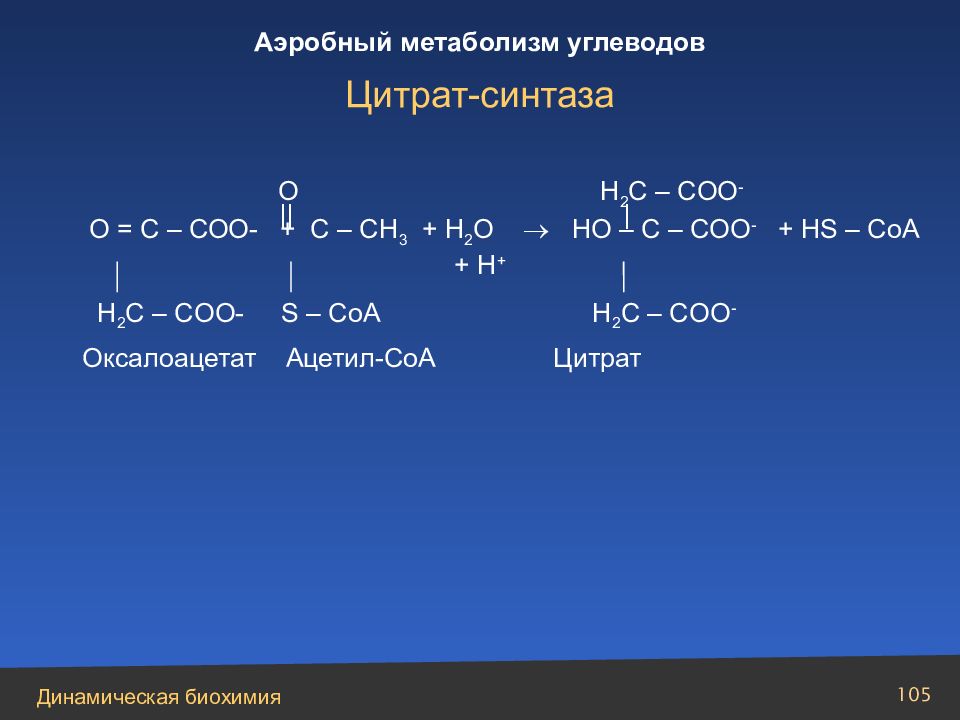
Слайд 105
О = С – СОО- + С – СН 3 + Н 2 О НО – С – СОО - + HS – CoA + H + O H 2 C – COO - || | H 2 C – COO- S – CoA H 2 C – COO - Оксалоацетат Ацетил-СоА Цитрат Цитрат-синтаза
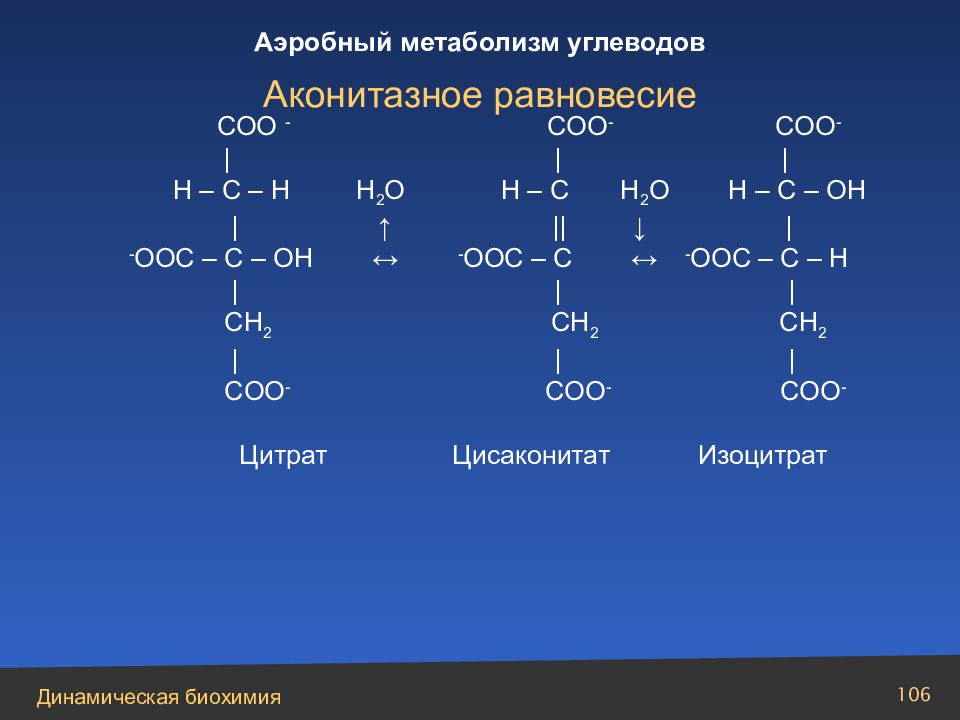
Слайд 106
СОО - COO - COO - | | | H – C – H H 2 O H – C H 2 O H – C – OH | ↑ || ↓ | - OOC – C – OH ↔ - OOC – C ↔ - OOC – C – H | | | CH 2 CH 2 CH 2 | | | COO - COO - COO - Цитрат Цисаконитат Изоцитрат Аконитазное равновесие
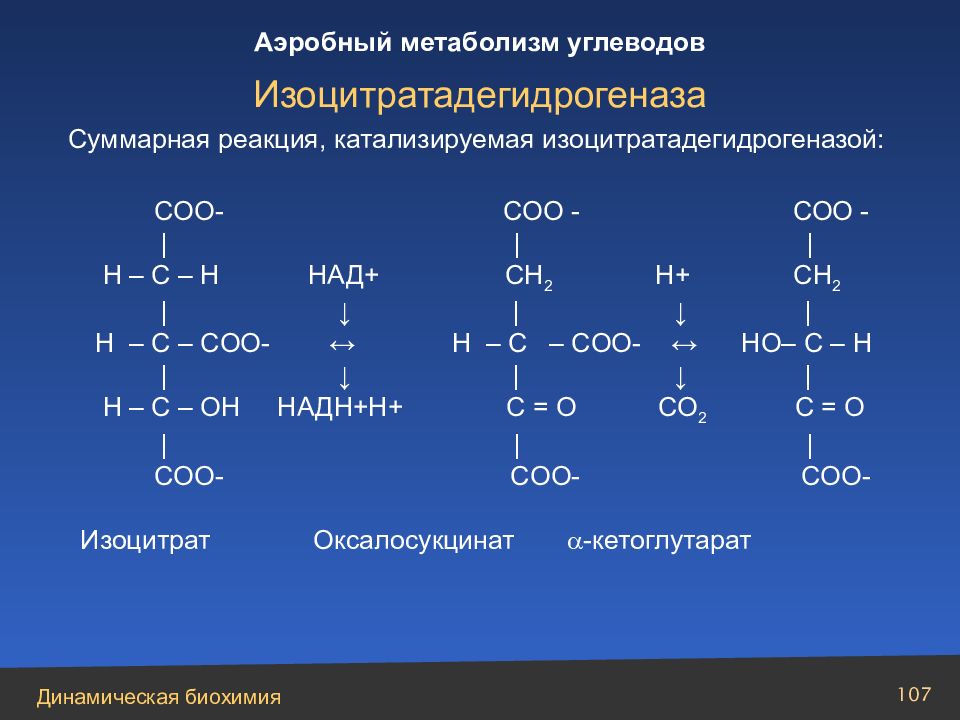
Слайд 107
Суммарная реакция, катализируемая изоцитратадегидрогеназой: COO - СОО - СОО - | | | H – C – H НАД+ CH 2 Н+ CH 2 | ↓ | ↓ | H – C – COO - ↔ Н – C – COO - ↔ НО– C – H | ↓ | ↓ | H – C – О H НАДН+Н+ C = О СО 2 C = О | | | COO - COO - COO - Изоцитрат Оксалосукцинат - кетоглутарат Изоцитратадегидрогеназа
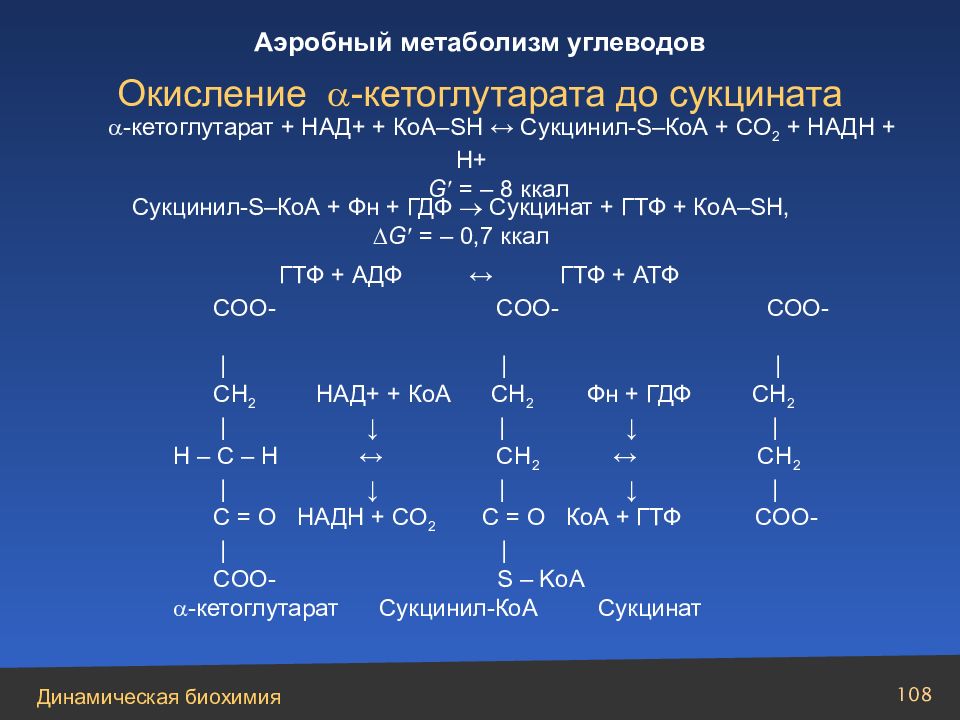
Слайд 108
-кетоглутарат + НАД + + КоА–SH ↔ Cукцинил-S–КоА + СО 2 + НАДН + Н+ G = – 8 ккал Сукцинил-S–КоА + Фн + ГДФ Сукцинат + ГТФ + КоА–SH, G = – 0,7 ккал ГТФ + АДФ ↔ ГТФ + АТФ СОО- COO - COO - | | | CH 2 НАД+ + КоА CH 2 Фн + ГДФ CH 2 | ↓ | ↓ | H – C – H ↔ CH 2 ↔ CH 2 | ↓ | ↓ | C = O НАДН + СО 2 C = O КоА + ГТФ COO - | | COO - S – KoA - кетоглутарат C укцинил-КоА Сукцинат Окисление -кетоглутарата до сукцината
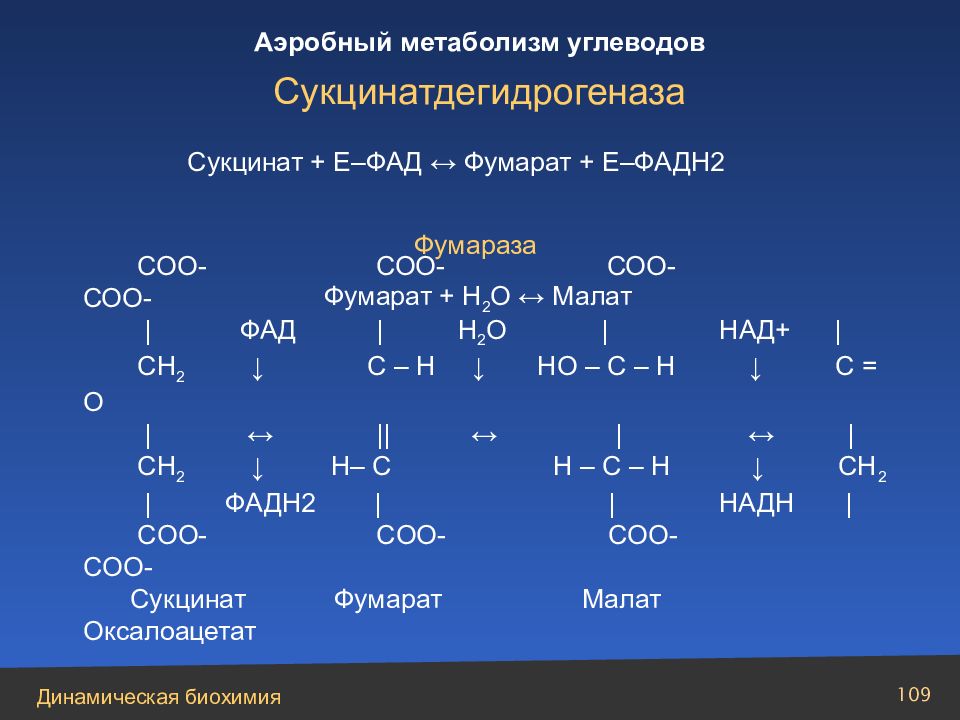
Слайд 109
Сукцинат + Е–ФАД ↔ Фумарат + Е–ФАДН2 Фумараза Фумарат + Н 2 О ↔ Малат СОО- СОО- СОО- СОО- | ФАД | Н 2 О | НАД+ | CH 2 ↓ C – H ↓ HO – C – H ↓ C = O | ↔ || ↔ | ↔ | CH 2 ↓ Н– C H – C – H ↓ CH 2 | ФАДН2 | | НАДН | COO - COO - COO - COO - C укцинат Фумарат Малат Оксалоацетат Сукцинатдегидрогеназа
Слайд 110
Малат + НАД+ ↔ Оксалоацетат + НАДН + Н+ Окисление малата до оксалоацетата
Слайд 111
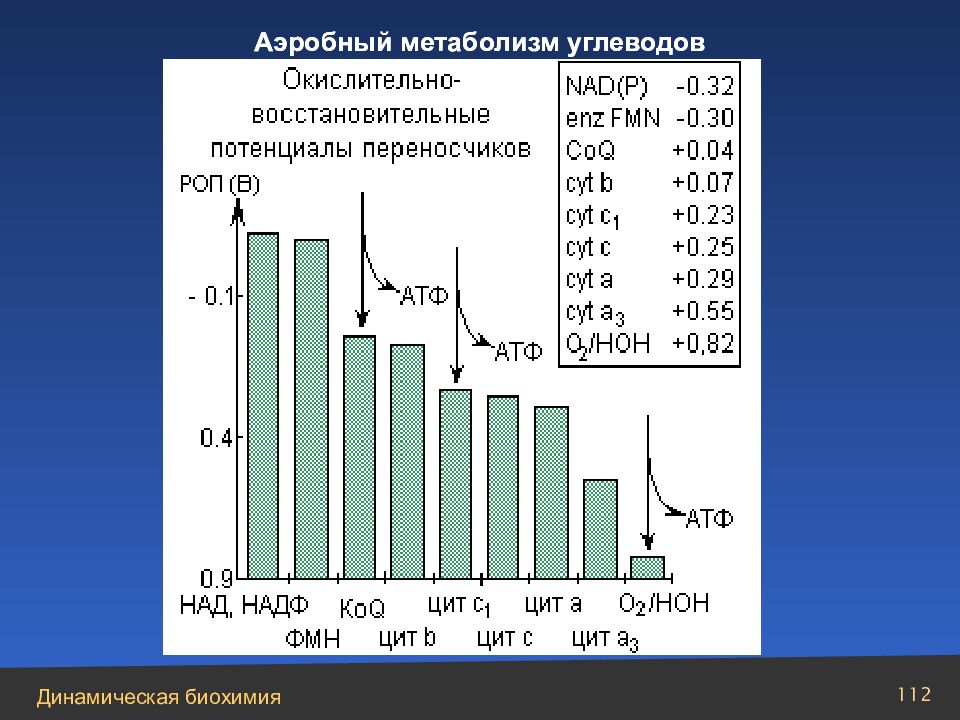
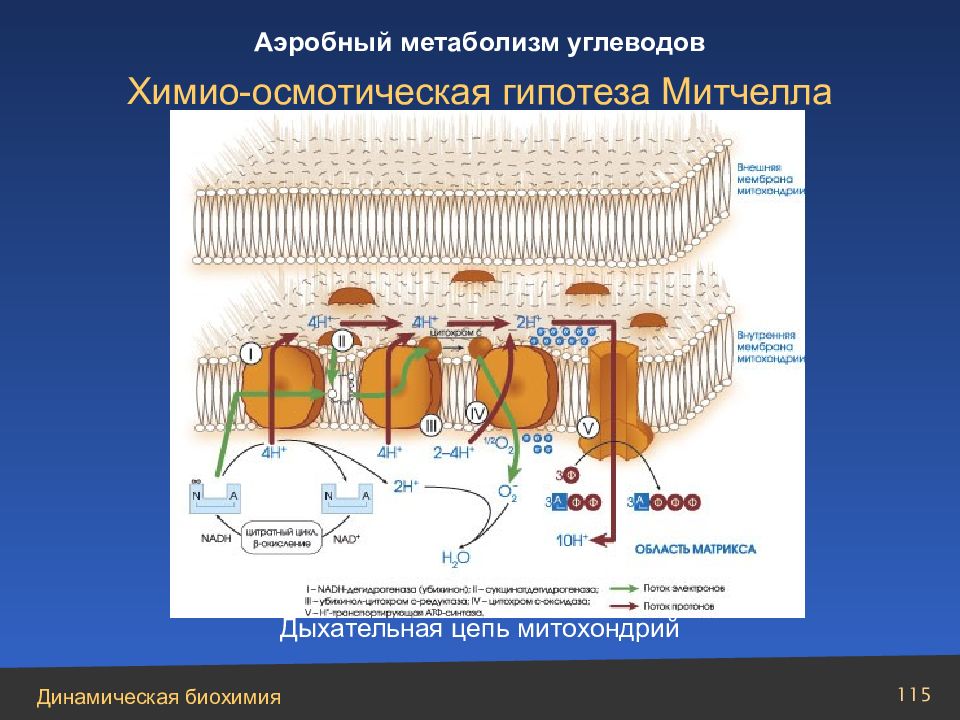
НАДН + Н+ + Е1 – ФАД → НАД+ + Е1 – ФАДН2 Е1 – ФАДН2 + 2Е2 – Fe (111) → E 1– ФАД + 2Е2 – Fe (11) + 2 H + 2E2 – Fe(11) + 2H+ + KoQ → 2E2 – Fe(111) + KoQH2 KoQ H2 + 2 Цит.b(111) → KoQ + 2H+ + 2 Цит.b(111) 2 Цит.b(11) + 2 Цит. с (111) → 2 Цит.b(111) + 2 Цит. с (11) 2Цит.с(11) + 2 Цит. а (111) → 2Цит.с(111) + 2Цит.а(11) 2Цит.а(11) + 2Цит.а3(111) → 2Цит.а(111) + 2Цит.а3(11) 2Цит.а3(11) +1/2О 2 + 2Н+ → 2Цит.а3(111) + Н 2 О Путь переноса электронов – дыхательная цепь
Слайд 113
Суммарное уравнение процесса фосфорилирования в дыхательной цепи: НАДН + 2Н+ + 3АДФ + Фн + 1/2О 2 → НАД+ + 4Н 2 О + 3АТФ Экзергонический компонент : НАДН + 2Н+ + 1/2 О 2 → НАД+ + Н 2 О, G = – 52,7 ккал Эндергонический компонент : 3АДФ + 3Фн → 3АТФ +3Н 2 О, G = + 21,9 ккал Аэробный метаболизм углеводов
Слайд 114
Суммарные реакции аэробного дыхания: С 6 Н 12 О 6 + 2Фн + 2АДФ + 2НАД+ → 2Пируват+2НАДН+2Н+ +2АТФ+2Н 2 О 2Пируват + 2НАД+ → 2Ацетил– S –КоА + 2НАДН + 2Н+ + 2СО 2 2Ацетил– S –КоА + 6НАД+ + ФП + 2АДФ + 2Фн → СО 2 + 6НАДН 6Н+ + ФПН2 + 2АТФ Суммируя три уравнения пролучим: Глюкоза+Фн+4АДФ+НАД++ФП → 6СО 2 +10НАДН+10Н+ +4АТФ+ФПН2+2Н 2 О 10 НАДН + 10 Н+ + 32 Фн + 32 АДФ + 6 О 2 + 3 ФПН2 → 32 АТФ + 40 Н 2 О Экзергонический компонент : Глюкоза + 6О 2 → 6СО 2 + 6Н 2 О, G = – 680 ккал Эндергонический компонент : 34Фн + 36АДФ → 36АТФ + 42Н 2 О, G = + 263 ккал Таким образом, общая эффективность накопления энергии составляет: 263/680 · 100 = 39 % Баланс энергии
Слайд 117
117 Превращение липидов в процессе пищеварения. Всасывание продуктов переваривания липидов и ресинтез липидов в кишечной стенке. Внутриклеточные процессы расщепления и синтеза липидов различных классов. Обмен триглицеридов и холестерина в тканях. Интеграция и регуляция метаболизма липидов. Нарушение обмена липидов при ожирении. Липидный обмен
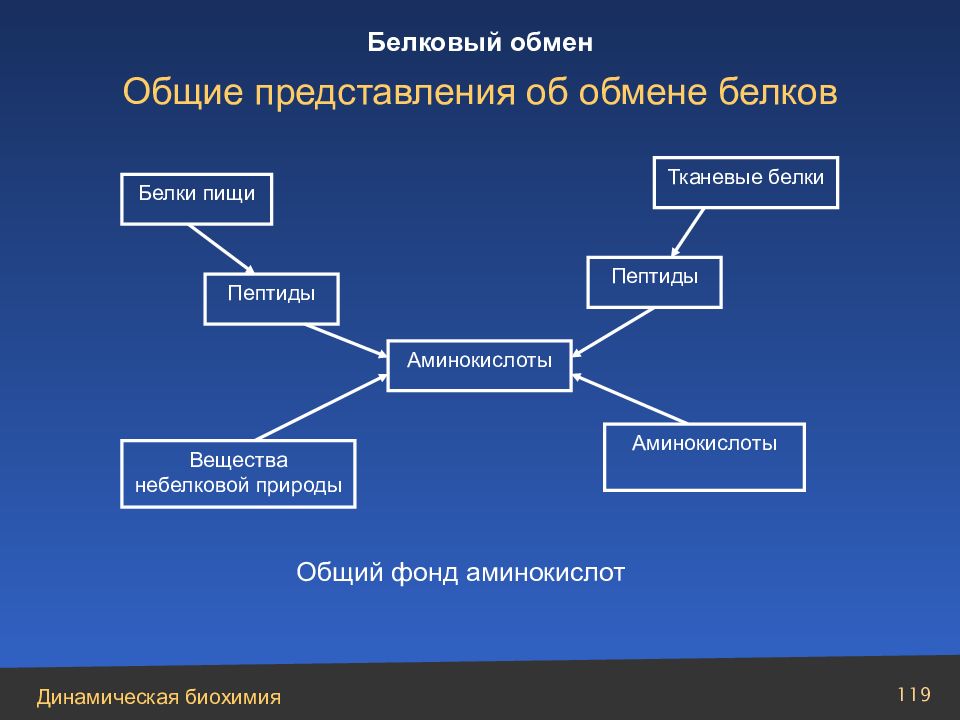
Слайд 119
119 Аминокислоты Белки пищи Пептиды Вещества небелковой природы Тканевые белки Пептиды Аминокислоты Общий фонд аминокислот Общие представления об обмене белков Белковый обмен
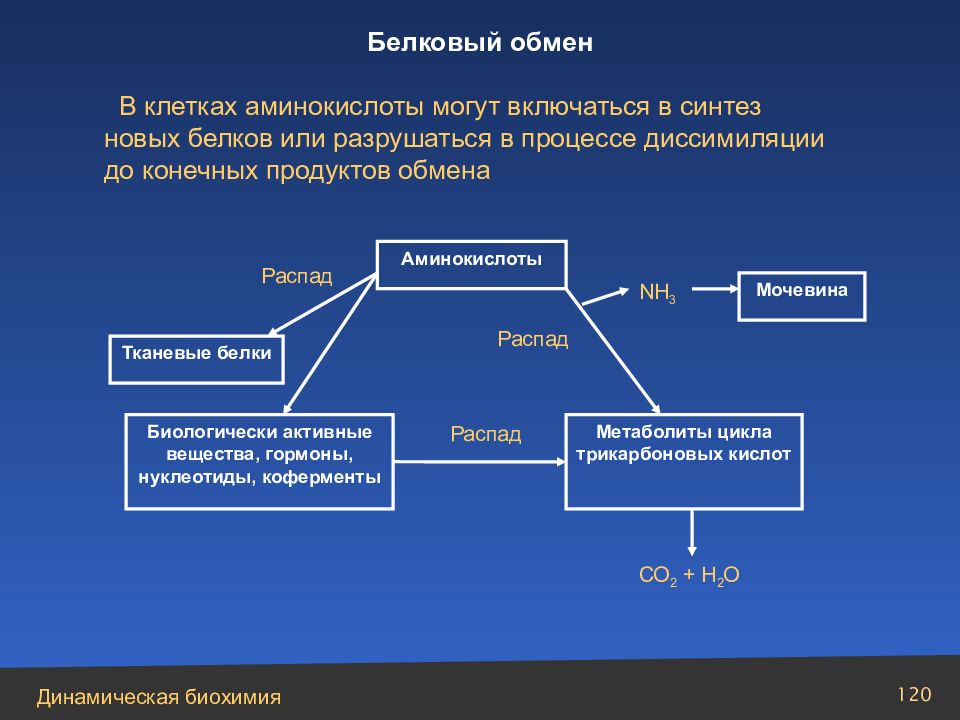
Слайд 120
120 Аминокислоты Тканевые белки Биологически активные вещества, гормоны, нуклеотиды, коферменты Распад Метаболиты цикла трикарбоновых кислот Распад СО 2 + Н 2 О Мочевина NH 3 Распад В клетках аминокислоты могут включаться в синтез новых белков или разрушаться в процессе диссимиляции до конечных продуктов обмена Белковый обмен
Слайд 121
121 Пищеварение белков. Синтез белков. Внутриклеточный распад белков. Пути выведения аммиака из организма. Суммарное уравнение цикла имеет вид: 2 NH 3 + CO 2 + 3 AT Ф → NH 2 - C О- NH 2 + 2 A ДФ + 2 H 3 PO 4 + АМФ + H 4 P 2 O 7 Белковый обмен
Слайд 123
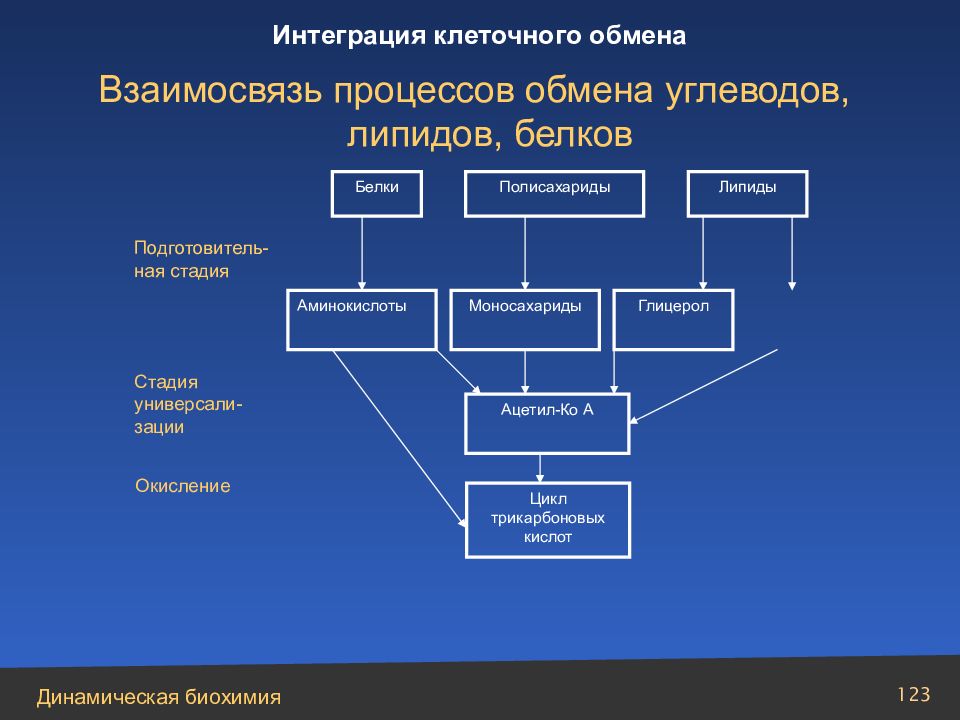
123 Белки Полисахариды Липиды Подготовитель-ная стадия Аминокислоты Моносахариды Глицерол Ацетил-Ко А Цикл трикарбоновых кислот Стадия универсали-зации Окисление Взаимосвязь процессов обмена углеводов, липидов, белков Интеграция клеточного обмена
Слайд 124
124 В клетке скорость химических реакций определяется: доступностью субстратов (концентрация реагирующих веществ); 2) активностью ферментов (конкурентное и неконкурентное торможение, аллостерическая регуляция); 3) количеством ферментов; 4) доступностью кофакторов (АТФ, ФДФ, НАД+, НАДФ+ и др.). Нервная и гормональная регуляция обмена веществ Внутриклеточная регуляция обмена веществ Интеграция клеточного обмена
Слайд 126
126 3.1. Биохимия мышечного сокращения 3.2. Энергетическое обеспечение мышечной деятельности 3.3. Биохимические изменения в организме при работе различного характера. Биохимические изменения при утомлении 3.4. Биохимические превращения в период восстановления после мышечной работы 3.5. Закономерности биохимической адаптации под влиянием систематической тренировки 3.6. Биохимический контроль при занятиях физической культурой и спортом 3.7. Биохимические основы силы, быстроты и выносливости 3.8. Биохимическое обоснование методики занятий физической культурой и спортом с лицами разного возраста. Биохимические основы рационального питания при занятиях физической культурой 3.9. Библиографический список Оглавление
Слайд 134
В основе модели скользящих нитей лежат следующие факты: при сокращении мышцы длины толстых и тонких нитей саркомера не изменяются; саркомер укорачивается за счет перекрывания толстых и тонких нитей, которые скользят друг относительно друга во время сокращения мышцы; это проявляется в том, что при сокращении мышцы полосы Н и I укорачиваются; сила, развиваемая мышцей, создается в процессе движения соседних нитей.
Слайд 138
Анаэробные механизмы: креатинфосфокиназный (алактатный) механизм, обеспечивающий ресинтез АТФ за счет перефосфорилирования между креатинфосфатом и АДФ; гликолитический (лактатный) механизм, обеспечивающий ресинтез АТФ в процессе анаэробного расщепления гликогена мышц или глюкозы крови с образованием молочной кислоты; миокиназный механизм, осуществляющий ресинтез АТФ за счет реакции перефосфорилирования между двумя A ДФ с участием миокиназы (аденилаткиназы).
Слайд 139
Общий КПД при преобразовании энергии метаболических процессов в механическую работу (Ем) зависит от двух показателей: эффективности преобразования выделяемой в ходе метаболических превращений энергии в энергию ресинтезируемых АТФ, т. е. эффективности фосфорилирования (Еф); эффективности преобразования АТФ в механическую работу, т. е. эффективности электромеханического сопряжения (Ее); Ем = (Еф/Ее) ∙100
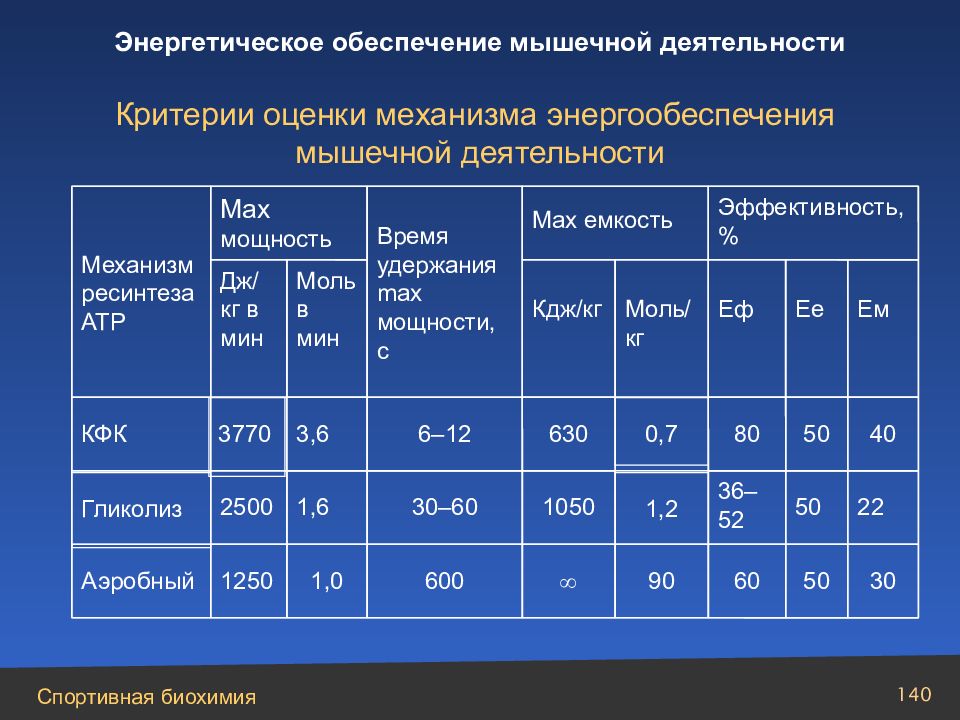
Слайд 140
Критерии оценки механизма энергообеспечения мышечной деятельности 30 50 60 90 600 1,0 1250 Аэробный 22 50 36–52 1,2 1050 30–60 1,6 2500 Гликолиз 40 50 80 0,7 630 6–12 3,6 3770 КФК Ем Ее Еф Моль/кг Кдж/кг Моль в мин Дж/ кг в мин Эффективность, % М ax емкость Время удержания max мощности, с Max мощность Механизм ресинтеза АТР
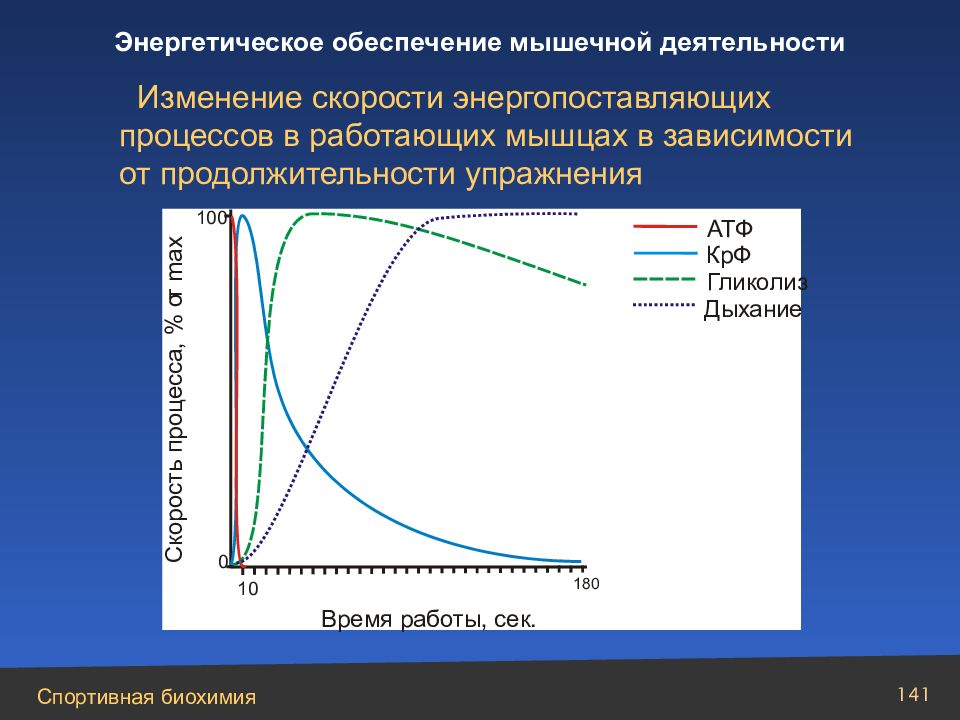
Слайд 141
Изменение скорости энергопоставляющих процессов в работающих мышцах в зависимости от продолжительности упражнения АТФ КрФ Дыхание Гликолиз С к о р о с т ь п р о ц е с с а , % о т max Время работы, сек. 10 100 0 180
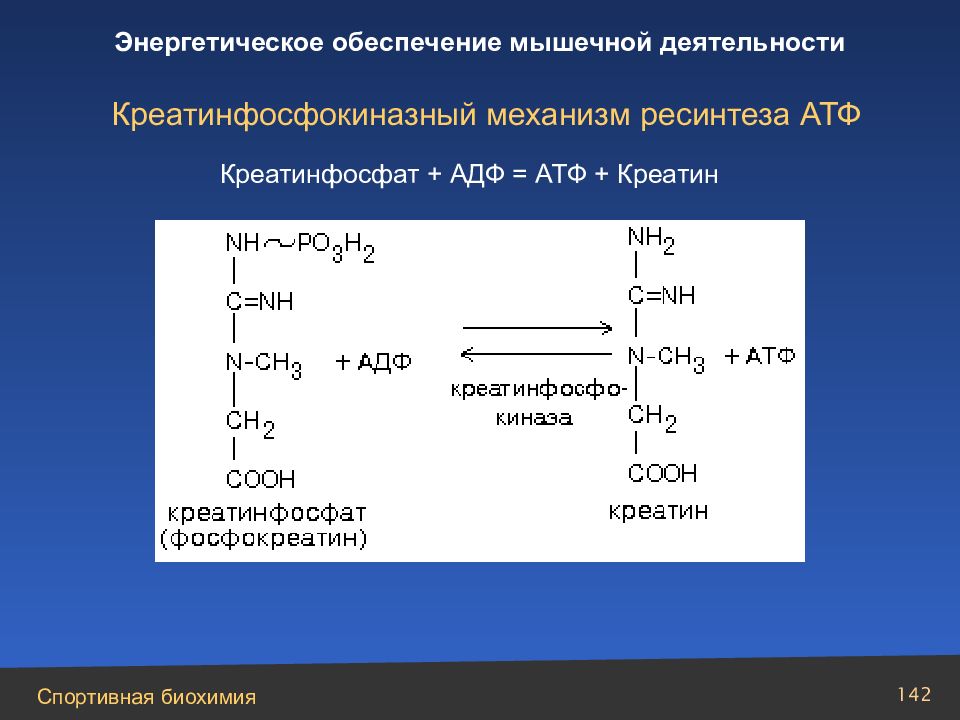
Слайд 142
Креатинфосфокиназный механизм ресинтеза АТФ Креатинфосфат + A ДФ = АТФ + Креатин
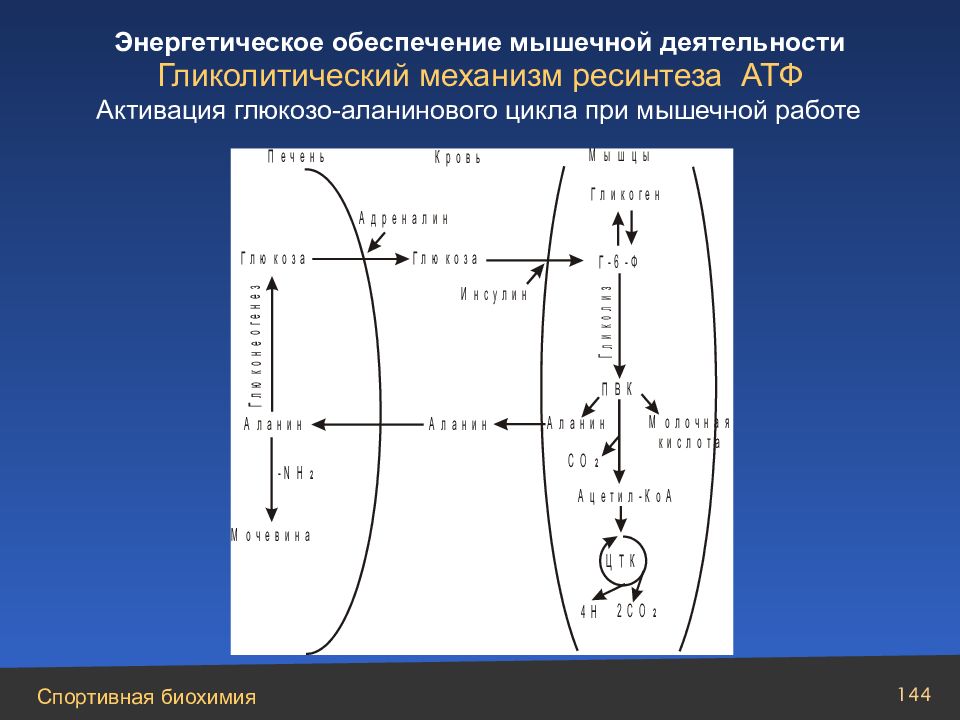
Слайд 144
Гликолитический механизм ресинтеза АТФ Активация глюкозо-аланинового цикла при мышечной работе
Слайд 146
Аэробный механизм ресинтеза АТФ Скорость образования АТФ в процессе окислительного фосфорилирования зависит от: соотношения АТФ/ A ДФ, при отсутствии A ДФ синтез АТФ не происходит; количества кислорода и эффективности его использования; активности окислительных ферментов; целостности мембран митохондрий; количества митохондрий; концентрации гормонов, ионов кальция и других регуляторов.
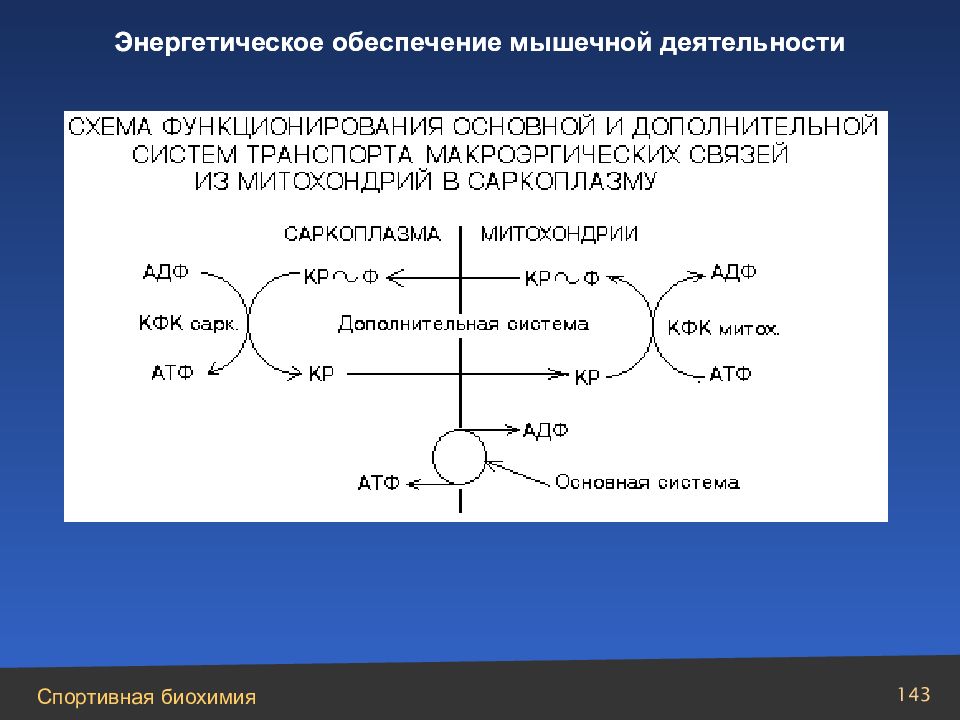
Слайд 147
Взаимосвязь анаэробных и аэробных превращений в скелетных мышцах: энерго-транспортный «челнок» с участием миофибриллярных и митохондриальных изоферментов креатинфосфокиназы
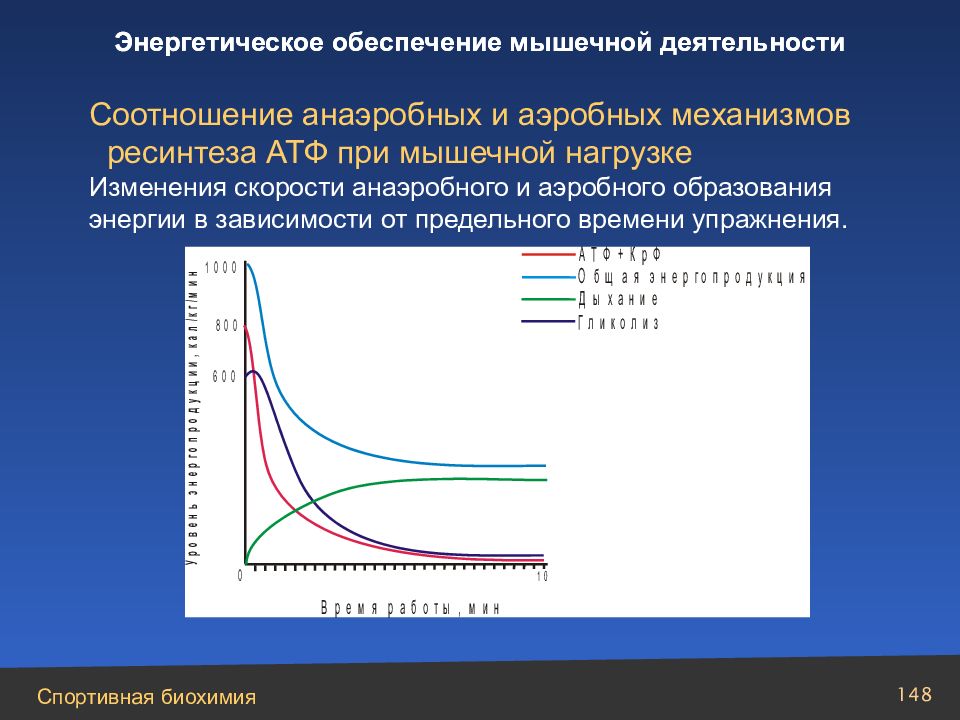
Слайд 148
Соотношение анаэробных и аэробных механизмов ресинтеза АТФ при мышечной нагрузке Изменения скорости анаэробного и аэробного образования энергии в зависимости от предельного времени упражнения. Энергетическое обеспечение мышечной деятельности
Слайд 149
Факторы, лимитирующие физическую работоспособность человека: биоэнергетические (аэробные или анаэробные) возможности человека; нейромышечные (мышечная сила и техника выполнения упражнения); психологическая мотивация (мотивация и тактика ведения спортивного состязания). Биохимические факторы спортивной работоспособности
Слайд 150
Основные особенности человека, определяющие его физическую работоспособность Алактатная анаэробная способность, связанная с процессами анаэробного ресинтеза АТР и КФ в работающей мышце Гликолитическая анаэробная способность, отражающая возможность усиления при работе анаэробного гликолитического процесса, в ходе которого происходит накопление лактата Аэробная способность, связанная с возможностью выполнения работы за счет усиления аэробных процессов в тканях при одновременном увеличении доставки и утилизации кислорода
Слайд 151
151 3.3. Биохимические изменения в организме при работе различного характера. Биохимические изменения при утомлении. Общие изменения в организме при физической нагрузке
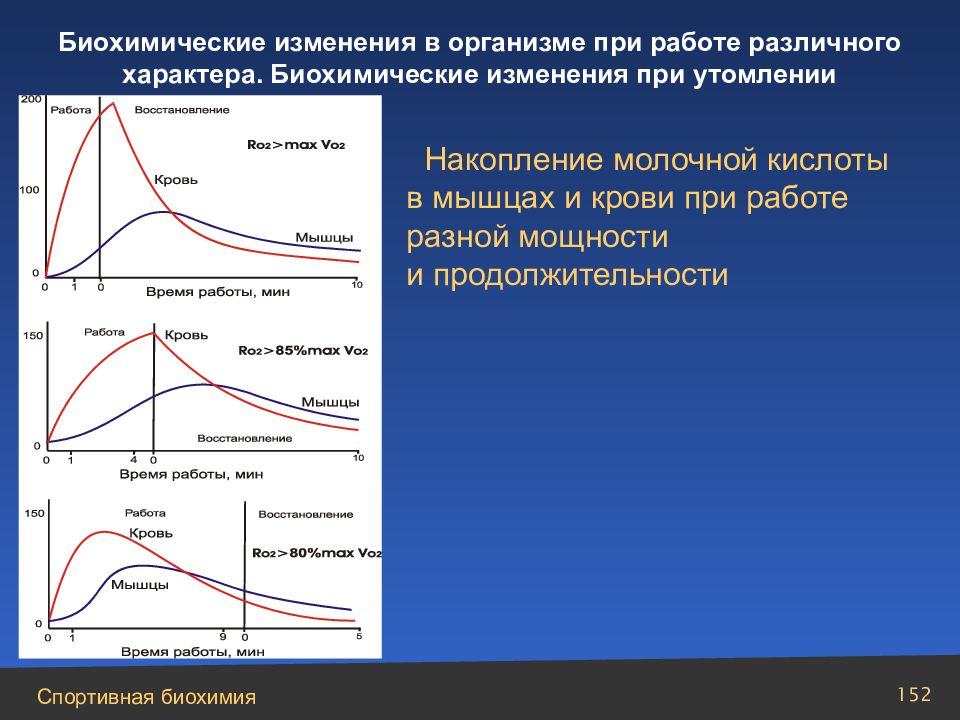
Слайд 152
Накопление молочной кислоты в мышцах и крови при работе разной мощности и продолжительности
Слайд 153
При переходе от состояния покоя к интенсивной мышечной деятельности происходят следующие процессы: анаэробные механизмы ресинтеза АТФ; использование креатинфосфата; гликолиз. Далее изменения метаболизма зависят от интенсивности мышечной работы: работа в "аэробной зоне“; работа в "смешанной зоне”; кислородная задолженность.
Слайд 154
Специализация мышц по типу энергетического обеспечения Красные мышцы – “медленные”, оксидативные. Белые мышцы – “быстрые”, гликолитические.
Слайд 155
В зависимости от количества мышц, участвующих в работе, ее делят на: локальную (менее ¼ всех мышц тела); региональную; глобальную (более ¾ всех мышц тела). Систематизация упражнений по характеру биохимических изменений при физической работе
Слайд 156
Режимы работы мышц: статический (изометрический) происходит пережимание капилляров, велика доля участия анаэробных реакций; динамический (изотонический) обеспечивается гораздо лучшее кровоснабжение тканей кислородом.
Слайд 157
Уровни мощности работы: критический – максимальное потребление кислорода; порог анаэробного обмена – усиление анаэробных реакций; мощность истощения – наивысшее развитие гликолиза; максимальная анаэробная мощность – предельных значений достигает скорость образования энергии в креатинфосфокиназной реакции. Зависимость биохимических процессов от мощности выполняемой мышечной работы
Слайд 158
Зоны относительной мощности по классификации В. С. Фарфеля: максимальная – обеспечение энергией за счет АТФ и креатинфосфата, частично – за счет гликолиза; субмаксимальная – обеспечение энергией за счет анаэробного гликолиза; большая – аэробные источники энергии; умеренная – аэробные источники энергии.
Слайд 159
Первопричины утомления снижение энергетических ресурсов; уменьшение активности ключевых ферментов из-за угнетающего действия продуктов метаболизма тканей; нарушение целостности функционирующих структур из-за недостаточности их пластического обеспечения; изменение нервной и гормональной регуляции и др.
Слайд 160
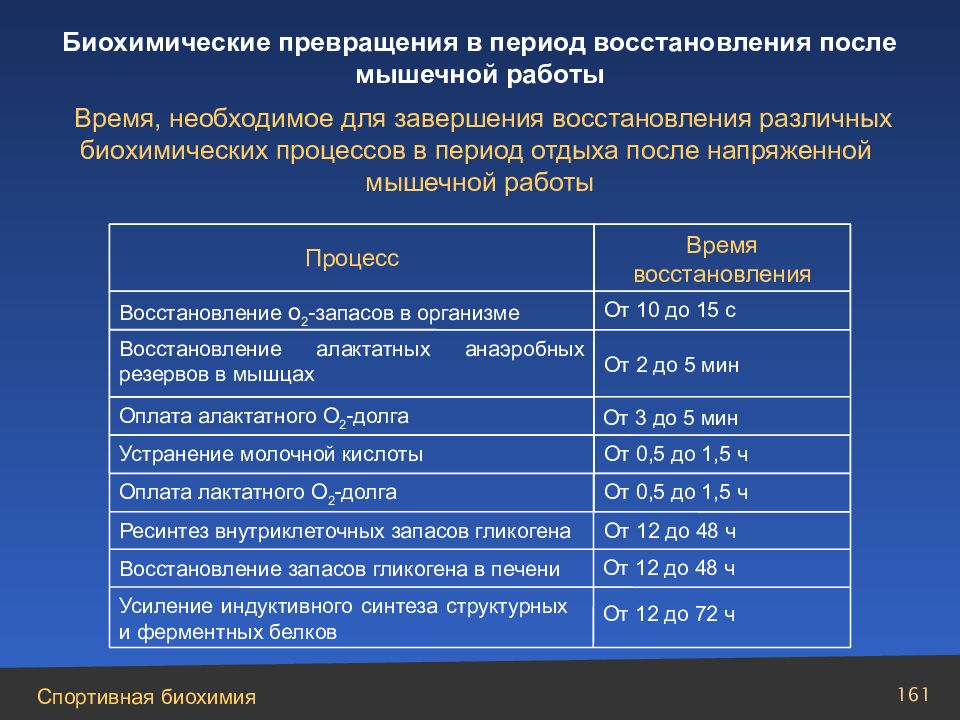
160 3.4. Биохимические превращения в период восстановления после мышечной работы. Срочное и отставленное восстановление
Слайд 161
Ресинтез внутриклеточных запасов гликогена От 12 до 72 ч Усиление индуктивного синтеза структурных и ферментных белков От 12 до 48 ч Восстановление запасов гликогена в печени От 12 до 48 ч От 0,5 до 1,5 ч Оплата лактатного О 2 -долга От 0,5 до 1,5 ч Устранение молочной кислоты От 3 до 5 мин Оплата алактатного О 2 - долга От 2 до 5 мин Восстановление алактатных анаэробных резервов в мышцах От 10 до 15 с Восстановление о 2 - запасов в организме Время восстановления Процесс Время, необходимое для завершения восстановления различных биохимических процессов в период отдыха после напряженной мышечной работы
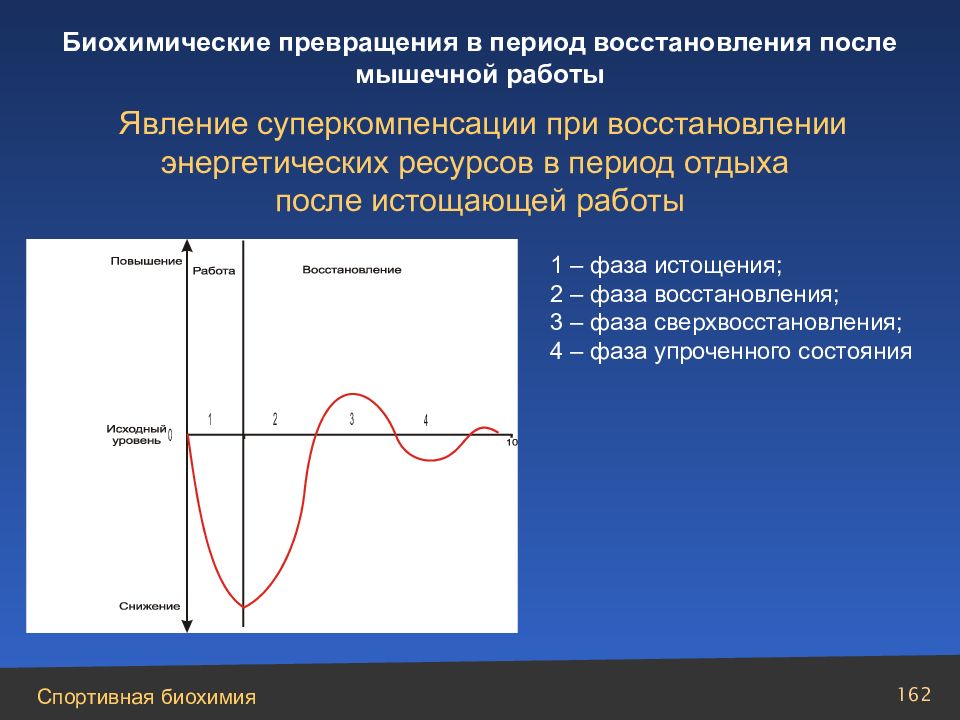
Слайд 162
1 – фаза истощения; 2 – фаза восстановления; 3 – фаза сверхвосстановления; 4 – фаза упроченного состояния Явление суперкомпенсации при восстановлении энергетических ресурсов в период отдыха после истощающей работы
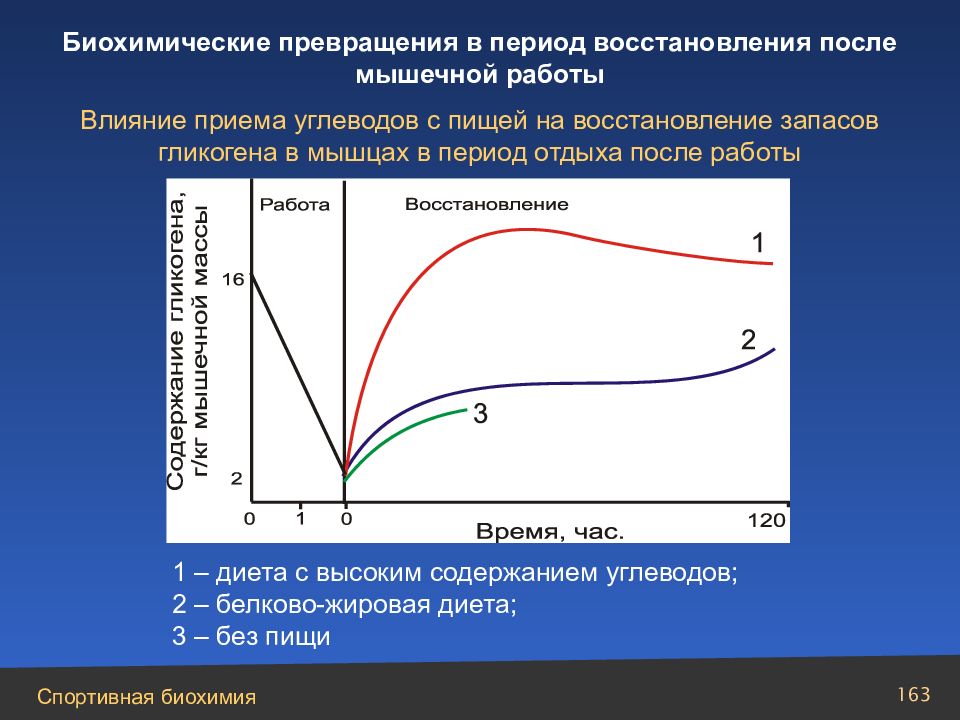
Слайд 163
1 – диета с высоким содержанием углеводов; 2 – белково-жировая диета; 3 – без пищи Влияние приема углеводов с пищей на восстановление запасов гликогена в мышцах в период отдыха после работы
Слайд 164
164 3.5. Закономерности биохимической адаптации под влиянием систематической тренировки
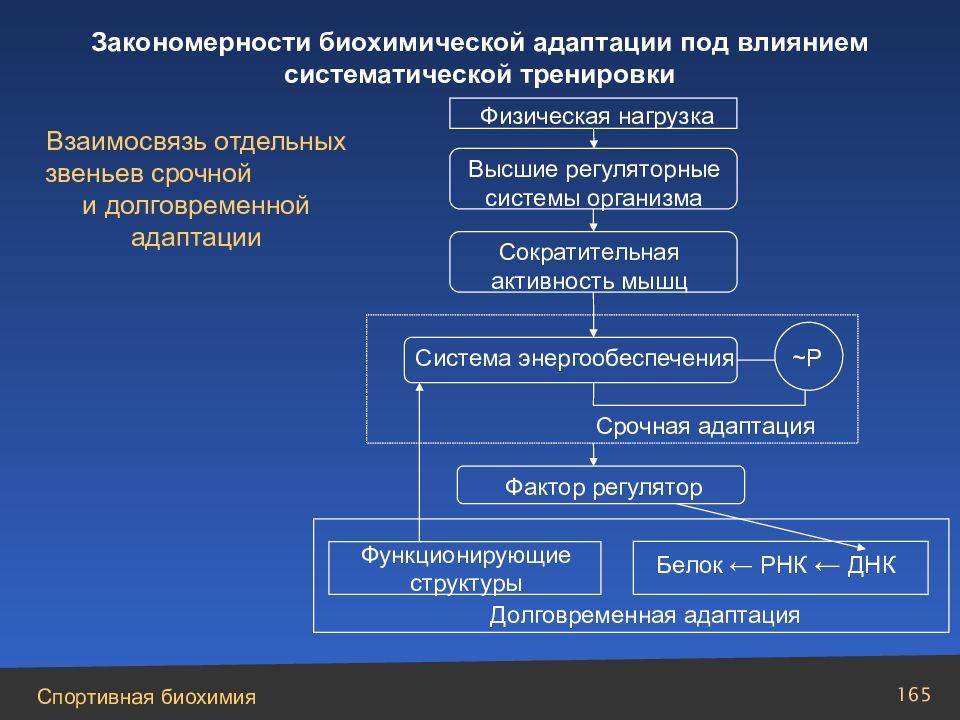
Слайд 165
Высшие регуляторные системы организма Физическая нагрузка Взаимосвязь отдельных звеньев срочной и долговременной адаптации Сократительная активность мышц Система энергообеспечения ~P Срочная адаптация Фактор регулятор Белок ← РНК ← ДНК Функционирующие структуры Долговременная адаптация
Слайд 166
Принципы тренировок на основе закономерностей биологической адаптации: сверхотягощение; специфичность; обратимость действия; положительное взаимодействие; последовательная адаптация; цикличность.
Слайд 167
Развитие адаптации под воздействием тренировки обеспечивается: системой внутриклеточного энергетического обмена; гормональными симпато-адреналовой и гипофизарно-адренокортикальной системами. Сверхотягощение
Слайд 168
168 3.6. Биохимический контроль при занятиях физической культурой и спортом. Биохимический контроль за развитием систем энергообеспечения организма и уровнем тренированности, утомления и восстановления организма
Слайд 169
О более высоком уровне тренированности свидетельствуют меньшее накопление лактата (по сравнению с нетренированными) при выполнении стандартной нагрузки, что связано с увеличением доли аэробных механизмов; большее накопление лактата при выполнении предельной нагрузки, что связано с увеличением гликолитической мощности; повышение мощности работы, при которой резко возрастает уровень лактата у тренированных лиц по сравнению с нетренированными; более длительная работа на предельном уровне; меньшее возрастание лактата при повышении мощности работы (совершенствование анаэробных процессов и экономичность энергозатрат ); увеличение скорости утилизации лактата в период восстановления после физической нагрузки.
Слайд 170
Регулярное применение допингов вызывает нарушение функции многих систем: сердечно-сосудистой; эндокринной, в особенности половых желез (атрофия) и гипофиза, что приводит к нарушению детородной функции, появлению мужских вторичных признаков у женщин (вирилизация) и увеличению молочных желез у мужчин (гинекомастия); функционирования печени, вызывая желтуху, отеки, циррозы; иммунной, что приводит к частым простудам, вирусным заболеваниям; нервной, проявляющееся в виде психических расстройств (агрессивность, депрессия, бессонница); прекращение роста трубчатых костей, что опасно для растущего организма. Контроль за применением допинга в спорте
Слайд 171
По фармакологическому действию допинги делятся на 5 классов: психостимуляторы (амфетамин, эфедрин, фенамин, кофеин, кокаин, и др.); наркотические средства (морфин, алкалоиды-опиаты, промедол, фентанил и др.); анаболические стероиды (тестостерон, его производные, метан-дростенолон, ретаболил, андродиол, и др), а также анаболические пептидные гормоны (соматотропин, гонадотропин, эритропоэтин); бета-блокаторы (анапримин, пропранолол, оксопреналол, надолол, атеналол и др.); диуретики (новурит, дихлотиазид, фуросимид (лазикс), клопамид, диакарб, верошпирон и др.). Контроль за применением допинга в спорте
Слайд 172
172 3.7. Биохимические основы силы, быстроты и выносливости Морфологические и биохимические основы скоростно-силовых качеств Биохимические основы методов скоростно-силовой подготовки спортсменов Биохимические основы выносливости Методы тренировки, способствующие развитию выносливости
Слайд 173
173 3.8. Биохимическое обоснование методики занятий физической культурой и спортом с лицами разного возраста. Биохимические основы рационального питания при занятиях физической культурой
Слайд 174
Основными химическими компонентами пищи являются 6 групп веществ: поставщики энергии (углеводы, белки, жиры); незаменимые аминокислоты; незаменимые жирные кислоты; витамины; минеральные вещества; вода. Биохимические основы рационального питания спортсменов
Слайд 175
Пищевые добавки способствуют: увеличению мышечной массы; коррекции компонентного состава тела (уменьшение жирового компонента, увеличение мышечного и костного); увеличению скорости метаболизма и энергообразования; восстановлению электролитического баланса; активации регуляторных механизмов энергообмена; снижению массы тела и др.
Слайд 176
176 Графики взяты из книги: Биохимия: учеб. для институтов физической культуры / ред. В. В. Меньшикова, Н. И. Волкова. – М.: Физкультура и спорт, 1986.
Слайд 177
177 Основной библиографический список Биохимия : учеб. для институтов физической культуры / ред. В. В. Меньшикова, Н. И. Волкова. – М. : Физкультура и спорт, 1986. Биохимия. Краткий курс с упражнениями и задачами / ред. Е. С. Северина, А. Я. Николаева. – М. : ГЭОТАР-МЕД, 2001. Волков, Н. И. Биохимия мышечной деятельности / Н. И. Волков. – М. : Олимпийский спорт, 2001. Николаев, А. Я. Биологическая химия / А. Я. Николаев. – М. : Высш. шк., 1989. Лабораторный практикум по биохимии для студентов факультета физической культуры и спорта. – СФУ, 2007. Лекции по биохимии для студентов факультета физической культуры и спорта. – СФУ, 2007. Учебно-методические указания для самостоятельной работы студентов факультета физической культуры и спорта. – СФУ, 2007. Электронный лабораторный практикум для студентов факультета физической культуры и спорта. – СФУ, 2007.
Последний слайд презентации: 1 1. 2. Строение, свойства, биологическая роль белков
178 Дополнительный библиографический список Березов, Т. Т. Биологическая химия / Т. Т. Березов, Б. Ф. Коровкин. – М. : Медицина, 1998. Мусил, Я. Современная биохимия в схемах / Я. Мусил, О. Новакова, К. Кунц. – М. : Мир, 1984. Пустовалова, Л. М. Практикум по биохимии / Л. М. Пустовалова. – Ростов-н/Дону : Феникс, 1999. Филлипович, Ю. Б. Основы биохимии / Ю. Б. Филлипович. – М. : Агар, 1999. Молекулярная биология клетки: в 3 тт. – 2-е изд. – М. : Мир, 1994.