Первый слайд презентации
Общая характеристика элементов VIA- группы (халькогены). Сера. Кислород
Слайд 2
Элементы VI группы главной подгруппы. O Халькогены, т.е S « рождающие руды». Se Te Po
Слайд 4
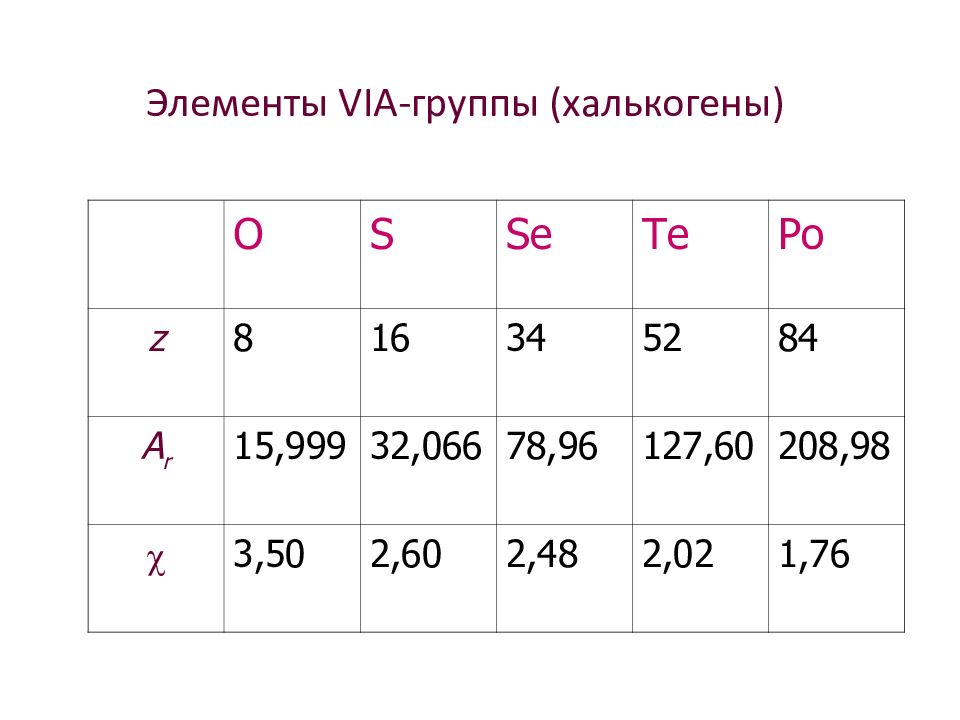
Элементы VI А-группы (халькогены) O S Se Te Po z 8 16 34 52 84 A r 15,999 32,066 78,96 127,60 208,98 3,50 2,60 2,48 2,02 1,76
Слайд 6
Кислород Кислород – самый распространенный элемент на Земле (49,5% масс.). Кислород существует в самородном виде (воздух) и входит в состав воды, горных пород и живых организмов. В атмосфере содержание кислорода – 23,13% масс..
Слайд 7
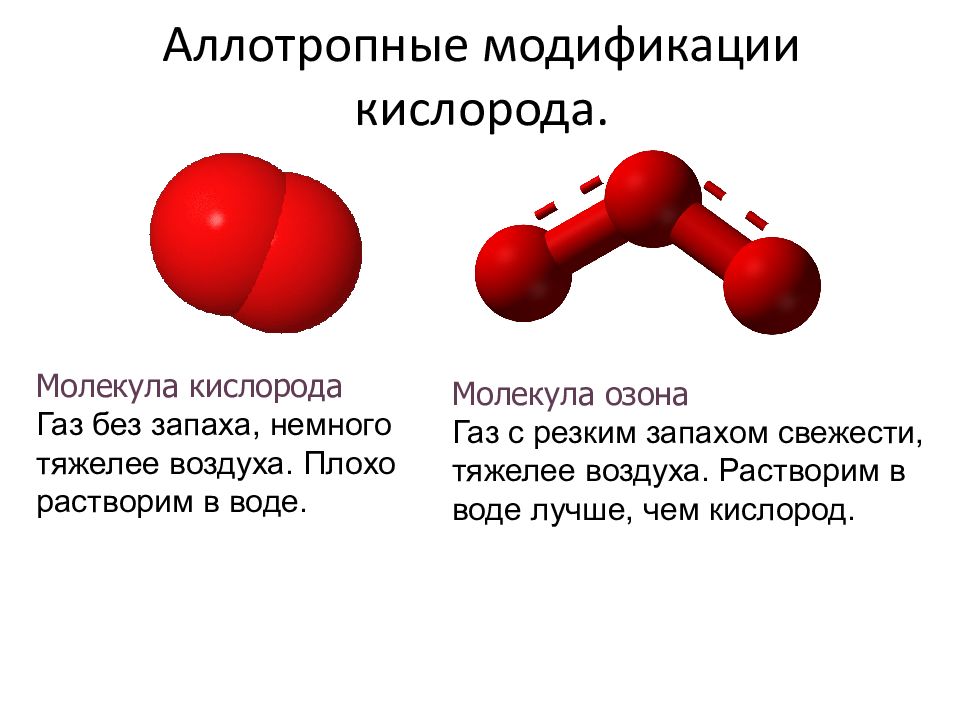
Аллотропные модификации кислорода. Молекула озона Газ с резким запахом свежести, тяжелее воздуха. Растворим в воде лучше, чем кислород. Молекула кислорода Газ без запаха, немного тяжелее воздуха. Плохо растворим в воде.
Слайд 8
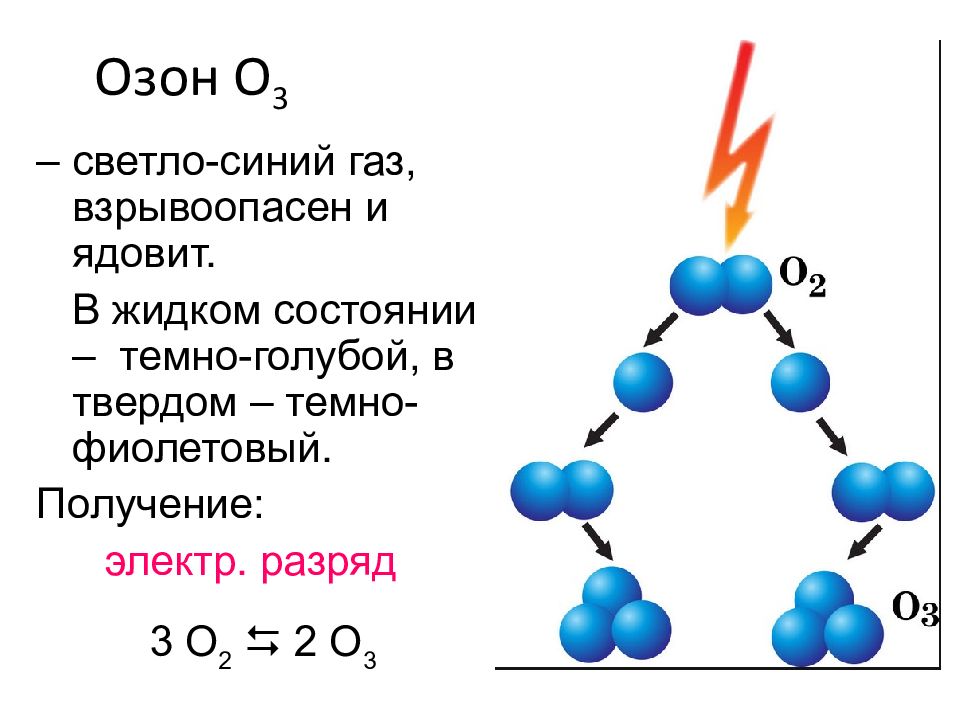
Озон O 3 – светло-синий газ, взрывоопасен и ядовит. В жидком состоянии – темно-голубой, в твердом – темно-фиолетовый. Получение: электр. разряд 3 O 2 2 O 3
Слайд 9
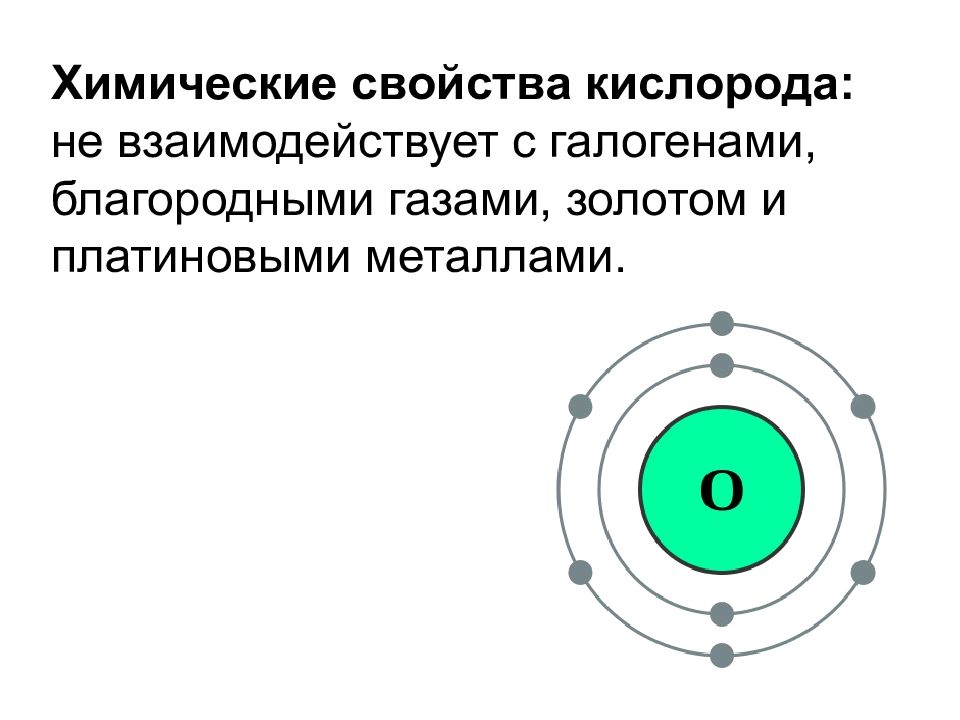
Химические свойства кислорода: не взаимодействует с галогенами, благородными газами, золотом и платиновыми металлами.
Слайд 10
Получение кислорода 2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑ 2 H 2 O 2 = 2 H 2 O + O 2 ↑ 2 KClO 3 = 2 KCl + 3 O 2 ↑ 2HgO = 2Hg + O 2 ↑ Дж. Пристли
Слайд 11
Кислород активно взаимодействует со щелочными металлами даже без нагревания. Металлы средней и низкой активности реагируют с кислородом при нагревании. 4 Li + O 2 = 2 Li 2 O 3 Fe + 2 O 2 = Fe 3 O 4 2Mg + O 2 = 2MgO
Слайд 12
Реакция горения При взаимодействии металлов и неметаллов с кислородом зачастую происходит выделение большого количества тепла и даже воспламенение. S + O 2 = SO 2 4 P + 5 O 2 = 2 P 2 O 5
Слайд 13
Взаимодействие кислорода с азотом происходит только при нагревании свыше 2000 °C или же при электрическом разряде. N 2 + O 2 = 2NO - Q
Слайд 14
Кислород довольно активно взаимодействует не только с простыми, но и со сложными веществами. CH 4 + 2O 2 = 2H 2 O + CO 2 2NO + O 2 = 2NO 2
Слайд 15
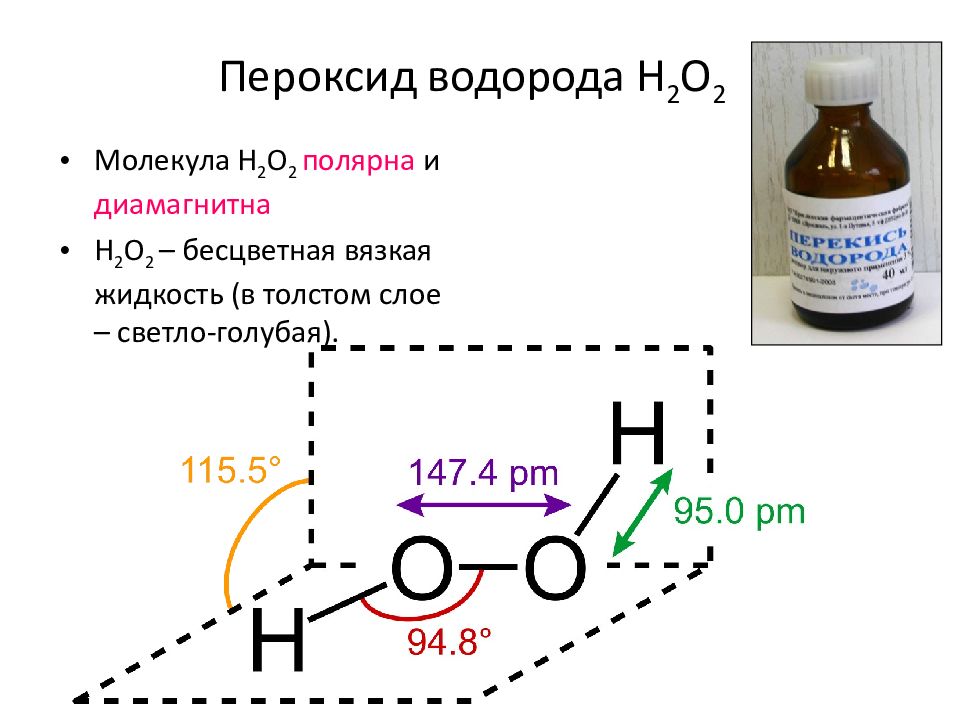
Пероксид водорода H 2 O 2 Молекула H 2 O 2 полярна и диамагнитна H 2 O 2 – бесцветная вязкая жидкость (в толстом слое – светло-голубая).
Слайд 16
Пероксид водорода H 2 O 2 В разбавленных растворах пероксид водорода неустойчив и самопроизвольно диспропорционирует: 2H 2 O 2 – I = 2H 2 O – II + O 2 0
Слайд 19
Сера- химический элемент Сера - химический элемент ΙΙΙ ( малого) периода,3 ряда, V Ι(А) группы Атомный номер 16 Заряд ядра Атомная масса 32,06 6 +16
Слайд 20
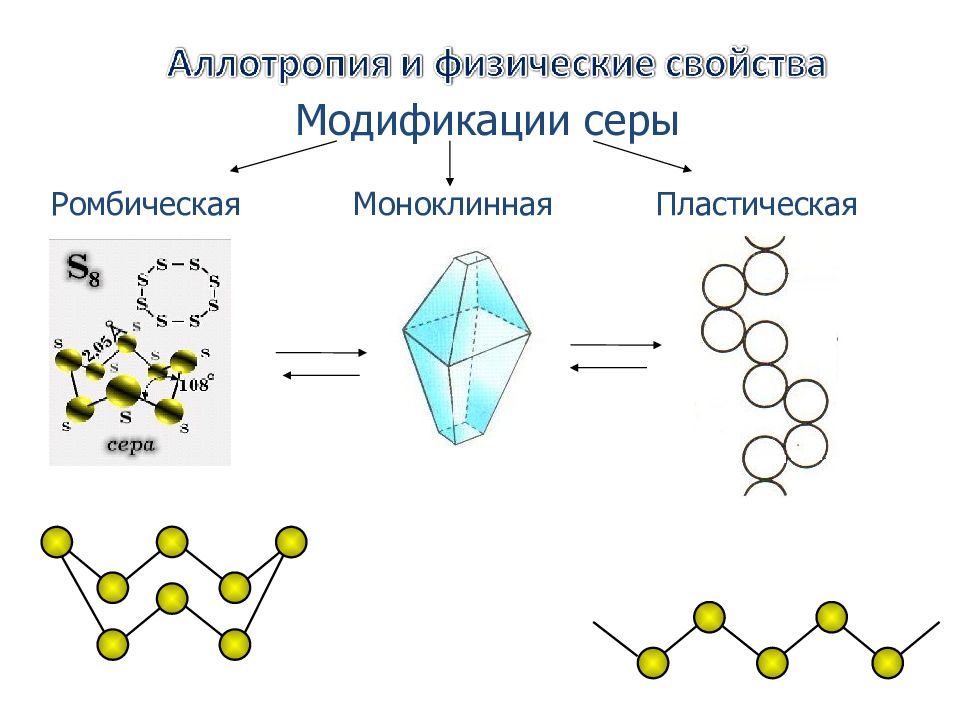
Шкала степеней окисления серы +VI +IV 0 I II SO 3, H 2 SO 4, K 2 SO 4, SF 6 SO 2, Na 2 SO 3, SF 4, SCl 4 Na 2 S 2, FeS 2 H 2 S, Na 2 S, CS 2 S (S 8, S x, S 6, S 4, S 2, S 0 )
Слайд 24
— твердое агрегатное состояние — желтого цвета — не растворима в воде — не смачивается водой — растворяется в органических растворителях
Слайд 26
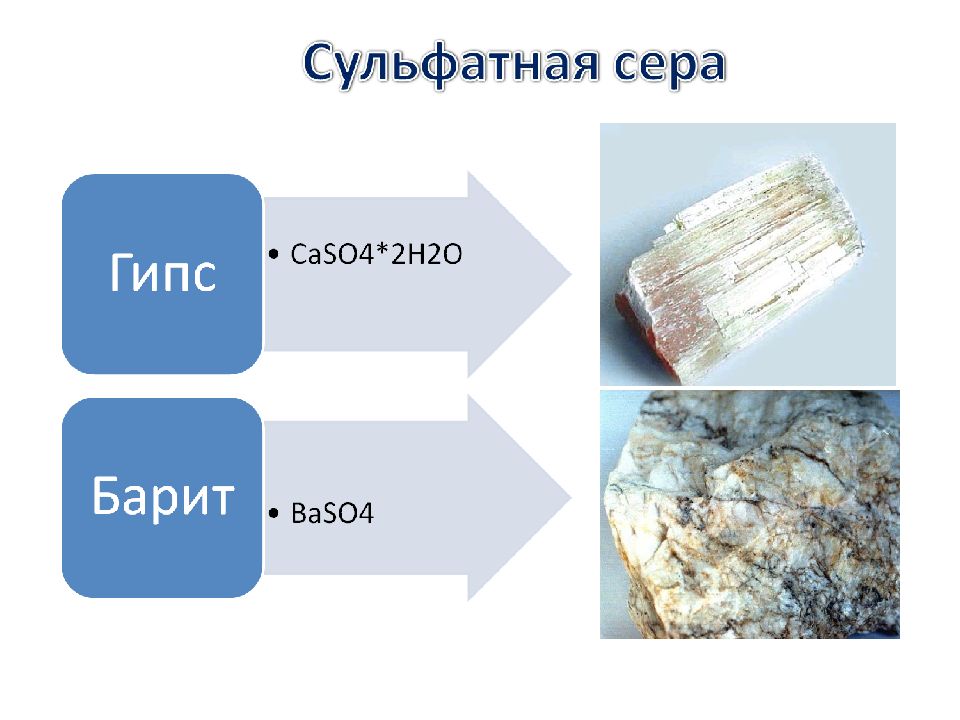
В природе сера встречается как в виде самородной серы, так и в составе минералов и горных пород, таких как сульфиды и сульфаты.
Слайд 27
Обычная ромбическая сера состоит из циклических молекул S 8. Кристаллы ромбической серы представляют собой октаэдры со срезанными углами. Ромбическая сера имеет полупрозрачную лимонно-жёлтую окраску, температура плавления — 112,8 ˚ С.
Слайд 29
1. Выплавление из горных пород FeS 2 → FeS + S ( без доступа воздуха ) 2. В лаборатории Неполное окисление сероводорода (при недостатке кислорода). H 2 S + O 2 → S + Н 2 О H 2 SO 3 + H 2 S → S + H 2 O Получение.
Слайд 30
Mg + S = MgS 2Al + 3S = Al 2 S 3 Взаимодействует со многими металлами, кроме золота и платины: Взаимодействует со всеми щелочными, щёлочноземельными металлами, а также медью, ртутью и серебром. Cu + S = CuS Hg + S = HgS Химические свойства серы
Слайд 31
Zn + S = ZnS С остальными металлами сера реагирует при нагревании: Окислительные свойства сера проявляет при взаимодействии с некоторыми неметаллами: H 2 + S = H 2 S Химические свойства серы
Слайд 32
S + O 2 = SO 2 Из неметаллов с серой не реагируют только азот, йод и благородные газы. При взаимодействии с кислородом сера проявляет восстановительные свойства: Химические свойства серы
Слайд 33
Взаимодействие с кислотами S + H 2 SO 4 (конц.) = SO 2 ↑ + H 2 O S + 6HNO 3 ( конц. ) = H 2 SO 4 + 6NO 2 ↑ + 2H 2 O Химические свойства серы
Слайд 34
Взаимодействие со щелочами S + KOH = K 2 S + K 2 SO 3 + H 2 O Химические свойства серы
Слайд 35
СЕРА в организме человека Сера входит в состав белков(волосы) Сера- составная часть активных веществ: витаминов и гормонов При недостатке серы в организме наблюдаются хрупкость и ломкость костей, выпадение волос.
Слайд 37
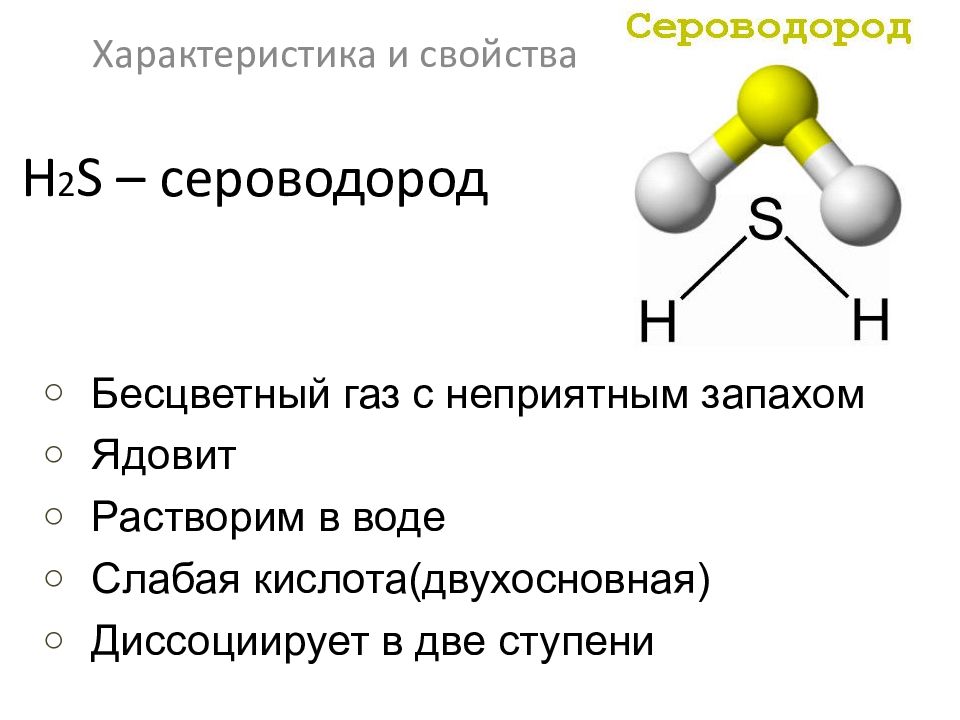
H 2 S – сероводород Характеристика и свойства Бесцветный газ с неприятным запахом Ядовит Растворим в воде Слабая кислота(двухосновная) Диссоциирует в две ступени
Слайд 39
Получение. H 2 + S → H 2 S Вытеснение сероводорода из сульфидов сильными кислотами HCl + FeS → H 2 S + FeCl 2
Слайд 40
Диссоциация. Диссоциация происходит в 2 ступени: H 2 S → H + + HS - HS - → 2H + + S 2 -
Слайд 41
Химические свойства !! Только восстановитель 2H2S + O2(недост) → 2S + 2H2O 2H2S + 3O2(изб) → 2S О 2 + 2H2O H2S + Ca → CaS + H2 H2S + CaO→ CaS + H2O H2S + 2NaOH→ Na2S + 2H2O H2S + 2FeCl3 → 2FeCl2 + S + 2HCl H2S + Br2 → S + 2HBr Качественная реакция на сероводородную кислоту: H2S + Pb(NO3)2 → PbS↓ + 2HNO3 ( черный )
Слайд 42
SO 2 – сернистый газ Характеристика и свойства Бесцветный газ с резким запахом Ядовит Тяжелее воздуха Хорошо растворим в воде
Слайд 43
Получение. 1. В промышленности: обжиг сульфидов 4 FeS 2 + 11 O 2 → 2 Fe 2 O 3 + 8 SO 2 2. В лаборатории: Горение серы S + O 2 → SO 2 ↑ Действие кислот на соли сернистой кислоты Na 2 SO 3 + 2HCl → 2NaCl + SO 2 ↑ + H 2 O При окислении тяжелых металлов концентрированной серной кислоты Cu + 2H 2 SO 4 (к) → CuSO 4 + SO 2 + 2H 2 O t o t o t o t o
Слайд 44
Химические свойства SO 2 + H 2 O ↔ H 2 SO 3 2NaOH + SO 2 → Na 2 SO 3 + H 2 O (NaHSO3) SO 2 – восстановитель: 2 SO 2 + O 2 → 2 SO 3 SO 2 + Br 2 + 2H 2 O → H 2 SO 4 + 2HBr SO 2 – окислитель: SO 2 + С → S + С O 2 SO 2 + 2H 2 S → 3S + 2H 2 O t o кат.
Слайд 45
SO 3 – серный ангидрид Характеристика и свойства Бесцветная жидкость При температуре <17 – белая кристаллическая масса Гигроскопичен
Слайд 46
Получение. В промышленности 2SO2 + O2 → 2SO3 В лаборатории Fe2(SO4)3 → Fe2O3 + 3SO3 t o, кат t o
Слайд 48
Серная кислота в природе Кислотное озеро на глубине вулкана Малый Семячик Кипящее озеро (Курильские острова) Европа – спутник Юпитера Облака планеты Венера
Слайд 49
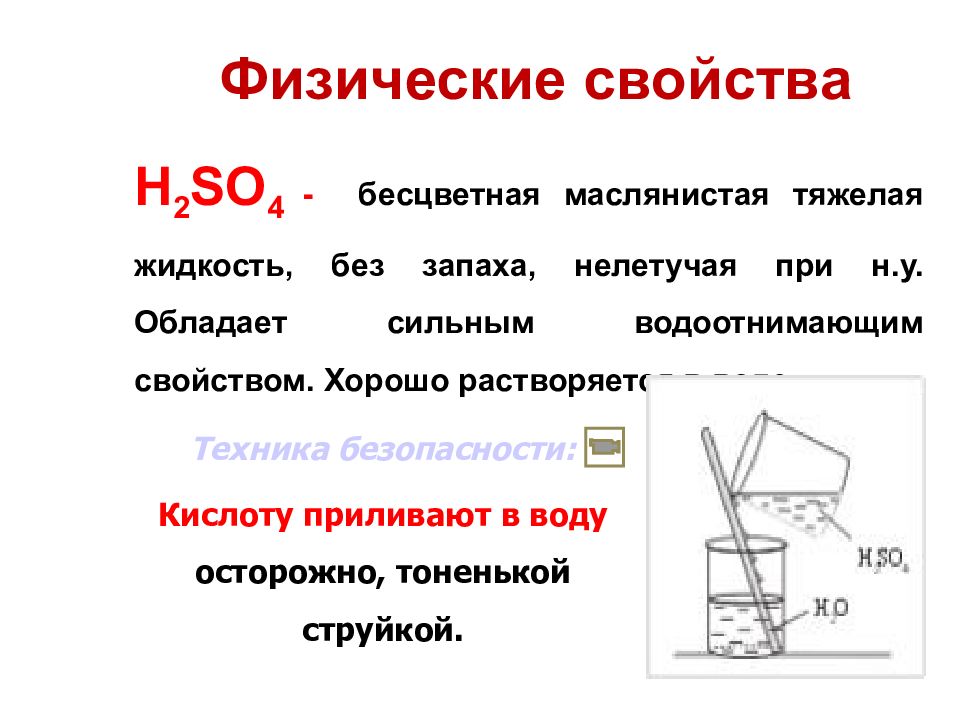
Физические свойства H 2 SO 4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим свойством. Хорошо растворяется в воде. Техника безопасности: Кислоту приливают в воду осторожно, тоненькой струйкой.
Слайд 52
Химические свойства разбавленной H 2 SO 4 1. Взаимодействие с металлами (Стоящими до Н в ЭРНМ) Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑ Cu + H 2 SO 4 ≠
Слайд 53
Химические свойства разбавленной H 2 SO 4 2. Взаимодействие с основными и амфотерными оксидами H 2 SO 4 + CuO = CuSO 4 + H 2 O
Слайд 54
Химические свойства разбавленной H 2 SO 4 3. Взаимодействие с основаниями: а) щелочами H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O б) нерастворимыми основаниями H 2 SO 4 + Cu(OH) 2 = CuSO 4 + 2H 2 O
Слайд 55
Химические свойства разбавленной H 2 SO 4 4. Взаимодействие с солями H 2 SO 4 + BaCl 2 = BaSO 4 ↓+ 2HCl Качественная реакция – выпадение белого осадка белый
Слайд 56
Химические свойства концентрированной H 2 SO 4 Концентрированная H 2 SO 4 - сильный окислитель за счет S(+6) 1. Взаимодействие с металлами + активные металлы + малоактивные металлы + Fe, Al H 2 S, S, SO 2 SO 2 Пассивация металла Cu + 2H 2 SO 4 ( конц ) = CuSO 4 + SO 2 ↑ + 2H 2 O Cu 0 – 2e - Cu +2 S +6 + 2e - S +4 окисление восстановление восстановитель окислитель
Слайд 58
Соли серной кислоты Na 2 SO 4 × 10H 2 O Глауберова соль CaSO 4 ×2H 2 O Гипс BaSO 4 Сульфат бария CuSO 4 ×5H 2 O Медный купорос
Слайд 60
Задание. Определите степени окисления серы в соединениях : SO 2, H 2 S, SO 3, CaS, Na 2 SO 4, NaHS, KHSO 4, MgSO 4, H 2 SO 4, K 2 SO 3.
Слайд 61
Тест 1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ: А) Mg, Cu; Б) Na, Zn; В) Ca, Li; Г) Fe, Al. 2. Разбавленная серная кислота реагирует с каждым из веществ: А) Cu и KO H; Б) Na 2 CO 3 и Al(OH) 3 В) AlCl 3 и Ag; Г) FeSO 4 и H 2 SO 4 3. При разбавлении серной кислоты всегда приливают кислоту к воде. Чем опасно разбавление концентрированной серной кислоты приливанием к ней воды?: А) Может возникнуть пожар; Б) Может произойти разложение воды; В) Может выделиться ядовитое вещество; Г) Может произойти разбрызгивание раствора вследствие выделения теплоты. 4. Водный раствор серной кислоты реагирует с каждым из веществ: А) С цинком и оксидом натрия; Б) С железом и оксидом углерода (II); В) С алюминием и хлоридом натрия; Г) С медью и гидроксидом калия.
Слайд 63
1.Распределение электронов по энергетическим уровням в атоме серы: А. 2, 6. В. 2, 8, 6. Б. 2, 8. Г. 2, 8, 8. 2.Ряд формул веществ, в котором степень окисления серы уменьшается: А. SO 3 -FeS-SO 2. В. SO 2 -S-H 2 S. Б. MgS-S-SO 2. Г. S - H 2 S - Al 2 S 3.
Слайд 64
3.Свойство, характерное для серы: А.Хорошо растворима в воде. Б.Имеет металлический блеск. В.Твердое вещество желтого цвета. Г.Проводит электрический ток. 4. Уравнение реакции, в котором элемент сера является восстановителем: А. Fe+H 2 SO 4 =FeSO 4 +H 2. Б. S+O 2 =SO 2. В. 2Li+S=Li 2 S. Г. SO 3 +H 2 O=H 2 SO 4