Первый слайд презентации: Разбор заданий по химии ОГЭ 2020-2021 учебный год
1,2, 18 задания Разбор заданий по химии ОГЭ 2020-2021 учебный год
Слайд 2
Демонстрационный вариант контрольных измерительных материалов основного государственного экзамена 2021 года по ХИМИИ Инструкция по выполнению работы Экзаменационная работа состоит из двух частей, включающих в себя 24 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 5 заданий с развёрнутым ответом. На выполнение экзаменационной работы по химии отводится 3 часа (180 минут). Ответы к заданиям 1–19 записываются в виде последовательности цифр (чисел) или числа. Ответ запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1. К заданиям 20–23 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Ответы на задания записываются на бланке ответов № 2. Задание 24 предполагает выполнение эксперимента под наблюдением экспертов. К выполнению задания 24 следует приступать после выполнения участником экзамена задания 23 и не ранее чем через 30 минут после начала экзамена. При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором. При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. После завершения работы проверьте, чтобы ответ на каждое задание в бланках ответов № 1 и № 2 был записан под правильным номером.
Слайд 3: 1 задание
1. Выберите два высказывания, в которых говорится о железе как о химическом элементе. 1) Железо реагирует с хлором. 2) Железо быстро ржавеет во влажном воздухе. 3) Пирит является сырьём для получения железа. 4) Гемоглобин, содержащий железо, переносит кислород. 5) В состав ржавчины входит железо. Запишите номера выбранных ответов. Ответ: 45
Слайд 4
Выберите два высказывания, в которых говорится о фосфоре как о химическом элементе: 1) Молекула фосфина состоит из трёх атомов водорода и одного атома фосфора 2) Фосфор входит в состав смеси, наносимой на стенку спичечной коробки 3) Фосфор имеет несколько аллотропных модификаций 4) Фосфор входит в состав растительных и животных белков 5) Чёрный фосфор обладает полупроводниковыми свойствами Ответ: 14 1 задание
Слайд 5: 1 задание
Выберите два высказывания, в которых говорится о водороде как о химическом элементе: 1) Водород входит в состав большинства органических соединений 2) Водород — самый лёгкий газ 3) Водородом заполняют воздушные шары 4) Водород содержится в вулканических газах 5) Молекула метана содержит четыре атома водорода Ответ: 15 1 задание
Слайд 6: 1 задание
Выберите два высказывания, в которых говорится о галлии как о химическом элементе: 1) Галлий — мягкий хрупкий металл серебристо-белого цвета с синеватым оттенком 2) Существование галлия было научно предсказано Д. И. Менделеевым 3) Чистый галлий плавится на руке человека 4) Галлием заполняют термометры (вместо ртути) для измерения высоких температур 5) В состав полупроводниковых материалов часто входит галлий Ответ: 25 1 задание
Слайд 7: 1 задание
Выберите два высказывания, в которых говорится о барии как о химическом элементе. 1) В земной коре содержится 0,05 % бария. 2) Барий плавится при температуре 710 °С. 3) Зелёная окраска пламени — «визитная карточка» бария, даже если он присутствует в микроскопических количествах. 4) Барий используют в качестве геттера — поглотителя остатков газов в вакуумных приборах. 5) Барий самовоспламеняется от удара, легко разлагает воду. Ответ: 13 1 задание
Слайд 8: 1 задание
Выберите два высказывания, в которых говорится о фторе как о простом веществе. 1) Кремний и древесный уголь самовоспламеняются во фторе. 2) В состав зубной эмали входит до 0,02 % фтора. 3) Фтор ядовит. 4) Во фреонах фтор работает на «индустрию холода». 5) Пластмассы, содержащие фтор, характеризуются химической и термической устойчивостью. Ответ: 13 1 задание
Слайд 9: Задание 2
На приведённом рисунке изображена модель атома химического элемента. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, модель которого изображена на рисунке. Решение. На приведённом рисунке изображена модель атома, имеющего два электронных слоя (т. е. располагающегося во втором периоде) и 6 валентных электронов (т. е. располагающегося в VIA группе). Ответ: 26.
Слайд 10: Задание 2
На приведённом рисунке изображена модель атома химического элемента. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, модель которого изображена на рисунке. (Для записи ответа используйте арабские цифры.) Ответ: 25. Задание 2
Слайд 11
На приведённом рисунке изображена схема строения электронных оболочек атома. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, схема строения которого изображена на рисунке. Решение. На приведённом рисунке изображена схема строения атома, имеющего три электронных слоя (т. е. располагающегося в третьем периоде) и 3 валентных электрона (т. е. располагающегося в IIIA группе). Ответ: 33. Задание 2
Слайд 12
На приведённом рисунке изображена модель атома химического элемента. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, модель которого изображена на рисунке. Решение. На приведённом рисунке изображена модель атома, имеющего три электронных слоя (т. е. располагающегося в третьем периоде) и 3 валентных электрона (т. е. располагающегося в IIIA группе). Ответ: 33. Задание 2
Слайд 13: Задание 2
На приведённом рисунке изображена схема строения электронных оболочек атома. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, схема строения которого изображена на рисунке. Решение. На приведённом рисунке изображена схема строения атома, имеющего три электронных слоя (т. е. располагающегося в третьем периоде) и 5 валентных электронов (т. е. располагающегося в VA группе). Ответ: 35. Задание 2
Слайд 14
Запишите в поле ответа число электронных оболочек и количество валентных электронов фосфора. Решение. Число электронных оболочек атома химического элемента равно номеру его периода в Периодической системе Д. И. Менделеева, а число валентных электронов — номеру группы (для главных подгрупп). Фосфор расположен в третьем периоде, VA группе. Ответ: 35. Задание 2
Слайд 15: Задание 2
Запишите в поле ответа номер периода и номер группы химического элемента, атом которого в основном состоянии содержит 8 электронов. Решение. Число электронов атома в основном состоянии равно числу протонов в ядре и равно порядковому номеру химического элемента в Периодической системе Д. И. Менделеева. 8-й элемент — кислород, находится во втором периоде, в VIA группе. Ответ: 26. Задание 2
Слайд 16
Запишите в поле ответа номер периода и номер группы химического элемента, атом которого в основном состоянии содержит 18 электронов. Решение. Число электронов атома в основном состоянии равно числу протонов в ядре и равно порядковому номеру химического элемента в Периодической системе Д. И. Менделеева. 18-й элемент — аргон, находится в третьем периоде, в VIIIA группе. Ответ: 38. Задание 2
Слайд 17
Запишите в поле ответа число электронов в основном состоянии и количество электронных оболочек химического элемента, ядро которого содержит 5 протонов. Решение. Число электронов атома в основном состоянии равно числу протонов в ядре и равно порядковому номеру химического элемента в Периодической системе Д. И. Менделеева. 5-й элемент — бор, расположенный во втором периоде. Номер периода равен числу электронных оболочек. Ответ: 52. Задание 2
Слайд 18: Задание 18
Массовая доля кислорода в нитрате железа(II) равна 1) 26,7% 2) 34,2% 3) 53,3% 4) 64,6% Решение. Формула нитратa железа(II) Fe(NO3)2 : . Его молярная масса: M = 56 + 14·2 + 16·6 = 180, поэтому W = 16·6·100/180 = 53,3%.
Слайд 19: Задания 18
Задания Д19 На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфита натрия? Решение. Формула сульфита натрия: Na2SO3 Его молярная масса: M = 23·2 + 32 + 16·3 = 126, поэтому W = 23·2·100/126 = 36,5%, W = 32·100/126 = 25,4%, W = 100 - 36.5 - 26.4 = 38,1%. Правильный ответ указан под номером 1.
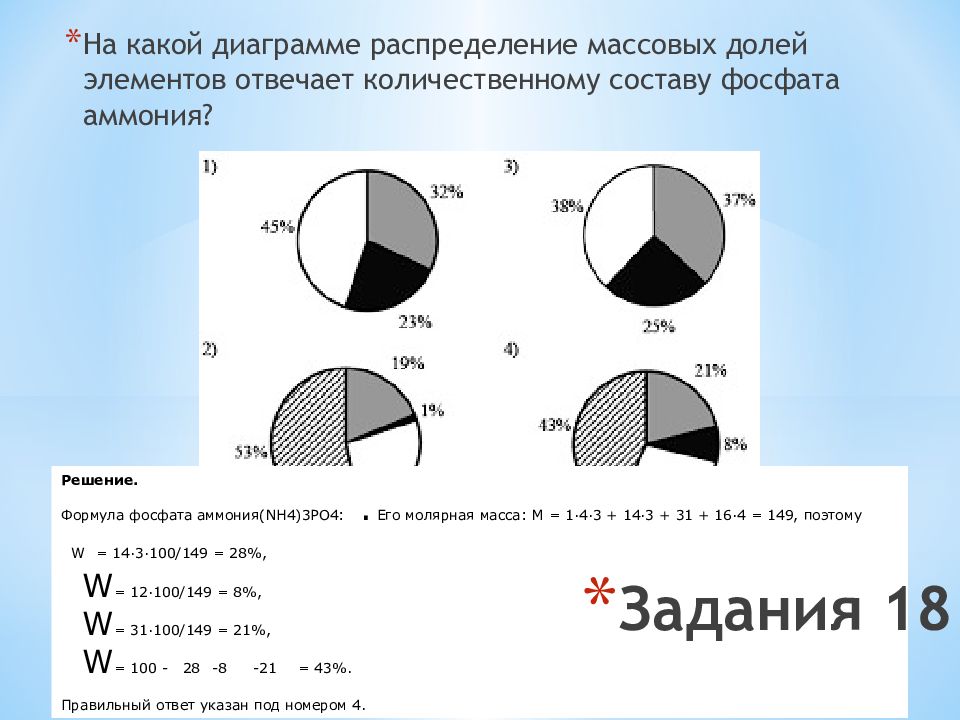
Слайд 20: Задания 18
На какой диаграмме распределение массовых долей элементов отвечает количественному составу фосфата аммония? Решение. Формула фосфата аммония (NH4)3PO4 : . Его молярная масса: M = 1·4·3 + 14·3 + 31 + 16·4 = 149, поэтому W = 14·3·100/149 = 28%, W = 12·100/149 = 8%, W = 31·100/149 = 21%, W = 100 - 28 - 8 - 21 = 43%. Правильный ответ указан под номером 4. Задания 18