Первый слайд презентации: Периодический закон и ПСХЭ Д. И. Менделеева в свете учения о строении атома
Слайд 2
Химический элемент – это… Атом – это ___________________. Изотоп – это разновидность атома одного химического элемента… Электрон – заряд равен ____, масса равна__________. Нейтрон – ________________________. Протон – это…
3 Дмитрий Иванович Менделеев ( 1834-1907 ) Выдающийся русский химик, открывший периодический закон и создавший периодическую систему химических элементов. .
Слайд 4
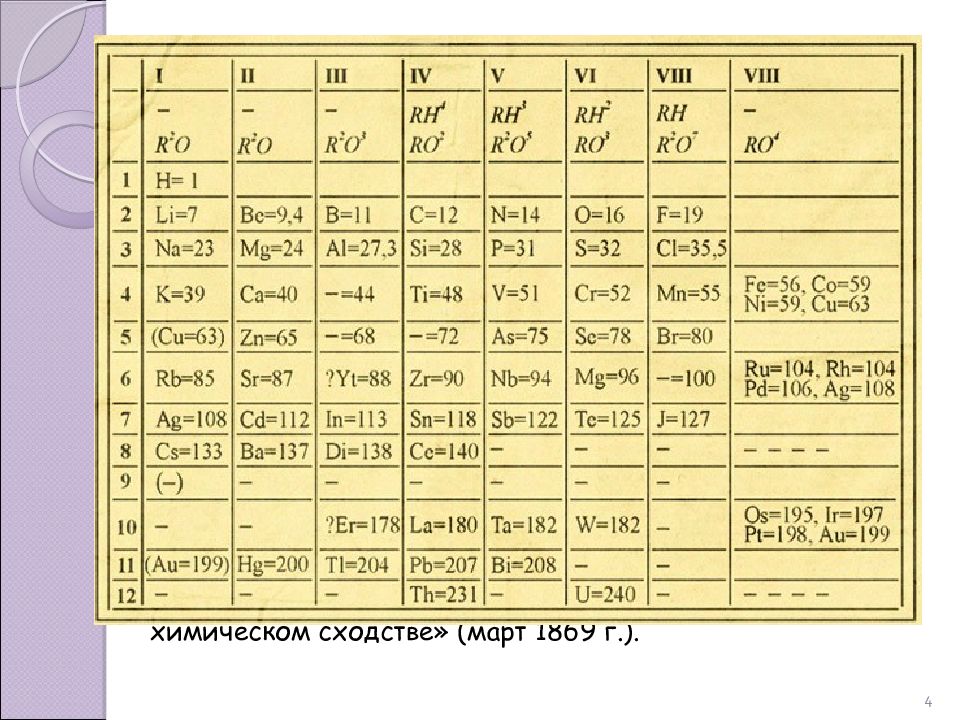
4 Первый вариант таблицы элементов, выражавшей периодический закон, Менделеев опубликовал в виде отдельного листка под названием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» (март 1869 г.).
21.02.2019 5 Современная периодическая таблица Д.И.Менделеева
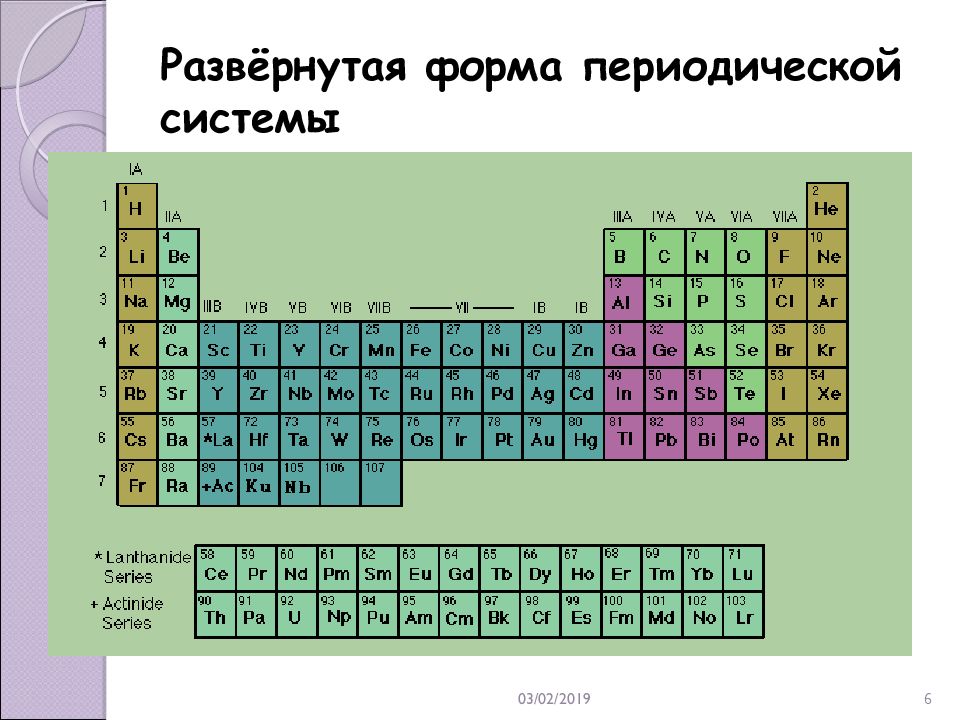
21.02.2019 6 Развёрнутая форма периодической системы
Слайд 7: Структура периодической системы:
7 Структура периодической системы: Формулировка периодического закона « Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов. ». Принцип построения периодической системы «Периодическая система построена в порядке возрастания атомной массы». Принцип периодичности «Периодичность - это повторение химических свойств через каждые восемь элементов на девятый» Понятие периода А) Период – это расположение элементов по горизонтали.. Б) Период начинается с щелочного металла и заканчивается инертным газом. В) В периодической системе всего 7 периодов, 1,2,3 малые и 4,5,6,7 большие Г) Период показывает количество энергетических уровней.
Слайд 8: Структура периодической системы:
21.02.2019 8 Структура периодической системы: Понятие группы А) Группа – это расположение элементов по вертикали. Б) В периодической системе всего 8 групп, каждая группа подразделяется на: главную, в которой происходит заполнение электронов на внешнем энергетическом уровне и побочную в которой происходит заполнение предвнешнего энергетического уровня. В) Группа показывает количество электронов на внешнем энергетическом уровне только в главных подгруппах. Г) Группа показывает наивысшую степень окисления в соединениях с кислородом. Понятие порядкового номера Порядковый номер показывает: А) Заряд ядра атома. Б) Количество протонов. В) Количество нейтронов, которые вычисляются между разностью молярной масс и порядковым номером. Г) Количество электронов, которые движутся вокруг атома и несут отрицательный заряд.
Слайд 10
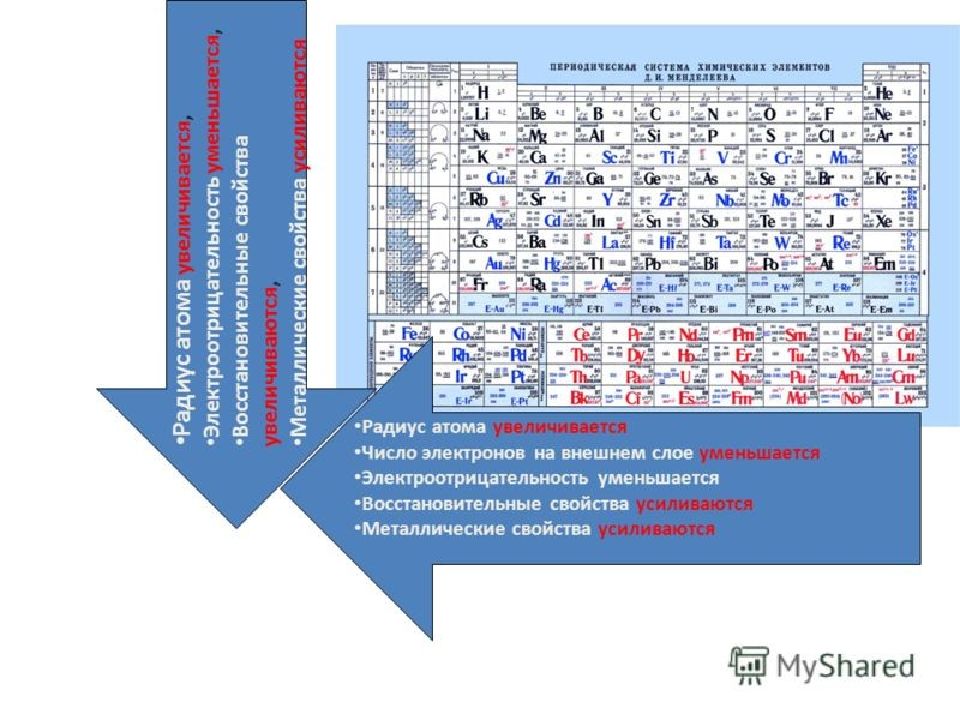
21.02.2019 10 Закономерности 1) В периодах степень окисления в высших оксидах и гидроксидах _ _ _ _ _ _ _ _ _ от _ _ до _ _ 2) Высшие оксиды и гидроксиды от_ _ _ _ _ _ _ _ через _ _ _ _ _ _ _ _ _ _ сменяются _ _ _ _ _ _ _ _ _ _
Слайд 11
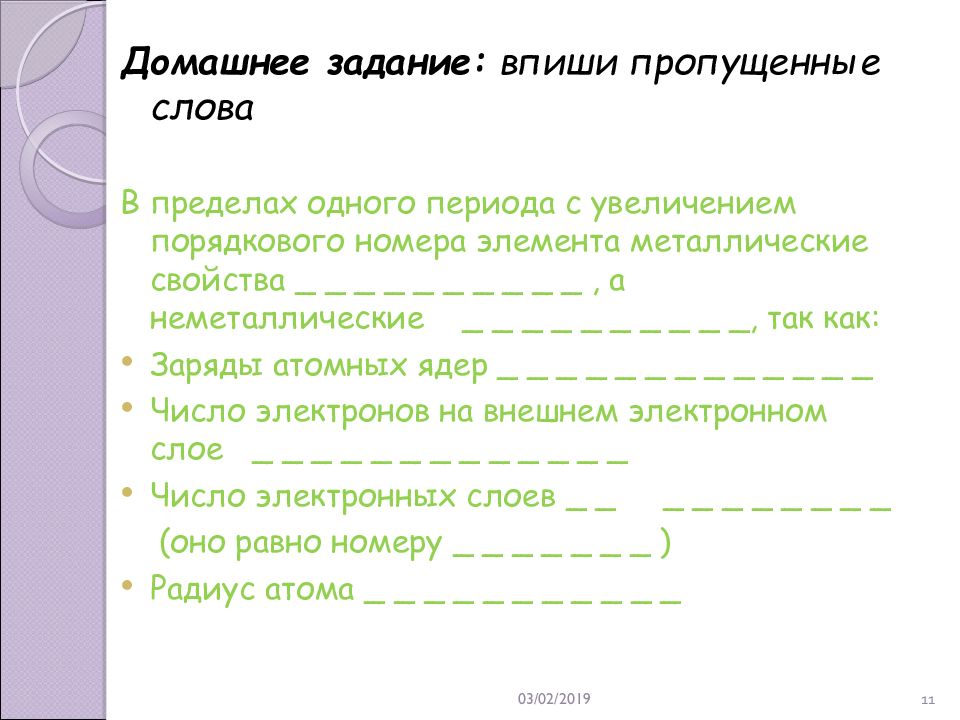
21.02.2019 11 Домашнее задание: впиши пропущенные слова В пределах одного периода с увеличением порядкового номера элемента металлические свойства _ _ _ _ _ _ _ _ _ _, а неметаллические _ _ _ _ _ _ _ _ _ _, так как: Заряды атомных ядер _ _ _ _ _ _ _ _ _ _ _ _ _ Число электронов на внешнем электронном слое _ _ _ _ _ _ _ _ _ _ _ _ _ Число электронных слоев _ _ _ _ _ _ _ _ _ _ (оно равно номеру _ _ _ _ _ _ _ ) Радиус атома _ _ _ _ _ _ _ _ _ _ _
Слайд 12
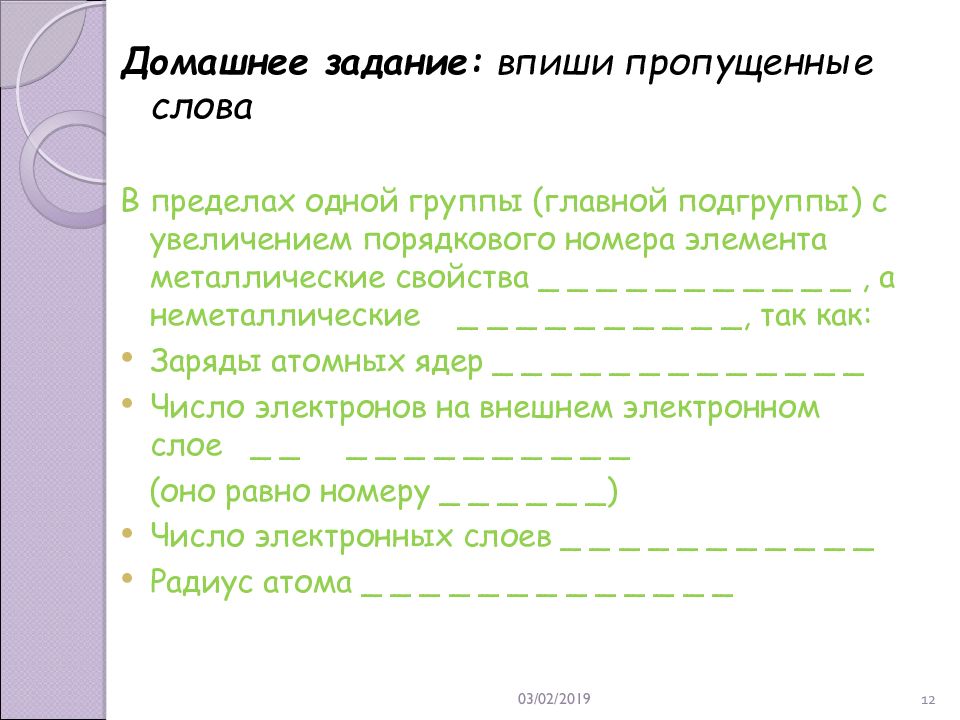
21.02.2019 12 Домашнее задание : впиши пропущенные слова В пределах одной группы (главной подгруппы) с увеличением порядкового номера элемента металлические свойства _ _ _ _ _ _ _ _ _ _ _, а неметаллические _ _ _ _ _ _ _ _ _ _, так как: Заряды атомных ядер _ _ _ _ _ _ _ _ _ _ _ _ _ Число электронов на внешнем электронном слое _ _ _ _ _ _ _ _ _ _ _ _ (оно равно номеру _ _ _ _ _ _) Число электронных слоев _ _ _ _ _ _ _ _ _ _ _ Радиус атома _ _ _ _ _ _ _ _ _ _ _ _ _
Слайд 13
21.02.2019 13 План характеристики химического элемента: 1. Положение в ПСХЭ: - Порядковый номер - Номер периода -Номер группы -Главная или побочная подгруппа 2. Строение атома: - Число электронов, протонов, нейтронов -Распределение электронов по уровням -Электронная формула 3. Прогноз свойств: - Металл или неметалл -Предполагаемые формулы и свойства соединений
Слайд 14
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ПО ПОЛОЖЕНИЮ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА 31 15 Р – 3 период, VA группа 31 15 Р · +15 ) 2 ) 8 ) 5 1 S ² 2S ² 2p⁶ 3S² 3p 3 СО = -3, +3, +5 Неметалл Высший оксид – Р 2 О 5 – кислотный Гидроксид – Н 3 РО 4 – фосфорная кислота Важнейшие соли – Са 3 (РО 4 ) 2 – фосфаты Летучее водородное соединение - РН 3 - фосфин
Слайд 15
21.02.2019 15 Задание: подчеркните символы химических элементов-металлов и расположите их в порядке ослабления металлических свойств: А) Cl; Al; S; Na; P; Mg; Si Б) Sn; As; N; Ge; C; Pb
Слайд 16
21.02.2019 16 Задание: подчеркните символы химических элементов-неметаллов и расположите их в порядке усиления неметаллических свойств: А) Li; F; N; Be; O; B; C Б) Bi; As; N; Sb; P
Слайд 17
21.02.2019 17 Задание. Расположи химические элементы в порядке возрастания - неметаллических свойств: а) P; S; Si. б) P; Cl; Mg. в) Ga; B; In. - металлических свойств: а) Ga; Al; In. б) Ga; B; Tl. в) P; Na; Al. ?
Слайд 18
21.02.2019 18 Задание: Сравните атомы поставив знаки ›, ‹ или = : А) заряд ядра: Al … Si; C…N; O…S; Mg…Ca Б) число электронных слоев: Al … Si; C…N; O…S; Mg…Ca B) Число электронов на внешнем слое: Al … Si; C…N; O…S; Mg…Ca Г) Радиус атома: Al … Si; C…N; O…S; Mg…Ca Д) Металлические свойства: Al … Si; C…N; O…S; Mg…Ca Е) Неметаллические свойства: Al … Si; C…N; O…S; Mg…Ca