Первый слайд презентации: СӨЖ Тақырыбы: Қазақстандағы аммиак өндірісі. КазАзот
Орындаған: Олжабекова Ж.Е Қабылдаған: Балгышева Б.Д
Слайд 2: Жоспар:
Кіріспе Аммиак Негізгі бөлім 1. Аммиактың физикалық, химиялық қасиеттері 2.Өнеркәсіпте алынуы 3.Қолданылуы 4.Қазақстандағы аммиак өндірісі. КазАзот Қорытынды Тест сұрақтары
Слайд 3
Аммиа ́ к — NH 3, сутегі нитриді; қалыпты жағдайда - өткір иісті; (ерітіндісі-мүсәтір спирті); түссіз газ; ауадан шамамен алғанда екі есе жеңіл; суда ерігіштігі жоғары - 1000 көлем суда 1200 көлем (0 °C кезінде) немесе 700 көлем (20 °C кезінде) NH 3 ериді.
Слайд 4: Физикалық қасиеті:
Аммиак — түссіз, өткір иісті, ауадан екі еседей жеңіл, тұншықтырғыш газ. Балқу температурасы - 77,8°С, қайнау температурасы - 33,4°С. Аммиак суда өте ерімтал, 1 көлем суда 700 көлем амм ериді. Аммиак суда ерігенде аммиак гидратын NH 3 ·H 2 O түзе Аммиактың судағы ерітіндісі аммиак суы немесе мусә спирті деген атпен медицинада қолданылады.
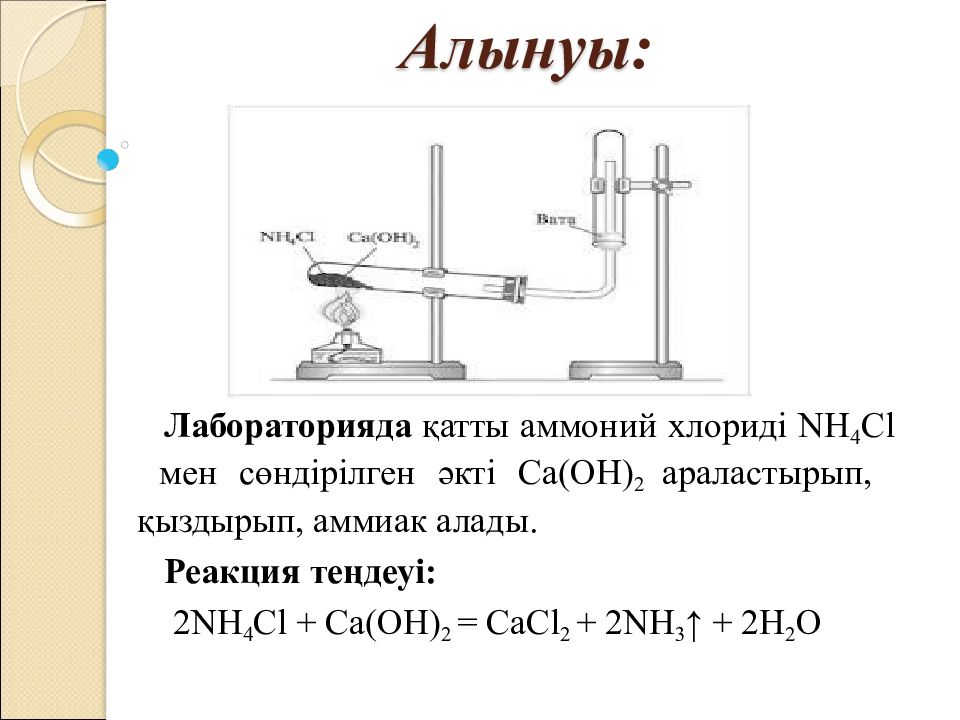
Слайд 5: Алынуы :
Лабораторияда қатты аммоний хлориді NH 4 Cl мен сөндірілген әкті Са(ОН) 2 араластырып, қыздырып, аммиак алады. Реакция теңдеуі: 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 ↑ + 2H 2 O
Слайд 6: Өнеркәсіпте алынуы:
Аммиак өнеркәсіптік жолмен азотты сутегімен қосу арқылы алады. Азот ауадан, сутегі судан алынады. Алғаш рет әдіс неміс химигі Фриц Габер қолданды. Аммиакты алудың өнеркәсіптік тәсілі Габер процесі деп аталады. Реакция көлемнің азаюы және жылу түрінде энергия бөліну арқылы өтеді: 3H 2 + N 2 → 2NH 3 + Q Реакция - қайтымды, сондықтан бірнеше шарттар сақталуы қажет. Жоғары қысым және төмен температура кезінде алынған аммиактың шығымы көп болады. Алайда төмен температуралар реакция жылдамдығын баяулатады, ал температураның көтерілуі кері реакция жылдамдығын арттырады.
Слайд 7
Химиялық қасиеттері: 4NH 3 + 5 O 2 → 4NO + 6H 2 O (kat: Pt, Cr 2 O 3 ) 2NH 3 + 3CuO → 3Cu + N 2 + 3H 2 O NH 3 + HCl → NH 4 Cl NH 3 + HNO 3 → NH 4 NO 3 Ag 2 O + 4NH 3 + H 2 O →2[Ag(NH 3 ) 2 ]OH 2NH 3 + 3Br 2 → N 2 + 6HBr NH 3 + H 2 O → NH 4 OH 2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO 4
Слайд 8: Қолданылуы
Аммиа к т ан минер а л д ы қ тыңай т қы ш т а р, д ә р і - дә р ме к тер, қопарылғыш заттар, азот қышқылы және нитраттар өндіріледі, аммоний тұздары алынады. Аммиак төменгі қысымда (0,7—0,8 мПа) оңай сұйылады, ол буланғанда көп жылу сіңіретін қасиетіне сәйкес тоңазытқыш қондырғыларда Аммоний реагент н и т р а т ы мен р е тінде қ о лданыл а ды. ам м он и й с у льф а т ы, ам м о н ий гидрофосфаттары тыңайтқыш ретінде кеңінен қолданылады. Аммоний хлориді : дәнекерлеуге, гальвани элементін даярлауға, ал аммоний гидрокарбонаты: кондитер, тамақ өнеркәсібінде қолданылады. Аммоний нитраты NH 4 NO 3 мен алюминий және көмірдің коспасынан аммонал деп а т а л а тын к опарылғыш з а т ж а са лынад ы.
Слайд 9: Қазақстандағы аммиак өндірісі. КазАзот
ҚазАзот АҚ – Қазақстанның кешенді өнеркәсіп орындарының бірі. Аммиак ( сутегі нитриді, NH3) — NH3 формуласы бар химиялық қоспа, қалыпты жағдайларда – өзіне тән өткір иісі бар түссіз газ. Аммиактың 10 % сулы ерітіндісі мүсәтір спирті ретінде белгілі. Техникалық сұйық аммиак – минералды тыңайтқыштарды және құрамында азот бар көптеген өнеркәсіптік заттектерді өндірудегі негізгі шикізат болып табылады. Ол химия өнеркәсібінің негізгі өнімдерінің бірі болып табылады. Оның дүниежүзілік жыл сайынғы өндіріс көлемі – 180 млн. тоннадан асады.
Слайд 11
КазАзоттың перспективалық агрохимиялық зерттеулері Минералдық тыңайтқыштардың Қазақстандағы әртүрлі ауылшаруашылық дақылдарының шығымдылығына әсерін талдауға және өсімдіктердің дұрыс минералдық қоректену жүйесін жасақтауға және химиялық өндірістің қоршаған ортаға әсерін барынша азайтуға бағытталған.
Слайд 12: Т ест
Аммиак молекуласының пішіні: A) кубті. Б) үшбұрышты B ) тетраэдрлі C) пирамидальді. D) жалпақ. E) октаэдрлі. Ж ) пирамида З) сегіз қырлы И) бипирамида NH3→NO→N2 тізбектегі азоттың тотығу дәрежесі: A) жоғарылайды. B) өзгермейді. C) төмендейді. D ) жоғарыдан, төмендейді. E) алдымен төмендейді, содан кейін жоғарылайды. Аммиактың өндірісте алынуы: A) N2+H2. B) NH4Cl+NaOH. C) NO2+H2. D) N2+H2O. E) NO+H2O. Аммиакқа тән емес физикалық қасиет: A) өзіне тән иісі бар. B) сұйықтық. C) ауадан жеңіл. D) суда жақсы ериді. E) түссіз газ Ж) иісі бар З) сұйық И) иісі өткір Аммиактың сутекпен салыстырғандағы тығыздығы: A) 4. B) 0,117. C) 6,5. D) 8,5. E) 17. Ж) 10 З)17/2 И) 23 Ж ) тікелей синтездеу З) тікелей әрекеттестіру И) азот пен сутекті тікелей әрекеттестіру
Слайд 13
6. Аммиактың судағы ерітіндісіндегі универсалды индикатор қағаздың түсін... өзгертеді. A) көкке. B) қызғылт сарыға. C) ал қызылға. D) қызылға. E ) сарыға. Ж) таңқурайға 7. Газ күйіндегі аммиакты анықтау әдісі: A ) известь суының түсінің лайлан у ы. B) лакмус қағазының күлгін түске боялуы. C) иісі бойынша. D) перманганат калийдің өз г е р уі. E) универсалды индикатордың түсінің қызаруы Ж) т үзілген иісі арқылы 8.Мүсәтір спирті дегеніміз: A) Құрғақ аммоний хлориді. Б) Өткір иісті B) Аммоний хлоридінің судағы ерітіндісі. C) Аммиактың судағы ерітіндісі. D) Аммоний сульфатының судағы ерітіндісі. E) Аммоний нитратының судағы ерітіндісі.. Ж) Аммиактың судағы ерітіндісі З) Өзіндік иісі бар 9.Азот қолданылмайтын сала: A) аммиак синтезі. B) азот қышқылы өндірісі. C) тереңдіктегі акваланг жұмысы. D) химиялық құбылыстағы инертті орта түрінде. E) суытқыш қондырғылар. Ж ) фосфор өндіруде З) техникада
Слайд 14
11.Аммиактың химиялық қасиетін көрсетіңіз : А) Аммиактың судағы ерітіндісі әлсіз негіздік қасиет көрсетеді Б) аммиак пен оттек ағынын тұтандырса, аммиак оңай жанады В) N 2 + 3 Н 2 ═ 2 N Н 3 С) N Н 3 +НСІ — N Н 4 СІ Д) 4N Н 3 + 3О 2 ═ 2 N 2 + 6 Н 2 О Е) Сумен әрекеттеспейді Ж) Активті емес З) Оттегімен әрекеттеспейді 12.Аммоний тұздары : А) құрамында аммоний ионы NH 4 + Б) қышқыл калдықтары болатын қатты В) кристалды күрделі заттар С) NH 4 Cl, (NH 4 ) 2 SO 4, NH 4 NO 3 Д) тұздардың бәрі суда жақсы ериді. Е) сұйық Ж) жай заттар З) органикалық заттар 10.Аммакты өнеркәсіпте синтездеу үшін қолданылатын катализатор: A ) платина. B) марганец оксиді. C) темір ұнтағы калий оксиді араласқан. D) никель. E) ванадий оксиді Ж) Fe+K.
Слайд 15
13.Аммоний тұздары қыздырғанда айрылады : А ) (N Н 4 ) 2 S О 4 ═ N Н 3 ↑ + N Н 4 Н S О 4 Б)( N Н 4 ) 3 РО 4 ═ 3 N Н 3 ↑ + Н 3 РО 4 В) N Н 4 N О 3 ═ N 2 О + 2Н 2 О С) (N Н 4 ) 2 S О 4 ═ 2 N Н 4 + + S О 4 2 Д) N Н 4 ОН ═ N Н 3 ↑ + Н 2 О Е) N Н 3 +НСІ — N Н 4 СІ Ж) N Н 3 +НОН — N Н 4 ОН З)Айырылмайды; 15) Аммиак өндірісте алынады : А) жай заттардан синтездеу Б) N 2 + 3 Н 2 ═ 2 N Н 3 В) 2 NН 4 ССI + Са (ОН) 2 ═ 2NН 3 ↑ + 2Н 2 О +СаСI 2 С) алынбайды; Д) күрделі заттарды әсер ету; Е) тікелей әсер ету Ж) тұз қышқылымен әсер ету З) тек зертханада 14. Қолданылуы: А) N Н 4 СІ – металдарды дәнекерлеу үшін, Б)( N Н 4 ) 2 S О 4, N Н 4 N О 3 – ауылшаруашылығында тыңайтқыш ретінде жұмсалады. В)( N Н 4 ) 2 НСО 3 – кондитер өнеркәсібінде қамырды көтеру үшін С) Қағаз өндірісінде Д) Ірі өнеркәсіпте Е) Бұйымдар жасауда Ж) Дәнекерлеуде З) Медицинада
Слайд 16: Тест жауаптары:
1. С,Ж 2. С,Д 3. А,З,И 4. В,З 5. Д,З 6. С,Ж 7. С,Ж 8. Б,С,Ж 9.С,Ж,З 10.С,Ж 11.С,В,Д 12. А,Б,В 13.А,Б 14.А,Б,В 15.А,Б,Е
Последний слайд презентации: СӨЖ Тақырыбы: Қазақстандағы аммиак өндірісі. КазАзот
............ қалыпты жағдайда - өткір иісті (ерітіндісі-мүсәтір спирті) түссіз газ. Тоңазытқыш техникада R717 деген атауға ие, мұндағы R — Refrigerant (хладагент), 7 — …….………., 17- молекулалық массасы. Аммоний нитраты мен аммоний сульфаты, аммоний гидрофосфаттары ……………… ретінде кеңінен қолданылады. .................... дәнекерлеуге, гальвани элементін даярлауға қолданылады. Аммиак молекуласының пішіні ……………….. болып келеді. Аммиактың сутекпен салыстырғандағы тығыздығы ……….... болады. Лабораторияда қатты аммоний хлориді NH 4 Cl мен сөндірілген әкті Са(ОН) 2 араластырып, қыздырып, …….…………… алады. Алғаш рет әдіс неміс химигі Фриц Габер қолданды. Аммиакты алудың өнеркәсіптік тәсілі …………….. процесі деп аталады. Аммоний нитраты NH 4 NO 3 мен алюминий және көмірдің коспасынан ………………. деп аталатын копарылғыш зат жасалынады.