Первый слайд презентации: Стрептоцид (сульфаниламид)
Выполнили: Нурхалыкова М Сулейманова Г
Слайд 2
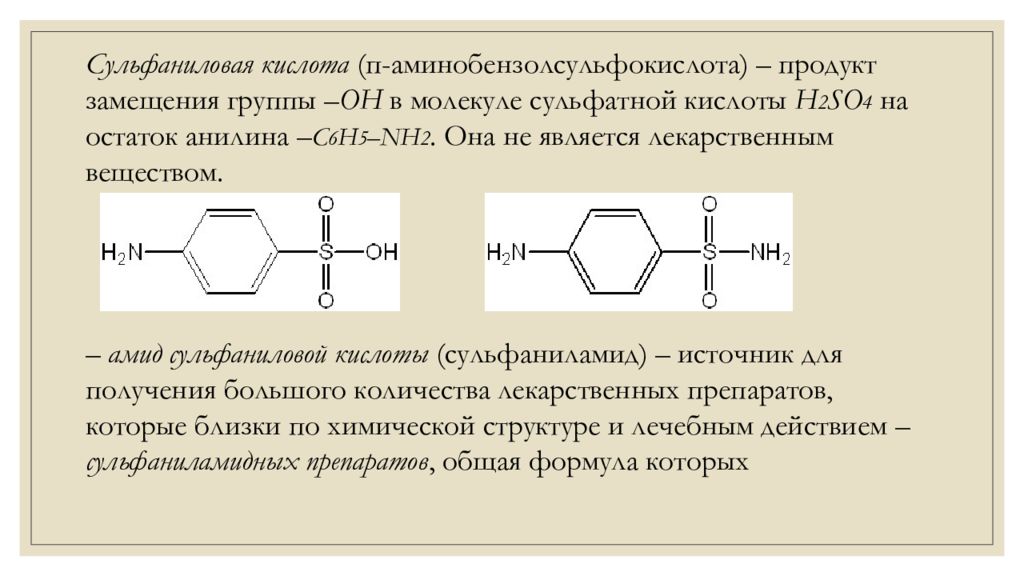
Сульфаниловая кислота (п- аминобензолсульфокислота ) – продукт замещения группы –ОН в молекуле сульфатной кислоты H 2 SO 4 на остаток анилина – C 6 H 5 –NH 2. Она не является лекарственным веществом. – амид сульфаниловой кислоты (сульфаниламид) – источник для получения большого количества лекарственных препаратов, которые близки по химической структуре и лечебным действием – сульфаниламидных препаратов, общая формула которых
Слайд 3
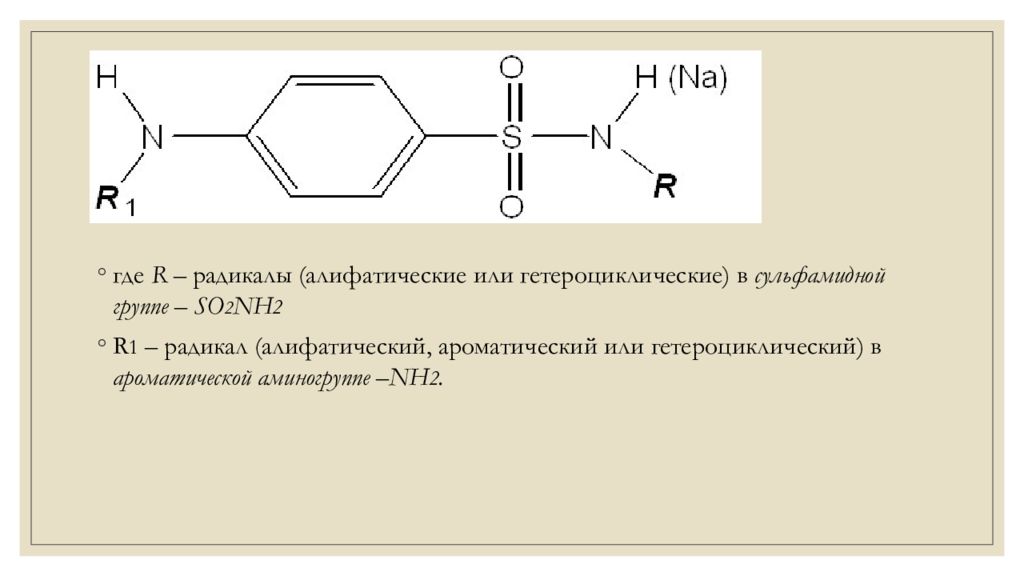
где R – радикалы (алифатические или гетероциклические) в сульфамидной группе – SO 2 NH 2 R 1 – радикал (алифатический, ароматический или гетероциклический) в ароматической аминогруппе –NH 2.
Слайд 4
Появление сульфаниламидов относится к 30-х годам XX ст. в связи с поиском красителей для текстильной промышленности. В 1908 г. Гельмо синтезировал п- аминобензолсульфамид H 2 N–C 6 H 4 –SO 2 –NH 2 (вошел потом в медицинскую практику под названием белый стрептоцид) и на его основе получали азокрасители для текстильной промышленности, не подозревая его биологической активности. Лечебный эффект таких красителей дал толчок для развития работ в этом направлении. Этому содействовало и то, что в 30-х годах ХХ ст. была сильная пандемия крупозного воспаления легких, особенно в странах Азии (Индия, Индонезия и др.)
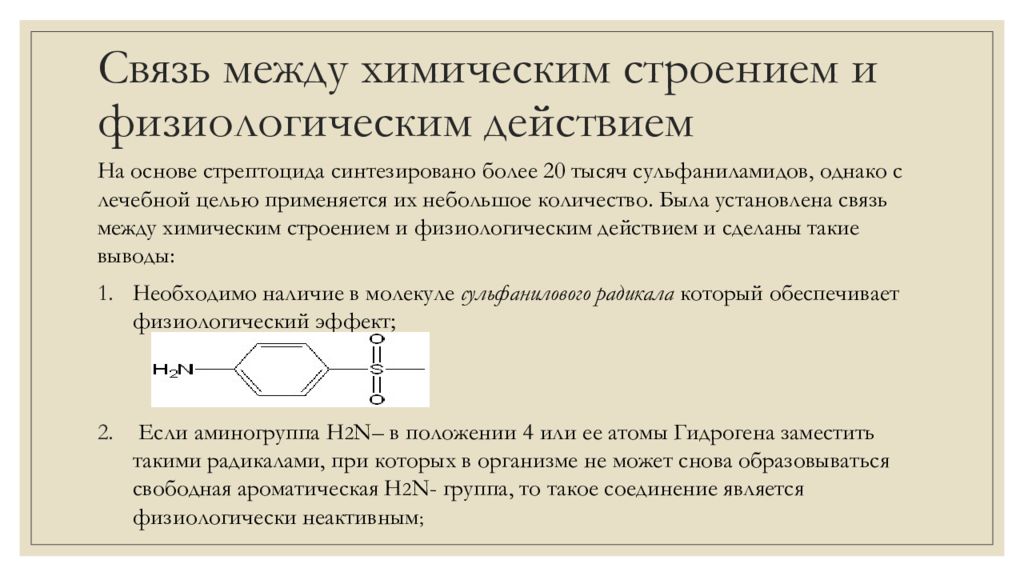
На основе стрептоцида синтезировано более 20 тысяч сульфаниламидов, однако с лечебной целью применяется их небольшое количество. Была установлена связь между химическим строением и физиологическим действием и сделаны такие выводы: Необходимо наличие в молекуле сульфанилового радикала который обеспечивает физиологический эффект; Если аминогруппа H 2 N – в положении 4 или ее атомы Гидрогена заместить такими радикалами, при которых в организме не может снова образовываться свободная ароматическая H 2 N- группа, то такое соединение является физиологически неактивным ;
Слайд 6
3. Перемещение H 2 N-группы из положения 4 в положения 2 или 3 бензольного ядра приводит к полной потере активности; 4. Введение в бензольное ядро дополнительных заместителей разрушает или значительно уменьшает активность соединения. 5. При замещении Гидрогена сульфамидной группы –SO 2 –NH 2 различными радикалами физиологическое действие увеличивается или уменьшается в зависимости от характера радикала. Лучшие препараты по активности можно получить, если эти субституенты имитируют некоторые составные части витаминов. Так, в состав витамина В 1 (тиамина) входят тиазоловый и пиримидиновый циклы, поэтому такие сульфаниламиды (норсульфазол, сульфазин ) более активны по сравнению с незамещенным сульфаниламидом.
Слайд 7
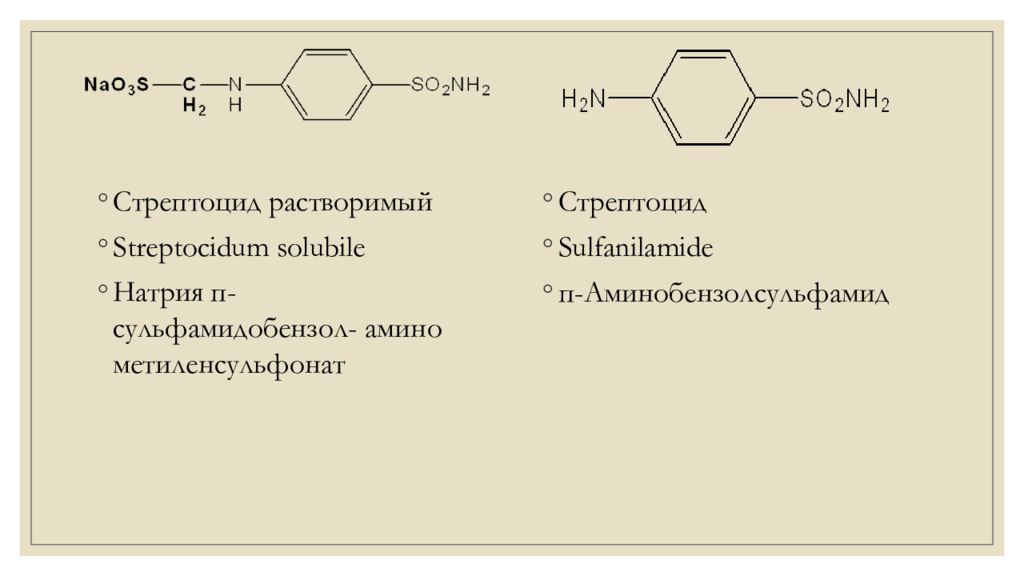
Стрептоцид растворимый Streptocidum solubile Натрия п- сульфамидобензол - амино метиленсульфонат Стрептоцид Sulfanilamide п- Аминобензолсульфамид
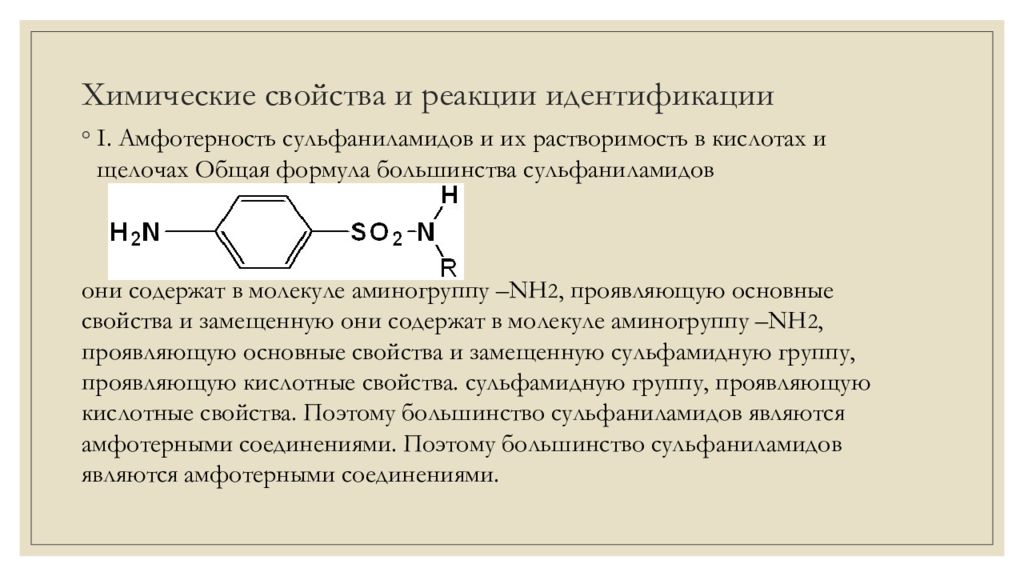
І. Амфотерность сульфаниламидов и их растворимость в кислотах и щелочах Общая формула большинства сульфаниламидов они содержат в молекуле аминогруппу – NH 2, проявляющую основные свойства и замещенную они содержат в молекуле аминогруппу – NH 2, проявляющую основные свойства и замещенную сульфамидную группу, проявляющую кислотные свойства. сульфамидную группу, проявляющую кислотные свойства. Поэтому большинство сульфаниламидов являются амфотерными соединениями. Поэтому большинство сульфаниламидов являются амфотерными соединениями.
Слайд 9
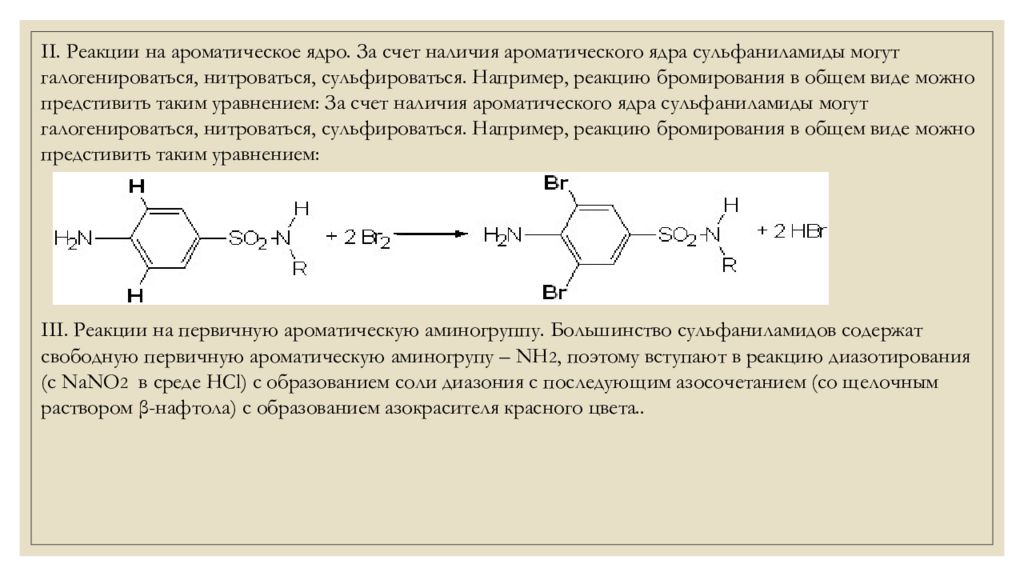
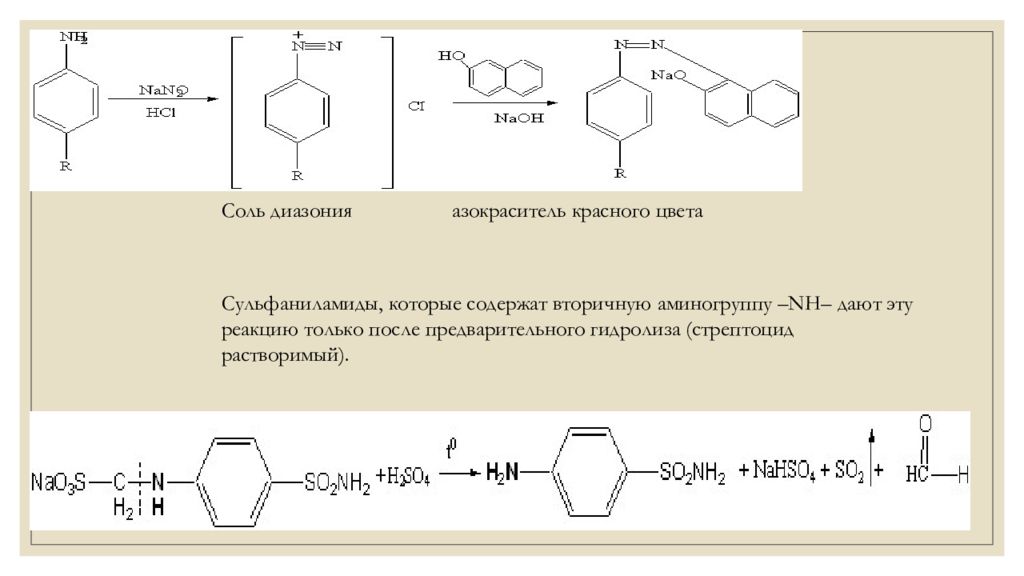
ІІ. Реакции на ароматическое ядро. За счет наличия ароматического ядра сульфаниламиды могут галогенироваться, нитроваться, сульфироваться. Например, реакцию бромирования в общем виде можно предстивить таким уравнением: За счет наличия ароматического ядра сульфаниламиды могут галогенироваться, нитроваться, сульфироваться. Например, реакцию бромирования в общем виде можно предстивить таким уравнением : ІІІ. Реакции на первичную ароматическую аминогруппу. Большинство сульфаниламидов содержат свободную первичную ароматическую аминогрупу – NH 2, поэтому вступают в реакцию диазотирования (с NaNO 2 в среде НСl ) с образованием соли диазония с последующим азосочетанием (со щелочным раствором β-нафтола) с образованием азокрасителя красного цвета..
Слайд 10
Соль диазония азокраситель красного цвета Сульфаниламиды, которые содержат вторичную аминогруппу –NH– дают эту реакцию только после предварительного гидролиза (стрептоцид растворимый).
Слайд 11: IV. Выявление Сульфура в молекуле сульфаниламида
Наличие Сульфура в молекулах сульфаниламидов идентифицируют после минерализации субстанции путем окисления концентрированной HNO 3 или сплавления с 10-кратным количеством KNO 3. Образующиеся при этом сульфат-ионы SO4 2 – выявляют с помощью реакция с раствором барий хлорида BaCl 2 в среде разбавленной хлоридной кислоты HCl. Для этого остаток после минерализации растворяют в воде и фильтруют. К 5 мл фильтрата прибавляют 1 мл кислоты хлоридной разбавленной Р и 1 мл раствора барий хлорида Р1 BaCl 2 ; образуется белый осадок, который нерастворим ни в минеральных кислотах, ни в щелочах: SO 4 2 – + Ba 2 + BaSO 4
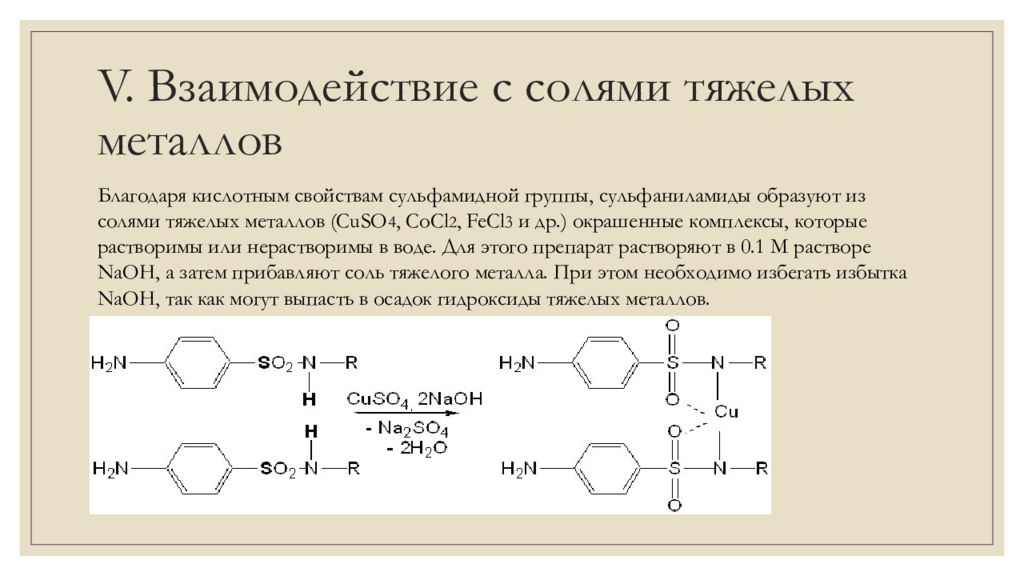
Благодаря кислотным свойствам сульфамидной группы, сульфаниламиды образуют из солями тяжелых металлов ( CuSO 4, CoCl 2, FeCl 3 и др.) окрашенные комплексы, которые растворимы или нерастворимы в воде. Для этого препарат растворяют в 0.1 М растворе NaOH, а затем прибавляют соль тяжелого металла. При этом необходимо избегать избытка NaOH, так как могут выпасть в осадок гидроксиды тяжелых металлов.
Слайд 13: Количественное определение сульфаниламидов
Нитритометрия. Этот метод можно использовать для количественного определения большинства сульфа - ниламидов, в молекулах которых содержится свободная ароматическая аминогруппа: стрептоцида. В основе определения лежит диазотирование свободной ароматической аминогруппы ( Em = M.м.):
Слайд 14
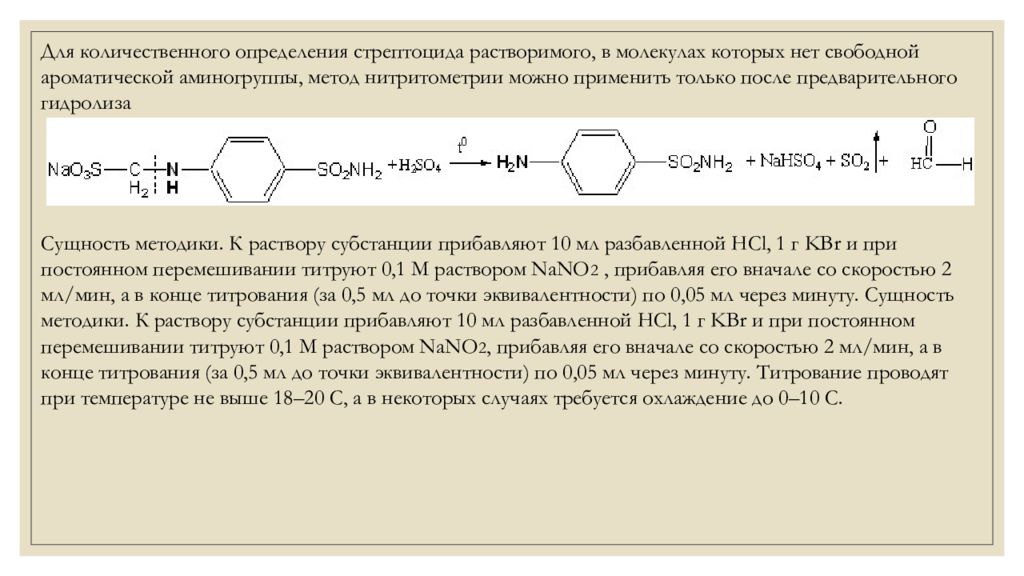
Для количественного определения стрептоцида растворимого, в молекулах которых нет свободной ароматической аминогруппы, метод нитритометрии можно применить только после предварительного гидролиза Сущность методики. К раствору субстанции прибавляют 10 мл разбавленной HCl, 1 г KBr и при постоянном перемешивании титруют 0,1 М раствором NaNO 2, прибавляя его вначале со скоростью 2 мл/мин, а в конце титрования (за 0,5 мл до точки эквивалентности) по 0,05 мл через минуту. Сущность методики. К раствору субстанции прибавляют 10 мл разбавленной HCl, 1 г KBr и при постоянном перемешивании титруют 0,1 М раствором NaNO 2, прибавляя его вначале со скоростью 2 мл/мин, а в конце титрования (за 0,5 мл до точки эквивалентности) по 0,05 мл через минуту. Титрование проводят при температуре не выше 18–20 С, а в некоторых случаях требуется охлаждение до 0–10 С.
Слайд 15
Точку эквивалентности определяют с помощью внутренних индикаторов ( тропеолина 00 – до желтого окрашивания, смеси тропеолина 00 и метиленового синего (4 капли и 2 капли) – переход красно-фиолетового окрашивания до голубого, нейтрального красного – до синего окрашивания), наружных индикаторов (йодкрахмальной бумаги – до синего окрашивания) или потенциометрически (без применения и ндикаторов). Параллельно проводят контрольный опыт. Избыточная капля титранта NaNO 2 реагирует с КI йодкрахмальной ( йодидкрахмальной ) бумаги в среде HCl с образованием йода I 2 и потому йодкрахмальная бумага синеет. Избыточная капля титранта NaNO 2 реагирует с КI йодкрахмальной ( йодидкрахмальной ) бумаги в среде HCl с образованием йода I 2 и потому йодкрахмальная бумага синеет. 2NaNO 2 + 2KI + 4HCl I 2 + 2NO + 2KCl + 2NaCl + 2H 2 О При использовании индикаторов титрование обычно проводят 3 раза первое титрование – пробное второе – медленное прибавление титранта NaNO 2, особенно вблизи точки эквивалентности третье – «слепая» проба.
Слайд 16: Броматометрия, обратное титрование, с йодометрическим окончанием
Определенный обьем аликвоты исследуемого раствора субстанции помещают в колбу с притертой стеклянной пробкой, прибавляют избыток стандартного раствора калий бромата КBrO 3, кристаллический калий бромид KBr, подкисляют кислотой хлоридной Р HCl (или сульфатной H 2 SO 4 ), закрывают пробкой и оставляют на 15 мин, периодически перемешивая KBrO 3 + 5KBr + 6HCl 3Br 2 + 6KCl + 3H 2 O Выделившийся бром Br 2 реагирует с субстанцией сульфаниламида (реакция на бензеновое кольцо) с образованием дибромпроизводного :
Слайд 17
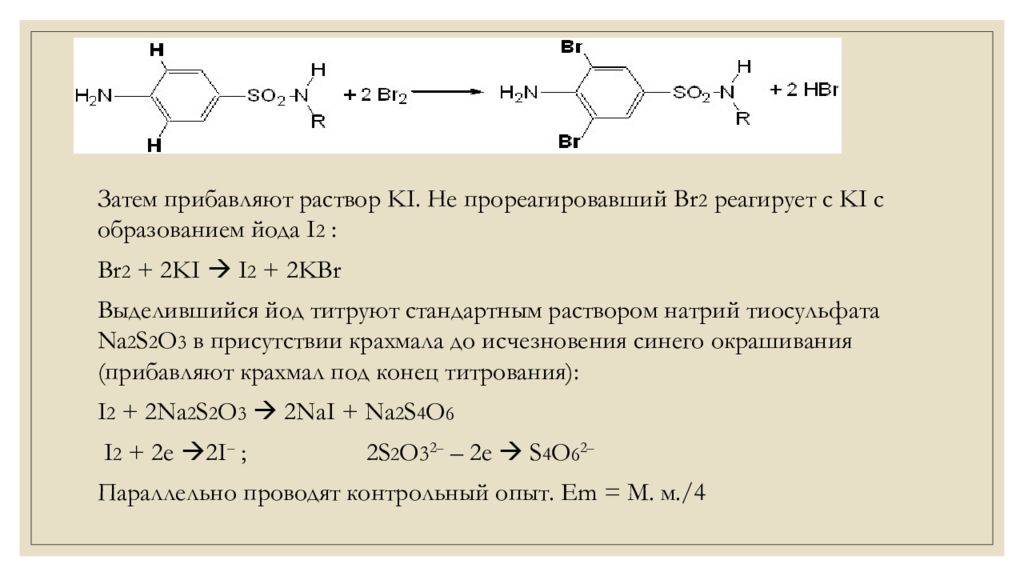
Затем прибавляют раствор KI. Не прореагировавший Br 2 реагирует с KI с образованием й ода I 2 : Br 2 + 2KI I 2 + 2KBr Выделившийся йод титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 в присутствии крахмала до исчезновения синего окрашивания (прибавляют крахмал под конец титрования): I 2 + 2Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 I 2 + 2е 2I – ; 2S 2 O 3 2 – – 2е S 4 O 6 2 – Параллельно проводят контрольный опыт. Еm = М. м./4
Слайд 18
Метод Кьельдаля (классический) – определение Нитрогена в препарате. С этой целью субстанцию минерализуют кипячением в специальном приборе в присутствии K 2 SO 4, CuSO 4 и концентрированной сульфатной кислоты H 2 SO 4. При этом Нитроген переходит в аммоний гидрогенсульфат NH 4 HSO 4, который при взаимодействии со щелочью NaOH образует аммиак NH 3 : NH 4 HSO 4 + 2NaOH NH 3 + Na 2 SO 4 + 2H 2 O Полученный аммиак NH 3 отгоняют в колбу-приемник с ортоборатной (борной) кислотой H 3 B O 3 : NH 3 + H 3 BO 3 NH 4 BO 2 + H 2 O 2NH 3 + 4H 3 BO 3 (NH 4 ) 2 B 4 O 7 + 5H 2 O Образовавшиеся соли (метаборат NH 4 BO 2 и тетраборат аммония ( NH 4 ) 2 B 4 O 7 ) титруют стандартным раствором хлоридной кислоты HCl в присутствии смешанного индикатора (смесь метилового красного и метиленового синего (2:1 ):
Слайд 19
NH 4 BO 2 + HCl + H 2 O NH 4 Cl + H 3 BO 3 (NH 4 ) 2 B 4 O 7 + 2HCl + 5H2O 2NH 4 Cl + 4H 3 BO 3 Эквивалентная масса препарата зависит от числа атомов Нитрогена в молекуле субстанции. Хранение. Список сильнодействующих веществ. В плотно укопоренном контейнере, в сухом, прохладном, защищенном от света месте.
Слайд 20: Применение. Химиотерапевтические антибактериальные средства
Сульфаниламиды оказывают бактериостатическое действие, которое связано с нарушением образования микроорганизмами необходимых для их развития ростовых факторов – фолиевой и дигидрофолиевой кислот и других веществ, в молекулу которых входит п- аминобензойная кислота (ПАБК). Сульфаниламиды, которые по строению напоминают ПАБК, являются ее имитаторами, то есть используются микробной клеткой вместо ПАБК и тем самым нарушают в ней обменные процессы. Действуют на стрепто -, пневмо -, стафило - и менингококки, кишечную палочку и поэтому широко применяются для лечения инфекционных заболеваний, вызванных этими возбудителями. Для достижения терапевтического эффекта сульфаниламиды необходимо принимать в дозах, достаточных для предупреждения использования микроорганизмами ПАБК, содержащейся в таканях. При недостаточных дозах или слишком раннем прекращении лечения возможно появление устойчивых штаммов возбудителей, не поддающихся в дальнейшем действию сульфаниламидов. Необходимо учитывать, что некоторые препараты, в молекулу которых входит остаток ПАБК (например, новокаин), могут оказывать выраженное антисульфа - ниламидное действие. Многие сульфаниламидные препараты (стрептоцид, норсульфазол, сульфазин, сульфадимезин, сульфа - пиридазин, сульфадиметоксин и др.) относительно легко всасываются и быстро накапливаются в крови и органах в бактериостатических концентрациях и поэтому применяются для лечения различных инфекционных болезней.
Слайд 21
Скорость выведения из организма в значительной мере определяет величину дозы и частоту приема препарата. Плохо всасывающиеся препараты можно назначать одновременно с хорошо всасывающимися. Сульфаниламиды можно комбинировать с антибиотиками При приеме сульфаниламидов могут наблюдаться аллергические реакции и побочные явления: тошнота, рвота, дерматиты, нарушения функции почек. Вследствие плохой растворимости сульфаниламидов и их ацетильных производных (особенно в кислой моче), могут образовываться в почках кристаллы, которые могут закупорить мочевые пути. В связи с медленным выделением из организма возможно кумулирование побочных явлений (диспепсические явления, изменения крови, аллергические реакции). Поэтому рекомендуется принимать эти препараты только по предписанию врача. Для предупреждения указанных осложнений при приеме сульфаниламидов больные должны получать обильное щелочное питье.
Последний слайд презентации: Стрептоцид (сульфаниламид)
Противопоказано применение указанных препаратов больным с токсико-аллергическими реакциями, возникающими при приеме какого-либо сульфаниламида. Формы выпуска: порошок, таблетки по 0,3 г и 0,5 г ( стертоцид ), мазь и линимент стрептоцида и стрептоцида растворимого 5 %.