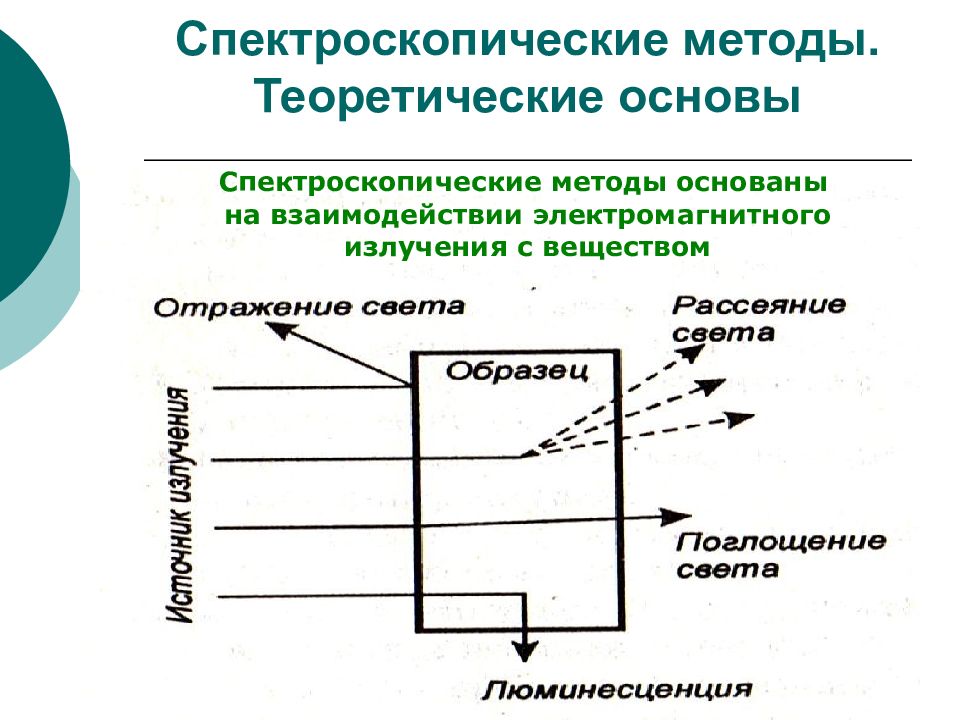
Спектроскопические методы основаны на взаимодействии электромагнитного излучения с веществом
Что взаимодействует со светом: Атомная спектроскопия (атомы). Молекулярная спектроскопия (молекулы). Что происходит со светом: Эмиссионные (испускание). Абсорбционные (поглощение). Люминесцентные (свечение). Другие световые взаимодействия: Другие оптические методы (рассеивание, преломление, вращение и др.).
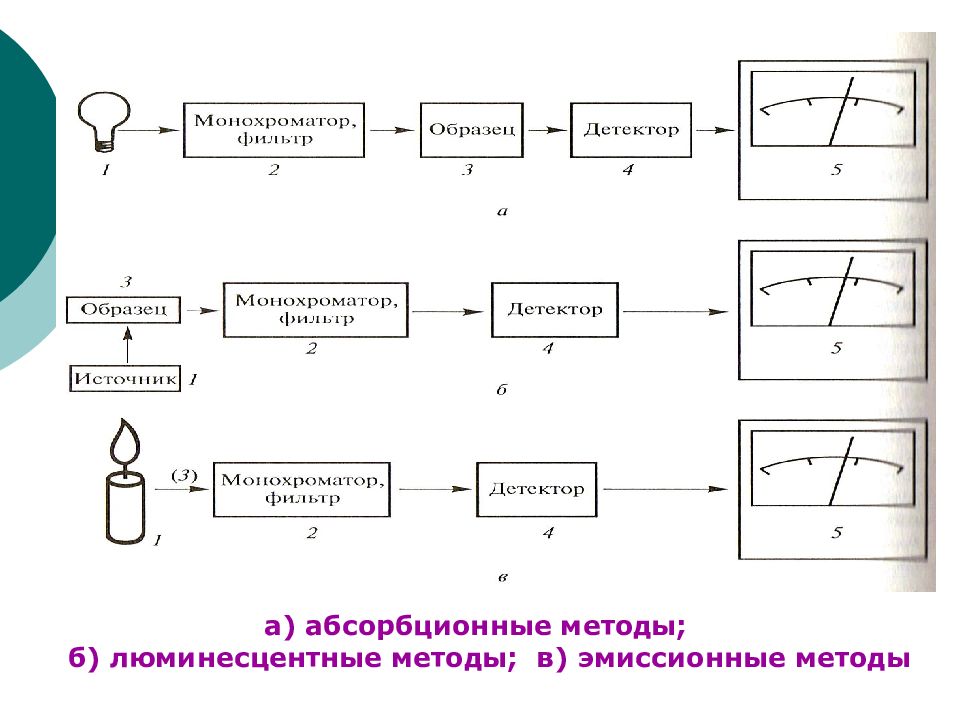
Слайд 5: Основные узлы спектральных приборов
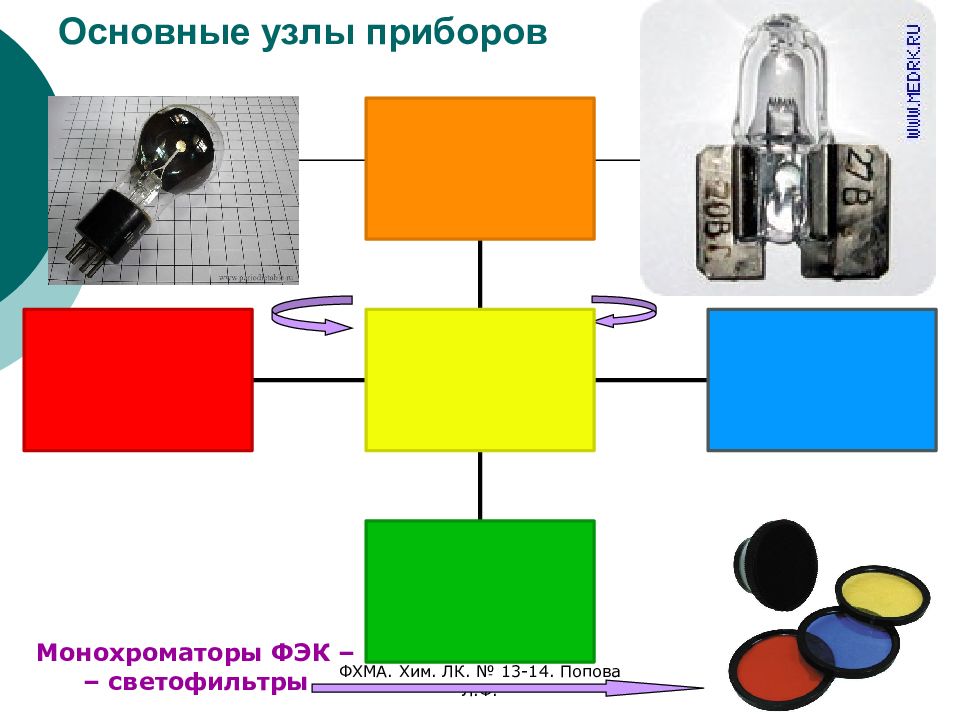
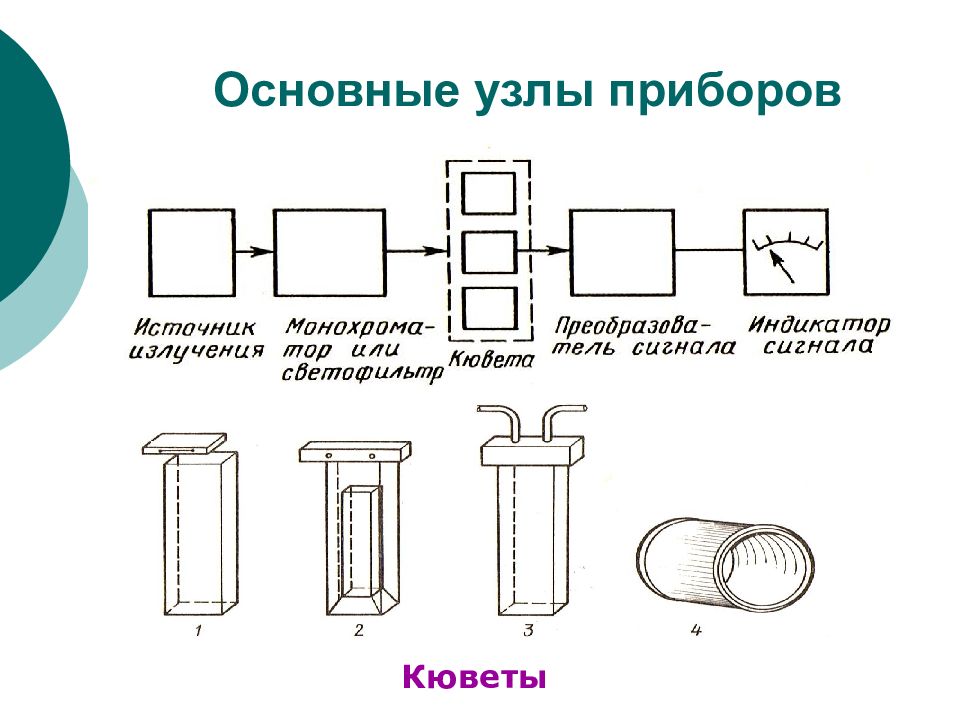
Источник излучения (различные лампы). Монохроматоры: Бездисперсионные (светофильтры): абсорбционные; интерференционные. Дисперсионные (собственно монохроматоры): призмы; дифракционные решетки (пропускающая, отражательная). Отделение для установки исследуемого образца. Детекторы (фотографии, фотоэлементы, счетчики фотонов). Преобразователи сигнала (самописцы, компьютеры).
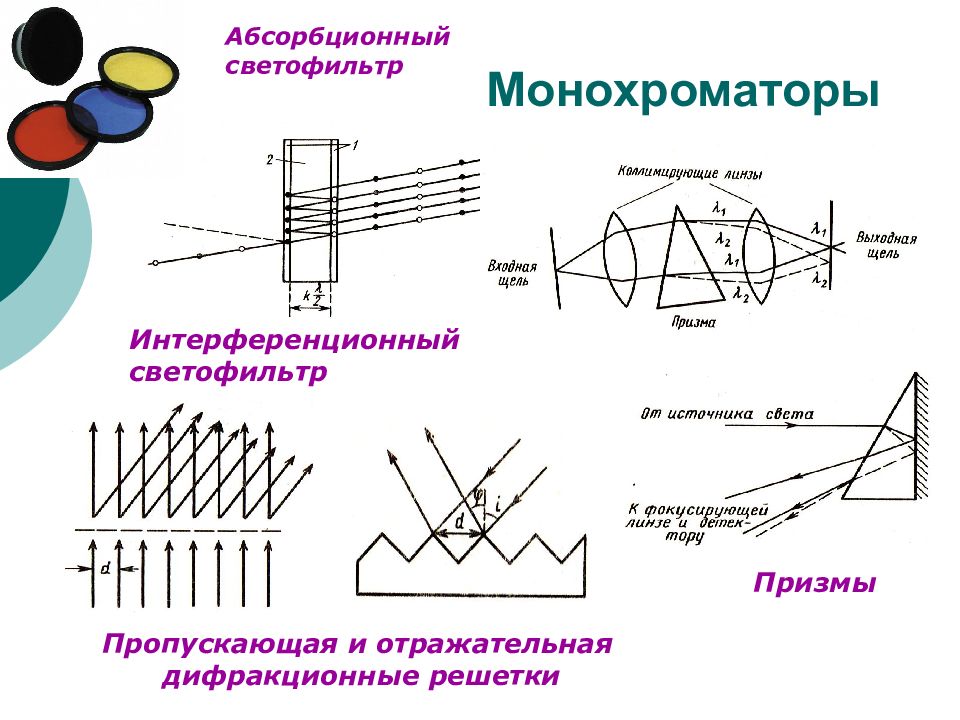
Слайд 6: Монохроматоры
Призмы Интерференционный светофильтр Пропускающая и отражательная дифракционные решетки Абсорбционный светофильтр
Слайд 9: Молекулярная спектроскопия
Классификация методов: Эмиссионная (не существует) Почему? Абсорбционная : Спектрофотомерия (в ВС и УФ); ИК-спектроскопия. Люминесцентный анализ (флуориметрия). Турбидиметрия и нефелометрия. Поляриметрия. Рефрактометрия.
Слайд 10: Молекулярная абсорбционная спектроскопия
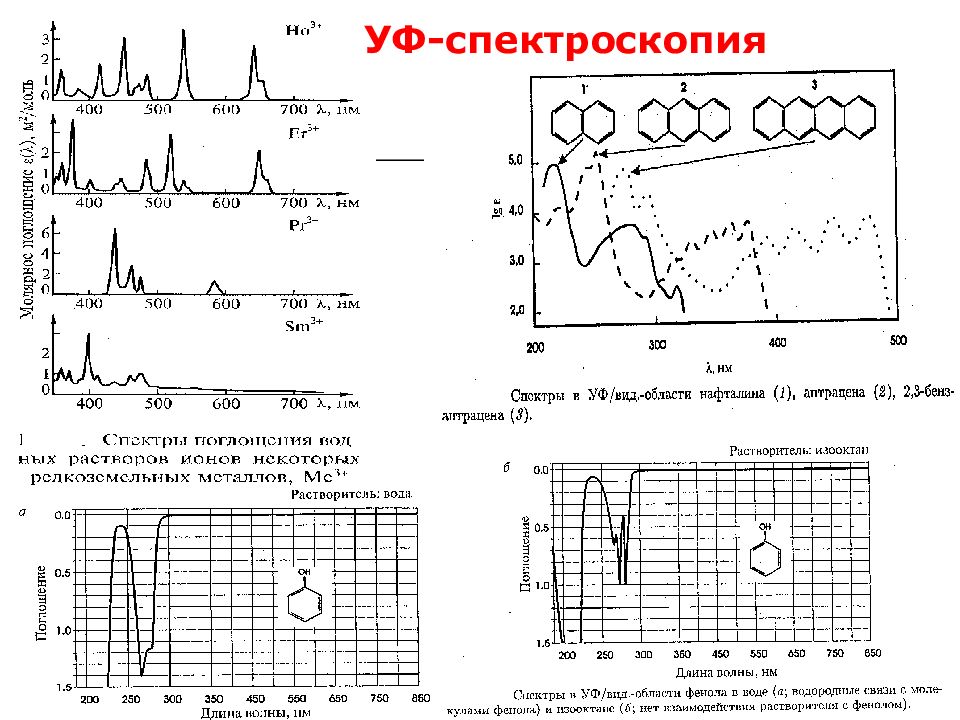
Молекулярная абсорбционная спектроскопия основана на энергетических и колебательных переходах внешних (валентных) электронов в молекулах. Используется излучение УФ- и видимой области оптического диапазона – это спектрофотомерия. Используется излучение ИК-области оптического диапазона – это ИК-спектроскопия.
Слайд 11: Спектрофотометрия
Основана на: законе Бугера-Ламберта-Бера: А = ε ·l·C Законе аддитивности оптических плотностей: А = ε 1 ·l·C 1 + ε 2 ·l·C 2 +…. Анализ окрашенных растворов – в ВС (фотоколориметрия); Анализ неокрашенных растворов, способных поглощать ультрафиолетовый свет – в УФ.
Слайд 14: Основные узлы приборов
ФХМА. Хим. ЛК. № 13-14. Попова Л.Ф. 14 Основные узлы приборов Монохроматоры ФЭК – – светофильтры
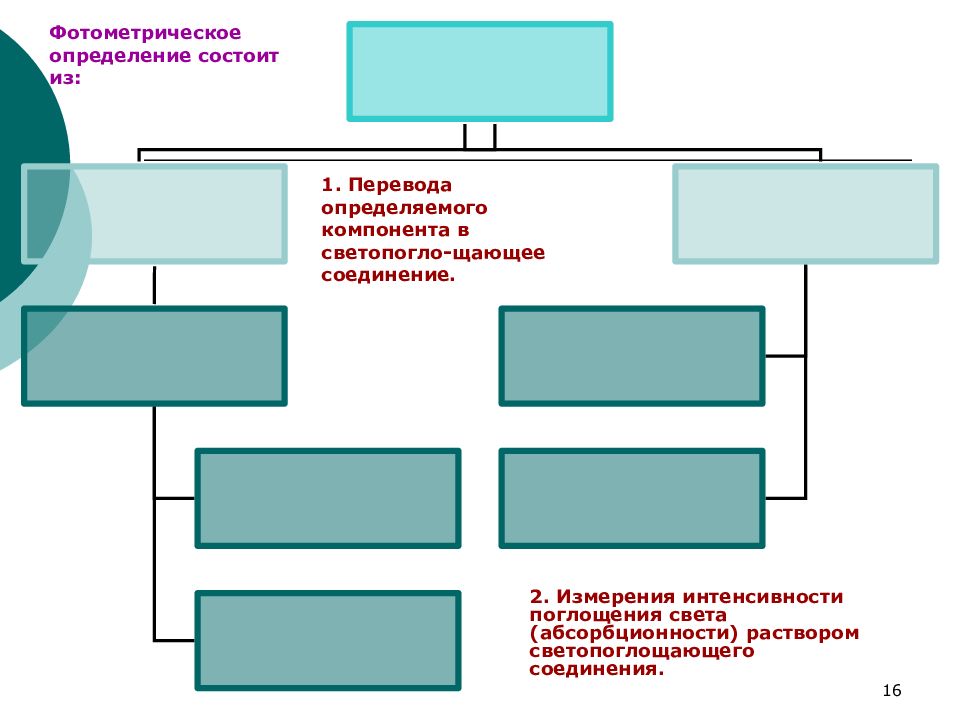
Слайд 16
16 Фотометрическое определение состоит из: 1. Перевода определяемого компонента в светопогло-щающее соединение. 2. Измерения интенсивности поглощения света (абсорбционности) раствором светопоглощающего соединения.
Слайд 17: Колориметрия (ФЭК)
ФХМА. Хим. ЛК. № 13-14. Попова Л.Ф. 17 Это анализ окрашенных растворов. Окраска вещества связана с избирательным светопоглощением ВС: не поглощает свет – бесцветно; поглощает весь видимый спектр – черное; поглощает ВС избирательно – окрашено; окраска раствора– непоглощенный (дополнительный цвет) спектр ВС. Колориметрия (ФЭК)
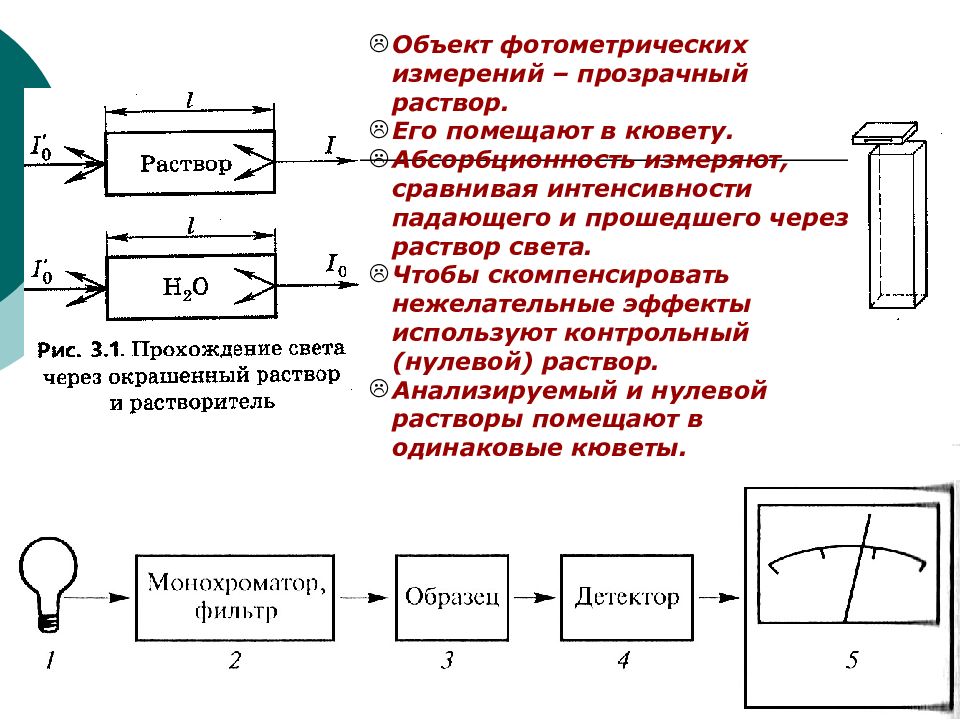
Слайд 18
ФХМА. Хим. ЛК. № 13-14. Попова Л.Ф. 18 Объект фотометрических измерений – прозрачный раствор. Его помещают в кювету. Абсорбционность измеряют, сравнивая интенсивности падающего и прошедшего через раствор света. Чтобы скомпенсировать нежелательные эффекты используют контрольный (нулевой) раствор. Анализируемый и нулевой растворы помещают в одинаковые кюветы.
Слайд 19
ФХМА. Хим. ЛК. № 13-14. Попова Л.Ф. 19 Способы получения фотометрируемого и нулевого растворов в колориметрии: Растворением цветного вещества в подходящем растворителе (дитизон в С Cl 4, KMnO 4 в H 2 O ). Нулевой раствор – чистый растворитель. В ходе химической реакции ( Fe 3+ + 3SCN - = [Fe(SCN) 3 ] ). Нулевой раствор – все компоненты, участвующие в химической реакции, кроме определяемого.
ФХМА. Хим. ЛК. № 13-14. Попова Л.Ф. 20 Выбор условий колориметрических определений Основные условия : Рабочая длина волны (светофильтр). Рабочая кювета. Для подбора условий используется стандартный раствор с С max определяемого компонента в выбранном методе (из него получают фотометрируемый раствор) и контрольный (нулевой) раствор. Как их приготовить? Выбор длины волны : поместить в кюветное отделение стандартный и нулевой растворы в кюветах на 1,0 см. Измерить А на всех длинах волн (светофильтрах). Построить кривую светопоглощения А = ƒ ( λ ). Max на кривой – рабочая длина волны. Выбор кюветы : проводится на выбранной ранее рабочей длине волны. Оптимальная А для стандартного раствора с С max составляет 0,6-0,8. Если в кювете на 1 см. А < 0,6 нужно взять большую кювету, если > 0,8 – меньшую.
Слайд 21: Ответьте на вопросы:
Как получить фотометрируемое соединение? Сколько Вам известно способов? Что такое контрольный (нулевой) раствор? Что может быть взято в качестве контрольного раствора? В каком случае? Как правильно подобрать светофильтр или рабочую длину волны? Как правильно подобрать рабочую кювету? Что такое способ калибровочного графика? Какова методика построения калибровочного графика в фотометрии?
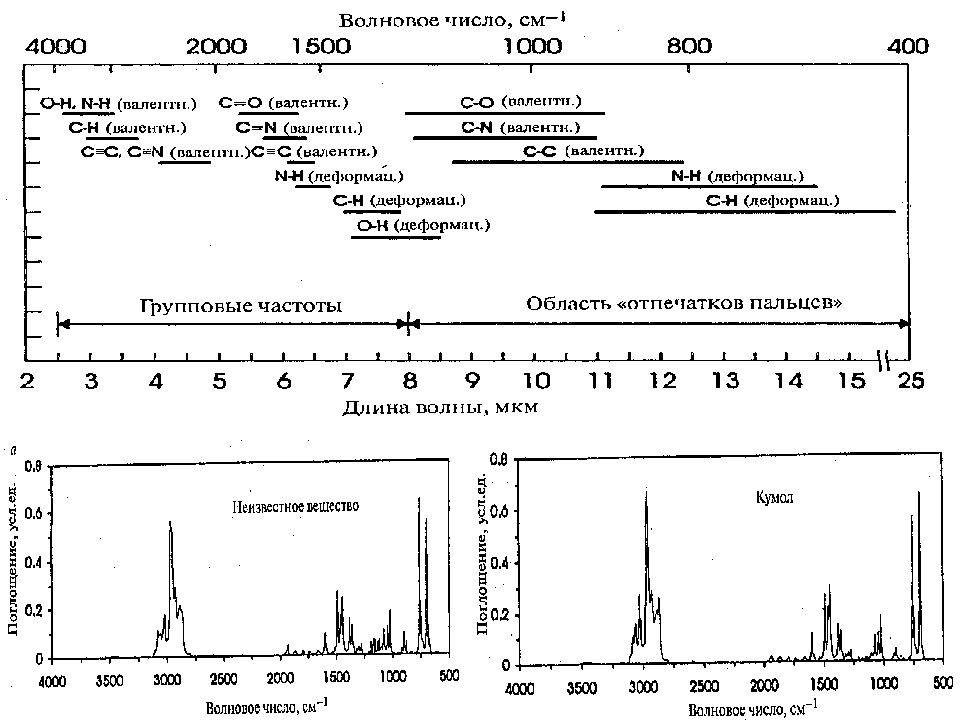
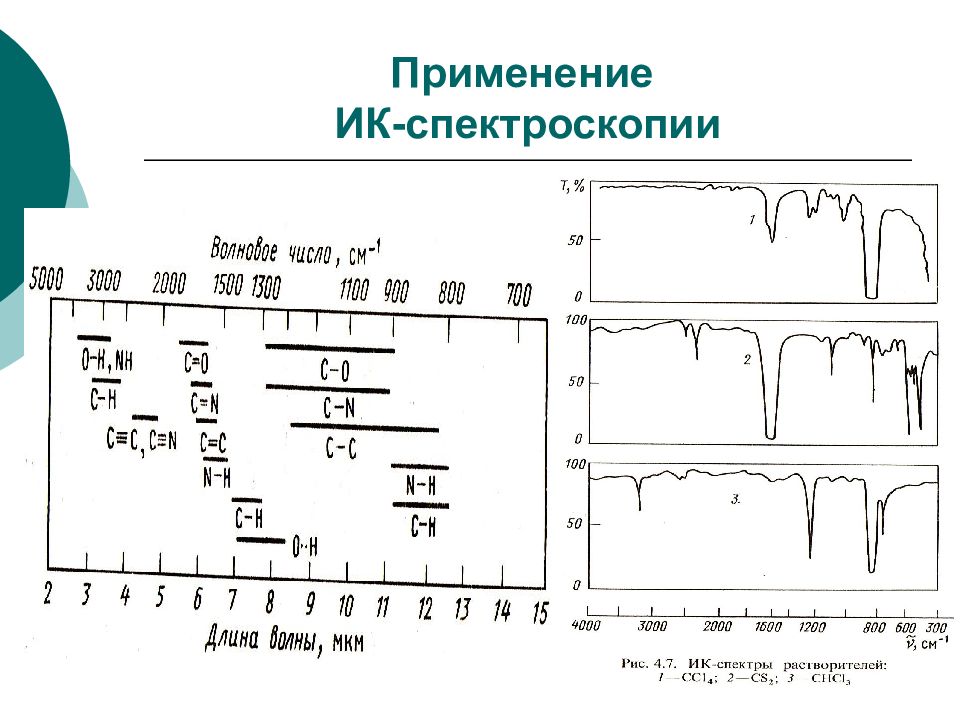
Слайд 23: ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ
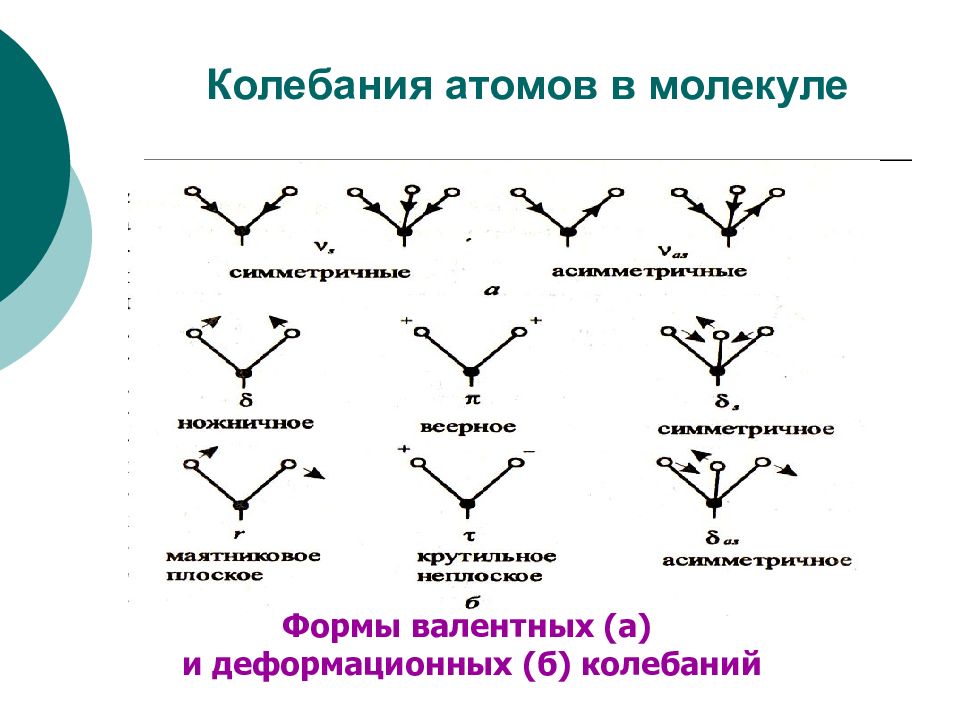
ФХМА. Хим. ЛК. № 13-14. Попова Л.Ф. 23 ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ ИК-спектроскопия основана на переходах молекулы из одного колебательного состояния в другое. При этом молекула поглощает инфракрасное излучение (ИК). Необходимое условие колебательного перехода – изменение дипольного момента молекулы при колебании атомов. Симметричная молекула, не обладающая дипольным моментом, не может поглощать ИК-излучение ( N 2, H 2, галогены и др.). У некоторых молекул дипольный момент появляется при изменении типа колебаний атомов (СО 2 ). В многоатомной молекуле выделяют несколько типов колебаний атомов: Валентные (симметричные и асимметричные) – это ритмичные колебания вдоль оси связи, при которых изменяется длина связи, но не меняется угол между связями. Деформационные – это колебания, при которых изменяются углы между связями, но не меняется длина связей.
Слайд 24: Колебания атомов в молекуле
Формы валентных (а) и деформационных (б) колебаний
Слайд 28: Дополнительное оборудование приборов
1 – источник излучения; 2 – зеркала; 3 – модулятор; 4,5 – кюветы; 6 – монохроматор; 7 – детектор; 8 - индикатор
Слайд 30: Люминесцентный анализ
В основе лежит явление люминесценции. Люминесценция – это свечение вещества, возникшее после поглощения им энергии возбуждения; представляет собой избыточное излучение по сравнению с тепловым излучением. Основана на электронных переходах в атомах, молекулах или ионах при их возвращении из возбужденного состояния в стационарное. Наблюдается в ВС, УФ областях спектра.
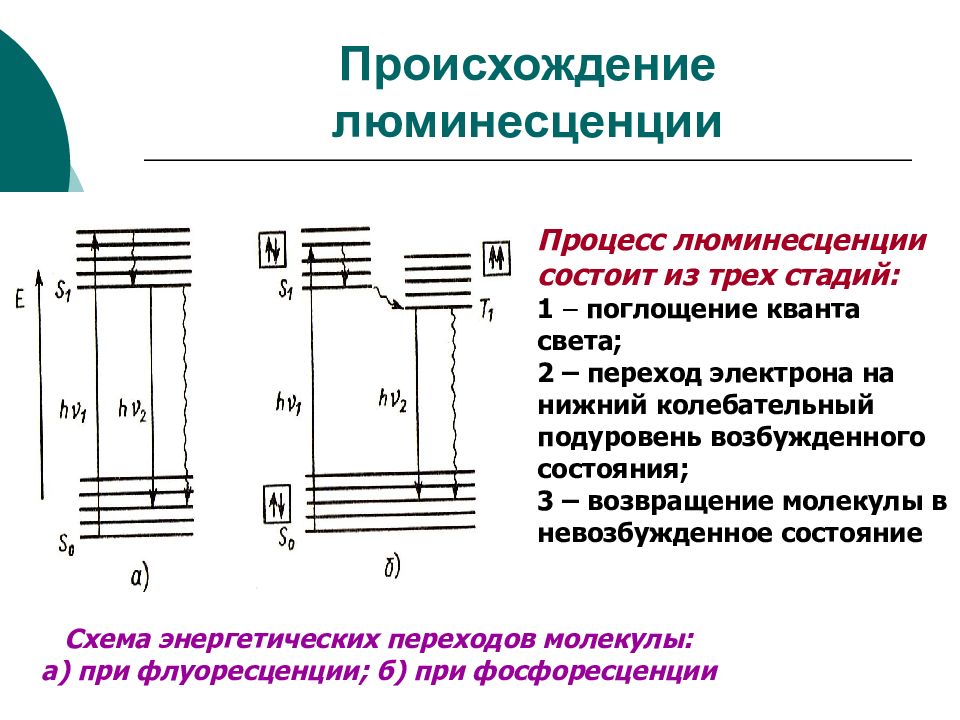
Слайд 31: Происхождение люминесценции
Процесс люминесценции состоит из трех стадий: 1 – поглощение кванта света; 2 – переход электрона на нижний колебательный подуровень возбужденного состояния; 3 – возвращение молекулы в невозбужденное состояние Схема энергетических переходов молекулы: а) при флуоресценции; б) при фосфоресценции
Слайд 33: Оборудование для люминесцентного анализа
Схема флюориметра : 1 – источник излучения; 2, 4 – светофильтры ; 3 – кювета; 5 – детектор
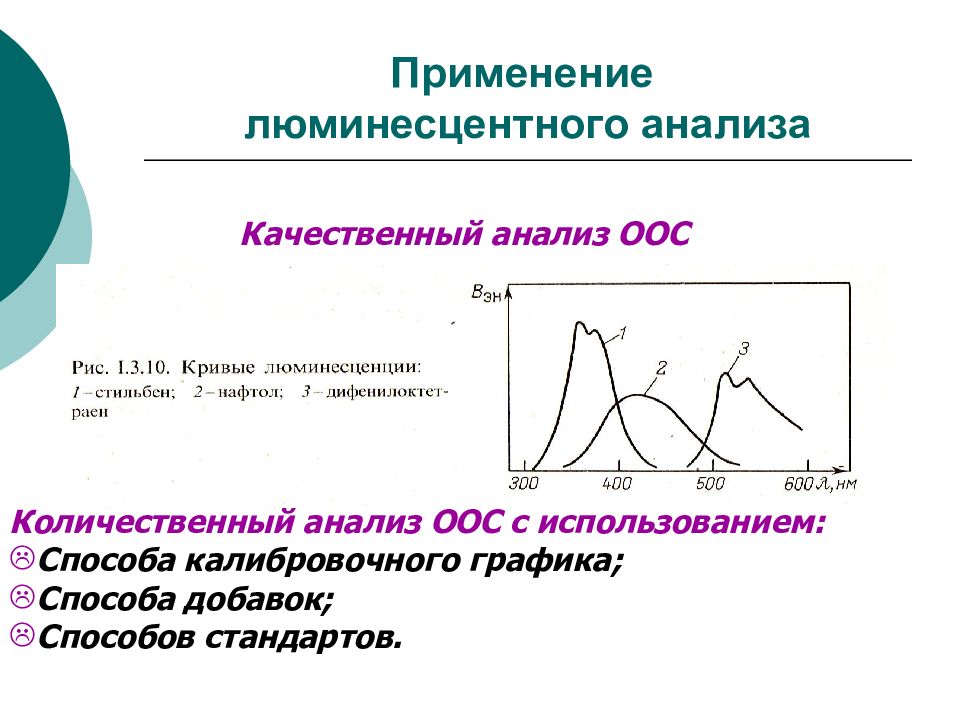
Слайд 34: Применение люминесцентного анализа
Количественный анализ ООС с использованием: Способа калибровочного графика; Способа добавок; Способов стандартов. Качественный анализ ООС
Слайд 35: Другие оптические методы
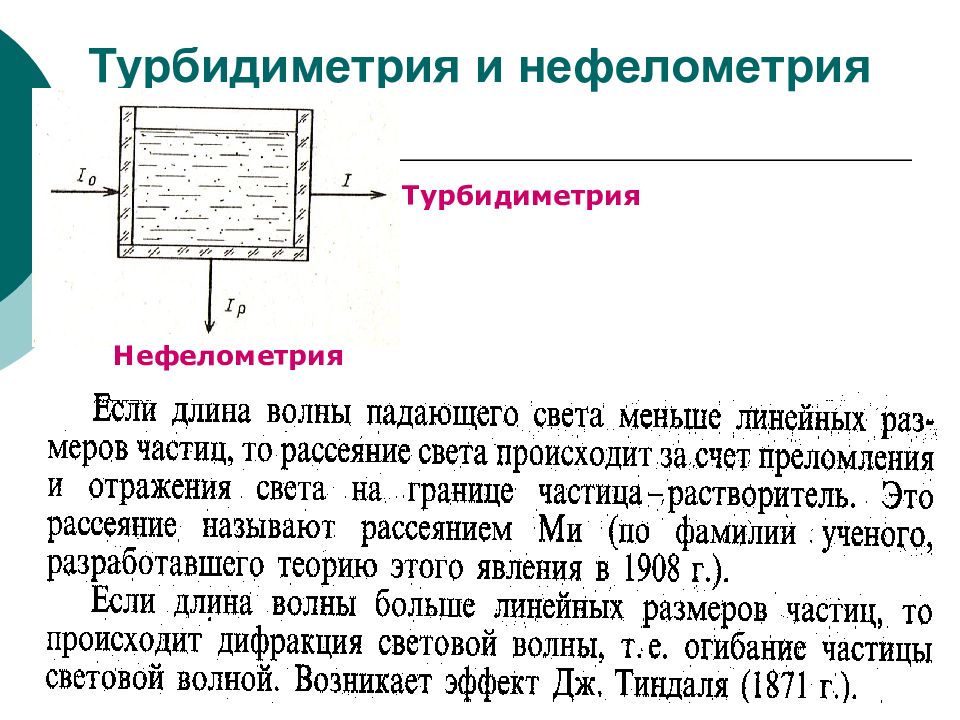
Турбидиметрия и нефелометрия (основаны на способности коллоидных растворов и мутных сред рассеивать свет). Рефрактометрия (основана на способности света преломляться на границе раздела двух оптически разных сред). Поляриметрия (основана на способности оптически активных веществ вращать плоскость поляризации плоскополяризованного света).
Слайд 36: Турбидиметрия и нефелометрия
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 36 Турбидиметрия и нефелометрия Нефелометрия Турбидиметрия
Слайд 37: Особенности коллоидных растворов
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 37 Особенности коллоидных растворов Для получения коллоидных систем нужно соблюдать условия: Дисперсная фаза (вещество) должна быть нерастворима в данной дисперсионной среде (растворителе). Необходимо добиться, чтобы частицы фазы достигли размеров коллоидных частиц. Необходимо наличие стабилизатора, предотвращающего самопроизвольную коагуляцию ( что это такое? ) коллоидного раствора. В качестве стабилизаторов используются ПАВ (растворы желатина, крахмала, мыла, клей), др. органические соединения (многоатомные спирты и др.). Почему?
Слайд 38: Турбидиметрия и нефелометрия
Нефелометр ФЭК марки КФК-2 Современные нефелометры и ФЭК
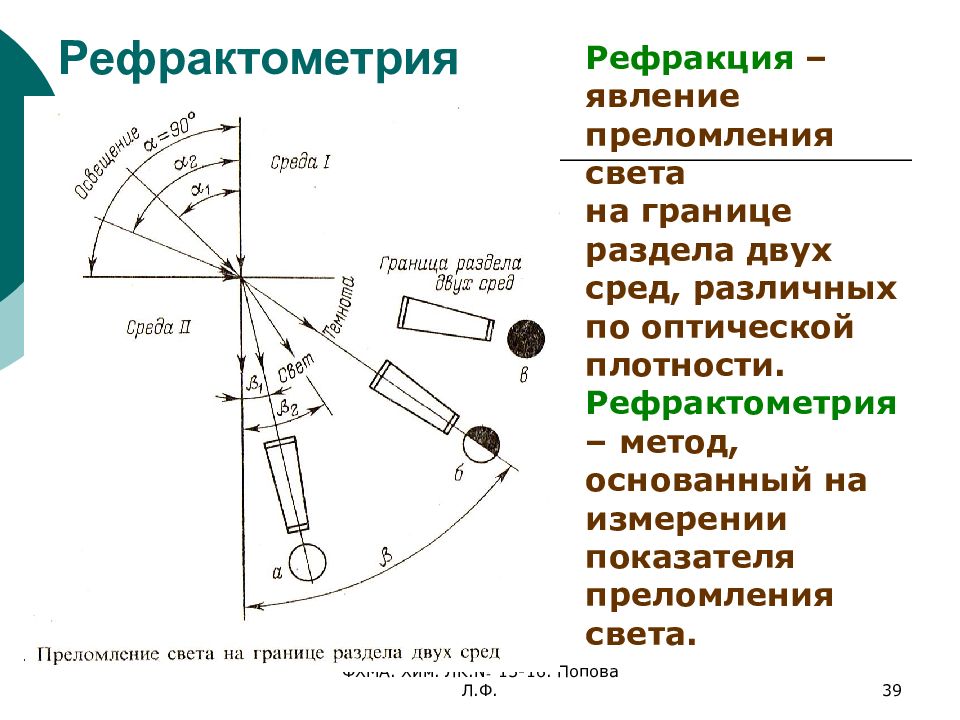
Слайд 39: Рефрактометрия
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 39 Рефрактометрия Рефракция – явление преломления света на границе раздела двух сред, различных по оптической плотности. Рефрактометрия – метод, основанный на измерении показателя преломления света.
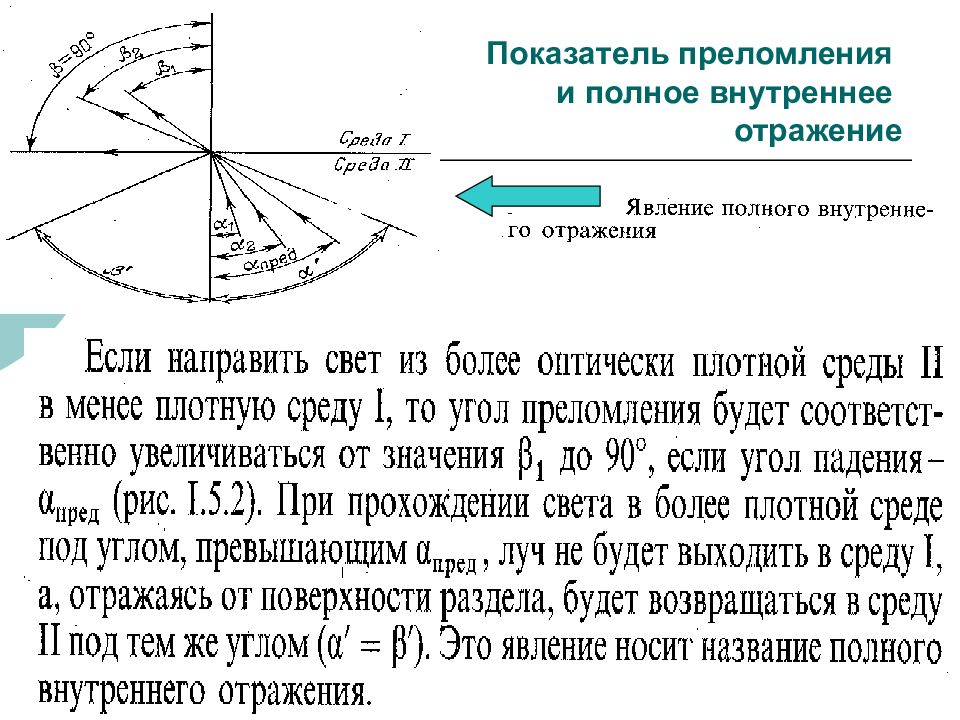
Слайд 41: Показатель преломления и полное внутреннее отражение
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 41 Показатель преломления и полное внутреннее отражение
Слайд 42: Приборы для определения n D
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 42 Приборы для определения n D Рефрактометр Измеряют угол полного внутреннего отражения. n D 20 (Н 2 О) = 1,333.
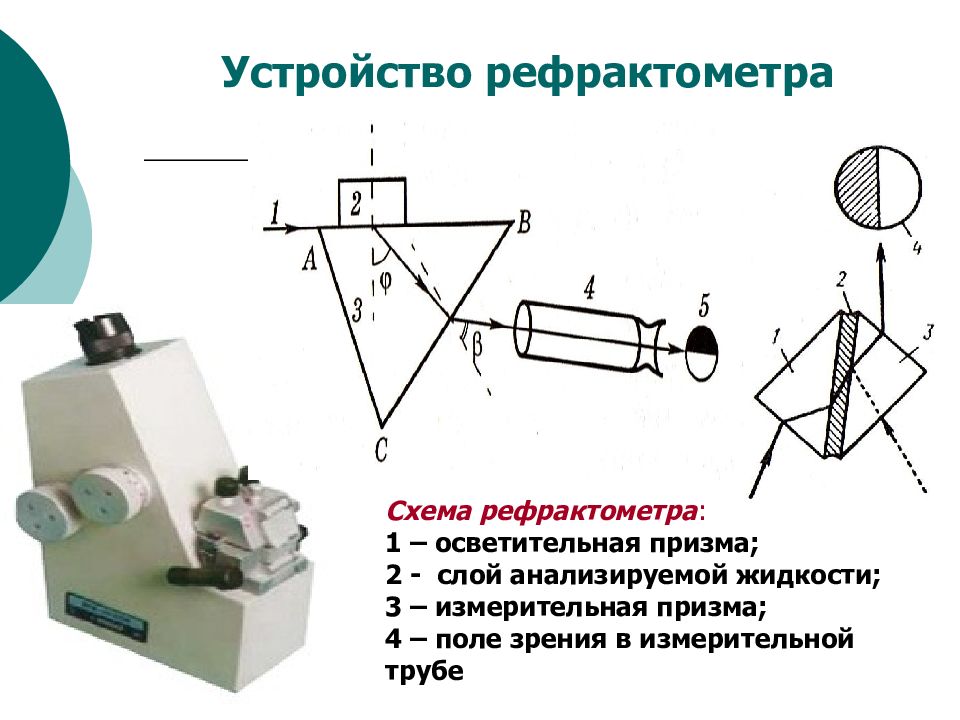
Слайд 43
Схема рефрактометра : 1 – осветительная призма; 2 - слой анализируемой жидкости; 3 – измерительная призма; 4 – поле зрения в измерительной трубе Устройство рефрактометра
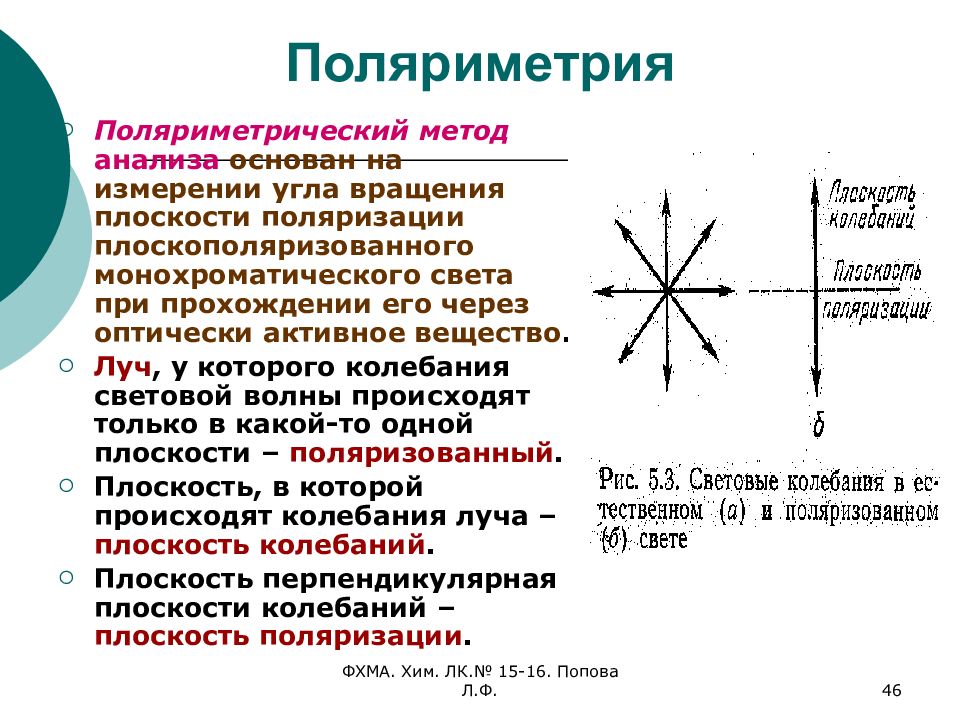
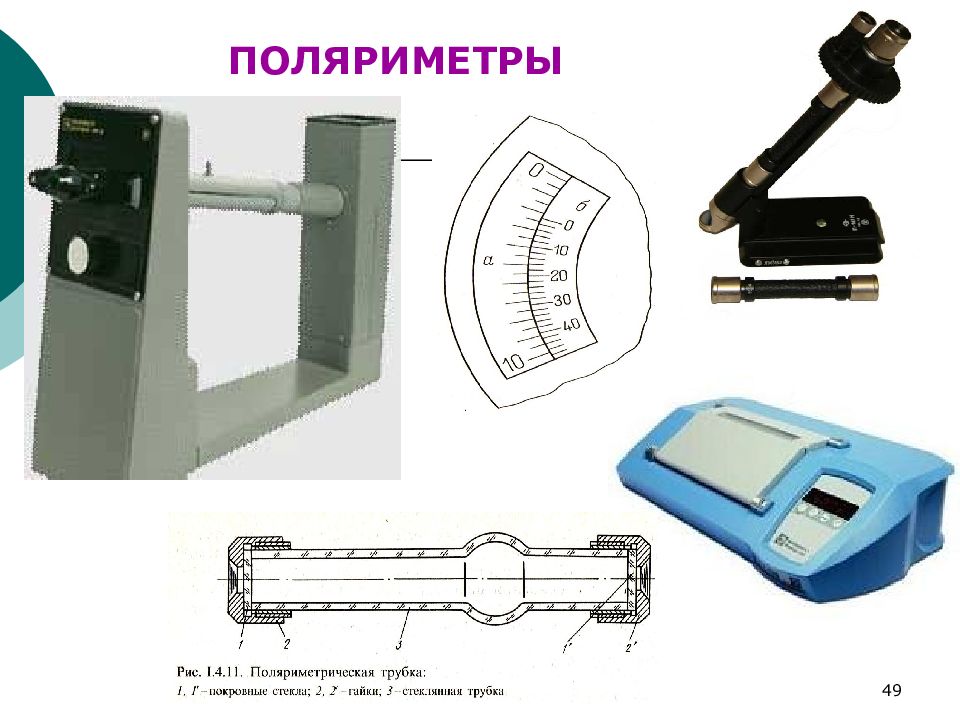
Слайд 46: Поляриметрия
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 46 Поляриметрия Поляриметрический метод анализа основан на измерении угла вращения плоскости поляризации плоскополяризованного монохроматического света при прохождении его через оптически активное вещество. Луч, у которого колебания световой волны происходят только в какой-то одной плоскости – поляризованный. Плоскость, в которой происходят колебания луча – плоскость колебаний. Плоскость перпендикулярная плоскости колебаний – плоскость поляризации.
Слайд 47
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 47 Оптически активные вещества – это вещества, способные вращать плоскость поляризации. Оптически неактивные вещества – это вещества, неспособные вращать плоскость поляризации. К оптически активным веществам относятся растворы органических веществ, молекулы которых содержат хотя бы один хиральный (асимметричный) атом углерода. При прохождении поляризованного света через оптически активное вещество происходит поворот плоскости поляризации на некоторый угол – угол вращения плоскости поляризации ( α ). Вращение называют правым (d) и считают положительным, если оно происходит по часовой стрелке, когда смотрят навстречу лучу. Вращение называют левым (l) и считают отрицательным, если оно происходит против часовой стрелки, когда смотрят навстречу лучу. Оптически неактивная эквимолярная смесь право- и левовращающих изомеров – рацемат ( d l ).
Слайд 48
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 48 Угол вращения плоскости поляризации зависит от: Природы оптически активного вещества. Концентрации оптически активного вещества. Толщины слоя раствора. Длины волны поляризуемого света. Температуры. Для количественной характеристики способности оптически активных веществ вращать плоскость поляризации плоскополяризованного света вводят понятие удельного вращения [ α ], которое соответствует углу вращения плоскости поляризации монохроматического излучения при l = 1 дм и содержании оптически активного вещества 1 г/мл. Его можно рассчитать по формуле: для индивидуальных жидких оптически активных веществ : [ α ] = α / ( ρ • l ); для растворов оптически активных веществ : [ α ] = ( α • 100) / (С • l ), где α – измеренный угол вращения, градусы; ρ – плотность жидкости, г/мл; l – толщина слоя оптически активного вещества, дм; С – концентрация оптически активного вещества, г/100 мл раствора. Молярное вращение плоскости поляризации рассчитывают по формуле: [ α М ] = [ α ] • М.
Слайд 50
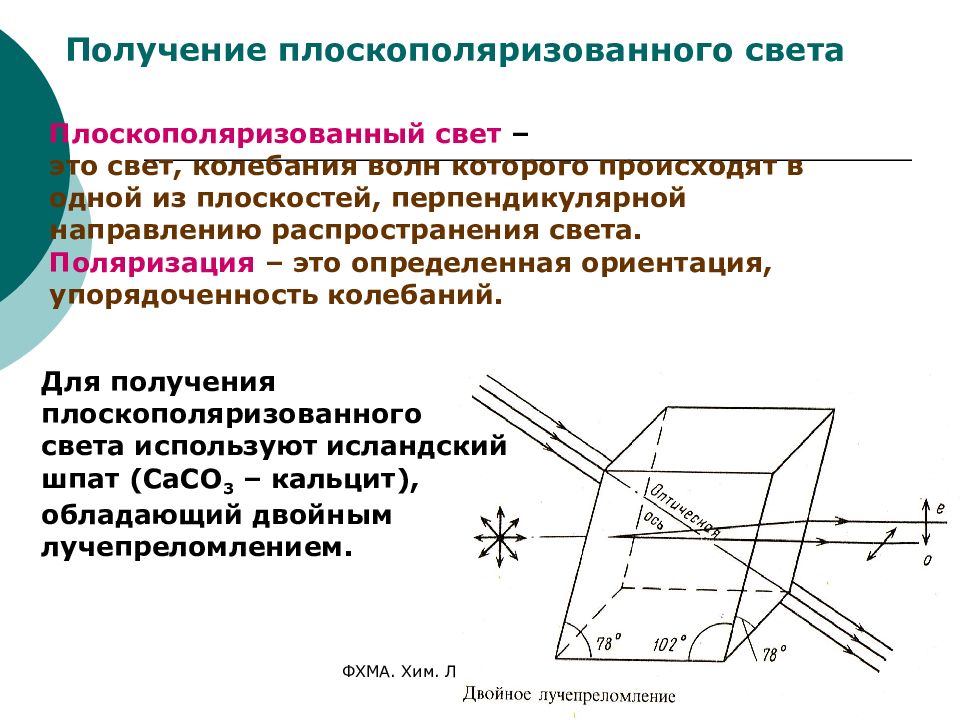
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 50 Получение плоскополяризованного света Плоскополяризованный свет – это свет, колебания волн которого происходят в одной из плоскостей, перпендикулярной направлению распространения света. Поляризация – это определенная ориентация, упорядоченность колебаний. Для получения плоскополяризованного света используют исландский шпат (СаСО 3 – кальцит), обладающий двойным лучепреломлением.
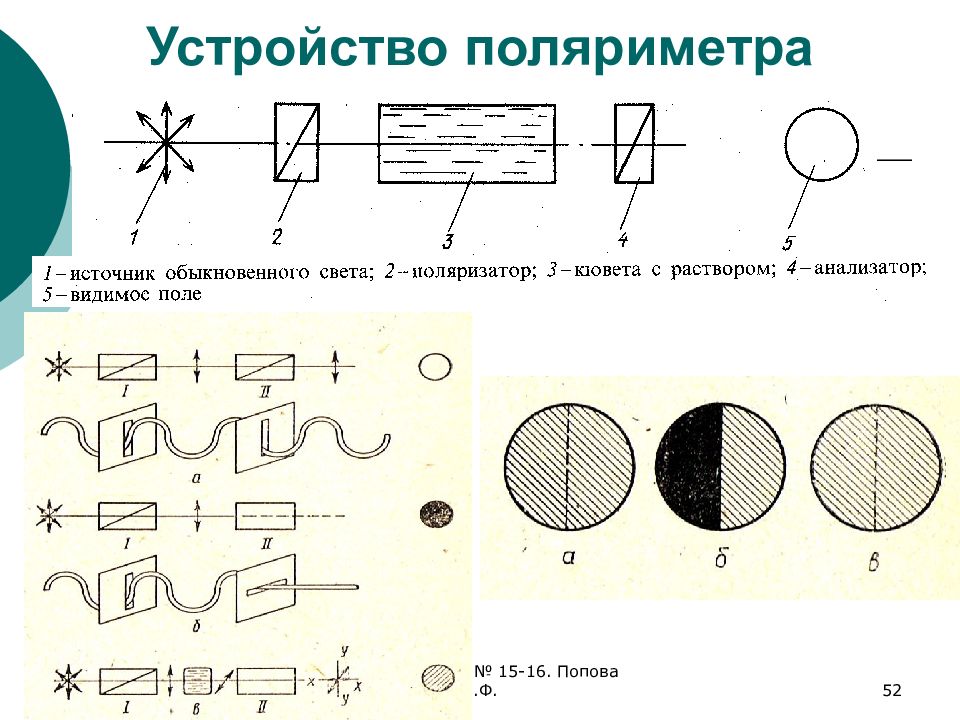
Слайд 52: Устройство поляриметра
ФХМА. Хим. ЛК.№ 15-16. Попова Л.Ф. 52 Устройство поляриметра