Первый слайд презентации
Тема 2 : Структурно функціональні особливості мембранних білків.
Слайд 2
План: 1. Характеристика інтегральних мембранних білків : способи зв’язування з мембранами, характеристика секретаз, вплив ліпідного оточення. 2. Приклади бітопічних та політопічних білків мембран. 3. Характеристика периферичних мембранних білків. 4. Мембранні білки, ковалентно зв’язані з ліпідами. 5. Виділення, очищення та дослідження мембранних білків. Питання для самостійного опрацювання: 1. Приклади інтегральних мембранних білків : бактеріородопсин, глікофорин, порини. 2. Периферичні білки еритроцитарних мембран.
Слайд 3
Рекомендована література: 1. Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А. Биомембранология : Учебное пособие.-Петрозаводск : Изд-во Кар.НЦ РАН, 2006: – 226 с. 2. Геннис Р. Биомембраны. Молекулярная структура и функции. – М.: Мир, 1997.– 624 с. 3. Курський М.Д., Кучеренко С.М. Біомемембранологія.- К.: Вища школа, 1992. – 260с. 4. Кучеренко М.Є., Бабенюк Ю.Д., Войціцький В.М. Сучасні методи біохімічних досліджень. – К.: Фітосоціоцентр, 2001. – 424 с. 5. Мушкамбаров Н.Н., Кузнєцов С.Л. Молекулярная б и ология.-М.: ООО « Медицинское информационное агентство», 2003. – 287с. 6. Остапченко Л.І., Михайлик І.В. Біологічні мембрани: методи дослідження структури та функцій: Навчальний посібник. – К.: Видавничо-поліграфічний центр «Київський університет», 2006. – 215 с. 7. Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Molecular biology of the Cell, 5th edition. Garland Science, 2008.
Слайд 4
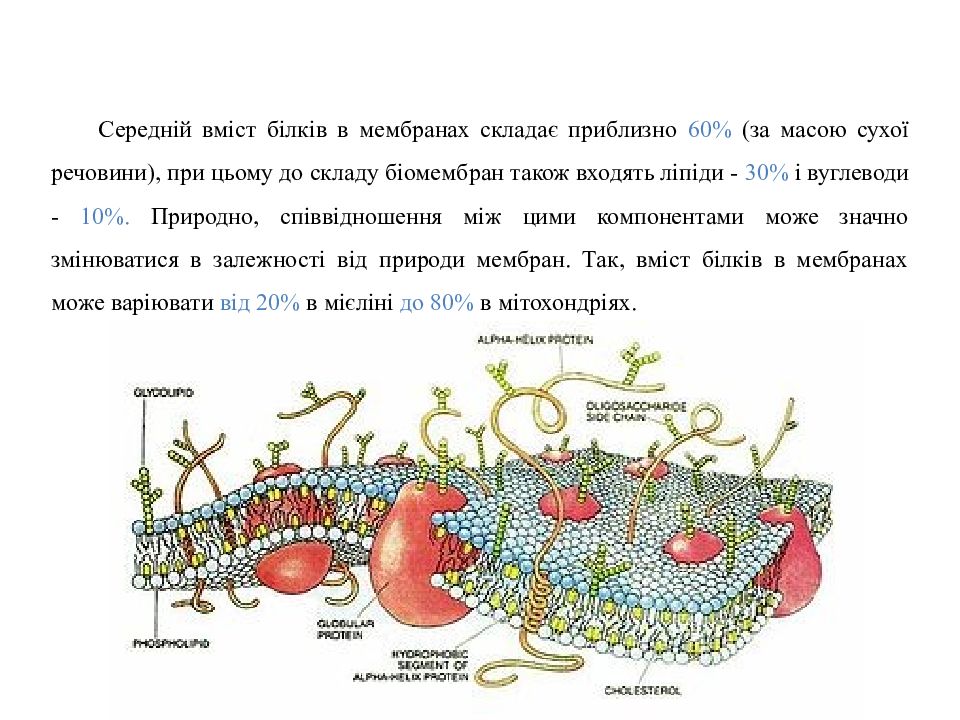
Середній вміст білків в мембранах складає приблизно 60% (за масою сухої речовини), при цьому до складу біомембран також входять ліпіди - 30% і вуглеводи - 10%. Природно, співвідношення між цими компонентами може значно змінюватися в залежності від природи мембран. Так, вміст білків в мембранах може варіювати від 20% в мієліні до 80% в мітохондріях.
Слайд 5
Функціональні види мембранних білків 1.Структурні білки. 2.Транспортні білки. 3. Білки, що забезпечують безпосередню міжклітинну взаємодію. 4. Білки, що приймають участь у передачі сигналів
Слайд 6: Функції мембранних білків
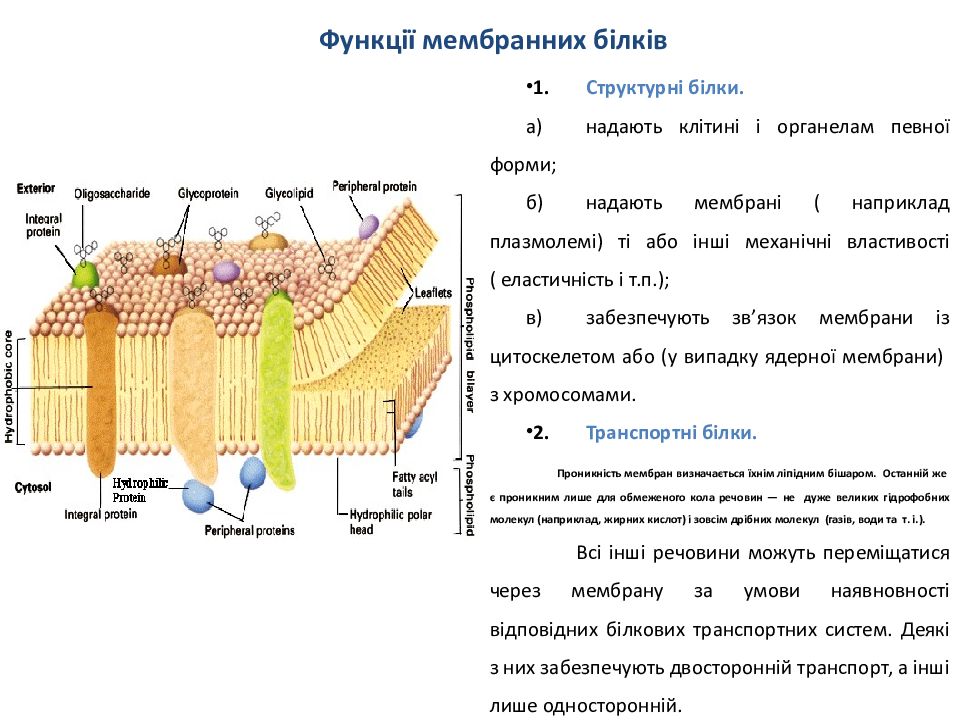
1. Структурн і білки. а) надають клітині і органелам певної форми ; б) надають мембрані ( наприклад плазмолемі ) ті або інші механічні властивості ( еластичність і т.п.); в) забезпечують зв ’ язок мембрани із цитоскелетом або (у випадку ядерної мембрани) з хромосомами. 2. Транспортні білки. Проникність мембран визначається їхнім ліпідним бішаром. Останній же є проникним лише для обмеженого кола речовин — не дуже великих гідрофобних молекул ( наприклад, жирних кислот) і зовсім дрібних молекул ( газів, води та т. і.). Всі інші речовини можуть переміщатися через мембрану за умови наявновності відповідних білкових транспортних систем. Деякі з них забезпечують двосторонній транспорт, а інші лише односторонній.
Слайд 7: Функції мембранних білків
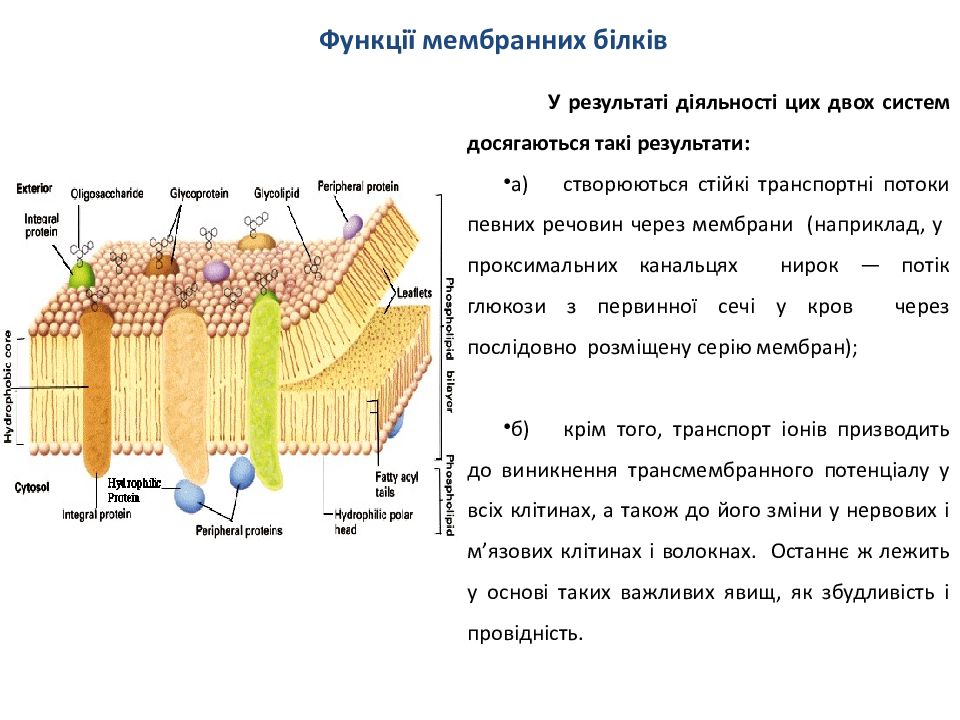
У результаті діяльності цих двох систем досяга ю ться такі результати : а) створюються стійкі транспортні потоки певних речовин через мембрани ( наприклад, у проксимальних канальцях нирок — потік глюкози з первинної сечі у кров через послідовно розміщену серію мембран); б) крім того, транспорт іонів призводить до виникнення трансмембранного потенціалу у всіх клітинах, а також до його зміни у нервових і м ’ язових клітинах і волокнах. Останнє ж лежить у основі таких важливих явищ, як збудливість і провідність.
Слайд 8: Функції мембранних білків
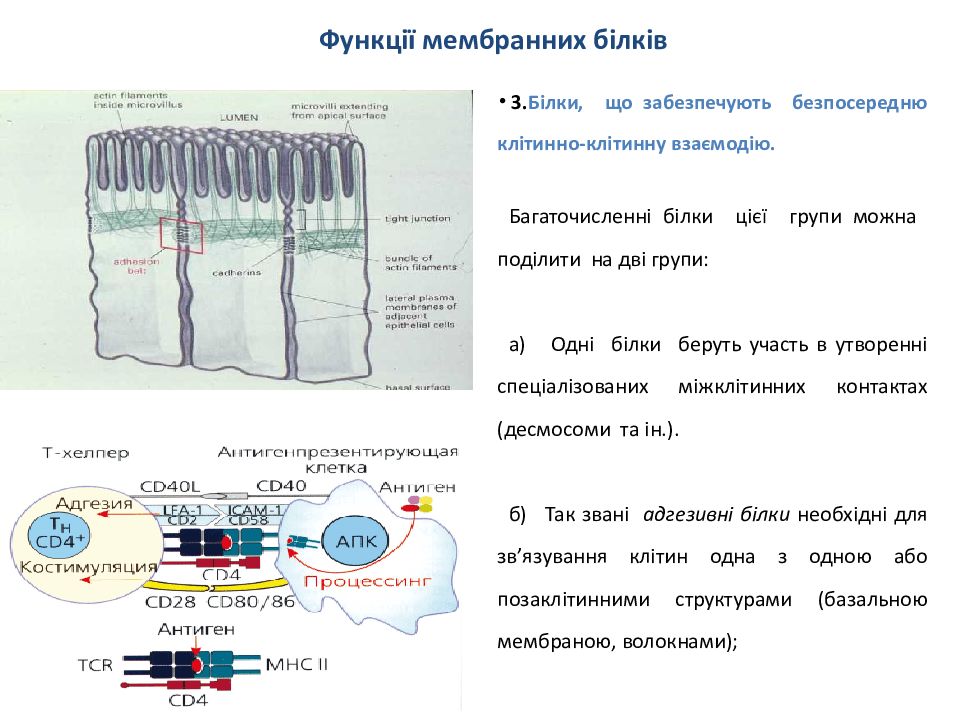
3. Білки, що забезпечують безпосередню клітинно-клітинну взаємодію. Багаточисленні білки цієї групи можна поділити на дві групи : а) Одні білки беруть участь в утворенні спеціалізованих міжклітинних контактах ( десмосоми та ін.). б) Так звані адгезивні білки необхідні для зв ’ язування клітин одна з одною або позаклітинними структурами (базальною мембраною, волокнами);
Слайд 9: Функції мембранних білків
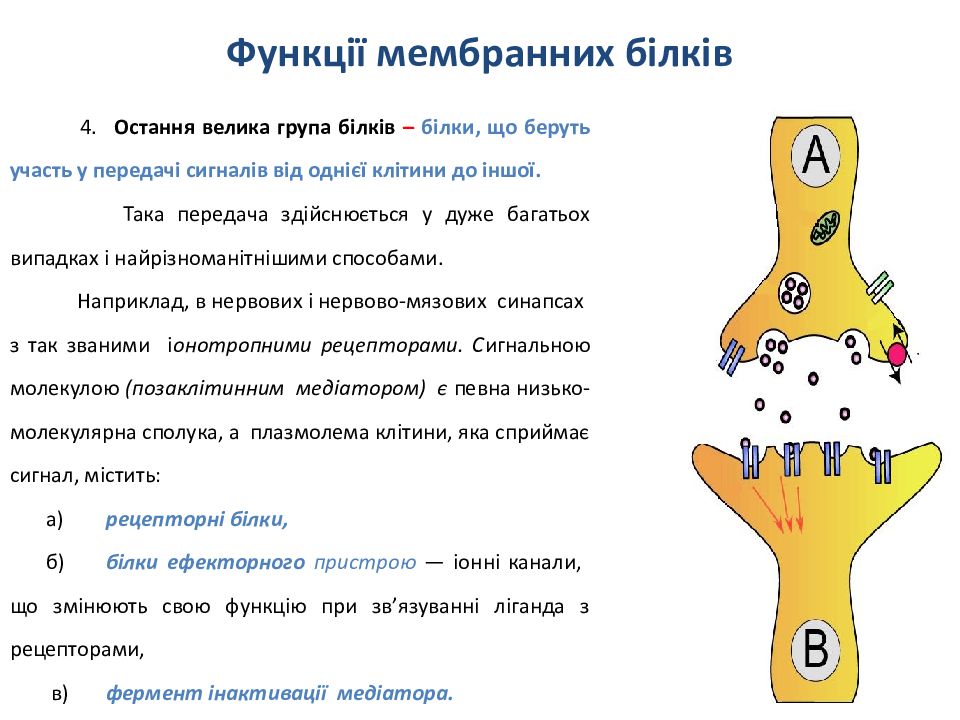
4. Остання велика група білків – білки, що беруть участь у передачі сигналів від однієї клітини до іншої. Така передача здійснюється у дуже багатьох випадках і найрізноманітнішими способами. Наприклад, в нервових і нервово-мязових синапсах з так званими і онотропними рецепторами. С игнальною молекулою ( позаклітинним медіатором ) є певна низько-молекулярна сполука, а плазмолема клітини, яка сприймає сигнал, містить : а) рецепторні білки, б) білки ефекторного пристрою — іонні канали, що змінюють свою функцію при зв ’ язуванні ліганда з рецепторами, в) фермент інактивації медіатора.
Слайд 10
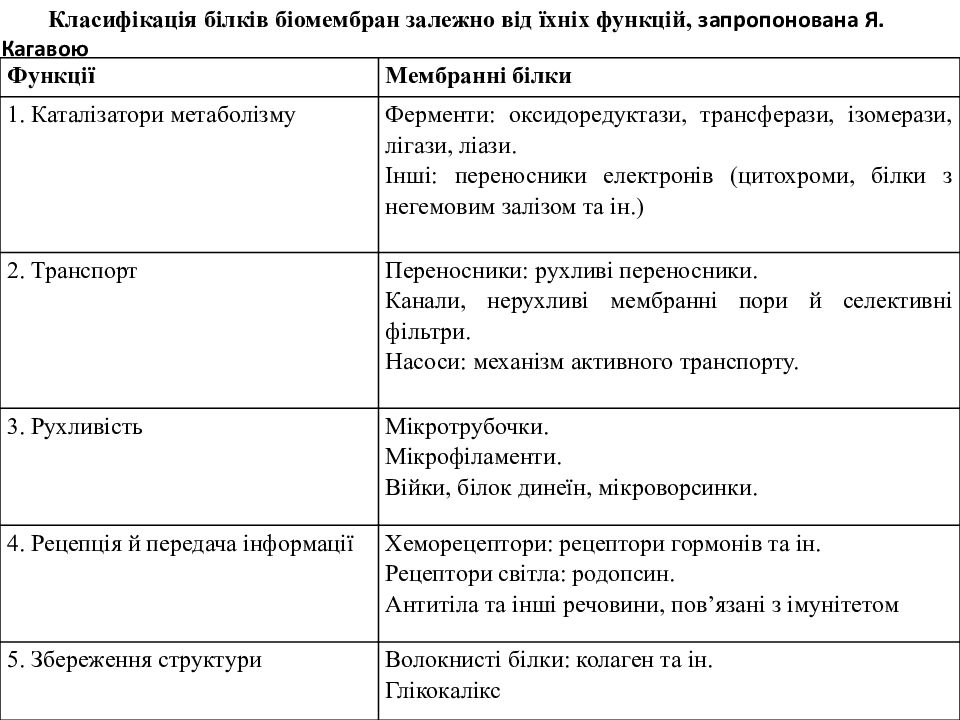
Функції Мембранні білки 1. Каталізатори метаболізму Ферменти: оксидоредуктази, трансферази, ізомерази, лігази, ліази. Інші: переносники електронів (цитохроми, білки з негемовим залізом та ін.) 2. Транспорт Переносники: рухливі переносники. Канали, нерухливі мембранні пори й селективні фільтри. Насоси: механізм активного транспорту. 3. Рухливість Мікротрубочки. Мікрофіламенти. Війки, білок динеїн, мікроворсинки. 4. Рецепція й передача інформації Хеморецептори: рецептори гормонів та ін. Рецептори світла: родопсин. Антитіла та інші речовини, пов’язані з імунітетом 5. Збереження структури Волокнисті білки: колаген та ін. Глікокалікс Класифікація білків біомембран залежно від їхніх функцій, запропонована Я. Кагавою
Слайд 11
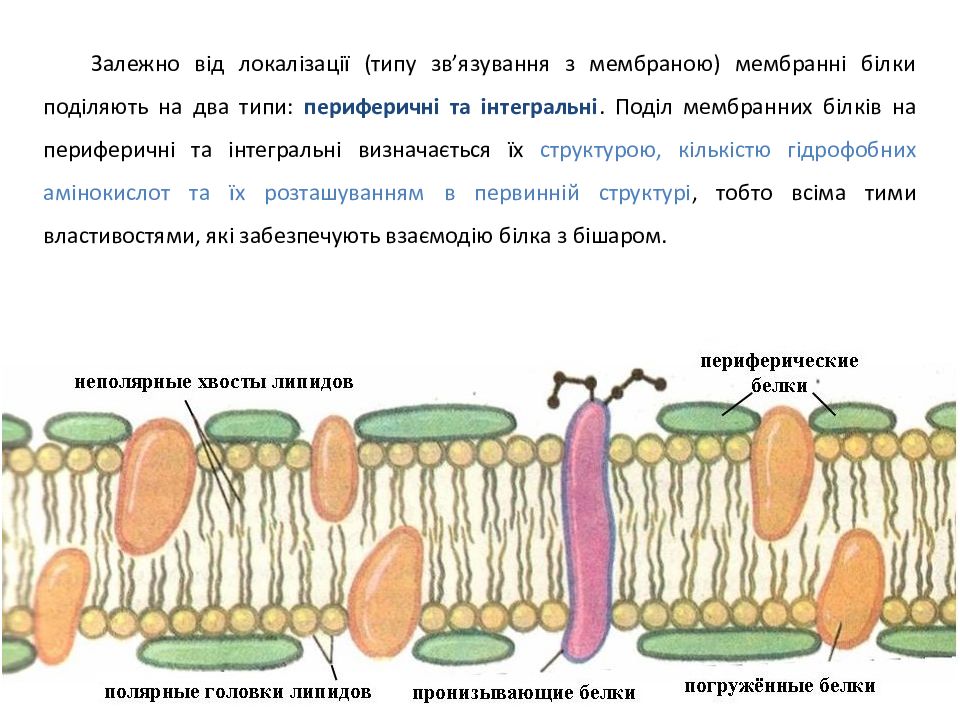
Залежно від локалізації (типу зв’язування з мембраною) мембранні білки поділяють на два типи: периферичні та інтегральні. Поділ мембранних білків на периферичні та інтегральні визначається їх структурою, кількістю гідрофобних амінокислот та їх розташуванням в первинній структурі, тобто всіма тими властивостями, які забезпечують взаємодію білка з бішаром.
Слайд 12
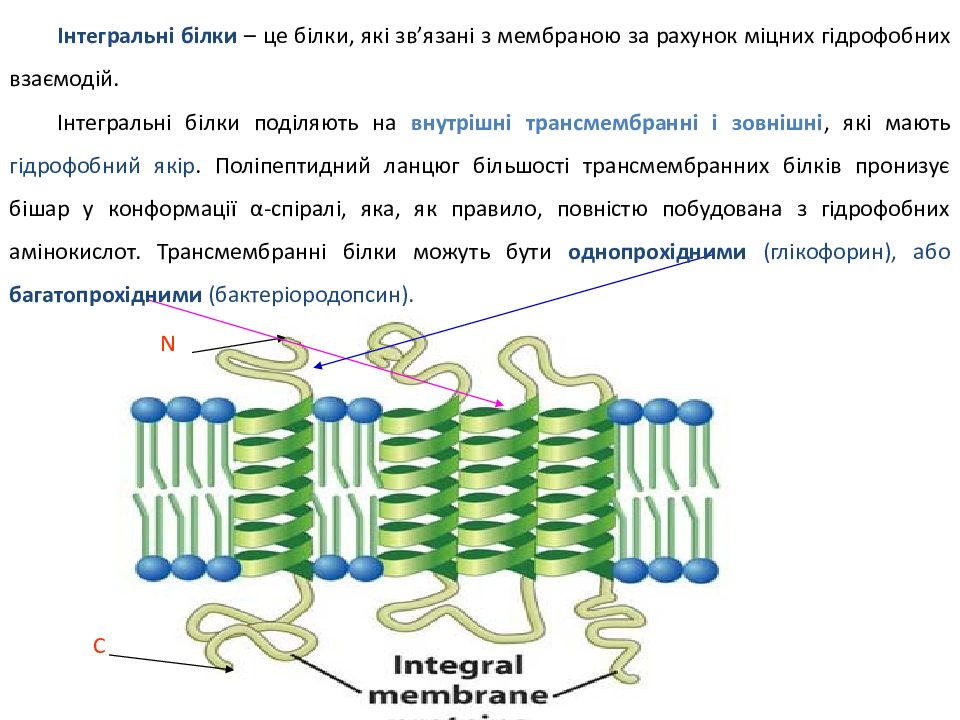
N С Ін тегральні білки – це білки, які зв ’ язані з мембраною за рахунок міцних гідрофобних взаємодій. Інтегральні білки поділяють на внутрішні трансмембранні і зовнішні, які мають гідрофобний якір. Поліпептидний ланцюг більшості трансмембранних білків пронизує бішар у конформації α -спіралі, яка, як правило, повністю побудована з гідрофобних амінокислот. Трансмембранні білки можуть бути однопрохідними ( глікофорин ), або багатопрохідними ( бактеріородопсин ).
Слайд 13
Інтегральні мембранні білки є глобулярними, амфіфільними макромолекулами. Вони взаємодіють як з гідрофобними, так і гідрофільними ділянками біомембрани. Для інтегральних мембранних білків характерний високий вміст α-спіральних ділянок, а також ділянок з конфігурацією статичного клубка. Тому мембранні білки переважно представлені глобулярними, а не плоскими витягнутими структурами. Наскільки білок занурюється у бішар визначається амінокислотною послідовністю та третинною структурою.
Слайд 14
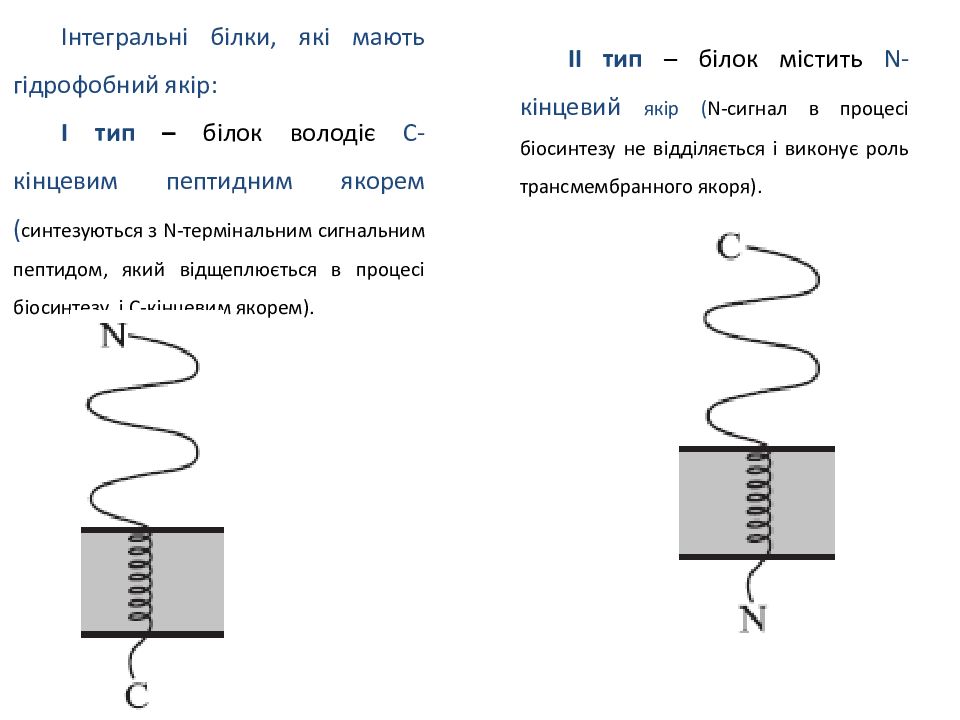
Інтегральні білки, які мають гідрофобний якір: І тип – білок володіє С-кінцевим пептидним якорем ( синтезуються з N-термінальним сигнальним пептидом, який відщеплюється в процесі біосинтезу, і С-кінцевим якорем). ІІ тип – білок містить N - кінцевий якір ( N-сигнал в процесі біосинтезу не відділяється і виконує роль трансмембранного якоря).
Слайд 15
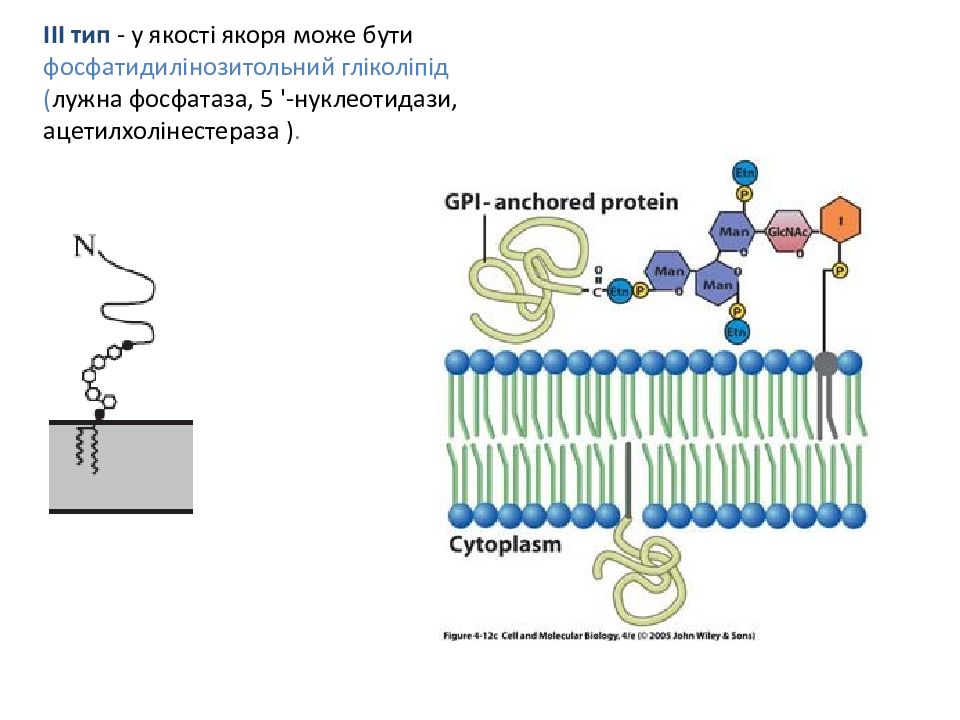
ІІІ тип - у якості якоря може бути фосфатидилінозитольний гліколіпід ( лужна фосфатаза, 5 '-нуклеотидази, ацетилхолінестераза ).
Слайд 16
Для багатьох білків, вбудованих в мембрану за допомогою якоря, характерно « відлущування » ( shedding ) з клітинної поверхні. Утворення розчинних форм відбувається в результаті ферментативного гідролізу доступної примембранної ділянки білка-субстрату і описано для різноманітних по структурі і функціях інтегральних білків I і II типів. Група Назва Типологія Ферменти АПФ Сиацилтрансфераза І тип ІІ тип Ліганди рецепторів Перетворюючий фактор росту (TGF- α) Фактор некрозу пухлин (TNG-α) Kit -ліганд Фактор росту CSF-1 І тип ІІ тип І тип І тип Молекули клітинної адгезії L -селектин Протеоглікан NG-2 І тип І тип Рецептори Трансфериновий рецептор Фолат-рецептор Рецептор фактора росту нервів Рецептор перетворюючого фактора росту ІІ тип І тип І тип І тип Вірусні білки Глікопротеїн віруса везикулярного стоматиту І тип Інші білки Попередник амілоїдного білка (АРР) Глікопротеїн Ib І тип І тип Інтегральні мембранні білки з пептидним якорем здатні переходити при протеолізі в секреторну форму
Слайд 17
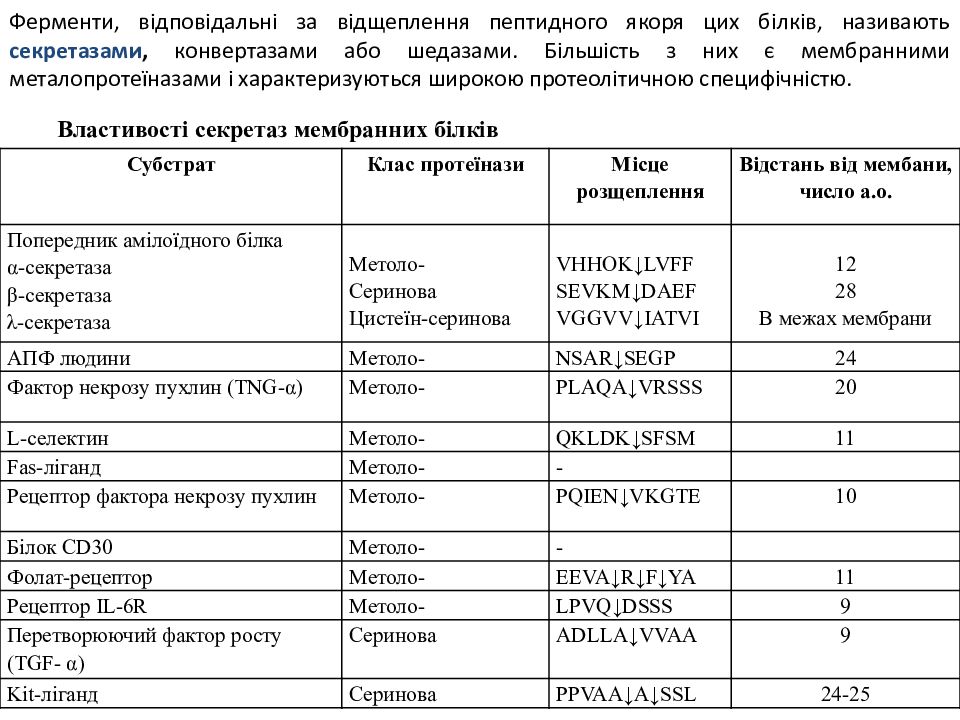
Ферменти, відповідальні за відщеплення пептидного якоря цих білків, називають секретазами, конвертазами або шедазами. Більшість з них є мембранними металопротеїназами і характеризуються широкою протеолітичною специфічністю. Субстрат Клас протеїнази Місце розщеплення Відстань від мембани, число а.о. Попередник амілоїдного білка α-секретаза β-секретаза λ-секретаза Метоло- Серинова Цистеїн-серинова VHHOK↓LVFF SEVKM↓DAEF VGGVV↓IATVI 12 28 В межах мембрани АПФ людини Метоло- NSAR↓SEGP 24 Фактор некрозу пухлин (TNG-α) Метоло- PLAQA↓VRSSS 20 L -селектин Метоло- QKLDK↓SFSM 11 Fas- ліганд Метоло- - Рецептор фактора некрозу пухлин Метоло- PQIEN↓VKGTE 10 Білок CD30 Метоло- - Фолат-рецептор Метоло- EEVA↓R↓F↓YA 11 Рецептор IL-6R Метоло- LPVQ↓DSSS 9 Перетворюючий фактор росту (TGF- α) Серинова ADLLA↓VVAA 9 Kit -ліганд Серинова PPVAA↓A↓SSL 24-25 Властивості секретаз мембранних білків
Слайд 18
Утворення βА4-пептиду Основна причина хвороби Альцгеймера. Цей пептид утворюється в процесі розщеплення мембранозв'язаного попередника амілоїдного білка двома β- і γ-секретазами, при цьому дія α-секретази попереджає розвиток цього захворювання.
Слайд 19
Таким чином, біологічна роль різних мембранних ферментів може в значній мірі визначатися їх здатністю до зв'язування з мембраною. По-перше, зв'язування з біомембраною забезпечує локалізацію (концентрування) ферментів в певній частині клітини і / або в тій області мембрани, де концентрується субстрат. По-друге, адсорбція ферментів на мембрані створює можливість для сполучення процесів каталізу і трансмембранного переносу. По-третє, для багатьох ферментів при зв'язуванні з мембраною забезпечується доступність водонерозчинних субстратів. По-четверте, при зв'язуванні формується оптимальне мікрооточення, яке забезпечує нативну конформацію і каталітичну активність мембранних ферментів.
Слайд 20
Вплив ліпідного оточення Функціональна активність мембранних білків в першу чергу залежить від динамічних властивостей ліпідного матриксу мембр а ни, що забезпечують конформаційну рухливість ферменту - здатність білкової молекули здійснювати оборотний конфор маційний перехід з напруженого стану в розслаблений. Така можливість залежить від щільності упаковки ліпідів, яка в свою чергу залежить від складу мембран. Зазвичай при температурах нижче критичної ( Т кр - температура фазового переходу « Гель - рідкий кристал », індивідуальна для кожної мембрани, наприклад в бі шарових мембранах чистого фосфатидилхоліну Т кр становить 23 °) мембрани надто впорядковані, щоб забезпечувати конформаційну лабільність білків. Для нормального функціонування більшості трансмембранних білків, необхідний “ рідкий” стан оточуючої їх ліпідної ділянки, і перш за все анулярних ліпідів. Проте, для білків, які виконують структурну функцію, фазовий стан ліпідів значення не має.
Слайд 21
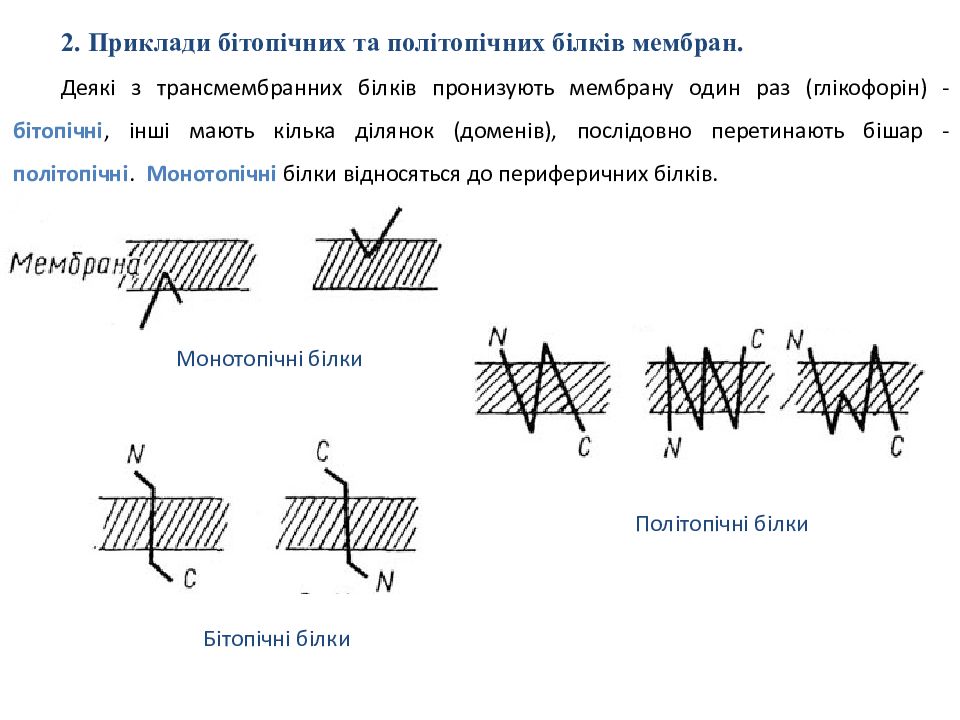
2. Приклади бітопічних та політопічних білків мембран. Деякі з трансмембранних білків пронизують мембрану один раз ( глікофорін ) - бітоп ічні, інші мають кілька ділянок ( доменів ), послідовно перетинають бішар - політопіч ні. Монотопіч ні білки відносяться до пери феричних білк ів. Монотопічні білки Бітопічні білки Політопічні білки
Слайд 22
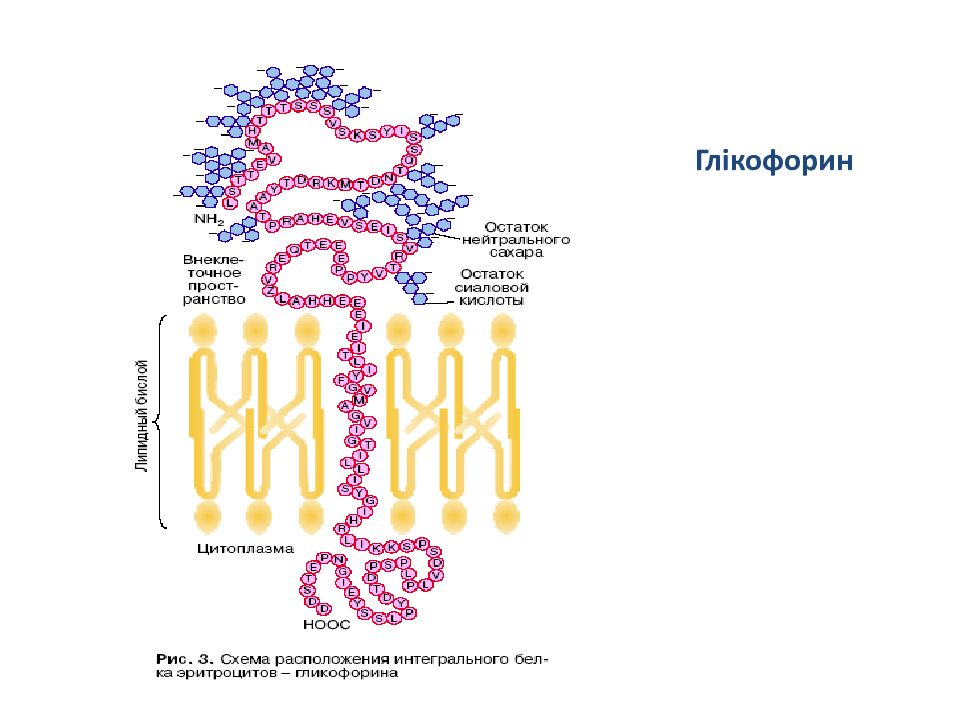
Б ітопіч ний білок - глікофор и н з мембрани еритроцитів. Він містить 23 неполярн і амінокислот ні послідовності, розташован і приблизно в середині ланцюга. М олекула глікофор и н у повністю пронизує мем бану, причому занурен а у мембрану гідрофобн а ділянк а має α- спіральну структуру. К інці молекули виступають по обох боках ліпідного бішару. Вуглеводи приєднуються на N-кінці гідрофобної частини молекули. Отже, N-кінець локалізований на зовнішній поверхні мембрани. Найчастіше у мембранних білках зустрічаються N- зв ’ язані через аспарагін вуглеводневі ланцюги. Глікофорин у цьому відношенні є виключенням: до його складу входять 15 О-зв ’ язаних через залишки серину і треоніну вуглеводневі ланцюги і лише 1 N- зв ’ язаний. Вміст вуглеводної компоненти складає 6% від загальної маси білка.
Слайд 24
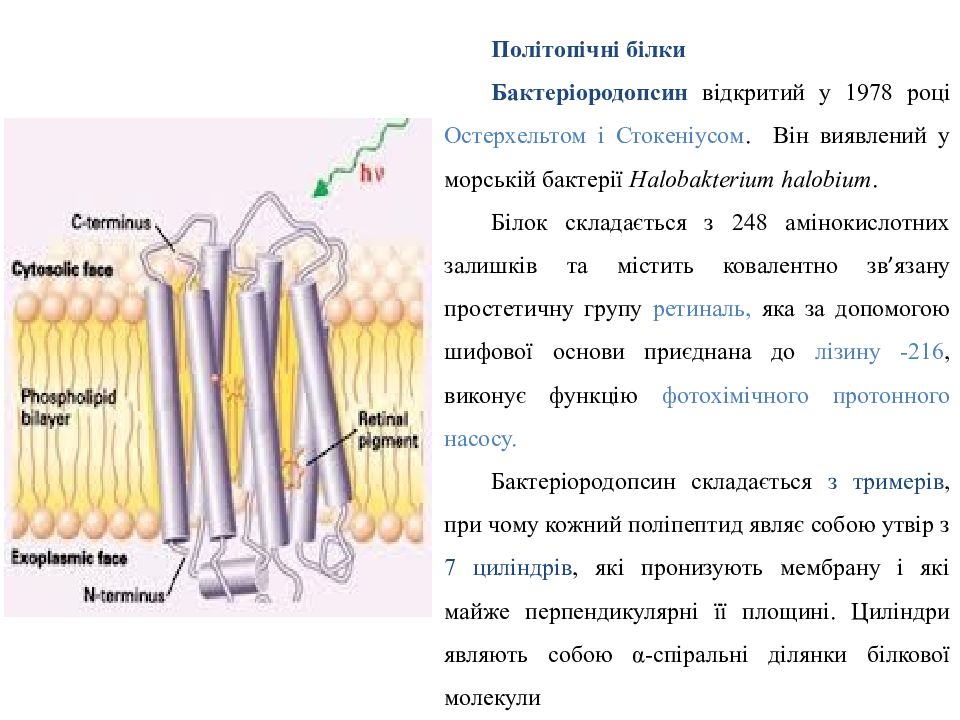
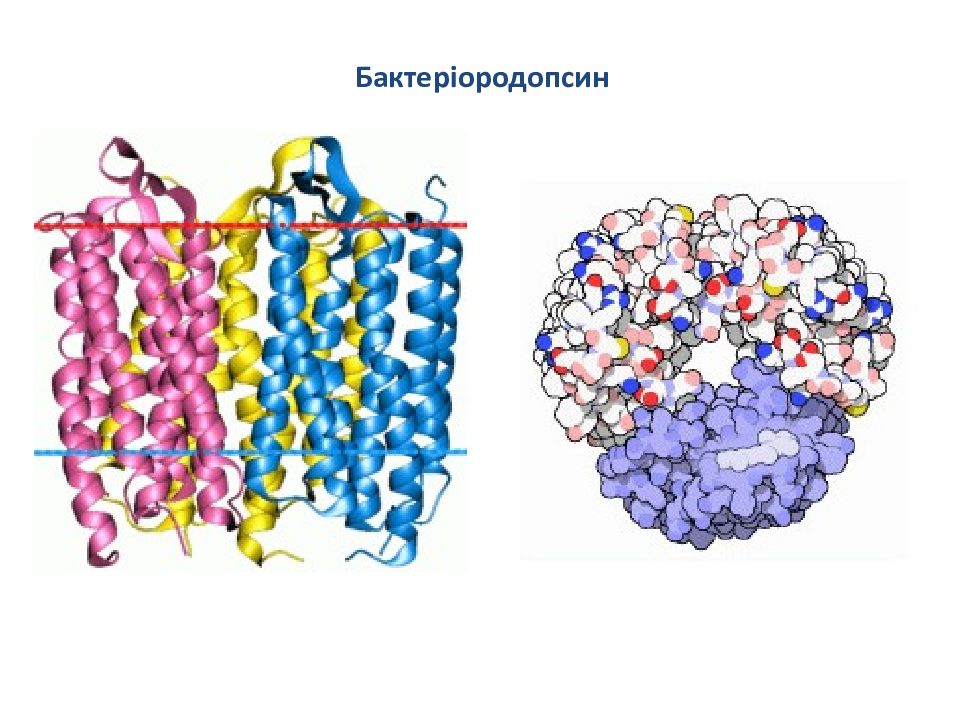
П олітопічн і білк и Бактеріородопсин відкритий у 1978 році Остерхельтом і Стокеніусом. Він виявлений у морській бактерії Halobakterium halobium. Білок складається з 248 амінокислотних залишків та містить ковалентно зв ’ язану простетичну групу ретиналь, яка за допомогою шифової основи приєднана до лізину -216, виконує функцію фотохімічного протонного насосу. Бактеріородопсин складається з тримерів, при чому кожний поліпептид являє собою утвір з 7 циліндрів, які пронизують мембрану і які майже перпендикулярні її площині. Циліндри являють собою α-спіральні ділянки білкової молекули
Слайд 26
3. Характеристика периферичних мембранних білків. Периферичними називають білки, які легко вимиваються з мембран розчинами солей або навіть дистильованою водою. Периферичні білки відрізняються від інтегральних меншою глибиною проникнення в бішар і ступенем впливу на стан і рухливість вуглеводневих ланцюгів ліпідів. Периферичні білки можуть зворотно змінювати свій статус, прикріплюючись до мембрані на певний час (такі білки називають амфіпатичними ). Для амфіпатичних білків є спеціальні сигнали, які стимулюють їхню асоціацію з мембраною (часто таким сигналом є їх фосфорилювання специфічними кіназами, що змінює їх третинну структуру і гідрофобність, точніше - ліотропність ). До таких білків, наприклад, відносять протеїн С, фактори згортання крові. Також є білки, що утворюють комплекси з інтегральними білками ( сахараза-ізомальтаза і мальтаза-глікоамілаза ).
Слайд 27
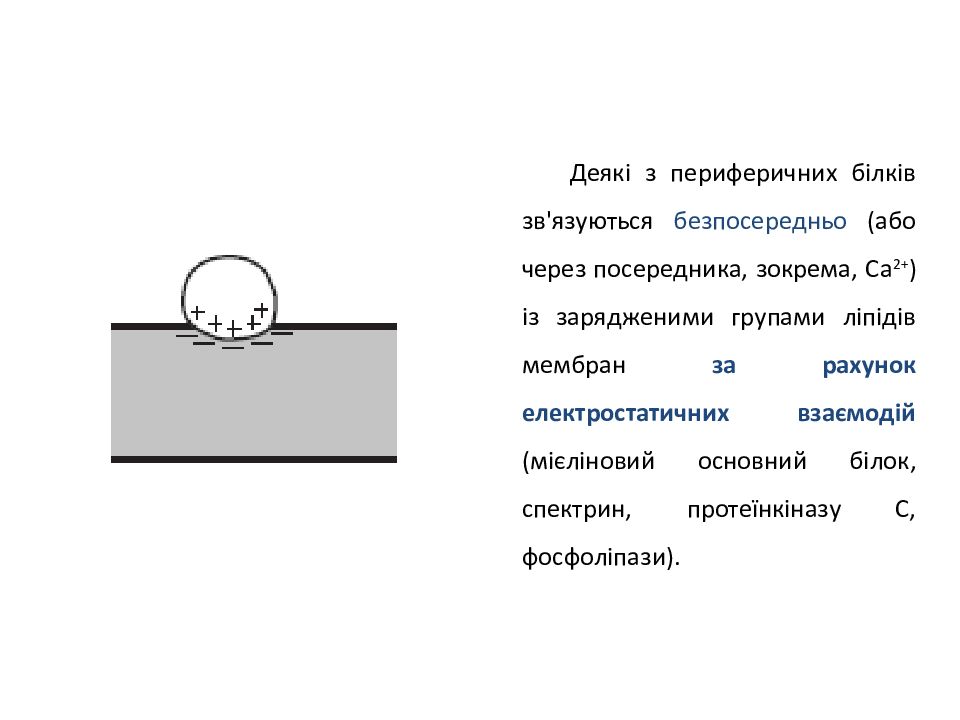
Деякі з периферичних білків зв'язуються безпосередньо (або через посередника, зокрема, Са 2+ ) із зарядженими групами ліпідів мембран за рахунок електростатичних взаємодій (мієліновий основний білок, спектрин, протеїнкіназу С, фосфоліпази).
Слайд 28
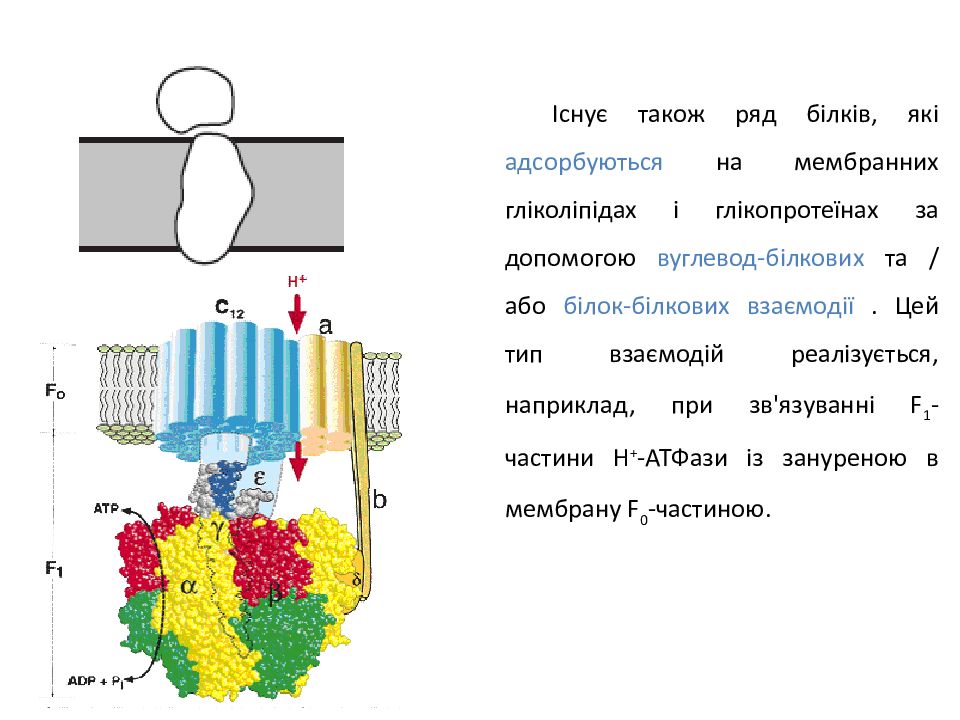
Існує також ряд білків, які адсорбуються на мембранних гліколіпідах і глікопротеїнах за допомогою вуглевод-білкових та / або білок-білкових взаємодії. Цей тип взаємодій реалізується, наприклад, при зв'язуванні F 1 -частини Н + -АТФази із зануреною в мембрану F 0 -частиною.
Слайд 29
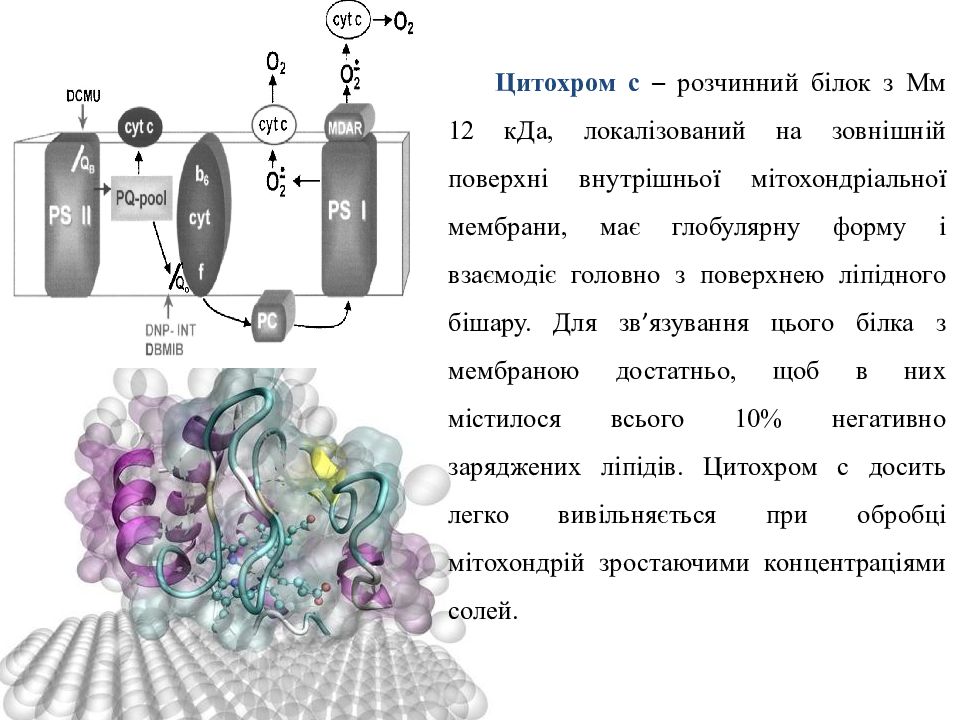
Ц итохром с – розчинний білок з Мм 12 кДа, локалізований на зовнішній поверхні внутрішньої мітохондріальної мембрани, має глобулярну форму і взаємодіє головно з поверхнею ліпідного бішару. Для зв ’ язування цього білка з мембраною достатньо, щоб в них містилося всього 10% негативно заряджених ліпідів. Цитохром с досить легко вивільняється при обробці мітохондрій зростаючими концентраціями солей.
Слайд 30
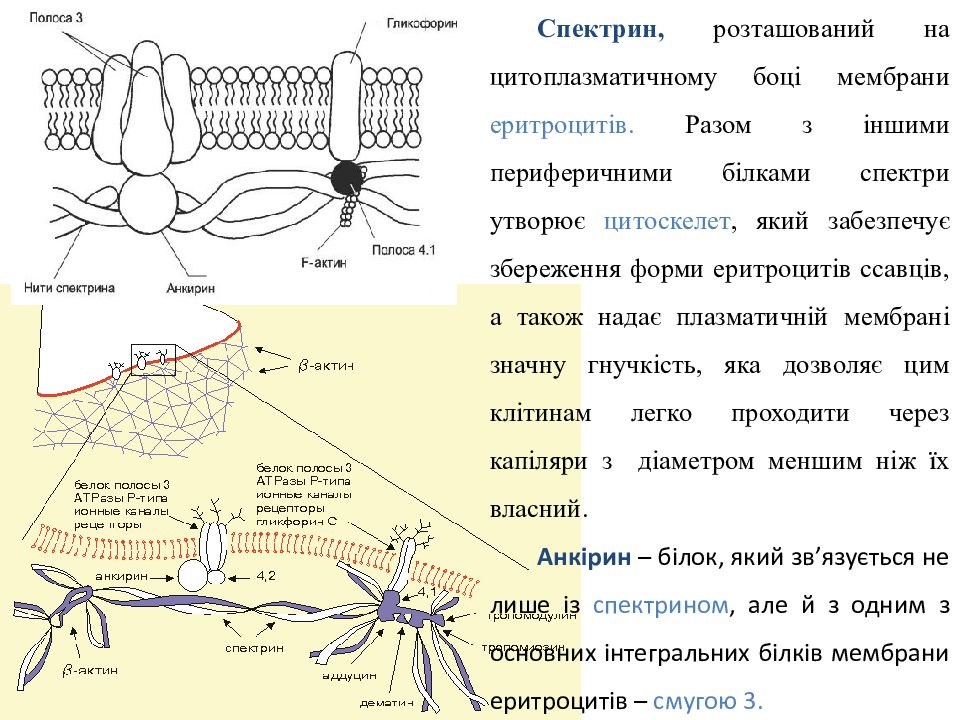
С пектрин, розташований на цитоплазматичному боці мембрани еритроцитів. Разом з іншими периферичними білками спектри утворює цитоскелет, який забезпечує збереження форми еритроцитів ссавців, а також надає плазматичній мембрані значну гнучкість, яка дозволяє цим клітинам легко проходити через капіляри з діаметром меншим ніж їх власний. Анкірин – білок, який зв’язується не лише із спектрином, але й з одним з основних інтегральних білків мембрани еритроцитів – смугою 3.
Слайд 31
4. Мембранні білки, ковалентно зв’язані з ліпідами. Мембранні білки е укаріот часто б у вают ковалентно з в'язан і з ліпідами. Їх можна розділити на три класи : білки, зв’язані з міристиновою кислотою ( через амідн ий зв'язок з N- кінцевих гліцином ; одночасно з трансляцією на рибосомах ) ; білки, зв’язані з пальмітиново ю кислотою ( утворення тіо е фірн ого зв'язку з цистеїном або гідрокс ие фірн ого зв'язку з серин ом і треон і н ом; посттрансляц ійно ) ; білки, зв’язані з глікозил фосфатидил і нозитолом ( ковалентн е зв'яз ування глікофосфоліпід у - похідного фосфатидилінозитолу посттрансляц ійно після протеолітичного відщеплення амінокислот 17-31 від карбоксильного кінця молекули-попередника ). Білки, зв’язані з жирними кислотами локалізовані в основному на цитоплазматичн ій поверхні плазматичної мембрані, а білки, звязані з фосфатидил і нозитол ом, - на зовнішній.
Слайд 32
Деякі мембранні білки, ковалентно зв ’ язані з ліпідами I. Прокаріоти 1. Ліпопротеїни зовнішньої мембрани бактерії Е. coli 2. Пеніциліназу ( B. licheniformis ) 3. Цитохромна субодиниця реакційного центру II. Еукаріоти (А) Білки, до яких приєднана міристинова кислота 1. Р60 src 2. Каталітична субодиниця сАМР-протеїнкінази 3. NАРН-цитоxром b 5 -редуктаза 4. α-субодиниця гуаніннуклеотидзв ’ язуючого білка (Б) Білки, до яких приєднана пальмітинова кислота 1. Р21 ras 2. Глікопротеїн G вірусу везикулярного стоматиту 3. НА-глікопротеїн вірусу грипу 4. Трансфериновий рецептор (ссавці) 5. Родопсин 6. Анкірін (В) Білки з глікозилфосфатидилінозитольним якорем 1. Глікопротеїн Т h у-1 2. Поверхневий глікопротеїн трипаносом 3. Ацетилхолінестераза 4. 5'-нуклеотидази 5. Лужна фосфатаза 6. Адгезивна молекула нервових клітин ( N -САМ)
Слайд 33
5. Виділення,очищення та дослідження мембранних білків. Для визначення методів дослідження білків мембран необхідно враховувати: способи їх прикріплення до мембрани ; функціональну класифікацію мембранних білків; а також їх класифікацію за локалізацією по відношенню до ліпідів.
Слайд 34
Методи солюбілізації ( розбирання нативної мембрани на складові елементи) мембранних білків можна розділити на такі: 1) білки, адсорбовані на поверхні мембран, легко виділити розчинами з низькою іонною силою; 2) якщо білки приєднані до мембрани іонними зв’язками або якщо необхідною умовою зберігання їхньої структурної цілісності є наявність у середовищі достатньої кількості іонів, білки можна виділити, якщо видалити із середовища катіони (наприклад, за допомогою ЕДТА); 3) білки, які зв’язані електростатично, можна виділити за допомогою розчинів з високою іонною силою (0,5-1,2 М); 4) іноді можна використовувати різні денатуруючі агенти за високої концентрації ( гуанідин, сечовина та ін.). Ці сполуки руйнують іонне оточення білків у мембранах, розщеплюють слабкі зв’язки. Недолік їх використання полягає у тому, що білки при солюбілізації інактивуються ; 5) як попередню стадію розщеплення мембран, використовують обробку гідролітичними ферментами (наприклад, папаїн, трипсин, фосфоліпази); 6) для фрагментації мембран можна використовувати ультразвук; 7) детергенти, які є амфіфільними сполуками, зв’язуються гідрофобно з мембранними білками, полярні групи яких взаємодіють з водою.
Слайд 35
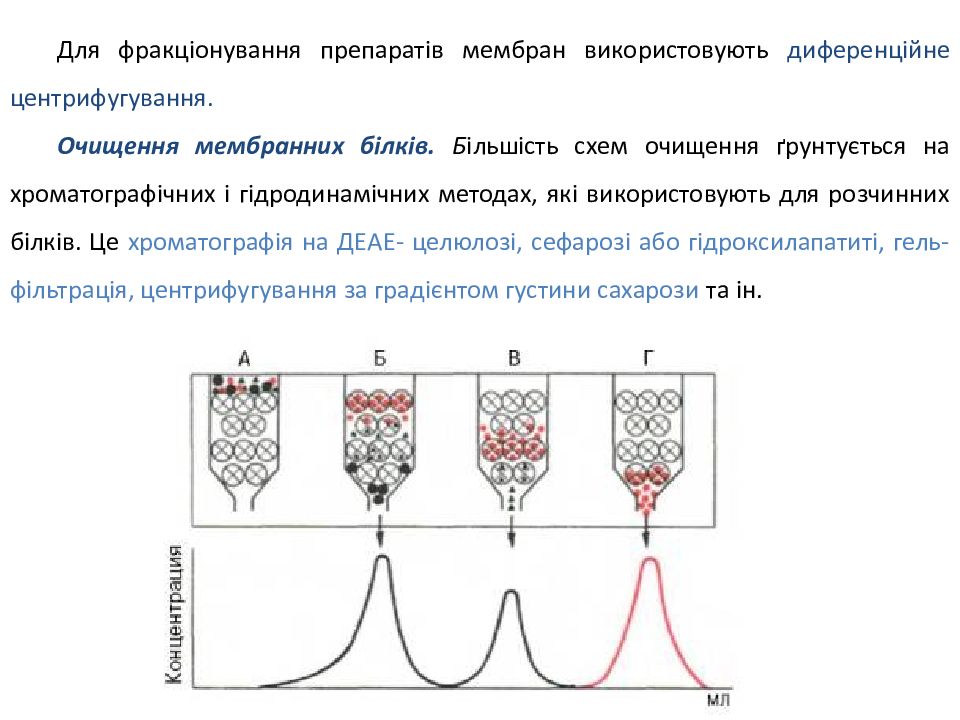
Для фракціонування препаратів мембран використовують диференційне центрифугування. Очищення мембранних білків. Б ільшість схем очищення ґрунтується на хроматографічних і гідродинамічних методах, які використовують для розчинних білків. Це хроматографія на ДЕАЕ- целюлозі, сефарозі або гідроксилапатиті, гель-фільтрація, центрифугування за градієнтом густини сахарози та ін.
Слайд 36
Д етергент руйнує мембрану, займаючи місце ліпідів, які оточують той чи інший білок, та визначає стабільність білка в розчині. Детергенти. Упродовж останніх десятиліть з’явилось багато різних детергентів. Класифікація: 1) іонні : а) катіонні (мають додатній заряд), б) аніонні (мають від’ємний заряд), в) цвіттер-іонні ; 2) неіонні. Неіонні детергенти – тритон, твіни. Аніонні детергенти представлені хелатом і дезоксихелатом натрію, а також найбільш широко використовуваним додецилсульфатом натрію. Одна з проблем – підбір оптимальних умов солюбілізації досліджуваного білка. Були спроби вибору необхідного детергенту за допомогою одного параметра, який називається гідрофільно-ліпофільний баланс (ГЛБ). Цей параметр змінюється від 1 до 20.
Слайд 37
Параметри, які характеризують здатність детергентів до міцелоутворення : 1 – критична концентрація міцелоутворення ( ККМ ); 2 – число агрегації. ККМ – це та концентрація, за якої детергент починає утворювати міцели. Число агрегації показує, скільки молекул детергенту припадає на одну міцелу. Видалення детергенту : діаліз, гель-фільтрація, сильне розведення солюбілізату, адсорбція детергенту на гідрофобних полімерах. Необхідно враховувати: 1) максимальну солюбілізацію досліджуваного білка. 2) солюбілізацію білка у потрібній формі. 3) ймовірність використання детергента за цієї методики.
Слайд 38
Периферичні білки вивільняються під час промивання мембрани буферними розчинами з низькою іонною силою та буферними розчинами з високим або низьким значенням рН за присутності хелатуючих агентів (ЕДТА), які зв’язують двовалентні катіони. Для вивільнення інтегральних мембранних білків необхідно використовувати детергенти або органічні розчинники. Детергенти руйнують ліпідний бішар і, як вважають, зв’язуються з гідрофобними ділянками мембранних білків, які контактують з гідрофобною частиною бішару.
Слайд 39
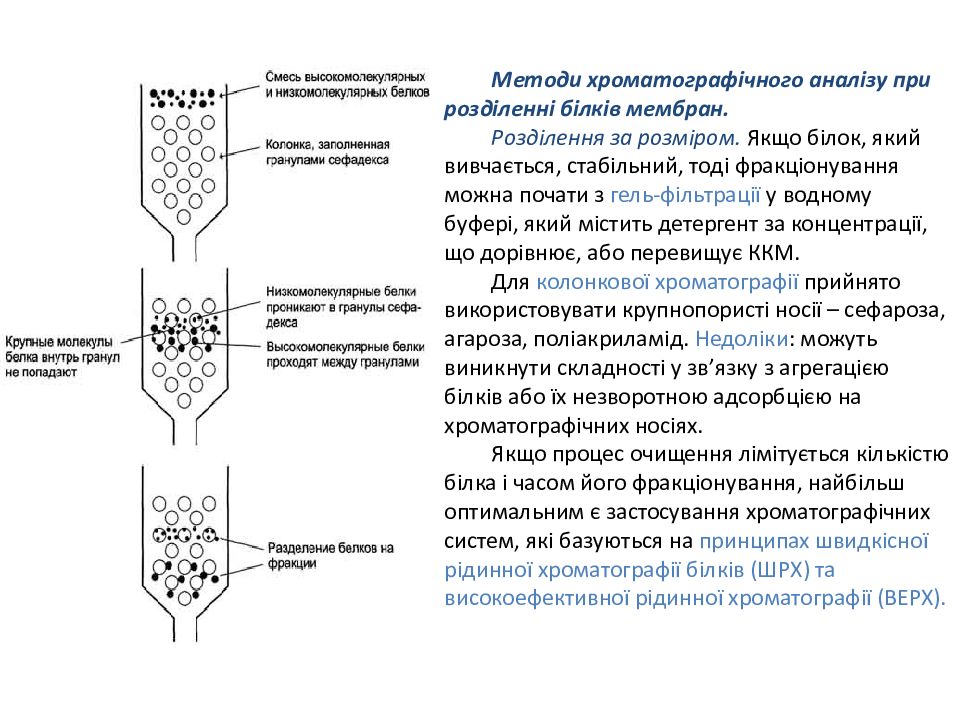
Методи хроматографічного аналізу при розділенні білків мембран. Розділення за розміром. Якщо білок, який вивчається, стабільний, тоді фракціонування можна почати з гель-фільтрації у водному буфері, який містить детергент за концентрації, що дорівнює, або перевищує ККМ. Для колонкової хроматографії прийнято використовувати крупнопористі носії – сефароза, агароза, поліакриламід. Недоліки : можуть виникнути складності у зв’язку з агрегацією білків або їх незворотною адсорбцією на хроматографічних носіях. Якщо процес очищення лімітується кількістю білка і часом його фракціонування, найбільш оптимальним є застосування хроматографічних систем, які базуються на принципах швидкісної рідинної хроматографії білків (ШРХ) та високоефективної рідинної хроматографії (ВЕРХ).
Слайд 40
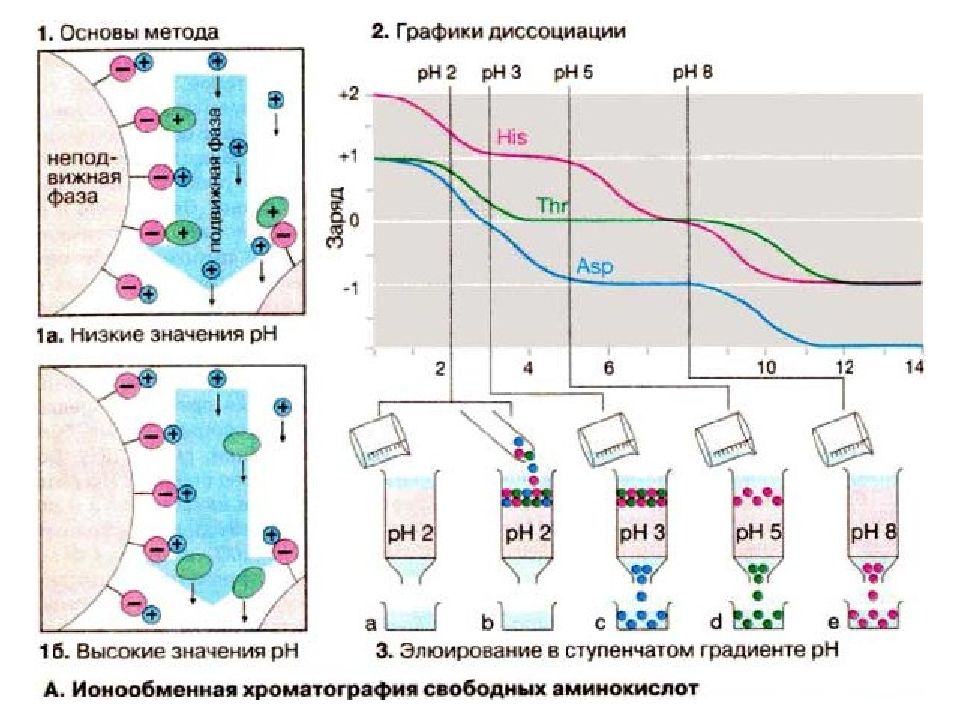
Розділення за зарядом. Іонообмінна хроматографія. Для виділення мембранних білків можна використовувати класичні іонообмінні системи. Найбільш популярні слабкозаряджені ДЕАЕ- та КМ-іоніти (на основі целюлози і декстрану ). Ефективність очищення залежить від властивостей білка: якщо білок гідрофільний, можна підібрати умови, за яких він буде міцно зв’язуватись з іонітом. Білки, які занурені у бішар, після солюбілізації щільно оточені детергентною оболонкою, тому менш ймовірна взаємодія із зарядженим адсорбентом. З урахуванням цього ДЕАЕ-колонки, як правило, зрівноважують буфером низької іонної сили (наприклад, 0,1 М трис-НСl або фосфатним буфером), що містить детергент (0,1%) при рН 6,5–8,0. Елюювання проводять сольовими розчинами зростаючих концентрацій (0-1 М NaCl або КCl ), які також містять детергент. КМ-сорбенти, як правило, зрівноважують при слабкокислих рН (5,5–7,0), а для елюювання найчастіше використовують розчини з градієнтом рН, а не солі.
Слайд 42
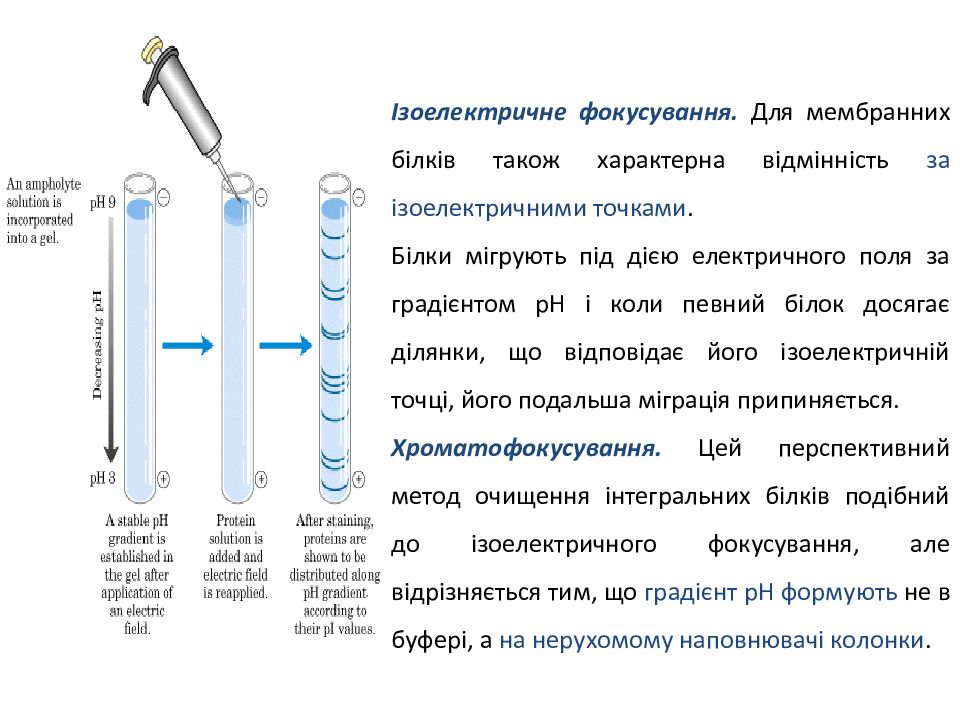
Ізоелектричне фокусування. Для мембранних білків також характерна відмінність за ізоелектричними точками. Білки мігрують під дією електричного поля за градієнтом рН і коли певний білок досягає ділянки, що відповідає його ізоелектричній точці, його подальша міграція припиняється. Хроматофокусування. Цей перспективний метод очищення інтегральних білків подібний до ізоелектричного фокусування, але відрізняється тим, що градієнт рН формують не в буфері, а на нерухомому наповнювачі колонки.
Слайд 43
Гідрофобна хроматографія. В її основі лежить зв’язування білків з гідрофобними групами, ковалентно пришитими до носія. Адсорбція білків на носії, наприклад, фенілсефарозі, відбувається за рахунок гідрофобних взаємодій і посилюється за високих концентрацій солей, низьких рН. Потім проводять елюювання білка сольовими розчинами. Вихід препарату покращується при підвищенні рН. У деяких випадках цей метод може бути ефективним для розділення інтегральних білків від периферичних.